- 研究文章gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
动态光对大豆光合作用的抑制作用在缺氮条件下比在充足供氮条件下小,而不是大gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba20.gydF4y2Ba文章编号:gydF4y2Ba339gydF4y2Ba(gydF4y2Ba2020.gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
植物总是暴露在动态的光下。动态光下叶片的光合光利用效率低于均匀光下。环境因素对动态光合作用影响的研究非常有限。氮对植物至关重要,尤其是对光合作用。低氮(LN)降低核酮糖-1,5-二磷酸羧化酶/加氧酶(Rubisco),从而限制光合作用。Rubisco的降低也延迟了LN叶片的光合诱导;因此,我们假设光合CO的差异gydF4y2Ba2gydF4y2Ba在均匀光和动态光之间的固定作用,LN叶片比充足施氮的叶片更强。gydF4y2Ba
结果gydF4y2Ba
为验证这一假设,研究了大豆植株在低氮或高氮(HN)条件下生长,并在均匀光和动态光条件下测定了叶片光合气体交换、酶活性和蛋白质含量。出乎意料的是,动态光对LN叶片光合作用的抑制作用要小于HN叶片。其潜在机制也得到了阐明。短的弱光(LL)间隔对Rubisco活性没有影响,但明显失活了果糖-1,6-二磷酸酶(FBPase)和sedoheptu糖-1,7-二磷酸酶(SBPase),表明在LL间隔后的光合诱导依赖于FBPase和SBPase的再激活,而不是Rubisco。在LN叶片中Rubisco的下降幅度大于FBPase和SBPase,因此FBPase和SBPase相对过量。在动态光的强光阶段,LN叶片中较低的FBPase和SBPase需要被激活以实现光合作用的恢复。因此,LN叶片的光合恢复比HN叶片快,缓解了动态光对LN叶片的光合抑制作用。gydF4y2Ba
结论gydF4y2Ba
与我们的期望相反,动态光线造成的光合抑制,而不是更多,在LN叶中而不是在大豆的叶子中。这是缓解由动态光引起的光合抑制的压力条件的第一个报告。gydF4y2Ba
背景gydF4y2Ba
在自然或半自然条件下生长的植物暴露在动态的光环境中[gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba].叶片表面的光强度随时间尺度变化,从秒到小时不等。这种变化是由于太阳的运动、云层的变化和邻近植物的阴影[gydF4y2Ba4gydF4y2Ba,gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba].因此,为了更全面地了解光合作用对环境的响应,有必要对动态光条件下的光合作用进行表征[gydF4y2Ba2gydF4y2Ba,gydF4y2Ba6gydF4y2Ba].gydF4y2Ba
与均匀辐照度相比,动态光降低了叶片的光利用效率[gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4gydF4y2Ba,gydF4y2Ba7gydF4y2Ba],这是由于(1)由弱光(LL)转换为强光(H)后光合恢复延迟[gydF4y2Ba6gydF4y2Ba,gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba];(2)光呼吸COgydF4y2Ba2gydF4y2Ba爆裂 [gydF4y2Ba6gydF4y2Ba,gydF4y2Ba10gydF4y2Ba,gydF4y2Ba11gydF4y2Ba];(3)从HL到LL切换后,在从HL到LL后的非平淡细胞淬火(NPQ)的松弛滞后[gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba].为了有效利用动态光中的能量,植物需要在HL条件发生时迅速激活光合作用。快速光合诱导需要核酮糖-1,5-二磷酸羧化酶/加氧酶(Rubisco)等卡尔文循环酶的快速激活以及气孔的快速打开[gydF4y2Ba2gydF4y2Ba,gydF4y2Ba8gydF4y2Ba,gydF4y2Ba14gydF4y2Ba].Rubisco的催化效率相对较低,Rubisco的光合作用通量控制值远高于Calvin周期中其他酶的控制值[gydF4y2Ba15gydF4y2Ba].此外,Rubisco的活化速度相对较慢;因此Rubisco被认为是大多数条件下光合诱导的限制因子[gydF4y2Ba2gydF4y2Ba,gydF4y2Ba16gydF4y2Ba].据报道,Rubisco在体内的活化速度决定了大豆基因型间不同的光合诱导率[gydF4y2Ba17gydF4y2Ba].Rubisco的活化依赖于一种辅助酶,Rubisco活化酶(RCA) [gydF4y2Ba18gydF4y2Ba,gydF4y2Ba19gydF4y2Ba].RCA通过促进释放抑制碳酸氨基化或催化的抑制糖分子来维持Rubisco活动[gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba21gydF4y2Ba].最近的研究报道,RCA的数量与光合诱导率密切相关[gydF4y2Ba22gydF4y2Ba]改进的RCA蛋白显然加速光合诱导[gydF4y2Ba23gydF4y2Ba].gydF4y2Ba
氮是植物中最重要的无机营养素之一。氮对于植物生长,产量和尤其是光合作用至关重要,大于50%的总叶片氮被分配给光合仪器[gydF4y2Ba24gydF4y2Ba,gydF4y2Ba25gydF4y2Ba].低氮(LN)供应会降低光合色素、类囊体膜蛋白和卡尔文循环相关酶的含量,从而降低光合COgydF4y2Ba2gydF4y2Ba叶子固定[gydF4y2Ba26gydF4y2Ba].Rubisco,光合CO的限速酶gydF4y2Ba2gydF4y2Ba在正常大气中的C3叶片中的固定gydF4y2Ba2gydF4y2Ba是对氮供应水平最敏感的蛋白质之一,因为它是植物叶片中最丰富的酶,含有大量的氮(约占叶片氮的20%)[gydF4y2Ba27.gydF4y2Ba].gydF4y2Ba
为了补偿Rubisco含量的下降,在LN供应下,叶片Rubisco活化增加[gydF4y2Ba28.gydF4y2Ba,gydF4y2Ba29.gydF4y2Ba,gydF4y2Ba30.gydF4y2Ba,gydF4y2Ba31.gydF4y2Ba,gydF4y2Ba32.gydF4y2Ba].在光合诱导过程中,LN供体叶片需要更长的时间才能达到较高的Rubisco活化状态。因此,在动态光条件下,LN的供应会减缓光合作用的诱导,从而降低光的利用效率。因此,假设光合CO的差异gydF4y2Ba2gydF4y2Ba在均匀光和动态光之间的固定作用,LN叶片比充足施氮的叶片更强。gydF4y2Ba
为了验证上述假设,大豆幼苗在两个氮供应水平下生长。然后,在动态和均匀的辐照下分析这些叶片中的光合气体交换,活性和钙循环酶蛋白的蛋白质。虽然具有大豆的共生的根茎可以固定氮气,但田间的大豆仍然依靠大量肥料的应用,尤其是在大豆与其他作物的旋转过程中。氮缺乏症通常发生在大豆栽培中。gydF4y2Ba
结果gydF4y2Ba
稳态光条件下的光合煤气交换gydF4y2Ba
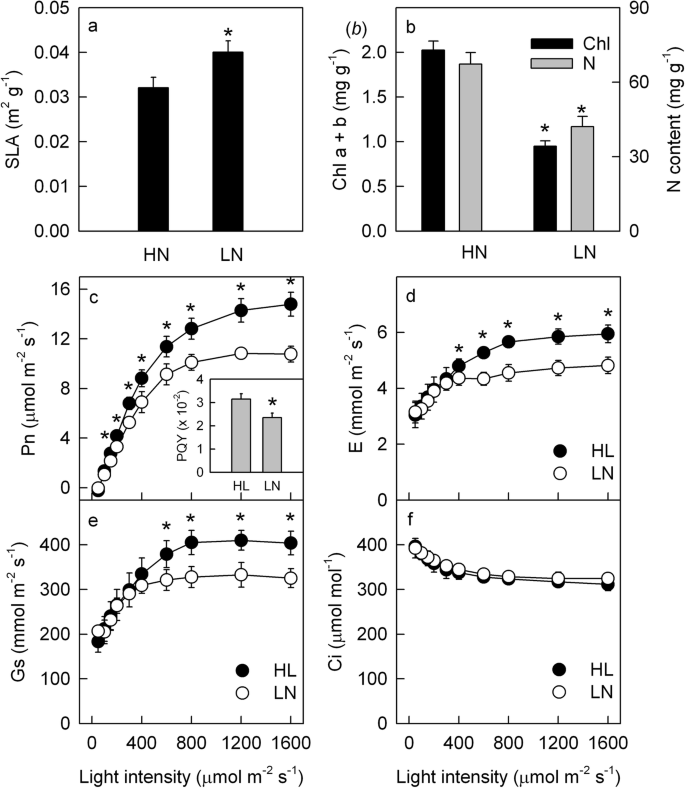
低N(LN)电源显着降低了氮气和叶绿素的含量,并增加了特定的叶面积(SLA;图。gydF4y2Ba1gydF4y2Baa, b).在150 ~ 1600 μmol m范围内,LN叶片的稳态Pn低于HN叶片gydF4y2Ba- 2gydF4y2Ba年代gydF4y2Ba- 1gydF4y2Ba照明(无花果。gydF4y2Ba1gydF4y2BaC)。较低的pqy [gydF4y2Ba33.gydF4y2Ba],估计为LL叶片Pn与PFD线性关系的初始斜率(图。gydF4y2Ba1gydF4y2Bac),表明有限光照条件下的光能利用效率受到LN供应的限制。饱和光(1200 ~ 1600 μmol m .)下的PngydF4y2Ba- 2gydF4y2Ba年代gydF4y2Ba- 1gydF4y2Ba), LN叶比HN叶低(图。gydF4y2Ba1gydF4y2Bac),说明LN叶片的光合能力较低。与HN叶片相比,LN叶片的气孔导度(Gs)和蒸腾速率(E)均较低,但胞间CO含量相近gydF4y2Ba2gydF4y2Ba浓度(CI;图。gydF4y2Ba1gydF4y2Bad-f),表明LN叶片的低Pn是由非气孔限制引起的。gydF4y2Ba
物质含量和稳态光合气体交换。比叶面积(SLA;gydF4y2Ba一个gydF4y2Ba)、总叶绿素(Chl)和氮(N)含量(gydF4y2BabgydF4y2Ba)、净光合速率(Pn;gydF4y2BacgydF4y2Ba)、蒸腾速率(E;gydF4y2BadgydF4y2Ba)、气孔导度(Gs;gydF4y2BaegydF4y2Ba)和细胞间有限公司gydF4y2Ba2gydF4y2Ba浓度(CI;gydF4y2BafgydF4y2Ba)、光合量子产量(PQY;图c插入)在高氮(HN;充型)和低氮(LN;关闭)提供的植物。意味着±SD,gydF4y2BangydF4y2Ba= 6。星号表示在gydF4y2BaPgydF4y2Ba < 0.05 between HN and LN leaves (T-test)
变化光照条件下的光合作用气体交换gydF4y2Ba
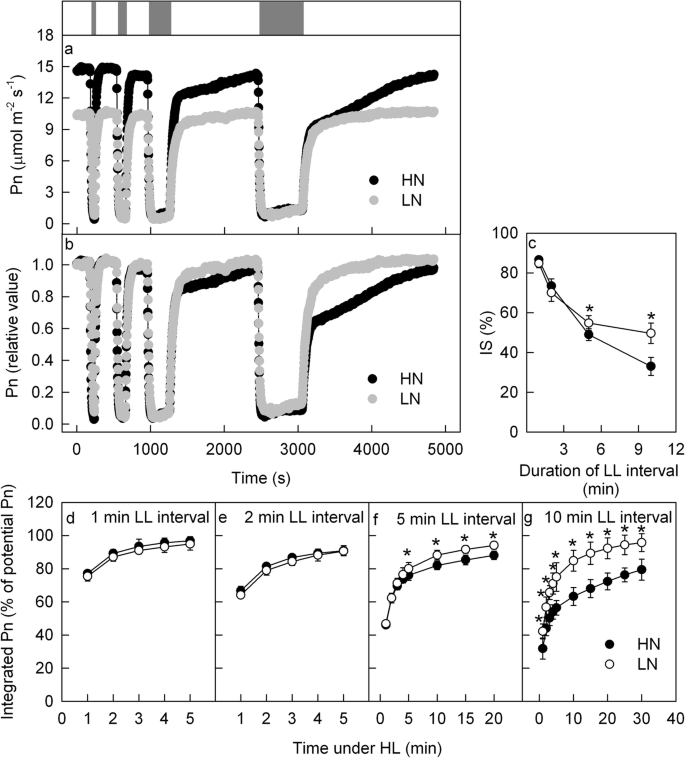
为了阐明氮供应对动态光合作用的影响,采用1,600 μmol mgydF4y2Ba- 2gydF4y2Ba年代gydF4y2Ba- 1gydF4y2Ba)叶暴露于L1的间隔(100μmolmgydF4y2Ba- 2gydF4y2Ba年代gydF4y2Ba- 1gydF4y2Ba)对于各种持续时间;之后,将LL切换到HL(如上图所示。gydF4y2Ba2gydF4y2BaA),并同步记录光合气体交换。当光强降低时,Pn迅速降低;但当光照强度增加时,Pn并不能立即恢复,而是逐渐增加(图2)。gydF4y2Ba2gydF4y2Baa, b).在短的弱光间隔(60或120 s)后,HL条件下HN和LN叶片的Pn恢复相似。然而,当弱光间隔延长到300或600 s时,LN叶片HL下Pn随后的恢复速度要快于HL叶片(图3)。gydF4y2Ba2gydF4y2Baa, b).用HL暴露30 s后的Pn表示低光间隔后IS% [gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba].IS%随弱光间隔时间延长而逐渐降低;弱光间隔300或600 s后,HN叶片的IS%明显低于LN叶片(图3)。gydF4y2Ba2gydF4y2BaC)。gydF4y2Ba
在改变光线条件下的光合煤气交换。净光合速率的时间过程(PN;gydF4y2Ba一个gydF4y2Ba,gydF4y2BabgydF4y2Ba)在高氮(HN;黑色)和低氮(LN;灰色)供应厂的叶片中的变化下。图上的横杆(gydF4y2Ba一个gydF4y2Ba)显示高(1600μmolmgydF4y2Ba- 2gydF4y2Ba年代gydF4y2Ba- 1gydF4y2Ba;霍奇金淋巴瘤;LL (100 μmol m .)gydF4y2Ba- 2gydF4y2Ba年代gydF4y2Ba- 1gydF4y2Ba;会;灰色bar)时期。将叶片在HL下调整20-40分钟,直至PN稳定,之后将叶暴露于变化的光。从左到右,灰杆,表示LL的60,120,300和600秒。原始pn在图中显示(gydF4y2Ba一个gydF4y2Ba).在情节中(gydF4y2BabgydF4y2Ba),稳定HL下的PN作为100%,并且在稳定的HL下计算改变光条件下的PN作为PN的百分比。(gydF4y2BacgydF4y2Ba)不同持续时间LL间隔后Pn (IS%)的诱导状态。(gydF4y2BadgydF4y2Ba-gydF4y2BaggydF4y2Ba) 60岁以下HL期间的综合Pn (gydF4y2BadgydF4y2Ba), 120 (gydF4y2BaegydF4y2Ba)、300 (f)或600 (gydF4y2BaggydF4y2Ba)LL间隔。平均值±SD,n = 6.星号表示HN和LN叶片之间P <0.05的显着差异(T检验)gydF4y2Ba
为了量化动态光对光合碳固定的影响,我们计算了不同弱光间隔时间HL期间的综合Pn(图2)。gydF4y2Ba2gydF4y2Bad)。弱光期导致后续强光期的固碳损失显著;这种损失随着低光时间间隔的延长而加重,并且这种损失在HL病情开始时更加严重(图)。gydF4y2Ba2gydF4y2Bad)。在LN和HN叶片之间存在60或120秒低光间隔后的光合碳固定的损失,但在300或600秒的低光间隔后的损失比在LN叶子中更严重(无花果。gydF4y2Ba2gydF4y2Bad)。gydF4y2Ba
同意先前的报告[gydF4y2Ba34.gydF4y2Ba],在变化的光照条件下,Gs和E表现出与Pn相似的趋势,但Gs和E的变化比Pn更轻微、更缓慢(附加文件)gydF4y2Ba1gydF4y2Ba).我们还观察到,Gs和E在HN叶片中比在LN叶片中下降更剧烈。在变化光照条件下,HN和LN叶片Ci变化相似(附文件)gydF4y2Ba1gydF4y2Ba),说明不同光照条件下,HN和LN叶片光合速率的差异主要是由于非气孔限制所致。gydF4y2Ba
HL暴露引起的PSII光抑制也是影响CO的一个潜在因素gydF4y2Ba2gydF4y2Ba固定。因此,PSII(FV / FM)的最大量子产率[gydF4y2Ba35.gydF4y2Ba,gydF4y2Ba36.gydF4y2Ba]和D1蛋白的含量,D1蛋白是叶片PSII反应中心的核心亚基[gydF4y2Ba37.gydF4y2Ba,gydF4y2Ba38.gydF4y2Ba,gydF4y2Ba39.gydF4y2Ba],在动态光合作用的气体交换测量之前和之后测量,以反映Psii PhotoInchitch。动态光合气体交换测量导致FV / FM轻微但显着降低;但是,FV / FM在LN和HN叶中相似(附加文件gydF4y2Ba2gydF4y2Ba).另外,光合气体交换测定后D1蛋白的含量没有变化(附文件)gydF4y2Ba2gydF4y2Ba).动态光合气体交换后,HN和LN叶片Fv/Fm相似,D1蛋白稳定,说明HN和LN叶片动态Pns的差异不受PSII光抑制和D1蛋白降解的影响。gydF4y2Ba
HN和LN营养液不仅氮含量不同,渗透势也不同。为了分析渗透势对光合气体交换的影响,我们在LN营养液中加入聚乙二醇(PEG),确保LN + PEG营养液的渗透势与HN营养液的渗透势相似。将LN植株移入LN + PEG营养液中,在移入LN + PEG营养液前和移入LN + PEG营养液后24 h测定叶片光合气体交换量。光合作用气体交换不受添加PEG的影响(附文件)gydF4y2Ba3.gydF4y2Ba).因此,低渗透势的HN营养液不影响光合气体交换。gydF4y2Ba
波动灯条件下的光合煤气交换gydF4y2Ba
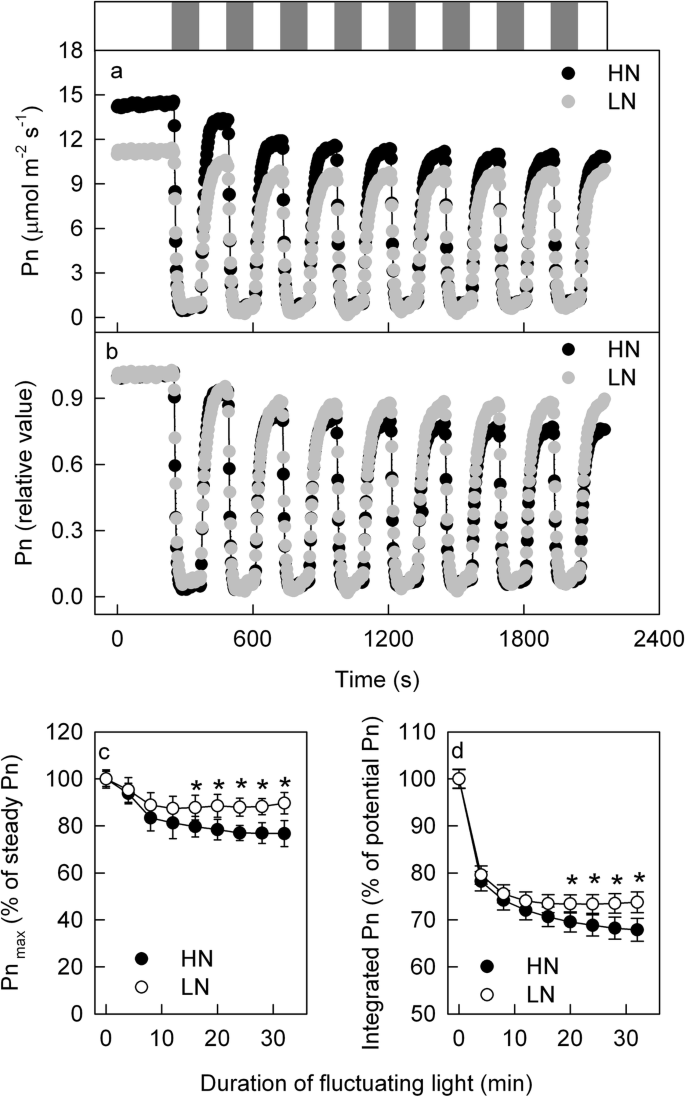
上述结果表明,LN和HN叶片光合气体交换对一个短弱光间隔(60或120 s)的响应相似,但对重复短弱光间隔(田间常见)的响应尚不清楚。为了明确这一不确定性,将叶片暴露在100 ~ 1600 μmol m的光照条件下gydF4y2Ba- 2gydF4y2Ba年代gydF4y2Ba- 1gydF4y2Ba每120秒,共32分钟。gydF4y2Ba3.gydF4y2Baa,b)。观察到在120秒低光间隔后的120秒的高光周期期间,PN无法在稳态HL条件下恢复到水平,因此HL周期下的最大PN(PNgydF4y2Ba马克斯gydF4y2Ba)随着光持续时间的增加而逐渐减少(图。gydF4y2Ba3.gydF4y2BaC)。由于PN延迟诱导和PN的减少gydF4y2Ba马克斯gydF4y2Ba,在波动的光下比在稳态光下的波动下较低,并且通过增加的波动光的持续时间加剧了这种集成的PN的丧失(图。gydF4y2Ba3.gydF4y2Bad).这些Pn的减少gydF4y2Ba马克斯gydF4y2Ba在波动光下的集成PN在叶子中比在LN叶中更明显。gydF4y2Ba
波动光照条件下的光合作用气体交换。净光合速率的时间过程(PN;gydF4y2Ba一个gydF4y2Ba,gydF4y2BabgydF4y2Ba),在波动光下高氮(HN;黑色)和低氮(LN;灰色)供给植物。图上的横杆(gydF4y2Ba一个gydF4y2Ba)显示高(1600μmolmgydF4y2Ba- 2gydF4y2Ba年代gydF4y2Ba- 1gydF4y2Ba;霍奇金淋巴瘤;LL (100 μmol m .)gydF4y2Ba- 2gydF4y2Ba年代gydF4y2Ba- 1gydF4y2Ba;会;灰色bar)时期。在1600 μmol mgydF4y2Ba- 2gydF4y2Ba年代gydF4y2Ba- 1gydF4y2Ba处理20 ~ 40 min,直至Pn稳定后,叶片暴露于波动光强(1600 μmol m .)之间gydF4y2Ba- 2gydF4y2Ba年代gydF4y2Ba- 1gydF4y2Ba)和低(100 μmol m .gydF4y2Ba- 2gydF4y2Ba年代gydF4y2Ba- 1gydF4y2Ba)每120秒的条件。原始pn在图中显示(gydF4y2Ba一个gydF4y2Ba).在情节中(gydF4y2BabgydF4y2Ba),稳定HL下的PN作为100%,并且在稳定的HL下计算改变光条件下的PN作为PN的百分比。(gydF4y2BabgydF4y2Ba)HL期间的最大PN(PNgydF4y2Ba马克斯gydF4y2Ba)在HN和ln供应的工厂;稳定HL下的Pn取100%,Pn取100%gydF4y2Ba马克斯gydF4y2Ba计算为稳定HL下Pn的百分比。(gydF4y2BacgydF4y2Ba) HN-和ln -提供的植物在波动光下的综合Pn。平均值±SD,n = 6.星号表示HN和LN叶片之间P <0.05的显着差异(T检验)gydF4y2Ba
在波动的光照条件下,GS和E逐渐降低,GS和E的降低在HN叶中比LN叶子更严重(附加文件gydF4y2Ba4gydF4y2Ba).此外,在波动光照下,HN和LN叶片的Ci变化相似(附加文件gydF4y2Ba4gydF4y2Ba),表明波动光下HN和LN叶片光合速率的差异是由于非气孔限制所致。阵线/ Fm轻微但显著降低光合气体交换后测量光波动条件下,但阵线/ Fm的下降是类似在LN和HN叶子,这表明,脉动光条件下不同的动态pn HN和LN叶子之间独立的PSII光抑制。gydF4y2Ba
RuBP羧化和再生能力gydF4y2Ba
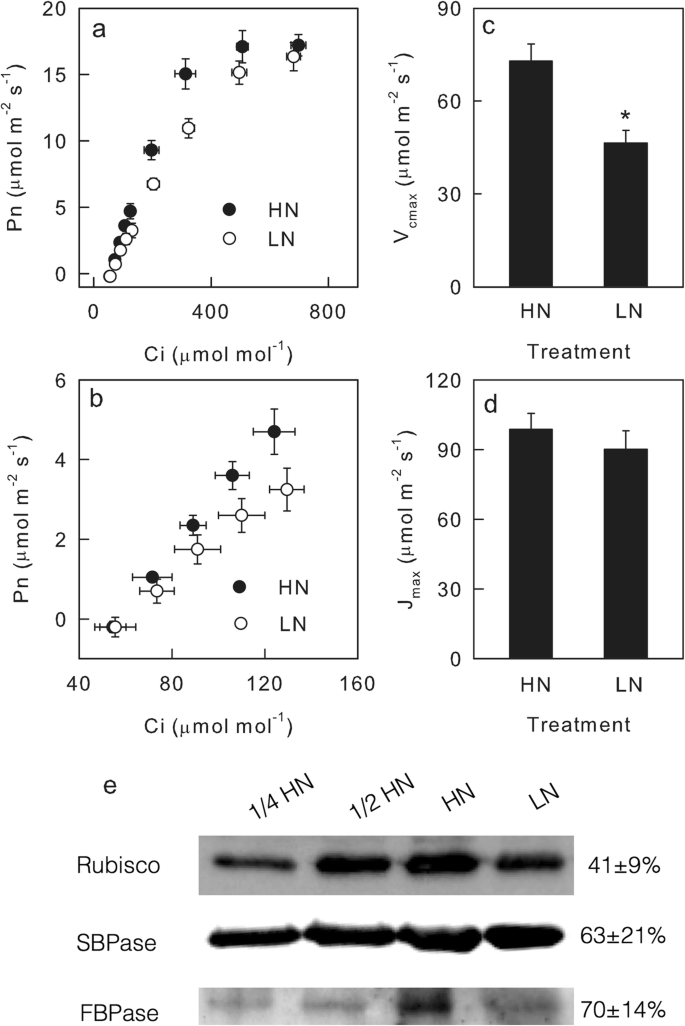
上述结果表明,LN和HN叶片动态光合作用的差异主要是由非气孔限制造成的。除了气孔限制外,光合固碳还受到生化因素的限制,包括RuBP羧化和再生[gydF4y2Ba40gydF4y2Ba,gydF4y2Ba41.gydF4y2Ba,gydF4y2Ba42.gydF4y2Ba].因此,在饱和光(1600 μmol m .)下测定了Pn/Ci响应曲线gydF4y2Ba- 2gydF4y2Ba年代gydF4y2Ba- 1gydF4y2Ba)量化叶片的垃圾羧化和再生能力。当C 1低于600μmol摩尔时,HN叶片在叶片中比在LN叶中更高gydF4y2Ba- 1gydF4y2Ba(无花果。gydF4y2Ba4gydF4y2Baa,b),但在饱和ci下Hn和Ln之间的pn差异减少(图。gydF4y2Ba4gydF4y2Ba), VgydF4y2BacmaxgydF4y2BaLN叶子比在叶子中显着降低;但是,jgydF4y2Ba马克斯gydF4y2BaLN和HN叶片的值相似(图2)。gydF4y2Ba4gydF4y2Bac, d)。gydF4y2Ba
RuBP羧化和再生能力。细胞间公司gydF4y2Ba2gydF4y2Ba净光合速率(Pn;gydF4y2Ba一个gydF4y2Ba,gydF4y2BabgydF4y2Ba);rubp羧化的最大速率(VgydF4y2BacmaxgydF4y2Ba;gydF4y2BacgydF4y2Ba);RuBP再生的最大速率(JgydF4y2Ba马克斯gydF4y2Ba;gydF4y2BadgydF4y2Ba);Rubisco, SBPase和FBPase的含量(gydF4y2BaegydF4y2Ba)在高氮的叶子中(HN;填充) - 和低氮(LN;封闭的)隔离植物。在绘制e,1/2和1/4中表示加载的蛋白质样品的量,并且带右侧的数量表明LN叶片中的蛋白质含量为叶片的百分比。原始的全长凝胶和污染列在附加文件中gydF4y2Ba5gydF4y2Ba。平均值±SD, n = 6(气体交换)或3(免疫印迹)。星号表示HN和LN叶片间P < 0.05显著差异(t检验)gydF4y2Ba
免疫印迹分析表明,与HN相比,LN叶片中RuBP羧化的关键酶Rubisco含量降低了50%以上;而RuBP再生的关键酶SBPase和FBPase在LN叶片中的含量比HN叶片下降了不到50%(图2)。gydF4y2Ba4gydF4y2Bae).这些结果支持了气体交换数据,因为低氮供应对RuBP再生能力的降低比RuBP羧化能力更严重。gydF4y2Ba
在稳定的动态条件下测定酶的活性gydF4y2Ba
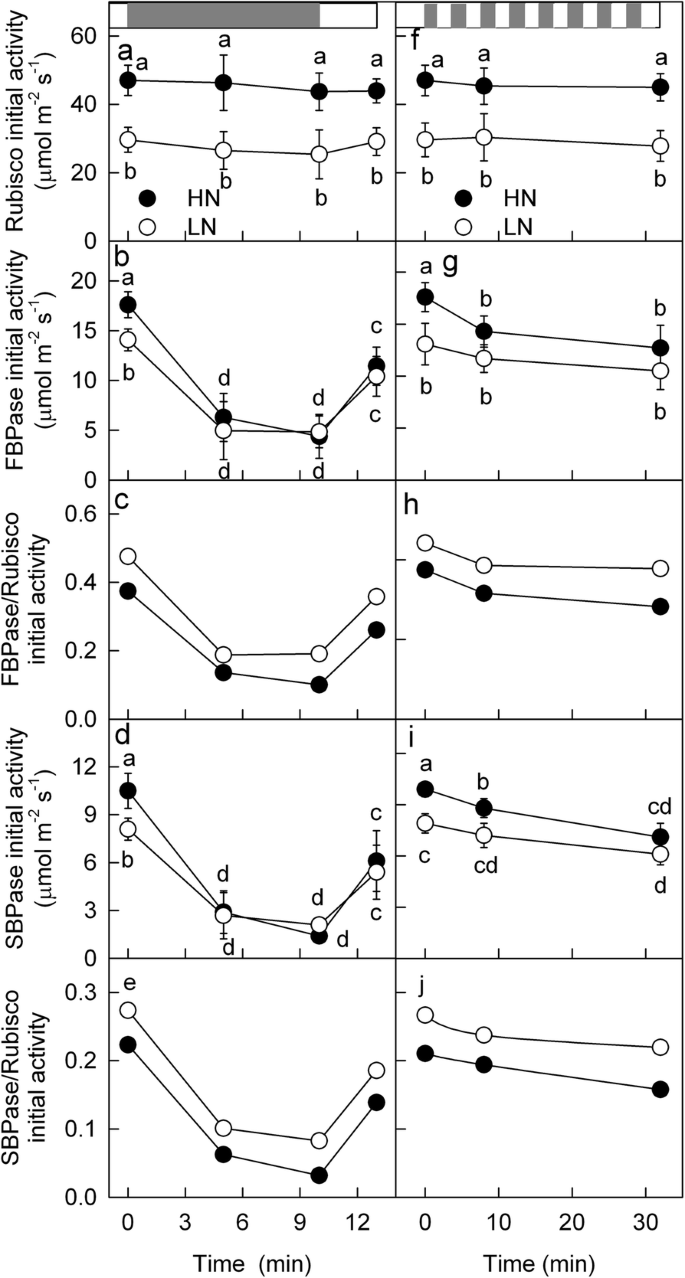
蛋白的含量反映了RuBP在LN和HN叶片中羧化和再生的潜在能力,但不反映相关酶的实际活性,特别是在变化的光照条件下。为了进一步阐明LN和HN叶片不同动态光合过程的机制,在稳定和变化的光照条件下测定了Rubisco、FBPase和SBPase的活性。稳定HL条件下,LN叶片Rubisco、FBPase和SBPase活性均低于HN叶片,但LN和HN叶片Rubisco活性的差异比FBPase和SBPase活性的差异更明显;LN叶片中FBPase/Rubisco和SBPase/Rubisco活性的比值高于HN叶片(图)。gydF4y2Ba5gydF4y2Ba).经过600 s的弱光间隔后,Rubisco的活性几乎保持稳定,但在LN和HN叶片中FBPase和SBPase的活性都下降到非常低的水平(图)。gydF4y2Ba5gydF4y2Ba).其次,当再次暴露于HL时,LN和HN叶片中FBPase和SBPase的活性以同样的速率增加。此外,树叶被暴露于波动的光32分钟,二磷酸核酮糖羧化酶活性没有改变在LN或HN叶子,但FBPase停用HN树叶在LN超过叶,和SBPase释放20.2% HN树叶在LN叶子但只有14.1%。此外,在动态光照条件下,LN叶片中FBPase/Rubisco和SBPase/Rubisco活性始终高于HN叶片。gydF4y2Ba
在稳定的动态条件下酶的活性。Rubisco (gydF4y2Ba一个gydF4y2Ba,gydF4y2BafgydF4y2Ba), FBPase (gydF4y2BabgydF4y2Ba,gydF4y2BaggydF4y2Ba)和sbpase(gydF4y2BadgydF4y2Ba,gydF4y2Ba我gydF4y2Ba)以及FBPase与Rubisco的活性比(gydF4y2BacgydF4y2Ba,gydF4y2BahgydF4y2Ba)和SBPase与Rubisco (gydF4y2BaegydF4y2Ba,gydF4y2BajgydF4y2Ba)在高氮(HN;充型)和低氮(LN;(关闭)在动态光下供应的植物。图上的横杆(gydF4y2Ba一个gydF4y2Ba)显示高(1600μmolmgydF4y2Ba- 2gydF4y2Ba年代gydF4y2Ba- 1gydF4y2Ba;霍奇金淋巴瘤;LL (100 μmol m .)gydF4y2Ba- 2gydF4y2Ba年代gydF4y2Ba- 1gydF4y2Ba;霍奇金淋巴瘤;灰色bar)时期。变化的叶子(gydF4y2Ba一个gydF4y2Ba-gydF4y2BaegydF4y2Ba)在HL下适应20 ~ 40 min,然后将叶片置于LL下600 s,再将叶片置于HL下180 s。在波动的光线下的树叶(gydF4y2BafgydF4y2Ba-gydF4y2BajgydF4y2Ba(2)不同光强条件下,叶片在不同光强条件下(1600 μmol m .gydF4y2Ba- 2gydF4y2Ba年代gydF4y2Ba- 1gydF4y2Ba)和低(100 μmol m .gydF4y2Ba- 2gydF4y2Ba年代gydF4y2Ba- 1gydF4y2Ba)每120秒32分钟。平均值±SD,n = 6.不同的字母表示不同治疗(T检验)之间P <0.05的显着差异gydF4y2Ba
讨论gydF4y2Ba
RUBP再生相关酶在动态光下限制光合诱导gydF4y2Ba
动态光由HL太阳斑和LL太阳斑之间的间隔组成。HL日斑期间的快速光合激活以及LL间隔期间光合激活状态的维持有助于动态光的有效利用。因此,HL太阳斑下激活缓慢的酶和LL间隔内活性迅速下降的酶都是动态光条件下优化光合作用的潜在限制因素。gydF4y2Ba
一个600 s的LL间隔或更短的LL间隔(120 s)只轻微干扰Rubisco活性,但显著降低FBPase和SBPase活性(图)。gydF4y2Ba5gydF4y2Ba),这与FBPase蛋白在光照和黑暗条件下分别快速还原和氧化的情况一致[gydF4y2Ba43.gydF4y2Ba].接下来,当HL突然出现时,Rubisco仍然是高度活性的,但是SBPase和FBPase需要被重新激活以匹配Rubisco的活性。因此,LL间隔后的光合诱导主要受限于SBPase和FBPase的再激活。gydF4y2Ba
在10分钟的LL间隔后,SBPase和FBPase几乎完全失活(图)。gydF4y2Ba5gydF4y2Ba),因此较长的LL间隔不会继续使SBPase和FBPase失效。然而,如果LL间隔时间延长,Rubisco的活性将继续下降。因此,我们推测Rubisco激活态对光合诱导的限制将随着LL间隔的延长而增加。gydF4y2Ba
除了在该实验中测量的SBPase和FBP酶之外,GAPDH和PRK还是RUBP再生中的光活化酶和潜在的速率限制酶[gydF4y2Ba15gydF4y2Ba],但其光合通量控制值低于SBPase和FBPase [gydF4y2Ba15gydF4y2Ba].体外和体内实验都表明,GAPDH和PRK酶被迅速激活,但灭活缓慢[gydF4y2Ba44.gydF4y2Ba,gydF4y2Ba45.gydF4y2Ba,gydF4y2Ba46.gydF4y2Ba,即使只有300 μmol mgydF4y2Ba- 2gydF4y2Ba年代gydF4y2Ba- 1gydF4y2Ba[gydF4y2Ba41.gydF4y2Ba].然而,也报道了相反的结果[gydF4y2Ba47.gydF4y2Ba].此外,一些催化可逆反应的非调节酶,如醛缩酶和转酮醇酶,在稳态光下对碳通量有显著的控制[gydF4y2Ba15gydF4y2Ba,gydF4y2Ba48.gydF4y2Ba,gydF4y2Ba49.gydF4y2Ba,gydF4y2Ba50gydF4y2Ba].因此,其他卡尔文循环相关酶在动态光诱导中的作用有待进一步研究。gydF4y2Ba
最近的研究报道,多余的NPQ可以减少光合电子传递,从而限制COgydF4y2Ba2gydF4y2Ba在动态光线条件下固定[gydF4y2Ba12gydF4y2Ba,gydF4y2Ba51gydF4y2Ba].然而,我们认为LN和HN大豆叶片动态光合作用的差异不是由NPQ本身贡献的,因为电子传递是CO的限制因素gydF4y2Ba2gydF4y2Ba只能在弱光下固定,不能在强光下固定;因此,NPQ影响了电子传递,从而改变了COgydF4y2Ba2gydF4y2Ba将转换后的固定从高到低光,而不是从低到高光线后的转换[gydF4y2Ba12gydF4y2Ba,gydF4y2Ba51gydF4y2Ba].不同的公司gydF4y2Ba2gydF4y2BaLN和HN叶片之间的固定行为仅在弱光到强光转换后才观察到(图2)。gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba),因此这种差异不是由NPQ引起的。gydF4y2Ba
动态光诱导的光合抑制较少,而不是更多,在LN叶中而不是在HN大豆叶中gydF4y2Ba
与稳态光合作用一样,动态光合作用也可以受环境因素的影响。广泛研究稳态光合作用与环境之间的关系;然而,只有有限数量的研究与环境因素对动态光合作用的影响有关[gydF4y2Ba2gydF4y2Ba].一般来说,胁迫条件会增加动态光对光合作用的抑制,而有利条件会缓解这种抑制作用。据报道,干旱[gydF4y2Ba9gydF4y2Ba氮缺乏[gydF4y2Ba8gydF4y2Ba]及热压力[gydF4y2Ba52gydF4y2Ba均增加了动态光对光合作用的抑制。此外,高CO可缓解动态光诱导的光合抑制gydF4y2Ba2gydF4y2Ba大气(gydF4y2Ba10gydF4y2Ba,gydF4y2Ba53gydF4y2Ba,gydF4y2Ba54gydF4y2Ba,gydF4y2Ba55gydF4y2Ba,gydF4y2Ba56gydF4y2Ba].然而,我们的结果表明,LN胁迫缓解而不是加剧了动态光诱导的光合抑制。据我们所知,本研究首次报道了胁迫条件可以缓解动态光引起的光合作用抑制。gydF4y2Ba
这个结果超出了我们的预期。根据传统观点[gydF4y2Ba9gydF4y2Ba], Rubisco的激活状态会升高,以补偿供应LL叶片Rubisco的减少;Rubisco激活态越高,达到Rubisco激活态所需的时间就越长,这会延迟光合诱导,从而增加动态光引起的光合抑制。gydF4y2Ba
然而,本研究表明,在LL间隔后的光合诱导主要受到SBPase和FBPase再激活的限制,而不是Rubisco(见上)。因此,尽管Rubisco的含量在LN供体叶片(Figs。gydF4y2Ba4gydF4y2Ba,gydF4y2Ba5gydF4y2Ba),这一降低并没有延迟LL间隔后的光合作用。此外,由于Rubisco的含量比SBPase和FBPase的含量下降更明显(图。gydF4y2Ba4gydF4y2Ba)、SBPase和FBPase在LN叶片中相对过量(图。gydF4y2Ba5gydF4y2Ba).因此,激活所需的SBPase和FBPase含量较低(图)。gydF4y2Ba5gydF4y2Ba(因此,LN叶子中需要较短的时间以在LL间隔后光合诱导期间匹配Rubisco的活动。因此,光合诱导在LN供应叶中比HN供应叶更快,减轻了动态光诱导的光合抑制。gydF4y2Ba
结论gydF4y2Ba
本研究提示RuBP再生相关酶(SBPase和FBPase)的再激活,而不是RuBP羧化酶(Rubisco),限制了动态光条件下的光合诱导和光利用效率。LN大豆叶片中相对于Rubisco过量的FBPase和SBPase加速了动态光下的光合诱导。因此,与我们的预期相反,动态光对LN叶片光合作用的抑制比HN叶片少,而不是多。gydF4y2Ba
方法gydF4y2Ba
植物材料gydF4y2Ba
大豆(gydF4y2Ba大豆gydF4y2Ba简历。Qihuang34;从山东农业科学院作物研究所购买,进行了正式的识别。种子仍然在商业上销售,但目前尚不清楚优惠券标本是否已被储存在公共植物标本中。植物在盆中(直径为20厘米,高度为25厘米),填充有蛭石。用高(10mM硝酸盐)或低(硝酸盐)氮气(1mm硝酸盐)氮气营养溶液每2天灌溉植物。营养溶液含有1或10mm N,10mM P,25mM k,2mM Mg,1mM Ca,2mm S,0.1mm FE,180μmb,25μmmn,3μmzn,1.3μmcu,和0.5μmmo。不仅缺乏缺乏症,而且过量的氮对植物有害,包括光合机制。在大豆的先前报告中提到了本研究中的10mm硝酸盐作为“高氮处理”[gydF4y2Ba57gydF4y2Ba,gydF4y2Ba58gydF4y2Ba和其他物种[gydF4y2Ba59gydF4y2Ba,gydF4y2Ba60gydF4y2Ba,gydF4y2Ba61gydF4y2Ba,gydF4y2Ba62gydF4y2Ba提供充足而不过量的氮给植物。gydF4y2Ba
不同的氮供应水平也影响营养液的渗透势,但高氮营养液渗透势的轻微增加可以忽略。生长过程中不使用土壤,试验过程中未观察到结瘤现象。这些植物被放在温室里;最高温度和光照强度约为32°C和1000 μmol mgydF4y2Ba- 2gydF4y2Ba年代gydF4y2Ba- 1gydF4y2Ba在白天。温室内湿度为50-70%。实验使用4- 5周龄植株发育完全的最年轻叶片。gydF4y2Ba
SLA,氮和叶绿素含量gydF4y2Ba
比叶面积(SLA)是用叶面积除以叶干质量得到的。用LI-3000C area Meter (Li-Cor, USA)测量叶面积,然后在70°C烘干叶材料。用80%的丙酮从冷冻叶片中提取叶片叶绿素,用UV-2550分光光度计(日本岛津)按照Porra等人的方法进行分析[gydF4y2Ba63gydF4y2Ba].采用K9860型凯氏定氮仪(中国哈农)测定总氮含量。gydF4y2Ba
气体交换的测量gydF4y2Ba
光合气体交换参数、光合速率(Pn)、蒸腾速率(E)和气孔下COgydF4y2Ba2gydF4y2Ba使用CIRAS-3便携式光合系统(PP系统,USA)测量浓度(CI)。光强度,轻质质量(95%红色和5%蓝光),COgydF4y2Ba2gydF4y2Ba在CIRAS-3光合系统中,分压(Cr)、相对湿度(60%)和叶片温度(30°C)由一个自动控制装置控制。光子通量密度(PFD)和COgydF4y2Ba2gydF4y2Ba响应曲线测定表明,叶片适应于HL (1600 μmol mgydF4y2Ba- 2gydF4y2Ba年代gydF4y2Ba- 1gydF4y2Ba)及正常一氧化碳gydF4y2Ba2gydF4y2Ba(400μmolmolgydF4y2Ba- 1gydF4y2Ba),然后它们适应每种光强和COgydF4y2Ba2gydF4y2Ba在响应曲线测量过程中,浓度保持至少120秒。在PFD响应曲线测量过程中,光强度的变化顺序为:1600、1200、800、600、400、300、200、150、100和50 μmol mgydF4y2Ba- 2gydF4y2Ba年代gydF4y2Ba- 1gydF4y2Ba。在CO的测量期间,CR按以下顺序改变gydF4y2Ba2gydF4y2Ba响应曲线:400,300,200,175,150,125,100,400,600和800μmolmolgydF4y2Ba- 1gydF4y2Ba。光合量子产量(PQY)是光强(50 ~ 200 μmol m)和光强(50 ~ 200 μmol m)线性关系的斜率gydF4y2Ba- 2gydF4y2Ba年代gydF4y2Ba- 1gydF4y2Ba) [gydF4y2Ba33.gydF4y2Ba].Pn/Ci响应曲线从400 μmol mol开始测量gydF4y2Ba- 1gydF4y2Ba环境CO.gydF4y2Ba2gydF4y2Ba然后逐渐降低到50 μmol molgydF4y2Ba- 1gydF4y2Ba;之后,将浓度恢复至400μmolmolgydF4y2Ba- 1gydF4y2Ba并保持至少15分钟,直到PN恢复到初始值,以重新激活Rubisco,然后,环境COgydF4y2Ba2gydF4y2Ba浓度从400 μmol mol逐渐增加到900 μmol molgydF4y2Ba- 1gydF4y2Ba。的有限公司gydF4y2Ba2gydF4y2Ba根据C3光合作用模型,RuBP羧化作用或RuBP再生会限制同化率[gydF4y2Ba40gydF4y2Ba].rubp -羧化的最大速率(VgydF4y2BacmaxgydF4y2Ba)和rubp再生(JgydF4y2Ba马克斯gydF4y2Ba),通过拟合Pn/Ci响应曲线[gydF4y2Ba64gydF4y2Ba,gydF4y2Ba65gydF4y2Ba].光下线粒体呼吸速率的典型值(Rd),二氧化碳和CO的Rubisco米氏常数gydF4y2Ba2gydF4y2Ba无呼吸状态下的补偿点(1.35 μmol mgydF4y2Ba- 2gydF4y2Ba年代gydF4y2Ba- 1gydF4y2Ba651 μmol molgydF4y2Ba- 1gydF4y2Ba和55.2 μmol molgydF4y2Ba- 1gydF4y2Ba, 分别) [gydF4y2Ba65gydF4y2Ba用来解决v的值gydF4y2BacmaxgydF4y2Ba和JgydF4y2Ba马克斯gydF4y2Ba在这项研究中。gydF4y2Ba
在1600 μmol m的光照条件下,对叶片的气体交换进行了动态测定gydF4y2Ba- 2gydF4y2Ba年代gydF4y2Ba- 1gydF4y2Ba光和400 μmol molgydF4y2Ba- 1gydF4y2Ba有限公司gydF4y2Ba2gydF4y2Ba在CIRAS-3的会议厅。当光合作用气体交换达到稳定状态后,CIRAS-3每3 s自动记录一次数据。叶片表面的光强度由CIRAS-3上的自动控制装置根据本研究使用的两种方案之一来控制。第一种方法为:用1600 μmol m的HL溶液180 sgydF4y2Ba- 2gydF4y2Ba年代gydF4y2Ba- 1gydF4y2Ba)、60 s的LL (100 μmol m .gydF4y2Ba- 2gydF4y2Ba年代gydF4y2Ba- 1gydF4y2Ba)、HL为300 s、LL为120 s、HL为300 s、LL为300 s、HL为1200 s、LL为600 s、HL为1800 s。第二种治疗方案为:HL治疗240 s, LL治疗和HL治疗每120 s交替进行。在本研究中,气体交换时间历程曲线下的面积表示综合气体交换。计算Pn的诱导状态(IS%)值为IS% = (PngydF4y2Ba30年代gydF4y2Ba + RdgydF4y2Ba) / (PngydF4y2Ba稳定的gydF4y2Ba + RdgydF4y2Ba),其中PngydF4y2Ba30年代gydF4y2Ba在HL后30秒的Pn是否跟随LL, Pn的间隔gydF4y2Ba稳定的gydF4y2Ba是稳态HL条件下的Pn, RgydF4y2BadgydF4y2Ba是黑暗中的呼吸频率。gydF4y2Ba
免疫印迹分析gydF4y2Ba
在进行稳态气体交换测量后,这些叶子被切割、称重并立即储存在液氮中。用50 mM HEPES-KOH (pH 7.8)、10 mM NaCl和2 mM MgCl组成的缓冲液提取可溶性蛋白gydF4y2Ba2gydF4y2Ba从1.75厘米gydF4y2Ba- 2gydF4y2Ba叶组织。将10微升可溶性蛋白质与加载缓冲液混合,并在99℃下退化10分钟。然后将可溶性蛋白质加载到10%(w / w)的SDS-PAGE凝胶上分离。随后使用标准方法随后将来自凝胶的蛋白质涂在硝酸纤维素上。免疫缩乳通过特定的原发性抗体和辣根过氧化物酶 - 缀合的抗兔二抗(Solarbio,China)进行。施加热科学超人征西微微衬底用于检测免疫反应。通过Tanon 5500冷却的电荷耦合器件相机(中国坦昂)记录化学发光在印迹上。从Phyto AB(USA)或Agrisera(瑞典)购买抗果糖-1,6-二磷酸酶(FBP酶),Sedoheptulose-1,7-双磷酸酶(SBPase)和Rubisco大亚基(RBCL)的主要抗体。gydF4y2Ba
酶活性测定gydF4y2Ba
对不同植物的酶活性和气体交换进行了分析。光照前,用LI-3000C面积仪(Li-Cor, USA)测量叶面积。光照后,叶子从植株中分离出来,并迅速在液氮中冷冻。Rubisco活性的测定方法参照Yang et al.和Cheng et al. [gydF4y2Ba66gydF4y2Ba,gydF4y2Ba67gydF4y2Ba].使用砂浆和杵在含有100mm三嗪(pH8.0),5mM MgCl的萃取缓冲液中,将冷冻叶片磨削到液氮中的细粉。gydF4y2Ba2gydF4y2Ba, 0.1 mM EDTA, 5 mM二硫苏糖醇,1% (w/v)聚乙烯吡咯烷酮,1% (w/v)酪蛋白和0.05% (v/v) Triton X-100。在含有5 mM HEPES-NaOH (pH 8.0)、1 mM NaHCO的反应介质中测定初始Rubisco活性gydF4y2Ba3.gydF4y2Ba,2 mm mgclgydF4y2Ba2gydF4y2Ba, 0.25 mM二硫苏糖醇,0.1 mM EDTA, 1 U甘油醛-3-磷酸脱氢酶,0.5 mM ATP, 0.015 mM NADHgydF4y2Ba2gydF4y2Ba、0.5 mM磷酸肌酸和0.06 mM二磷酸核酮糖。在340 nm处检测90 s的吸光度变化。SBPase活性的测定方法参照Harrison et al.和Simkin et al. [gydF4y2Ba68gydF4y2Ba,gydF4y2Ba69gydF4y2Ba].含有50mM HEPES(pH8.2),5mM MgCl的萃取缓冲液gydF4y2Ba2gydF4y2Ba、1 mM EDTA、1 mM EGTA、10%甘油、0.1% Triton X-100、2 mM苯甲脒、2 mM氨基己酸、0.5 mM苯甲磺酰氟(PMSF)和10 mM二硫苏糖醇(DTT)。gydF4y2Ba
反应介质中含有50 mM Tris (pH 8.2), 15 mM MgClgydF4y2Ba2gydF4y2Ba, 1.5 mM EDTA, 10 mM DTT和2 mM sedoheptulose-1,7-二磷酸和提取物,在25°C孵育5分钟后进行分析。加入高氯酸溶液终止反应,4℃离心。将样品和标准品与Biomol Green (Affiniti Research Products, Exeter, UK)混合,室温孵育30分钟,测量620 nm处的吸光度。FBPase活性测定采用Sassenrath-Cole和Pearcy方法[gydF4y2Ba45.gydF4y2Ba].含有100mm三甘氨酸(pH8.1),10mM MgCl的萃取缓冲液gydF4y2Ba2gydF4y2Ba、1 mM EDTA、15 mM巯基乙醇和1 mM果糖-1,6-二磷酸。FBPase活性在25°C下测定,方法是在1 mL含100 mM tricine (pH 8.1), 20 mM MgCl的检测缓冲液中,在340 nm处测量吸光度的增加gydF4y2Ba2gydF4y2Ba, 1 mM EDTA, 0.3 mM NADPgydF4y2Ba+gydF4y2Ba, 0.6 mM果糖-1,6-二磷酸,0.6单位葡萄糖-6- p -脱氢酶,1.2单位磷酸葡萄糖异构酶和0.1 mL叶提取物。一些细胞质FBPase活性将被检测到,尽管使用检测条件有利于质体FBPase。但据报道,胞质FBPase活性仅为质体FBPase活性的1.2%以下gydF4y2Ba拟南芥gydF4y2Ba叶下的叶子[gydF4y2Ba70gydF4y2Ba].因此,忽略了细胞溶质FBPase对FBPase活性的贡献。通过上述测定条件检测的FBPase的活性被认为是体积FBP酶。gydF4y2Ba
统计分析gydF4y2Ba
测量在3-6株植物中进行。用于使用SPS 11分析治疗之间的差异的T检验。gydF4y2Ba
可用性数据和材料gydF4y2Ba
本研究中产生或分析的所有数据均包含在本文[及其补充信息文件]中。gydF4y2Ba
缩写gydF4y2Ba
- 置信区间:gydF4y2Ba
-
仅仅替代公司CO.gydF4y2Ba2gydF4y2Ba专注gydF4y2Ba
- 克雷格:gydF4y2Ba
-
有限公司gydF4y2Ba2gydF4y2Ba分压gydF4y2Ba
- 艾凡:gydF4y2Ba
-
蒸腾速率gydF4y2Ba
- FBPase:gydF4y2Ba
-
的特性,6-bisphosphatasegydF4y2Ba
- 霍奇金淋巴瘤:gydF4y2Ba
-
高亮度gydF4y2Ba
- HN:gydF4y2Ba
-
高氮gydF4y2Ba
- %:gydF4y2Ba
-
Pn感应态gydF4y2Ba
- JgydF4y2Ba马克斯gydF4y2Ba:gydF4y2Ba
-
rubp再生的最大速率gydF4y2Ba
- 噢,gydF4y2Ba
-
低光gydF4y2Ba
- LN:gydF4y2Ba
-
低氮gydF4y2Ba
- 挂钩:gydF4y2Ba
-
聚乙二醇gydF4y2Ba
- PFD:gydF4y2Ba
-
光子通量密度gydF4y2Ba
- Pn:gydF4y2Ba
-
光合速率gydF4y2Ba
- PngydF4y2Ba马克斯gydF4y2Ba:gydF4y2Ba
-
HL周期下的最大PNgydF4y2Ba
- PQY:gydF4y2Ba
-
光合量子产量gydF4y2Ba
- ::gydF4y2Ba
-
二磷酸核酮糖羧化酶大亚基gydF4y2Ba
- RCA:gydF4y2Ba
-
二磷酸核酮糖羧化酶活化酶gydF4y2Ba
- 理查德·道金斯:gydF4y2Ba
-
线粒体呼吸率在光线下gydF4y2Ba
- 二磷酸核酮糖羧化酶:gydF4y2Ba
-
核酮糖1 5 5-bisphosphate,羧化酶/加氧酶gydF4y2Ba
- SBPase:gydF4y2Ba
-
Sedohepleplulose-1,7-双磷酸酶gydF4y2Ba
- SLA:gydF4y2Ba
-
比叶面积gydF4y2Ba
- VgydF4y2BacmaxgydF4y2Ba:gydF4y2Ba
-
最大rubp-carboxylation速率gydF4y2Ba
参考gydF4y2Ba
- 1.gydF4y2Ba
Pearcy RW光碟。植物冠层中的太阳斑和光合作用。《植物生理学》1990;41:421-53。gydF4y2Ba
- 2.gydF4y2Ba
达达,Pearcy rw。在树木和森林中的Sunflecks:从光合生理到全球变革生物学。树生理。2012; 32:1066-81。gydF4y2Ba
- 3.gydF4y2Ba
(1)高丛蓝莓光合限制对产量的影响gydF4y2BaVaccinium corymbosumgydF4y2Ba)生长于北欧环境。J Exp Bot. 2018; 69:3069-80。gydF4y2Ba
- 4.gydF4y2Ba
Leakey ADB, Press MC, Scholes JD。动态辐照度的模式影响了Dipterocarp树幼苗的光合容量和生长。oecologia。2003; 135:184-93。gydF4y2Ba
- 5.gydF4y2Ba
朱晓刚,刘建军,刘建军,等。光系统热耗散在高到低光转换过程中的缓慢可逆性可能导致作物冠层碳吸收损失的理论分析。J Exp Bot. 2004; 55:1167-75。gydF4y2Ba
- 6.gydF4y2Ba
Kaiser E,Morales A,Harbinson J,Kromdijk J,Heuvelink E,Marcelis LF。不同环境条件下的动态光合作用。J Exp Bot。2015; 66:2415-26。gydF4y2Ba
- 7.gydF4y2Ba
光合诱导强烈地影响净光合作用的光补偿点,同时也影响表观量子效率。树木。2002;16:47 - 62。gydF4y2Ba
- 8.gydF4y2Ba
Sun J,Miao Y,Peng S,Yong L.氮气可以提高光合作用的快速反应在水稻中改变辐照度(gydF4y2Ba奥雅萨苜蓿gydF4y2BaL.)植物。SCI批准。2016; 6:31305。gydF4y2Ba
- 9。gydF4y2Ba
Sun J,Zhang Q,Tabassum Ma,Ye M,Peng S,Li Y.在水缺损条件下的抑制在斑点比水稻均匀辐照度更严重(gydF4y2Ba奥雅萨苜蓿gydF4y2Ba) 植物。Funct植物生物。2017; 44:464-72。gydF4y2Ba
- 10.gydF4y2Ba
Leakey adb,按MC,Scholes JD,Watling JR。相对提高升高的光合作用和生长gydF4y2Ba2gydF4y2Ba,在太阳斑点下比均匀辐照热带雨林的树苗更大。在光合作用和太阳斑点下生长。植物学报2002;25:1701-14。gydF4y2Ba
- 11.gydF4y2Ba
李基亚,肖尔斯,Press MC.太阳斑对龙果幼苗的生理和生态意义。J Exp Bot. 2005; 56:469-82。gydF4y2Ba
- 12.gydF4y2Ba
Kromdijk J,GłowackaK,Leonelli L,Gabilly St,Iwai M,Niyogi Kk,Long SP。通过加速光保护恢复来提高光合作用和作物生产力。科学。2016; 354:857-61。gydF4y2Ba
- 13。gydF4y2Ba
Hubbart S, Smillie IR, Heatley M, Swarup R, Foo CC, Zhao L, Murchie EH。增强类囊体光保护可以提高水稻产量和冠层辐射利用效率。Commun生物。2018;1:22说。gydF4y2Ba
- 14。gydF4y2Ba
Porcar-Castell A,Palmroth S.在高度动态环境中建模光合作用:SunFlecks的情况。树生理。2012; 32:1062-5。gydF4y2Ba
- 15.gydF4y2Ba
卡尔文循环的再现。Photosynth杂志2003;75:1-10。gydF4y2Ba
- 16.gydF4y2Ba
小西曼,夏基TD,皮尔斯RW大根桉核酮糖-1,5-二磷酸羧化酶活性对辐照度阶跃变化的响应。植物杂志。1988;88:148-52。gydF4y2Ba
- 17.gydF4y2Ba
SOLEH MA,Tanaka Y,Nomoto Y,Iwahashi Y,Nakashima K,Fukuda Y等。诱导大豆光合作用诱导的基因型差异因素(gydF4y2Ba大豆gydF4y2Ba(左)。稳定)。植物学报。2016;39:685-93。gydF4y2Ba
- 18.gydF4y2Ba
二磷酸二羧化酶活化酶-二磷酸二羧化酶的催化伴侣。Photosynth杂志2003;75:11-27。gydF4y2Ba
- 19。gydF4y2Ba
Carmo-Silva E,Scales JC,Madgwick PJ,Parry Ma。优化Rubisco及其规则,以获得更大的资源利用效率。植物细胞环境。2015; 38:1817-32。gydF4y2Ba
- 20.gydF4y2Ba
核酮糖1,5 -二磷酸羧化酶/加氧酶活性的调节。植物学报1992;43:415-37。gydF4y2Ba
- 21.gydF4y2Ba
引用本文:王志强,王志强,王志强,等。辅助蛋白在Rubisco生物发生和功能中的作用。Nat植物。2015;1:15065。gydF4y2Ba
- 22.gydF4y2Ba
Yamori W,Masumoto C,Fukayama H,Makino A. Rubisco Activase是任何叶子温度的非稳态光合作用的关键调节器,在高温下稳态光合作用的较小程度。植物J. 2012; 71:871-80。gydF4y2Ba
- 23.gydF4y2Ba
Carmo-Silva AE,Salvucci Me。Rubisco Actiac ase的调节性质在物种中不同,并影响光学转变过程中的光合作用。植物理性。2013; 161:1645-55。gydF4y2Ba
- 24.gydF4y2Ba
蛋白质氮在光合装置中的分配:成本、后果和控制。印:Brigs WR,编辑。光合作用。纽约:Alan R. Liss;1989.p . 183 - 205。gydF4y2Ba
- 25。gydF4y2Ba
王志强,王志强,王志强,等。玉米光合氮利用效率与蛋白质分配的关系。植物生理学报。2003;44:952-6。gydF4y2Ba
- 26。gydF4y2Ba
Makino A.光合作用,籽粒产量和稻米和小麦的氮。植物理性。2011; 155:125-9。gydF4y2Ba
- 27。gydF4y2Ba
小埃文斯,克拉克VC。光合作用的氮成本。J Exp Bot. 2019; 70:7-15。gydF4y2Ba
- 28.gydF4y2Ba
程丽,李永海。苹果叶片的Rubisco活化状态随含氮量的增加而降低。J Exp Bot. 2000; 51:1687-94。gydF4y2Ba
- 29.gydF4y2Ba
Ray D, Sheshshayee MS, Mukhopadhyay K, Bindumadhava H, Prasad TG, Kumar MU。高氮利用效率的水稻基因型与较低Rubisco含量下较高的净光合速率相关。杆菌的杂志。2003;46:251-6。gydF4y2Ba
- 30.gydF4y2Ba
养分供应增加了由内部导度引起的对co2运动的光合限制。J Exp Bot. 2004; 55:2313-21。gydF4y2Ba
- 31.gydF4y2Ba
Warren CR, Dreyer E, Adams MA。叶片光合作用与rubisco的关系gydF4y2BaPinus sylvestris.gydF4y2Ba响应于氮供应和Rubisco和氨基酸作为氮气储存的拟议作用。树木。2003; 17:359-66。gydF4y2Ba
- 32.gydF4y2Ba
叶光华,王志强,王志强,等。基于回归分析参数和叶肉电导的木本植物A/ci曲线分析。J Exp Bot. 2004; 55:2581-8。gydF4y2Ba
- 33.gydF4y2Ba
关键词:CO,量子产率,量子化学gydF4y2Ba2gydF4y2BaC3和C4植物吸收依赖于温度,COgydF4y2Ba2gydF4y2Ba和O.gydF4y2Ba2gydF4y2Ba专注。植物理性。1977年; 59:86-90。gydF4y2Ba
- 34.gydF4y2Ba
李志刚,李志刚,李志刚,等。光诱导气孔对水稻光合作用和水分利用效率的影响。新植醇。2016;211:1209-20。gydF4y2Ba
- 35.gydF4y2Ba
孔F,邓Y,周B,王G,王Y,萌Q.叶绿体靶向DNAJ蛋白有助于在寒冷胁迫下的照相型II的维护。J Exp Bot。2014; 65:143-58。gydF4y2Ba
- 36.gydF4y2Ba
杨旭,李旭,杨旭。小麦高产选择需要叶片解剖和生化性状的改善,包括对非最适温度条件的耐受性。Photosynth杂志2018;136:245-55。gydF4y2Ba
- 37。gydF4y2Ba
庄凯,孔凤芳,张绍华,杨敏,刘智,王颖,马宁,孟c。旋毛虫1通过保护光合系统II和调节淀粉降解增强番茄抗寒性。新植醇。2019;221:1998 - 2012。gydF4y2Ba
- 38。gydF4y2Ba
张敏,张国强,康海辉,周思明,王伟。小麦E3连接酶基因TaPUB1对烟草耐盐性的影响。植物生理学报。2017;58:1673-88。gydF4y2Ba
- 39。gydF4y2Ba
谭伟,孟QW,杨欣,杨欣。外源钙对烤烟光合作用的影响。acta botanica yunnanica(云南植物研究). 2011;gydF4y2Ba
- 40.gydF4y2Ba
Farquhar Gd,von Caemmerer S,Berry Ja。光合作用的生化模型gydF4y2Ba2gydF4y2BaC3种叶片中的同化。Planta。1980; 149:78-90。gydF4y2Ba
- 41.gydF4y2Ba
long sp,伯纳奇奇cj。气体交换测量,他们能告诉我们对光合作用的潜在限制是什么?程序和错误来源。J Exp Bot。2003; 54:2393。gydF4y2Ba
- 42.gydF4y2Ba
Bernacchi CJ,Bagley Je,Serbin SP,Ruiz-Vera UM,Rosenthal DM,Vanloocke A.将C3光合作用从叶绿体到生态系统。植物细胞环境。2013; 36:1641-57。gydF4y2Ba
- 43.gydF4y2Ba
Naranjo B, Diaz-Espejo A, Lindahl M, Cejudo FJ。f型硫氧还蛋白在碳代谢的短期激活中发挥作用,其损失影响拟南芥在短期条件下的生长。J Exp Bot. 2016; 67:1951-64。gydF4y2Ba
- 44.gydF4y2Ba
叶绿体磷酸化蛋白激酶的性质。植物杂志。1974;53:136-9。gydF4y2Ba
- 45.gydF4y2Ba
萨森拉斯-科尔GF,皮尔斯RW。低光照射强度和持续时间对光合诱导状态的调节。植物杂志。1994;105:1115-23。gydF4y2Ba
- 46.gydF4y2Ba
Marri L,Zaffagnini M,Collin V,Issakidisbourguet E,Lemaire SD,Pupillo P等人。在GAPDH / CP12 / PRK超分子复合物相关的拟南芥拟南芥的Calvin循环酶的特定硫氧化酶及易激活。莫尔植物。2009; 2:259-69。gydF4y2Ba
- 47.gydF4y2Ba
硫氧还蛋白介导的基质多蛋白复合物可逆解离对光可利用性变化的响应。美国国立科学院。2008; 105:4056 - 61。gydF4y2Ba
- 48.gydF4y2Ba
Haake V, Geiger M, Walch-Liu P, Engels C, Zrenner R, Stitt M.野生型马铃薯植株醛缩酶活性的变化对生长光强和二氧化碳浓度的适应是重要的,因为在一系列生长条件下,质体醛缩酶对环境的光合速率起着控制作用。植物j . 1999; 17:479 - 89。gydF4y2Ba
- 49。gydF4y2Ba
Haake V,Zrenner R,Sonnewald U,Stitt M.塑体醛糖酶活性的中等减少抑制光合作用,改变了糖和淀粉的水平,并抑制马铃薯植物的生长。工厂J. 1998; 14:147-57。gydF4y2Ba
- 50。gydF4y2Ba
反义烟草转化体中质体转酮醇酶活性的轻微降低对光合作用和苯丙酸代谢具有显著影响。植物细胞。2001;13:535-51。gydF4y2Ba
- 51.gydF4y2Ba
Armbruster U,Carrillo R,Venema K,Pavlovic L,Schmidtmann E,Kornfeld A等人。ION Antiport加速了波动光环境中的光合作用。NAT Communce。2014; 5:5439。gydF4y2Ba
- 52.gydF4y2Ba
Leakey ADB, Press MC, Scholes JD。太阳斑对热带雨林树木幼苗光合作用的高温抑制作用大于均匀光照。植物学报2003;26:1681-90。gydF4y2Ba
- 53.gydF4y2Ba
诺姆堡E,埃尔斯沃思DS。CO升高条件下林下幼树光合太阳斑的利用潜力gydF4y2Ba2gydF4y2Ba在脸上。环境科学。2000;122:163 - 74。gydF4y2Ba
- 54.gydF4y2Ba
Holišová P, Zitová M, Klem K, Urban O.波动光下co2浓度升高对碳同化的影响。J Environ Qual. 2012; 41:31 - 8。gydF4y2Ba
- 55.gydF4y2Ba
Kaiser E,Kromdijk J,Harbinson J,Heuvelink E,Marcelis LFM。由CO的光合诱导及其扩散,羧化和电子传输过程gydF4y2Ba2gydF4y2Ba部分压力,温度,空气湿度和蓝色辐照度。Ann Bot。2017; 119:191-205。gydF4y2Ba
- 56.gydF4y2Ba
周东,侯维林,哈宾逊,莫拉莱斯,马塞利斯。高有限公司gydF4y2Ba2gydF4y2Ba无论光合诱导状态如何,都会增加波动辐照的光合作用。J Exp Bot。2017; 68:5629-40。gydF4y2Ba
- 57.gydF4y2Ba
Paradiso R,Buondo R,Dixon Ma,Barbieri G,De Pacale S.细菌根系共生和尿素的作用作为氮气的源于用于生物生物寿命支持系统(BLSS)的大豆植物的性能。前植物SCI。2015; 6:888。gydF4y2Ba
- 58.gydF4y2Ba
Keino L, Baijukya F, Ng 'etich W, Otinga AN, Okalebo JR, Njoroge R, Mukalama J.营养限制大豆(gydF4y2BaGlycine Maxl.gydF4y2Ba)生长在肯尼亚西部的Acrisols和ferralsols。《公共科学图书馆•综合》。2015;十12。gydF4y2Ba
- 59.gydF4y2Ba
Takatani N,ITO T,Kiba T,Mori M,Miyamoto T,Maeda Si,Maeda Si,高二氧化碳对亚麻植物的生长过程中拟南芥幼苗生长和代谢的影响。植物细胞生理。2014; 55:281-92。gydF4y2Ba
- 60。gydF4y2Ba
高氮水稻光饱和光合速率研究(英文)gydF4y2Ba奥雅萨苜蓿gydF4y2Ba叶片与叶绿体CO有关gydF4y2Ba2gydF4y2Ba专注。J Exp Bot。2009; 60:2351-60。gydF4y2Ba
- 61。gydF4y2Ba
李y,任b,丁l,沉q,彭s,郭s。叶绿体大小是否影响光合氮使用效率?Plos一个。2013; 8:4。gydF4y2Ba
- 62。gydF4y2Ba
Fernández-Crespo E,Scalschi L,Llorens E,García-AgustínP,CamañesG.NH4gydF4y2Ba+gydF4y2Ba通过激活全身获得的适应来保护番茄植物免受假单胞菌植物。J Exp Bot。2015; 66:6777-90。gydF4y2Ba
- 63.gydF4y2Ba
Porra RJ。叶绿素a和b精确测定联立方程的发展和使用的起伏历史。Photosynth Res. 2002; 73:149-56。gydF4y2Ba
- 64.gydF4y2Ba
Bernacchi CJ,Singsaas El,Pimentel C,Portis Ar,Long SP。改进了Rubisco-Limited光合作用模型的温度响应函数。植物细胞环境。2001; 24:253-9。gydF4y2Ba
- 65.gydF4y2Ba
Sharkey TD, Bernacchi CJ, Farquhar GD, Singsaas EL。拟合C3叶片光合二氧化碳响应曲线。植物学报2007;30:1035-40。gydF4y2Ba
- 66.gydF4y2Ba
关键词:甜菜碱,转基因烟草,光合作用,高温胁迫植物杂志。2005;138:2299 - 309。gydF4y2Ba
- 67.gydF4y2Ba
程F,周耶,夏XJ,Shi K,周J,Yu JQ。叶状血管生殖素-F和硫昔单素-M 1/4在CO的芸苔类药物诱导的变化中起重要作用gydF4y2Ba2gydF4y2Ba番茄的同化和细胞氧化还原稳态。J Exp Bot. 2014; 65:4335-47。gydF4y2Ba
- 68.gydF4y2Ba
哈里森ep,愿意纳姆,劳埃德·杰克,雨。转基因烟草中的Sedoheptulose-1,7-双磷脂酶水平降低,导致光合容量降低和改变的碳水化合物积累。Planta。1998年; 204:27-36。gydF4y2Ba
- 69.gydF4y2Ba
Simkin AJ, McAusland L, Headland LR, Lawson T, Raines CA.光合碳同化的多基因操纵增加COgydF4y2Ba2gydF4y2Ba烟草的固定和生物量产量。J Exp Bot. 2015; 66:4075-90。gydF4y2Ba
- 70.gydF4y2Ba
StrandÅ,赶紧v,汉克斯,猎人n,gustafsson p,Gardeströmp,stitt m.拟南芥的适应在低温下发展。增加细胞质体积伴随着Calvin循环和蔗糖 - 生物合成途径中酶活性的增加。植物理性。1999; 119:1387-98。gydF4y2Ba
致谢gydF4y2Ba
不适用。gydF4y2Ba
资金gydF4y2Ba
本作中国天然科学基金的财务支持(31701966; 31401339; 31771691);山东省自然科学基金会(ZR2017QC001);中国国家重点研发计划(2016YFD0300106; 2016YFD0300205)。此外,资助者在研究和收集,分析和解释方面没有作用,数据的决定,或准备稿件。gydF4y2Ba
作者信息gydF4y2Ba
从属关系gydF4y2Ba
贡献gydF4y2Ba
YTL和YNL进行了大部分实验和数据分析。YL2培养植物。QS分析酶活性。GL,PL,ZSZ设计了这项研究。YL1,ZSZ和HYG是撰写手稿的主要贡献者。所有作者阅读并认可的终稿。gydF4y2Ba
相应的作者gydF4y2Ba
伦理宣言gydF4y2Ba
伦理批准和同意参与gydF4y2Ba
不适用。gydF4y2Ba
同意出版gydF4y2Ba
不适用。gydF4y2Ba
相互竞争的利益gydF4y2Ba
两位作者宣称他们没有相互竞争的利益。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。gydF4y2Ba
补充信息gydF4y2Ba
附加文件1:图S1。gydF4y2Ba
气孔电导(GS),蒸腾速率(E)和分子膜有限公司gydF4y2Ba2gydF4y2Ba浓度(Ci)。gydF4y2Ba
附加文件2:图S2。gydF4y2Ba
动态光合气体交换测定引起的PSII光抑制。gydF4y2Ba
附加文件3:图S3。gydF4y2Ba
渗透势对光合作用气体交换的影响。gydF4y2Ba
附加文件4:图S4。gydF4y2Ba
气孔导率(GS),蒸腾率(E)和替代物有限公司gydF4y2Ba2gydF4y2Ba在波动条件下浓度(CI)。gydF4y2Ba
附加文件5:图S5。gydF4y2Ba
原始,全长凝胶和rubisco,sbpase和fbpase的污点。gydF4y2Ba
附加文件6。gydF4y2Ba
图1-5和图S1-S4的原始数据。gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料都包含在本文的知识共享许可中,除非在该材料的信用额度中另有说明。如果资料不包括在文章的知识共享许可协议中,并且你的预期用途没有被法律规定允许或超过允许用途,你将需要直接从版权所有者获得许可。如欲查阅本许可证副本,请浏览gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba。创作共用及公共领域专用豁免书(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)适用于本文中提供的数据,除非另有用入数据的信用额度。gydF4y2Ba
关于这篇文章gydF4y2Ba
引用这篇文章gydF4y2Ba
李,欧美。,Li, Y., Li, YN.等等。gydF4y2Ba动态光对大豆光合作用的抑制作用在缺氮条件下比在充足供氮条件下小,而不是大。gydF4y2BaBMC植物BIOL.gydF4y2Ba20.gydF4y2Ba339(2020)。https://doi.org/10.1186/s12870-020-02516-ygydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12870-020-02516-ygydF4y2Ba
关键词gydF4y2Ba
- 动态灯gydF4y2Ba
- 低氮gydF4y2Ba
- 光合作用gydF4y2Ba
- 大豆gydF4y2Ba