摘要
背景
果实颜色是葡萄果实的重要性状,主要由花色苷含量和组成决定。为进一步探讨葡萄果实的着色机制,研究了葡萄果实的F1群体葡萄用‘Red Globe’בMuscat Hamburg’进行颜色位点定位,并进行转录组分析以协助筛选候选基因。
结果
从人群全基因组重测序(WGS)中共获得438,407个高质量单核苷酸多态性(SNPs),选取27,454个SNPs构建高密度遗传图谱。所选snp聚为19个连锁群,遗传距离为1442.638 cM。用颜色等级、色差、总花青素含量和花青素组成对果实颜色进行评价。2017年和2018年各表型的Pearson相关系数均在0.01水平上显著。主要的颜色轨迹MYBA1而且MYBA2在LG2上被发现,解释了26 - 63.6%的表型变异。此外,在Chr2、Chr4、Chr6、Chr11和Chr17上检测到9个影响较小的qtl。结合基因注释和RNA-seq数据,从上述qtl中筛选出多个新的候选基因。
结论
这些结果表明,葡萄果实颜色是由一个主色位点和多个小色位点控制的数量性状。虽然主要颜色位点与前人研究一致,但本研究发现了几个与葡萄果实颜色和花青素积累相关的次要qtl和候选基因。具体的监管机制还有待进一步探索。
背景
葡萄是一种重要的经济作物,果实的颜色是葡萄的一个重要特征。众所周知,葡萄浆果的颜色取决于果皮中的花青素。1].花青素在内质网中通过类黄酮途径合成,然后通过一系列转运体运输到液泡中保存(图。S1)[2,3.,4].
类黄酮途径由MYB、bHLH和WD40 (MBW)组成的转录复合体调控[5,6].毫无疑问,花青素的生物合成也受到MBW转录复合体的调控[7,8].udp -葡萄糖:花青素:类黄酮糖基转移酶(UFGT)催化的糖基化是花青素生物合成的关键步骤。在葡萄中,表达UFGT受2号染色体上一系列MYB转录因子(tf)的转录调控[3.].MYBA1和MYBA2是通过调控花青素的表达参与调控花青素生物合成的关键tfUFGT在葡萄。在诉酿酒用葡萄,一个逆转录转座子(Gret1)在VvMYBA1基因,它形成了一个非功能性的等位基因VvMYBA1a并通过阻止其正常表达影响其功能[9,10].此外,在编码区的碱基突变VvMYBA2基因导致其翻译的早期终止,从而形成非功能性等位基因VvMYBA2w.白皮葡萄是由两种基因突变引起的VvMYBA1而且VvMYBA2基因(11,12,很好地解释了白皮葡萄的起源。然而,葡萄浆果的皮肤颜色是一个复杂的性状,有许多中间颜色类型。这么多颜色是怎么来的?有研究表明,葡萄果实的颜色与单倍型的组成密切相关MYBA基因(13,14].然而,这并不能完全解释葡萄的分色现象。
花青素的生物合成是一个复杂的代谢过程,由一系列调控因子组成的网络进行调控。在许多其他植物和葡萄中也发现了一些调节剂。在拟南芥, MYB-Like 2 (MYBL2)蛋白[15,16, Jasmonate zimi -domain (JAZ) [17]及鳞状细胞启动子结合蛋白样(SPL) [18]被证明可以通过与其对应的成员相互作用来抑制MBW复合物的作用,从而抑制花青素的合成。另一方面,研究表明MYBD、ELONGATED hypocoty5 (HY5)蛋白、DELLA等蛋白可以通过抑制这些抑制子的作用来促进花青素的生物合成[19,20.,21].最近,发现了3个新的R2R3-MYB基因(ASR1, ASR2, ASR3),并证实它们参与了植物花青素合成佩妮[22].在苹果,一系列MYB基因(MdMYB1 / MdMYB10,MdMYB9,MdMYB11)[23,24,25),bHLH基因(MdbHLH3而且MdMYC2)[26,27]和WD40基因(MdTTG1)[28]被鉴定参与花青素合成调控。近年来,除了MYBA1和MYBA2外,在葡萄中还发现了其他花青素合成调控因子。克隆了两个MYB转录因子(MYBC2-L1和VvMYB4-Like),并显示在葡萄莓皮肤花青素生物合成中发挥负调控作用[29,30.].两种mirna (miRNA828和miRNA858)调控了MYB促进葡萄花青素积累的基因[31].这些结果表明,葡萄果实颜色是一个复杂的性状,受多个位点和多个基因调控。
定量性状位点(QTL)定位是发现功能位点和基因的有效方法。构建高质量的遗传连锁图谱是QTL定位的基础。最早的基因图谱是基于RAPD和AFLP标记构建的[32,33].利用RAPD、AFLP、SRAP、SSR等传统DNA标记构建了大量葡萄遗传图谱[34,35,36,37,38].然而,这些DNA标记的数量有限,因此很难用这些传统标记构建高密度遗传图谱。随后,葡萄全基因组的发表[39],测序技术的快速发展促进了单核苷酸多态性(SNP)标记的发展和广泛应用[40].snp是基因组中最丰富、最稳定的遗传变异,是构建高密度遗传图谱的理想标记。近年来,利用基于葡萄SNP标记构建的高密度遗传图谱,已经发现了多个qtl和相关性状的候选基因[41,42,43,44,45,46,47].因此,高密度遗传图谱在QTL定位中具有明显优势。
在本研究中,全基因组重测序(WGS)策略用于识别snp,以构建高密度遗传图谱诉酿酒用葡萄“红地球”和“马斯喀特汉堡”。从表观颜色、花青素含量和花青素组成等方面进行QTL定位。利用高密度遗传图谱鉴定出多个与果实颜色性状相关的qtl。结合qtl和转录组分析结果,筛选出了几个可能与花青素积累和浆果颜色决定有关的候选基因。这为进一步研究葡萄果实颜色的调控提供了参考。
结果
WGS数据和SNP标记
经WGS处理后,F1群体95个个体和亲本的高质量clean reads分别为715.24 Gb和42.72 Gb。clean read已提交到NCBI的SRA数据库(Accession ID: PRJNA589353)。平均GC含量为37.12%。基因组中clean reads的平均覆盖率为91.70%,平均制图率为96.36% (TableS1).这表明测序读数在基因组中是随机分布的。母代平均覆盖深度为43.78倍,父代平均覆盖深度为50.55倍,子代平均覆盖深度为16.62倍S1).
经过严格的筛选(深度> =10,质量值> = 40,筛选漏检率大于20%或非二态型的snp),从种群中共获得优质snp 438,407个。经过进一步筛选,使用27454个snp构建高密度遗传图谱。
遗传图谱的构建
母本“Red Globe”的图谱在19条染色体(Chrs)的733个bin标记上锚定了12325个snp,遗传距离为1271.352 cM。平均标记距离为1.734 cM。“红地球”中snp的平均数量为770 / Chr。父本“麝香猫汉堡”的图谱在19个Chrs的929个bin标记上固定了15404个snp,遗传距离为1614.853 cM。平均标记距离为1.738 cM。“马斯喀特汉堡”中snp的平均数量为每Chr 811个(表S2).
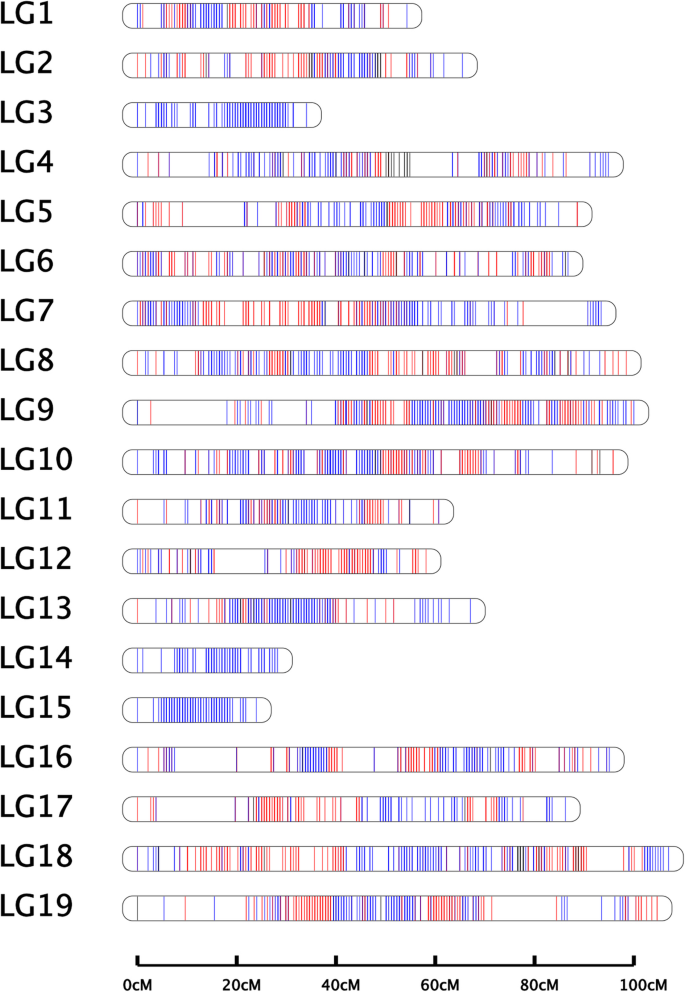
基于1554个bin标记的27454个snp构建了综合遗传图谱,聚在19个连锁群(LGs)中,覆盖1442.638 cM(图1)。1;表格1).平均标记距离为0.928 cM。每LG平均snp和bin标记数分别为1445和82个。遗传距离为34.051 cM (LG3) ~ 107.001 cM (LG18),平均为75.928 cM / LG。LGs的“最大间隙”在2.662 cM (LG3)到15.945 cM (LG17)之间。“Gap < 5 cM”的平均百分比为99.928%(表2)1).遗传与物理图谱共线性分析的Spearman相关系数为0.87 (LG18) ~ 0.97 (LG4和LG12), 19个lgg的平均Spearman为0.93(图1)。S2;表格S3).结果表明,19个LGs与物理图谱具有高度的遗传共线性。
浆果颜色的表型分析
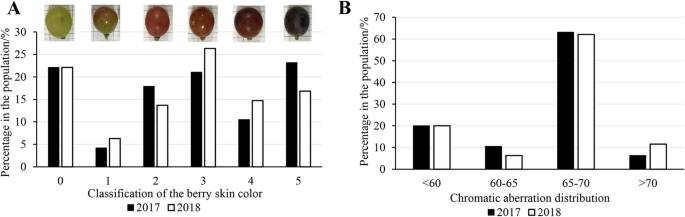
在2017年和2018年,群体的浆果颜色表现出明显的性状分离,从黄绿色到紫黑色,从0级到5级(图5)。2a)在种群中,21个黄绿色系的后代非常稳定。除了极端的着色类型,黄绿色和紫黑色(0级和5级),中间的着色类型(1-4级)约占人口的60%(图。2a). 2017 - 2018年颜色等级皮尔逊相关系数为0.916(表1)2).
此外,还用色度计评价了种群的颜色。这是一种量化葡萄莓果皮颜色的方法。在人群中,2017年色度值为52.37 ~ 71.59,2018年为52.16 ~ 74.33。黄绿色系的色度值均在60以下,紫黑色系的色度值均在70左右。大多数后代的色度值在65 ~ 70之间,占种群的60%以上(图2)。2b). 2017 - 2018年色差皮尔逊相关系数为0.911(表2).
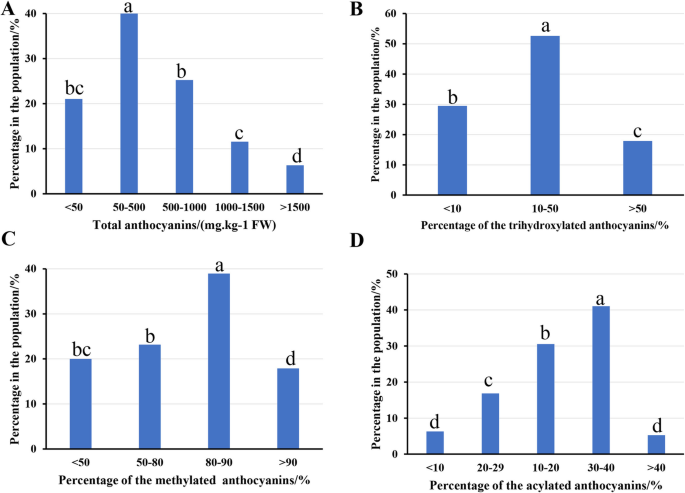
为更好地评价果实颜色性状,采用超高效液相色谱-质谱联用法测定了群体果实皮中花青素的组成和含量。果实皮中总花青素含量在1.43 ~ 1869.99 mg/kg (FW)之间。大多数后代的总花青素含量在50 mg/kg (FW)到1000 mg/kg (FW)之间,占种群总数的65%以上(图2)。3.a).关于花青素成分,种群内浆果皮中共检测到12种花青素(表1)S4).在这项研究中,在群体中的浆果皮肤中检测到双羟基(花青素基和芍药苷基)和三羟基(飞豆苷基、芍药苷基和茉莉苷基)花青素。虽然三羟基化花青素在所有后代中所占比例均小于50%,但也表现出明显的分离。在超过50%的后代中,三羟基化花青素占花青素的10 - 50%(图。3.b).花青素的甲基化和酰基化极大地丰富了葡萄花青素的种类。芍药苷基花青素是在芍药苷基花青素甲基化的基础上形成的,芍药苷基花青素和茉莉苷基花青素是在飞蛾草苷基花青素甲基化的基础上形成的。在该群体中,甲基化花青素占花青素的很大比例,在80%的后代中,甲基化花青素占花青素的50%以上。此外,在超过一半的后代中,甲基化花青素占花青素的80%以上(图5)。3.c).在后代中也检测到酰基化花青素。然而,酰基化花青素只存在于不到50%的后代中,这些花青素大部分分布在10 - 40%的后代中(图4)。3.d)。
QTL分析
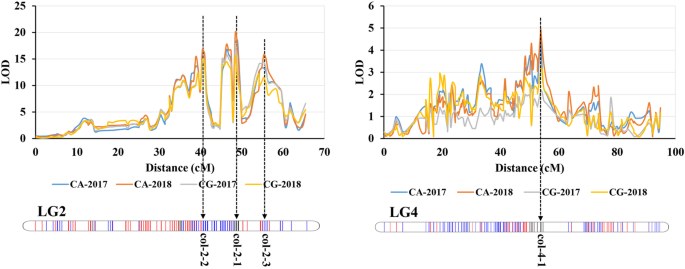
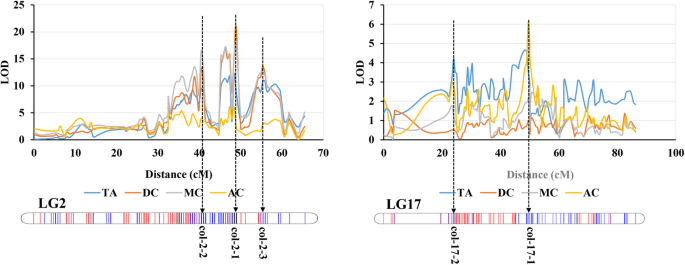
根据高密度遗传图谱,确定了与浆果颜色性状相关的qtl。在颜色等级(CG)和色差(CA)方面,识别出4个在2017年和2018年一致的位点(图1)。4).在这些位点中,基于CG和CA的表型,在Chr2上鉴定出3个位点(col-2-1、col-2-2和col-2-3),其中col-2-1位点解释了CA 62.5%的表型变异,2018年LOD评分最高为20.01(表2-2)3.).这显然是莓色性状的一个主要QTL。此外,在Chr4上检测到一个位点col-4-1,解释了22.2和19%的CA表型变异,2017年和2018年LOD得分分别为4.8和4.31(表4)3.).
葡萄果实的颜色与果皮中的花青素含量和成分密切相关。利用总花青素(TA)的表型和三羟基化花青素(DC)、甲基化花青素(MC)和酰基化花青素(AC)的比例进行QTL定位。这一结果与CG和CA的结果一致,确定了4种表型的主要QTL col-2-1。在Chr2上,根据TA、DC和MC的表型也鉴定出了col-2-2和col-2-3位点(图1)。5;表格4).此外,基于TA和AC,在Chr17上还鉴定出了另外两个位点(col-17-1和col-17-2)。其中,col-17-1位点与TA和AC均相关,而col-17-2位点仅与TA相关(图1)。5;表格4).此外,基于这四种表型,在Chr4上鉴定出两个位点(col-4-1和col-4-2),在Chr6上鉴定出一个位点(col-6-1),在Chr11上鉴定出两个位点(col-11-1和col-11-2)。S3;表格4).
QTL区基因表达分析及候选基因选择
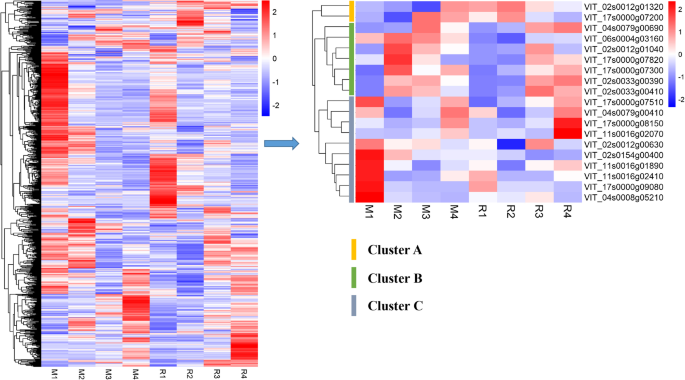
根据葡萄参考基因组(PN40024 assembly 12X)的注释数据,在上述QTL区域共鉴定出1056个基因。根据亲本“红地球”和“汉堡麝香猫”在4个不同浆果发育阶段的转录组数据分析了这些基因的表达。RNA-Seq的clean数据已提交到NCBI的SRA数据库(Accession ID: PRJNA627817)。qRT-PCR分析结果显示,葡萄莓果皮中与花青素积累相关的20个基因的表达模式与RNA-Seq的结果高度一致,说明RNA-Seq的数据是可靠的(图1)。S4).在上述QTL区中,有748个基因在亲本莓皮中表达。这些基因的表达水平和注释信息见表S5.根据表达模式分析和注释信息,共筛选出19个候选基因(图5)。6;表格5).两个MYB基因(MYBA1而且MYBA2)位于主要基因座col-2-1。此外,在col2 -2位点有4个基因,col17 -1位点有6个基因,col4 -1位点有2个基因,col4 -2位点有1个基因,col6 -1位点有1个基因,col11 -2位点有3个基因被鉴定为可能与葡萄莓皮调控相关的候选基因(表2)5).这19个基因表现为3种表达模式(聚类A、聚类B和聚类C),这些候选基因大多以聚类B和聚类C的模式表达(图1)。6).随着浆果的发育,B簇基因的表达水平先上升后下降。而C簇基因的表达量则先降低后升高。
讨论
由于果实颜色是葡萄的重要性状,因此果实颜色的调控机制一直是研究热点。葡萄果实的颜色与果皮中的花青素含量和成分密切相关[1].葡萄果实花青素的生物合成主要受chr 2上的一个颜色位点的调控。的基因型MYBA1而且MYBA2该颜色位点的基因与葡萄浆果的颜色密切相关[9,10,11,12,13].从白葡萄和彩色葡萄的角度来看,这更多的是一种品质特征。两者的突变MYBA1而且MYBA2基因导致了白皮葡萄,完全支持了这一观点[11,12].然而,彩色葡萄的浆果颜色从最浅的粉色到最深的紫黑色不等。葡萄浆果着色的连续分布(图。2)和花青素含量(图。3.A)是数量性状的典型特征。因此,根据这个颜色轨迹很难完全解释葡萄的分色现象。
在我们的研究中,主要的QTL col-2-1含有MYBA在第2号染色体上检测到所有与浆果颜色相关的表型的基因簇,解释了26 - 63.6%的表型方差。这与之前的研究一致。这也证实了我们QTL定位的可靠性。此外,在与莓皮花青素含量和组成有关的Chr2、Chr4、Chr6、Chr11和Chr17上鉴定出一系列影响较小的qtl(表43.而且4).为了更好地解释葡萄果实颜色调节机制,近年来有一些研究对葡萄果实颜色进行了QTL定位[48,49,50,51,52].然而,由于SSR标记构建的遗传图谱密度较低,以往的研究通常只确定2号染色体上的主要颜色位点。Costantini等人[53]构建了基于SSR标记和有限SNP标记的遗传图谱,对葡萄颜色进行QTL定位。SNP标记的使用大大增加了遗传图谱的密度,提高了QTL定位的精度。因此,在Costantini等人的研究中,除了LG2上的主要QTL外,还在其他LGs上发现了多个其他QTL。[53].在我们的研究中,基于WGS开发的大量SNP标记构建了一个非常高密度的遗传图谱(图1)。1;表格1).这为精细QTL定位、识别小QTL和解析紧密链接的QTL提供了可靠的基础[54].
除了良好的遗传图谱外,性状的准确评价也是QTL定位的关键因素。葡萄浆果的颜色是一个复杂的性状。为了更好地评价果实颜色性状,本研究采用了多种方法,包括用精确色度计进行主观评价等级和用超高效液相色谱-质谱法检测花色苷含量和组成。因此,根据浆果颜色的不同表型描述进行QTL定位。2017 - 2018年CG和CA的Pearson相关系数分别为0.916和0.911(表2)2),分别。这表明葡萄果实颜色是一个相对稳定的性状,遗传因素在其调控中起主要作用。
对于主观浆果CG,只在LG2上检测到QTL,包括一个主QTL col-2-1和两个其他QTL col-2-2和col-2-3。在主要QTL col-2-1中MYBA1(VIT_02s0033g00410)和MYBA2(VIT_02s0033g00390)基因在该位点被鉴定,该基因在花青素合成调控中发挥重要作用[9,10,11,12].毫无疑问MYBA1而且MYBA2是调节葡萄果实颜色的主要基因。在QTL col-2-2上,有4个转录因子基因在亲本中表达量较高,其中1个基因在亲本中表达量较高肝(VIT_02s0154g00400)MYB(VIT_02s0012g00630)南汽(VIT_02s0012g01040)和一个bHLH(VIT_02s0012g01320)基因(表5).毫无疑问,一系列MYB和bHLH转录因子已被证实在颜色调节中发挥重要作用[15,16,22,24,25,26,27].该位点的候选MYB和bHLH转录因子也可能参与颜色调控。一项研究表明,DELLA蛋白参与了植物花青素合成的调控拟南芥[20.].作为DELLA蛋白的一个成员,候选基因肝本研究选取的可能参与调控葡萄花青素积累。NAC tf已被证明参与了血橙和血桃花青素合成的调控[55,56].在我们的研究中,被注释为NAC转录因子的候选基因可能在葡萄中具有类似的功能。除了LG2上的这三个QTL外,LG4上的另一个QTL col-4-1被鉴定为CA(表4)3.).在这个位点选择了两个候选基因,MYB(VIT_04s0079g00410)和销售税(VIT_04s0079g00690)。的销售税该基因在亲本中表达量非常高,被鉴定为在葡萄花青素运输中发挥重要作用[57].遗憾的是,在QTL col-2-3中没有找到合适的基因。
葡萄浆果的颜色是由果皮中的花青素组成和含量决定的[1].因此,为了更系统地评价果实颜色性状,利用uls - ms对子代花青素组成和含量进行了检测。然后,从花青素含量和组成的角度进行QTL定位。有趣的是,LG2上的主要QTL被确定为所有这些表型,LOD评分从6.13到20.62(表4).这表明该主要QTL不仅影响花青素含量,而且调控花青素的组成。这一结果与以往的研究一致[52,53].Azuma等人。[52]进行QTL分析,结果表明LG2上的颜色位点是花青素三/二羟基化和甲基化/非甲基化比例的主要QTL。此外,他们还发现在LG1上有一个QTL含有an花青素O-methyltransferase(AOMT)基因在甲基化花青素的合成中起着重要作用。然而,虽然我们在LG2上检测到了甲基化花青素比例的主要颜色位点,但在LG1上没有检测到QTL。然而,如前所述,QTL col-4-1被鉴定为甲基化和三羟基化花青素的比例,可能与花青素组成的调节有关。此外,通过QTL定位,检测各种花色苷在LG2上的主要QTL [53].对于酰基化花青素比例,在LG17上检测到极显著的QTL col-17-1, LOD评分为6.11,表型方差可解释率为25.9%。TA也检测到该QTL。F3'H H+-ATPase和几个tf从该QTL中选择(表5).F3'H是花青素合成途径中的一种重要酶,其表达对花青素组成有重要影响[2,3.,58].花青素在液泡中积累,液泡中的pH值对花青素的稳定性和显色有重要影响。H+- atp酶在控制液泡pH和花青素转运中起重要作用[25].总的来说,除了LG2上的主色QTL外,还检测到多个花青素含量和组成的QTL。从这些qtl中筛选出一系列候选基因。增加遗传群体的规模可以有效提高基因组片段的交换率,从而提高QTL定位的精度[59,60].在我们的研究中,用于QTL定位的F1群体相对较少。在未来的研究中,我们可以通过增加种群的规模来进一步提高QTL作图的精度。
结论
浆果颜色是葡萄和葡萄酒的重要性状,进一步研究葡萄的着色机制具有重要意义。本研究基于葡萄莓色高密度遗传图谱进行QTL定位。此外,主要QTL col-2-1对LG2含有MYBA发现多个与浆果颜色相关的qtl。其中,LG2上的另一个QTL col-2-2和LG17上的另一个QTL col-17-1与花青素含量和组成具有非常显著的相关性。这有力地说明葡萄果实颜色是一个由多个基因座控制的数量性状。综合基因注释和RNA-seq数据,从上述QTL区域中选择了几个新的候选基因。虽然这些新的候选基因的功能还有待进一步验证,但这些结果对于葡萄莓色调控机制的研究具有重要意义。
方法
植物材料
诉酿酒用葡萄简历。利用5个SSR标记(VVMD27、VVMD28、Vchr3a、VMC1C10、VrZAG67)鉴定的“红地球”和“汉堡马斯卡”及其95个杂交后代。植株生长在山西省农业科学院果树研究所(37°23ˊN, 112°32ˊE)的田间。葡萄园采用了南北方向的排。当葡萄果实成熟时,我们评估了果实的颜色,并检测了果实皮中的花青素。采用观察种子颜色和测定可溶性固形物的方法来判断果实的成熟。当种子完全变成褐色,可溶性固形物平均达到18或更多,并且在一周内没有增加时,浆果就被认为处于成熟阶段。
在4个不同果实发育阶段采集亲本果实皮:变型前(40 DAF)、变型时(80 DAF)、果实成熟前(100 DAF)和果实成熟期间(120 DAF)。在每个阶段,3-5簇“红地球”和“马斯喀特汉堡”,每簇收集20个浆果。收集了40-50个浆果的果皮。在“红地球”和“汉堡麝香猫”的每个阶段进行3个生物重复。
DNA提取、文库构建和测序
用基因组DNA提取试剂盒(天根生物技术,北京,中国)从亲本和子代的幼叶中提取基因组DNA。用琼脂糖凝胶检测DNA质量。使用酶标记仪器(Multiskan FC, Thermo Scientific™,Waltham, MA, USA)测量DNA浓度。提取DNA后,用Covaris进行基因组DNA片段,然后进行纯化和修复。然后,这些片段被添加到Illumina适配器中。用聚合酶链反应(PCR)对片段进行扩增。在进一步的质量控制和纯化后,文库使用Hiseq X Ten平台(Illumina, San Diego, CA, USA),由华大基因(深圳)有限公司进行150碱基对端测序。亲本和子代的测序深度分别为30X和10X。
基因分型与基因图谱构建
以葡萄PN40024组装体12X作为参考基因组[39].使用软件BWA v0.7.15将清洁reads与参考基因组进行比对。采用GATK 3.7进行SNP检测,使用GATK 3.7的selectvariables和variantfiltering工具对SNP标记进行过滤(过滤参数:QD < 2.0 / FS > 60.0 / MQ < / MQRankSum < 40.0-12.5 / ReadPosRankSum < 8.0)。对获得的群体SNP进行进一步过滤,去除深度(DP)小于10、质量值(GQ)小于40、缺失率大于20%、非二态SNP的reads,获得高质量的群体SNP标记。利用LepMap3构建基于SNP标记的遗传图谱。利用LepMap3的Filtering2功能对部分分离标记进行筛选。利用LepMap3的separatechrosomes2功能进行连锁组聚类,并设置LOD评分为‘7’作为判断位点是否连锁的阈值。利用SVG绘制共线图,显示遗传图谱与物理图谱的共线关系。还计算了Spearman相关系数,以评估遗传和物理图谱之间的共线性。
葡萄浆果颜色的评价
根据浆果的颜色,将种群分为0 ~ 5级。0级表示白色(黄绿色)颜色类型,5级表示紫黑色颜色类型。从0级到5级表示浆果颜色从浅到深的变化。此外,还使用色度计(CR-410,柯尼卡美能达相机,Co, Ozaka, Japan)来评估浆果皮的颜色。
花青素的提取与测定
葡萄莓皮中花青素的提取方法参考He等。7孙等人。[61,62].UPLC-MS (Waters, Milford, MA, USA)用于测定花青素的组成和含量,方法参考Sun等。[61].
QTL分析
采用MapQTL 6.0计算标记共分离和QTL位置。表型、图谱和位点信息导入MapQTL 6.0。采用多重QTL定位(MOM)方法进行QTL分析。
RNA序列
使用天根植物RNA提取试剂盒(天根生物技术,北京,中国)从葡萄莓皮中提取总RNA。然后,使用酶标记仪器(Multiskan FC, Thermo Scientific™,Waltham, MA, USA)测量RNA浓度。然后,使用华大基因(华大基因,深圳,中国)BGISEQ-500平台进行RNA测序。
存在分析
为了验证RNA-seq的结果,我们选择了20个与花青素积累相关的基因,并设计了引物(TableS6)进行qRT-PCR。采用Roche LightCycler480实时检测系统(Roche)进行qRT-PCR。的肌动蛋白作为参考基因计算靶基因相对表达量2——ΔΔCT方法(63].
统计分析
采用SPSS软件(SPSS 22.0, Chicago, IL, USA)进行统计分析。用于比较分析的所有实验数据均基于三个生物重复。
数据和材料的可用性
在这项研究中产生或分析的所有数据都包含在这篇发表的文章及其补充信息文件中。WGS和转录组数据可从NCBI的SRA数据库中获取(登录ID: PRJNA589353, PRJNA627817)。
缩写
- 交流:
-
Acylated花青素
- CA:
-
色差
- 重心:
-
颜色
- 装备:
-
染色体
- DC:
-
Trihydroxylated花青素
- LGs:
-
连杆组
- 主持人:
-
甲基化花青素
- QTL:
-
数量性状位点
- 单核苷酸多态性:
-
单核苷酸多态性
- 助教:
-
总花青素
- TFs:
-
转录因子
- UFGT:
-
UDP-glucose:花青素类黄酮葡糖基转移酶
- WGS:
-
全基因组重测序
参考文献
- 1.
Castellarin SD, Di Gaspero G, Marconi R, Nonis A, Peterlunger E, Paillard S,等。红色葡萄的颜色变化(葡萄L.):基因组组织,表达类黄酮3 ' -羟化酶,类黄酮3 ',5 ' -羟化酶浆果皮肤中基于红花青素- /蓝飞燕草素的花青素的基因和相关代谢物分析。BMC基因组学。2006;7:12。
- 2.
黄文华,黄文华,黄文华。葡萄类黄酮和二苯乙烯合成相关结构基因的克隆与分子分析(英文版)葡萄l .)。植物分子生物学1994;24:743-55。
- 3.
R2R3 MYB转录因子:葡萄类黄酮生物合成途径的关键调控因子。原生质。2012;249:109-18。
- 4.
黄酮类化合物的运输机制:如何去,和谁去。植物科学进展2015;20:576-85。
- 5.
黄酮类化合物:生物化学通路的调节和进化的彩色模型。植物科学进展2005;10:236-42。
- 6.
田亮,庞宇,狄克逊RA。原花青素类黄酮的生物合成与基因工程。Phytochem启7:445 2008;65年。
- 7.
何峰,穆林,闫刚,梁宁,潘强,王杰,等。彩色葡萄花青素的生物合成及其调控。分子。2010;15:9057 - 91。
- 8.
欧文斯CL。在葡萄色素。作者:陈c,编辑。水果和蔬菜中的色素。纽约:施普林格;2015.p . 189 - 204。
- 9.
小林林,后藤山本,弘chika H.葡萄皮肤颜色逆转录转座子诱导突变。科学。2004;304:982。
- 10.
小林S,后藤山本N,弘千hVvmybA1葡萄花青素产生相关基因的表达葡萄)肤色突变体。科学通报2005;74:196-203。
- 11.
Walker AR, Lee E, Bogs J, McDavid DAJ, Thomas MR, Robinson SP.白葡萄是通过两个相似和相邻的调控基因突变产生的。植物j . 2007; 49:772 - 85。
- 12.
这个P, Lacombe T, Cadle-Davidson M, Owens CL。酿酒葡萄(葡萄L.)颜色与驯化基因的等位基因变异有关VvmybA1.应用理论学报2007;114:723-30。
- 13.
竹间A,宇藤Y,佐藤A,三谷N,河野A,班Y,等。颜色位点上的单倍型组成是影响皮肤颜色变异的主要遗传决定因素葡萄属×labruscana葡萄。应用理论。2011;122:1427-38。
- 14.
Carrasco D, De Lorenzis G, Maghradze D, Revilla E, Bellido A, Failla O等。等位基因变异VvMYBA1而且VvMYBA2天然葡萄群体的驯化基因(葡萄无性系种群。结果表明).植物学报2015;301:1613-24。
- 15.
Dubos C, Le Gourrierec J, Baudry A, Huep G, Lanet E, Debeaujon I,等。MYBL2是一种新的类黄酮生物合成调节剂拟南芥.植物j . 2008; 2008(55): 940 - 53。
- 16.
AtMYBL2是一种具有单一MYB结构域的蛋白质,它在花青素生物合成中起负调控作用拟南芥.植物j . 2008; 55:954 - 67。
- 17.
齐涛,宋松,任强,吴东,黄红,陈勇,等。茉莉酸- zimi结构域蛋白与WD-repeat/bHLH/MYB复合物相互作用,调节茉莉酸介导的花青素积累和毛状体启动拟南芥.植物细胞。2011;23:1795 - 814。
- 18.
郭杰,felppes FF,刘超,Weigel D,王杰。植物花青素合成的负调控拟南芥mir156靶向的SPL转录因子。植物细胞。2011;23:1512-22。
- 19.
Nguyen NH, Jeong CY, Kang G, Yoo S, Hong S, Lee h。HY5作用的MYBD通过抑制MYBL2增加花青素的积累拟南芥.植物j . 2015; 84:1192 - 205。
- 20.
谢艳,谭宏,马智,黄杰。DELLA蛋白通过隔离MYB/bHLH/WD40复合体的MYBL2和JAZ抑制子促进花青素的生物合成拟南芥.摩尔。2016;9:711-21。
- 21.
王颖,王颖,宋卓,张华。microRNA858a和HY5对MYBL2的抑制导致了花青素生物合成通路的激活拟南芥.摩尔。2016;9:1395 - 405。
- 22.
张浩,Koes R,尚浩,付铮,王磊,董旭,等。三种新的花青素的鉴定与功能分析R2R3-MYB基因在佩妮.工厂直接。2019;3:e114。
- 23.
坂Y,本田C,畑山Y,五十岚M,别所H,森口tMYB转录因子基因,是苹果皮肤红色发育的关键调控因子。植物细胞物理学报2007;48:958-70。
- 24.
安旭,田勇,陈凯,刘旭,刘东,谢曦,等。MdMYB9和MdMYB11参与调控ja诱导的苹果花青素和原花青素的生物合成。植物细胞物理学报2015;56:650-62。
- 25.
胡东,孙聪,马青,尤聪,程亮,郝颖。MdMYB1通过直接促进苹果花青素和苹果酸盐在液泡中的转运调节其积累。植物杂志。2016;170:1315-30。
- 26.
谢曦,李松,张锐,赵杰,陈勇,赵强,等。bHLH转录因子MdbHLH3促进苹果花青素积累和果实着色,以应对低温。植物细胞环境学报2012;35:1884-97。
- 27.
安杰,李红,宋丽,苏琳,刘旭,尤聪,等。苹果bHLH转录因子MdMYC2的分子克隆及功能表征。植物生理生物化学,2016;108:24-31。
- 28.
安鑫,田勇,陈凯,王鑫,郝颖。苹果WD40蛋白MdTTG1与bHLH蛋白互作,而不与MYB蛋白互作,调控花青素积累。植物生理学报,2012;169:710-7。
- 29.
Cavallini E, Matus JT, Finezzo L, Zenoni S, Loyola R, Guzzo F,等。在葡萄中,苯丙类途径由一组R2R3-MYB C2阻遏子控制在不同的分支。植物杂志。2015;167:1448 - 70。
- 30.
Pérez-Díaz JR, Pérez-Díaz J, Madrid-Espinoza J, González-Villanueva E, Moreno Y, Ruiz-Lara s葡萄R2R3-MYB转录因子家族新成员抑制转基因烟草花中花青素的积累。植物分子生物学,2016;90:63-76。
- 31.
Tirumalai V, Swetha C, Nair A, Pandit A, Shivaprasad PV。miR828和miR858调控VvMYB114促进葡萄花青素和黄酮醇积累。J Exp Bot. 2019; 70:4775-92。
- 32.
Williams JG, Kubelik AR, Livak KJ, Rafalski JA, Tingey SV。用任意引物扩增的DNA多态性是有用的遗传标记。核酸Res. 1990; 18:6531-5。
- 33.
Vos P, Hogers R, Bleeker M, Reijans M, van de Lee T, Hornes M,等。AFLP:一种新的DNA指纹识别技术。核酸Res. 1995; 23:4407-14。
- 34.
Adam-Blondon AF, Roux C, Claux D, Butterlin G, Merdinoglu D, This p葡萄基因组:葡萄遗传的工具。《应用科学》2004;109:1017-27。
- 35.
Doligez A, Adam-Blondon AF, Cipriani G, Di Gaspero G, Laucou V, Merdinoglu D,等。基于5个定位居群的葡萄SSR综合图谱。应用科学,2006;113:369-82。
- 36.
Di Gaspero G, Cipriani G, Adam-Blondon AF, Testolin R.显示420个微卫星标记和82个r基因候选标记染色体位置的葡萄连锁图谱。应用理论学报2007;114:1249-63。
- 37.
Salmaso M, Malacarne G, Troggio M, Faes G, Stefanini M, Grando MS,等。一个小道消息(葡萄L.)整合139个表达基因位置的遗传图谱。应用科学学报2008;116:1129-43。
- 38.
Carreño I, Cabezas JA, Martínez-Mora C, Arroyo-García R, Cenis JL, Martínez-Zapater JM,等。鲜食葡萄果实硬度的定量遗传分析(葡萄l .)。树Genet基因组2015;11:818。
- 39.
Jaillon O, Aury JM, Noel B, Policriti A, Clepet C, Casagrande A,等。葡萄基因组序列提示主要被子植物门的祖先六倍化。大自然。2007;449:463-7。
- 40.
Varshney RK, Nayak SN, May GD, Jackson SA。下一代测序技术及其对作物遗传育种的影响。生物科技趋势》。2009;27:522-30。
- 41.
王宁,方琳,辛红,王玲,李松。利用下一代限制性位点相关DNA测序构建葡萄高密度遗传图谱。植物生物学杂志,2012;12:148。
- 42.
陈娟,王楠,方丽,梁铮,李松,吴斌。葡萄果实糖、酸高密度遗传图谱的构建及qtl定位。BMC Plant Biol. 2015;15:28。
- 43.
苏王J, K,郭Y,邢H,赵Y, Z,等。利用特异性长度扩增片段(SLAF)测序构建葡萄高密度遗传图谱。《公共科学图书馆•综合》。2017;12:e181728。
- 44.
Barba P, Loughner R, Wentworth K, Nyrop JP, Loeb GM, Reisch BI。一个与叶表毛性状相关的QTL对掠食性螨的数量有重要影响Typhlodromus pyri在杂交葡萄种群中。Hortic杂志2019;6:87。
- 45.
傅萍,田强,赖刚,李锐,宋松,陆杰葡萄属amurensis“双港”的小道消息。Hortic杂志2019;6:67。
- 46.
陈磊,杨松,陈丽娟,杨淑娟,Hyma KE, Cadle-Davidson L, Hwang C.小麦霜霉病抗性高密度连锁图谱的构建及QTL检测葡萄-派生的“诺顿”。《应用科学》2019;132:137-47。
- 47.
林红,冷红,郭燕,近藤松,赵莹,石刚,等。种间葡萄霜霉病抗性的qtl和候选基因诉酿酒用葡萄l×诉amurensisRupr)穿越。Sci Hortic。2019;244:200-7。
- 48.
Fournier-Level A, Le Cunff L, Gomez C, Doligez A, Ageorges A, Roux C,等。葡萄花青素变异的数量遗传基础(葡萄l . ssp。漂白亚麻纤维卷浆果:数量性状位点到数量性状核苷酸的集成研究。遗传学。2009;183:1127-39。
- 49.
葡萄花青素甲基化水平的遗传机制(葡萄l .)。植物生物学杂志,2011;11:179。
- 50.
黄勇,Bertrand Y, Guiraud J, Vialet S, Launay A, Cheynier V,等。葡萄表达QTL定位——葡萄肤色的遗传决定论。植物科学。2013;207:18-24。
- 51.
坂Y,三谷N,林林T,佐藤A, Azuma A,河野A,等。种间杂交葡萄花青素含量的数量性状位点探索(葡萄属labruscana×葡萄).Euphytica。2014;198:101-14。
- 52.
高间A,班Y,佐藤A,河野A,白石M,屋久治H,等。颜色位点上的MYB二倍型影响葡萄莓皮中三/二羟基化和甲基化/非甲基化花青素的比例。树Genet genomics 2015;11:31。
- 53.
Costantini L, Malacarne G, Lorenzi S, Troggio M, Mattivi F, Moser C,等。葡萄颜色精细调控的新候选基因。J Exp Bot. 2015; 66:4427-40。
- 54.
Stange M, Utz HF, Schrag TA, Melchinger AE, Würschum T.高密度基因分型:QTL定位的过度杀伤?从玉米和模拟的案例研究中得到的教训。《应用科学学报》2013;126:2563-74。
- 55.
Crifò T, Petrone G, Lo Cicero L, Lo Piero AR.短冷藏提高血橙中花青素含量和与其生物合成相关的转录本水平。农业食品化学,2012;60:476-81。
- 56.
周浩,林旺K,王浩,顾超,Dare AP, Espley RV,等。果肉桃的分子遗传学揭示了NAC转录因子对花青素合成的激活作用。植物j . 2015; 82:105-21。
- 57.
张伟,张文华,张文华。色素中谷胱甘肽S-转移酶(GSTs)的纯化、分子克隆及鉴定葡萄l细胞悬浮培养物作为假定的花青素运输蛋白。J Exp Bot 2008; 59:3621-34。
- 58.
黄酮3′-羟化酶和黄酮3′,5′-羟化酶基因在葡萄中表达及黄酮组成的研究(英文)葡萄).植物科学。2006;170:61-9。
- 59.
MI Vales, Schon CC, Capettini F, Chen XM, Corey AE, Mather DE,等。群体规模对大麦条锈病抗性QTL估计的影响。应用科学,2005;111:1260-70。
- 60.
D厅,Hallingback HR, Wu HX。林木性状QTL效应数量和规模的估算。树Genet基因组。2016;12:6。
- 61.
孙丽,范鑫,张颖,蒋娟,孙浩,刘晨。黑、白棘葡萄果实中花青素合成和转运相关基因的转录组分析(葡萄属davidii).Hereditas。2016;153:17。
- 62.
孙丽,李珊,唐鑫,范鑫,张艳,蒋娟,刘娟,刘晨。转录组分析揭示了葡萄“红地球”光诱导花青素积累的相关基因(诉酿酒用葡萄l .)。基因。2020;728:144284。
- 63.
Livak KJ, Schmittgen TD。相关基因表达数据的实时定量PCR分析和2-△△CT方法。方法。2001;25:402-8。
确认
我们感谢华大基因(中国武汉)在WGS和转录组分析方面的服务。
资金
感谢国家重点研发计划项目(2019YFD1001401)、国家自然科学基金项目(31772265)、中国农业科学研究系统(car -29)和农业科技创新计划项目(CAAS-ASTIP-ZFRI)对本研究的支持。资助者在研究的设计、收集、分析和数据的解释以及手稿的撰写中没有任何作用。
作者信息
从属关系
贡献
CL、JL和LS构思并设计了该研究。XT构造了总体。LS、SL和JJ收集叶子和浆果皮,提取DNA、RNA和花青素。XF帮助进行表型实验。YZ协助基因图谱构建和QTL定位。LS进行了数据分析并准备了稿件。CL和JL帮助修改了手稿。所有作者阅读并批准了最终稿件。
相应的作者
道德声明
伦理批准和同意参与
不适用。
同意出版
不适用。
相互竞争的利益
作者声明他们与这项工作没有利益冲突。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构附属的管辖权要求保持中立。
补充信息
附加文件1:图S1。
花青素生物合成途径示意图。
附加文件2:图S2。
遗传图谱与物理图谱的共线性分析。
附加文件3:图S3。
LG4、LG6和LG11上总花青素(TA)和三羟基化花青素(DC)、甲基化花青素(MC)和酰基化花青素(AC)的QTL定位。
附加文件4:图S4。
RNA-Seq数据的qRT-PCR验证。直方图表示RNA-Seq评估的表达水平,数据报告为3个生物重复的均值±SE(左轴)。折线图表示qRT-PCR评估的表达倍数变化,数据以3个重复的均值±SE表示(右轴)。
附加文件5:表S1。
测序数据的统计和与参考基因组的比对。
附加文件6:表S2。
亲本遗传图谱中标记的分布。
附加文件7:表S3。
各LG遗传图谱与物理图谱之间的Spearman相关系数。
补充文件8:表S4。
质谱和色谱信息检测的花青素群体。
附加文件9:表S5。
QTL区基因表达水平及注释。
附加文件10:表S6。
引物的存在。
权利和权限
开放获取本文遵循创作共用署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),该协议允许在任何媒体或格式中使用、分享、改编、分发和复制,只要您给予原作者和来源适当的署名,提供创作共用许可协议的链接,并说明是否有更改。本文中的图片或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果材料不包含在文章的创作共用许可中,并且您的预期用途不被法律法规允许或超出了允许的用途,您将需要直接从版权所有者那里获得许可。欲查看此许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献放弃书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信用额度中另有说明。
关于这篇文章
引用这篇文章
孙丽娟,李舒,蒋俊。et al。基于高密度遗传图谱,确定了葡萄莓色性状相关的新数量性状位点和候选基因。BMC植物杂志20.302(2020)。https://doi.org/10.1186/s12870-020-02517-x
收到了:
接受:
发表:
关键字
- 葡萄
- 浆果颜色
- 花青素
- 高密度遗传图谱
- 数量性状位点(QTL)
- 候选基因