抽象的
背景
来自桦树的三萜(桦木属platyphyllasuk。)发挥抗肿瘤和抗艾滋病毒活动。由于植物次级代谢途径的复杂性,植物中的三萜化合物并不总是通过单个基因确定;它们可以通过聚乙烯定量性状来控制。与三萜类化合物相关的次生代谢涉及关键生物合成酶的组织特异性和定位。萜烯合成受光,激素和其他信号的影响,以及上游转录因子调节。
结果
在此,我们鉴定并表征了两个桦树MYB转录因子(TFs),它们调节三萜的生物合成。BpMYB21和BpMYB61是R2R3转录因子,它们分别正向和负向调节对茉莉酸甲酯(MeJA)和水杨酸(SA)的反应。BpMYB21和BpMYB61在哈尔滨市7、8月份叶片和茎中的表达高于根。脱落酸(ABA)、MeJA、SA和赤霉素(GAs)上调BpMYB21的表达。ABA、MeJA和SA降低了BpMYB61在叶片中的表达,降低了BpMYB21在茎中的表达,而GAs、乙烯和损伤则增加了BpMYB61的表达。BpMYB21定位于细胞核,而BpMYB61定位于细胞膜和细胞核。BpMYB21 (1302 bp)和BpMYB61 (850 bp)的启动子均有活性。BpMYB21和BpMYB61连接到pYES3中,导入无外源基因酵母株AnchorINVScl、桦树SS转基因酵母株INVScl-pYES2-SSAnchorAnchor和桦树SE转基因酵母株INVScl-pYES2-SE,含SS和MYB21基因的转基因酵母株AnchorINVScl-pYES-MYB21-SS和含MYB61基因的转基因酵母株INVScl-pYES3-MYB61中角鲨烯含量最高。BpMYB21转基因桦树关键三萜合成基因上调,BpMYB61转基因桦树锚基磷酸酯(farnesyl焦磷酸合酶)和SS(角烯合酶)上调,而HMGR(3-羟基-3-甲基戊二酰辅酶a还原酶)、BPWAnchor (lupeols合酶)、 SE (squalene epoxidase) and BPY (b-amyrin synthase) were down-regulated. Both BpMYB21 and BpMYB61 specifically activate SE and BPX (cycloartenol synthase synthesis) promoters.
结论
这些发现支持R2R3-MYB基因的进一步功能表征,并照亮了监管作用BPMYB21和BPMYB61在桦木三萜的合成中。
背景
桦木(桦木属platyphyllaSuk。)是中国的重要经济树种,其叶子和树皮包含许多次生代谢物,包括三角形桦木属platyphylla(TBP)具有广泛的药理学效应[1].桦树皮中的三萜与抗艾滋病毒和抑制肿瘤(胶质瘤、黑色素瘤、宫颈癌、乳腺癌、白血病、骨髓瘤)有关,毒性低、疗效高,使它们成为有希望的新药候选[2那3.那4.那5.那6.那7.].
由于二次代谢途径的复杂性,使用传统育种方法改善三萜类化合物的含量非常困难。近年来,植物分子生物学和基因工程有助于操纵植物次生代谢物的新方法。然而,由植物产生的三萜类化通常不是由单个基因确定的,而是通过由多根来控制的定量性状,萜类化合物的次生代谢是组织特异性并且与参与生物合成的关键酶的位置有关。Triterpenes的合成也受光,激素和上游转录因子(TFS)调节[1那8.].因此,与三萜合成相关的TFS的分离和鉴定和三萜代谢的调节对于通过遗传操作改善三萜产量是重要的。
MYB转录因子是植物中最大的转录因子家族之一,具有综合的生物学功能,包括对低温、干旱、盐胁迫、病虫害等非生物胁迫的响应,介导光、激素和信号转导,在植物生长发育中发挥重要作用。和次级代谢调节[9.那10].例如,MYB转录因子可以与基本的螺旋-环-螺旋(bHLH)转录因子形成转录复合物,调节茎的发育和种子的形成拟南芥在茉莉酸(JA)的介导下[11].在植物次生新陈代谢中,MPK4的MYB75的磷酸化促进了花青素的积累答:芥由光介导的[12].在类黄酮的生物合成中,MYB转录因子可以调控类黄酮生物合成相关酶编码基因的表达,从而有效调控类黄酮的合成[13].MYB TFs已被鉴定答:芥、小麦、Fraxinus velutina托尔。,茄属植物lycopersicum(番茄)和其他植物[14].最近,新的活性氧(ROS)-和防御相关的R2R3-MYB基因已在油菜(芸苔栗鸟L.),以及参与红猕猴桃的花青素生物合成的成员(Actinidia chinensis.)已获报道[14那15],但桦树中与三萜相关的R2R3-MYB基因尚未见报道。
茉莉酸甲酯(Meja)是一种重要的植物内源性激素,参与植物黄酮类化合物的生物合成和代谢[16]用作外部信号分子以诱导和激活苯丙烷代谢途径[17].我们实验室的先前研究表明,Meja治疗显着促进了桦树皮和叶片和培养的桦树细胞中的Triterpenes积累[8.].高温和MeJA联合作用对桦树细胞三萜合成的影响要强于单独的MeJA或高温作用[18].水杨酸(SA)不仅在植物压力,疾病和昆虫和微生物感染中发挥着重要作用,还在刺激植物防御系统中产生植物防御荷尔蒙,并且它也是一种重要的信号分子,介导外源诱导剂促进植物中次生代谢产物的合成[19那20.].MeJA和SA对萜类合成的影响可以快速诱导特异性高的生物合成基因的表达[21那22].
三萜类化合物由2,3-氧基喹甲烯合成,各种类型的三萜的前体。键酶3-羟基-3-甲基谷氨酰辅酶(HMGR),法呢酰焦膦酸盐合酶(FPS),Squalene合酶(SS)和Squalene环氧酶(SE)在三萜合成中是必需的[23那24].以前的研究表明,MEJA和SA可以显着诱导桦树细胞中MVA和三萜合成途径中关键基因的表达[8.那25].在本研究中,我们鉴定并表征了两种MYB TFS(BPMYB21和BPMYB61)回应Meja和SA归纳。的启动子SE.(角鲨烯环氧酶)那BPW.(卢普醇合成酶)和BPX.(cycloartenol synthase)在桦树中含有MYB结合位点,受MYB转录因子调控(待发表),因此我们推测这些响应MeJA和SA的MYB转录因子可能在三萜合成中发挥重要作用。根据之前的实验结果,我们进行了克隆BPMYB21和BPMYB61基于我们的桦树MeJA和SA诱导基因转录组数据库。测试TFs对激素和损伤的反应。这部小说BPMYB21该基因在桦树和酵母中表达均能促进三萜的生物合成。本研究结果为进一步表征参与桦木三萜合成的MYB TFs奠定了坚实的基础。
结果
孤立和特征BPMYB21和BPMYB61
在此,我们孤立MYB21和MYB61从我们的桦树转录组数据库中,研究了它们在三萜生物合成中的可能功能。的长篇BPMYB21(((GeneBank ID MF574045,NCBI)和BPMYB61(GeneBank ID KT344120,NCBI)基因被RT-PCR分离。这BPMYB21cDNA序列是1117 bp,含有编码337个氨基酸多肽的1014bp开放阅读框(ORF)(附加文件1).这BPMYB61cDNA序列是1203 bp,含有1203bp ORF编码400个氨基酸的蛋白质(附加文件2).
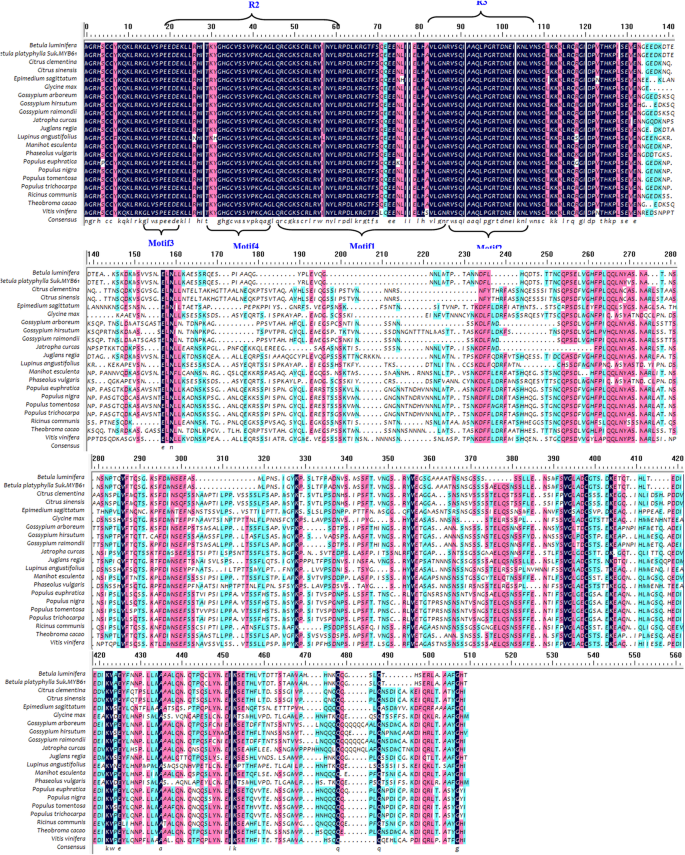
R2R3-MYBS的特征在于R2和R3重复[10[我们的分析证实了R2R3结构域的R域和四个图案的存在,便于与MYB合作伙伴相互作用(图。1那2和3.).
编码的氨基酸序列的多次对准BPMYB21与那些编码的人my获得的其他生物。使用DNAMAN多重对齐工具进行对齐。水平箭头代表R域。垂直箭头表示R2R3域中的图案,便于与MYB合作伙伴的互动。排列的序列来自于juglans regia.MyB30样(XP_018851905.1),葡萄MYB39(XP_002281638.1),胡杨MYB86(XP_011044525.1),Populus Trichocarpa.(XP_006370357.1),烟草myb39(oit30152.1),Nelumbo NuciferaMYB39(XP_010277911.1)和Fragaria VESCA子公司。vesca.气味1样(XP_004293589.1)
编码的氨基酸序列的多次对准BPMYB61与那些编码的人my其他生物的S。使用DNAMAN多重对齐工具进行对齐。排列的序列来自于Betula Luminifera(ACJ38663.1),Populus Trichocarpa.(XP_002320929.1),juglans regia.(XP_018843144.1),胡杨(XP_011040042.1),Populus tomentosa(AIA66961.1),杨树黑质(BAR45573.1),Manihot Esculenta.(oay48816.1),Theobroma可可(XP_007051325.1),葡萄(XP_002281027.1)和陆地棉(XP_016695803.1)
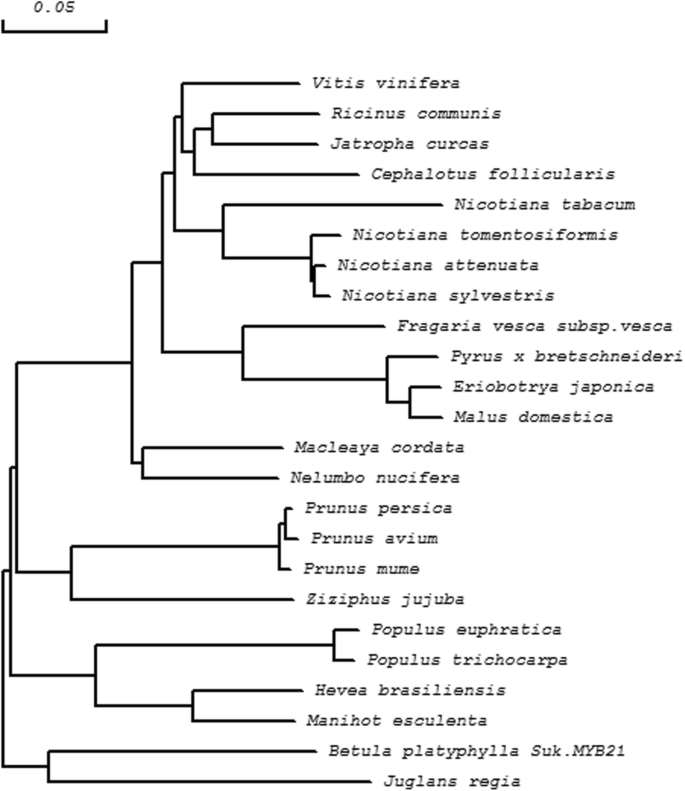
蛋白质的保守结构域BPMYB21和BPMYB61结果表明,BpMYB21包含一个Myb dna结合域和两个sant特异性区域,分别跨越14-61、14-63和16-61氨基酸残基。这BPMYB21基因是R2R3-MYB系列的成员,这个家庭的成员调节各种植物物种中的黄酮类生物合成。使用Protparam在扩展网站上分析BPMyB21蛋白的物理化学性质,揭示了38.04kDa的分子量和6.45的等电点(PI)。不稳定的系数是49.59,暗示它是不稳定的蛋白质(不稳定系数<40表示稳定性)。BPMYB21蛋白的平均亲水性为-0.632,暗示它是亲水的。使用质子的亲水性氨基酸序列分析预测位置164中最强的2.344的疏水值,并且在34(> 0.5时,最强的亲水值 - 2.722(> 0.5表示疏水性,<0.5表示亲水性,并且这些值在这些情况下表示。BPMYB21中的跨膜区域的预测表明,蛋白质的N-末端位于膜外侧,并且有两个跨膜螺旋,跨越残留物138至161,(内部至细胞外向)和残留物146至164(超)细胞内方向)。二次结构预测表明,BPMYB21由α-螺旋(26.41%),延长的股线(11.28%),随机线圈(10.68%)和不规则转弯(51.63%)组成。BPMYB21的氨基酸序列与MYBS含有〜64%的序列同一性juglans regia.那胡杨,葡萄.BpMYB21与其他MYB蛋白的多序列比对如图所示。1和使用Dnaman 8.0软件构建的邻近的系统发育树表明与同源物相关的最强相关性J. Regia.(无花果。2额外的文件3.).
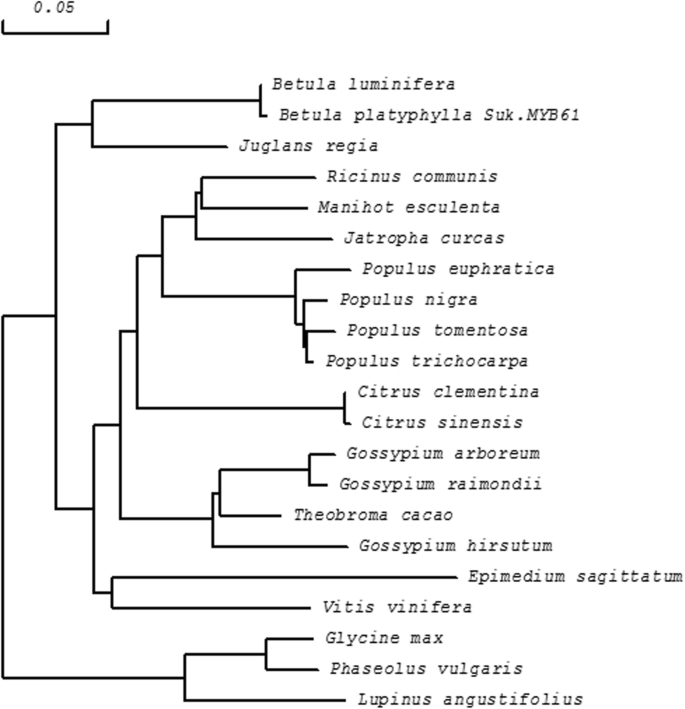
这BPMYB61该基因也是R2R3-MYB家族的成员(图。3.),R2和R3 MYB DNA结合残留物,跨越位置14-61和67-112。使用Protparam在扩展网站上分析BPMyB61的物理化学性质,揭示了44.77kDa的分子量和6.51的PI。不稳定系数为51.11,暗示不稳定的蛋白质。平均亲水性为-0.746,表明亲水性蛋白质。ProtScale预测位置81的最强疏水值2.189,最强的亲水值为-2.967,适用于140。BPMYB61蛋白没有跨膜螺旋。使用SOPMA软件的二次结构预测表明BPMYB61由α-螺旋(44%),β-转(6.00%),延长的股线(8.25%)和随机线圈(41.75%)组成。BPMYB61的氨基酸序列与MYBS的同源性61-97%Populus Euphratica Oliv那juglans regia.那Populus Trichocarpa.,Betula Luminifera.将BpMYB61与其他MYB蛋白进行多序列比对,利用DNAMAN 8.0软件构建相邻连接系统发育树,鉴定出BpMYB61B. Luminifera.作为最近的同源物(图。3.和4.额外的文件3.).
隔离与分析BPMYB21和BPMYB61启动子序列
的启动子序列BPMYB21和BPMYB61用基因组行走法扩增1302 bp和850 bp基因,并用PlantCARE软件进行分析。结果显示了TATA和CAAT盒子的存在。此外,5’-非翻译区(5’utrs)在+ 901 bpBPMYB21启动子,和+ 688 bpBPMYB61启动子(表1和2额外的文件4.).
在BPMYB21启动子,确定了与激素调节有关的三种组分;JA响应元件(CGTCA主题)AT + 673 BP,ABA响应元件(ABRE响应元件(ABRE主题),AT-467和+ 469 BP,以及AT-960 BP的SA响应元件(TCA元素)。此外,还确定了有关与轻度调节相关的若干监管要素BPMYB21启动子,包括GAG、SP1、I-box、GATA和G-box,均与顺式元件的光学响应有关。在+ 108、−858和−324 bp、+ 34 bp、−250 bp和−94 bp处发现6个胚乳表达元件(Skn-1和GCN4基序)。此外,BPMYB21启动子中分别含有+ 179、−462和+ 622 bp的MBS和tc富重复序列元件。MBS可与与干旱诱导相关的MYB转录因子结合,富含tc的重复序列是顺式作用元素,可对不利的环境条件和防御机制作出反应(附加文件)4.).
在BPMYB61启动子,两种厌氧诱导的调节元件(ARES)在+ 282和-443BP中找到,以及位于+ 126,+ 135,+ 251和-270的四个光响应元件(Boxi,G-Box和SP1) bp, seven light response elements (GA, GAG, I-box, TCCC and CHS Unit 1 motifs) located at − 626, + 397,-672, − 551, + 674, + 818 and + 192 bp, a meristem-specific regulatory element (CAT-box) located at − 471 bp, a MYBHv1 binding site (CCAAT-box) located at − 761 bp, a gibberellin (GA) response element (GARE motif) located at + 599 bp, and four endosperm expression elements (GCN4 and Skn-1 motifs) located at + 34, − 250, − 94 and − 88 bp. One MYB binding site involved in drought control is located at + 586 bp, and a corn protein metabolism regulation element (O2 site) is located at + 87 bp. One seed-specific expression regulatory element (RY element) is located at + 329 bp, an SA response element (TCA element) is present at − 395 bp, and a cis-acting element associated with circadian rhythms is located at − 234 bp. BothBPMYB21和BPMYB61启动子序列具有MYB转录因子结合MBS组分和BHLH TF结合位点G盒组分,表明MYB和BHLH TFS之间的相互作用。这些监管元素的存在表明表达BPMYB21和BPMYB61在桦木响应各种植物激素和不利条件。
两者的推动者BPMYB21和BPMYB61拥有启动子活动。GUS染色在烟草和桦木浸润的烟雾中透露了大面积的蓝色,用PBPMYB61渗透,表明茎中强的引发活性,但叶子中的活性较弱。然而,在烟草叶/茎和桦木叶中观察到大面积的蓝色,用PBPMYB21渗透,分别表明桦木叶和茎中的强且薄弱的活性(图。5.).
空间和时间表达式模式BPMYB.植物激素治疗后的基因
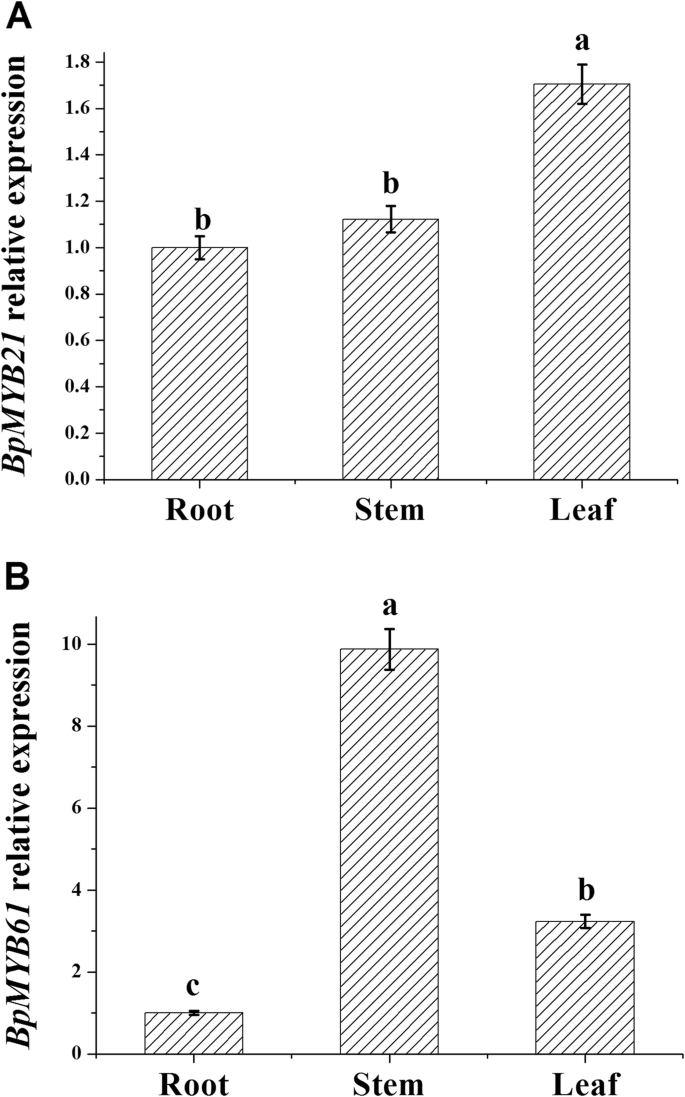
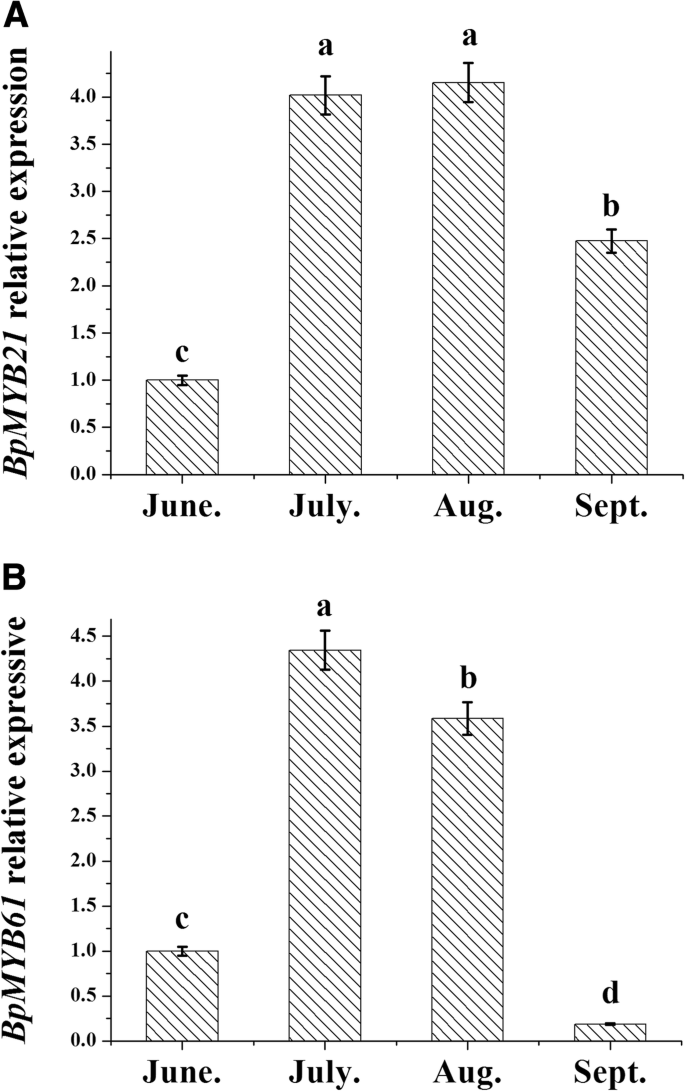
两者的组织表达模式不同BpMYBs(无花果。6.).BPMYB21在叶子中高度表达,其次是茎,并在根中最小的表达BPMYB61在茎中表达量高,其次是叶,在根中表达量最低。在时间方面的表达也观察到差异(图。7.);表达的BPMYB21和BPMYB61在7月和8月显著升高。
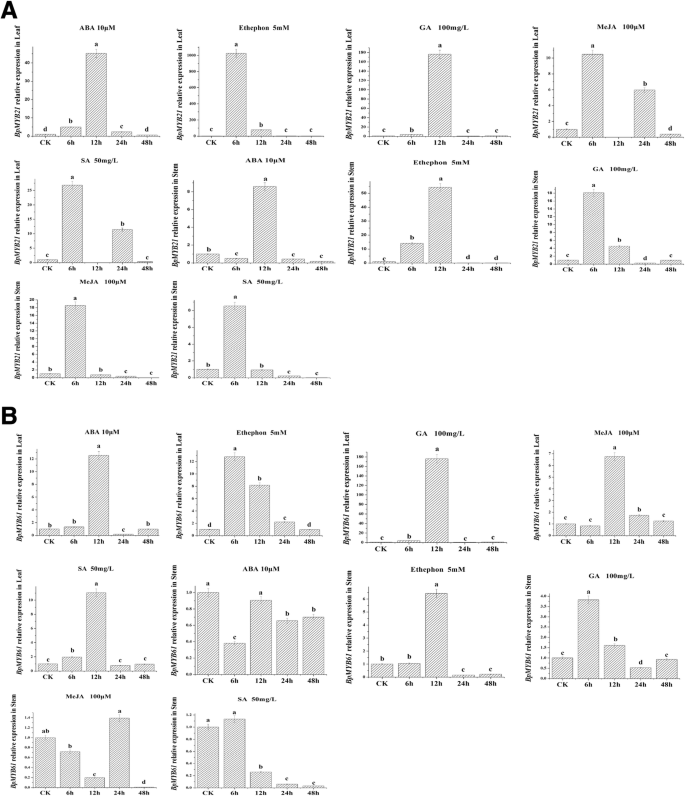
不同激素处理后也观察到表达模式的差异(图。8.a,b)。在叶子中,表达BPMYB21MeJA、SA和乙烯处理6 h, ABA和GA处理12 h后,均显著升高。在茎中,表达BPMYB21在用ME JA,SA或GA处理6小时后也显着增加,ABA或Ethephon 12小时(图。8.a).类似地,表达BPMYB61经这些激素处理后的叶片也显著增加。表达式BPMYB61与对照组相比,ABA、Me JA、SA或GA处理12 h,乙烯利处理6 h后,表达上调。的表达模式BPMYB61经这些激素处理后获得的茎与观察到的叶不同.表达式BPMYB61在ABA,MEJA或SA处理后,转录物显着降低48小时(图。8.b).有趣的是,表达BPMYB61赤霉素处理6 h,乙烯利处理12 h后,分别比对照组提高3.82-和6.42倍。这些结果表明BPMYB21和BPMYB61对激素诱导的反应不同,这也是组织特异性的。
BpMYB21和BpMYB61的亚细胞定位
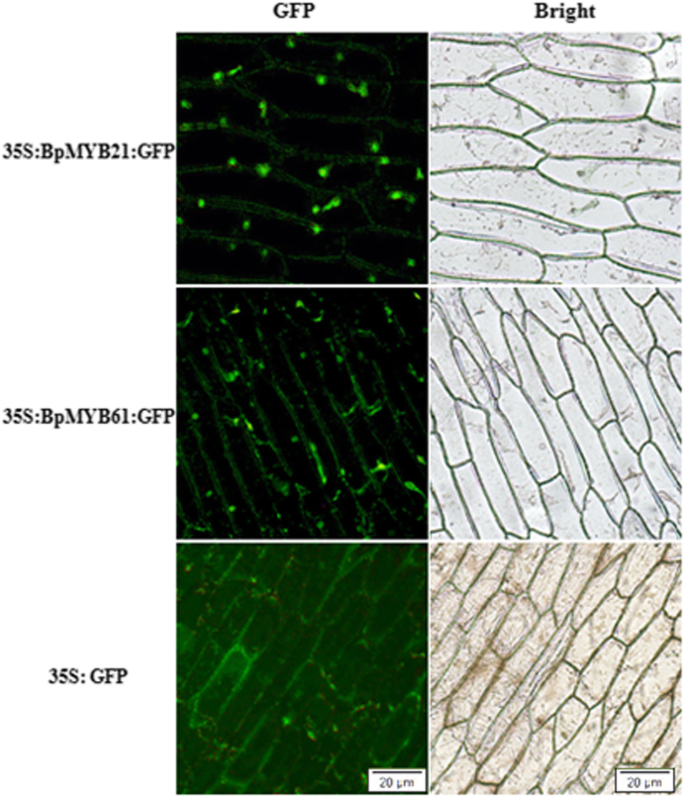
我们研究了使用洋葱表皮细胞中的瞬时表达测定法在生物细胞中使用洋葱表达测定,具有表达绿色荧光蛋白(GFP),BPMYB21 / GFP或BPMYB61 / GFP融合的构建体。荧光显微镜表明,核中存在BPMYB21 / GFP,而BPMYB61 / GFP靶向核和细胞膜(图。9.).GFP控制分布于整个细胞(图。9.).从典型的光学显微镜图像(图。9.,右图),我们可以清楚地看到洋葱表皮核的位置。因此,在该实验中未检测到细胞核中特定蛋白的共定位。
INVScl转化子中角鲨烯和总三萜积累的分析
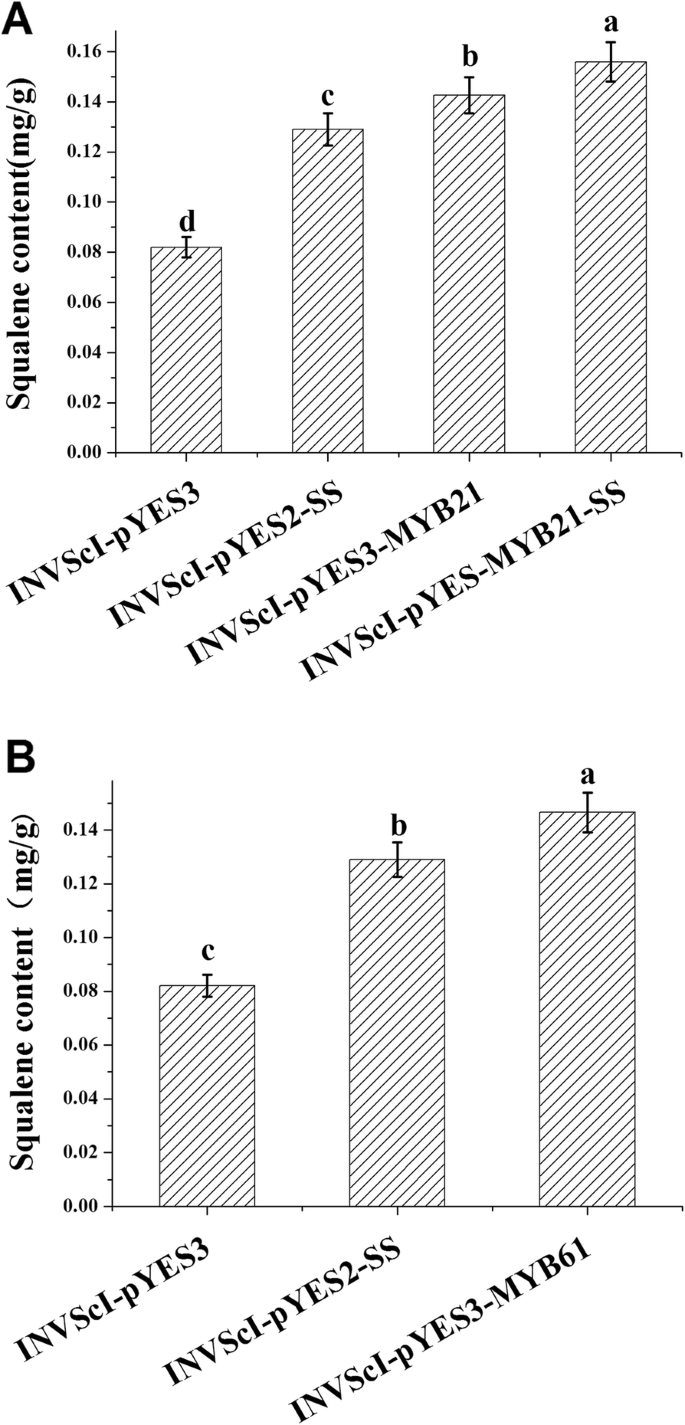
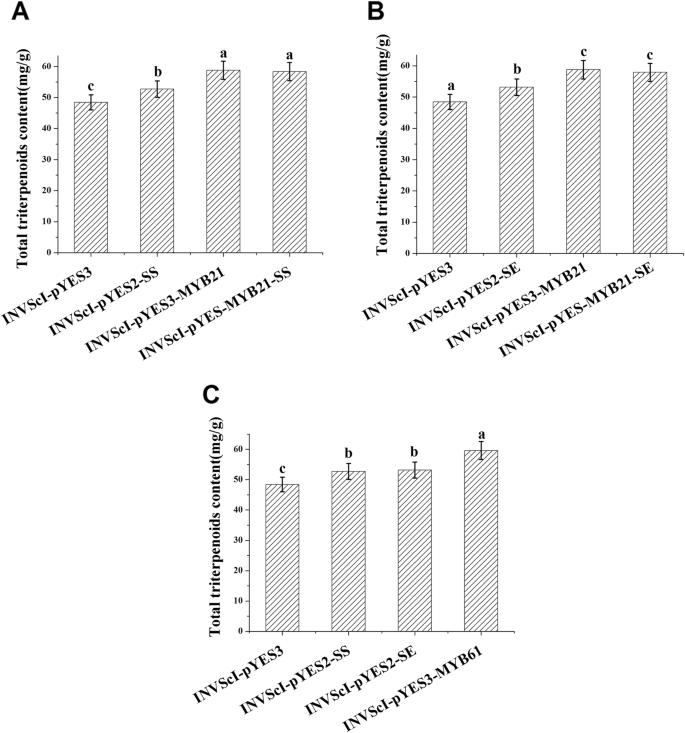
为了研究BpMYB21和BpMYB61的功能,BPMYB21和BPMYB61将基因纳入Invscl,并研究了Invscl-pyes2-Sssssteg酵母细胞和萜烯合成。通过半乳糖诱导重组和对照酵母12小时,并通过高效液相色谱(HPLC)提取和分析Squalene合酶产物[26].培养12 h后,INVScl-pYES3-MYB21 - ss细胞(0.155 mg/g)的角鲨烯含量比空白载体的对照组酵母细胞增加89%,比INVScl-pYES2-SS细胞增加20%,比INVScl-pYES3-MYB21细胞增加9%。10).invscl-pyes3-myb61细胞中的角鲨烯含量为0.146mg / g,比在空载体对照酵母细胞中高出78%,比invscl-pyes2-ss细胞高出13%(图。10).
为进一步研究BpMYB21和BpMYB61的功能,分别接种重组酵母和对照酵母12 h,提取三萜并测定总三萜含量[10].invscl-pyes-myb21-ss细胞中的总三萜含量为58.333mg / g,比含空载体的对照酵母细胞高出20%,比invscl-pyes2-ss细胞高10%。与对照酵母细胞相比,invscl-pyes3-myb21细胞中的总三萜烯含量增加21%。invscl-pyes3-myb61细胞的总三萜含量为59.625mg / g,比对照酵母细胞高出23%,高于invscl-pyes2-ss细胞的13%(图。11).这些结果表明BPMYB21和BPMYB61参与了角鲨烯和三萜的合成。
转基因桦树植物中三萜合成相关基因的表达
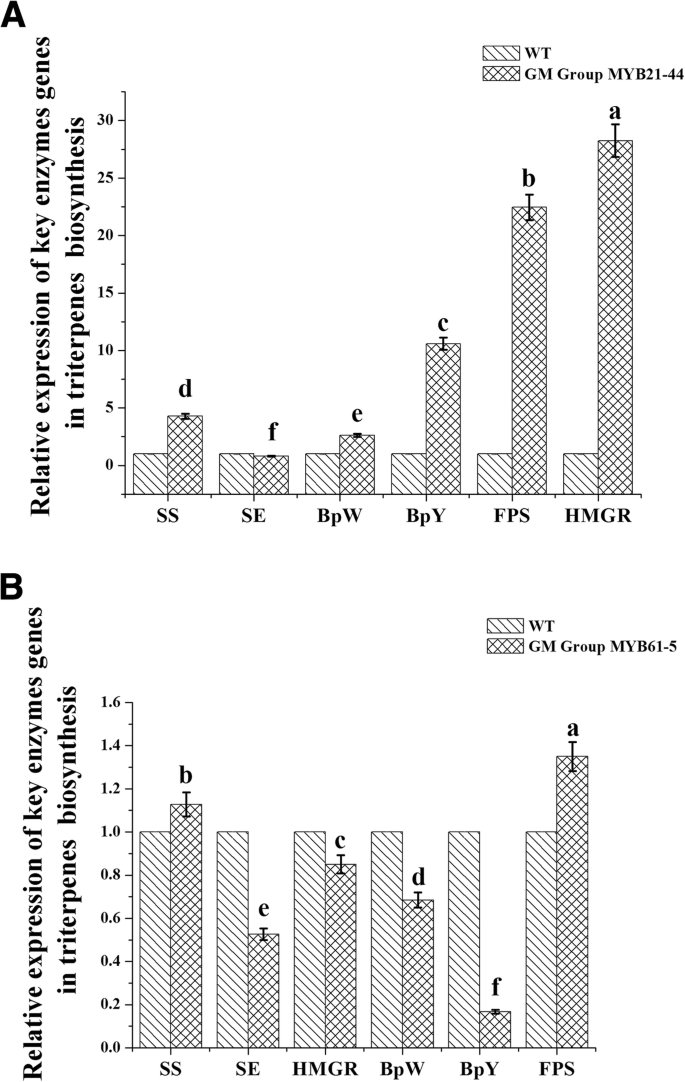
研究…的作用BPMYB21和BPMYB61研究了桦树三萜合成的相关基因。三萜合成相关基因的表达(SS.那SE.那b那BPW.那帧/秒和HMGR.)在转基因植物中(Nub21-44和MyB61-5系)过表达BPMYB21或BPMYB61采用real-time RT-PCR检测。在MYB21-44转基因植株中,表达SS.那BPW.那b那帧/秒和HMGR.与野生桦木(对照)相比,分别上调了4.27-、2.61-、10.59-、22.44-和28.24倍。12),其中HMGR.经历了最重要的上调。表达式SE.在野生桦树中是79%,代表略微下调。这些结果表明BPMYB21可以积极调节表达吗SS.那BPW.那b那帧/秒和HMGR.基因在桦树。
在MyB61-5转基因植物中,表达SS.和帧/秒与野生桦树相比,分别显示出类似程度的上调程度,13和35%。表达式HMGR.那BPW.那SE.和b下调幅度分别为84、68、52和16%b是最显着的改变。这些结果表明BPMYB61可能会对表达产生负面调节HMGR.那BPW.那SE.和b桦树中的基因(图。12b)。
白桦酸、齐墩果酸和白桦苷的高效液相色谱分析BPMYB21和BPMYB61转基因白桦
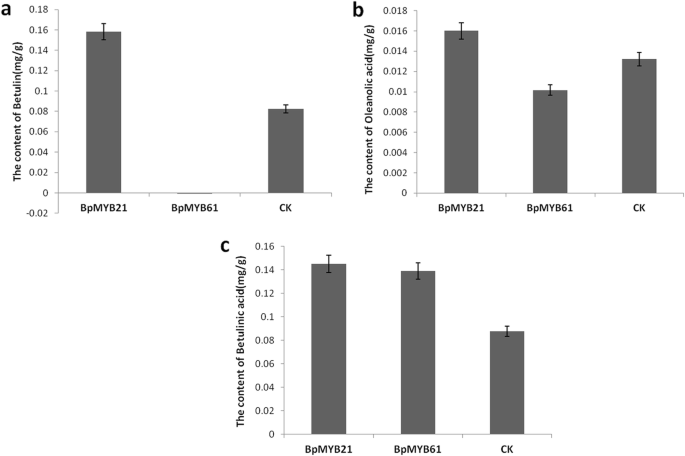
为了进一步探讨BPMYB21和BPMYB61在三萜合成中的功能,使用MYB21-44和MYB61-5线的茎段诱导愈伤组织大量过度表达BPMYB21或BPMYB61,分别。然后用标准曲线和回归方程测定呼应组织中桦木酸,葡聚糖和桦木蛋白的含量Y1 = 9×106×+ 68,020(R2 = 0.9994),Y2 = 107x + 43,301(R2 = 0.9993)和Y3 = 107x + 63,763(R2 = 0.995)分别。结果表明,愈伤组织中的所有三种分子在野生桦树中的含量较高。与对照相比,桦木酸,葡萄糖和桦木中的含量分别增加65,21和92%。在MyB61-5转基因桦中,与野生桦树相比,桦木酸的含量分别升高59%,分别逐渐降低23%和92%。在三种测试的化合物中,过表达BPMYB21白桦脂含量增加最多,其次为白桦脂酸和齐墩果酸。过度的BPMYB61桦木素含量降低最多,齐墩果酸次之。13).这些结果进一步说明BpMYB21和BpMYB61参与了三萜的合成。
BPMYB21和BPMYB61转录因子桦木桦木中三萜生物合成基因的调节
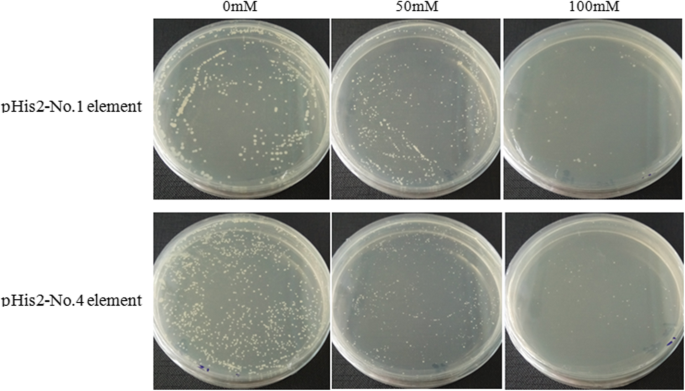
的监管SE.和BPX.通过BPMYB21和BPMYB61 TFS通过酵母单杂交测定验证基因。具体而言,我们筛选了六种类型的MYB结合元素,并成功地构建了三个替代的顺式代理元件诱饵和含有捕食载体的拷贝BPMYB21和BPMYB61,分别。自激活结果显示,100 mmol/L 3-氨基-1,2,4-三唑(3-amino-1,2,4-triazole)可抑制元件1和元件4的转录激活,而2,3,5和6则不受抑制(图1)。14).这可能是因为在没有诱饵的情况下,酵母中可能存在一种内源性调节因子,它可能识别并结合目标序列,使其与酵母单杂交筛选不相容。这些结果表明两者之间存在微弱的相互作用BPMYB21元素1和元素4在发起人SE.和BPX.基因。相比之下,两者之间有很强的相互作用BPMYB61元素1和4,表示BPMYB61对此有效率有效的监管效果SE.和BPX.基因(图。15).
讨论
MYB转录因子调节植物次生代谢产物的合成,在类黄酮代谢中发挥重要作用[27]、花青素生物合成和其他次生代谢产物答:芥[27那28].例如,AtmyB75的过表达增加了次级代谢物的积累,例如花青素和黄酮醇[29],而AtmyB3的过度表达,AtmyB6和AtmyBl2在该物种中抑制花青素生物合成[30.].同时,WD40-BHLH-MYB综合体也在一定程度上调节植物生理和生化反应。例如,植物激素作用上游诱导MyB-BHLH-WD40络合物,从而调节腺毛的形成Artemisia Annua.[31].
在本研究中,我们首先克隆全长BPMYB21和BPMYB61TFS来自b . platyphylla苏克人。使用RT-PCR,并暂时命名为它们BPMYB21和BPMYB61,分别。NCBI BLAST对准分析显示〜64%氨基酸序列同源之间BPMYB21和mybsjuglans regia.那胡杨和葡萄.保守结构域分析显示一个Myb dna结合和两个sant特异性基序(图。1).同样的,BPMYB61被发现是61-97%对Mybs的同源胡杨那juglans regia.那Populus Trichocarpa.和Betula Luminifera.编码的多肽序列BPMYB61还含有MYB DNA绑定图案。因此,我们建议BPMYB21和BPMYB61是桦树中新的R2R3-MYB基因。
我们获得了启动子BPMYB21和BPMYB61从b . platyphylla采用基因组行走法,分别得到1302 bp和850 bp片段。这BPMYB21和BPMYB61启动子包含许多典型的组件,包括TATA和CAAT盒,以及有助于适应不利环境条件的与应力相关的顺式元件。启动子中还包含ABRE、CGTCA、TCA和GARE等植物激素反应元件,表明BPMYB21和BPMYB61由植物激素调节。同样地,AtmyB30和BES1,ATMYB77和ARF7和ATMYB18和FHY1FHL参与了拟南芥中的芸苔属,毒素和光学信号的调节[32那33].桦木转录数据分析显示BPMYB21和BPMYB61基因可以由MEJA和SA信号诱导,BPMYB21和BPMYB61分别被MeJA和SA上调和下调。此外,的表达BPMYB21和BPMYB61被不同的荷尔蒙诱导。MyB基因家族通常根据MYB域中的MYB重复的数量分为四个亚壳,即R1R2R3-MYB(3R-MYB),R2R3-MYB(2R-MYB)和4R-MYB,包含三个,两个和四个myb重复;植物中大多数MyB TFS是R2R3-MYB或R1-MYB类型[28那34].在本研究中,生物信息学分析表明,BPMYB21和BPMYB61都是R2R3-MYB系列蛋白(图。1和3.).
JA、SA、乙烯等激素参与植物次生代谢相关的信号转导,形成复杂的调控网络[35].例如,在JA信号转导途径中,涉及类黄酮代谢途径的抑制剂Jasmonate Zim-域(Jaz)作为直接抑制剂和MyB TF,促进MyB TFS的调节,从而影响代谢黄酮类化合物[36].外源SA促进萜类、生物碱和黄酮类化合物等次生代谢物的合成[37那38那39].在先前的研究中,我们证明MEJA和SA显着增强了桦树中的三萜含量,并上调了参与三萜生物合成的基因的表达[23那24那25].在目前的研究中,BPMYB21- - -BPMYB61-表达转基因植株分别用ABA、GA、Me JA和SA处理后,与对照相比,应答率均升高,说明转基因植株的ABA、GA、Me JA和SA表达BPMYB21和BPMYB61确实受植物激素诱导的影响。这BPMYB21该基因在茎叶中的表达模式与MeJA和SA一致,在6 h内表现出应答。叶片和茎中对ABA响应的表达模式呈现相似的趋势,12 h后表达上调。这BPMYB61基因分别对茎和叶中的激素治疗敏感,分别为48小时和12小时。Meja与SA之间可能存在协同效应BPMYB21ABA,Meja和SA激素和SA荷尔蒙也可能是真的BPMYB61表达式。
此外,MYB TFs如MBS和bHLH TFs的结合位点,包括g -boxBPMYB21和BPMYB61启动子序列。MYB家族TFs不仅可以单独调节植物次生代谢产物的合成[14];相同的MYB TFs,如AmMYB305和AmMYB340,也可以通过相互作用调节次生代谢物的合成[40].例如,BHLH TFS还可以调节次级代谢物如葡糖苷,黄酮类化合物的合成[41]和萜类化合物[42],花青素的生物合成受TTG1/bHLH/Myb复合物控制,协同调控效率高于单组分作用拟南芥[43].
从酵母中获得的角鲨烯和总三萜与从植物中获得的角鲨烯和总三萜相同,和植物一样,酵母是这些化学物质的良好来源。随着合成生物学在萜类化合物中的应用,利用酵母表达系统合成萜类化合物的研究取得了进展。大肠杆菌和酿酒酵母通常用作三萜类皂苷合成的宿主。酵母具有许多植物中次生代谢所需的许多酶和底物,次级代谢物的合成效率可以高于植物中的效率[44].的确,利用酵母表达系统和合成生物学方法合成萜类化合物已经取得了很大的进展[45].例如,通过将甲羟戊酸(MEV)途径与酵母基因组相结合,改善了工程菌株的遗传稳定性,其过表达amorpha fruticosa.411-二烯合成酶基因艾提高了500倍,倍半萜青蒿素的收率提高了[46].在另一个研究中,使用酵母作为宿主,UDP-糖基转移酶,CYP716A47及其辅酶ATR2-1人参是共表达的,并且可以从划痕中合成包括Panaxadiol saponins CK的三萜类化合物[47].在本研究中,invscl-pyes3-myb21和invscl-pyes3-myb21-s重组酵母细胞中的角鲨烯含量和总三萜含量增加到不同程度。与对照酵母细胞相比,invscl-pyes-myb21-ss酵母细胞的角鲨烯含量增加了〜89%,invscl-pyes3-myb61重组酵母中的角鲨烯和总三萜含量增加了invscl-pyes3-myb61 > INVScl-pYES2-SS > INVScl-pYES3. These results suggest thatBPMYB21和BPMYB61在Squalene和Triterpenes合成中的功能,但改善程度有限。表达式SS.那b那BPW.那帧/秒和HMGR.在过表达的转基因桦树中BPMYB21.表达式SS.和帧/秒同样上调,表达HMGR.那BPW.那SE.和b相对下调。同时,MYB21-44和MYB61-5转基因株系中三萜产物含量的变化与MVA通路基因表达的变化相似。MVA基因在BpMYB21-44中表达上调,在BpMYB61-5中表达下调。虽然MYB61酵母中三萜产物的含量有所增加,但与MYB21酵母相比增幅很小。此外,在以往的研究中,我们获得了参与三萜合成的关键基因的启动子序列(未发表),并发现了该基因的启动子SE.那BPW.和BPX.基因含有可与MYB TFS结合的顺式作用元素。因此,MyB TFS可以通过在三萜合成中的关键酶的启动子中结合到CIS作用元件来调节三萜的合成。在此,我们确认了调节SE.和BPX.BpMYB21和BpMYB61 TFs在桦树中的表达。我们获得了含有SS./SE.在我们之前的研究中,它们的启动子是来自酵母的GAL1,但我们的结果表明,当BPMYB21和BPMYB61进入含酵母菌株SS./SE.,并且分三萜含量增加。通过我们对GAL1启动子序列的分析表明,GAL1启动子序列具有MYB转录因子的调节元件,表明BPMYB21和BPMYB61可以调节表达吗SS./SE.酵母中的基因,然后调节三萜合成。与此同时,我们之前的实验证实了启动子序列SS.和SE.桦树的基因确实含有MBS序列的作用位点BPMYB.转录因子。有人建议BPMYB21和BPMYB61在桦树中可能会调节表达SS.和SE.基因,然后调节三萜合成。我们还将更多地关注未来酵母细胞中MYB基因和GAL1启动子的相互作用和调控机制。
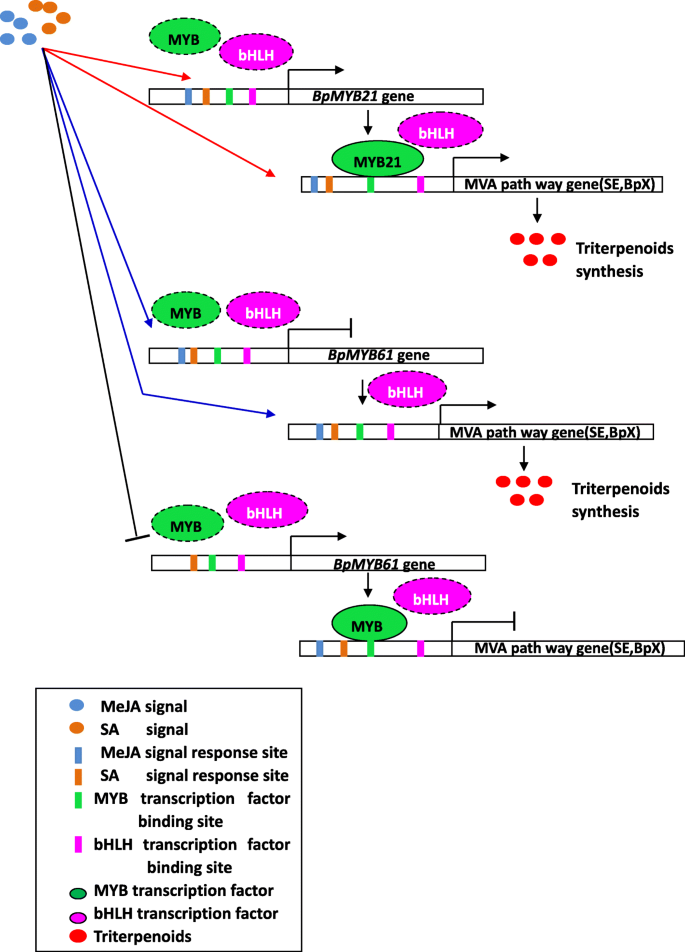
然而,MYB作用元件并不是决定MYB TFs是否激活下游基因启动子的唯一因素;顺式元件的数量、位置以及元件两端启动子序列的特征都会影响启动子的转录激活[48].激素信号的诱导也是下游基因表达的决定因素。基于上述结果,我们推导出诸如Meja或Sa等激素信号可能会引起表达myMYB TFs和/或bHLH TFs可能也发挥上游调控作用my基因。我们推测有两种主要机制,MYB TFS调节Terpenoid生物合成。通过直接在编码萜烯合成中的关键酶的基因的启动子中直接作用于相关的CIS作用元素,或通过与BHLH TFS相互作用;或者,MYB TFS可以形成具有BHLH和WD40 TF的转录复合物,以调节下游靶基因的表达,从而调节萜类化合物的合成。但是,是否使得BHLH TFS调节表达式my它们是否与MYB转录因子形成转录复合物还需要进一步验证。此外,的表达my基因是由特定的基因和外部条件调控的,这也需要进一步的探索。基于本研究的结果和以前的报告,我们提出了一个简化的工作模型的角色BPMYB21和BPMYB61在激素诱导的三萜合成中b . platyphylla(无花果。16).在未来的研究中,可以通过激素诱导转基因植物,以研究参与MEJA或SA信号诱导反应的MYB-BHLH转录复合物调节三萜。
结论
我们克隆BPMYB21和BPMYB61基因桦木属platyphylla苏克人。首次。BPMYB21是MYB转录因子家庭的新成员。BPMYB21和BPMYB61基因表现出时空表达特异性。这些基因在不同激素和损伤诱导下的表达模式存在显著差异。的启动子BPMYB21和BPMYB61基因具有启动子活性。BPMYB21和BPMYB61基因参与了角鲨烯和三萜的合成。在转基因植株中,我们发现BPMYB21和BPMYB61基因涉及参与三萜途径中涉及的关键基因的表达,但两个基因的调节存在显着差异。BPMYB21和BPMYB61对此进行了监管效果SE.和BPX.基因,BPMYB61的调节效果更强。BPMYB21和BPMYB61基因对植物的三萜产量和调节具有很大的潜力。
方法
植物材料和生长条件
本研究中使用的植物材料(桦木植物)来自我们的实验室(林生工程实验室,中国哈尔滨东北林业大学生命科学学院; Yaguang Zhan教授是实验室的主持人,电子邮件:yaguangzhan@126.com.).本研究使用来自4周龄桦树植物的不同组织。如前所述,桦树在16小时:8小时(23-25°C)光/暗光周期下的生长室中生长。对于用ABA(10μm),Meja(100μm),sa(50mg / l),ethephon(5mm)或ga(100mg / l),桦木被完全浸泡在含有适当激素的WPM液体培养基中解决方案。在植物激素治疗后在不同时间收获桦树树苗的叶子和茎。
基因克隆与序列分析
通过CTAB方法提取基因组DNA和总RNA。BPMYB21和BPMYB61基因序列来自我们实验室中的桦树转录组数据。特定引物(MyB21-Full-F / R和MyB61-Full-F / R;在表格中S1)被设计用于扩增全长BPMYB21和BPMYB61基因组序列和桦木的cDNA序列。PCR产物用18-T T-Vector连接(Takara,Dian,中国)。使用来自NCBI的Blast软件选择来自不同植物物种的氨基酸序列。使用PROSITE计划进行BPMYBS的主题分析(http://prosite.expasy.org/prosite.html.)和智能工具(http://smart.embl-heidelberg.de.).MyB蛋白的各个结构域使用Dnaman8.0(Lynnon Biosoft)对齐,并通过BoxShade说明(http://www.ch.embnet.org/software/box_form.html.).对同源肽段序列进行比对,利用DNAMAN软件构建相邻连接系统发育树。图中所有序列数据和系统发育数据的登录号。2和4.已在附加文件中提供3..
逆转录和实时荧光定量PCR
表达式BPMYB21和BPMYB61对不同月份的根、茎、叶组织进行了分析。表达式BPMYB21和BPMYB61在用10μM脱落酸(ABA),100μM甲酸亚甲酸(ME-JASMONEN酸(ME-JAS),50mM乙烯,50mg /升半环酸(SA)和100mg / L胃纤维素(气体)后分析在茎和叶组织中分析)对于0,6,12,24和48小时。使用RealmasterMix与Sybr Green I(Takara)和如前所述的ABI7500实时PCR系统收获用于RNA提取,随后的逆转录和定量实时PCR(QRT-PCR)分析的材料。如前所述[23].这TU.基因被用作内部控制。用于逆转录和qRT-PCR分析的引物列于表中S2.
亚细胞定位
编码序列BPMYB21和BPMYB61插入PCAMBIA1303载体中,以在35S启动子的控制下与绿色荧光蛋白(GFP)融合,以产生GFP-BPMYB21和GFP-BPMYB61构建体。融合构建PCAMBIA1303-GFP-BPMYB21和pcambia1303-gfp-BPMYB61和对照pCAMBIA1303-GFP,采用三亲本杂交法将其导入菌株LBA4404。利用农杆菌介导的瞬时表达对洋葱表皮细胞进行亚细胞定位分析[49].用于与GFP融合的引物列于附加文件中3.表S1。采用激光共聚焦显微镜观察BpMYB21和BpMYB61蛋白的亚细胞分布,使用LSM510 Meta UV仪(Zeiss,德国)。引物用于BPMYB21或BPMYB61和GFP融合列于表中S3..
BPMYB21和BPMYB61启动子分离及活性分析
启动子区BPMYB21和BPMYB61由基因组行走方法分离。使用DNA提取试剂盒从幼桦植物中提取基因组DNA。基因组步行PCR在制造商的指示之后,具有通用基因组步进套件进行。在表中列出了基因组步行PCR的引物,包括AP1-AP4和特异性引物。S4.守恒顺式元素主题位于BPMYB21或BPMYB61使用PlantCare鉴定启动子(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/).研究活动BPMYB21和BPMYB61在启动子中,pXGUS-P载体中的自杀基因被替换为BPMYB21或BPMYB61启动子序列生成PMYB21 :: GUS和PMYB61 :: GUS。用于融合GUS的引物在表中列出S5.首先,利用三亲本杂交方法将构建的质粒pMYB21::GUS和pMYB61::GUS转入农杆菌菌株LBA4404中,用LBA4404培养整个桦树和烟草植株48 h,将外源基因导入植株。然后检测Gus酶活性,检测外源启动子是否有活性,并研究表达位置。
转基因植物的产生
为了验证功能BPMYB21和BPMYB61在控制桦树三萜合成过程中,它们分别在桦树幼苗中过表达。生成BPMYB21和BPMYB61过表达构建,编码序列BPMYB21或BPMYB61在35S启动子的控制下,插入修饰的pCAMBIA1303载体。融合构建了pCAMBIA1303-BPMYB21和pCAMBIA1303 -BPMYB61并且使用超紧张杂交方法将控制PCAMBIA1303掺入菌株LBA4404中。桦树植物的叶子,叶柄和茎段用作实验材料。LBA4404含有PCAMBIA1303-BPMYB21或PCAMBIA1303-BPMYB61的农杆菌在LB培养基中重新悬浮,渗透到桦树植物的叶片,叶柄和茎段中[50].在去除土壤杆菌后进行愈伤组织诱导和幼苗丛集,直至使用如前所述的培养条件(使用培养条件)在培养条件下培养至2〜3cm,[49].表中列出了用于获得过表达结构的引物S6.
角鲨烯和三萜类酵母分析
编码序列BPMYB21和BPMYB61插入pyes3矢量。全长基因包括一个埃森I限制性内切酶位点通过PCR获得,引物通过输液引物设计网站(https://www.takarabio.com/learning-centers/cloning/in-fusion-cloning-tools.),详见表S7).BPMYB21和BPMYB61将基因整合到INVScl酵母菌株中,并分析INVSc-pYES2-SS酵母细胞中萜类化合物的合成。酵母转化使用酵母转化试剂盒(Cat。不。yp7867 - 200 t;(北京华岳生物有限公司)其中角鲨烯和总三萜的含量酿酒酵母INVSCI通过高效液相色谱(HPLC)测量[51].所有实验均重复三次。
转基因桦木中桦木酸、齐墩果酸和桦木素的测定
通过HPLC确定转基因桦蛋白酸和葡萄糖酸中的含量,如前所述[26].
酵母单杂交测定
使用Matchmaker单杂交系统进行酵母单杂化测定。通过寡核苷酸退火合成3-5×MBS基序的片段并将其连接到埃森pHis2向量的I位。诱饵结构与SMA.I和整合到酵母基因组(菌株Y187)。使用SD/−T/−H培养基上不同浓度的3-AT测定HIS的基础表达。BPMYB21和BPMYB61将orf连接到pGADT7-Rec2的GAL4激活域,并在含有100 mM 3-AT的SD/−T/−H/−L培养基上测试酵母转化子。用于诱饵和猎物构造的引物列于表中S8和表S9..
可用性数据和材料
所有支持数据都包含在附加文件中。在当前研究期间生成和/或分析的数据集可用于[持久性Web链接或访问数据集]存储库。
缩写
- 帧:
-
法呢基焦磷酸合成酶
- SS:
-
角鲨烯合酶
- HMGR:
-
3-羟基-3-甲基戊芳族辅酶A还原酶
- BPW:
-
羽扇豆醇合成酶
- SE:
-
squalene环氧酶
- BPY:
-
β香树脂醇合成酶
- BPX:
-
环丁烯醇合成酶
- 阿巴:
-
脱盐酸
- 遗传算法:
-
吉布林素
- Meja:
-
茉莉酸甲酯
- SA:
-
水杨酸
- HPLC:
-
高效液相色谱法
- SD /−T:
-
合成辍学介质缺乏Trp
- SD / -H:
-
缺乏他的综合辍学媒介
- SD / -L:
-
合成Dropout介质缺乏Leu
参考
- 1.
尹吉,詹·yg,肖杰。三萜的合成与调节桦木属platyphylla苏克人。植物Physiol Communic。2009; 45:520-6。
- 2.
叶yy,他dw,ye wc,张xq,zhao sx。23羟基桦木酸体外抗癌作用。J南京铁路MED学院。2001; 20:141-6。
- 3.
李波,李啊,金XJ。抗肿瘤活性和分类中分离的免疫调节作用桦木属Platyphylla.中华免疫杂志,2000;16:485-90。
- 4.
程慧,刘伟伟,涂正东,陈晓,米立新,史美美,郑庆华,王海英。TFM对l -甲状腺素诱导的大鼠心肌肥大的抑制作用。中国药典,2000;16:279-81。
- 5.
Fujioka T,Kashiwada Y,Kilkuskie Re,Cosentino LM,Ballas LM,Jiang JB,Janzen WP,Chen就是,Lee Kh。抗助剂剂.11.乙酰酸和铂酸作为抗HIV原理Syzigium claviflorum.,以及结构相关的三萜抗hiv活性。J Nat Prod(劳埃德银行)。1994; 57:243-7。
- 6.
Fulda S,Jeremias I,Steiner Hh等人。Betulinc酸:一种用于恶性脑肿瘤细胞癌的新细胞氧基毒剂。查看问题TOC。1999年; 82:435-41。
- 7.
famas A, Pınzaru CS, Dehelean CA等。通过FT-Raman和FT-IR光谱分析,发现桦木素及其天然资源具有潜在的抗癌药物潜力。拉曼Spectrosc。2011;42:97 - 107。
- 8.
李民币,尹j,詹yg,仁克,王zh。水,氮气和甲基己酸酯处理对桦木丛生群的影响(桦木属platyphyllasuk。)。Acta Botan Boreali-Occiden Sin。2012; 32:0155-61。
- 9。
牛玉玲,蒋晓明,徐晓明。植物转录因子MYB基因家族的研究进展。Mol Plant Breeding. 2016; 14:50 - 9。
- 10.
陈柏斯,牛芳芳,刘文忠,杨斌,张建新,马建勇,程华,韩飞,蒋永强。油菜R2R3-MYB基因家族的鉴定、克隆及特性分析芸苔栗鸟l)鉴定一个调节ROS积累和超敏样细胞死亡的新成员。DNA研究》2016;23:101-14。
- 11.
齐TC,黄鹤,歌曲SS,谢德。通过BHLH-MYB综合体调节茉莉 - 介导的雄蕊开发和种子生产拟南芥.植物细胞。2015;27:1620-33。
- 12.
Li Wsn,Gao Wy,Yin Jl,王克,王R,Petersen CC,Mundy M,John Q,Jin L. MPK4的磷酸化是光诱导的花青素积累所必需的拟南芥.植物细胞。2016;28:2866 - 83。
- 13.
邢W,金XL。黄芪转录因子的最新进展,涉及类黄酮生物合成调节。莫尔植物育种。2015; 13:689-96。
- 14.
刘家,奥巴顿A,MA P. MYB转录因子作为植物苯丙醇代谢调节因子。莫尔植物。2015; 8:689-708。
- 15.
李文斌,丁志华,阮明斌,于晓林,彭明,刘云峰。猕猴桃R2R3-MYB转录因子及其对红猕猴桃花青素合成的贡献Sci众议员2017;7:16861。
- 16.
罗雪平,朱达元,黄永杰,李曼夫,姚鹏飞,高飞,李春林,赵海霞。茉莉酸甲酯对黄酮类化合物积累及相关基因表达的影响荞麦豆芽.基因组苹果Biol。2015; 34:1040-6。
- 17.
马军,胡文忠,毕毅,蒋爱玲,萨仁。茉莉酸处理对鲜切生菜和卷心菜组织中苯丙烷代谢的影响。食品工业科技。2013;34:333-9。
- 18.
常兆坤,朱震,董华,尹杰,詹颖光。me JA联合高温胁迫对桦树悬浮细胞中三萜积累的影响《中草药》2016;47:2333-40。
- 19。
李国珍,李利民,姚志平,刘凤德。乙烯与水杨酸的相互作用拟南芥反应聚乙二醇应力。J沉阳普通大学(自然科学版)。2017; 35:214-9。
- 20.
关键词:水杨酸,水杨酸,钙离子,三萜类化合物桦木属platyphylla.北京林业大学学报2014;36:51-8。
- 21。
王Y. CA的作用和机制2+在SA和me中,JA诱导桦木三萜的合成。哈尔滨:东北林业大学;2014.
- 22。
李cx。ME JA和SA的桦木树苗三萜类生物合成调控及其关键酶基因研究帧/秒克隆。哈尔滨:东北林业大学;2012.
- 23。
尹j,任cl,zhan yg,李cx,小jl,邱w,李xy,彭·赫姆。白桦树脂素和OSC基因的分布及表达特征(桦木属platyphyllasuk。)。Mol Biol rep. 2013; 39:2321-8。
- 24。
Yin J,Liang T,Wang S,Zhang M,Xiao J,Zhan Y,Li C.干旱和氮气对白桦树苗桦木和OleAlic酸积累的影响。植物mol biol rep。2014; 33:705-15。
- 25。
关键词:盐胁迫,生理特性,OSC基因表达,三萜积累桦木属platyphyllaSuk到Meja和Sa治疗。植物mol Biol rep。2015; 34:427-39。
- 26。
尹军,李旭,詹永刚,李勇,曲志勇,孙玲,王世英,杨军,肖建林。基因的克隆与表达BpMYC4和BPBHLH9.基因和角色BPBHLH9.在桦木中三萜的合成。植物生物学杂志。2017;17:214。
- 27。
刘毅,史哲,马克西莫娃,佩恩·乔丹,吉尔蒂南·乔丹。Tc-MYBPA是拟南芥tt2样转录因子,参与原花青素合成的调控Theobroma可可.生物医学中心植物生物学。2015;15:160。
- 28.
关键词:拟南芥,MYB转录因子,拟南芥植物科学。2010;15:523 - 523。
- 29.
Nawaporn O,Michael R,Arjen VD,Robert CS,Joop Ja,Marcel D.通过MyB75转录因子的过度表达来调制拟南芥的黄酮代谢物:Kaemp-FeroL-3,7-Dirhamnoside在抵抗专科昆虫的作用草本皮埃斯·铜霉素。J Exp Bot。2014; 65:2203-17。
- 30.
Rowan DD, Cao MS, Wang KL, Cooney JM, Jensen DJ, Austin PT, Hunt MB, Cara N, Hellens RP, Schaffer RJ, Allan AC. Environmental regulation of leaf colour in red 35S:PAP1拟南芥.新植物。2009; 182:102-15。
- 31.
Maes L, Van Nieuwerburgh, Zhang YS, Reed DW, Pollier J, Casteele SV, Inzé D, Covello SP, Deforce D, Goossens A.解析抗疟化合物青蒿素的毛状体形成和生物合成的植物激素调控艾annuaplants.新植物。2010; 189:176。
- 32.
Wester K,Diguini S,Geiier F,Timmer J,Fleck C,HülskampM.R3单次重复基因的功能多样性在培训中的开发中。发展。2009; 136:1487-96。
- 33.
李玲,于晓峰,A Thompson,郭敏,S Yoshida, Asami T, Chory J, Yin YH。拟南芥MYB30是BES1的直接靶点,与BES1共同调控油菜素甾醇诱导的基因表达。植物j . 2009; 58:275 - 86。
- 34.
陈啊,杨XY,他,刘MH,李杰,高紫育,林泽,张毅,王XX,邱XM,沉YP,张L,邓x,罗杰,邓XW,陈泽,古海,qu lj。拟南芥的MYB转录因子超家族:与水稻MYB系列的表达分析和系统发育比较[J]。植物mol biol。2006; 60:107-24。
- 35.
郭妍,张培培,郭先生,陈坤思。次生代谢物和植物对病原疾病的防御。植物生理学学报(英文版);2012;
- 36.
Sun C,Zhou Xj,Chen Rm,Fan Yl,Wang L.植物中Jaz蛋白的综合概述。Biotechnol Bull。2012; 6:1-8。
- 37.
杨志明,李建平,李建平,等。水杨酸在植物抗病性中的重要作用[j] .植物营养与肥料学报,2015,26(3):457 - 464。科学。1994;266:1247-50。
- 38.
拟南芥中吲哚硫代葡萄糖苷的诱导。植物杂志。2001;126:849-60。
- 39.
在诱导过程中,信号通路是通过十八烷类途径介导茉莉酸。美国国家科学研究院1993;90:7490-4。
- 40.
Moyano E,Martinez-Garcia JF,Martin C.表观冗余MyB基因功能为控制antIrrhinum花中的类黄酮生物合成而提供传动装置。植物细胞。1996年; 8:1519-32。
- 41.
Dombrecht B,Xue GP,Sprague SJ,Kirkegaard Ja,Ross JJ,Reid JB,Fitt GP,Sewelam N,Schenk PM,礼仪JM。Myc2差异地调节拟南芥中不同的jasmonate依赖功能。植物细胞。2007; 19:2225。
- 42.
van MA,Steensma P,Schweizer F,Pollier J,Gariboldi I,Payne R,Vanden Br,Miettinen K,Espoz J,Purnama PC。BHLH转录因子BIS1控制Catharanthus Roseus中单萜吲哚生物碱途径的虹膜分支。Proc Natl Acad Sci U S A. 2015; 112:8130。
- 43.
李泽,李我。调节黄酮类生物合成的转录因子进展。J南京林业大学(自然科学版)。2011; 35:129-34。
- 44.
罗正林,张坤林,马晓军,郭永红。三萜皂苷合成生物学研究进展。《中草药》2016;47:1806-14。
- 45。
赵yj,风扇jj,王c,冯xd,li c.增强工程化葡萄糖酸生产酿酒酵母.生物抛光工艺。2018;257:339-43。
- 46。
RO DK,Paradise Em,Ouellet M,Fisher Kj,Newman Kl,Ndungu JM,Ho Ka,ra,火腿Ts,Kirby J,Chang Mcy,Withers St,Shiba Y,Sarpong R,Keasling JD。生产抗疟药前体青蒿酸在工程酵母中。自然。2006; 440:940-3。
- 47。
燕X,范y,魏爱,王pp,刘qf,魏yj,张l,赵gp,yue jm,周舍。在代谢工程酵母中生产生物活性人参皂苷k。细胞res。2014; 24:770-3。
- 48。
刘海。甜橙CSMYBF1基因的功能性鉴定与调节机制分析。武汉:华忠农业大学;2016年。
- 49。
詹YG。组织培养和遗传转化桦木属platyphylla苏克人。哈尔滨:东北林业大学;2001.
- 50。
Nagegowda哒。植物挥发性萜类代谢:生物合成基因、转录调控和亚细胞区隔。2月。2010;584(14):2965 - 73。
- 51。
关键词:角鲨烯合成酶,角鲨烯环氧化酶,基因克隆,启动子桦木属platyphylla苏克人。原生质。2016; 253:1347-63。
致谢
作者感谢Hu Shanglian教授在西南科技大学提供矢量。我们要感谢母语英语演讲者Elixigen公司(加利福尼亚州亨廷顿海滩)编辑我们的手稿。
资金
国家自然科学基金(no . 31570589);中央高校基本科研业务费专项资金(no . 257-2020DY01);盐碱植被生态恢复教育部重点实验室开放基金(no . 20200522-4)。中国政府和教育部提供了资金,并在实验测试和数据收集、数据分析以及支付出版费用方面发挥了非常重要的作用。
作者信息
从属关系
贡献
所有作者均已阅读并批准稿件。JY1和LS设计实验;LS进行实验并撰写稿件;JY1和YGZ对稿件进行了修改;YL和ZYQ分析了BpMYB21和BpMYB61的亚细胞定位;LS和JY2进行基因表达实验;JLX和SYW采用高效液相色谱法分析了角鲨烯产物、白桦酸、齐墩果酸和白桦醇。JY1:静音;杨JY2:杰
相应的作者
道德声明
伦理批准和同意参与
植物材料(桦树幼苗,桦木属platyphyllaSuk。)在本研究中使用的是来自我们的实验室(林生工程实验室,中国哈尔滨东北林业大学生命科学学院; Yaguang Zhan教授是实验室的主持人;电子邮件yaguangzhan@126.com.).所有植物材料都是免费提供的。本实验所用的桦树苗为本实验室组织培养苗,非濒危材料和树种。
同意出版物
不适用。
利益争夺
作者们宣称他们没有相互竞争的利益。
额外的信息
出版商的注意事项
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
补充信息
额外的文件1。
核苷酸序列和推导的氨基酸序列BPMYB21从桦树。
附加文件2。
核苷酸序列和推导的氨基酸序列BPMYB61从桦树。
附加文件4。
序列BPMYB21和BPMYB61来自桦木的启动子。
附加文件5:
表S1。用于基因克隆和序列分析的特异性引物。
附加文件6:
表S2。用于逆转录和定量实时PCR(QRT-PCR)分析的引物。
附加文件7:
表S3。BPMYB21,BPMYB61和GFP融合引物设计用于亚细胞定位分析。
附加文件8:
表S4。BPMYB21和BPMYB61的内含子引物
附加文件9:
表S5。BPMYB21和BPMYB61启动子克隆的特异性引物。
额外的文件10:
表S6。启动子活性分析引物
额外的文件11:
表S7。角鲨烯和总三萜酵母表达载体构建引物。
额外的文件12:
表S8。酵母单杂交检测诱饵载体成分合成和构建的引物。
额外的文件13:
表S9。酵母单杂交测定猎物载体构建的引物。
权利和权限
开放获取本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料包括在文章的创作共用许可中,除非在材料的信用线中另有说明。如果材料没有包含在文章的创作共用许可证中,而您的预期使用不被法律法规允许或超过允许的使用,您将需要直接获得版权持有人的许可。如欲浏览本许可证的副本,请浏览http://creativecommons.org/licenses/by/4.0/.“创作共用公共领域”豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用这篇文章
尹,J.,Sun,L.,Li,Y.et al。功能的识别BPMYB21和BPMYB61桦木三萜合成中对Meja和SA反应的转录因子。BMC植物杂志20.374(2020)。https://doi.org/10.1186/s12870-020-02521-1.
收到了:
公认:
发表:
关键字
- 桦木属platyphylla苏克人。
- MYB转录因子
- 表达分析
- 常用药用
- 功能注释