摘要
背景
雄性不育性是杂交种子生产和种质创新的有效性状。迄今为止,关于雄性不育的研究多集中在细胞质和隐性核不育方面,而对显性核雄性不育的研究较少,特别是棉花的显性核雄性不育研究较少。
结果
我们发现了一种天然雄性不育(MS)的海岛棉(g .取得)变异。遗传分析表明,该突变是由单个核基因的显性突变引起的。通过对MS型和野生型花药切片的细胞学比较观察,发现花粉母细胞四分体期(PMC)和四分体期(PMC)后花药的细胞差异。在MS花药中,花粉粒外壁无小刺,绒毡层空泡化,退化延迟,无功能性花粉粒。比较减数分裂、四分体、单核和双核花粉以及花粉成熟阶段的转录组,发现MS和WT之间有13783个非冗余差异表达基因(DEGs)。基于DEGs的数量、富集GO项和KEGG通路的分析,很明显,在四分体阶段和之后发生了显著的转录组变化,与细胞学观察一致,主要的差异是在淀粉、蔗糖、抗坏血酸盐、Aldarate,丙氨酸,天冬氨酸和谷氨酸,角质,亚氨酸和蜡的生物合成。WGCNA分析发现5个模块包含920个与花药发育高度相关的基因,其中绿色黄色模块包含54个与PMC减数分裂和四分体形成高度相关的基因。NAC转录因子(Gh_D11G2469)被鉴定为该模块的中心基因,这为进一步的功能描述提供了依据。
结论
我们发现MS性状是由一个显性核基因控制的,是由四分体阶段绒毡层的延迟降解引起的。比较转录组分析和基因网络构建发现了DEGs,丰富的氧化GO术语和代谢途径,以及可能与花药发育和MS性状相关的枢纽基因。这些结果有助于加深对显性基因雄性不育(DGMS)的认识,为棉花种质创新提供了源泉。
背景
雄性不育通常是指雌雄同株植物保持完全正常的雌性功能,而不能产生雄性配子的一种生物学性状。不利的生长条件、疾病或基因突变可导致男性不育。雄性不育通常分为细胞质性雄性不育(CMS)和核性雄性不育(GMS) [1].CMS由功能失调的线粒体基因引起,表现出典型的非孟德尔遗传[2].GMS由核基因控制,一般为隐性突变,影响植物的大量生物功能[3.].雄性不育是一种有效的授粉控制系统,是杂交制种的重要手段。了解花粉和花药的发育对有性生殖至关重要。许多研究探讨了不同植物花粉和花药发育过程中的生理生化变化,以及花粉发育相关基因调控和代谢机制[4,5,6,7,8].一些研究已经确定了参与花粉和花药发育的关键基因[9),如男性不育2(一份),CYP703A2,CYP704B1[10,11,12参与花药细胞分化和分裂、花粉细胞壁发育和花药开裂[13,14,15,16,17,18].
花药的形成经历一个非常复杂的过程。在小孢子细胞期,花药壁由四层组成:表皮层、内胚层、中间层和绒毡层[19].适当的程序性细胞死亡(PCD)导致花药壁层的受控降解,对功能花粉粒的发育非常重要。绒毡层是与花粉母细胞(PMC)直接相连的花药最内部的壁,其主要功能是为花粉发育提供充足的营养[20.],因此绒毡层的发育和及时降解对花粉壁的发育至关重要。一些基因已被证明与PCD和绒毡层降解有关。MS1在植物中编码PHD(植物血液域)转录因子拟南芥。的ms1突变体显示绒毡层细胞液泡化和延迟PCD,导致雄性不育[21,22].许多转录因子,如DYT1, TDF1而且AMS,已发现其参与了绒毡层降解和花药壁发育的调控。的dyt1突变体显示绒毡层细胞分裂和液泡化异常,导致异常四分体的形成[23].TDF1是一个R2R3MYB转录因子和下游的功能DYT1.的tdf1突变体出现液泡化绒毡层细胞,导致胼胝质酶分泌和降解异常[24].自动对盘及成交系统是一个基本的螺旋-环-螺旋(bHLH)转录因子。的自动对盘及成交系统突变体绒毡层细胞出现空泡化和延迟降解,小孢子外壁出现缺陷自动对盘及成交系统是绒毡层细胞发育和小孢子形成所必需的[25].
棉花是我国最重要的纤维作物,具有明显的杂种优势。然而,由于缺乏合适的F1种子雄性不育材料和人工阉割F1种子生产成本高,杂种优势在棉花生产中的应用受到了限制。CMS和GMS都有棉花。除了对MS突变体的遗传分析外,还应用了生理、生化、细胞学和转录组学研究来研究MS的机制。例如,在“咚A”MS突变体及其相应WT的花药不同发育阶段,发现激素生物生成和信号传递、碳和能量代谢以及花粉壁发育相关基因的表达存在差异[26].1355A,单次隐性突变引起的GMS突变体,单核期花药的花粉壁增厚,没有小刺[27].
尽管棉花的CMS和GMS研究都取得了进展,但仍急需新的MS种质资源,特别是那些稳定的GMS种质资源。在本研究中,我们报道了在海岛棉领域发现的一个新的天然GMS突变体。g .取得).GMS突变体的不育性状由一个显性核基因控制,并渗透到两个精英中g .取得还有陆地棉(g .分子)背景。我们进一步比较了陆地棉再生品种石大98-6及其近等基因质谱系石大98-6A的花药发育和转录组,以了解MS突变体的细胞表型和与MS性状相关的基因网络。
结果
雄性不育性状的遗传分析
发现雄性不育突变体后,将雄性不育性状转移到师大98-6 (g .分子)或新海53号(g .取得)背景,以不育分离株为母本,施大98-6或新海53为花粉供体,进行5次回交。在每一代BC1F1中,我们观察到不育和可育分离体的数量大致相等。所有可育分离株的后代都是可育的。这些结果表明,雄性不育性状是由一个仅能在杂合子中维持的显性核基因引起的。为了进一步证实这一假设,我们通过将不育(指定为石大98-6A或新海53A)或可育BC5F1分离体与循环亲本(石大98-6或新海53)或其他分离体杂交,生成了几个分离群体g .分子各种Xinluzao33(表1).通过花期和最终铃结实期的花药/花粉分析,分析了雄蜂育性的分离。由师大98-6A和师大98-6回交衍生的BC6F1群体,不育株1015株,可育株1004株,分离比为1:1 (χ2= 0.06 < χ20.05= 3.84,P= 0.86 > 0.05)。由新海53A ×新海53衍生的BC6F1群体和由石大98-6A ×新陆早33和新海53A ×新陆早33衍生的两个F1群体,不育和可育植株分离比均为1:1。此外,BC5F1可育株师大98-6与师大98-6杂交的后代均具有完全可育性(表5)1),表明BC5F1可育分离体为纯合子。这些结果表明,士大98-6或新海53的雄性不育是由单个核基因的显性突变引起的。
雄性不育突变体的表型特征
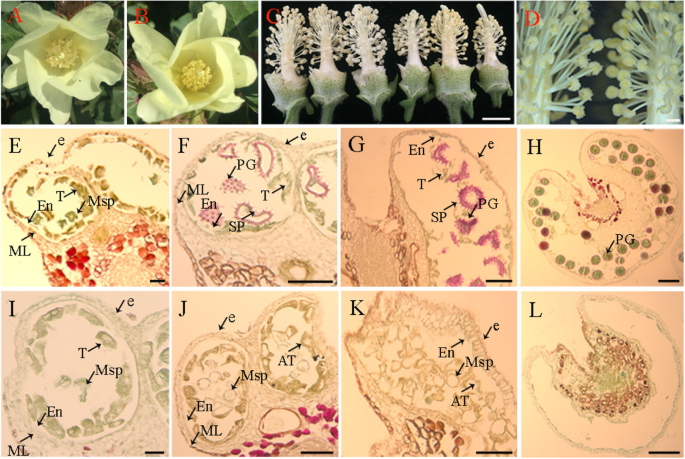
在营养生长和成熟植株中,MS(师大98-6A)和WT(师大98-6)在形态学上无明显差异。在生殖生长期间,MS和WT植株在开花时间、花瓣颜色、花芽大小等花器官上无明显差异,但在花药外观和发育上有明显差异。WT的花药呈淡黄色,在成熟阶段通常开裂产生花粉粒。1a).但MS花药呈暗黄色,成熟时未开裂(图1)。1b),因此在MS中没有产生花粉粒(图5)。1c, d).为了确定WT和MS在花药发育上的差异,我们解剖了WT和MS在不同发育阶段的花药,比较了细胞学上的花药发育。
花表型特征及花药显微观察一个。0 DPA野生型花。b。0dpa师大98-6A (MS)花。c。0 DPA无花瓣的花,左边3个和右边3个分别来自WT和MS植物。d。光镜下可育分离体(左)和MS分离体(右)的花药。e-l。WT和MS花药发育的比较。e。减数分裂期的可育花药切片。f。四分体期可育花药的剖面图。g。单核和双核花粉期可育花药切片。h。花粉成熟期的可育花药切片。我。减数分裂期雄性不育花药切片。j。四分体期雄性不育花药切片。k。单核和双核花粉期雄性不育花药切片。l花粉成熟期可育雄性不育花药切片。e,表皮;毫升,中间层;恩,内层;T,毯;Msp,小孢子;在异常毯;SP,微刺凸;PG,花粉粒。规模的酒吧c而且d分别表示1 cm和1000 μm;规模的酒吧e而且我代表20μm;规模的酒吧f, g, j而且k代表50μm;规模的酒吧h而且l代表100μm
我们按照之前的方法,通过石蜡切片的光学显微镜观察来确定花药的发育阶段[28].在PMC减数分裂阶段,MS和WT的花药细胞学特征相似,细胞结构无明显差异(图1)。1e, i).在四分体期首次观察到MS花药的明显缺陷。此时野生型花药小孢子释放,花粉粒不饱满,呈月牙状,外壁突出有小刺,被红花O染成粉红色(图1)。1f),而在MS花药中,小孢子也能正常释放,但小孢子外壁发育出现明显异常,包括无法形成突出的小刺和紧密空泡的绒毡层细胞(图1)。1j).在单核和双核花粉期,WT的花粉粒开始积累淀粉,用Fast green FCF将淀粉染成绿色,花粉粒外壁有正常的刺突,被Safranine O染成粉红色,绒毡层被吸收利用为营养物质(图1)。1g).在MS突变体中,绒毡层崩解,不能被花粉粒作为营养物质完全吸收,降解延迟,小孢子无物质积累(Fast Green FCF未染色)。此外,花粉粒没有刺突,无法被红花O染成粉红色,最终流产(图5)。1k).在成熟阶段,用Safranine O和Fast Green FCF对WT花粉粒进行着色(图5)。1h),而在MS花药中只观察到有缺陷的花粉壁腔,没有花粉粒。1l)。
转录组分析
为了探索MS突变体花药败育的分子机制,我们比较了上节所述的减数分裂、四分体、单核和双核花粉、花粉成熟四个发育阶段的WT和MS花药的转录组,考虑到在四分体阶段开始观察到花药细胞表型的差异。共对24个文库(2个基因型× 4个发育阶段× 3个生物学重复)进行测序,共获得1,161,509,206个原始reads。所有样品中核苷酸质量分数大于30的Q30序列为92.94%,GC含量为43.22%。对原始reads进行过滤,去除低质量reads,最终共使用1,145,504,498个clean reads进行对齐。大约96.04%的清洁reads可以与TM-1参考基因组对齐(详见方法),其中~ 89.66%的reads是唯一对齐的3.:表S1)。
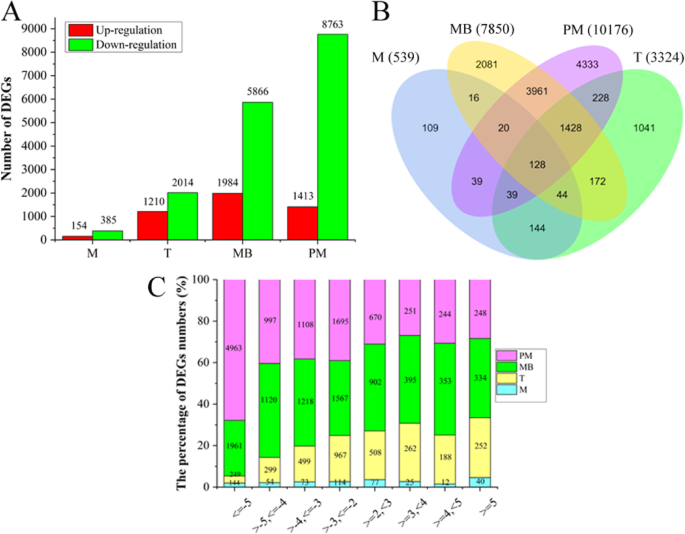
在4个花药发育阶段,MS和WT之间共有21789个基因表达差异,其中下调表达基因17028个(78.15%),上调表达基因4761个(21.85%)(|log)2(折变)|≥2和p邻接的< 0.05;无花果。2a).与WT相比,MS在所有四个发育阶段的下调基因数量都远高于上调基因数量,尤其是在两个发育后期(图1)。2a).在21789个DEGs中,有13783个是唯一的,其中109个、1041个、2081个和4333个分别是减数分裂、四分体、单核和双核花粉和成熟花粉阶段所特有的,128个基因在所有四个发育阶段都有差异表达(图1)。2b).在上调基因(MS vs WT)中,2157个(45.31%)基因表达变化2-3倍,874个(18.35%)基因表达变化超过5倍。在下调基因中,4343(25.51%)表达差异2-3倍,7317(42.97%)>表达差异5倍(图4)。2c)。
qRT-PCR分析证实DEGs
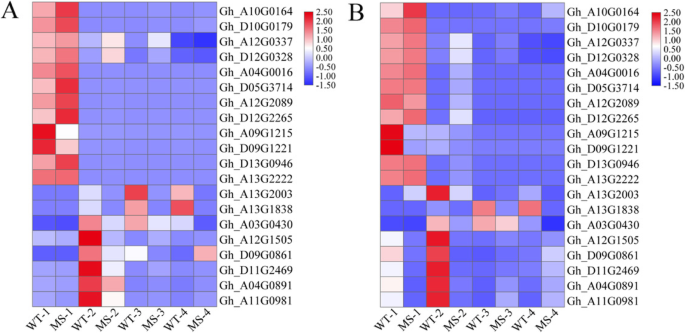
为了验证RNA-seq结果和鉴定的DEGs,我们选择了20个基因进行实时定量聚合酶链反应(qRT-PCR)验证,包括12个与绒毡层和花药发育相关的基因,2个基因(Gh_A13G2003而且Gh_A13G1838)编码抗坏血酸过氧化物酶,编码NAC结构域47蛋白(Gh_D11G2469)、mlp样蛋白423 (Gh_A04G0891, myb结构域蛋白2 (Gh_A11G0981),类nacl,由AP3/PI激活(Gh_A12G1505)、依赖谷氨酰胺的天冬酰胺合酶1 (Gh_D09G0861)及核糖体蛋白(Gh_A03G0430)(图。3.).除了Gh_A13G2003,所有其他基因在qRT-PCR之间的表达谱呈现相同的趋势(图。3.a)和RNA-Seq(图。3.b)在花药发育的其他四个阶段,证实了RNA-seq结果的可靠性。
qRT-PCR (a)和RNA-seq分析(b)测定的20个选定基因在花药四个发育阶段的相对表达量的热图。DYT1(Gh_A10G0164而且Gh_D10G0179),自动对盘及成交系统(Gh_A12G0337而且Gh_D12G0328),MYB103(Gh_A04G0016而且Gh_D05G3714),MS1(Gh_A12G2089而且Gh_D12G2265),一份(Gh_A09G1215而且Gh_D09G1221),TDF1(Gh_D13G0946而且Gh_A13G2222)和编码抗坏血酸过氧化物酶的基因(Gh_A13G2003而且Gh_A13G1838)、核糖体蛋白(Gh_A03G0430),含有47蛋白的NAC结构域(Gh_D11G2469)、mlp样蛋白423 (Gh_A04G0891, myb结构域蛋白2 (Gh_A11G0981),类nacl,由AP3/PI激活(Gh_A12G1505)和依赖谷氨酰胺的天冬酰胺合酶1 (Gh_D09G0861).MS:师大98-6A, WT:师大98-6。MS-1和WT-1代表减数分裂期,MS-2和WT-2代表四分体期,MS-3和WT-3代表单核和双核花粉期,MS-4和WT-4代表花粉成熟期
DEGs基因本体分析
利用MS和WT在4个不同花药发育阶段的遗传差异进行基因本体(GO)分析。采用校正的标准P价值≤0.05时,我们发现118个GO术语富集了13783个deg(附加文件4:表S2),并分别鉴定出5、95、125和107个在减数分裂、四分体、单核和双核花粉和花粉成熟阶段富集的GO项,其中每个相应阶段有2、33、34和21个独特的GO项(图2)。4a).在减数分裂阶段,氧化石墨烯富集项的数量明显减少(图中显示的是氧化石墨烯富集前30项,而不是富集的5项。4b)高于其他三个阶段(图。4c).减数分裂期和四分体期均富集3项氧化石墨烯,四分体期和单核、双核花粉期均富集6项氧化石墨烯,单核、双核花粉期和花粉成熟期均富集33项氧化石墨烯,四分体期和花粉成熟期均富集1项氧化石墨烯。从四分体期到花粉成熟期共富集了52个氧化石墨烯项,四个阶段均未发现共同富集的氧化石墨烯项(图1)。4a).减数分裂期与其他三个阶段的氧化石墨烯含量差异较大5:表S3)。例如,减数分裂阶段富集的两个生物过程项与天冬酰胺代谢有关,而其他三个阶段富集的生物过程项主要与细胞分化和细胞壁组织或生物发生有关(图1)。4b, c)。这些结果以及在四个发育阶段识别的deg数量表明,MS和WT之间花药发育的显著差异很可能从四分体阶段开始,与细胞学观察一致。
DEGs的KEGG通路
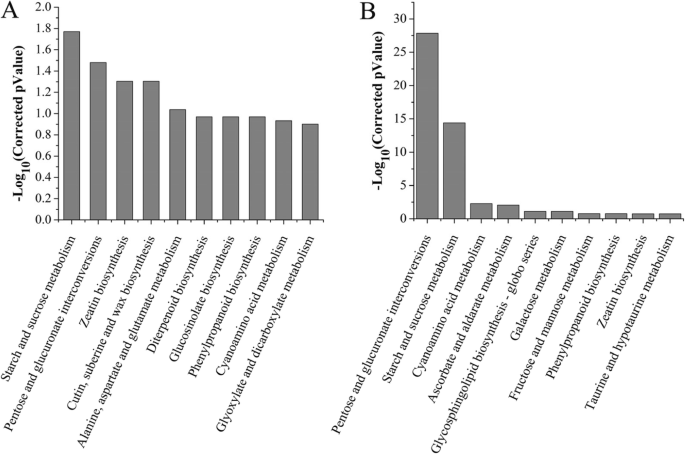
为了进一步分析DEGs,我们进行了通路分析。对所有13,783个非冗余deg的分析发现了109个京都基因与基因组百科(KEGG)通路(附加文件)6:表S4)。许多显著变化的途径与淀粉和蔗糖的代谢、植物-病原体相互作用、半乳糖代谢、内吞作用的生物合成、倍半萜和三萜、肌醇磷酸盐代谢、苯丙类生物合成和吞噬体有关6表S4),其中许多与绒毡层和花粉壁的发育有关。减数分裂阶段富集的KEGG通路包括淀粉、蔗糖、丙氨酸、天冬氨酸和谷氨酸的代谢,戊糖和葡糖酸盐的相互转化,玉米素、角质、亚嘌呤和蜡的生物合成(图1)。5a).参与玉米素生物合成的DEGs包括编码细胞分裂素氧化酶/脱氢酶的基因(Gh_D04G0688)和don-glucosyltransferase (Gh_D08G1604).在参与角质、亚分泌和蜡代谢的DEGs中,编码荷荷巴酰基辅酶a还原酶相关雄性不育蛋白(Gh_A09G1215,Gh_D09G1221)、细胞色素P450 (Gh_D12G2271)和热红蛋白相关家族蛋白(Gh_D10G1585)(额外的文件6:表S4,附加文件1:图印地)。在四联体阶段,与淀粉、蔗糖、氰基氨基酸、抗坏血酸盐和aldarate代谢以及戊糖和葡萄糖醛酸盐相互转化相关的通路富集(图。5B),包括编码丝氨酸羟甲基转移酶的基因(Gh_A11G1879), BS-glucosidase (Gh_D07G2431,Gh_D01G2109)和抗坏血酸过氧化物酶(Gh_A13G2003)(额外的文件6:表S4,附加文件1:图就是S1C)。单核和双核花粉期富集的途径与醚脂和苯丙氨酸代谢有关,包括编码磷脂/甘油酰基转移酶(Gh_A01G0955)和过氧化物酶(Gh_A08G2028而且Gh_D11G0463)(额外的文件6:表S4,附加文件1:图S1D)。在花粉成熟阶段鉴定出具有21个DEGs的萜类合成酶途径,与倍半萜和三萜的生物合成有关(附加文件6:表S4,附加文件1:图S1E)。这些结果表明,棉花花药发育受一个复杂的基因网络控制,该基因网络调节多种代谢途径。
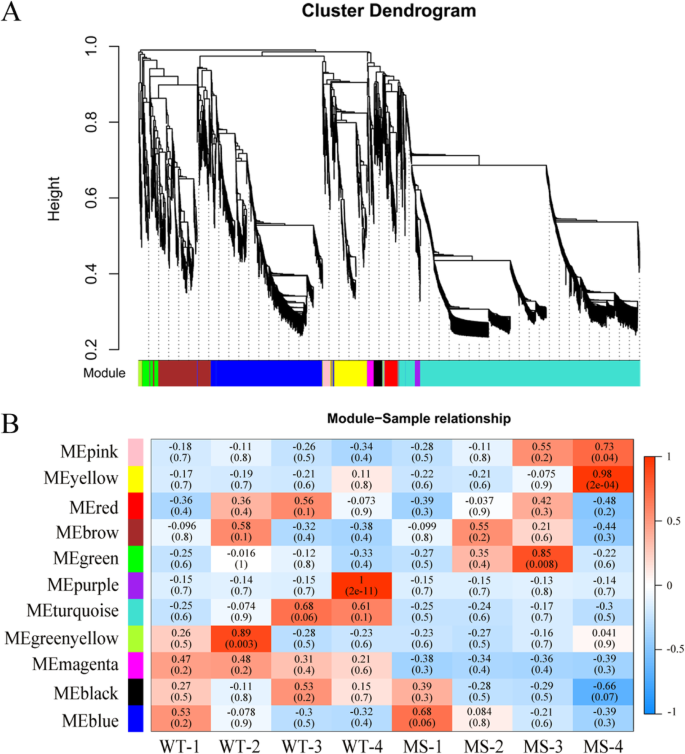
WGCNA基因网络分析
加权相关网络分析(WGCNA)是一种描述基因与不同样本关联模式的系统生物学方法。为了识别与花药发育高度相关的特定基因,WGCNA利用13783个非冗余deg和所有生物样本生成了共表达网络。共有11个基因模块与不同样本的特异性表达谱相关(图。6a).在11个基因模块中,5个(黄绿色、绿色、紫色、黄色和粉色)在WT或MS中与四核、单核和双核花粉或花粉成熟阶段显著相关,没有一个基因模块与减数分裂阶段显著相关,尽管蓝色模块在MS中略显著相关(图4)。6b).带有54个基因的黄绿色模块与WT的四分体阶段(师大98-6)高度相关。绿色(191个基因)和绿松石(3262个基因)模块分别与MS和WT的单核和双核花粉期显著或极显著相关。紫色模块中有78个基因与WT花粉成熟阶段显著相关。黄色模块(492个基因)和粉色模块(105个基因)与MS花粉成熟阶段显著相关。6b)。
对绿黄色模块的54个DEGs进行了10个GO项的富集,包括天冬酰胺合成酶(谷氨酰胺水解)活性、天冬酰胺代谢过程、天冬酰胺生物合成过程、天冬氨酸家族氨基酸生物合成过程和天冬氨酸家族氨基酸代谢过程(附加文件)2:图S2A)。在减数分裂和四分体阶段,黄绿色模块与丙氨酸、天冬氨酸和谷氨酸代谢高度相关P价值= 9.15 × 10−3, 3个基因)和二萜生物合成(修正P价值= 1.38 × 10−22个基因)(附加文件2:图开通)。KEGG通路分析也在每个其他模块的基因上进行(附加文件7:表S5),以及它们的每千基转录本每百万映射读取(FPKM)值的片段在附加文件中显示8:表S6。
雄性不育共表达基因网络的构建及枢纽基因的鉴定
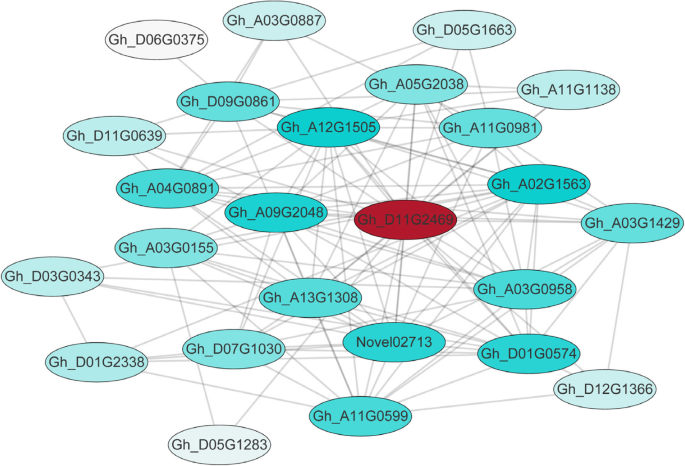
根据细胞学观察,WT和MS之间花药发育的差异首先出现在四分体阶段,因此我们的研究重点是黄绿色模块,因为它在WT中与四分体阶段显著相关,而在MS中其大部分基因在四分体阶段显著下调(图1)。6b).在这些下调基因中,我们进一步关注了在减数分裂过程中同样下调的基因,因为它们可能与绒毡层的降解和早期花粉粒的形成有关。在黄绿色模块中,我们基于特征基因连接的标准识别了25个枢纽基因(K我)值≥0.9,边权值≥0.4。主要的中心基因包括编码NAC结构域蛋白47 (Gh_D11G2469)、mlp样蛋白423 (Gh_A04G0891, myb结构域蛋白2 (Gh_A11G0981)及依赖谷氨酰胺的天冬酰胺合酶1 (Gh_D09G0861)(图。7、表2).
绒毡层和花药发育相关基因
绒毡层在花粉发育过程中起着重要作用。绒毡层发育异常会导致花粉败育。在拟南芥,许多基因和转录因子,包括Dyt1, tdf1, ams, myb103而且MS1、绒毡层的调节发育已有报道[29].在我们的花药转录组数据中,这些基因的棉花同源体聚集在蓝色模块中(图1)。6b),与MS的减数分裂阶段有一定的相关性(图1)。3.b).就个体而言,这些绒毡层发育相关基因在WT和MS的减数分裂阶段表达无差异,但在MS的四分体阶段显著上调(图1)。3.b),表明这些基因可能有助于MS特质,尽管它们可能不是MS特质的原因。拟南芥和水稻其他与花药和绒毡层发育相关的棉花同源基因在减数分裂和/或四分体阶段也有差异表达。例如,一份基因(Gh_A09G1215,Gh_D09G1221)编码荷荷巴酰基辅酶a还原酶相关雄性不育蛋白(图。3.b)与WT相比,MS在减数分裂和四分体阶段表达下调ACOS5(Gh_A03G1091,Gh_D02G1514)编码酰基辅酶a合成酶5CYP703A1(Gh_A12G1506,Gh_D12G2768),CYP703A2(Gh_A12G1014,Gh_D12G1132)编码细胞色素P450在MS花药四分体期上调(图。3.b)。
讨论
雄性不育可以防止自交并允许异体交配,从而通过消除阉割过程降低杂交种子生产的成本。本研究中描述的雄性不育性状是由单个核基因的显性突变控制的1),对花药和花粉发育产生不利影响,导致花粉完全败育(图5)。1).该突变体在不同遗传背景和不同环境条件下均表现稳定,在棉花杂种优势育种中具有较高的应用价值。在育种中,循环选择是通过多次杂交和选择,改善作物群体遗传结构,提高群体中有利基因出现频率的有效策略。它在作物改良中起着重要的作用,因为不同种质的有利基因可以通过循环选择集中在一个个体上[30.,31,32].我们将该性状导入到不同的优良棉花遗传背景中,如师大98-6和新海53。利用优质MS基因渗入种质作为母本,可以方便地进行大量杂交,为新种质资源的创建提供了有力的工具。
MS突变体没有产生任何花粉粒,这可能是由于在减数分裂阶段和四分体阶段之间的发育缺陷造成的,因为在四分体阶段观察到MS和WT之间最初的花药发育差异(图5)。1f, j).在四分体期,MS花药绒毡层空泡化。在单核和双核阶段,与WT花药相比,MS花药有更多的绒毡层残留或剩余绒毡层细胞,花粉壁变厚(图5)。1k),花粉粒无小刺。1j, k).绒毡层是与花粉母细胞直接相连的花药最内壁,在花粉发育过程中起着重要作用。随着小孢子的形成,绒毡层细胞开始功能分化,形成具有分泌功能的细胞。绒毡层的降解为小孢子的发育提供了必要的酶和营养物质[33,34].绒毡层降解因此需要非常精确的调控,绒毡层的早熟或延迟降解可能导致小孢子流产[35].因此,我们推测,延迟绒毡层降解或功能花粉粒发育失败可能是我们发现的MS性状的潜在原因。
已有研究表明,调控绒毡层发育的转录因子基因突变可导致绒毡层空化、不规则降解和花粉壁缺陷拟南芥[36].基因网络或级联,DYT1-TDF1-自动对盘及成交系统-MYB103-MS1被认为参与了植物绒毡层发育和降解的调控拟南芥[21,34].TDF1是一个R2R3MYB转录因子基因。在答:芥的绒毡层细胞tdf1突变体有严重的形态空泡,不能转运到分泌绒毡层[37].其水稻同源(OsTDF1起了类似的作用答:芥[38].突变OsTDF1导致水解酶、疏水蛋白、纤维素、半纤维素和果胶聚合物发生变化,对花粉壁的发育起作用。在MS花药中,拟南芥棉花同源基因的表达水平TDF1等网络中调控绒毡层发育和降解的基因在四分体阶段均上调,提示MS花药中绒毡层在此阶段仍在降解,与观察到的MS花药中绒毡层延迟降解表型一致(图1)。1j, k)。
在大米和答:芥,活性氧(ROS)调节绒毡层中的PCD,从而影响雄性配子的发育[39,40].为了维持ROS的动态平衡,植物中含有产生ROS的酶(如NADPH氧化酶和过氧化物酶)和去除ROS的酶(如抗坏血酸过氧化物酶和谷胱甘肽过氧化物酶)。抗氧化剂,如抗坏血酸和谷胱甘肽,主要作用于清除羟自由基和单线态氧[41].根据KEGG分析,四分体期DEGs中抗坏血酸和谷胱甘肽相关基因富集。5b), MS中基因表达水平低于WT(附加文件1:图S1C),这可能导致MS突变体细胞中ROS的清除失败。因此,MS突变体细胞内的ROS稳态无法维持,导致花药发育的关键期被破坏,导致植株发生不育。GO分析表明,在减数分裂阶段,天冬酰胺合成酶(谷氨酰胺水解)活性、天冬酰胺生物合成和代谢过程均较丰富。4b,额外的文件2:图S2A), KEGG分析发现绿黄色模块中富含谷氨酸、天冬氨酸和谷氨酸代谢2:图S2)。
基于WGCNA分析(表2)和相关网络图(图5)。7),编码含有NAC结构域的蛋白质(Gh_D11G2469)被鉴定为与减数分裂和四分体阶段花药发育高度相关的候选枢纽基因。Gh_D11G2469是同源拟南芥基因AT1G61110而且AT3G04070.AT1G61110GUS融合分析显示,该蛋白在绒毡层中特异性表达。基因突变导致绒毡层和花粉发育缺陷,最终导致雄性不育[42].的功能AT3G04070尚未报道。水稻同源物的下调,Os07g37920的,Gh_D11G2469减少活花粉粒比例,引起雄性不育[43].考虑到这些被证明的角色拟南芥而水稻同源体在花药和花粉发育中的作用Gh_D11G2469在棉花中,花药和花粉的发育需要进一步的表征。
结论
我们描述了在海岛棉中发现的一种由单一显性核基因控制的天然雄性不育突变。不育花药与可育花药的细胞学比较表明,雄性不育是由减数分裂到四分体形成过程中发育缺陷引起的花粉败育所致。比较转录组分析支持细胞学观察结果。基因网络和通路分析确定了调控花药和花粉发育的基因模块和候选基因。MS特质已渗透到精英群体中g .分子而且g .取得为培育杂交优势杂交组合、杂交种子生产和种质资源创新提供了新的种质资源。
方法
植物材料
1992年夏天,我们发现了一株雄性不育的海岛棉花(g .取得).用可育植物的花粉对不育植株的花进行授粉,以保持不育特性。F1群体的可育植株和不育植株数量大致相当,从可育F1植株衍生的F2后代均可育,表明雄性不育性状由单一显性基因突变控制。本研究使用的雄性不育突变体由石河子大学棉花研究所提供。首先,将海岛棉的雄性不育性通过回交遗传给陆地棉,然后将不育性状导入陆地棉师大98-6 (g .分子)及海岛棉新海53号(g .取得采用回交(6次)方法分别选育近等基因雄性不育系师大98-6A和新海53A。利用石大98-6A或新海53A与陆地棉品种新陆早33杂交的2个群体进行了遗传分析1).分离群体在新疆石河子大学棉花研究所试验田内培养。用于显微镜观察和转录组分析的植株(WT和MS)生长在28-30°C, 16 L: 8 D光周期方案,相对湿度60%的人工气候室中。
组织学分析
从MS和WT植物中采集直径< 9 mm的不同大小的花蕾,利用光学显微镜对减数分裂、四分体、单核和双核花粉以及花粉成熟阶段的花药进行鉴定[28].分别采集四个发育阶段的花药,用液氮冷冻,- 80°C保存,以备后续试验。组织学观察:样品在FAA(5%福尔马林、5%冰醋酸、70%酒精)中固定,随浓度增加的酒精(70、85、95、100%)脱水各1 h,然后以浓度增加的二甲苯(1/2酒精+ 1/2二甲苯、1/4酒精+ 3/4二甲苯和纯二甲苯)处理各1 h,最后浸入蜡中包埋。嵌入后的样品被切成厚度为8 μm的薄片。一滴粘稠的片剂和酱汁和切片一起滴在干净的玻片上,然后烤干。样品用1%藏红花O(配置85%酒精)和1% Fast Green FCF法(配置95%酒精)脱蜡染色,然后脱水透明,安装光学显微镜观察。
RNA提取、文库构建和RNA- seq
不同阶段采集的花药送往北京诺维根生物信息技术有限公司进行RNA-Seq。用纳米分光光度计和安捷伦2100生物分析仪测定RNA样品的纯度和完整性。用1%琼脂糖凝胶电泳进一步检测RNA完整性和可能的污染。每个样品共使用3 μg总RNA用于RNA-seq文库制备(每个发育阶段有3个生物重复)。测序使用Illumina HiSeq 4000测序平台,有150个碱基对(bp)对端(PE)读取。
数据处理
使用Perl脚本对FASTq格式的原始数据进行处理,以确定数据的质量,包括GC内容的百分比、Q20和Q30。对低质量的读取进行过滤和消除,以获得清洁的读取以供后续分析。索引的g .分子用Bowtie v2.2.3构建参考基因组,从CottonGen数据库下载基因模型注释文件(http://www.cottongen.org).生成的干净读取映射到g .分子TM-1基因组(44使用TopHat v2.0.12。Cufflinks软件使用FPKM计算单个基因的表达水平[45].利用DESeq软件,通过负二项分布和Benjamini和Hochberg法计算错误发现率(FDR),以及调整后的方法确定差异基因表达p价值.的调整p价值以< 0.05为样品间差异鉴别阈值。
DEGs和KEGG通路的功能注释
基于与被标注对象的同源性对DEGs的功能进行标注拟南芥基因使用TAIR (拟南芥信息资源)。GOseq [46]用于对DEGs进行氧化石墨烯功能富集分析。利用KOBAS 2.0软件进行KEGG富集。
基因网络的构建与枢纽基因的筛选
WGCNA R包[47]被用来构建与花药发育相关的共表达网络。在此基础上筛选集线器基因K我值和高权重值。使用Cytoscape 3.6.1绘制相关网络。
DEGs的定量RT-PCR验证
根据之前报道的协议,进行定量RT-PCR (qRT-PCR)验证DEGs [48].根据cdna序列用NCBI Primer-BLAST (https://www.ncbi.nlm.nih.gov/tools/primer-blast/)(额外的文件9:表S7)。用RNA提取试剂盒(Takara)从样品中提取总RNA。将总RNA (1 μg)变性后,用PrimeScript™RT试剂Kit与gDNA Eraser (Takara)在42°C 15 min, 58°C 5 s逆转录。采用Power SYBR Green PCR Master Mix在Light Cycler®480II上进行qRT-PCR, 10 μl PCR反应包含cDNA 1 μl、SYBR Green PCR Master Mix 5 μl、每对目标引物10 μl和H2O. PCR条件为:95°C预孵育5 min, 94°C 15 s, 58°C 20 s, 72°C 20 s,循环40次,然后95°C熔解5 s, 65°C 1 min, 97°C 1 min,最后在40°C冷却10 s。来自三个独立生物学实验的三个技术重复用于qRT-PCR分析。根据2−∆∆CT方法与泛素(GhUBI, XM_012634824)作为内参基因[49].
缩写
- CMS:
-
胞质不育
- 总经理:
-
基因的雄性不育
- 为副总经理:
-
显性核雄性不育
- PMC:
-
花粉母细胞
- bHLH:
-
基本helix-loop-helix
- 博士:
-
植物hemoedomain
- 纤毛运动:
-
程序性细胞死亡
- 度:
-
差异表达基因
- 存在:
-
定量实时聚合酶链反应
- 走:
-
基因本体论
- KEGG:
-
京都基因和基因组百科全书
- WGCNA:
-
加权相关网络分析
- K我:
-
Eigengene-based连接
- FPKM:
-
每千碱基转录片段每百万映射读取
- ROS:
-
活性氧
- 体育:
-
Paired-end
- 罗斯福:
-
错误发现率
- WT:
-
肥沃系(师大98-6)
- 女士:
-
雄性不育突变系(师大98-6A)
参考文献
张丽娟,张丽娟,张丽娟。花发育的线粒体调控。线粒体。2008;8(1):74 - 86。
张红华,程新军,张立军,刘qq,顾敏明,唐淑珍。鉴定wa型细胞质雄性不育粳稻育性恢复的Rf5和Rf6位点周围基因(栽培稻)线。Euphytica。2019;215(3):44。
张玉军,陈娟,刘建军,夏MX,王文申芙。棉花花药早期发育的转录组分析揭示了主要代谢途径的雄性不育基因。植物生长学报,2015;34(2):223-32。
刘志华,石晓燕,李松,张丽丽,宋晓燕。在异核异质雄性不育小麦中,氧化应激和异常程序性细胞死亡与花粉败育有关。植物科学学报2018;9:595。
恩格克,赫澈,罗奇,等。花药特异性碳水化合物供应与代谢工程雄性不育的恢复。中国生物医学工程学报2010;61(10):2693-706。
黄晓明,王晓明,王晓明,等。植物种皮和花粉发育过程中gpi -脂质转移蛋白的研究进展拟南芥.杂志杆菌。2014;152(1):32-42。
谢凯,黄ahc。芸苔属绒毡层中的绒小体积累内质网衍生的类黄酮和烷烃,并将其输送到花粉表面。植物细胞。2007;19(2):582 - 96。
陈光华,叶晓霞,张淑云,朱德思,袁丽丽,侯建峰,王刚。芜菜可育花蕾与不育花蕾的转录组比较分析(芸苔属植物定l .)。BMC基因组学。2018;19(1):908。
Wilson ZA, Zhang DB。从拟南芥对水稻:花粉发育的途径。中国生物医学工程学报2009;60(5):1479-92。
陈伟伟,于晓华,张凯胜,史建新,Oliveira SD, Schreiber L, Shanklin J,张东宝。雄性不育2编码花粉外壁发育所需的质体定位脂肪酰基载体蛋白还原酶拟南芥.植物杂志。2011;157(2):842 - 53年。
石晶,谭海霞,余晓华,刘云云,梁文wq, Ranathunge K, Franke RB, Schreiber L,王玉军,凯元,尚克林J,马红,张东宝。缺陷花粉壁是水稻花药和小孢子发育所必需的,并编码脂肪酰基载体蛋白还原酶。植物细胞。2011;23(6):2225 - 46。
徐佳,丁志伟,Barrena GZ,史建新,梁文wq,袁智,Werck-Reichhart D, Schreiber L, Wilson ZA,张东宝。夭折的小孢子作为花粉壁形成的主要调节剂拟南芥.植物细胞,2014,26(4):1544 - 56。
Wijeratne AJ,张伟,孙玉军,刘力龙,Albert R,郑志刚,Oppenheimer DG,赵德泽,马洪拟南芥野生型和突变型花药:洞察花药细胞分化和调节网络。植物j . 2007;(1): 52 14-29。
Thorstensen T, Grini PE, Mercy IS, Alm V, Erdal S, Aasland R, Aalen RB。的拟南芥集合结构域蛋白ASHR3参与雄蕊发育并与bHLH转录因子相互作用夭折的小孢子(自动对盘及成交系统).植物分子生物学,2008;66(1-2):47-59。
楼燕,徐晓峰,朱军,顾金珺,Blackmore S,杨楠楠。绒毡层AHL家族蛋白TEK决定花粉壁内的内泌素形成。Nat Commun。2014;5:3855。
Colcombet J, boison - dernier A, Ros-Palau R, Vera CE, Schroeder JI。拟南芥体细胞胚胎发生受体激酶1而且2是绒毡层发育和小孢子成熟所必需的。植物细胞。2005;17(12):3350 - 61。
蒋军,张铮,曹军。花粉壁发育:相关酶和代谢途径。植物医学杂志。2013;15(2):249 - 63。
杨振发,刘亮,孙丽萍,于平,张培萍,阿巴斯阿,向新军,吴文祥,张毅刚,曹丽丽,程硕。OsMS1作为转录激活因子调节水稻程序性绒毡层发育和花粉外壁形成。植物分子生物学2019;99(1-2):175-91。
Zini LM, Galati GB, Solís SM, Ferrucci MS.无Sapindaceae(无Sapindaceae) Melicoccus lepidopetalus的花药结构和花粉发育:家族雌雄异株的进化途径。植物区系形态分布与功能生态学报,2012;207(10):712-20。
张伟,孙玉军,Timofejeva LM,陈cb, Grossniklaus U,马洪拟南芥绒毡层的发育和功能功能失调的TAPETUM1(DYT1)编码bHLH转录因子。发展。2006;133(16):3085 - 95。
Ito T, Nagata N, Yoshiba Y, Takagi MO, Ma H, Shinozaki K.拟南芥雄性不育1编码一个博士型转录因子,调节花粉和绒毡层发育。植物细胞。2007;19(11):3549 - 62。
杨春春,Barrena GV, Conner K, Wilson ZA。男性STERILITY1是绒毡层发育和花粉壁生物合成所必需的。植物细胞。2007;19(11):3530 - 48。
冯培明,陆德华,彭亚波,孙玉军,宁刚,马洪拟南芥花药转录组的DYT1对花粉的开发。植物j . 2012; 72(4): 612 - 24。
朱军,娄勇,徐晓峰,杨楠楠。绒毡层发育和功能的遗传途径拟南芥.植物生物学杂志,2011;53(11):892-900。
徐军,杨春春,袁铮,张德升,刚吾美,丁志伟,梁文蔚,张东宝,威尔逊扎。的夭折的小孢子雄性减数分裂后生殖发育需要调节网络拟南芥.植物细胞。2010;22(1):91 - 107。
魏MM,宋MZ,范SL,于SX。利用数字基因表达谱分析遗传雄性不育和野生型棉花花药发育过程中差异表达基因的转录组学分析。BMC基因组学。2013;14(1):97。
吴永利,闵颖,吴振春,杨亮,朱丽峰,杨晓霞,袁大庆,郭晓春,张晓龙。棉花雄性不育系1355A花粉壁缺陷导致雄性不育。Sci众议员2015;5:9608。
刘峰,马丽华,王玉伟,李玉军,张学友,薛峰,聂晓华,朱庆华,孙杰。GhFAD2-3是否需要进一步发展陆地棉.植物生物学杂志2019;19(1):1 - 17。
顾金珺,朱军,余勇,滕晓东,娄勇,徐晓峰,刘建林,杨楠楠。DYT1直接调节的表达TDF1用于植物绒毡层的发育和花粉壁的形成拟南芥.植物j . 2014; 80(6): 1005 - 13所示。
杨燕,包少云,周晓红,刘杰,庄勇。比较转录组分析揭示的茄子雄性不育相关关键基因及途径。植物生物学杂志,2018;18(1):1 - 13。
陈丽,刘永刚。作物雄性不育与育性恢复。植物学报(自然科学版)2014;65(1):579-606。
Bohra A, Jha UC, Adhimoolam P, Bisht D, Singh NP。田间作物杂交育种中的细胞质雄性不育。植物细胞学报2016;35(5):967-93。
万丽丽,查文杰,程晓燕,刘超,吕亮,刘春霞,王志强,杜斌,陈荣泽,朱丽丽,何志强。水稻β-1,3-葡聚糖酶基因Osg1花粉发育过程中胼胝质降解所必需的。足底。2011;233(2):309 - 23所示。
王晓燕,王晓燕。孢粉素合成与花粉外壁发育的遗传调控。植物学报,2012;62(1):437-60。
Balk J, Leaver CJ。的PET1-CMS向日葵线粒体突变与细胞程序性过早死亡和细胞色素c释放有关。植物细胞。2001;13(8):1803 - 18。
索伦森AM, Kröber S, Unte US, hujser P, Dekker K, Saedler H.拟南芥夭折的小孢子(自动对盘及成交系统)基因编码一个MYC类转录因子。植物j . 2003; 33(2): 413 - 23所示。
陈红,李红,高建峰,姜红,王超,关艳芳,杨楠楠。绒毡层发育与功能缺陷是花药发育和小孢子成熟的绒毡层功能所必需的拟南芥.植物j . 2008; 55(2): 266 - 77。
蔡芳芳,朱军,楼燕,郭志林,熊士祥,王凯,杨楠楠。功能分析OsTDF1揭示了水稻和水稻之间绒毡层发育的保守遗传途径拟南芥.Sci公牛。2015;60(12):1073 - 82。
胡立峰,梁文wq,尹春春,崔旭,宗杰,王旭,胡建平,张东宝。大米MADS3在花药发育后期调节ROS内稳态。植物细胞。2011;23(2):515 - 33所示。
谢海涛,万志英,李松,张颖。NADPH氧化酶时空生成活性氧对植物绒毡层程序性细胞死亡和花粉发育至关重要拟南芥.植物细胞,2014,26(5):2007 - 23所示。
Gechev TS, Van Breusegem F, Stone JM, Denev I, Laloi C.活性氧作为调节植物胁迫反应和程序性细胞死亡的信号。28 Bioessays。2006;(11):1091 - 101。
绒毡层特异性NAC转录因子参与花粉发育。麦迪逊:第十六届国际会议拟南芥研究。麦迪逊:威斯康辛大学;2005.
didistelfeld A, Pearce SP, Avni R, Scherer B, Uauy C,活塞F, Slade A,赵瑞瑞,Dubcovsky J.小麦和水稻同源NAC转录因子的发散功能。植物分子生物学杂志,2012;78(4-5):515-24。
张志忠,胡勇,蒋伟坤,方磊,关晓燕,陈金鼎,张剑斌,Saski CA, Scheffler BE, Stelly DM,等。同种异体四倍体棉花的测序(陆地棉l . acc。TM-1)提供了纤维改进的资源。生物科技Nat》。2015;33(5):531 - 7。
Trapnell C, Williams BA, Pertea G, Mortazavi A, Kwan G, Baren MJ, Salzberg SL, Wold BJ, Pachter L. RNA-Seq转录本组装和量化揭示了细胞分化过程中未注释的转录本和亚型转换。生物科技Nat》。2010;28(5):511 - 5。
Young MD, Wakefield MJ, Smyth GK, Oshlack A. RNA-seq的基因本体论分析:考虑选择偏差。基因组医学杂志。2010;11 (2):R14。
Langfelder P, Horvath S. WGCNA:加权相关网络分析的R包。BMC生物信息学。2008;9(1):559。
杨亮,吴永利,张明,张建芳,Stewart JM,邢春珍,吴建勇,金世祥。CMS-D8棉花细胞质雄性不育系和保持系的转录组、细胞学和生化分析。植物分子生物学杂志,2018;97(6):537-51。
程晓强,朱晓峰,田文伟,程文华,Hakim SJ,金士祥,朱红华。陆地棉多胺氧化酶基因的全基因组鉴定与表达分析(英文)陆地棉l .)。植物细胞学报2017;29(2):237-49。
确认
不适用。
资金
基金资助:国家自然科学基金资助项目[31660353]、国家重点研发计划项目[2016YFD0101900]、国家转基因生物育种重大专项项目[2016zx08005 - 005]、石河子大学作物育种专项项目[YZZX201601]。资助机构在设计研究、收集、分析和解释数据以及撰写手稿方面没有任何作用。
作者信息
从属关系
贡献
JS, X-Q C, Q-H Z和FL策划和设计了研究。X-Q C, X-Y Z, FX, S-H Z, Y-J L, LF和JS进行了实验,进行了野外调查,分析了数据。X-Q C, Q-H Z, JS和FL撰写手稿。JS和FL贡献相当。所有作者都阅读并认可了最终版本的手稿。
相应的作者
道德声明
伦理批准和同意参与
不适用。
同意出版
不适用。
相互竞争的利益
作者声明他们没有竞争利益。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构附属的管辖权要求保持中立。
补充信息
附加文件1:图S1。
与花药发育阶段相关的deg的热图比较。一个。维恩图显示了四个阶段不同的kegg。b, c, d而且e分别在减数分裂期、四分体期、单核和双核花粉期和花粉成熟期显示了与功能类相关的DEGs。红色代表高表达,蓝色代表低表达。每一行代表一个DEG。
附加文件2:图S2。
黄绿色模块基因的GO分析及KEGG通路。一个。黄绿色模块基因氧化石墨烯富集分析。*表示显著富集P价值≤0.05)。b。黄绿模块上的deg的KEGG分类。横轴为富集因子,纵轴为途径富集统计量。圆的大小代表基因的数量。红色代表高KEGG富集,蓝色代表低KEGG富集。
附加文件3:表S1。
转录组测序数据质量和基因组制图。
附加文件4:表S2。
13783种常见DEGs的氧化石墨烯富集分析。
附加文件5:表S3。
四分体期至花粉成熟期氧化石墨烯富集分析。
补充文件6:表S4。
DEGs的KEGG富集分析。
附加文件7:表5。
绿色、紫色、黄色和粉色模块中KEGG富集分析。
附加文件8:表S6。
关键KEGG通路基因在5个模块中富集。
附加文件9:表S7。
qRT-PCR的引物。
权利和权限
开放获取本文遵循创作共用署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),该协议允许在任何媒体或格式中使用、分享、改编、分发和复制,只要您给予原作者和来源适当的署名,提供创作共用许可协议的链接,并说明是否有更改。本文中的图片或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果材料不包含在文章的创作共用许可中,并且您的预期用途不被法律法规允许或超出了允许的用途,您将需要直接从版权所有者那里获得许可。欲查看此许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献放弃书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信用额度中另有说明。
关于这篇文章
引用这篇文章
程,XQ。,Zhang, XY., Xue, F.et al。棉花显性雄性不育突变体的性状鉴定及转录组分析。BMC植物杂志20.312(2020)。https://doi.org/10.1186/s12870-020-02522-0
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12870-020-02522-0
关键字
- 陆地棉
- 度
- 转录组分析
- 花粉的开发
- WGCNA