摘要
背景
频繁发生的干旱胁迫对全球玉米生产产生负面影响。人们为培育耐旱玉米品系和探索玉米的耐旱机制作出了大量努力。然而,关于抗旱玉米和对照玉米间转录组变化的比较研究尚缺乏。
结果
本研究以玉米自交系长C7-2 (C7-2)种子为材料,通过辐照,获得了一个耐旱突变体(C7-2t)60有限公司-γ。与野生型C7-2相比,C7-2t在控制和大田条件下都表现出明显的延迟萎蔫和更高的耐旱性,表明其具有较高的保水能力。通过转录组分析鉴定干旱期间C7-2和C7-2t之间的差异表达基因(deg)。结果表明,C7-2和C7-2t的抗旱性共包含4552个deg。特别是C7-2中光合相关基因的表达受到抑制,而C7-2t中这些基因在干旱条件下几乎不受影响。此外,在C7-2t中,一组特定的DEGs参与苯丙烷的生物合成和牛磺酸(次牛磺酸)的代谢;这些DEGs在与膜系统和细胞壁生物合成相关的细胞成分中富集。
结论
C7-2t的耐旱性主要是由于其高持水能力、稳定的光合作用(支持渗透调节)和在干旱条件下加强细胞壁的生物合成。
背景
频繁发生的干旱胁迫对全球玉米产量产生负面影响[1,2].增强玉米抗旱性是解决干旱胁迫导致产量损失问题的有效途径[3.,4].育种家和农学家对培育耐旱品系和揭示其耐旱特性很感兴趣[5].因此,阐明玉米对干旱胁迫的响应和适应机制对满足日益增长的粮食需求具有重要意义[6].
植物的耐旱性通常根据其表型和生理生化反应的差异来评价[7,8].耐旱植物因其较高的持水能力,可以在较长时间的干旱胁迫下保持稳定的形态结构[9,10].一方面,耐旱品系需要增强根系从土壤中吸收水分的能力[9].通过减少玉米单个皮层细胞的数量和增加其体积,根系可以减少对表层土壤的探索,并向更深的土壤生长,这使玉米能够从土壤中获得更多的水分[11,12].另一方面,通过降低叶片气孔的密度和控制气孔的开度,可以提高叶片的耐旱性[13,14].此外,植物在干旱条件下可合成脯氨酸和可溶性糖,通过渗透调节降低细胞内的水势,维持细胞内稳态[15,16].干旱胁迫还会激活过氧化物清除酶系统,清除干旱引起的过量活性氧(ROS),从而破坏细胞膜系统,最终导致细胞死亡[17,18].抗氧化体系(酶系和非酶系)活性是评价玉米抗旱性的有效指标[19,20.].通过比较杂交系、自交系和转基因系之间的生理生化变化,已鉴定出耐旱玉米品系[21,22,23].然而,由于遗传背景的差异,这些变化并不能完全解释玉米的耐旱性。植物的干旱反应涉及一个复杂的调控网络,这是有充分证据的;因此,需要对关键干旱响应基因进行组学研究,以提高作物的耐旱性状[24].
迄今为止只有少数耐旱基因如ZmVPP1而且ZmPP2C在玉米中通过传统测序方法鉴定,并对其功能特征[22,25,26].玉米抗旱性中存在许多关键基因[22,26,27,28,29];然而,阐明这些干旱反应基因的功能需要较长的时间[25].
RNA-seq具有低成本、高通量、高灵敏度等优点,是大规模鉴定干旱响应基因的有力工具,可促进玉米等植物关键抗旱基因的挖掘[30.,31,32,33,34,35,36,37].例如,RNA-seq研究表明,细胞壁生物合成/水通道蛋白相关基因的上调使玉米重组自交系在干旱条件下获得干旱适应性[27];抗旱玉米细胞壁重塑相关基因参与抗旱反应过程,氨基酸和碳水化合物的合成与抗旱有关[36].
本研究利用玉米自交系长7 - 2 (C7-2)的种子辐照,培育了耐旱系(C7-2t)。为了探究C7-2t抗旱性的机制,我们比较了C7-2和C7-2t的生理、生化和转录组变化。我们的研究结果将突出C7-2t的耐旱性特征,并有助于玉米新型耐旱性基因的鉴定和功能研究。
结果
玉米耐旱突变体的选育
的60用Co-γ辐照200 Gy 1 h的玉米种子进行耐旱选育,因为诱变的致死率为50%,即约有一半种子失去了萌发能力。然后,通过连续5年的自交杂交,获得了有前景的耐旱突变体。实验室研究进一步证实,其中一个突变体(C7-2t)在苗期早期表现出优异的耐旱性能(图7 - 2t)。1一个;无花果。1b).突变体C7-2t的耐旱指数明显高于野生型C7-2(图S1a)。显然,35日龄的C7-2植株叶片卷曲的时间早于C7-2t植株,后者在田间水分缺陷条件下保持了正常叶片形态(图7 - 2t)。1c;无花果。1d).此外,C7-2t的花丝间隔(ASI)明显短于C7-2(图S . 2)1b;无花果。1c).此外,两品系在田间株高、穗高和生物量上均无显著差异(图S .)2).因此,抗旱C7-2t在田间表现出较好的抗旱性能。接下来,通过生理、生化和转录组分析,探讨了C7-2t抗旱性的机制。
两个玉米系的干旱响应差异
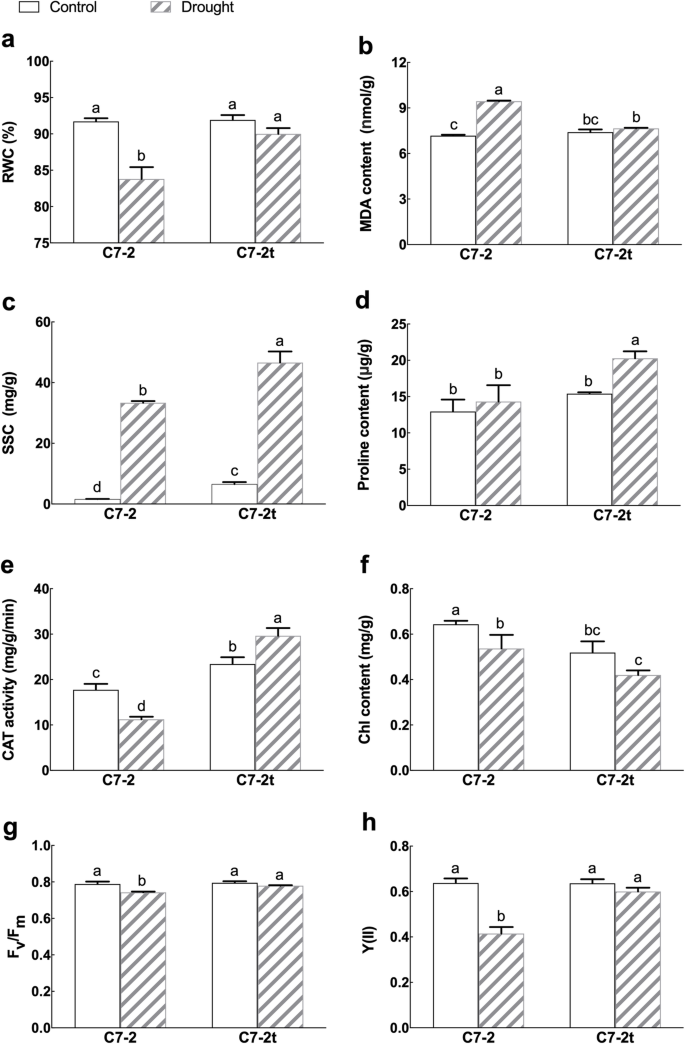
在正常条件下,C7-2t和C7-2叶片相对含水量(RWC)、脯氨酸含量、丙二醛(MDA)含量和叶绿素(Chl)荧光参数无显著差异,而过氧化氢酶(CAT)活性和可溶性糖(SSC)含量均高于C7-2(图7 - 2)。2).
在7 d的干旱处理中,C7-2表现出越来越严重的枯萎,而C7-2t没有表现出任何枯萎迹象(图7- 2t)。1b);两个品系的RWC均有所降低,C7-2的降低比C7-2t更明显(图7 - 2t)。2a),干旱条件下C7-2t叶片中MDA含量低于C7-2(图7 - 2)。2b),表明干旱胁迫下C7-2t比C7-2遭受更小的损伤。此外,C7-2t的SSC和脯氨酸含量以及CAT活性显著高于C7-2(图7 - 2)。2c, d, e),表明C7-2t可能通过调控SSC和脯氨酸含量以及CAT活性来增强抗旱性。
干旱条件下,两品系叶片总Chl含量均降低。需要注意的是,C7-2t中Chl含量在正常条件下也低于C7-2(图7 - 2)。2f).显然,突变影响了C7-2t中Chl的合成。然而,最大光化学量子产额(Fv/ F米干旱胁迫下C7-2t光系统II (PS II)的有效光化学量子产额(Y(II))均显著高于C7-2(图7 - 2)。2g h)。
基因序列组装、注释和分类
为了比较干旱胁迫下C7-2和C7-2t的转录谱,从三个独立的生物重复序列中收集了12个样本进行RNA-seq分析。来自C7-2对照(CC)、C7-2干旱处理(CD)、C7-2t对照(TC)和C7-2t干旱处理(TD)的原始读数分别为142,060,004、140,113,794、134,927,492和141,943,752。在去除适配器、低质量序列和模糊读后,分别获得138,139,372 (CC)、135,923,246 (CD)、131,095,380 (TC)和138,366,112 (TD)个干净的成对端读(表366,112)1).用FPKM(每千碱基外显子模型每百万reads映射片段)值评估基因的表达水平。FPKM≥1的基因在12个样本中的比例为56.19 ~ 59.91%。与C7-2相比,C7-2t中FPKM > 1基因较少。FPKM≥100的基因在12个样本中的比例为2.09 ~ 2.38%(表S1).
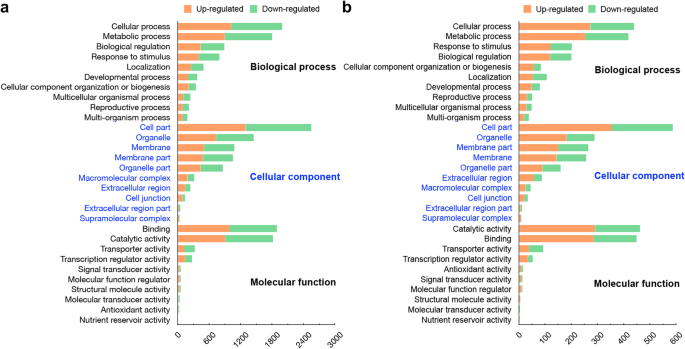
所有检测基因的注释均参考了五个公共数据库(NCBInr、NCBInt、UniProtKB、KEGG和COG)。大约98.78%的检测序列(31536)至少有一个显著匹配(E< 1 e−6)。一个或多个基因本体(gene ontology, GO)术语被分配到23231个基因(72.77%),其中7178个被识别的GO术语属于生物过程、细胞成分和分子功能类别(表S .)1).在生物过程类别中,分别有7.97、5.23和2.26%的检测基因被注释到dna模板转录(GO:0006351)、dna模板转录调控(GO:0006355)和防御反应(GO:0006952)。在细胞成分类别中,细胞核(GO:0005634)、膜整体成分(GO:0016021)和细胞质(GO:0005737)分别占17.48%、14.88%和9.75%。在分子功能类中,ATP结合(GO:0005524;11.75%),金属离子结合(GO:0046872;7.51%)和DNA结合(GO:0003677;6.11%)在GO检测基因中排名最高。
在干旱胁迫下,两个品系检测基因的GO分类具有显著的高度相似性(图2)。3.).在生物过程组中,GO的前三大类为细胞过程、代谢过程和生物调节。在细胞组分组中,大量基因富集在细胞部分、细胞器和膜上。在分子功能组中,氧化石墨烯的前三大类分别是结合活性、催化活性和转运蛋白活性。
差异表达基因的鉴定
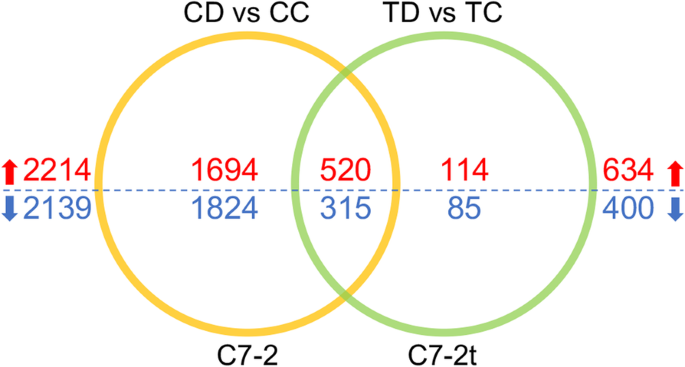
总的来说,在C7-2 (CD vs CC)和C7-2t (TD vs TC)中分别鉴定出4353和1034个干旱响应deg(图7 - 2)。4;表的年代2).C7-2中表达上调的deg有2214个,下调的有2139个。C7-2t,上调634个deg,下调400个。两组比较(CD vs CC和TD vs TC)共有835个基因,包括520个上调基因和315个下调基因(表S .)3.).这些DEGs主要对水胁迫相关刺激的剧烈变化作出反应,如DEGs的上调dehydrins (DHN1Zm00001d037894;COR410, Zm00001d017547, Zm00001d051420)和万能应激蛋白A(Zm00001d034027)。
剔除共享的DEGs后,C7-2和C7-2t分别检测到3518个和199个DEGs(图7 - 2)。4;表的年代4),表明两系间干旱响应途径存在差异。在C7-2t特异的199个DEGs中,上调的有114个,下调的有85个,这可能与C7-2t的耐旱性有关。在3518个C7-2特异性基因中,上调基因1694个,下调基因1824个。显然,干旱胁迫对C7-2基因表达的影响大于C7-2t。因此,与C7-2t相比,干旱胁迫显著抑制了C7-2植株的生长,表明C7-2t具有积极的干旱适应策略。
GO和KEGG对deg进行富集
通过氧化石墨烯富集分析,研究了干旱胁迫下生物过程的变异性。在C7-2和C7-2t中,分别有182个和90个GO项在干旱条件下出现过代表(FDR < 0.05)(表S .)5).
C7-2中这些改变的基因主要影响叶绿体部分(GO:0044434)和光合作用。光合膜(GO:0034357)和叶绿体类囊体膜(GO:0009535)相关的DEGs显著富集。在干旱胁迫下,锌转运体4(Zm00001d036965)和atp依赖性锌金属蛋白酶FTSH 6(Zm00001d037232)上调;光系统II反应中心PSB28蛋白(Zm00001d000409),光腔位置的光合NDH亚单位2(Zm00001d016943),光合NDH亚单位的腔位3(Zm00001d018623)下调。此外,与叶绿素结合相关的基因(GO:0016168)被显著抑制。叶绿素a/b结合蛋白(Zm00001d044401;Zm00001d044402;Zm00001d005814;Zm00001d048998),主要参与光捕获(GO:0009765)。此外,光合作用的电子转移过程受到影响(GO:0009773, GO:0009767)。这些基因的下调可以解释干旱胁迫下C7-2光合效率的下降(图7 - 2)。2).
对于C7-2t的干旱诱导反应,90个生物过程在干旱条件下被强化(表S .)5),明显低于C7-2,说明C7-2t受干旱胁迫的影响相对较小。值得注意的是,与细胞壁相关的GO术语显著丰富,包括植物型次生细胞壁生物成因(GO:0009834)、植物型细胞壁组织或生物成因(GO:0071669)、细胞壁组织或生物成因(GO:0071554)和植物型细胞壁生物成因(GO:0009832)。许多参与这些过程的基因在C7-2t中被特异性检测到,如expansin-like A2(Zm00001d029783),xyloglucan糖基转移酶(Zm00001d038676 Zm00001d020560)。此外,干旱胁迫下C7-2t中与次生代谢相关的GO项也显著富集,如黄酮类化合物3 ',5 ' -羟化酶活性(GO:0033772)和酪氨酸解氨酶活性(GO:0052883),这些都是细胞壁合成所必需的。
通过计算C7-2t和C7-2之间的代谢过程,进行KEGG富集分析,比较干旱对C7-2t和C7-2代谢过程的影响q -价值。在C7-2t中,7条通路显著富集(图7 - 2t)。5;表的年代6):植物激素信号转导(26个基因)、苯丙氨酸生物合成(19)、苯丙氨酸代谢(6)、淀粉和蔗糖代谢(15)、牛磺酸和次牛磺酸代谢(4)、苯并草嗪类生物合成(5)、肌醇磷酸代谢(9)。在C7-2中,24条通路显著富集(图7 - 2)。4;表的年代6),其中淀粉和蔗糖代谢(50)、光合作用-天线蛋白(13)、苯并恶嗪类生物合成(14)、植物激素信号转导(66)、氨基糖和核苷酸糖代谢(41)富集程度最高。与C7-2相比,C7-2t中苯丙类生物合成和牛磺酸、次牛磺酸代谢通路尤为富集,有8个上调和11个下调的deg参与苯丙类生物合成通路,4个上调基因参与牛磺酸、次牛磺酸代谢通路。
干旱条件下细胞壁生物合成
GO分析表明,干旱胁迫下C7-2t细胞壁(GO:0005618)基因显著富集。在生物过程分类中,C7-2t中共有23个DEGs富集进入植物型细胞壁组织或生物发生的入口(GO:0071669),其中下调5个,上调18个。特别是编码扩增素蛋白参与细胞壁生物合成的基因明显上调,如:expansin-like A2,expansin-like A1,expansin-B4,expansin-B11,expansin-B12,从1.1到3.29,变化为log2倍。此外,基因(Zm00001d020531;Zm00001d005775;Zm00001d032776;Zm00001d043477;Zm00001d005478;Zm00001d005451)在干旱胁迫诱导下编码纤维素合成酶A催化亚基。这些结果表明,C7-2t可以通过加强细胞壁的合成来减轻干旱胁迫的负面影响。虽然在C7-2中也检测到编码膨胀素的DEGs,但在干旱胁迫下没有明显的富集结果。
干旱条件下稳定糖的合成
双向糖转运蛋白(Zm00001d016590;Zm00001d040656;Zm00001d010440;Zm00001d015914;Zm00001d044421)和蔗糖合成酶(Zm00001d029091;Zm00001d029087;Zm00001d045042)在C7-2和C7-2t中均上调。干旱条件下糖合成和转运的上调需要光合作用提供稳定的能量供应。
在C7-2中,有69个干旱响应基因参与光合作用(GO:0015979)、光合作用和暗反应(GO:0019685)、光合作用、捕光、光合作用(GO:0009765)、光系统I中的捕光(GO:0009768)等生物过程。其中66个DEGs被干旱抑制,只有3个被干旱诱导(Zm00001d042211, Zm00001d001820,原叶绿素还原酶A;Zm00001d016166,磷酸烯醇丙酮酸羧化酶).
在C7-2中,编码磷酸三糖/磷酸转位子的DEGs在干旱条件下表达不一致:1个上调(Zm00001d005542), 2个下调(Zm00001d032383;Zm00001d039258)。蔗糖合酶基因(Zm00001d051837)和糖转运蛋白基因(Zm00001d029251、Zm00001d009603、Zm00001d029254、Zm00001d009605)表达下调。在C7-2t中未检测到这些基因表达下调。这些结果表明,干旱胁迫下C7-2t稳定的光合作用可能为糖的合成和代谢提供了更好的保证。
qRT-PCR检测DEGs
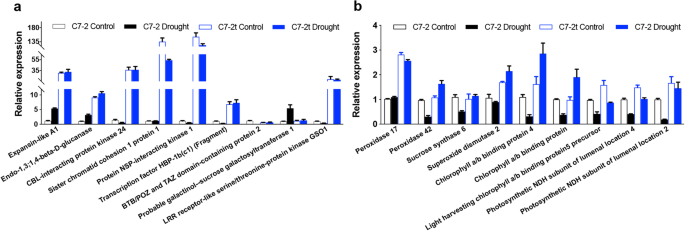
总共选择了18个感兴趣的deg来评估RNA-seq结果的准确性(表S7)用qRT-PCR(图;6).特别是表达水平蔗糖合成酶6C7-2在干旱条件下降低;表达水平过氧化物酶17,过氧化物酶42,超氧化物歧化酶2C7-2t中参与光合作用的其他5个deg均高于C7-2。qRT-PCR结果与转录组分析结果一致。
讨论
C7-2t和C7-2之间生理生化反应的差异
在本研究中,玉米耐旱突变体C7-2t被克隆60开发了Co-γ辐照技术。与野生型C7-2相比,C7-2t在干旱胁迫下表现出更高的耐旱性。C7-2t与C7-2在生理生化指标上存在显著差异(图7 - 2)。2).
RWC被广泛用于鉴定各种植物的耐旱性,包括玉米[20.,38].具有较高RWC的植物可以通过减少干旱对其抗氧化系统的破坏来增强其适应性[39].干旱条件下,C7-2t叶片的RWC比C7-2高,即保持水分的能力较强。脯氨酸和可溶性糖在渗透调节中起重要作用[40],与耐旱性有关[41,42].干旱条件下,C7-2t叶片中脯氨酸和可溶性糖的积累量高于C7-2。
提高抗氧化防御系统的效率可以保护光合色素、蛋白质和DNA免受过多的ROS损伤[40,43].严重干旱胁迫下CAT活性与MDA含量成反比[20.].CAT活性和MDA含量测定表明,干旱胁迫下C7-2t对ROS的损伤小于C7-2。
在田间,降低Chl含量可改善植物冠层的光照分布[44,45].另一方面,减少Chl合成所节省的氮和能量将增强对干旱胁迫的特异性响应[46].因此,C7-2t叶片Chl含量低可能是其干旱适应策略的一部分。C7-2t较C7-2具有较高的RWC、渗透压积累、抗氧化活性和光合效率,且MDA水平较低,从而提高了C7-2t的耐旱性。
可溶性糖渗透调节对C7-2t抗旱性的贡献
可溶性糖,包括葡萄糖、蔗糖、麦芽糖和海藻糖,在干旱胁迫下的渗透调节中发挥积极作用[47,48,49].在抗旱小麦中,可溶性糖合成相关基因的表达增加解释了其耐旱性[50].在本研究中,对照和干旱胁迫条件下,C7-2t的可溶性糖含量高于C7-2(图7 - 2)。2).显然,C7-2t具有有效的干旱适应策略,部分基于可溶性糖的渗透调节。在本研究中,C7-2t中光合相关基因的表达几乎不受影响,因此C7-2t在干旱条件下能更有效地合成可溶性糖。
C7-2t在转录组水平调控可溶性糖的特定成分。葡萄糖能形成1,1-糖苷连锁的海藻糖,减轻干旱胁迫下高浓度海藻糖-6-磷酸造成的损伤[48].在本研究中,的表达海藻糖6-磷酸合成酶/磷酸酶和海藻糖6-磷酸磷酸酶C7-2 (log2干旱胁迫下,C7-2t中可溶性糖含量的升高可能不是由于海藻糖合成的增强。
的表达β淀粉酶(Zm00001d014083)在干旱条件下C7-2和C7-2t均被激活,表明叶片中的淀粉可以分解为麦芽糖。然而,C7-2中编码β-淀粉酶的几个基因(Zm00001d009016, Zm00001d029983, Zm00001d047077)在干旱胁迫下下调,可能导致麦芽糖含量降低,光合系统对干旱胁迫的敏感性增加[51].综上所述,C7-2t在干旱胁迫下能在叶片中合成更多的可溶性糖,维持光合作用的稳定性,因此比C7-2更耐旱。
细胞壁生物合成相关基因对C7-2t保水性的贡献
有组织的多酶复合物参与多糖生物合成,为细胞壁合成提供了强有力的保证[52].升高的表达糖基转移酶对抗旱性有贡献拟南芥细胞分裂素缺乏突变体[53].在本研究中,有几个glucuronosyltransferasesC7-2t (Zm00001d039231, Zm00001d007231)和C7-2 (Zm00001d002064, Zm00001d007231, Zm00001d008250)在干旱胁迫下表达上调。GO富集分析显示,在C7-2t中,许多DEGs与细胞壁组织有关,尤其是与细胞壁组织有关棒曲霉素家庭(54]由各种非生物胁迫和ABA诱导[55,56].过表达后气孔密度降低RhEXPA4[57].此外,膨胀素可以通过中止细胞壁活性和硬化细胞结构来减少水分流失[27].
木素含量和苯丙合成途径中间产物与玉米抗旱性呈正相关[58,59].咖啡酸的积累p干旱胁迫下木质部SAP中的-香豆酸通过影响木质素生物合成调控玉米叶片的生长[60,61].p-香豆酸能快速木质化胁迫下的组织,提高干旱胁迫下的适应性[62,63].在本研究中,KEGG和GO富集分析表明,干旱条件下C7-2t木质素相关代谢活性,如苯丙烷合成途径增强。最有可能的是苯丙类生物合成途径及其中间产物咖啡酸和p-香豆酸参与了C7-2t对干旱胁迫的响应。
ABA在C7-2t抗旱策略中的作用
9-cis环氧类胡萝卜素双加氧酶1是ABA合成的关键酶[64,65].在目前的研究中,日志2编码9-顺式环氧类胡萝卜素双加氧酶1 (Zm00001d018819, Zm00001d033222)的基因在C7-2t突变倍数分别为4.48和3.15,而在C7-2突变倍数分别为7.03和4.57,说明C7-2对干旱胁迫的敏感性可能源于干旱胁迫下产生了更多的内源ABA。
PP2C在胁迫下作为负调控因子参与ABA信号转导通路[26].最近的一项研究证明了这一点PP2C-A10(定位于6号染色体)与内质网应激有关[26].在本研究中,在C7-2和C7-2t中分别检测到29个PP2C基因(25个上调,4个下调)和14个(均上调)。尤其是对数2折叠变化PP2C-A10C7-2t显著低于C7-2。这些结果表明aba依赖性上调基因为植物抗旱性提供了转录支持[6],包括C7-2t。
结论
在本研究中,我们在对照和大田条件下选育了比C7-2更耐旱的自交系C7-2t。C7-2和C7-2t在生理、生化和转录组方面的差异可以解释C7-2t的耐旱机制(图7 - 2t)。7).本文鉴定的抗旱突变体C7-2t和干旱响应型deg将为玉米的基础研究和抗旱育种提供依据。
方法
创造耐旱玉米突变体
玉米的种子(玉米l .)C7-2购自河南秋乐种业科技有限公司(中国郑州)。种子被人为变异60Co-γ辐照1小时,剂量分别为150、200和250戈瑞。200戈瑞的辐射致死率约为50%。因此,2013年在田间种植了200颗经gy处理的种子,以生产M0的一代。通过减少浇水次数维持土壤干旱,筛选出耐旱植株并进行自花授粉。场地选择过程连续进行了五年(主要由QBZ和WW进行)。自从米4收集田间表现优于C7-2的耐旱良种(如C7-2t),保存于种子储藏室(河南农业大学生命科学学院,中国)。通过盆栽试验,从表型、干旱生理生化变化等方面进一步评价了C7-2t的抗旱性[66].
玉米材料和生长条件
用2%次氯酸钠冲洗种子10分钟,用蒸馏水冲洗三次。然后将样品种植在装满1100 g生长培养基(Pindstrup Substrate, 0-6 mm, pH值6.0,Pindstrup Mosebrug a /S,丹麦)和1000 ml水的塑料盒中。这些盒子被放置在一个生长室中,环境温度为27°C,湿度为60%,光照14小时,黑暗10小时。7天大的幼苗被分为两组:(a)正常浇水的对照植物和(b)停止浇水7天的干旱处理植物。然后,收集膨胀的第三片叶子进行生理、生化和RNA-seq分析。三株植物的叶子作为样本,在N液中冷冻后保存在- 80°C2.所有实验至少进行了3个独立的生物重复。
生理生化分析
新鲜叶片分为两组,一组在80°C下干燥12 h以确定干重,另一组在暗处蒸馏水中放置12 h以确定膨松重量。RWC由以下公式计算:RWC =(鲜重-干重)/(膨化重-干重)·100% [67].采用建立的方法测定CAT活性及Chl、游离脯氨酸、SSC和MDA含量[68,69,70,71,72].用MINI-PAM-II (Walz, Germany)测定Chl荧光。最大光化学量子产额(Fv/ F米)和PS II的有效光化学量子产额(Y(II)) [73,74].所有测定均在3个生物实验中进行。
RNA提取与检测
根据制造商的说明,在3个生物重复中使用超纯RNA试剂盒(CoWin Biotech Co., China)提取RNA。RNA用无rnase - DNase I (Takara, Japan)处理以去除任何可能的DNA。然后通过凝胶电泳和Agilent 2100生物分析仪(Agilent Technologies, Palo Alto, CA, USA)检查完整性。总RNA浓度使用NanoDrop 8000分光光度计(NanoDrop, Wilmington, DE)测定。由安诺达基因科技有限公司(中国北京)进行RNA-seq分析,总RNA RIN值≥7.3,28S:18S比值≥1.2。
RNA-seq分析
每个样品约2 μg RNA被用作RNA-seq分析的输入材料。按照制造商的建议,使用NEBNext®Ultra™RNA文库准备试剂盒for Illumina®(#E7530L, NEB, USA)生成测序文库。在每个样本中添加索引码来对序列进行属性划分。简单地说,用聚t低聚附着磁珠从总RNA中纯化mRNA。在NEBNext第一链合成反应缓冲液(5X)中,用二价阳离子在高温下进行裂解。RNase H和聚合酶I分别用于催化第一链cDNA和第二链cDNA的合成。经过提纯和末端修复后,进行了a尾和接箍。通过PCR富集纯化的cDNA模板,完成文库构建。从原始reads中去除污染reads、低质量reads和N碱基大于总碱基5%的reads后获得清洁的RNA-seq reads。
参考基因组和注释文件从ENSEMBL数据库(http://www.ensembl.org/index.html).采用Bowtie2构建基因组指数。干净数据通过HISAT2与参考基因组比对[75,76],通过FPKM计算基因表达量[77].用DESeq2软件估计deg值p-值根据Wald检验计算[78].的p-值用BH法校正。基因与问≤0.05和|log2_ratio|≥1被鉴定为deg。
功能富集分析
FDR < 0.05的GO术语被认为显著富集。京都基因与基因组百科全书(KEGG,http://www.kegg.jp/)通过超几何实验进行富集,其中p-值通过多次比较调整为问值。KEGG条款问< 0.05为显著富集。
定量qRT-PCR分析
在干旱和对照条件下,每个品系分别从三个独立的组中提取12个总RNA样本。使用SuperReal PreMix Plus (Tiangen, Beijing, China)进行第一链cDNA合成。
共筛选出18个基因,利用在线工具Primer3设计基因特异性引物(http://primer3.ut.ee).选择泛素基因与引物Ubi 5 ' (5 ' -TAAGCTGCCGATGTGCCTGCG-3 ')和Ubi 3 ' (5 ' -CTGAAAGACAGAACATAATGAGCACAG-3 ')一起作为加载对照。每个PCR (20 μL)含有10 μL 2× SuperReal PreMix Plus,引物0.6 μM和适当稀释的cDNA。qRT-PCR使用赛默飞世尔Scientific StepOnePlus™Real-Time PCR仪,按照制造商说明书进行。热循环条件为95°C,持续15分钟,然后在95°C下循环40次,每次10秒,在60°C下循环32秒。在第二个解离阶段,95°C持续10 s,然后是65-95°C,增加0.5°C,持续0.05 s。所有反应都进行了三次。相对表达量由2−ΔΔCT方法(79].
数据和材料的可用性
在本研究过程中产生或分析的所有数据都包含在本文及其补充信息文件中。转录组分析的原始数据集可在工作发表后根据合理要求从通讯作者处获得。
缩写
- ASI:
-
Anthesis-silk间隔
- C7-2:
-
自交系长7 - 2
- C7-2t:
-
耐旱自交系
- 猫:
-
过氧化氢酶
- 答:
-
C7-2控制
- CD:
-
C7-2干旱处理
- 排名:
-
叶绿素
- 度:
-
差异表达基因
- FPKM:
-
每千碱基外显子模型每百万次读取的片段数
- 走:
-
基因本体论
- MDA:
-
丙二醛
- ROS:
-
活性氧
- RWC:
-
相对含水量
- SSC:
-
可溶性糖含量
- TC:
-
C7-2t控制
- 道明:
-
C7-2t干旱处理
参考文献
- 1.
Feller U, Vaseva II。极端气候事件:干旱和高温对重要农艺植物生理过程的影响。环境科学进展。2014;2:39。https://doi.org/10.3389/fenvs.2014.00039.
- 2.
吴松,宁峰,张强,吴霞,王伟。加强大田条件下作物干旱响应的组学研究。植物科学进展(英文版);https://doi.org/10.3389/fpls.2017.00174.
- 3.
Boyer JS。植物生产力与环境。科学。1982;218:443-8。https://doi.org/10.1126/science.218.4571.443.
- 4.
王志刚,王志刚,王志刚。分子育种中干旱表型的研究进展。植物科学进展,2009;14:488-96。https://doi.org/10.1016/j.tplants.2009.07.007.
- 5.
Avramova V, Nagel KA, Abdelgawad H, Bustos D, Duplessis M, Fiorani F, Beemster GTS。基于苗期根、梢性状多尺度分析的玉米杂交种耐旱性筛选中国科学(d辑),2016;https://doi.org/10.1093/jxb/erw055.
- 6.
朱镕基JK。植物的非生物胁迫信号及其响应。细胞。2016;167:313-24。https://doi.org/10.1016/j.cell.2016.08.029.
- 7.
Ribaut JM, Ragot M.提高玉米干旱适应性的标记辅助选择:回交方法,展望,局限性和替代方法。中国科学(d辑),2007;https://doi.org/10.1093/jxb/erl214.
- 8.
李国强,李国强。生理育种。植物学报,2016;31:162-71。https://doi.org/10.1016/j.pbi.2016.04.005.
- 9.
coma LH, Becker SR, Cruz VMV, Byrne PF, Dierig DA。干旱条件下根系性状对植物生产力的影响。植物科学进展(英文版);https://doi.org/10.3389/fpls.2013.00442.
- 10.
库马尔A,夏尔马KD。叶片含水量-作物植物抗旱性的简单指标。中国农业科学(英文版),2010;
- 11.
齐孟古JG,布朗KM,林奇JP。减少根皮层细胞锉数可提高玉米的耐旱性。植物学报。2014;166:1943-55。https://doi.org/10.1104/pp.114.249037.
- 12.
齐孟古JG,布朗KM,林奇JP。大的根皮层细胞大小提高了玉米的耐旱性。植物学报。2014;166:2166-78。https://doi.org/10.1104/pp.114.250449.
- 13.
Boccalandro HE, Rugnone ML, Moreno JE, Ploschuk EL, Serna L, Yanovsky MJ, Casal JJ。光敏色素B以牺牲水分利用效率为代价来增强拟南芥的光合作用。植物科学学报。2009;30(2):344 - 344。https://doi.org/10.1104/pp.109.135509.
- 14.
刘娟,张峰,周娟,陈峰,王波,谢霞。光敏色素B对总叶面积和气孔密度的控制影响水稻抗旱性。植物化学学报,2012;https://doi.org/10.1007/s11103-011-9860-3.
- 15.
Mattioni C, Lacerenza NG, Troccoli A, Leonardis AMD, Fonzo ND。水盐胁迫对硬粒小麦幼苗脯氨酸代谢的影响。植物化学学报。1997;101:787-92。https://doi.org/10.1111/j.1399-3054.1997.tb01064.x.
- 16.
库马尔,瑞迪,苏达卡尔。NaCl对两种不同耐盐性桑树高产基因型脯氨酸代谢的影响。植物科学通报2003;https://doi.org/10.1016/s0168 - 9452 (03) 00332 - 7.
- 17.
Munné-Bosch S, Peñuelas J.水杨酸在干旱和恢复过程中对田间种植的菲利亚植物的光和抗氧化保护作用。足底。2003;217:758 - 66。https://doi.org/10.2307/23388121.
- 18.
Anjum SA, Wang LC, Farooq M, Hussain M,薛玲,邹CM。油菜素内酯通过调控酶抗氧化剂和叶片气体交换提高玉米的耐旱性。中国农业科学(英文版);2011;https://doi.org/10.1111/j.1439-037X.2010.00459.x.
- 19.
马德华,李志强,李志强,等。抗旱玉米杂交种的选育评价(玉米l)在胁迫管理条件下籽粒产量和其他性状的自交系。尼日利亚J热内。2014;28:19-23。https://doi.org/10.1016/j.nigjg.2015.06.004.
- 20.
Anjum SA, Ashraf U, Tanveer M, Khan I, Hussain S, Shahzad B, Zohaib A, Abbas F, Saleem MF, Ali I, Wang LC。干旱诱导3个玉米杂交种生长、渗透物积累和抗氧化代谢的变化。植物科学进展,2017;https://doi.org/10.3389/fpls.2017.00069.
- 21.
李志强,李志强,李志强,李志强。干旱胁迫下玉米籽粒产量的表型稳定性及其归因特征。中国植物科学,2017;8:1397。https://doi.org/10.3389/fpls.2017.01397.
- 22.
王晓玲,王宏伟,刘世祥,Ferjani A,李建军,闫建斌,杨晓华,秦峰。玉米ZmVPP1基因变异对玉米幼苗耐旱性的影响。Nat Genet, 2016;48:1233。https://doi.org/10.1038/ng.3636.
- 23.
Beyene Y, Mugo S, Semagn K, Asea G, Trevisan W, Tarekegne A, Tefera T, Gethi J, Kiula B, Gakunga J, Karaya H, Chavangi A.双单倍体玉米系及其试验组合的遗传距离;干旱胁迫和非胁迫条件下的表现。Euphytica。2013;192:379 - 92。https://doi.org/10.1007/s10681-013-0867-5.
- 24.
加里多-卡德纳斯JA, Mesa-Valle C, Manzano-Agugliaro F.植物分子标记研究的趋势。足底。2018;247:543-57。https://doi.org/10.1007/s00425-017-2829-y.
- 25.
杨鑫,高松,徐松,张忠,Prasanna BM,李林,李娟,闫娟。玉米种质资源的全球分布特征及其在复杂数量性状分析中的应用潜力。Mol育种,2011;28:511-26。https://doi.org/10.1007/s11032-010-9500-7.
- 26.
项勇,单霞,秦峰,戴敏。ZmPP2C-A基因中内质网应激反应元件缺失促进玉米幼苗的耐旱性。植物学报。2017;10:456-69。https://doi.org/10.1016/j.molp.2016.10.003.
- 27.
闵华,陈超,魏胜,尚霞,孙敏,夏锐,刘旭,郝东,陈宏,谢强。基于重组自交系转录组分析的玉米幼苗耐旱机制鉴定。前沿植物科学,2016;7:1080。https://doi.org/10.3389/fpls.2016.01080.
- 28.
石俊,高宏,王宏,Lafitte HR, Archibald RL,杨敏,Hakimi SM, Mo H, Habben JE。通过CRISPR-Cas9产生的ARGOS8变体可以提高田间干旱胁迫条件下的玉米产量。中国生物工程学报,2017;15(4):457 - 457。https://doi.org/10.1111/pbi.12603.
- 29.
谢晓明,杨晓明,杨晓明,陈晓明,陈晓明,等。热带玉米自交系品质控制基因分型的研究进展。《理论与实践》,2012;https://doi.org/10.1007/s00122-012-1928-1.
- 30.
吕晓霞,周霞,曹艳,周敏,杨晨,梁松,杨晨。植物低温和干旱响应转录组的rna序列分析玉米梅ssp墨西哥中国植物科学,2017;8:136。https://doi.org/10.3389/fpls.2017.00136.
- 31.
张霞,刘霞,张东,唐红,孙波,李超,郝林,刘超,李艳,石勇。田间干旱条件下玉米自交系基因表达的全基因组鉴定揭示了转录因子在抗旱性中的重要意义。PLoS One. 2017;12:e0179477。https://doi.org/10.1371/journal.pone.0179477.
- 32.
李萍,曹伟,方华,徐松,尹胜,张勇,林东,王娟,陈勇,徐超。玉米苗期叶片对非生物胁迫响应的转录组分析。前面.植物科学学报,2017;https://doi.org/10.3389/fpls.2017.00290.
- 33.
宋坤,金兴昌,申申,金赫,文成昌,金智勇,李文明。干旱胁迫下玉米叶片开花时间基因的转录组分析。植物科学学报,2017;https://doi.org/10.3389/fpls.2017.00267.
- 34.
Opitz N, Marcon C, Paschold A, Malik WA, Lithio A, Brandt R, Piepho HP, Nettleton D, Hochholdinger F.水分亏缺对玉米初生根转录组可塑性的影响。中国科学(d辑),2015;https://doi.org/10.1093/jxb/erv453.
- 35.
张志刚,张志刚,张志刚,张志刚。干旱对玉米生殖组织和叶片分生组织基因表达的影响。植物科学学报,2012;https://doi.org/10.1104/pp.112.200444.
- 36.
曾达涛,刘珊珊,王霞,刘刚,金红,董安,杨勇,段宏。玉米自交系干旱响应关键基因及途径的比较转录组和生理分析。中国生物化学杂志2019;20:1268。https://doi.org/10.3390/ijms20061268.
- 37.
李勇,孙超,黄忠,潘杰,王玲,范霞。在比较玉米生理和转录组反应的基础上,提出了中国玉米基础基因型黄早4号和长7-2渐进式耐水亏和生长恢复的机制。植物生理学报,2009;30(4):344 - 344。https://doi.org/10.1093/pcp/pcp145.
- 38.
高勇,Lynch JP。在水分亏缺胁迫下,减少冠根数量有助于玉米的水分获取(玉米l .)。中国科学(d辑),2016;https://doi.org/10.1093/jxb/erw243.
- 39.
王丽娟,王丽娟,王丽娟,王丽娟。干旱胁迫对2个玉米品种生长、叶片气体交换和抗氧化能力的影响。环境科学学报,2016;23:17132-41。https://doi.org/10.1007/s11356-016-6894-8.
- 40.
法鲁克M,瓦希德A,小林N,藤田D,巴士拉SMA。植物干旱胁迫:影响、机制与管理。农业可持续发展,2009;29:185-212。https://doi.org/10.1051/agro:2008021.
- 41.
胡晓明,陈晓明,陈晓明,陈晓明,等。干旱胁迫下玉米脯氨酸和多胺代谢相关基因表达的研究进展。植物学报。2019;63:247-52。https://doi.org/10.32615/bp.2019.028.
- 42.
Vendruscolo ECG, Ivan S, Marcos P, Carlos Alberto S, Molinari HBC, Celso Jamil M, Vieira LGE。胁迫诱导的脯氨酸合成使转基因小麦对水分亏缺具有耐受性。中国植物学报。2007;26(4):366 - 366。https://doi.org/10.1016/j.jplph.2007.05.001.
- 43.
Blokhina O, virrolainen E, Fagerstedt KV。抗氧化剂、氧化损伤和缺氧应激:综述。安·波特。2003;91:179-94。https://doi.org/10.1093/aob/mcf118.
- 44.
朱晓霞,张晓明,张晓明,等。天线尺寸对光合效率的影响。植物物理学报,2011;https://doi.org/10.1104/pp.110.165886.
- 45.
朱晓霞,龙斯平,Ort RD.提高光合效率,提高产量。植物学报,2010;https://doi.org/10.1146/annurev-arplant-042809-112206.
- 46.
Slattery RA, Vanloocke A, Bernacchi CJ, Zhu XG, Ort DR.田间条件下大豆叶绿素降低突变体的光合作用、光利用效率和产量。中国植物科学,2017;8:549。https://doi.org/10.3389/fpls.2017.00549.
- 47.
Ibrahim HA, Abdellatif YMR。麦芽糖和海藻糖对水分胁迫下小麦生长、产量及部分生化成分的影响。中国农业科学。2016;61:267-74。https://doi.org/10.1016/j.aoas.2016.05.002.
- 48.
Redillas MCFR, Park SH, Lee JW, Kim YS, Jeong JS, Jung H, Bang SW, Hahn TR, Kim JK。海藻糖的积累增加了水稻植株的可溶性糖含量,使其具有耐旱性和耐盐性。植物学报,2012;6:89-96。https://doi.org/10.1007/s11816-011-0210-3.
- 49.
赫希科维茨,欧仁,柯恒。海藻糖和蔗糖在蓝藻细菌暴露在基质水胁迫的积累。应用环境微生物学。1991;57:645-8。https://doi.org/10.1002/bit.260370511.
- 50.
侯杰,黄霞,孙伟,杜春,王超,谢勇,马勇,马东。小麦茎干水溶性碳水化合物积累及基因表达与抗旱性相关。中国生物医学工程学报,2018;https://doi.org/10.1016/j.jplph.2018.09.017.
- 51.
卡普兰F,盖伊CL。RNA干扰拟南芥β -淀粉酶8防止麦芽糖在冷休克时的积累,增加PSII光化学效率对冷冻胁迫的敏感性。植物学报(英文版);2005;https://doi.org/10.1111/j.1365-313x.2005.02565.x.
- 52.
Culbertson AT, Ehrlich JJ, Choe JY, Honzatko RB, Zabotina OA。木葡聚糖木糖基转移酶1的结构揭示了定义木葡聚糖聚合物生物学模式的简单空间规则。美国国家科学院。2018; 115:6064-9。https://doi.org/10.1073/pnas.1801105115.
- 53.
李萍,李玉军,张富军,张广广,姜晓霞,于红梅,侯伯康。拟南芥udp -糖基转移酶UGT79B2和UGT79B3通过调节花青素积累来提高耐寒、耐盐和耐旱能力。植物J. 2017; 89:85-103。https://doi.org/10.1111/tpj.13324.
- 54.
张志刚,张志刚,张志刚。扩展素在植物生长中的作用及其在作物改良中的应用。植物细胞报告2016;35:49 - 65。https://doi.org/10.1007/s00299-016-1948-4.
- 55.
Abuqamar S, Ajeb S, Sham A, Enan MR, Iratni R.拟南芥A2基因突变增强了对坏死性真菌的抗性和对非生物胁迫的超敏感性。植物病理学杂志,2013;14:813-27。https://doi.org/10.1111/mpp.12049.
- 56.
赵瑞敏,韩云云,冯云云,李峰,王伟。干旱胁迫下扩张素参与脱落酸和吲哚-3-乙酸介导的小麦细胞生长。植物学报,2012;31:671-85。https://doi.org/10.1007/s00299-011-1185-9.
- 57.
Lü P,康敏,姜霞,戴峰,高娟,张晨。玫瑰膨胀素基因rhexp4调控拟南芥叶片生长及抗旱耐盐能力。足底。2013;237:1547-59。https://doi.org/10.1007/s00425-013-1867-3.
- 58.
胡勇,李卫成,徐永强,李国军,廖勇,傅凤林。干旱胁迫下玉米叶片木质素生物合成候选基因的差异表达。应用化学学报。2009;50:413 - 424。https://doi.org/10.1007/bf03195675.
- 59.
杨玲,方泉杰,季平,倪霞,陈松,李rd, Kemerait RC,郭斌。干旱诱导玉米籽粒发育的代谢响应及其调控。中国生物科技,2018;16(1):16 - 16。https://doi.org/10.1111/pbi.12899.
- 60.
阿尔瓦雷斯S,马什EL,施罗德SG,沙赫特曼DP。干旱条件下玉米木质部液代谢组学和蛋白质组学的变化。植物生态学报,2010;31(4):366 - 366。https://doi.org/10.1111/j.1365-3040.2007.01770.x.
- 61.
Vincent D, Lapierre C, Pollet B, Cornic G, Negroni L, Zivy M.水分亏缺影响玉米叶片中咖啡酸o -甲基转移酶、木质化和相关酶。蛋白质组学研究。植物科学进展。2005;37(4):349 - 349。https://doi.org/10.1104/pp.104.050815.
- 62.
林建军,黄XX,李强,曹艳,鲍艳,孟XF,李玉军,付晨,侯伯康。拟南芥中udp -糖基转移酶72B1催化单木酚糖偶联,对正常细胞壁木质化至关重要。植物J. 2016; 88:26-42。https://doi.org/10.1111/tpj.13229.
- 63.
胁迫诱导黄瓜中游离和结合对香豆醛积累的分子和生化基础。植物物理学报。2011;157:1056-66。https://doi.org/10.1104/pp.111.184358.
- 64.
李文杰,李文杰,李文杰,李文杰。ABA感知与信号传递。植物科学进展,2010;15:395-401。https://doi.org/10.1016/j.tplants.2010.04.006.
- 65.
Babak B, Satoshi I, Miki F, Yasunari F, Hironori T, Yuriko O, Kazuko YS, Masatomo K, Kazuo S.拟南芥9-顺式环氧类胡萝卜素双加氧酶基因启动子区参与脱水诱导转录的研究。DNA决议2013;20:315-24。https://doi.org/10.1093/dnares/dst012.
- 66.
陈东,王松,曹斌,曹东,冷刚,李华,尹玲,单玲,邓霞。干旱胁迫和复水对玉米幼苗生长和生理反应的基因型变异揭示了恢复在玉米幼苗干旱适应中的重要作用。前沿植物科学,2016;6:1241。https://doi.org/10.3389/fpls.2015.01241.
- 67.
Galmés J, Flexas J, Savé R, Medrano H.地中海不同生长形态和叶片习性植物的水分关系和气孔特征:对水分胁迫和恢复的响应。植物学报。2007;29(3):329 - 329。https://doi.org/10.1007/s11104-006-9148-6.
- 68.
Bates LS, Waldren RP, Teare ID。水分胁迫研究中游离脯氨酸的快速测定。植物土壤。1973;39:205-7。https://doi.org/10.1007/BF00018060.
- 69.
菲尔斯弗兰克-威廉姆斯。酵母细胞对碳水化合物的同化和降解。生物化学学报。1951;193:113-24。https://doi.org/10.1515/bchm2.1951.286.1-6.270.
- 70.
Dhindsa RS, Plumb-Dhindsa P, Thorpe TA。叶片衰老:与膜透性和脂质过氧化水平升高、超氧化物歧化酶和过氧化氢酶水平降低有关。中华科学技术学报,2001;32(3):394 - 397。https://doi.org/10.1093/jxb/32.1.93.
- 71.
郑刚,范超,狄生,王霞,向春,庞勇。拟南芥EDT1基因过表达对紫花苜蓿抗旱性的影响(紫花苜蓿l .)。中国植物科学,2017;8:2125。https://doi.org/10.3389/fpls.2017.02125.
- 72.
Sartory DP, Grobbelaar JU。淡水浮游植物叶绿素a的提取及分光光度法分析。Hydrobiologia。1984;114:177 - 87。https://doi.org/10.1007/bf00031869.
- 73.
北岛M,巴特勒WL。二溴百里醌对叶绿体中叶绿素荧光和初级光化学的猝灭。生物化学学报,2007;26(3):366 - 366。https://doi.org/10.1016/0005 - 2728 (75) 90209 - 1.
- 74.
王志强,王志强,王志强,等。叶绿素荧光猝灭与光合电子传递量子产率的关系。生物化学学报,1989;39(4):389 - 397。https://doi.org/10.1016/s0304 - 4165 (89) 80016 - 9.
- 75.
Kim D, Langmead B, Salzberg SL. HISAT:低内存需求的快速拼接对齐器。南京大学学报(自然科学版),2015;https://doi.org/10.1038/nmeth.3317.
- 76.
Langmead B, Trapnell C, Pop M, Salzberg SL.人类基因组短DNA序列的超快和内存高效对齐。中国生物工程学报。2009;10:R25。https://doi.org/10.1186/gb-2009-10-3-r25.
- 77.
Trapnell C, Williams BA, Pertea G, Mortazavi A, Kwan G, Van Baren MJ, Salzberg SL, Wold BJ, Pachter L. RNA-Seq转录本组装和定量揭示了细胞分化过程中未注释的转录本和异型转换。生物工程学报。2010;28:511-5。https://doi.org/10.1038/nbt.1621.
- 78.
王磊,冯志,王旭,王霞,张旭。一种从RNA-seq数据中识别差异表达基因的R包。生物信息学。2010;26:136-8。https://doi.org/10.1093/bioinformatics/btp612.
- 79.
Livak KJ, Schmittgen TD。使用实时定量PCR和2−ΔΔCT方法分析相关基因表达数据。方法。2001;25:402-8。https://doi.org/10.1006/meth.2001.1262.
致谢
我们感谢吴兆坤、牛良杰和张杭在玉米突变体C7-2t的创造和选择上的宝贵投入。
资金
国家自然科学基金资助项目(No.;U1904107,授予WW),河南省重点项目和专项基金(批准号:192102110014,授予HL)。我们声明,所有资助机构在研究设计、数据收集、分析和解释以及撰写手稿方面都没有任何角色。
作者信息
从属关系
贡献
QBZ进行实验。WW和HL构想并设计了实验。QBZ、HL、XLW和WW对数据进行了分析。QBZ和WW起草了手稿。所有作者都阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准并同意参与
不适用。
发表同意书
不适用。
相互竞争的利益
作者声明没有利益冲突。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
附加文件1
:表S1RNA测序检测到的所有基因的FPKM值和注释。
附加文件2
:表S2C7-2和C7-2t检测到deg。
附加文件3
:表S3C7-2和C7-2t共有的deg。
附加文件4
:表S4C7-2和C7-2t特异性的deg。
附加文件5
:表S5C7-2和C7-2t中DEGs的GO富集分析。
附加文件6
:表S6C7-2和C7-2t中DEGs的KEGG富集分析。
附加文件7
:表S7qRT-PCR所用引物。
附加文件8
:无花果S1。C7-2和C7-2t的耐旱性指数、秃穗距和ASI的比较。(一个)幼苗三叶期盆栽试验评价。(b)及(c)显示了穗性状的差异和代表ASI的横坐标。
附加文件9
:无花果S2。C7-2和C7-2t在田间收获时株高、穗高和生物量。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
张强,刘宏,吴X。et al。基于生理、生化和转录组分析的玉米耐旱突变体耐旱机制鉴定。BMC植物生物学20.315(2020)。https://doi.org/10.1186/s12870-020-02526-w
收到了:
接受:
发表:
关键字
- 差异表达基因
- Drought-adaptation模型
- 耐旱基因突变
- 干旱胁迫
- 转录组分析
- 玉米