摘要
背景
非编码小RNA tRFs (trna衍生片段)和phasiRNAs(植物特异性)在植物生长发育和抗逆性中发挥重要作用。然而,tRFs和phasirna是否对植物重要的胁迫激素ABA有反应仍然是一个谜。
结果
在这里,rna测序被用于破译番茄中tRFs和phasiRNAs的景观。茄属植物lycopersicum叶面喷施外源ABA 24 h后叶片的反应。共检测到733个trf和137个phasirna。trf主要来源于tRNA阿拉巴马州运送谷丙氨酸,谷丙氨酸倾向于在5”末端鸟嘌呤位点和D环尿嘧啶位点产生tRF阿拉巴马州长度为20nt。大多数phasirna来源于NBS-LRR抗性基因。表达分析显示156个tRFs和68个phasiRNAs分别表达差异。一般来说,外源ABA主要抑制tRFs和phasiRNAs的表达。此外,对靶基因预测和转录组数据的综合分析表明,ABA显著下调了与生物和非生物抗性相关的phsaiRNAs的丰度。相应地,它们的靶基因如AP2 /小块土地,WRKY和NBS-LRR,STK和RLK,主要是上调。
结论
结合之前对ABA应答miRNAs的分析,推测ABA可以通过调节小rna(如miRNAs、tRFs、phasiRNAs)及其靶基因的表达和相互作用来提高植物对各种胁迫的抗性。该研究丰富了植物tRFs和phasiRNAs,为进一步研究植物在生物和非生物胁迫下对ABA的响应-tRFs和phasiRNAs及其功能提供了重要基础。
背景
RNA是以DNA链为模板,遵循互补碱基配对原则转录而成的单链核苷酸。长期以来,人们普遍认为RNA仅作为将遗传信息从DNA传递到蛋白质的中间媒介。然而,过去十年的研究表明,RNA在生命过程中发挥的作用比以前所理解的要重要。
植物内源性小RNA (sRNA)的长度一般在20 ~ 24 nt之间,最初是通过Dicer-like (DCL)蛋白的内切酶活性在较大RNA前体的螺旋区形成双链双链[7]。通过与Argonaute (AGO)蛋白结合,靶向靶RNA,发挥负转录后调控功能,在植物生长发育、逆境响应和表观遗传修饰等方面发挥重要作用[20.]。
tRNA是一类广泛存在且数量丰富的非编码RNA,长度一般在72 ~ 90nt之间。除了参与蛋白质合成外,tRNA还具有多种非规范功能,如参与细胞增殖、分化、凋亡和应激反应等生物过程[42,46]。tRF, tRNA衍生片段,是一类非编码sRNA,在精确调控下,通过特定的内切酶活性形成tRNA前体或成熟体。根据酶切位点的不同,可分为5种主要类型:5e-tRF、D-tRF、A-tRF、V-tRF和3e-tRF [44]。tRF,首先在海拉细胞中发现[33],广泛存在于真核生物和原核生物中,具有多种生物学功能,包括作为基因表达调节剂和应激反应中的信号分子[70]。目前,对tRF的研究主要是在动物身上进行的。有一些关于植物tRF的研究报道拟南芥[4,24,37],栽培稻[4,41],Physcomitrella金属盘[4,41],Cucurbita最大值[66],芸苔属植物拉伯[10),小麦[59]。Alves等人的研究[4[3]表明了tRF的产生机制拟南芥与miRNA不同,不依赖于DCL蛋白,但具体机制尚不清楚,推测s样核糖核酸酶1 (RNS1)可能参与了tRF的形成;共免疫沉淀实验表明,动物和植物tRF均可结合AGO蛋白家族参与RNAi,也可通过与其他sRNA相互作用调节基因表达和蛋白合成。此外,Alves等人还揭示了tRF在拟南芥,栽培稻和Physcomitrella金属盘在干旱、寒冷和氧化胁迫下[4]。据报道,tRF可以抑制转座因子,并通过补充靶基因来维持基因组的稳定性拟南芥稻米花粉[35,41]。然而,预测tRF靶基因的方法仍然不准确。
phasiRNA (phase, secondary, small interfering RNA, phasiRNA)是一类具有相位排列结构的植物特异性非编码siRNA,由蛋白质编码位点和非编码位点(统称为phasiRNA产生位点)上的mirna介导。pha位点)。根据其作用方式,phasiRNA可分为顺式作用siRNA (casiRNA)和反式作用siRNA (tasiRNA) [5,13,65]。的主要文本pha由RNA聚合酶II转录的基因与粗内质网上的多核糖体结合,并被mirna介导的AGO蛋白切割,产生相RNA前体;然后由RDR6 (RNA依赖性RNA聚合酶6)与SGS3(基因沉默抑制因子3)和SDE5(沉默缺陷因子5)辅助将其复制成双链RNA;双链RNA被DRB4 (dsrna结合因子4)和DCL4 (Dicer样4)复合体切割成从头到尾的短RNA片段,长度为21 nt或24 nt,即phasiRNA [69]。在植物生长发育过程中,PhsiRNA通过调节细胞分裂和分化参与植物生殖调节,影响组织器官的发育[8,19]。此外,phasiRNA在抵抗非生物胁迫中也发挥着重要作用[34,51,54]和病原体感染[26,61,68]。例如,miR6445-中产生的相rnaPHA18途径和miR393-PHA1/2通路可以调节的反应杨树trichocarpa分别对干旱和盐胁迫[51]。此外,phasiRNA的反式作用增强了番茄对马铃薯梭形块茎类病毒(PSTVd)的抗性[68]。
脱落酸根据其光学构型可分为S-ABA和R-ABA,天然活性脱落酸为S-ABA(简称ABA)。ABA是植物重要的内源激素,在植物生长发育过程中,能促进花、叶、果的脱落和种子的成熟休眠,调节气孔运动和开花,抑制生长,加速衰老[j]。2,49,52,62]。此外,ABA还能提高植物对干旱、高温、高盐、重金属等胁迫的耐受性,因此又被称为胁迫激素[29,32,38,43,71]。不同的研究对ABA在植物对病原体反应中的作用有不同的结论[39]。ABA对植物抗病性的调节作用是正调控还是负调控取决于病原菌类型、侵染方式、防御期、受影响组织类型和ABA浓度[j]。28]。我们前期的研究表明,低浓度的ABA可以显著提高番茄对多种病原菌的抗性,抑制靶向抗病基因的mirna的产生,促进抗病基因的表达[14,60],这与我们的实地实验结果一致。
番茄(茄属植物lycopersicum(2n = 24)是一种重要的园艺经济作物,遗传资源丰富,突变体多,基因组小(950 Mb),遗传图谱广泛,遗传转化系统高效稳定,易于杂交,繁殖系数高。随着2012年番茄基因组测序的完成,番茄已成为作物研究的重要模式植物[15]。
目前,关于植物tRFs和phasiRNAs的研究很少,它们对ABA的反应仍然是一个谜。本研究利用小RNA测序技术对番茄外源ABA响应的tRFs和phasiRNAs进行了鉴定和分析。分析了差异表达的phasiRNAs与其靶基因表达的相关性,推断了ABA增强植物抗病性和逆境适应性的结果。研究结果不仅丰富了植物tRFs和phasiRNAs,而且为进一步研究tRFs和phasiRNAs在植物响应ABA和适应生物和非生物胁迫中的作用提供了重要依据。
方法
植物材料
西红柿的种子。红太阳903(已商业化推广的品种)购自大连天地种子公司。有限公司如前所述,用ABA溶液和去离子水培养和处理植物[60]。简单地说,在中国四川省成都市,番茄种子被播种在塑料盆里,在自然光下在温室里生长。当西红柿长出5-7片叶子时,它们被随机分成两组。一组喷施2mg /L ABA水溶液作为处理组(A1D);另一组喷入与对照组(C1D)相同体积的去离子水。然后收集第三片叶片,在24 h后分别从两组中取出10株组合成混合样品,速冻后立即保存在液氮中供后续实验使用。
sRNA测序及文库建设
番茄转录组测序和sRNA测序的材料相同,分别于2013年和2016年完成测序[14,60]。采用Trizol试剂(Invitrogen, Carlsbad, CA)从C1D和A1D番茄叶片中分离总RNA。用15% PAGE凝胶将长度为18 - 30nt的小RNA从总RNA中分离出来,然后从凝胶中纯化。然后通过逆转录PCR将小rna逆转录成cdna。cdna在华大基因(中国深圳)Illumina HiSeq™2000上测序。对测序获得的原始reads进行优化,并与番茄基因组进行比对,进行sRNA注释,分析基因组中的表达和分布。
tRF和phasiRNA的鉴定和定量
tRNAscan-se软件(http://lowelab.ucsc.edu/tRNAscan-SE/)得到了番茄tRNA序列的二级结构信息,并对tRNA“三叶草”的各个“叶”序列进行了鉴定。根据Olvedy的分类原则[44], tRNA二级结构分为5e-tRF、D-tRF、A-tRF、V-tRF和3e-tRF五个部分。利用bowtie软件(http://bowtie-bio.sourceforge.net/index.shtml),且对齐方式无错匹配。根据比较结果,flaimapper软件识别的tRNA短读峰[64被视为扶轮基金会。计算某个后机匣与tRNA某部分二级结构的交点所占的比例,如果该比例达到75%,则将该后机匣归为该部分。由于tRNA的某些部分相交较长,如果有一个tRF落在相交处,则该tRF将同时分为两类。如果一个扶轮基金会在任何部分不能占据总长度的75%的交点,则该扶轮基金会被归类为其他扶轮基金会。然后,根据每个样本的tRNA的reads比较来量化tRF。对于每个reads,如果位于某个tRF外的碱基少于3个,则确定该reads来自该tRF,该reads的重复次数即为该tRF的表达水平或丰度。
根据郭等人的方法[22],使用phaseTank (http://phasetank.sourceforge.net/)将所有短读段与参考基因组进行比较,鉴定候选phasirna及其前体。PhaseTank使用一种新的评分系统来预测pha基因座和phasiRNA在全基因组范围内的调控网络。序列的相位分数由相位比、相位数和丰度决定。分数越大,序列为真的可能性越大pha基因。然后,候选phasiRNA前体序列与参考基因组中已知的基因元件序列相交,排除tRNA、rRNA等假阳性结果,剩余的长片段为phasiRNA前体。这些前体的短序列长度为21 nt即为phasiRNA,在基因组相应位置出现的phasiRNA的重复次数即为每个样品中phasiRNA的表达水平。
tRF与phasiRNA的差异表达分析
tRF和phasiRNA的reads以及miRNA的reads [14]作为一个整体进行归一化,归一化表达式数据的单位为每百万读数(RPM)。
一个tRF的归一化计数=(一个tRF的reads数/ tRF、phasiRNAs和miRNAs的reads数)*1,000,000。
一个phasiRNA的归一化计数=(一个phasiRNA的reads数/ trf、phasiRNA和mirna的reads数)*1,000,000。
将两个样本中tRF和phasiRNA的表达归一化后,分别分析tRF和phasiRNA的差异表达。与phasiRNA相同,通过将A1D中的tRF RPM除以C1D中的tRF RPM来计算fold-change。P-value按Audic [6]。至少有1 / log的表达式级别发生变化2叠化(日志2FC)|≥0.25P-值< 0.05被认为是对ABA处理的应答,并将tRF或phasiRNA的显著差异表达归为带有|log的序列2FC |≥1。tRF和phasiRNA2认为FC| < 0.25表达水平无明显变化。
phasiRNA靶标预测
由于tRF靶基因预测方法尚不成熟,本研究仅参照Enright等人的方法预测了phasiRNA靶基因[18]。基于三种性质的phasiRNA靶标预测方法[j]1,36]:使用miRanda算法计算的序列互补性评分、RNA-RNA双链的自由能和相关基因组中靶位点的保守性。一般来说,分数越高,自由能越低,则目标关系越强。这里,本研究设置的阈值为:得分≥500,自由能≤- 50。
结果
sRNA测序结果
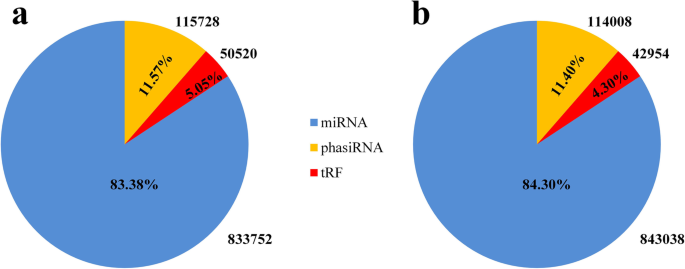
我们分别从ABA处理组(A1D)和对照组(C1D)的番茄叶片构建了sRNA文库,几乎涵盖了所有的sRNA,包括mirna、siRNA、tRNA、rRNA、snRNA、snoRNA、外显子或内含子降解片段[14]。通过将这些sRNA clean reads注释到番茄基因组中,鉴定出733个tRFs (C1D中的545个,AID中的536个)和137个phasiRNAs。此外,我们发现在C1D和A1D的注释srna中,mirna所占的比例更高。因此,我们对番茄tRFs、phasiRNAs和miRNAs的表达水平进行了全面归一化分析,探讨tRFs和phasiRNAs在这些sRNAs中的比例及其对外源ABA的响应。
对三种sRNAs、tRFs、phasiRNAs和miRNAs的表达进行总体归一化分析显示,在对照组(C1D)中,miRNAs的总表达量为833,750 RPM(占83.38%),tRFs的总表达量为50,520 RPM(占5.05%),phasiRNAs的总表达量为115728 RPM(占11.57%)。1).同样,在处理组(A1D)中,每种sRNA的总表达量mirna为843,038 RPM(占84.30%),trf为42,954 RPM(占4.30%),phasiRNAs为114,008 RPM(占11.40%)。1 b).此外,与C1D相比,A1D中miRNAs、tRFs和phasiRNAs的表达量下降,分别减少9288、9566和1720 RPM。
番茄tRFs对外源ABA的响应及差异表达分析
后机匣的特点
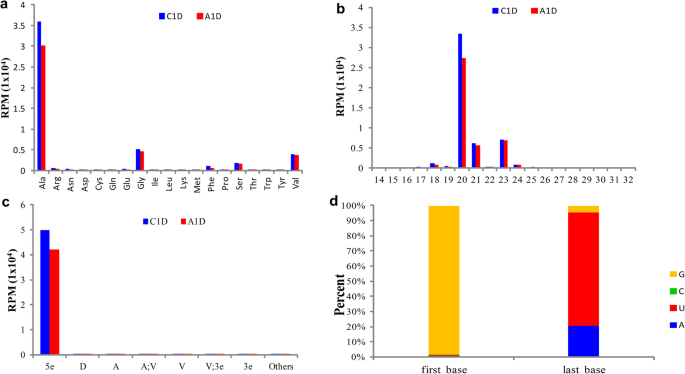
我们分别分析了C1D和A1D中tRF的来源、长度、类型和碱基偏好。结果基本一致,但存在差异(图2)。2).除tRNA种类外,鉴定的trf均来源于tRNA他的(转运组氨酸的tRNA等),其中大部分来源于tRNA阿拉巴马州,然后是tRNA通用电气, tRNA瓦尔和tRNA爵士(无花果。2).
长度分析显示后机匣的长度主要为20 nt(图2)。2 b).大部分trf都在5e-tRF范围内,C1D占绝对优势比例为98.67%,A1D占绝对优势比例为98.35%(图2)。2摄氏度).分析这些5e-tRFs在C1D和A1D中的第一碱基和最后碱基的偏好,发现大部分的5e-tRFs在C1D和A1D中都有”末端碱基为鸟嘌呤(G),分别占98.57%和98.93%”其中尿嘧啶(U)分别占74.86%和73.79%(图2)。二维).由于5e-tRF在A1D和C1D中的碱基偏好基本相同,图1。2仅显示了5e-tRF在C1D中的碱基分布。
综上所述,C1D和A1D中鉴定的trf主要来源于tRNA阿拉巴马州,并倾向于产生tRF阿拉巴马州(trf源自tRNA阿拉巴马州,等),通过在tRNA 5处切割,长度为20nt”末端鸟嘌呤位点和D环尿嘧啶位点(类似于5e-tRF)。
tRF的差异表达分析
总的来说,与C1D相比,A1D中tRF的总表达量明显下降(从50,520转到42,954转),尤其是tRF阿拉巴马州。只有5种tRF略有增加,即tRFAsp,扶轮基金会半胱氨酸,扶轮基金会箴,扶轮基金会用力推和扶轮基金会Trp(无花果。2).按长度分类,长度为15 - 23nt的tRFs在A1D中的表达较C1D减少。其中,长度为20 nt的后机匣在6081.12 RPM时丰度最高,降幅最大(图2)。2 b).
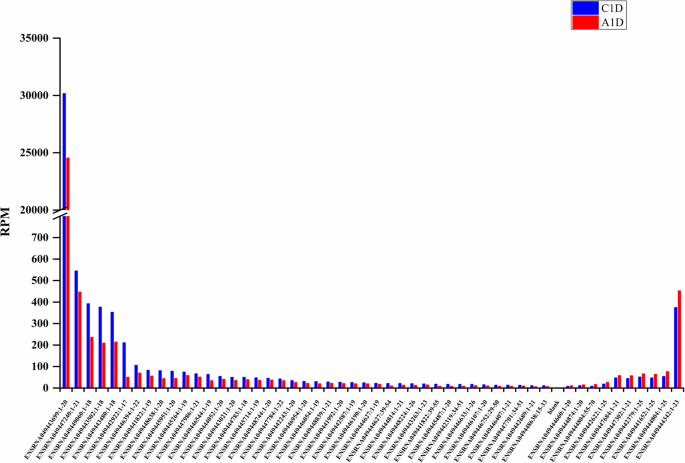
在C1D和A1D中共鉴定出733个trf(补充表S)1).为了降低噪声,我们将C1D和A1D中表达水平低于2 RPM的tRFs去除,然后留下230个tRFs用于后续的差异表达分析。在230个trf中,156个存在差异表达2FC|≥0.25p< 0.05),其中上调74个,下调82个;74例无显著变化(|log)2FC| < 0.25)(补充表52).在156个差异表达的trf中,51个在至少一个文库中表达了超过10个rpm(补充表S)3.).51个tRFs以其表达水平为坐标,观察C1D和A1D的变化(图2)。3.).结果表明,51个tRFs中有41个被下调,下调tRFs的总丰度从33,315.52 RPM下降到26,572.77 RPM,减少了6742.75 RPM;而上调后的tRFs从663.41 RPM增加到840.83 RPM,仅增加了177.42 RPM。tRF (ID: ENSRNA049443699:1-20)是tRF的一种阿拉巴马州, C1D表达30155.81 RPM, A1D表达24539.08 RPM,下降5616.73 RPM,远高于其他tRFs(小于600 RPM)。结果表明,喷施外源ABA普遍抑制tRF的表达,特别是抑制20 nt tRF的表达阿拉巴马州。此外,tRF的表达Asp从166.1 RPM增加到236.72 RPM, tRF的表达增加Glu从491.46转降低到326.82转。
番茄phasiRNAs对外源ABA的响应及其与抗逆性的关系
pha位点
在C1D和A1D中共鉴定出137个相rna (Supplementary Table S)4).分析pha结果表明,110个phasiRNAs来自蛋白编码基因,27个phasiRNAs来自非编码基因。在110个来源于蛋白质编码基因的相rna中,60个来源于NBS-LRR(核苷酸结合位点-亮氨酸富重复)基因,4源于RLK(受体样激酶)基因,1个来自抗病蛋白r3a样编码基因,7个来自编码锌指CCCH结构域的蛋白编码基因,2个来自生长素F-box蛋白5编码基因,2个来自推定的Os03g0370250蛋白编码基因,34个来自未注释的蛋白编码基因(表1)1).
phasiRNA的差异表达分析
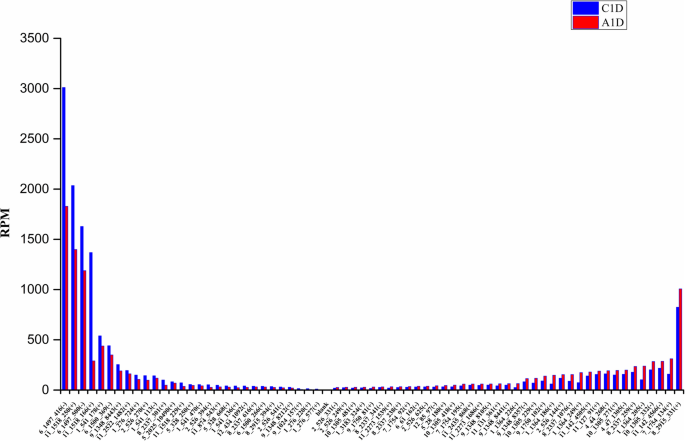
在至少一个文库中,所有137个phasirna的最小RPM值为10,因此可以直接用于差异表达分析(补充表S)5).其中差异表达68例2FC|≥0.25p< 0.05),其中上调39个,下调29个;而69则无显著变化2FC| < 0.25)(补充表56).在68个phasirna中,虽然下调的phasirna(29个)少于上调的phasirna(39个),但下调的phasirna的丰度和下降幅度都远高于上调的phasirna(图2)。4).下调相rna的总丰度从10715.98减少到6710.06 RPM,减少了4005.92 RPM;上调相rna的总丰度从3715.64增加到5529.62 RPM,只增加了1543.98 RPM。结果表明,对ABA有响应的phasiRNAs丰度较高,ABA普遍抑制其表达。
靶向应激相关基因的差异表达phasiRNAs
此外,利用Enright等人的方法[18]预测68个差异表达的phasirna的靶基因,并由此得知耐药相关的phasirna(补充表S)7).此外,结合ABA应答的比较转录组数据,分析这些phasiRNAs丰度变化对靶基因表达的影响(Supplementary Table S)8).
结果显示,预测有15个差异表达的phasiRNAs靶向耐药相关基因,其中7个靶向TFs, 12个靶向耐药基因(R基因)。TFs包括AP2/ERF (apetala2 /乙烯反应元件结合因子)、MYB (v-myb禽成髓细胞病病毒癌基因同源物)、NAC、ARF(生长素反应因子)、GRAS、bHLH(碱性螺旋-环-螺旋蛋白)和WRKY。R基因包括NBS-LRR,STK(丝氨酸/苏氨酸蛋白激酶)和RLK(表2).
总体而言,尽管耐药相关的phasirna下调(7)的幅度小于上调(8),但下调的phasirna的丰度和变异程度都远高于上调的phasirna。相应的,大多数抗性靶基因表达上调。此外,一些phasiRNAs靶向多个基因,同样,一个基因可以被多个phasiRNAs靶向。
在靶向tf的7个差异表达的phasirna中,4个上调,3个下调。它们的表达及对靶基因的影响与上述结果一致。特别是,一些下调的phasiRNAs靶向多个基因,下降幅度较大,如11_1518_166(+)(1368.32 ~ 291.07 RPM)和11_1518_229(+)(72.79 ~ 37.35 RPM)。这两种phasirna靶向5种AP2 /小块土地基因(包括小块土地基因),并且在转录数据中检测到三个转录本并升高(表2)2).
四个MYB三个phasirna分别为1_1364_249(+)、10_1305_229(+)和11_1518_229(+)。上调的1_1364_249(+)(74.25至174.64 RPM)和10_1305_229(+)(70.83至118.08 RPM)的目标相同MYB基因,但没有检测到转录本。下调的11_1518_229(+)也靶向3个基因的5个转录本MYB基因,其中1个转录本升高,4个转录本不变。
此外,下调的11_1518_229(+)也靶向2个南汽基因,但只检测到一个转录本没有改变。此外,两个东盟地区论坛基因被三个阶段rna靶向,分别为1_1364_205(−)、1_1364_226(−)和11_1518_250(+)。其中,1_1364_205(−)(103.08至239.45 RPM)和1_1364_226(−)(25.4至64.8 RPM)的上调目标相同东盟地区论坛基因,其中一个检测到的转录本没有改变。然而,下调的11_1518_250(+)(2035.14 ~ 1398.8 RPM)靶向另一个转录本东盟地区论坛基因,升高了。
肝,bHLH和WRKY被下调的11_1518_166(+)同时靶向。预计它会靶向一个基因的两个转录本肝基因,没有改变。预计它还会靶向一个基因的两个转录本bHLH基因,其中一个转录本升高,另一个不变。此外,预计它的目标是两个的三个转录本WRKY基因,所有这些都升高了。
总之,预测总共有7种差异表达的phasirna靶向上述tf。预计三个下调的phasirna将靶向15个TF基因的17个转录本,其中9个表达增加,8个保持不变。预计四个上调的phasirna将靶向两个未改变的TF基因。
本研究预测了12个差异表达的phasirna(6个上调,6个下调)作为靶标NBS-LRRs,STK年代或RLK5 .结合转录组数据分析靶基因的表达,结果显示,这些ABA应答的靶抗性基因大部分上调。
13NBS-LRR基因(21个转录本)被下调的1_541_136(+)、6_1497_500(−)和11_1518_229(+)以及上调的9_1750_102(+)、11_131_361(+)和11_2273_1539(+)六个phasiRNAs靶向。在检测到的7个转录本中,有4个NBS-LRR低表达phasiRNAs靶向的基因中,3个升高,4个变化不明显。其中14个检测到了9个NBS-LRR上调表达的phasiRNAs所靶向的基因有6个升高,4个降低,4个变化不明显。
14STK通过下调的1_541_136(+)、6_1497_500(−)、11_1518_166(+)和11_1518_229(+)以及上调的1_1364_205(−)、1_1364_226(−)、10_1305_418(+)和11_131_361(+)8个phasiRNAs靶向30个转录本基因。在17个检测到的转录本中,有11个STK低表达phasiRNAs靶向的基因9个升高,3个降低,5个变化不明显。其中13个检测到7个STK上调表达的phasiRNAs所靶向的基因有6个升高,2个降低,5个变化不明显。此外,发现Solyc02g083900.2.1被1_541_136(+)和11_131_361(+)靶向,Solyc01g106770.2.1同时被1_541_136(+)、11_1518_166(+)和11_131_361(+)靶向。
24RLK通过下调的1_541_178(+)、6_1497_500(−)、6_1500_369(−)、11_1518_166(+)、11_1518_229(+)和上调的9_1750_102(+)、11_131_361(+)、11_2273_1539(+)8个phasiRNAs靶向40个转录本基因。在38个检测到的转录本中,有22个RLK低表达phasiRNAs靶向的基因有18个升高,4个降低,16个变化不明显。其中4个检测到4个的转录本RLK被上表达的phasiRNAs靶向的1个基因升高,3个基因变化不明显。此外,发现Solyc12g056730.1.1同时被11_131_361(+)和11_1518_166(+)靶向,对应两个转录本。
总之,有12个差异表达的phasirna被预测为靶标NBS-LRR,STK或RLK在这项研究中。其中,6个下调phasirna的总表达丰度从4091.77降低到2330.79 RPM,降低了1760.98 RPM。他们瞄准了62个转录本NBS-LRR,STK或RLK30个转录本表达增加,7个表达减少,25个保持不变。6个上调phasirna的总表达丰度从316.07 RPM增加到590.39 RPM,增加了274.32 RPM。他们瞄准了31个转录本NBS-LRR,STK或RLK表达增加13个,表达减少6个,表达不变12个。因此,结果表明,下调的phasirna丰度更高,变化范围更大,更有效。它们的表达变化与其靶基因的表达变化基本呈负相关。这些差异表达的靶基因大部分被上调。其中,抗性靶基因数量最多,主要由两个下调的phasirna 11_1518_166(+)和11_1518_229(+)靶向。
讨论
sRNA对ABA的响应
外源ABA诱导番茄sRNA对ABA产生响应。作为研究最深入的sRNA, mirna通过剪接靶mRNA并抑制其翻译或与其他sRNA的相互作用,直接或间接参与调控植物生长发育、生物和非生物胁迫响应等生命活动[56]。因此,我们在本研究中对番茄tRFs、phasiRNAs和miRNAs的表达水平进行了全面的归一化分析。结果发现,在C1D和A1D中,miRNAs的表达量远高于phasiRNAs和tRFs,且tRFs丰度最低。推测miRNAs的生理调控作用大于phasiRNAs和tRFs。在一定程度上,mirna的功能甚至可能掩盖phasirna和trf的功能。因此,在探究番茄tRFs和phasiRNAs对外源ABA的响应时,有必要将这三种sRNAs的表达作为一个整体进行正常化。此外,施用外源ABA后,番茄miRNAs、tRFs和phasiRNAs的丰度降低,说明外源ABA可以抑制miRNAs、tRFs和phasiRNAs的表达。
后机匣的特点
在本研究中,大部分trf来源于tRNA阿拉巴马州它倾向于产生tRF阿拉巴马州在tRNA处切割,长度为20nt阿拉巴马州5”末端鸟嘌呤位点和D环尿嘧啶位点。以往的研究表明,在胁迫作用下,不同物种甚至同一植物的不同组织的tRF表达谱会发生不同范围的变化,但总的来说,tRF的表达是不变的Asp会增加,而扶轮基金会的表达Glu会减少[10]。同样,在本研究中,tRF的表达AsptRFGlu在外源ABA处理后表达下调。推测tRF的上调与AsptRF的下调Glu是植物应对压力的常见方式。C1D和A1D中tRFs的长度以20 nt为主,与中预测的tRFs的长度分布相似拟南芥[4]。结果表明,ABA对trf的长度没有影响。然而,与C1D相比,A1D中tRF的总表达水平明显降低,而tRF的表达阿拉巴马州长度为20 nt时减少最多,说明外源ABA的喷洒抑制了tRF的表达,特别是抑制了20 nt tRF的产生阿拉巴马州。
大多数预测的trf都在5e-tRF范围内,这与人类前列腺癌细胞中trf的类型分布相似[33],日本血吸虫[11],拟南芥,栽培稻和Physcomitrella金属盘[4]。说明tRF在tRNA的任何位置都没有被切割,主要在tRNA 5上产生”推测其处理tRFs的方式具有进化保守性。此外,虽然外源ABA处理后5e-tRFs的表达量有所下降,但在A1D中5e-tRFs仍占绝对优势地位,这与玉米叶片、顶部分生组织、花粉和胚乳中tRFs的类型分布相似芸苔属植物拉伯在高温应力下[10],表明应激处理没有改变tRNA加工产生tRF的方式。根据Olvedy等人的分类标准[44], tRNA起始位置与d环“发夹”的最后第三个碱基之间的片段为5e-tRF。根据tRNA“三叶草”二级结构,5e-tRF的标准长度仅为20 nt,这表明本次测序所鉴定的trf大部分从tRNA 5开始”端和端到d环。5号航站楼”在C1D和A1D中,5e-tRF的碱基主要是鸟嘌呤,这与水稻花粉和A1D的碱基偏好一致拟南芥[35,37]。推测可能与tRNA 5有关”末端受体臂碱基对鸟嘌呤的偏好,这似乎与tRFs的产生和稳定性有关[35]。5e-tRFs在A1D和C1D中的碱基偏好基本相同,说明碱基偏好是保守的,不会因外源ABA的处理而改变。
总体而言,外源ABA处理在诱导或抑制部分tRF表达的同时,并未改变番茄tRF的来源、长度、类型和碱基偏好。
ABA诱导tRFs的差异表达
总体而言,在剩余的156个丰度至少在C1D或A1D中超过2 RPM的tRFs中,下调tRFs的数量(82个)多于上调tRFs的数量(74个)。进一步分析丰度至少在C1D或A1D中大于10rpm的差异表达tRFs, 51个tRFs显示下调tRFs的数量(41个)多于上调tRFs的数量(10个)。同样,tRF下调表达的总丰度(33,315.52 ~ 26,572.77 RPM)远高于上调表达的总丰度(663.41 ~ 840.83 RPM),说明ABA对tRF表达的抑制作用强于促进作用。据报道,植物tRF表达谱在生物和非生物胁迫下发生不同范围的变化。在拟南芥在缺磷、干旱胁迫或病原菌侵染下,tRFs丰度增加[25,37]。然而,大多数trf的丰度芸苔属植物拉伯叶片、胚、胚乳和胚珠在高温下减少[10]。在本研究中,低浓度ABA处理的番茄叶片中大部分trf均下调。据此推测,植物可能通过调节tRFs的表达来应对逆境,但具体机制尚不清楚,需要进一步研究。此外,扶轮基金会的金额阿拉巴马州(ID: ENSRNA049443699:1-20)远高于其他基因,这可能起了重要作用。
pha位点
137个相rna中110个来源于蛋白编码基因,这与双子叶植物相rna主要来源于蛋白编码基因的结论一致[63]。此外,我们的结果表明,它们中的大多数来自于NBS-LRR和RLK抗性基因,这与其他研究的结果相似[50,61,65]。在大豆和Medicago truncatula, miR2118触发TIR-NBS-LRR在水稻和拟南芥中也发现了类似的靶基因位点[26,55]。结合对phasiRNAs靶基因的预测结果,推测phasiRNAs可能在植物抗病中发挥重要作用。
ABA诱导phasiRNAs的差异表达
外源ABA处理后,phasiRNAs的表达发生了差异。这里检测到68个phasiRNAs的差异表达。虽然下调的phasiRNAs数量(29个)低于上调的phasiRNAs数量(39个),但下调的phasiRNAs总体丰度和变异范围(10715.98 ~ 6710.06 RPM)远高于上调的phasiRNAs数量(3715.64 ~ 5529.62 RPM)。说明ABA对phasiRNAs表达的抑制作用强于促进作用。先前的研究表明,在不同的范围内,phasiRNAs的表达发生了变化拟南芥在缺磷条件下[25),在杨树trichocarpa在干旱下[51在番茄中感染了b . cinereal[61]。本研究中,外源ABA处理后番茄叶片中phasiRNA的表达普遍受到抑制,说明ABA可以调控phasiRNA的表达,进一步证明了phasiRNA可能参与植物对不同生物和非生物胁迫的响应。
参与应激反应的phasiRNAs
靶向tf的phasirna
转录因子(Transcription factors, TFs),又称反式作用因子,通过与靶基因启动子区特定的DNA序列(称为顺式作用元件)结合,激活或抑制靶基因的转录表达[48]。越来越多的研究表明,除了植物的生长发育外,植物转运因子在植物适应各种生物和非生物胁迫方面也发挥着越来越重要的作用。许多TFs基因的表达包括AP2 /小块土地,MYB,bHLH和WRKY可受多种生物和非生物胁迫诱导,如高盐、干旱、低温、植物激素、病原菌感染等[16,27,47,58]。TF基因的过表达或敲除会影响植物对多种胁迫的耐受性。如拟南芥AP2/ERF基因过表达RAP2.2可提高植物对灰霉病的抗性,但敲除基因后易感性大大增加[67]。以及WRKY基因的过表达BcWRKY46和CaWRKY40能分别提高烟草的耐低温性和辣椒的耐热性和青枯病性[16,57]。
本研究预测7种tf的18个转录本是7种phasiRNAs的靶标,其中被上调的phasiRNAs靶向的转录本要么未被检测到,要么表达保持不变。然而,下调phasiRNAs靶向的tf显示,大多数转录本表达增强,没有转录本表达降低,有些转录本保持不变或未被检测到。由于下调phasirna的丰度和变异度都高于上调phasirna,因此推测下调phasirna的作用也更强。
因此,外源ABA抑制了针对TFs的phasiRNAs的表达,上调了TFs的表达,这可能提高了植物对各种生物和非生物胁迫的耐受性。此外,我们发现对照组和治疗组中phasiRNAs靶向的tf丰度都相对较低(FPKM < 15),推测这与它们的生理作用密切相关。TFs通过与靶基因启动子区顺式作用元件结合,调控多种下游功能基因的表达,其丰度的微小变化会引发一系列下游信号放大级联反应,从而引起一系列生理变化[60]。
靶向R基因的phasirna
据报道,有多个pha在R基因中保护植物免受病原体侵害的位点,并且由此产生的phasirna也靶向R基因[61]。许多phasirna可以调节其他的NBS-LRR在靶向a后,以顺式或跨式的方式进行基因座的定位NBS-LRR转录,呈现扩增级联效应,增强植物抗病性[65]。同样,大多数phasirna起源于NBS-LRR和RLK并且大多数差异表达的phasirna预计会靶向抗性基因NBS-LRR,STK和RLK在这项研究中。NBS-LRR抗病蛋白可直接或间接识别病原体,刺激下游信号级联反应,进而引发防御反应、超敏反应或细胞凋亡[9,17]。在本研究中,三个下调的phasirna靶向7个NBS-LRR转录本,其中3个在外源ABA处理后升高,4个不变。三个上调的phasirna靶向14个NBS-LRR转录本,其中6个升高,4个降低,4个不变。总之,目标NBS-LRR基因表达上调9个,不变8个,下调4个。关于本研究中检测到的phasiRNAs及其耐药基因的关系,我们在后面一起讨论。
STK作为R基因家族的重要成员,广泛存在于各种植物中,其功能之一是参与环境和病原体胁迫信号的传递[12]。截至目前,共有57名STK成员拟南芥,其中23个已被证实参与对水杨酸、ABA、高盐度、高渗透、冷热胁迫的响应[45]。水稻抗白叶枯病基因Xa21[53小麦抗叶锈病基因Lr10[21和番茄假单胞菌抗性基因美国专利商标局[40]都包含STK域。在本研究中,4个下调的phasirna靶向17个STK转录本,其中9个表达增加,3个表达减少,5个保持不变。4个上调的phasirna靶向13个STK转录本,其中6个表达增加,2个表达减少,5个保持不变。
RLK属于STK家族,因其结构和功能类似于动物受体激酶(酪氨酸蛋白激酶)而得名,通过感知外界信号在植物生长发育、信号转导和各种胁迫反应中发挥重要作用[3.,31]。人们发现拟南芥RLK家族基因WAKL4在Cu2 +、锌2 +和倪2 +治疗,WAKL4基因T-DNA插入突变体对铜敏感2 +和锌2 +的宽容拟南芥过度表达WAKL4Ni基因2 +增强了[23]。Kim和Hwang发现了一个辣椒(甜椒)受体样细胞质蛋白激酶基因CaPIK1被油菜黄单胞菌感染后转录激活。辣椒发汗和水杨酸含量过表达CaPIK1基因比野生型高,当植物受到病原菌感染时,CaPIK1蛋白通过水杨酸途径调控防御反应[30.]。在本研究中,5个下调的phasiRNAs靶向38个RLK转录本,其中18个在ABA处理后升高,4个降低,16个不变。三个上调的phasiRNA靶向4个RLK转录本,其中1个升高,3个不变。
总的来说,下调phasiRNARs靶向的R基因转录本表达水平大多增加或保持不变(30个升高,7个降低,25个不变),表明下调phasiRNARs与靶R基因呈阴性。但上调的phasirna与它们的靶标相关性不明显(13个升高,6个降低,12个不变)。推测下调的影响更强,与上述原因相同,下调的phasirna (4091.77 ~ 2330.79 RPM)的丰度和变异量远高于上调的phasirna (316.07 ~ 590.39 RPM)。它也可能是其他非编码rna相互作用的结果。
重要的是,6_1497_500(−)(1628.21 ~ 1188.46 RPM)、11_1518_166(+)(1368.32 ~ 291.07)和11_1518_229(+)(72.79 ~ 37.35)这三个phasiRNAs靶向多个基因(包括tf和R基因),它们的丰度受ABA影响的程度较大。结果表明,它们可能在植物的逆境适应中发挥关键作用。它们的作用应作进一步调查。
总的来说,ABA导致phasiRNAs下调,而TFs和抗性蛋白基因上调,表明phasiRNAs与靶基因呈负相关。这表明ABA可以提高植物的环境抗性和抗病性,结果与我们的现场结果一致(数据未显示)。
结论
综上所述,外源ABA的应用抑制了番茄中tRFs和phasiRNAs的表达,显著降低了与抗逆性相关的phsaiRNAs的丰度,上调了与抗逆性和抗病性相关的相应靶基因的表达,包括AP2/ERF、MYB、NAC、ARF、GRAS、bHLH、WRKY和R基因的TFsNBS-LRR,STK,RLK。结合前人对ABA响应的比较转录组和miRNAs的分析,提出ABA可以通过调节miRNAs、phasiRNAs和tRFs等sRNAs与靶基因的表达和相互作用,提高植物对各种生物和非生物胁迫的适应性。
数据和材料的可用性
所有测序reads均存入Sequence Read Archive数据库,检索号:PRJNA209403 (https://trace.ncbi.nlm.nih.gov/Traces/sra_sub/sub.cgi?subid=1943955&from = list&action = show:提交)。
缩写
- A1D:
-
治疗组
- 阿坝:
-
脱落酸
- C1D:
-
对照组
- NBS-LRR:
-
核苷酸结合位点-富含亮氨酸重复序列
- phasiRNA:
-
阶段性的,次级的,小干扰RNA
- RLK:
-
受体激酶
- 转:
-
每百万读取数
- STK:
-
丝氨酸/ threonine-protein激酶
- TF:
-
转录因子
- 扶轮基金会:
-
tRNA-derived片段
- bHLH:
-
基本helix-loop-helix
参考文献
- 1.
Abrahante JE, paul AL, Li M, Volk ML, Tennessen JM, Miller EA, Rougvie AE。秀丽隐杆线虫驼背样基因lin-57/hbl-1控制发育时间并受microrna调控。生物医学进展,2003;4(5):625-37。
- 2.
adaddicott FT, Lyon JL, Ohkuma K, Thiessen WE, Carns HR, Smith OE, Cornforth JW, Milborrow BV, Ryback G, Wareing PF.脱落酸:脱落蛋白II (dormin)的新名称。科学。1968;159:1493。
- 3.
Afzal AJ, Wood AJ, Lightfoot DA。植物受体样丝氨酸苏氨酸激酶:在信号传导和植物防御中的作用。植物与微生物学报。2008;21(1):57 - 57。https://doi.org/10.1094/MPMI-21-5-0507。
- 4.
Alves CS, Vicentini R, Duarte GT, Pinoti VF, Vincentz M, Nogueira FTS。陆地植物trna衍生RNA片段的全基因组鉴定和表征。植物化学学报,2016;33(3):357 - 357。https://doi.org/10.1007/s11103-016-0545-9。
- 5.
Arikit S,夏锐,Kakrana A,黄坤,翟杰,闫志,Valdes-Lopez O, Prince S, Musket TA, Nguyen HT, Stacey G, Meyers BC。大豆小rna图谱鉴定了来自数百个编码基因的阶段性sirna。植物学报。2014;26(2):481 - 481。https://doi.org/10.1105/tpc.114.131847。
- 6.
奥迪克S,克拉维里JM。数字基因表达谱的意义。基因工程学报。1997;7:986-95。https://doi.org/10.1101/gr.7.10.986。
- 7.
Axtell乔丹。植物小rna的分类与比较。植物学报,2013;44(4):559 - 559。https://doi.org/10.1146/annurev-arplant-050312-120043。
- 8.
邓文华,陈文华,陈文华,等。小分子rna的发育模式。现代信息技术,2014;27:83-91。https://doi.org/10.1016/j.gde.2014.04.004。
- 9.
植物抗病基因:功能与结构的结合。植物学报。1996;8:1757-71。https://doi.org/10.1105/tpc.8.10.1757。
- 10.
Byeon B, Bilichak A, Kovalchuk .组织特异性热诱导ncRNA片段表达的变化芸苔属植物拉伯植物。生物工程学报。2018;14:38 - 56。https://doi.org/10.1016/j.bcab.2018.03.024。
- 11.
蔡鹏飞,朴学祥,郝丽丽,刘顺,侯宁,王辉,陈启军。日本血吸虫卵非编码小RNA群体的深入分析。科学通报,2013;8:e64003。https://doi.org/10.1371/journal.pone.0064003。
- 12.
曹安志,邢丽萍,王学祥,杨晓明,王伟,孙玉玲,钱超,倪建林,陈玉萍,刘大杰,王雪霞,陈佩德。丝氨酸/苏氨酸激酶基因Stpk-V是小麦抗白粉病基因Pm21的关键成员之一,它赋予小麦抗白粉病的能力。科学通报,2011;38(1):1 - 7。https://doi.org/10.1073/pnas.1016981108。
- 13.
陈海明,陈立林,Patel K,李永华,Baulcombe DC,吴世生。22核苷酸rna触发植物次生siRNA生物发生。科学通报,2010;37(4):591 - 591。https://doi.org/10.1073/pnas.1001738107。
- 14.
程海燕,王勇,陶翔,范云峰,戴勇,杨华,马小荣。番茄外源脱落酸应答microrna的基因组分析(茄属植物lycopersicum).BMC Genomics. 2016;17:423。https://doi.org/10.1186/s12864-016-2591-8。
- 15.
财团TTG。番茄基因组序列提供了对肉质果实进化的深入了解。大自然。2012;485:635-41。https://doi.org/10.1038/nature11119。
- 16.
党福福,王永宁,于磊,Eulgem T,赖勇,刘志强,王鑫,邱爱玲,张天涛,林杰。辣椒WRKY蛋白CaWRKY40在辣椒耐热性和抗茄青枯菌侵染调控中发挥重要作用。植物学报。2013;36(6):757 - 764。https://doi.org/10.1111/pce.12011。
- 17.
唐格尔JL,琼斯JD。植物病原体和对感染的综合防御反应。大自然。2001;411:826-33。https://doi.org/10.1038/35081161。
- 18.
Enright AJ, John B, Gaul U, Tuschl T, Sander C, Marks DS。果蝇中的MicroRNA靶标。中国生物医学工程学报,2003;5:1 - 4。https://doi.org/10.1186/gb-2003-5-1-r1。
- 19.
范勇,杨军,Mathioni SM,于军,沈军,杨旭,王磊,张强,蔡铮,徐超,李翔,肖军,Meyers BC。PMS1T产生阶段性小干扰rna,调控水稻光敏雄性不育。科学通报,2016;33(3):391 - 391。https://doi.org/10.1073/pnas.1619159114。
- 20.
费强,夏锐,梅耶斯。转录后调控网络中的阶段性、次级、小干扰rna。植物学报。2013;25:2400-15。https://doi.org/10.1105/tpc.113.114652。
- 21.
张建军,张建军,张建军,等。一种新的受体样激酶基因的克隆Lr10小麦抗病位点。植物学报,2010;11:45-52。https://doi.org/10.1046/j.1365-313X.1997.11010045.x。
- 22.
郭清良,曲晓峰,金文华。PhaseTank: phasirna及其调控级联的全基因组计算鉴定。生物信息学。2015;31:284-6。https://doi.org/10.1093/bioinformatics/btu628。
- 23.
侯晓伟,童海燕,杰西S,简达文,彭新,何铮。细胞壁相关激酶WAKL4参与拟南芥矿物质反应。植物生理学报。2005;139:1704-16。https://doi.org/10.1104/pp.105.066910。
- 24.
谢丽玲,林思,郭海峰,邱天杰。磷酸盐饥渴拟南芥根系中trna衍生小rna的丰度。植物信号学报,2010;5:537-9。https://doi.org/10.4161/psb.11029。
- 25.
谢丽玲,林思,施国强,陈建伟,林毅伟,曾颖颖,李文辉,邱天杰。通过深度测序揭示小rna介导的拟南芥对磷酸盐缺乏的反应。植物生理学报。2009;51(1):2102 - 2102。https://doi.org/10.1104/pp.109.147280。
- 26.
Jagadeeswaran G,郑勇,李玉峰,Shukla Li, Matts J, Hoyt P, Macmil SL, Wiley GB, Roe BA,张伟,Sunkar R.Medicago truncatula揭示了四个新的豆类特异性microRNA家族。新植物学家。2009;184:85-98。https://doi.org/10.1111/j.1469-8137.2009.02915.x。
- 27.
姜艳,杨波,Deyholos MK.拟南芥bHLH92转录因子在非生物胁迫中的功能研究。基因工程学报。2009;28:503 - 16。https://doi.org/10.1007/s00438-009-0481-3。
- 28.
朱莉安,李春华,杨丽娟。ABA在植物抗病中的作用。植物科学,2009;14:31 - 7。https://doi.org/10.1016/j.tplants.2009.03.006。
- 29.
Khadri M, Tejera NA, Lluch C.氯化钠与aba的相互作用(菜豆耐盐性不同的品种。植物生态学报。2007;26(1):1 - 8。https://doi.org/10.1016/j.envexpbot.2006.10.008。
- 30.
金德生,黄宝康。辣椒受体样细胞质蛋白激酶CaPIK1参与植物防御和细胞死亡反应的信号转导。植物科学学报。2011;33(6):544 - 544。https://doi.org/10.1111/j.1365-313X.2011.04525.x。
- 31.
李建军,李建军,李建军。细胞壁相关蛋白激酶WAK4的反义表达抑制细胞伸长并改变细胞形态。植物学报。2001;13(3):1317 - 1331。https://doi.org/10.2307/3871298。
- 32.
钙、脱落酸、乙烯和水杨酸对拟南芥热应激诱导氧化损伤的保护作用。植物生理学报。2002;28(2):682 - 95。https://doi.org/10.1104/pp.010320。
- 33.
李春华,李春华,李春华,等。一类新型小RNA: trna衍生的RNA片段(tRFs)。基因工程学报,2009;23:2639-49。https://doi.org/10.1101/gad.1837609。
- 34.
李松,刘军,刘志,李欣,吴峰,何勇。拟南芥热诱导TAS1 TARGET1通过热胁迫转录因子a1a介导耐热性。植物学报,2014;26(6):764 - 780。https://doi.org/10.1105/tpc.114.124883。
- 35.
刘伟,童亚,白洁(2018)水稻雄性配子体发育中trna来源片段的生物信息学分析。植物学报53:625-633。Doi:https://doi.org/10.11983/CBB17169。
- 36.
刘建军,刘建军,刘建军,刘建军,刘建军。秀丽隐杆线虫的驼背同源物hbl-1控制着时间模式,可能是MicroRNA的靶标。生态学报,2003;4(5):639-50。
- 37.
Loss-Morais G, Margis W, Peter M.与argonaute相关的植物trna衍生RNA片段(trf)的描述及其推测靶标的鉴定。生物医学杂志。2013;8:6-10。https://doi.org/10.1186/1745-6150-8-6。
- 38.
马华奇,王志强,王志强,Gómez-Cadenas .甜菜碱和脱落酸对木瓜水分亏缺胁迫的影响。植物学报,2012;31 - 10。https://doi.org/10.1007/s00344-011-9214-z。
- 39.
脱落酸在植物-病原体相互作用中的作用。[J] .植物生理学报,2009;56(6):742 - 742。https://doi.org/10.1134/S102144370906003X。
- 40.
Martin GB, Brommonschenkel SH, Chunwongse J, Frary A, Ganal MW, Spivey R, Wu T, Earle ED, Tanksley SD。番茄抗病蛋白激酶基因的图谱克隆。科学。1993;262:1432-6。https://doi.org/10.1126/science.7902614。
- 41.
马丁内斯G,乔杜里SG,斯洛特金RK。trna衍生的小rna靶向转座元件转录物。核酸学报,2017;45(5):542 - 552。https://doi.org/10.1093/nar/gkx103。
- 42.
梅燕,勇杰,刘宏,石燕,Meinkoth J, Dreyfuss G,杨晓霞。tRNA结合细胞色素抑制caspase激活。生物化学学报。2010;37:668-78。https://doi.org/10.1016/j.molcel.2010.01.023。
- 43.
孟富珍,胡丽萍,王胜,隋晓玲,魏玲,魏永祥,孙建林,张志祥。外源ABA对低温下黄瓜幼苗叶片碳水化合物代谢的影响植物学报。2008;56(6):533 - 544。https://doi.org/10.1007/s10725-008-9303-6。
- 44.
Olvedy M, Scaravilli M, hoogstrat Y, Visakorpi T, Jenster G, Martens-Uzunova ES。前列腺癌中trna衍生片段的综合曲目。Oncotarget。2016;7:24766 - 77。https://doi.org/10.18632/oncotarget.8293。
- 45.
杨建军,刘建军,刘建军,等。植物丝氨酸/苏氨酸/酪氨酸特异性蛋白激酶的全基因组分析与实验研究。植物化学学报。2006;30(2):391 - 391。https://doi.org/10.1007/s11103-005-4109-7。
- 46.
Phizicky EM, Hopper AK。tRNA生物学冲到了前面。中国生物医学工程学报,2010;24(1):532 - 536。https://doi.org/10.1101/gad.1956510。
- 47.
Raffaele S, Rivas S, Roby D.水杨酸在拟南芥atmyb30介导的超敏细胞死亡程序控制中的重要作用。中国生物医学工程学报。2006;38(2):391 - 394。https://doi.org/10.1016/j.febslet.2006.05.027。
- 48.
王晓明,王晓明。植物转录因子数据库的比较分析。Curr Genomics. 2009; 10:10-7。https://doi.org/10.2174/138920209787581253。
- 49.
Rohde A, Kurup S, Holdsworth M. ABI3从种子中出现。植物科学,2000;5:418-9。https://doi.org/10.1016/s1360 - 1385 (00) 01736 - 2。
- 50.
沈厄,刘毅,叶云云,范丽娟。植物非编码小rna的研究进展。浙江大学学报(农业与生命科学版)2014; 40:370-8。https://doi.org/10.3785/j.issn.1008-9209.2014.04.211。
- 51.
帅鹏,苏勇,梁东,张志,夏霞,尹伟。水稻干旱响应性与相rna的鉴定杨树trichocarpa。财经学报,2016;59:3616 - 27。https://doi.org/10.1002/1873-3468.12419。
- 52.
宋文文,马晓荣,谭华,周建勇。脱落酸增强番茄幼苗对茄疫病的抗性。植物生理学报,2011;49(1):693 - 700。https://doi.org/10.1016/j.plaphy.2011.03.018。
- 53.
宋文勇,王国良,陈丽丽,金合生,皮利利,Holsten T, Gardner J,王波,翟文新,朱丽莲,Fauquet C, Ronald P.水稻抗病基因A受体激酶样蛋白的编码Xa21。科学。1995;270:1804-6。https://doi.org/10.1126/science.270.5243.1804。
- 54.
张建军,张建军,张建军,张建军。豆科植物miR1514a调节NAC转录因子转录物触发phasiRNA形成以应对干旱。实验学报,2017;68:2013-26。https://doi.org/10.1093/jxb/erw380。
- 55.
孙亚忠,梅忠,刘霞,严爱康,秦海,黄福林,陈凤凤,姚思敏,林海明,林宝玲。大豆早期发育阶段Glycine max和Glycine max小RNA谱的比较。中国生物医学工程学报,2016;17(2):444 - 444。https://doi.org/10.3390/ijms17122043。
- 56.
孙卡荣,李艳芳,Jagadeeswaran G. microrna在植物逆境响应中的作用。植物科学,2012;17(6):196 - 203。https://doi.org/10.1016/j.tplants.2012.01.010。
- 57.
王峰,侯霞,王忠,王松,姜芳,李勇。一种新的白菜冷诱导基因(芸苔属植物定ssp。对),BcWRKY46提高转基因烟草的耐冷、耐盐和脱水胁迫能力。中国生物医学工程学报,2012;39(1):1 - 4。https://doi.org/10.1007/s11033-011-1245-9。
- 58.
王旭,陈旭,刘毅,高宏,王忠,孙刚。CkDREB基因锦鸡儿几种作为AP2/EREBP转录因子参与多种非生物胁迫胁迫反应的调控。中国生物医学工程学报(英文版);2011;38(4):591 - 591。https://doi.org/10.1007/s11033-010-0425-3。
- 59.
王艳,李慧,孙强,姚颖。小麦幼苗trna、RNAs和snoRNAs衍生小rna的特征及其对热胁迫的响应。科学通报,2016;11:e0150933。https://doi.org/10.1371/journal.pone.0150933。
- 60.
王Y,道X,唐XM,肖L,孙建立,燕XF,李D,邓HY,马XR。番茄(茄属植物lycopersicum)对外源性脱落酸的反应。生物医学工程学报,2013;14(4):841。https://doi.org/10.1186/1471-2164-14-841。
- 61.
吴福林,陈毅,田霞,朱晓玲,金文华。全基因组鉴定和表征的阶段性小干扰RNA基因的响应葡萄孢菌感染茄属植物lycopersicum。科学代表2017;7:30 019。https://doi.org/10.1038/s41598-017-02233-x。
- 62.
严建伟,方丽,杨丽,何红,黄燕,刘燕,张安。Abscisic acid insensitive4介导拟南芥MUR4转录促进,通过Abscisic acid insensitive4正调控L -阿拉伯糖代谢抑制种子萌发。植物学报,2020;225(2):823-34。https://doi.org/10.1111/nph.16149。
- 63.
杨艳,周云峰,张玉春,陈玉青。草相rna与雄性生育力。中国生命科学,2018;61:148-54。https://doi.org/10.1007/s11427-017-9166-3。
- 64.
刘建军,刘建军,刘建军。FlaiMapper:利用RNA-seq高通量数据对nrna衍生小片段进行计算注释。生物信息学。2015;31:665 - 73。https://doi.org/10.1093/bioinformatics/btu696。
- 65.
翟军,郑东辉,De Paoli E,等。microrna作为植物NB-LRR防御基因家族的主要调控因子,通过产生阶段性的、反式的sirna。中国生物医学工程学报,2011;25(5):544 - 544。https://doi.org/10.1101/gad.177527.111。
- 66.
张松,孙丽,Kragler F.韧皮部递送RNA库中含有小分子非编码RNA并干扰翻译。植物生理学报。2009;15(2):378 - 387。https://doi.org/10.1104/pp.108.134767。
- 67.
赵颖,魏涛,尹克勤,陈志,顾华,曲丽娟,秦刚RAP2.2在植物对葡萄孢菌和乙烯的抗性反应中起重要作用。植物学报。2012;19(5):450 - 60。https://doi.org/10.1111/j.1469-8137.2012.04160.x。
- 68.
郑艳,王艳,丁斌,费铮。综合转录组分析表明,马铃薯纺锤体块茎类病毒可触发选择性剪接、诱导相rna反式活性和免疫应答的全基因组变化。中国生物医学工程学报,2017;31(1):444 - 444。https://doi.org/10.1128/JVI.00247-17。
- 69.
朱彩霞,熊伟,莫碧霞。植物相rna的研究进展。生命科学学报,2018;30:831-9。https://doi.org/10.13376/j.cbls/2018098。
- 70.
朱立文,谢勇,郭建明。tRNA衍生片段和tRNA半片段的生物学功能及其在发病机制中的作用。生物化学学报,2017;44(4):565 - 72。https://doi.org/10.16476/j.pibb.2017.0163。
- 71.
宗宁,王海红,李志祥,马玲,谢玲,庞建林,范玉玲,赵军。玉米NCP1通过与转录因子ABP9相互作用并抑制其活性负向调控干旱和ABA响应。植物化学学报,2014;39(3):339 - 357。https://doi.org/10.1007/s11103-019-00951-6。
致谢
我们感谢匿名审稿人和编辑对本文的改进提出的建设性意见和建议。
资金
研究的设计、数据的收集、分析、解释以及论文的撰写得到了中国国家重点研究发展计划(批准号:2017YFD0201301)和四川省重点研究发展计划(批准号:2019YFN0017)的支持。
作者信息
从属关系
贡献
XRM, WL构思和设计研究,撰写和修改稿件。YW, XT和CXL进行了实验。WL, YD, XYL, MP分析数据。XRM也监督,严格修改,并补充写作。所有作者都阅读并认可了稿件。
相应的作者
道德声明
伦理批准并同意参与
不适用。
发表同意书
不适用。
相互竞争的利益
作者宣称他们没有竞争利益。
额外的信息
出版商的注意
施普林格·自然对已出版的地图和机构关系中的管辖权要求保持中立。
补充信息
附加文件1表S1
。本研究中发现的tRFs列表及其表达水平。表S2。降低噪声后tRFs对照(C1D)和aba处理(A1D)文库中的差异表达水平。表S3。一个库中具有最小10 RPM值的差异表达trf列表。表S4。本研究中鉴定的phasiRNAs列表及其表达水平。表S5。对照(C1D)和aba处理(A1D)相rna文库中的差异表达水平。表S6。一个文库中最小10 RPM值的差异表达phasirna列表。表S7。phasiRNAs的靶基因。表S8。phasiRNAs靶点的表达模式
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,该协议允许以任何媒介或格式使用、共享、改编、分发和复制,只要您适当地注明原作者和来源,提供知识共享许可协议的链接,并注明是否进行了更改。本文中的图像或其他第三方材料包含在文章的知识共享许可协议中,除非在材料的署名中另有说明。如果材料未包含在文章的知识共享许可中,并且您的预期用途不被法律法规允许或超过允许的用途,您将需要直接获得版权所有者的许可。如欲查阅本许可证副本,请浏览http://creativecommons.org/licenses/by/4.0/。创作共用公共领域免责声明(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非在数据的信用额度中另有说明。
关于本文
引用本文
栾伟,戴勇,李,刘晓东。et al。番茄中tRFs和phasirna的鉴定茄属植物lycopersicum)和它们对外源脱落酸的反应。BMC Plant Biol20.320(2020)。https://doi.org/10.1186/s12870-020-02528-8
收到了:
接受:
发表:
关键字
- 扶轮基金会
- phasiRNA
- 脱落酸(ABA)
- RNA-Seq
- 转录因子
- 抗性基因