抽象的
背景
Calvin循环在碳固定中起着至关重要的作用,为植物生长和发育提供有机大分子的前体。目前,通过突变体或基于地图的克隆方法在单子叶植物中没有参与Calvin循环中的基因。
结果
在这里,我们分离了一个低分蘖突变体,c6635,在米饭中(栽培稻).突变体展示浅绿色叶片,在早期生长阶段的颜料含量强烈下降和光合产能。此外,其个体植物尺寸较小,大多数人只生产了两个分蘖。在成熟的阶段,其生产性圆锥花序,粒子数和种子设定率显着降低,这导致籽粒产量的急剧降低。我们证实单一的核苷酸突变LOC_Os04g16680编码Calvin循环中涉及的Sedoheptulose1,7-双磷酸酶(SBPase)的基因对突变表型负责c6635通过基于地图的克隆,mutmap分析和互补实验.序列分析表明,点突变导致SBPase c端由Gly-364突变为Asp。此外,OSSBPase.基因主要在叶片中表达,并且编码蛋白位于叶绿体中。突变OSSBPase.可以显着影响Calvin循环所涉及的一些关键基因的表达水平。
结论
我们成功确定了一个SBP.单圈植物中的ASE基因。同时,我们证明了该基因3'-末端的单个核苷酸取代严重影响植物生长和谷物产量,这意味着SBPase的C末端的Gly-364可以在水稻中的SBPase功能中发挥重要作用。
背景
地球上的人类和其他生命的能量取决于最初来自太阳。作为将太阳能转化为化学能的唯一生物过程,光合作用是对人类生存的重要性。超过90%的作物生物量来自光合产物[1].作物光合效率是影响作物产量的关键因素。光合作用包括光反应和暗反应,也称为固定碳反应。在自养生物的五种固碳途径中,卡尔文循环是植物中唯一使用的生物合成过程[2].光合碳同化呈C3植物的钙氏循环效率低,这是作物产量的限制因素[3.那4.].
卡尔文循环是光合作用的第一个途径并将大气中的二氧化碳同化为有机化合物的骨架,这是有机大分子的前体,是植物生长和发育的基础[5.那6.].它发生在叶绿体基质中,并包含在三个不同阶段的11个酶催化的13个酶促步骤:核苷酸的羧化1,5-双磷酸(摩擦),减少3-磷酸糖,rubp的再生[7.那8.].卡尔文循环中的第一个酶促反应是RuBP的羧化反应。它转换公司2并用氢丝二磷酸羧酸酯/氧酶(Rubisco)催化并催化为两种3-磷酸盐。竞争对手抑制氧气对Rubisco导致RUBP的较低速度低,因此Rubisco是光合作用中的一个关键率限制酶[9.那10.那11.].将3-磷酸糖醛的减少到甘油醛3-磷酸盐由3-磷酸甘油糖激酶(Pgkinase)和甘油醛-3-磷酸脱氢酶(GAPDH)催化的两种酶促反应组成。Remp的再生是一种相对复合阶段,包括催化八个酶的10个步骤:三糖磷酸异构酶(TPI),醛糖酶,果糖-1,6-双磷酸醛糖酶(FBAase),转铁糖醇酶,Sedoheptulose1,7-双磷酸酶(SBP酶),核苷酸酶5-磷酸映像酶(RPE),核糖5-磷酸异构酶(RPI),磷脂酶(Prkase)[8.].在这个阶段,再生反应的电子传递能力有限是Calvin循环中碳同化无效的另一个原因[12.].FBAase和SBPase是Remp再生中的两个关键酶。FBAase催化两种反应:一种是将甘氨醛3-磷酸酯和二羟基丙酮磷酸酯(DHAP)转化为果糖1,6-双磷酸盐,另一个是赤藓糖4-磷酸酯和DHAP转化为Sedoheptulose1,7-双磷酸盐。SBPase催化Sedoheppeptulose 1,7-双磷酸盐至Sedoheppatelose 7-磷酸盐,并在将同化的碳分配给再生阶段以再生摩擦或淀粉生物合成中的循环中的淀粉生物合成起到至关重要的作用[13.那14.].这种特殊的作用强调了SBPase在卡尔文循环或光合作用中碳固定的重要性[5.那15.那16.].
全长cDNA或基因组DNASBPase基因已从各种光合生物中分离出来。首个克隆其全长cDNA序列的研究是在小麦(小麦)通过使用玉米SBPase筛选小麦cDNA文库[17.].此后,全长SBPase一些生物体的基因已经被确认,例如拟南芥和衣藻reinhardtii使用文库筛选方法获得cDNA或基因组DNA [18.那19.]和桑树(桑树), 白饭 (栽培稻)和黄瓜(Cucumis sativus),通过RACE (cDNA末端快速扩增)克隆出cDNA序列[20.那21.那22.].此外,拟南芥通过T-DNA插入突变体研究了SBPase基因[7.].然而,没有向克隆报告包括水稻和其他单圈子的研究SBPase利用突变体或/和基于图谱的克隆方法进行基因克隆。
在我们的研究中,一种低分蘖突变体,c6635,被鉴定在水稻中。突变体表现出严重迟钝的生长和发育,并急剧降低谷物产量。基于地图的克隆,高通量测序,Mutmap分析和互补实验表明了单一的核苷酸突变LOC_Os04g16680在卡尔文循环中编码SBPase的基因与突变表型有关.OSSBPase.主要用叶片表达,其编码蛋白位于叶绿体中。此外,Calvin周期的六个关键基因的表达水平c6635在苗期采用qRT-PCR检测突变体。
结果
由于严重迟钝的生长和发育,突变体显示出急剧降低的谷物产量
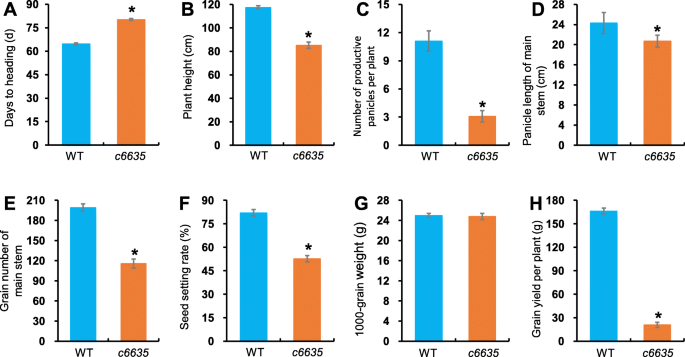
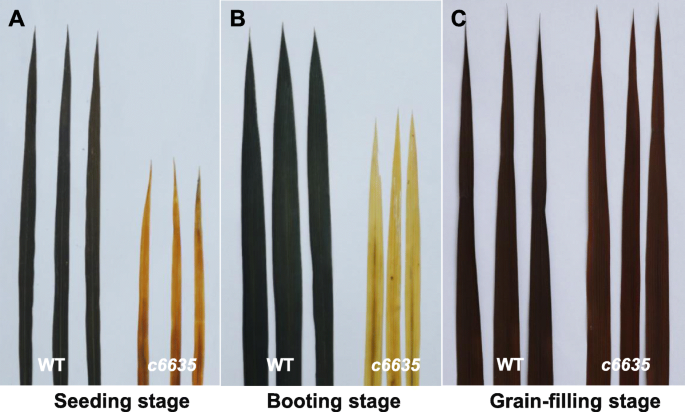
叶子c6635突变体在早期生长阶段显示浅绿色,在籽粒灌装阶段时转动野生型正常绿色(图。1a, c)。此外,它的单株显示出更小的大小,大多数个体只产生两个分蘖(图。1b,c)。另外,与野生型相比,突变体的标题阶段延迟了15.6天(图。2一种)。结果,成熟阶段的大多数农艺性状受到影响很大c6635突变体。例如,植物高度,每株植物的生产穗数,主要茎的晶粒数和种子设定率分别显着下降27.4,67.5,41.8和35.7%(图。2B,C,E,F)。最终,粮食产量c6635显著降低了87.5%(图。1D,2H)。结果表明突变c6635严重影响植物生长和粮食产量。
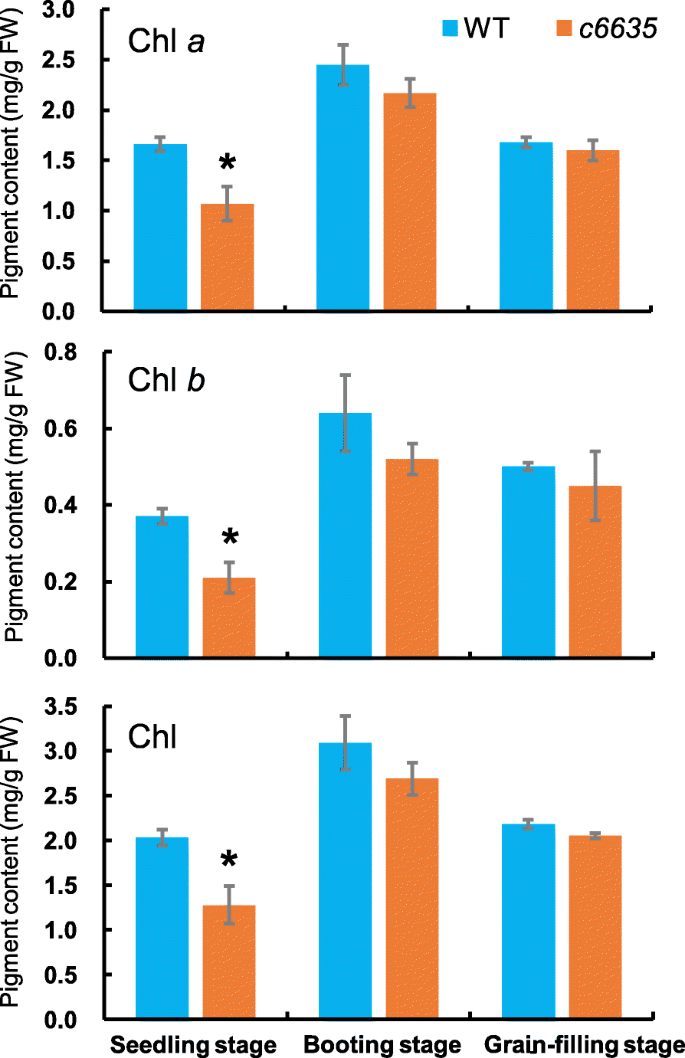
量化叶子颜色c6635,分别测量培养阶段突变体和野生型的颜料含量,引导阶段和籽粒填充阶段。与野生型相比,颜料含量包括CHL一种的背影,B.突变体中的总CHL分别在幼苗阶段分别显着降低35.5,43.2和36.5%(图。3.).然而,突变体在引导阶段和籽粒灌装阶段的颜料含量仍然略微降低,而与野生型无显着差异(图。3.).事实上,在籽粒灌装阶段,叶子颜色c6635已经转过常绿,其颜料含量也恢复到正常的野生类型。结果表明,浅绿色叶片表型c6635在幼苗阶段是由于颜料含量减少。
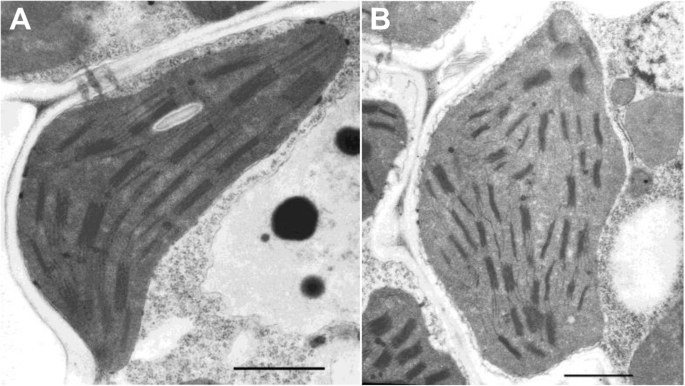
为了检测叶绿体的发展c6635突变体,使用透射电子显微镜观察其在幼苗阶段的叶绿体超微结构。野生型的囊体堆叠成甲状腺肿(图。4.a),而紫胶木c6635堆叠轻微失真(图。4.b).叶绿体的发育在一定程度上受到抑制c6635突变体。
突变体叶片的光合能力和淀粉含量在生长初期显著下降
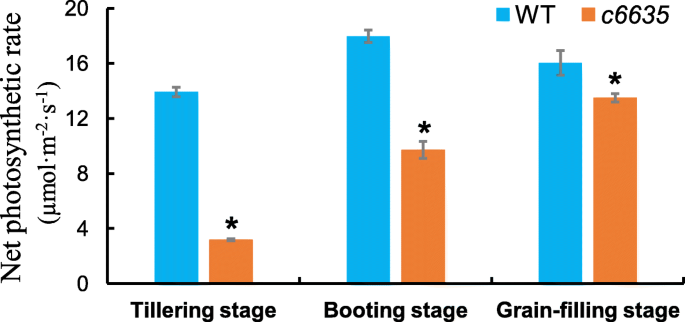
为了调查光合作用是否受到影响c6635用便携式光合仪测定了突变体各时期的净光合速率。净光合速率c6635与野生型相比,分别在分蘖下,引导和籽粒填充阶段的突变体分别显着降低77.1,46.0和15.9%(图。5.).光合参数数据表明,紫花苜蓿的光合能力c6635突变体在早期生长阶段明显缺乏,但在籽粒灌装阶段逐渐恢复。
调查淀粉积累是否受到影响c6635突变体,采用淀粉碘法检测叶片中淀粉含量。如图所示。6.在野生型叶片和靴子阶段的野生叶片中观察到深棕色或黑色,而在叶子中观察到浅棕色或浅黄色c6635突变体在相同阶段(图。6.a, b).在灌浆期,野生型和野生型的叶片c6635突变体染成棕色,虽然野生型叶子仍然略深于于c6635(图。6.C)。结果表明,只有一点淀粉堆积在叶子中c6635在幼苗和启动阶段的突变体,但淀粉积累在c6635叶片几乎恢复到籽粒灌装阶段的正常野生型水平,这与叶片颜色的变化和突变体的净光合速率一致。
这c6635定位到一个推测的编码卡尔文循环的SBPase基因
为了进行突变体的遗传分析,c6635与野生亲本中华11号(japonica.品种,下文中ZH11)构建f1和F2人口。f的所有植物1群体叶色和分蘖数与野生型相同。在F中观察到正常表型和突变表型2人口并表现出良好的契约,分离比为3:1(χ2<χ20.05 = 3.84,P. > 0.05). The results indicated that mutant phenotype ofc6635由单个隐性基因控制。
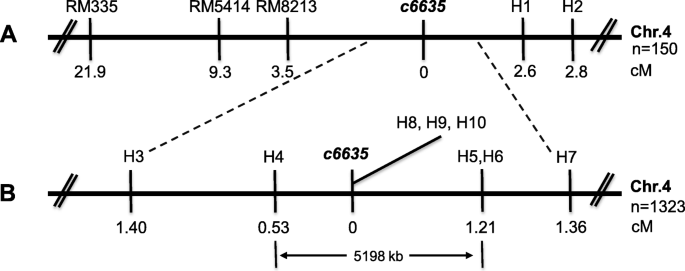
测绘种群是由杂交得来的c6635和indic品种Gang46B (G46B)。利用分布在水稻12条染色体上的300多个SSR标记进行初步定位。初步结果表明,突变基因位于第4染色体上,与RM335连锁。然后是SSR标记RM8213和RM5414,以及新设计的InDel标记H1和H2(表2)1)被用于映射,并且c6635轨迹位于染色体4的Centromere附近的短臂上的RM8213和H1之间的区域(图。7.一种)。随后,八个更多的indel标记(表1)用于进一步的映射。最后,c6635轨迹限于H4和H5之间的区域,其物理距离为5200kb(图。7.b)。
由于H4和H5之间的较大的物理距离,使用高通量测序和Mutmap方法来鉴定该区域中的候选基因。高通量测序结果25个突变植物,浅绿色叶片和较少的分蘖(c6635/ Zh11)f2人口显示ZH11之间的14个SNPc6635位于5200kb区域内的基因组(附加文件1:表S1)。在这些SNPs中,只有两个引起错义突变:一个位于一个基因(loc_os04g18760.)编码Retrotransposon蛋白Ty3-Gypsy子类,另一个位于基因中(LOC_Os04g16680根据水稻基因组注释项目编码果糖-1,6-双磷酸酶。NCBI在NCBI中使用BLASTP的氨基酸序列比对的结果表明,LOM_OS04G16680对SBPase具有高度同源的拟南芥.然后,我们放大并测序LOC_Os04g16680野生类型的基因和c6635突变体,结果未发现,在组基因序列中被处于基因组序列的置位2143替代的单个核苷酸G引起从甘氨酸-364的氨基酸变化到编码蛋白的C末端的ASP。因此,我们确定了LOC_Os04g16680基因作为负责突变表型的候选基因c6635,并暂时被指定为OSSBPase..
序列分析表明OSSBPase.基因包含8个外显子和7个内含子,基因组DNA为2750 bp, cDNA为1179 bp,编码392个氨基酸,分子量约为42.2 kD。利用ChloroP和TargetP预测了OsSBPase蛋白n端21个氨基酸残基的叶绿体过境肽(图。8.).多序列对齐显示OSSBPase的同源物在单圈,双象状,苔藓和藻类中广泛存在。此外,OSSBPase与单圈植物的同源物具有高相似性Broachypodium distachyon.那小麦和Zea Mays.和二象植物Cucumis sativus那尼科尼亚塔哈瓦姆和拟南芥和苔藓Physcomitrella patens.和Marchantia polymorpha和海藻衣藻reinhardtii那山脉浮子和Tetrabaena Socialis.同一性分别为94.4、93.7、92.9、83.2、81.6、74.4、77.0、75.2、69.9、69.3和65.7%。8.).系统发育分析表明,OSSBPase与单圈植物的同源蛋白质的关系最接近(图。9.).
OsSBPase的同源序列。黑色阴影表示相同的残留物,灰色阴影表示相似的残留物(≥75%相同)。蓝色箭头表示OsSBPase突变位点;红色下划线表示推测的叶绿体信号肽。红色三角形表示FBP/SBP域的残基,黑色三角形表示AMP域的残基。各蛋白序列的GenBank登录号如下:OsSBPase (栽培稻,loc_os04g16680),bdsbpase(Broachypodium distachyon., XP_003564625.1), tasbase (小麦, CBH32512.1), ZmSBPase (Zea Mays.,onm36378.1),cssbpase(Cucumis sativus,acq82818.1),ntsbpase(尼科尼亚塔哈瓦姆,AII99841.1),ATSBPase(拟南芥, AAB33001.1), PpSBPase (Physcomitrella patens., XP_024376141.1), MpSBPase (Marchantia polymorpha,ABF68592.1),CRSBPase(衣藻reinhardtii, XP_001691997.1), GpSBPase (性原细胞胸,kxz56517.1),tssbpase(Tetrabaena Socialis.PNH12434.1)
OsSBPase及其同源基因的系统发育分析。各蛋白序列的GenBank登录号如图所示。8.
突变体的表型c6635通过与野生型的转化而获救OSSBPase.基因
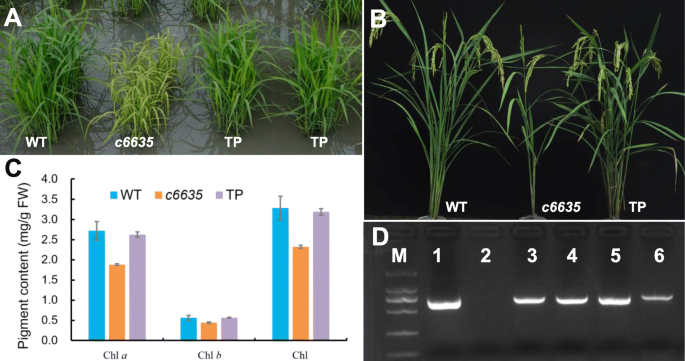
为了确认您选择负责突变表型的候选基因c6635,通过转化野生型全长cDNA来进行遗传互补实验OSSBPase.基因肌动蛋白1推动者进入c6635突变体。最终获得19个独立的转基因株系,PCR检测17个株系为阳性转基因株系。结果表明,17个转基因阳性株系叶片颜色和分蘖数均正常。10.A,B,D)。此外,转基因系中的颜料含量对幼苗阶段的野生型没有差异(图。10.c).互补结果验证了单核苷酸取代OSSBPase.基因对表型负责c6635.
互补的c6635突变体与OSSBPase.来自野生型的基因。一种野生型(WT)表型c6635突变体,以及苗期pcr阳性转基因植株(TP)。B.WT的表型,c6635晶粒灌装阶段的突变体和TP植物。CWT的颜料含量,c6635突变体和TP植物在幼苗阶段。误差栏表示SD。D.PCR阳性转基因系的PCR试验(从附加文件中裁剪2:图S1)。M:DL-2000标记;1:PCR阳性对照(PC2300- actin-OSSBPase.质粒);2:PCR阴性对照(c6635突变体);3-6: pcr阳性转基因品系
OsSBPase蛋白定位于叶绿体中
据预测,OSSBPase蛋白含有叶绿体过渡肽,其在其N-末端使用氯气和靶标在其N-末端的氨基酸残基[23.那24.].为了确定OsSBPase的实际亚细胞定位,将融合蛋白OsSBPase-eGFP和绿色荧光蛋白(eGFP)转化并在水稻原生质体中瞬时表达。OsSBPase-eGFP融合蛋白的绿色荧光与叶绿素的红色荧光具有相同的模式(图)。11.一种)。然而,在用空载体转化的整个原生质体中观察到来自EGFP的绿色荧光(图。11.b)。结果证实,OSSBPase位于叶绿体中,与其用作钙素循环的关键酶的位置一致。应该注意的是,突变部位c6635突变体从叶绿体过渡肽的编码区中出来,不应影响突变的OSSBPase的定位,尽管它影响了类囊体,颜料含量,光合作用,生物质和籽粒产量的形态。
OSSBPase.基因主要在叶片中表达
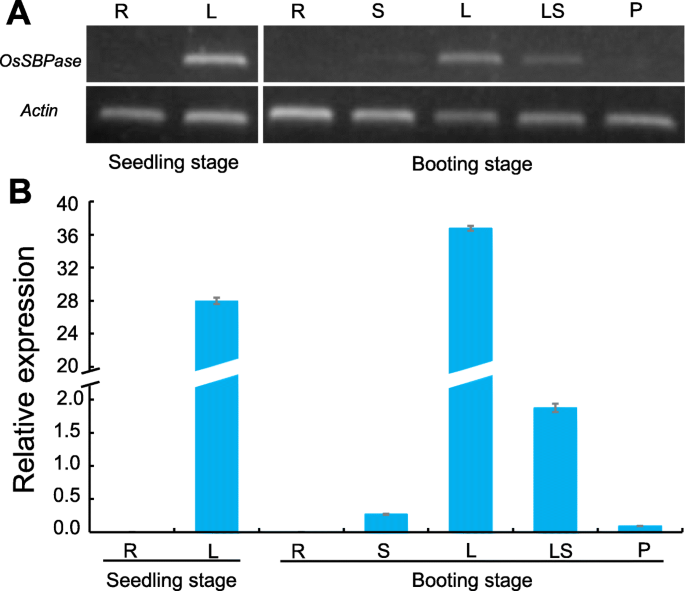
探讨。的时空表达模式OsSBPase,从幼苗和靴子阶段的各种组织或器官中提取的总RNA用于进行半定量和定量RT-PCR分析。这两种测试显示出相同的时空表达模式,即在幼苗和引导阶段,在叶片和引导阶段具有极高的表达,在叶子鞘中的高表达和茎和青少年在引导阶段的轻微表达,但两个阶段没有可检测到的根本(无花果。12.).结果表明OSSBPase.主要用叶片表达并根本根本表达。
表达模式的OSSBPase.通过半定量分析(一种)(从附加文件中裁剪3.:图S2)和实时定量分析(B.).R:根,S:茎,L:叶片,LS:叶鞘,P:幼穗。actin 1.被检查为内部控制。误差栏表示SD
该突变体影响了卡尔文周期的一些关键基因的表达水平
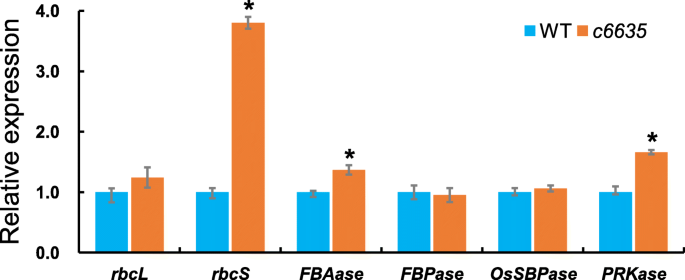
调查影响的影响OSSBPase.对Calvin循环的基因转录的突变,我们检测到Calvin循环的六个关键基因的表达水平(rbcl.那RBCS.那FBAase.那FBPase那OSSBPase.和Prkase.)通过在幼苗阶段进行实时定量PCR。rbcl.和RBCS.编码Rubisco的大小亚基,Rubisco是一种限速酶,催化卡尔文循环中的第一个反应。fbase酶催化两种反应,决定了二羟基丙酮磷酸(DHAP)在卡尔文循环中的命运。FBPase催化果糖1,6-二磷酸转化为果糖1,6-二磷酸。PRKase催化5-磷酸核酮糖转化为1,5-二磷酸核酮糖。如图所示。13.,六个关键基因对突变显示出不同的反应OSSBPase.在c6635突变体。的表达水平RBCS.那FBAase.和Prkase.在c6635与野生型相比有显着上调,而表达水平rbcl.那FBPase和OSSBPase.显示没有区别c6635和野生类型。有趣的是,RBCS.表现出最大的表达差异约为四倍c6635和野生类型。结果表明OSSBPase.突变对卡尔文周期相关关键基因的表达有显著影响。
讨论
到现在,SBPase利用各种方法和技术克隆了许多物种的基因[7.那18.那19.那20.那21.那22.].但是,没有SBPase使用突变体和/或基于地图的克隆方法克隆了单子叶植物的基因。在本研究中,我们表征了一种低分蘖突变体c6635.通过基于地图的克隆和mutmap分析,我们发现了C6635基因座在水稻中编码了Sedohepheplose 1,7-双磷酸酶(OSSBP酶)。进一步的互补分析表明,低分蘖表型c6635在引入野生型全长基因组序列后拯救突变体OSSBPase.基因。因此,我们成功地识别了aSBPase通过突变体和基于地图的克隆方法在单子叶植物中的基因。
卡尔文循环是提供有机大分子前体的基本生物过程,是植物生长发育的基础[5.那6.].因此,Calvin循环基因中的表达水平或突变可能导致植物的延迟生长和发育[7.那25.那26.那27.那28.那29.那30.那31.].例如,SBPase活性降低20%的反义转基因烟草表现出生长速率降低和褪绿[27.].T-DNA插入叶片塑料FBPase基因造成较少的叶片,更小的尺寸,较低的生长率,并降低了拟南芥的鲜美[30.].拟南芥sbp突变体,缺乏SBPase,呈淡绿色,莲座叶更紧密,植株也小得多[7.].在我们的研究中,OSSBPase.突变体c6635显示浅绿色叶子,在早期生长阶段的颜料含量和光合容量强烈衰落。此外,其个体植物尺寸较小,大多数人只生产了两个分蘖。在成熟的阶段,其生产性圆锥花序,粒子数和种子设定率显着降低,这导致籽粒产量的急剧降低。有趣的是,c6635突变体在叶子颜色,颜料含量和颗粒灌装阶段的淀粉积累中回收到正常水平(图。1C,3.那6.C),这是两者的区别c6635和两个拟南芥T-DNA插入突变体。差异化的原因可能是那个SBPase和FBPase拟南芥的基因sbp和CFBP1.突变体是由于T-DNA插入而几乎没有功能缺失的等位基因[7.那30.],而在3'-末端的单个核苷酸替代SBPase在c6635突变体没有引起功能完全失去功能。对叶子颜色恢复的另一种解释c6635在籽粒灌装阶段可以是具有类似功能的FBP酶可能部分补偿SBPase的缺陷[7.那30.].
在蓝藻中,FBP / SBPase催化两种单独的酶反应去磷酸化Sedohepating SedohepateLate1,7-双磷酸盐和果糖1,6-双磷酸盐,其在高等植物中由两个单独的酶,FBPase和SBPase进行[32.].基于FBP/SBPase、FBPase和SBPase之间的进化关系和高度相似性,从FBP/SBPase和FBPase中推测出SBPase的结构、结构域和活性位点[17.].功能性FBP/SBPase是一个四聚体结构,包括四个单体(C1, C2, C3和C4)和两个二聚体对(C1/C4和C2/C3) [33.].FBP / SBPASE来自Thermosynechococcus elongatus.和SyneChocystis sp..PCC 6803具有两个调节结构域:FBP / SBP结构域和腺苷一磷酸吲哚酮(AMP)结构域,两种域之间的所有关键残留物在两个蓝藻之间相同[32.那33.].AMP结构域由两个相邻单体的残基组成,AMP有助于将四个单体锁定到稳定的酶中[32.那34.].FBPase从porcu肾脏有两个状态:没有放大器结合和非活动状态的活动状态,具有放大器绑定。两种不同的有源状态在两个相邻单体之间的旋转不同[34.那35.].在我们的研究中,sbp酶c端由Gly-364突变为Asp,导致水稻生长发育严重迟缓,产量急剧下降c6635水稻的突变体(图。1那2那6.),暗示Gly-364可以在SBPase功能中发挥重要作用。对该粉碎的可能解释是OSSBPase的C末端的Gly-364位于AMP结构域的残余物周围,其可能影响两个相邻单体之间的旋转,并且最终显着降低SBPase的活性c6635突变体。
qRT-PCR分析结果显示RBCS.那FBAase.和Prkase.非常上调而上调rbcl.那FBPase和OSSBPase.野生型和野生型之间没有明显差异c6635突变体。有趣的是,rbcL和rbcS是Rubisco的两个亚基。然而,它们在c6635突变体(无花果。13.).不同的表达模式rbcl.和RBCS.可能是它们在Rubisco中不同功能的结果。rbcL是叶绿体编码的大亚基rbcl.基因和RBC是由核编码的小亚基RBCS.基因(11.].Rubisco的催化活性由含有催化结构域的RBCl亚基测定并受RBCS亚基调节[36.],这可能导致不同的表达模式rbcl.和RBCS..
转基因植物过表达异源SBPase要么FBP./SBPase基因显示酶水平增加,光合作用增强,生物量增加[37.那38.那39.那40,很少有研究报道转基因植物过度表达自己SBPase基因显示出的生物质产量增加[14.].在水稻中,过度表达米饭SBPase基因对生物量和产量无影响,但增强了对高温和盐胁迫的耐受性[41.那42.].我们也过度表达了OSSBPase.基因japonica.品种Nipponbare,初步观察表明过表达OSSBPase.水稻基因没有显着增强生物质和谷物产量,因此我们不再进一步调查通过测量和统计的农艺性状。根据报告的数据,过度表达SBPase在不同的植物物种中可能会有不同的反应,尤其是过度表达自己SBPase基因可能无法为某些植物提供优势[41.那42.].
结论
我们成功确定了一个SBP.单圈植物中的ASE基因。同时,我们证明了该基因3'-末端的单个核苷酸取代严重影响植物生长和谷物产量,这意味着SBPase的C末端的Gly-364可以在水稻中的SBPase功能中发挥重要作用。
方法
植物材料和生长条件
本研究中使用的植物材料原本来自我们的实验室。水稻低分蘖突变体c6635源自突变文库(japonica.通过甲磺酸乙酯(EMS)诱变品种中华湖11),经过几代后遗传稳定。这c6635突变体被越过japonica.品种Zh11和indic品种Gang46B(G46B)分别构建1和F2遗传分析和基因映射的人口。在天然水稻种植季节期间,所有植物材料都在中国成都市文江的稻田中生长。
颜料含量测定
收集幼苗,靴子和籽粒填充阶段的新鲜叶子以测量颜料含量。将0.2g叶片切成碎片并用80%丙酮在黑暗中萃取48小时。紫外线可见分光光度计(生物产物3s,Thermo,USA)用于按照来自Lichtenthaler的方法和井底的方法下测量663,646和470nm的颜料含量[43.].
观察叶绿体超微结构
野生型叶绿体超微结构c6635透射电镜观察突变体。野生型和野生型幼苗期鲜叶c6635在稻田中采集突变体,立即用3%戊二醛固定液固定。然后根据Li等人的方法对样品进行处理[44.],最后用H-600IV透射电子显微镜(日立,日本)观察和拍照。
光合能力测定
净光合速率(pN用全膨胀的顶部叶子或野生型叶子叶子测量c6635突变体在分蘖阶段,引导舞台和谷物灌装阶段,具有便携式光合仪器(Li-6400,Li-Cor Inc.,USA)[45.].所有测量都在早上9:00至9:30在阳光灿烂的日子开始(太阳辐射仍然很低)。来自野生类型的每叶c6635在短时间内彼此相同阶段的突变体。所有测量都在环境控制环境下进行:光子通量密度为1200μmolm- 2年代- 1,温度为30°C和CO2浓度400ppm。
淀粉碘试验
野生叶子在苗木,分蘖和谷物填充阶段来自野生型和c6635收获突变体,并在95%乙醇中占据12小时,然后在阴影条件下浸没在碘/碘化碘(2%/ 5%)溶液中[7.].观察样本并用相机(EOS 800D,Canon,Japan)拍摄。
c6635突变基因的图位克隆
这c6635突变体分别与Z11和G46B交叉,构建F.2遗传分析和映射的人口。一千三百二十三个具有低分蘖表型的个体选自(c6635 × G46B) F2用于基因定位的群体。351个标记均匀分布在12条染色体上http://www.grachene.org/microsat)用于初步绘图。基于Z11和G46B之间的差异,使用甘草烯和Primer5.0设计了新的插入/缺失(Indel)引物。因为受基因映射的限制的区域太大而不能鉴定候选基因,所以使用高通量测序和多浆法方法来鉴定候选基因。叶子由25个低分蘖植物收集(c6635 × ZH11) F2人口,切成小块并以平等的比例汇集。然后将混合样品送到生物标志公司(北京,中国)以进行高通量排序。Zh11和Zh11基因组之间的单核苷酸多态性(SNP)c6635基于Z11基因组检测突变体作为参考基因组序列。
序列分析
从水稻基因组注释计划(http://rice.plantbiology.msu.edu/).OSSBPase.基于每个推定基因的注释和突变体表型,最终选择基因作为候选基因。OSSBPase的同源序列从NCBI下载。DNAMAN版本6.0用于分析多序列对准,使用MEGA5使用UPGMA方法进行系统发育分析[46.].
C6635突变体的互补
确认突变OSSBPase.基因对低分蘖表型负责c6635突变体,进行互补实验OSSBPase.来自野生型转移的基因c6635突变体。的全长cDNAOSSBPase.从野生型与特定引物(F1:AggtctagaAtggagAcggtggtggCGCG,R1:AGCCTGCAGTAGGCGCGCGCGCGCCCAC)扩增XBA.我在5'-tend和a的网站太平洋标准时间我在3'-tene的网站。PCR产物被消化XBA.我和太平洋标准时间我并克隆到pc2300二进制矢量下肌动蛋白1启动子。PC2300-OSSBPase.被转化为c6635突变体农杆菌肿瘤术介导的转化。通过用特定引物(F2:TCAGTGTAGCTCGACC,R2:CagcagcaactTggtctc)扩增鉴定所有转化体。
OSSBPase的亚细胞定位
叶绿体转运肽和亚细胞定位,并由TargetP 1.1服务器和ChloroP 1.1服务器预测[23.那24.].确定OSSBPase的实际亚细胞定位,瞬态表达OSSBPase.对水稻原生质体中的基因进行了研究。的全长cDNAOSSBPase.用特异性引物(F3: AGGGGTACCATGGAGACGGTGGCCGCG, R3: AGCTCTAGAATAGGCGGCGGCGCCCAC)扩增kpn.我在5'末端的网站XBA.我网站在3'-ten。PC2300-35S-OSSBPase.-EGFP载体用插入PC2300-35S-EGFP载体的PCR产物构建,然后通过张等人的方法转化为水稻原生质体。[47.].用激光扫描共聚焦显微镜(尼康A1,日本)检测水稻原生质体中的荧光信号。
RT-PCR分析
不同的组织和器官的野生类型和c6635从7:00-8:00中收集突变体。在稻田中。用RNA Isolater试剂盒(Vazyme)从组织和器官中提取总RNA。根据其指示,使用2μg总RNA与他标记II q RT Supermix(R223-01,vazyme)的第一链cDNA获得第一链cDNA。检测表达式模式OSSBPase.使用基因特异性引物进行不同组织和器官,半定量和定量RT-PCR的基因肌动蛋白1基因作为内部控制。在幼苗阶段检测到Calvin循环中涉及六个关键基因的表达水平。所有QRT-PCR(10μl)在实时PCR系统中进行(QTower3.G,分析司)用5μL·尚·普通SYBR混合物(Q711-02,Vazyme),1μl底漆混合物和1μLcDNA。这肌动蛋白1基因被用作参考基因。测定分别用三种技术和生物学复制进行。表中列出了RT-PCR分析中使用的所有引物2.
可用性数据和材料
在当前研究期间使用和/或分析的数据集可从合理的请求上从相应的作者获得。
缩写
- rubp:
-
核酮糖1,5-bisphosphate
- Rubisco:
-
核糖糖二磷酸羧酸酶/氧酶
- RBCL:
-
Rubisco的大亚基
- RBCS:
-
Rubisco的小亚基
- FBAase:
-
果糖-1,6-双磷酸醛磷酸酶
- FBPase:
-
果糖1,6-双磷酸酶
- SBPase:
-
Sedohepleplose 1,7-双磷酸酶
- Prkase:
-
磷胰蛋白酶
参考
- 1。
Makino A.光合作用,籽粒产量和稻米和小麦的氮。植物理性。2011; 155:125-9。
- 2。
Thauer rk。碳固定的第五条途径。科学。2007; 318:1732-3。
- 3.
Long SP,Marshall-Colon A,朱X.通过工程作物光合作用和产量潜力满足未来的全球粮食需求。细胞。2015; 161:56-66。
- 4.
Janasch M,Asplund-Samuelsson J,Steuer r,哈德森ep。Calvin周期的动力学建模识别助焊剂控制和稳定的代谢物集胞藻属碳固定。J Exp Bot。2019; 70:973-83。
- 5。
Geiger Dr,Servaites JC。C3植物中光合碳代谢的昼夜调节。Annu Rev植物植物植物Mol Biol。1994年; 45:235-56。
- 6。
De Porcellinis AJ,Nørgaardh,雷利LMF,Ertersad Sm,Jones Pr,Hezlewood JL,Sakuragi Y.双官能果糖-1,6-双磷酸酶/ Sedoheptulose-1,7-双磷酸酶的过度表达导致碳代谢的光合作用和全球重新编程在synechocccus sp..PCC 7002. Metab Eng。2018; 47:170-83。
- 7。
Liu X, Yu H, Guan Y, Li J, Guo F. the metabolic interface role in oxidative stress, carbon assimilation and growth and development and multiple aspects of the growth and development . Liu X, Yu H, Guan Y, Li J, Guo F. the metabolic interface role in the oxidative stress, carbon assimilation and development and the multiple aspects of growth and development .(生物谷bioon.com拟南芥.摩尔。2012;5:1082 - 99。
- 8。
Buchanan BB,Wolosiuk Ra。光合作用:碳反应。在:林肯T,Eduardo Z,Ian Max M,Angus M,编辑。植物生理学和发展。桑德兰:恩豪斯伙伴;2015. p。203-44。
- 9。
Fukayama H,Mizumoto A,Ueguchi C,Katsunuma J,Morita R,Sasayama D,Hatanaka T,Azuma T. Rubisco Actiacase的表达水平与转基因稻中的Rubisco含量负相关。光合作用res。2018; 137:465-74。
- 10。
spreitzer rj,salvucci me。Rubisco:结构,监管相互作用和更好的酶的可能性。Annu Rev植物Biol。2002; 53:449-75。
- 11.
二磷酸核酮糖羧化酶的催化与调控。J Exp Bot. 2008; 59:1555-68。
- 12.
Von Caemmerer S,Farquhar Gd。光合作用生物化学与叶片气体交换之间的一些关系。Planta。1981; 153:376-87。
- 13。
伍德罗,即浆果Ja。光合作用CO的酶促调节2,固定在C3植物中。植物生理学报1988;39:533-94。
- 14。
丁峰,王明,张树华,艾欣。转基因番茄sbp酶活性对光合能力、生长及抗寒性的影响。Sci众议员2016;6:32741-54。
- 15.
Raines CA, Lloyd JC, Dyer TAsedoheptulose-1,7-二磷酸酶结构和功能的新认识一种重要但被忽视的卡尔文循环酶。J Exp Bot. 1999; 50:1-8。
- 16。
Raines Ca.Repvin周期重新审视。光合作用res。2003; 75:1-10。
- 17。
Raines CA, Lloyd JC, Willingham NM, Potts S, Dyer TA。小麦叶绿体sedoheptulose-1,7-二磷酸酶与果糖-1,6-二磷酸酶的cDNA和基因序列显示同源性。欧洲生物化学杂志1992;205:1053-9。
- 18。
Willingham NM, Lloyd JC, Raines CA.分子克隆拟南芥Sedoheptulose-1,7-二磷酸酶基因和小麦的表达研究拟南芥.植物mol biol。1994年; 26:1191-200。
- 19。
关键词:sedoheptulos -1,7-二磷酸酶衣藻reinhardtii.植物杂志。1994;104:1101-2。
- 20.
Ji X,GAI Y,MA J,Zheng C,Mu Z.来自桑树的Sedoheptulose-1,7-双磷酸酶CDNA的分子克隆与表征(桑属阿尔巴var。多种藻类).Silvae Genet。2008; 57:152-7。
- 21.
王敏,毕华,刘鹏,艾欣。植物sedoheptulos -1,7-二磷酸酶基因的克隆及表达分析Cucumis sativus.SCI Hortic。2011; 129:414-20。
- 22.
陈X,Xiong J,Yu T,Li X,Li S,Hua Y,Li Y,Zhu Y.环境应激调节水稻Sedohepleplose-1,7-双磷脂酶基因的分子克隆与表征。J工厂Biochem Biotechnol。2004; 13:93-9。
- 23.
Emanuelsson O,Nielsen H,von Heijne G.Chlorop,一种基于神经网络的方法,用于预测叶绿体过渡肽及其裂解位点。蛋白质SCI。1999年; 8:978-84。
- 24.
Emanuelsson O,Nielsen H,Brunak S,Von Heijne G.基于其N-末端氨基酸序列预测蛋白质的亚细胞定位。J Mol Biol。2000; 300:1005-16。
- 25。
Rodermel SR,Abbott MS,Bogorad L.核心琴相互作用:核反义基因抑制转化的烟草植物中的二磷酸核苷酸羧化酶水平。细胞。1988; 55:673-81。
- 26。
Haake V,Zrenner R,Sonnewald U,STITT M.塑体醛糖酶活性的中等减少抑制光合作用,改变糖和淀粉的水平,并抑制马铃薯植物的生长。工厂J. 1998; 14:147-57。
- 27。
哈里森ep,愿意纳姆,劳埃德·杰克,雨。转基因烟草中的Sedoheptulose-1,7-双磷脂酶水平降低,导致光合容量降低和改变的碳水化合物积累。Planta。1998年; 204:27-36。
- 28。
Henkes S.反义烟草转化体中的体积转发酮活性的小降低对光合作用和苯丙醇代谢的巨大作用。植物细胞。2001; 13:535-51。
- 29。
关键词:转基因马铃薯,果糖-1,6-二磷酸酶,叶绿体,光合作用植物j . 2003; 6:637-50。
- 30.
Rojas-GonzálezJA,Soto-SúarezM,García-díazÁ,罗梅洛·普埃特拉斯麦,桑罗尼奥·普埃特拉斯MC,Sandalio LM,MéridaÁ,Thormähleni,地理伯格P,SARRATO AJ,Sahrawy M.破坏叶片和细胞溶质的破坏FBPase基因导致矮化表型和重要的淀粉和代谢物的变化拟南芥.J Exp Bot。2015; 66:2673-89。
- 31.
价格GD,埃文斯JR,冯凯瑟默尔S,Yu JW,Badger Mr。通过反义RNA对叶绿体甘油糖醛-3-磷酸脱氢酶活性的特异性降低减少了CO2通过在转基因烟草植物中减少核苷酸二磷酸酯再生的同化。Planta。1995年; 195:369-78。
- 32.
关键词:果糖-1,6/ sedoheptu糖-1,7-二磷酸酶,分子结构Thermosynechococcus elongatus.与Sedohepleplulose-7-磷酸盐结合。Acta Crystallogr。2015; 71:1341-5。
- 33。
冯L,Sun Y,Deng H,Ding L,Wan J,Wang X,Wang W,Liao X,Hu X.来自蓝藻果糖-1,6 / Sedoheptulose-1,7-双磷酸酶的结构和生化表征集胞藻属菌株6803. FEBS J. 2013; 281:916-26。
- 34。
薛益,黄S,梁Jy,张义,润泽组合。果糖-1,6-双磷酸酶的晶体结构与果糖2,6-双磷酸盐,AMP和Zn络合2+在2.0-å分辨率下:抑制剂之间协同作用的方面。P Natl Acad Sci USA。1994年; 91:12482-6。
- 35。
Villeret V,Huang S,Zhang Y,Xue Y,Lipscomb Wn。菠菜叶绿体果糖-1,6-双磷酸酶的晶体结构为2.8埃分辨率。生物化学。1995年; 34:4299-306。
- 36。
spreitzer rj。小亚基在核苷酸-1,5-双磷酸羧酶/氧酶中的作用。拱生物学生生物糖。2003; 414:141-9。
- 37。
Miyagawa Y,Tamoi M,Shigeoka S.过表达的蓝藻果糖-1,6- / Sedoheptulose-1,7-双磷酸酶在烟草中增强了光合作用和生长。NAT BIOTECHNOL。2001; 19:965-9。
- 38。
罗森塔尔D,洛克A,科扎伊M,雷恩斯C,朗S, Ort D3.光合循环酶Sedoheptulose-1-7双磷酸酶可提高光合碳增益和完全开放空中有限公司的产量2熏蒸(脸)。BMC植物BIOL。2011; 11:123-34。
- 39。
Köhler I, ruz - vera U, VanLoocke A, Thomey M, Clemente T, Long S, Ort D, Bernacchi C.在未来气候条件下大豆蓝藻FBP/ sbp酶的表达可防止产量下降。J Exp Bot. 2016; 68:715-26。
- 40。
Driever S,Simkin A,Alotaibi S,FISK S,Madgwick P,Sparks C,Jones H,Lawson T,Parry M,Raines C.增加了SBPase活性,改善了温室条件下的小麦的光合作用和籽粒产量。Phil Trans R SoC B. 2017; 372:20160384。
- 41.
冯L,韩y,刘g,一个b,阳j,杨g,李y,朱y。Sedoheptulose-1,7-双磷酸酶的过度表达增强了转基因水稻盐胁迫下的光合作用和生长。Funct植物Biol。2007; 34:822-34。
- 42.
冯丽,王凯,李艳,谭艳,孔杰,李华,李艳,朱艳。转基因水稻sbp酶的过表达对高温胁迫下光合作用的影响。Plant Cell rep 2007; 26:1635-46。
- 43.
Lichtenthaler HK,Wellburn Ar。总类胡萝卜素和叶绿素的测定一种和B.不同溶剂中的叶子提取物。Biochem Soc Trans。1983; 603:591-2。
- 44.
李超,马芳,焦锐,陈超,王强,肖芳,孙超,邓欣,董超,王鹏。mg -原卟啉IX单甲基酯环化酶突变对水稻叶片黄斑表型的影响。植物生物学报告2019;37:253-64。
- 45.
关键词:水氮管理,杂交水稻,产量,氮素利用效率农田作物学报2012;127:85-98。
- 46.
Tamura K,Peterson D,Peterson N,SteCher G,Nei M,Kumar S. Mega5:使用最大可能性,进化距离和最大判定方法的分子进化遗传学分析。mol Biol Evol。2011; 28:2731-9。
- 47.
张Y,Su J,Duan S,AO Y,Dai J,Liu J,Wang P,Li Y,Liu B,Feng D.一种高效稻绿色组织原生质体系,用于瞬态基因表达和研究光/鸟塑料相关过程.植物方法。2011; 7:30-43。
- 48.
Su n,胡m,wu d,wu f,fei g,lan y,chen x,shu x,zhang x,gu x,cheng z,lei c,qi c,姜l,王h,万j。中断水稻五肽重复蛋白导致幼苗特异性白化表型及其利用,以增强杂交水稻生产中的种子纯度。植物理性。2012; 159:227-38。
致谢
我们感谢Chengscai Chu教授,从中国科学院遗传和发育生物学研究所,请求PCAMBIA2300和PCAMBIA2300-35 S-绿色荧光蛋白vectors。
资金
本研究得到了中国国家重点研究和发展方案的财务支持,以及中国国家自然科学基金(91735303和31971869)。融资组织在研究和收集,分析和解释方面没有在数据的设计中和写作稿件的作用。
作者信息
从属关系
贡献
CL对实验数据进行分析并撰写手稿。NL、RH和CL进行了大部分研究。PW对实验数据进行分析,并进行亚细胞定位分析。CC、JG、XY、XZ进行了现场试验。CS提供技术援助。PW和XD设计实验,监督研究,修改手稿。所有作者阅读并批准了手稿。
相应的作者
伦理宣言
伦理批准和同意参与
不适用。
同意出版物
不适用。
利益争夺
提交人声明他们没有竞争利益。
附加信息
出版商的注意
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
补充信息
附加文件1:表S1。
靶区Mutmap鉴定的十四个单核苷酸多态性(SNP)的信息。
附加文件2:图S1。
PCR阳性转基因系的PCR试验。M:DL-2000标记;1和18:PCR阳性对照(PC2300- actin-OSSBPase.质粒);2:PCR阴性对照(c6635突变体);3-6、8-17、19、21、22为pcr阳性转基因品系;7、20:pcr阴性转基因品系。
附加文件3:图S2。
表达模式的OSSBPase.基因通过半定量分析(凝胶中的两种复制)。R:根,S:茎,L:叶片,LS:叶鞘,P:幼穗。
权利和权限
开放访问本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信贷额度中另有说明。
关于这篇文章
引用这篇文章
李,C.,Li,N.,Huang,R.等等。在3'-末端的单核苷酸替代SBPase参与钙氏循环的基因严重影响水稻中的植物生长和籽粒产量。BMC植物BIOL.20.345(2020)。https://doi.org/10.1186/s12870-020-02541-x.
收到了:
公认:
发表:
关键词
- 米 (栽培稻)
- SBPase
- 凯文周期
- 增长与发展
- 屈服