- 研究文章gydF4y2Ba
- 开放访问gydF4y2Ba
- 发布:gydF4y2Ba
外源2-(3,4-二氯苯氧基)三乙胺通过提高玉米的光合能力、改善水分状况和维持钾素来缓解盐胁迫gydF4y2Ba+gydF4y2Ba/ NagydF4y2Ba+gydF4y2Ba体内稳态gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba20.gydF4y2Ba文章编号:gydF4y2Ba348.gydF4y2Ba(gydF4y2Ba2020gydF4y2Ba)gydF4y2Ba
抽象的gydF4y2Ba
背景gydF4y2Ba
土壤盐分限制了植物的生长和生产力。2-(3,4-二氯苯氧基)三乙胺(DCPTA)可以缓解植物的盐胁迫。然而,dcpta介导的耐盐机制尚未完全阐明。本研究旨在探讨其在提高光合能力、改善水分状况、维持钾素等方面的作用gydF4y2Ba+gydF4y2Ba/ NagydF4y2Ba+gydF4y2Ba袜子稳态和缓解盐度压力(gydF4y2Ba玉米gydF4y2Bal .)。gydF4y2Ba
结果gydF4y2Ba
在本研究中,玉米幼苗在NaCl (0, 150 mM)和DCPTA(0, 20, 100和400 μM)组合的营养液中生长。并对玉米幼苗的光合作用、水分状况、离子稳态及离子吸收转运相关基因的表达进行了评价。结果表明,DCPTA通过提高玉米幼苗的净光合速率(PgydF4y2BanGydF4y2Ba)和光系统II (PSII)光化学的量子效率。DCPTA提高了根系的导水性,有助于维持根系的水分状态。相对较高的KgydF4y2Ba+gydF4y2Ba但钠含量相对较低gydF4y2Ba+gydF4y2Ba浓度和钠gydF4y2Ba+gydF4y2Ba/ K.gydF4y2Ba+gydF4y2Ba在盐胁迫条件下,DCPTA存在时,观察到两种盐的比例。此外,DCPTA改变了四个基因的表达(gydF4y2BaZMSOS1gydF4y2Ba,gydF4y2BaZMHKT1gydF4y2Ba,gydF4y2BaZmNHX1gydF4y2Ba和gydF4y2BaZMSKOR.gydF4y2Ba)编码负责K的膜传输蛋白质gydF4y2Ba+gydF4y2Ba/ NagydF4y2Ba+gydF4y2Ba体内平衡。gydF4y2Ba
结论gydF4y2Ba
DCPTA改善了玉米的盐度耐受性可能与增强的光合容量,维持水状况和所涉及离子摄取和运输的基因的表达改变。gydF4y2Ba
背景gydF4y2Ba
土壤盐渍化是制约农业发展的最严重的不利环境因素之一[gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba].约8.3亿公顷土地(约占全球耕地面积的20%)受到土壤盐碱化的影响[gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4gydF4y2Ba,gydF4y2Ba5gydF4y2Ba],全球每年因农作物减产而损失120 - 273亿美元[gydF4y2Ba6gydF4y2Ba].预计2050年,全球人口将超过91亿亿,粮食生产增加70%以确保食品安全[gydF4y2Ba7gydF4y2Ba].土壤盐渍化将是实现这一目标的主要障碍[gydF4y2Ba8gydF4y2Ba].gydF4y2Ba
土壤盐度引发复杂的反应,以抑制植物生长和生理过程[gydF4y2Ba4gydF4y2Ba,gydF4y2Ba9gydF4y2Ba].首先,由于根区盐分浓度高,土壤盐分以渗透胁迫的形式抑制植物生长,然后是由于无胞菌溶胶过度积累钠离子而导致的离子缺乏或毒性gydF4y2Ba+gydF4y2Ba和Cl.gydF4y2Ba−GydF4y2Ba[gydF4y2Ba10.gydF4y2Ba,gydF4y2Ba11.gydF4y2Ba].渗透胁迫破坏细胞水分关系,抑制细胞扩张和分裂,降低气孔孔径和蒸腾作用[gydF4y2Ba12.gydF4y2Ba,gydF4y2Ba13.gydF4y2Ba].气孔关闭限制了大气CO的扩散gydF4y2Ba2gydF4y2Ba导致光合作用气孔限制,从而降低生长速率[gydF4y2Ba13.gydF4y2Ba]盐度引起的光合效率下降通常与光系统II(PSII)的抑制有关,PSII在光能转换和电子传输中起着核心作用[gydF4y2Ba14.gydF4y2Ba].液压导电性(LP)是指水可以从一个位置流到另一个位置的易于影响,因此影响水量速度[gydF4y2Ba13.gydF4y2Ba];LP可用于表明植物根吸收水的能力[gydF4y2Ba15.gydF4y2Ba].在盐度应力下,LP的维持是适应过程的重要组成部分,有助于恢复植物生长[gydF4y2Ba13.gydF4y2Ba].gydF4y2Ba
在长期暴露于盐度期间,植物经历离子胁迫,特别是由于氯化钠,导致植物营养不平衡和氧化应激,对植物生长,发育和存活的严重后果[gydF4y2Ba4gydF4y2Ba,gydF4y2Ba10.gydF4y2Ba,gydF4y2Ba12.gydF4y2Ba,gydF4y2Ba16.gydF4y2Ba].过量的nagydF4y2Ba+gydF4y2Ba对植物特别有害,因为它与k竞争gydF4y2Ba+gydF4y2Ba用于K所需的代谢过程gydF4y2Ba+gydF4y2Ba,导致酶失活、植物营养不平衡、蛋白质降解、叶片光化学抑制和氧化应激[gydF4y2Ba17.gydF4y2Ba].所有这些效果协同抑制植物生长和发展[gydF4y2Ba10.gydF4y2Ba].以往的研究表明,KgydF4y2Ba+gydF4y2Ba/ NagydF4y2Ba+gydF4y2Ba比率被认为是评价各种植物抗盐性的重要指标[gydF4y2Ba4gydF4y2Ba,gydF4y2Ba18.gydF4y2Ba].膜转运蛋白相关基因的调控gydF4y2Ba+gydF4y2Ba和/或kgydF4y2Ba+gydF4y2Ba摄取,易位或分区化是植物解决过多NA的重要策略gydF4y2Ba+gydF4y2Ba积累和K.gydF4y2Ba+gydF4y2Ba缺乏。质膜钠gydF4y2Ba+gydF4y2Ba/HgydF4y2Ba+gydF4y2Ba逆向转运(gydF4y2BaSOS1.gydF4y2Ba液泡质(NagydF4y2Ba+gydF4y2Ba,KgydF4y2Ba+gydF4y2Ba)/HgydF4y2Ba+gydF4y2Ba反向转运蛋白(NHX1,位于液泡膜中)可以隔离钠 + 进入液泡并在调节细胞pH和Na中起主要作用gydF4y2Ba+gydF4y2Ba稳态[gydF4y2Ba9gydF4y2Ba,gydF4y2Ba19.gydF4y2Ba].高亲和力钾转运蛋白1(gydF4y2BaHKT1gydF4y2Ba)参与了对罗的控制gydF4y2Ba+gydF4y2Ba通过钠的重吸收远距离运输gydF4y2Ba+gydF4y2Ba从木质sap进入根细胞,防止大累积nagydF4y2Ba+gydF4y2Ba在地上组织中[gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba21.gydF4y2Ba].而且,向外整流kgydF4y2Ba+gydF4y2Ba通道(gydF4y2BaskgydF4y2Ba)调和KgydF4y2Ba+gydF4y2Ba从根细胞分泌到木质部和KgydF4y2Ba+gydF4y2Ba运输到萌芽区[gydF4y2Ba22.gydF4y2Ba].gydF4y2Ba
生物刺激剂是一种从人和动物相关的工业过程中提取的天然或合成的生物活性小分子,它被认为是改善由盐度引起的生长抑制或提高植物对盐度胁迫的抵抗力的有效措施。gydF4y2Ba10.gydF4y2Ba,gydF4y2Ba23.gydF4y2Ba].叔胺生物调节剂2-(3,4-二氯苯氧基)三乙胺(DCPTA)是一类生物活性高、低分子量的胺类化合物,对作物的生长发育具有显著的调节作用[gydF4y2Ba24.gydF4y2Ba].已有研究表明,DCPTA可以提高番茄植株的干重[gydF4y2Ba25.gydF4y2Ba];提高甜菜、萝卜的根DW和叶面积[gydF4y2Ba26.gydF4y2Ba和玉米[gydF4y2Ba27.gydF4y2Ba];并增强丝纤维 - 1,5-双磷酸酯活性,并增加甜菜叶片中叶绿体的大小(gydF4y2BaBeta寻常魅力gydF4y2BaL.)[gydF4y2Ba28.gydF4y2Ba].DCPTA还能增强COgydF4y2Ba2gydF4y2Ba固定在棉花,促进瓜谷叶绿素生物合成[gydF4y2Ba29.gydF4y2Ba],并促进柑橘类胡萝卜素的合成[gydF4y2Ba30gydF4y2Ba]适宜浓度的DCPTA能提高净光合速率(PgydF4y2BanGydF4y2Ba)在玉米中(gydF4y2Ba玉米gydF4y2BaL.)[gydF4y2Ba31gydF4y2Ba]并具有抗衰老特性,如叶绿素降解的放缓所证明的(gydF4y2Baphoudolusulus vulgaris.gydF4y2Bal)黑暗中的叶盘[gydF4y2Ba32gydF4y2Ba].此外,DCPTA可以提高作物适应应力和改善应力阻力的能力[gydF4y2Ba33gydF4y2Ba,gydF4y2Ba34gydF4y2Ba,gydF4y2Ba35gydF4y2Ba,gydF4y2Ba36gydF4y2Ba].Xie et al. [gydF4y2Ba35gydF4y2Ba[显示喷雾DCPTA可以增加叶相对含水量(LRWC)并促进水吸收,如LP增加,这可能是由于根生长的改善,增加了与增加叶绿素含量相关的光合容量,更大的光合作用gydF4y2Ba4gydF4y2Ba酶活性和干旱胁迫下对叶绿体的损伤降低,从而增加了玉米幼苗的耐旱性。通过增加PSII光化学的最大量子效率,DCPTA还可以增加对低温应力的耐受性(gydF4y2BaFgydF4y2BavGydF4y2Ba/gydF4y2BaFgydF4y2Ba米GydF4y2Ba)和叶绿素含量,有效地保护了低温胁迫下玉米叶片的光合系统[gydF4y2Ba33gydF4y2Ba].gydF4y2Ba
玉米是世界范围内种植的最重要的谷物作物之一,为工业提供原料[gydF4y2Ba37gydF4y2Ba].玉米是粮食作物中产量最大的一种,主要种植区域在干旱和半干旱地区的灌溉农业区。然而,密集灌溉会导致高盐度[gydF4y2Ba38gydF4y2Ba].盐度诱导的生长细胞中营养状况的干扰抑制玉米生长并最终收益[gydF4y2Ba39gydF4y2Ba]。因为玉米被认为是一种中度盐分敏感的植物物种[gydF4y2Ba40gydF4y2Ba]然而,很少有耐盐玉米品种被商业化[gydF4y2Ba41gydF4y2Ba].因此,土壤盐度压力已成为可持续玉米生产最严重的威胁之一[gydF4y2Ba40gydF4y2Ba].先前的研究表明,添加DCPTA可以减轻由盐度应力引起的根DW的减少[gydF4y2Ba34gydF4y2Ba].然而,DCPTA的应用和剂量如何通过形态生理反应和离子稳态触发对NaCl胁迫的适应,特别是相关的分子机制尚不清楚。因此,本研究的目的如下:(1)确定的影响DCPTA玉米叶片光合能力和叶绿素荧光的暴露于盐度压力,(2)评估叶水的反应状态(叶水势(Ψω)和LRWC)和Lp的玉米的应用DCPTA盐度胁迫下,(3)探讨Na浓度的调节作用gydF4y2Ba+gydF4y2Ba和KgydF4y2Ba+gydF4y2Ba和nagydF4y2Ba+gydF4y2Ba/ K.gydF4y2Ba+gydF4y2Ba玉米叶和根中四种基因的表达量(gydF4y2BaZMSOS1gydF4y2Ba,gydF4y2BaZMHKT1gydF4y2Ba,gydF4y2BaZmNHX1gydF4y2Ba, 和gydF4y2BaZMSKOR.gydF4y2Ba)编码负责钠离子转运的蛋白质gydF4y2Ba+gydF4y2Ba和/或kgydF4y2Ba+gydF4y2Ba响应于盐度应力的叶片和根部的DCPTA的摄取,易位或分区化。这种系统调查将提供更多信息,以提高对玉米中DCPTA介导的盐度胁迫耐受性的调节机制。gydF4y2Ba
结果gydF4y2Ba
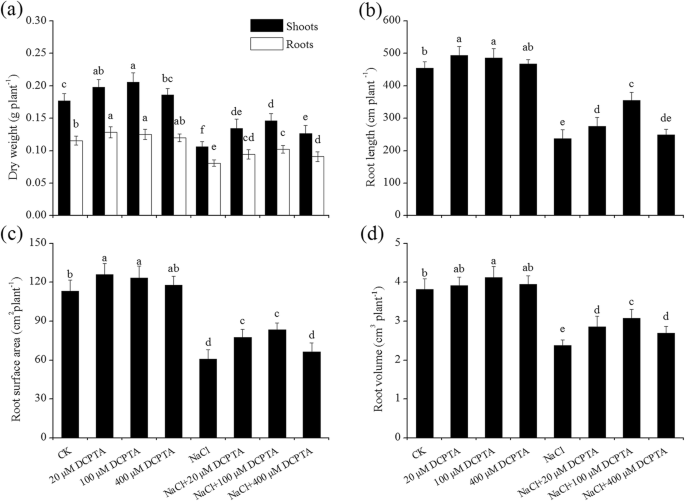
外源DCPTA能缓解盐度诱导的植物生长和生物量积累减少gydF4y2Ba
NaCl和DCPTA的根和芽的DW和玉米的根长,表面积和体积显着影响(gydF4y2BaPgydF4y2Ba≤0.001),NaCl和DCPTA施用量的交互作用对根长有显著影响(表2)gydF4y2Ba1gydF4y2Ba).如图所示。gydF4y2Ba1gydF4y2Ba和无花果。gydF4y2Ba2gydF4y2Ba,在非压力条件下,低剂量的DCPTA(20μm和100μm)显着增加了根和芽的DW和根长,表面积和体积,而相对高的DCPTA(400μm)没有对这些指标的显着影响。与非盐度条件相比,盐度应力显着抑制植物生长(gydF4y2BaPgydF4y2Ba ≤ 0.05), and the DWs of root and shoot, and the root length, surface area and volume were reduced by 40.0, 30.1, 47.7, 46.4 and 37.5%, respectively. However, NaCl-induced reduction in the DWs of root and shoot and root volume were alleviated by applications of DCPTA at 20–400 μM, and the decreases in root length and root surface area were alleviated by applications of DCPTA at 20 and 100 μM, whereas 100 μM DCPTA appeared to be the most effective concentration for alleviating salinity stress. Under salinity-stressed conditions, compared with those of untreated maize, the DWs of root and shoot, and the root length, surface area and volume of maize treated with 100 μM DCPTA significantly improved by 33.4, 26.2, 39.4, 37.2 and 29.2%, respectively.
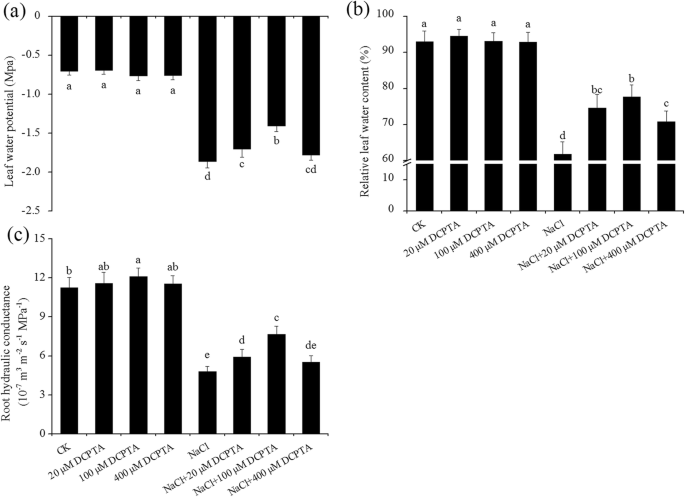
外源性DCPTA维护LRWC,叶ψΩ和根LPgydF4y2Ba
通过DCPTA和NaCl浓度显着影响LRWC,叶ψΩ和根LP;DCPTA和NaCl浓度之间的相互作用是显着的(表gydF4y2Ba1gydF4y2Ba).无盐条件下,DCPTA对叶片Ψω和LRWC无显著影响;然而,与对照组相比,100 μM DCPTA刺激Lp显著增加,增加了14.7%(图4)。gydF4y2Ba3.gydF4y2Ba).与非压力条件相比,盐度应力分别将叶子ω,LRWC和LP减少76.43,45.56和57.4%。在用20μm和100μm的DCPTA处理的植物中缓解了叶片ζω和LP的NaCl诱导的降低 - 更明显是后者的;然而,在用DCPTA(20-400μm)处理的植物中减少了LRWC,特别是在100μm的DCPTA中。仅与盐度应力相比,100μMDCPTA的施加分别将叶子ω,LRWC和LP增加24.4,21.6和59.8%。gydF4y2Ba
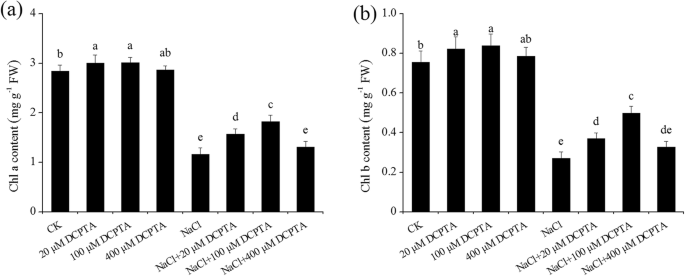
外源DCPTA提高了光合色素含量,提高了光合能力gydF4y2Ba
DCPTA和NaCl浓度显著影响叶绿素a和叶绿素b的含量,NaCl和DCPTA之间的相互作用显著影响叶绿素a和叶绿素b的含量(表1)gydF4y2Ba2gydF4y2Ba).在非压力条件下,DCPTA在20μm和100μm的应用刺激的CHL A和CHL B的含量显着增加,而400μmDCPTA对叶绿素含量没有显着影响(图。gydF4y2Ba4gydF4y2Ba).与非胁迫条件相比,NaCl显着影响玉米中的CHL A和CHL B,并分别将其内容物降低59.0%和64.1%。在盐度胁迫条件下,20μm和100μm的DCPTA处理植物在CHL A和CHL B的含量上提高了比DCPTA未治疗的植物的含量增加,并且增加了100μm的植物比20μm更大dcpta。与单独的盐度应力相比,100μMDCPTA分别将CHL A和CHL B的含量增加56.8%和84.3%。gydF4y2Ba
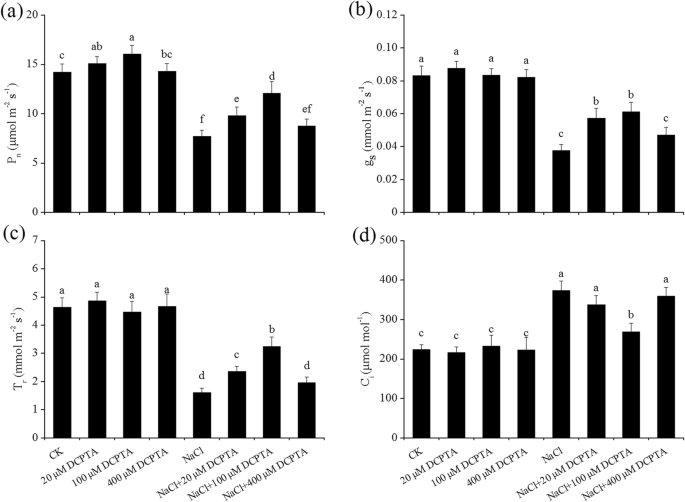
PgydF4y2BanGydF4y2Ba,气孔导度(ggydF4y2Ba年代GydF4y2Ba),细胞间有限公司gydF4y2Ba2gydF4y2Ba浓度(C.gydF4y2Ba我GydF4y2Ba)和蒸腾速率(TgydF4y2BarGydF4y2BaNaCl和DCPTA浓度显著影响。研究了DCPTA与NaCl浓度交互作用对磷的影响gydF4y2BanGydF4y2Ba是重要的(表gydF4y2Ba2gydF4y2Ba).在非压力条件下,低剂量的DCPTA(20μm和100μm)显着增加了pgydF4y2BanGydF4y2Ba而较高浓度的DCPTA (400 μM)对磷无显著影响gydF4y2BanGydF4y2Ba(图。gydF4y2Ba5agydF4y2Ba).PgydF4y2BanGydF4y2Ba在无胁迫条件下,20 μM和100 μM DCPTA处理比未处理分别增加了7.9和12.9%。NaCl显著降低磷含量gydF4y2BanGydF4y2Ba在玉米叶子。在应激条件下,与未经过dcpta处理的植物相比,PgydF4y2BanGydF4y2Ba在用20μm的浓度下用DCPTA处理的植物,分别增加了19.1和40.7%的100μm。同样,G.gydF4y2Ba年代GydF4y2Ba和TgydF4y2BarGydF4y2Ba在胁迫条件下,20 μM和100 μM DCPTA的施用缓解了植物叶片的这些不利影响(图2)。gydF4y2Ba5gydF4y2Ba相反,盐度胁迫显著刺激了c的增加gydF4y2Ba我GydF4y2Ba,但通过用100μm的DCPTA预处理来衰减该诱导(图。gydF4y2Ba5gydF4y2Bad)。gydF4y2Ba
DCPTA对P的影响gydF4y2BanGydF4y2Ba(gydF4y2Ba一个gydF4y2Ba),克gydF4y2Ba年代GydF4y2Ba(gydF4y2BabgydF4y2Ba), TgydF4y2BarGydF4y2Ba(gydF4y2BacgydF4y2Ba)和CgydF4y2Ba我GydF4y2Ba(gydF4y2BadgydF4y2Ba),非应激和盐度胁迫玉米幼苗的叶子。植株在0、20、100或400 μM DCPTA(含或不含150 mM NaCl)水培溶液中生长。数据是平均值±SES(gydF4y2BanGydF4y2Ba= 5)。条上的不同字母表示根据邓肯的测试(gydF4y2BaPgydF4y2Ba = 0.05)
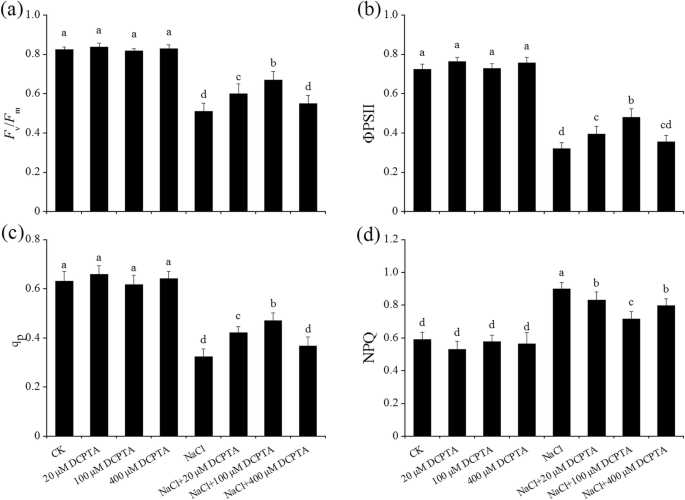
的gydF4y2BaFgydF4y2BavGydF4y2Ba/gydF4y2BaFgydF4y2Ba米GydF4y2BaDCPTA和NaCl浓度对NPQ、ΦPSII、qP和NPQ均有显著影响。DCPTA与NaCl浓度之间存在显著的相互作用gydF4y2Ba2gydF4y2Ba).在非胁迫条件下,DCPTA对得到的叶绿素荧光参数没有影响(图2)。gydF4y2Ba6gydF4y2Ba).与控制中的人相比gydF4y2BaFgydF4y2BavGydF4y2Ba/gydF4y2BaFgydF4y2Ba米GydF4y2Ba,φPSII和QP显着下降,并且响应于150mM NaCl的处理而显着增加。NaCl诱导的减少gydF4y2BaFgydF4y2BavGydF4y2Ba/gydF4y2BaFgydF4y2Ba米GydF4y2Ba100 μM和400 μM DCPTA对qP的降低有明显的缓解作用,而20 μM和100 μM - DCPTA对qP的降低有明显的缓解作用。DCPTA (20 ~ 400 μM)预处理可抑制nacl诱导的NPQ增加,且在100 μM时对NPQ的影响大于20 μM和400 μM时的影响。与盐度胁迫处理相比,100 μM的DCPTA处理显著提高了盐度gydF4y2BaFgydF4y2BavGydF4y2Ba/gydF4y2BaFgydF4y2Ba米GydF4y2Ba其中,ΦPSII下降了31.1%,qP下降了49.5%,NPQ下降了20.1%。gydF4y2Ba
DCPTA对gydF4y2BaFgydF4y2BavGydF4y2Ba/gydF4y2BaFgydF4y2Ba米GydF4y2Ba(gydF4y2Ba一个gydF4y2Ba),φpsii(gydF4y2BabgydF4y2Ba),QP(gydF4y2BacgydF4y2Ba)和NPQ (gydF4y2BadgydF4y2Ba)非压力和盐度应激玉米幼苗的叶子。植株在0、20、100或400 μM DCPTA(含或不含150 mM NaCl)水培溶液中生长。数据是平均值±SES(gydF4y2BanGydF4y2Ba= 5)。条形图上不同字母经邓肯检验差异显著(P = 0.05)gydF4y2Ba
外源性DCPTA可减弱NagydF4y2Ba+gydF4y2Ba毒性、调节钠gydF4y2Ba+gydF4y2Ba和KgydF4y2Ba+gydF4y2Ba体内稳态gydF4y2Ba
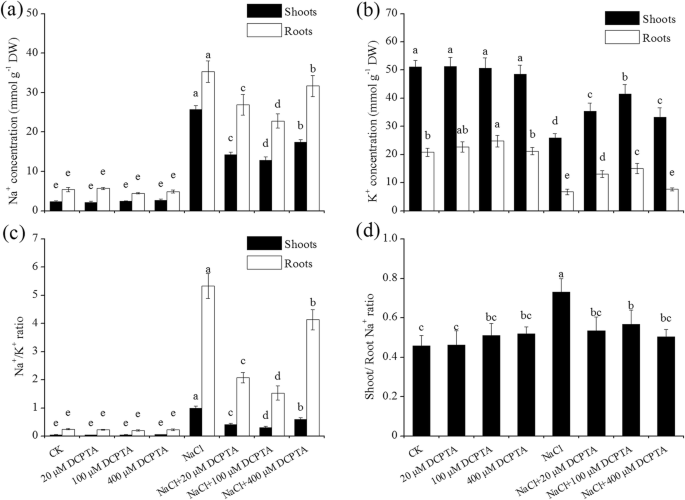
NaCl和DCPTA显着影响NA的内容gydF4y2Ba+gydF4y2Ba和KgydF4y2Ba+gydF4y2Ba和nagydF4y2Ba+gydF4y2Ba/ K.gydF4y2Ba+gydF4y2Ba玉米植物的枝条和根部的比例(gydF4y2BaPgydF4y2Ba ≤ 此外,NaCl和DCPTA之间的相互作用显著影响Na的含量gydF4y2Ba+gydF4y2Ba和KgydF4y2Ba+gydF4y2Ba在枝条和根部,和nagydF4y2Ba+gydF4y2Ba/ K.gydF4y2Ba+gydF4y2Ba玉米植物根中的比例(表gydF4y2Ba3.gydF4y2Ba).如图所示。gydF4y2Ba7gydF4y2Ba结果表明:150 mM NaCl显著影响Na浓度gydF4y2Ba+gydF4y2Ba和KgydF4y2Ba+gydF4y2Ba在玉米植物的根源和芽中。响应于150mM NaCl处理,NAgydF4y2Ba+gydF4y2Ba根部和枝条中的浓度分别增加了5.5%和9.8倍;K.gydF4y2Ba+gydF4y2Ba根和地上部的浓度分别降低了69.2%和49.3%;NagydF4y2Ba+gydF4y2Ba/ K.gydF4y2Ba+gydF4y2Ba根部和芽中的比例分别增加了20.4和21.4倍。在非压力条件下,DCPTA(20-400μm)的应用对NA没有影响gydF4y2Ba+gydF4y2Ba浓度和NagydF4y2Ba+gydF4y2Ba/ K.gydF4y2Ba+gydF4y2Ba在根和芽中的比例,kgydF4y2Ba+gydF4y2Ba茎/根钠浓度gydF4y2Ba+gydF4y2Ba施用100 μm DCPTA可显著提高植株的钾含量gydF4y2Ba+gydF4y2Ba浓度在根部。NaCl诱导Na +浓度的增加,并降低kgydF4y2Ba+gydF4y2Ba浓度,在枝条和根部,这些改变通常是通过使用的DCPTA而缓解。一百个微摩洛尔(100μm)的DCPTA似乎是降低NA最有效的浓度gydF4y2Ba+gydF4y2Ba浓度和增加kgydF4y2Ba+gydF4y2Ba盐度压力下的浓度。DCPTA应用程序显着影响NAgydF4y2Ba+gydF4y2Ba/ K.gydF4y2Ba+gydF4y2Ba盐胁迫植物根和芽的比例。在盐胁迫下,NagydF4y2Ba+gydF4y2Ba/ K.gydF4y2Ba+gydF4y2Ba用20,100和400μmDCPTA处理的植物芽的比率分别降低了59.1,68.6和39.7%,以及NA的比例gydF4y2Ba+gydF4y2Ba/ K.gydF4y2Ba+gydF4y2Ba在根部,分别减少了61.1,71.3和22.3%。此外,NaCl诱导的芽/根NA增加gydF4y2Ba+gydF4y2Ba通过DCPTA(20-400μm)的应用,特别是在100μm的DCPTA中缓解了比率。gydF4y2Ba
DCPTA对钠浓度的影响gydF4y2Ba+gydF4y2Ba(gydF4y2Ba一个gydF4y2Ba)和KgydF4y2Ba+gydF4y2Ba(gydF4y2BabgydF4y2Ba)和NagydF4y2Ba+gydF4y2Ba/ K.gydF4y2Ba+gydF4y2Ba比率 (gydF4y2BacgydF4y2Ba)在叶、根和茎/根中gydF4y2Ba+gydF4y2Ba比率 (gydF4y2BadgydF4y2Ba)在非压力和盐度应激玉米幼苗中。植株在0、20、100或400 μM DCPTA(含或不含150 mM NaCl)水培溶液中生长。数据是平均值±SES(gydF4y2BanGydF4y2Ba= 5)。条上的不同字母表示根据邓肯的测试(gydF4y2BaPgydF4y2Ba = 0.05)
外源性DCPTA维持KgydF4y2Ba+gydF4y2Ba/ NagydF4y2Ba+gydF4y2Ba通过改变的表达来保持体内平衡gydF4y2BaZMSOS1gydF4y2Ba,gydF4y2BaZMHKT1gydF4y2Ba,gydF4y2BaZmNHX1gydF4y2Ba和gydF4y2BaZMSKOR.gydF4y2Ba
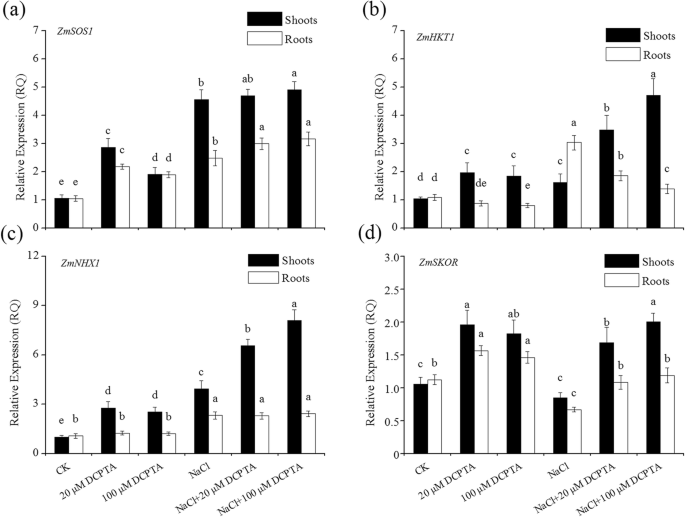
NaCl显著影响其表达gydF4y2BaZMSOS1gydF4y2Ba,gydF4y2BaZmNHX1gydF4y2Ba和gydF4y2BaZMHKT1gydF4y2Ba在拍摄和根部和根部和gydF4y2BaZMSKOR.gydF4y2Ba在玉米的根部(gydF4y2BaPgydF4y2Ba≤0.001)。DCPTA显著影响了表达gydF4y2BaZMSOS1gydF4y2Ba,gydF4y2BaZmNHX1gydF4y2Ba,gydF4y2BaZMHKT1gydF4y2Ba和gydF4y2BaZMSKOR.gydF4y2Ba在玉米的茎和根中。NaCl与DCPTA的相互作用显著影响了DCPTA的表达gydF4y2BaZMSOS1gydF4y2Ba,gydF4y2BaZMHKT1gydF4y2Ba在射击和根和ZM中gydF4y2BaNHX1.gydF4y2Ba在玉米植株的嫩枝中(表gydF4y2Ba4gydF4y2Ba).如图所示。gydF4y2Ba8gydF4y2Baa、 表达gydF4y2BaZMSOS1gydF4y2Ba无胁迫条件下20和100 μM DCPTA处理和盐胁迫条件下100 μM DCPTA处理的根和枝表达均显著上调。如图所示。gydF4y2Ba8gydF4y2Bab,在地上部,施用DCPTA显著增加gydF4y2BaZMHKT1gydF4y2Ba在压力和非压力条件下表达。在根中,DCPTA应用显着下降gydF4y2BaZMHKT1gydF4y2Ba应力条件下的表达式。在有应力和无应力条件下,的表达式gydF4y2BaZmNHX1gydF4y2Ba在芽中显著上调(图。gydF4y2Ba8gydF4y2Bac)和表达gydF4y2BaZMSKOR.gydF4y2Ba在植物的根源和芽中上调(图。gydF4y2Ba8gydF4y2Bad),在20和100 μM时对DCPTA的响应更明显。gydF4y2Ba
DCPTA对杂志表达的影响gydF4y2BaZMSOS1gydF4y2Ba(gydF4y2Ba一个gydF4y2Ba),gydF4y2BaZMHKT1gydF4y2Ba(gydF4y2BabgydF4y2Ba),gydF4y2BaZmNHX1gydF4y2Ba(gydF4y2BacgydF4y2Ba), 和gydF4y2BaZMSKOR.gydF4y2Ba(gydF4y2BadgydF4y2Ba)在非压力和盐度胁迫玉米幼苗的根和叶中。植株在0、20、100或400 μM DCPTA(含或不含150 mM NaCl)水培溶液中生长。数据是平均值±SES(gydF4y2BanGydF4y2Ba= 5)。条上的不同字母表示根据邓肯的测试(gydF4y2BaPgydF4y2Ba = 0.05)
讨论gydF4y2Ba
盐胁迫的有害影响涉及与植物生长发育有关的各种生理生化机制[gydF4y2Ba4gydF4y2Ba,gydF4y2Ba42gydF4y2Ba].生物量是植物对胁迫反应的可靠指标,盐胁迫的主要影响之一是抑制植物生长[gydF4y2Ba4gydF4y2Ba].在本研究中,盐胁迫显著降低了玉米幼苗的生长,表现为玉米幼苗根系和地上部的DW降低。然而,DCPTA的施用缓解了盐胁迫下的生长抑制,特别是在100 μM下。研究表明,有一个两阶段增长盐度反应:首先减少增长的减少土壤水势,然后通过盐伤害老叶子,因为盐浓度的迅速崛起在细胞壁的胞浆空泡再也不能削减的盐(gydF4y2Ba4gydF4y2Ba].DCPTA对盐胁迫下玉米幼苗生长的促进作用可能与维持水分和钾有关gydF4y2Ba+gydF4y2Ba/ NagydF4y2Ba+gydF4y2Ba体内平衡。DCPTA对两种大豆的生物质生产也有有益的影响[gydF4y2Ba43gydF4y2Ba]和玉米[gydF4y2Ba35gydF4y2Ba]在干旱胁迫和低温胁迫下的玉米[gydF4y2Ba33gydF4y2Ba,gydF4y2Ba36gydF4y2Ba].gydF4y2Ba
植物在盐度条件下生长减少是由于盐度对光合作用的生物能量过程造成不利影响[gydF4y2Ba1gydF4y2Ba].在这项研究中,NaCl压力降低了pgydF4y2BanGydF4y2Ba在玉米幼苗。外源DCPTA (20 μM和100 μM)缓解了nacl对植物光合作用的抑制作用,这与DCPTA处理提高了植物的根、枝生物量有关。气孔关闭是植物对盐胁迫的重要响应,叶片膨压降低以减少水分流失gydF4y2Ba年代GydF4y2Ba,因此,有限的环境COgydF4y2Ba2gydF4y2Ba扩散到羧化和光合术的气孔限制的位置[gydF4y2Ba13.gydF4y2Ba].一致,我们也观察到ggydF4y2Ba年代GydF4y2Ba响应NaCl应激而显着降低,并伴随着T的减少gydF4y2BarGydF4y2Ba.然而,通过DCPTA(20和100μm)缓解了这些减少,这与谢等人的先前研究结果一致。[gydF4y2Ba35gydF4y2Ba, DCPTA对植物光合能力有积极影响。增加ggydF4y2Ba年代GydF4y2Ba和TgydF4y2BarGydF4y2Ba可能与dcpta处理植株保持水分状态和增强根系吸水能力有关,从而降低光合作用的气孔限制[gydF4y2Ba35gydF4y2Ba].此外,盐度胁迫显著提高了CgydF4y2Ba我GydF4y2Ba,这可能是由于CO的减少gydF4y2Ba2gydF4y2Ba通过照相光氧化或损伤诱导的同化和盐度胁迫下光合作用酶的灭活[gydF4y2Ba13.gydF4y2Ba].这些结果表明,非气孔限制是导致磷含量下降的主要原因gydF4y2BanGydF4y2Ba在盐度条件下生长的植物[gydF4y2Ba44gydF4y2Ba].但是,C增加gydF4y2Ba我GydF4y2Ba100 μM DCPTA缓解了盐胁迫对番茄幼苗生长的影响,降低了CgydF4y2Ba我GydF4y2Ba在DCPTA治疗的植物中可能与增强型合作厂有关gydF4y2Ba2gydF4y2Ba这取决于光合器官结构和功能的完整性,从而降低dcpta处理植物光合作用的非气孔限制[gydF4y2Ba4gydF4y2Ba].DCPTA减轻了气孔限制和非气孔限制,提高了盐胁迫下的光合能力。gydF4y2Ba
叶绿素是捕获光能并在植物中进行光合作用的必需颜料。gydF4y2BaFgydF4y2BavGydF4y2Ba/gydF4y2BaFgydF4y2Ba米GydF4y2Ba, ΦPSII和qP是反映光化学猝灭的参数,而NPQ反映非光化学猝灭[gydF4y2Ba45gydF4y2Ba].在本研究中,NaCl胁迫降低了叶绿素含量,gydF4y2BaFgydF4y2BavGydF4y2Ba/gydF4y2BaFgydF4y2Ba米GydF4y2Ba在20 μM和100 μM的DCPTA处理下,上述下降趋势有所缓解。这说明外源DCPTA可能增强了PSII光化学吸收和转换光能的能力,提高了PSII光化学的量子效率,从而增强了盐度条件下的光合作用。此外,外源DCPTA缓解了盐胁迫下qP的降低和NPQ的增加,说明DCPTA可以提高光化学过程中吸收光的利用效率,且热耗散和荧光发射最小[gydF4y2Ba33gydF4y2Ba,gydF4y2Ba35gydF4y2Ba].这是通过观察到DCPTA改善的pgydF4y2BanGydF4y2Ba在盐度胁迫下的玉米幼苗。叶绿素含量的增加和PSII效率的改善可能与DCPTA在保护光合损伤免受胁迫条件下的氧化损伤中的有希望的作用有关[gydF4y2Ba35gydF4y2Ba,gydF4y2Ba46gydF4y2Ba]因此,这些结果表明,DCPTA提高了PSII效率,最终提高了玉米的光合能力和耐盐性。gydF4y2Ba
DCPTA的作用促进了植物生物量和光合能力的增加,也可以归因于水分状况的改善。在本研究中,施用20 μM和100 μM DCPTA缓解了盐胁迫下水分状况的下降,LRWC和叶片Ψω表明,这可能是由于植物根系吸水与叶片蒸腾之间保持了动态平衡[gydF4y2Ba13.gydF4y2Ba].此外,用DCPTA处理的应力植物中的LRWC和叶片ωΩ的相对较低的减少与G的相对较低的减少一致gydF4y2Ba年代GydF4y2Ba和TgydF4y2BarGydF4y2Ba在那些植物。鉴于DCPTA的有益作用对植物水分状况是由于增加根吸水,这在很大程度上是通过改善根系生长(这是与根DW,长度、表面积和体积)和Lp,不减少水损失的增加gydF4y2Ba年代GydF4y2Ba和TgydF4y2BarGydF4y2Ba.上述结果表明,DCPTA提高了玉米根系吸水能力,从而改善了盐胁迫下玉米植株的水分状况。gydF4y2Ba
根部吸收的盐在蒸腾物流中长距离运输到枝条,叶子是NA的主要位置gydF4y2Ba+gydF4y2Ba大多数植物中的积累[gydF4y2Ba4gydF4y2Ba].在本研究中,添加DCPTA导致Na显著降低gydF4y2Ba+gydF4y2Ba枝条中的浓度,伴随着减少的枝条/根NAgydF4y2Ba+gydF4y2Ba盐度压力下的比率。减少细胞质NagydF4y2Ba+gydF4y2Ba在高浓度下,植物已经进化出各种适应机制,包括限制NagydF4y2Ba+gydF4y2Ba从土壤溶液中吸收,挤出过多的钠gydF4y2Ba+gydF4y2Ba和钠的液泡分配gydF4y2Ba+gydF4y2Ba减少NA.gydF4y2Ba+gydF4y2Ba胞质内积聚[gydF4y2Ba47gydF4y2Ba].在本研究中,在盐度胁迫条件下,表达gydF4y2BaZMSOS1gydF4y2Ba在根和芽中表达上调,DCPTA进一步上调表达gydF4y2BaZMSOS1gydF4y2Ba根;反过来,这种上调降低了NagydF4y2Ba+gydF4y2Ba胞质内流或促进钠gydF4y2Ba+gydF4y2Ba导出到Applastic Space [gydF4y2Ba11.gydF4y2Ba,gydF4y2Ba48gydF4y2Ba]因此,DCPTA可以提高植物挤出钠的能力gydF4y2Ba+gydF4y2Ba进入土壤溶液和/或减轻NA的毒性作用gydF4y2Ba+gydF4y2Ba,作为Na的毒性gydF4y2Ba+gydF4y2Ba在妊娠空间中很小[gydF4y2Ba49gydF4y2Ba].DCPTA增加拍摄gydF4y2BaZMHKT1gydF4y2Ba盐胁迫下NagydF4y2Ba+gydF4y2Ba再循环进入木质部和钠gydF4y2Ba+gydF4y2Ba与此相反,DCPTA降低gydF4y2BaZMHKT1gydF4y2Ba在根中表达,减少了NagydF4y2Ba+gydF4y2Ba装入木质部,随后运输钠gydF4y2Ba+gydF4y2Ba这表明,与未经处理的植物相比,经DCPTA处理的植物可能更能抑制NagydF4y2Ba+gydF4y2Ba在敏感组织中积累。gydF4y2BaHKT.gydF4y2Ba转运体已经被证明介导钠的转运gydF4y2Ba+gydF4y2Ba通过检索na从根部到枝条gydF4y2Ba+gydF4y2Ba从根到茎的木质部汁液,这代表了一种策略,以避免光合器官的毒性作用[gydF4y2Ba9gydF4y2Ba,gydF4y2Ba42gydF4y2Ba].在本研究中gydF4y2BaZMHKT1gydF4y2Ba在盐胁迫下,对DCPTA的响应与下部茎/根钠有关gydF4y2Ba+gydF4y2Ba与未处理植株相比,DCPTA处理植株的光合速率显著降低。增加的表达式gydF4y2BaZMSOS1gydF4y2Ba在根源和gydF4y2BaZMHKT1gydF4y2Ba在芽中,同时降低gydF4y2BaZMHKT1gydF4y2Ba在根部有助于降低nagydF4y2Ba+gydF4y2Ba因此,在用DCPTA处理的植物的芽中浓度,因此可以是DCPTA对暴露于盐度胁迫的植物的关键后果。此外,最近的一项研究表明,Na-Suplimated玉米植物具有改进的液泡NagydF4y2Ba+gydF4y2Ba它们的叶片能积累大量的钠gydF4y2Ba+gydF4y2Ba在那些机构没有对光合能力的任何不利影响的影响[gydF4y2Ba50gydF4y2Ba].有人提议gydF4y2BaNHX.gydF4y2Ba函数在NagydF4y2Ba+gydF4y2Ba在液泡中的分区化和Na的流出gydF4y2Ba+gydF4y2Ba来自细胞[gydF4y2Ba4gydF4y2Ba,和。的上调gydF4y2BaNHX.gydF4y2Ba在转基因植物种类中如gydF4y2Ba芸苔属植物显著gydF4y2Ba[gydF4y2Ba51gydF4y2Ba],poplar [gydF4y2Ba52gydF4y2Ba]和番茄[gydF4y2Ba53gydF4y2Ba已被证明可以增加植物盐度耐受性。此外,先前的研究表明,耐盐性含致玉米杂种表现出更高的表达gydF4y2BaZmNHX1gydF4y2Ba除了暴露于盐度应力的盐度敏感杂种比对[gydF4y2Ba54gydF4y2Ba].在这项研究中,gydF4y2BaZmNHX1gydF4y2Ba在盐度应力下的植物的根部和芽的根部和芽上上调,并在盐度条件下进一步上调了DCPTA处理的植物的芽。上调gydF4y2BaZmNHX1gydF4y2Ba对DCPTA反应的芽中的表达是Na增加的原因gydF4y2Ba+gydF4y2Ba叶片液渣中的分区化,有利于减少NAgydF4y2Ba+gydF4y2Ba提高液泡的渗透性,同时增强植物的耐盐性[gydF4y2Ba55gydF4y2Ba].gydF4y2Ba
由于相似的水化半径KgydF4y2Ba+gydF4y2Ba和nagydF4y2Ba+gydF4y2Ba,过量的nagydF4y2Ba+gydF4y2Ba奥斯穆蒂姆显然竞争了kgydF4y2Ba+gydF4y2Ba进入运输站点的Syplast,导致k减少gydF4y2Ba+gydF4y2Ba浓度和Na的变化gydF4y2Ba+gydF4y2Ba/ K.gydF4y2Ba+gydF4y2Ba盐度压力下的比率[gydF4y2Ba18.gydF4y2Ba].在本研究中,DCPTA显著增加了KgydF4y2Ba+gydF4y2Ba浓度降低,钠含量降低gydF4y2Ba+gydF4y2Ba/ K.gydF4y2Ba+gydF4y2Ba盐度应力下植物中的比率,这对盐度耐受性至关重要[gydF4y2Ba4gydF4y2Ba].已经证明gydF4y2BaskgydF4y2Ba钾离子通道影响木质部负荷量gydF4y2Ba+gydF4y2Ba[gydF4y2Ba16.gydF4y2Ba].在这项研究中,DCPTA显着上调了表达gydF4y2BaZMSKOR.gydF4y2Ba在150 mM NaCl胁迫下,植株的钾含量增加gydF4y2Ba+gydF4y2Ba释放到木质部以便向嫩枝运输[gydF4y2Ba22.gydF4y2Ba,gydF4y2Ba56gydF4y2Ba],且与K增加相关gydF4y2Ba+gydF4y2Ba本研究用DCPTA治疗的植物中的浓度。而且,上调的gydF4y2BaZMSKOR.gydF4y2Ba结合gydF4y2BaZMSOS1gydF4y2Ba和gydF4y2BaZMHKT1gydF4y2Ba在拍摄以及下调gydF4y2BaZMHKT1gydF4y2Ba在用DCPTA治疗的植物根中可以占降低NAgydF4y2Ba+gydF4y2Ba/ KgydF4y2Ba+gydF4y2Ba盐度胁迫下的植物的比例。gydF4y2Ba
结论gydF4y2Ba
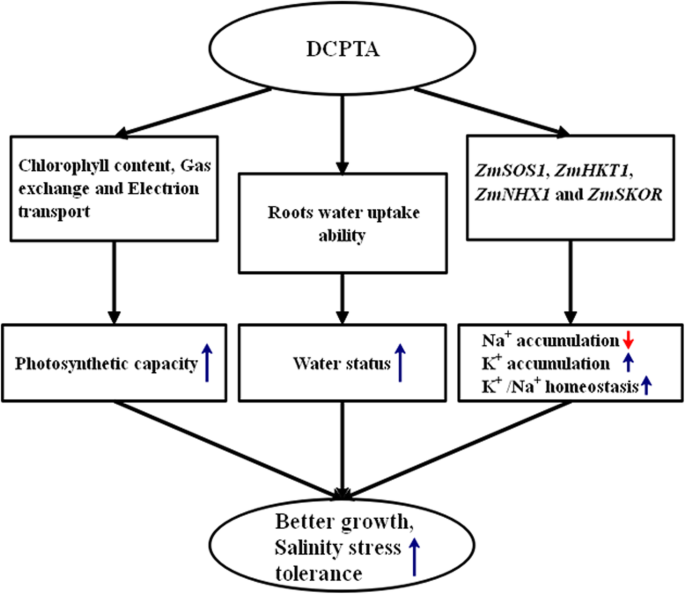
综上所述,100 μM DCPTA可提高玉米幼苗的耐盐性。DCPTA通过调节气孔运动和改善PSII的光能吸收和电子传递来提高玉米植株的光合能力;DCPTA通过促进根系生长和提高根系对水分的吸收能力来维持水分状态,促进水分向特定组织和CO的运输gydF4y2Ba2gydF4y2Ba质膜扩散;此外,DCPTA预处理降低了Na含量gydF4y2Ba+gydF4y2Ba浓度增加KgydF4y2Ba+gydF4y2Ba通过改变四种基因的表达来浓缩(gydF4y2BaZMSOS1gydF4y2Ba,gydF4y2BaZMHKT1gydF4y2Ba,gydF4y2BaZmNHX1gydF4y2Ba和gydF4y2BaZMSKOR.gydF4y2Ba)编码负责K的膜传输蛋白质gydF4y2Ba+gydF4y2Ba/ NagydF4y2Ba+gydF4y2Ba盐胁迫下的内稳态。光合作用、水分状况和钾含量的改善gydF4y2Ba+gydF4y2Ba/ NagydF4y2Ba+gydF4y2Ba稳态有助于提高生长和盐度应力耐受性(图。gydF4y2Ba9gydF4y2Ba).因此,适宜浓度的DCPTA是提高盐胁迫下作物产量的可持续途径。gydF4y2Ba
方法gydF4y2Ba
植物生长条件、胁迫处理和取样gydF4y2Ba
将中国北京德农种业有限公司的玉米(本地常种品种ZD958)种子表面用0.2%的氯化汞消毒10分钟,然后用大量蒸馏水冲洗。种子在蒸馏水中浸泡12 h后,置于28℃蒸馏水浸湿的双层滤纸上,在黑暗中萌发2 d。将萌发后的种子播种在石英砂中,气候箱(hcg - 280hx,哈尔滨东联电子科技发展有限公司,中国哈尔滨),温度设置为28°C/18°C,对应12 h/12 h(昼/夜)光周期;室内光照强度为350 ~ 450 μmol·mgydF4y2Ba− 2.gydF4y2Ba·gydF4y2Ba− 1.gydF4y2Ba,相对湿度为50 ~ 60%。将大小一致的二叶期幼苗移栽到装有1/2强度霍格兰营养液(pH 6.5)的塑料盆(40.5 cm × 32.5 cm × 12 cm,每盆12株)。营养液每3天更换一次,以避免养分消耗。营养液由以下成分组成:2.5 mM Ca (NOgydF4y2Ba3.gydF4y2Ba)gydF4y2Ba2gydF4y2Ba, 1.0 mM KgydF4y2Ba2gydF4y2Ba所以gydF4y2Ba4gydF4y2Ba, 0.2 mM KHgydF4y2Ba2gydF4y2Ba阿宝gydF4y2Ba4gydF4y2Ba,0.6 mm mgsogydF4y2Ba4gydF4y2Ba, 2.5 mM CaClgydF4y2Ba2gydF4y2Ba, 0.5 mM NaCl, 1.0 μM HgydF4y2Ba3.gydF4y2Ba薄gydF4y2Ba4gydF4y2Ba,2.0μmmnsogydF4y2Ba4gydF4y2Ba, 0.5 μM ZnSOgydF4y2Ba4gydF4y2Ba, 0.3 μM CuSOgydF4y2Ba4gydF4y2Ba, 0.005 μm (nh .gydF4y2Ba4gydF4y2Ba)gydF4y2Ba6gydF4y2Ba莫gydF4y2Ba7gydF4y2BaOgydF4y2Ba24.gydF4y2Ba和200μmfe-EDTA。当幼苗增长到三叶阶段时,它们用以下不同的营养溶液治疗:(1)1/2强度的Hoagland营养溶液(CK);(2)1/2强度Hoagland营养溶液+20μmdcpta(20μmdcpta);(3)1/2强度Hoagland营养溶液+100μmdcpta(100μmdcpta);(4)1/2强度Hoagland营养溶液+400μmdcpta(400μmdcpta);(5)150 mm NaCl,1/2强度Hoagland营养溶液+0μmdcpta(NaCl);(6)150mM NaCl,1/2强度Hoagland营养液+20μmdcpta(NaCl +20μmdcpta);(7)150mM NaCl,1/2强度的Hoagland营养溶液+100μmdcpta(NaCl +100μmdcpta);(8)150mM NaCl在1/2强度的Hoagland营养液+400μmdcpta(NaCl +400μmdcpta)中。在营养溶液中加入NaCl前2天应用DCPTA(郑州郑石化工有限公司)2天。 The NaCl concentration was gradually increased in 50 mM increments every 8 h to avoid salinity shock. The experiment included 8 treatments with 5 replicates (90 plants in total per treatment). Each replicate included 18 plants (selected from 2 pots of 12 plants each). Five days after the salinity level reached 150 mM, the gas exchange, chlorophyll fluorescence parameters, LRWC and leaf Ψω were measured for the second fully expanded leaf, and the root Lp was measured. The plants in the 8 treatments were then collected, frozen immediately in liquid nitrogen and stored at − 80 °C until the plant biomass determination and biochemical assays.
在第二个实验中,以同样的方式栽培这些植物。盐度治疗后24小时(0和150毫米氯化钠)结合DCPTA(0, 20和100μM),玉米幼苗的根和叶6治疗(包括五个复制)被混合采样5幼苗/复制,立即冻结在液态氮,然后储存在−RT-qPCR 80°C。gydF4y2Ba
植物生长,根特征参数和离子浓度分析gydF4y2Ba
处理5天后,将植株分为根和芽两部分。然后使用根扫描仪(MRS-9600TFU2L,上海美科威科技有限公司)扫描根特征参数,包括根长度、表面积和体积。中国上海)。根和芽随后在80°C烘箱中干燥至恒重,以确定DW。根和芽的干样被磨成细粉,通过直径1毫米的不锈钢网筛。之后,用5ml的HNO消化0.1 g的根和芽样品gydF4y2Ba3.gydF4y2Ba:HCLOgydF4y2Ba4gydF4y2Ba(5:1 v/v)80℃下的溶液 °C,直到样品仅含有少量白色残留物。然后将样品加热至50℃ 用去离子水稀释mL,测定钾的含量gydF4y2Ba+gydF4y2Ba和nagydF4y2Ba+gydF4y2Ba采用火焰原子吸收分光光度法(Z-2000;日立、日本)。gydF4y2Ba
测定LRWCgydF4y2Ba
为了分析LRWC,收集第二次完全展开的叶片并称重,测定鲜重(FW),然后在黑暗中浸泡在蒸馏水中24 h。然后用吸水纸轻轻吸干叶片,并称重以确定其膨体重量(TW)。然后样品在105°C的烘箱中干燥20分钟,然后是80°C,直到达到恒定的重量,此时测定DW。LRWC (%) = [(FW - DW) / (TW - DW)] × 100。gydF4y2Ba
叶ψω的测量gydF4y2Ba
第二次完全膨胀叶的叶片ψω由压力室技术(3115型压力室,北京华海恒辉科技有限公司,中国)。收获第二完全膨胀的叶片并立即插入压力室的橡胶塞孔中,使得切口暴露在密封圈外部大约几毫米以便于观察。在确认良好的密封之后,旋转压力控制阀以缓慢加压在0.05MPa·sgydF4y2Ba− 1.gydF4y2Ba.当切口处出现水膜时,控制阀停止转动,此时压力值记为叶片Ψω。gydF4y2Ba
叶绿素含量测定gydF4y2Ba
为了测量叶片中的叶绿素含量,将新鲜的叶样品(0.5g)和5ml丙酮(80%v / v)一起均匀化在冰浴中。在4℃下以10,000g离心10分钟后,用分光光度计(UV-5500,上海元分析仪器有限公司,中国)分光光度计(UV-5500,上海人民币分析仪器有限公司)在645和663nm处吸收吸光度以确定叶绿素A的内容(CHL A)和叶绿素B(CHL B)。根据Arnon的等式计算这些内容[gydF4y2Ba57gydF4y2Ba].gydF4y2Ba
气体交换参数的测定gydF4y2Ba
用Li-6400便携式光合系统(Li-Cor Inc.,USA)在9:00-11:00中测定附着叶的气体交换。对于玉米幼苗的不同治疗方法。第二个完全膨胀的叶片用于测定。在测量期间,叶室温度保持在大约26℃,光合光子通量密度(PPFD)为800μmolmgydF4y2Ba− 2.gydF4y2Ba s− 1.gydF4y2Ba,co.gydF4y2Ba2gydF4y2Ba浓度为400 μmol·molgydF4y2Ba− 1.gydF4y2Ba,相对湿度为60-70%。气体交换参数PgydF4y2BanGydF4y2Ba, GgydF4y2Ba年代GydF4y2Ba, CgydF4y2Ba我GydF4y2Ba和TgydF4y2BarGydF4y2Ba每次治疗有五种幼苗同时记录。gydF4y2Ba
叶绿素荧光参数的测定gydF4y2Ba
通过PAM2000调节荧光光谱仪(德国沃尔兹)测定叶绿素荧光。暗适应30分钟后,最小荧光(gydF4y2BaFgydF4y2BaoGydF4y2Ba(< 0.05 μmol·m)gydF4y2Ba− 2.gydF4y2Ba·gydF4y2Ba− 1.gydF4y2Ba)和最大荧光(gydF4y2BaFgydF4y2Ba米GydF4y2Ba)通过饱和脉冲光(0.8秒;8000μmol·mgydF4y2Ba− 2.gydF4y2Ba·gydF4y2Ba− 1.gydF4y2Ba).光合作用稳态荧光(gydF4y2BaFgydF4y2Ba年代GydF4y2Ba打开光化光(1 h;300μ摩尔·mgydF4y2Ba− 2.gydF4y2Ba·gydF4y2Ba− 1.gydF4y2Ba),饱和脉冲光(8000μmol·mgydF4y2Ba− 2.gydF4y2Ba·gydF4y2Ba− 1.gydF4y2Ba)再次打开以获得最大荧光值(gydF4y2BaFgydF4y2Ba米GydF4y2Ba'),光明灯被关闭,远红灯立即打开,最小荧光(gydF4y2BaFgydF4y2BaoGydF4y2Ba)。其他参数计算如下gydF4y2BaFgydF4y2BavGydF4y2Ba/gydF4y2BaFgydF4y2Ba米GydF4y2Ba = (FgydF4y2Ba米GydF4y2Ba-gydF4y2BaFgydF4y2BaoGydF4y2Ba) / FgydF4y2Ba米GydF4y2Ba;PSII的光化学量子效率(φPSII)=(gydF4y2BaFgydF4y2Ba米GydF4y2Ba' -gydF4y2BaFgydF4y2Ba年代GydF4y2Ba) / Fm”;光化学猝灭系数(qP) =gydF4y2BaFgydF4y2Ba米GydF4y2Ba' -gydF4y2BaFgydF4y2Ba年代GydF4y2Ba) / (gydF4y2BaFgydF4y2Ba米GydF4y2Ba' -gydF4y2BaFgydF4y2BaoGydF4y2Ba');并且非光化学淬火(NPQ)系数=(gydF4y2BaFgydF4y2Ba米GydF4y2Ba- - - - - -gydF4y2BaFgydF4y2Ba米GydF4y2Ba')/gydF4y2BaFgydF4y2Ba米GydF4y2Ba'[gydF4y2Ba45gydF4y2Ba].gydF4y2Ba
根Lp测定gydF4y2Ba
根据Nardini等人的方法进行LP的测定。[gydF4y2Ba58gydF4y2Ba,稍作修改。对5株玉米幼苗进行根茎扦插处理。然后将整个根置于压力室中,切口向密封圈外暴露约几厘米,并逐渐增加对根的压力(从0.1 MPa到0.4 MPa)。在每个压力梯度下(持续1分钟),用预先准备好的干燥吸水棉在Eppendorf管中收集汁液,然后在精密天平上称重,从而产生一个代表全植物T的汁液流范围gydF4y2BarGydF4y2Ba.根Lp的计算公式为:Lp = Jv/P,其中Jv (m·sgydF4y2Ba− 1.gydF4y2Ba)流速和P(MPa)是外部压力。gydF4y2Ba
RNA提取和定量RT-QPCRgydF4y2Ba
Toextract RNA using a Qiagen RNeasy Plant Mini Kit (Shanghai Baili Biotechnology Co., Ltd., Shanghai, China), 0.1 g of root and shoot samples was used. The cDNA was then reverse transcribed using an iScript™ cDNA synthesis kit (Bio-Rad, California, USA) kit. The cDNA was diluted 50-fold, and 2 μL was taken for qRT-PCR analysis. Actin1 was used as an internal reference gene. A relative quantitative analysis was performed using the 2-gydF4y2Ba△gydF4y2Ba△gydF4y2BaCTgydF4y2Ba方法。使用的引物列于表中gydF4y2BaS1gydF4y2Ba.每个处理5个重复,每株5个技术重复。gydF4y2Ba
统计分析gydF4y2Ba
采用SPSS 19.0 (IBM, Armonk, NY, USA)进行统计分析。采用三种变异源(NaCl、DCPTA及其相互作用)对数据进行双向方差分析,并采用邓肯多范围检验(Duncan’s multiple range test,gydF4y2BaPgydF4y2Ba < 0.05) (Additional file2gydF4y2Ba).gydF4y2Ba
数据和材料的可用性gydF4y2Ba
在当前研究期间使用和/或分析的数据集可从合理的请求上从相应的作者获得。gydF4y2Ba
缩写gydF4y2Ba
- CgydF4y2Ba我GydF4y2Ba:gydF4y2Ba
-
细胞内的公司gydF4y2Ba2gydF4y2Ba浓度gydF4y2Ba
- 的背影,gydF4y2Ba
-
叶绿素A.gydF4y2Ba
- 的背影b:gydF4y2Ba
-
叶绿素B.gydF4y2Ba
- DCPTA:gydF4y2Ba
-
(2) - 3 4-dichlorophenoxy三乙胺gydF4y2Ba
- DW:gydF4y2Ba
-
干重gydF4y2Ba
- FgydF4y2BaoGydF4y2Ba:gydF4y2Ba
-
最小荧光gydF4y2Ba
- FgydF4y2Ba米GydF4y2Ba:gydF4y2Ba
-
深适应状态的最大荧光产量gydF4y2Ba
- FgydF4y2BavGydF4y2Ba/gydF4y2BaFgydF4y2Ba米GydF4y2Ba:gydF4y2Ba
-
PSII光化学的最大量子产额gydF4y2Ba
- gGydF4y2Ba年代GydF4y2Ba:gydF4y2Ba
-
气孔导度gydF4y2Ba
- 珍:gydF4y2Ba
-
液流gydF4y2Ba
- LP:gydF4y2Ba
-
根液压导率gydF4y2Ba
- LRWC:gydF4y2Ba
-
叶片相对含水量gydF4y2Ba
- NPQ:gydF4y2Ba
-
非光化学淬火gydF4y2Ba
- 病人:gydF4y2Ba
-
压力gydF4y2Ba
- PgydF4y2BanGydF4y2Ba:gydF4y2Ba
-
净光合率gydF4y2Ba
- psii:gydF4y2Ba
-
拍照IIgydF4y2Ba
- PPFD:gydF4y2Ba
-
光合光子磁通密度gydF4y2Ba
- 表示为:gydF4y2Ba
-
光化学淬火系数gydF4y2Ba
- ROS:gydF4y2Ba
-
反应性氧气gydF4y2Ba
- TgydF4y2BarGydF4y2Ba:gydF4y2Ba
-
蒸腾速率gydF4y2Ba
- ψω:gydF4y2Ba
-
水潜力gydF4y2Ba
- ΦPSII:gydF4y2Ba
-
PSII光化学的有效量子产量gydF4y2Ba
参考gydF4y2Ba
- 1。gydF4y2Ba
Yadav S,Irfan M,Ahmad A,Hayat S.盐度的原因和植物表现出来的盐压力:综述。J环境BIOL。2011; 32(5):667-85。gydF4y2Ba
- 2。gydF4y2Ba
作物耐盐性的成本是多少?新植醇。2015;208(3):668 - 73。gydF4y2Ba
- 3.gydF4y2Ba
ABDEL LATEF AA,MOSTAFA MG,RAHMAN MM,ABDEL-FARID AB,TRAN LP。通过改变强调植物的物理生化特征,酵母和胡萝卜根的提取物增强海水诱导的盐胁迫下的玉米性能。J工厂增长调节。2019年; 38(3):966-79。gydF4y2Ba
- 4.gydF4y2Ba
Munns R,Tester M.盐度耐受机制。Annu Rev植物Biol。2008; 59(1):651。gydF4y2Ba
- 5.gydF4y2Ba
Abdel Latef Aa,Kordrostam M,Zakir A,Zaki H,Saleh Om。eustress与h.gydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba通过改善两种小麦品种的耐盐胁迫的耐受性促进植物生长。植物。2019; 8(9):303。gydF4y2Ba
- 6.gydF4y2Ba
Dagar JC,Sharma PC,Sharma DK,Singh Ak。创新盐水农业:印度斯普林斯。2016年。gydF4y2Ba
- 7.gydF4y2Ba
光合作用和盐度:这两者是相互排斥的吗?Photosynthetica。2018;56:1-16。gydF4y2Ba
- 8.gydF4y2Ba
粮农组织。如何在2050年养活世界。罗马:粮食和农业组织;2009.gydF4y2Ba
- 9gydF4y2Ba
徐国强,徐国强,徐国强。植物耐盐机制。植物学报,2014;19(6):371-9。gydF4y2Ba
- 10。gydF4y2Ba
硬质小麦中GABA分流。植物学报。2018;9:100。gydF4y2Ba
- 11.gydF4y2Ba
杨勇,郭勇。植物盐胁迫响应的分子机制研究。新植醇。2018;217(2):523 - 39。gydF4y2Ba
- 12.gydF4y2Ba
Ferchichi S, Hessini K, Dell Aversana E, D’amelia L, Carillo P. Hordeum vulgum和Hordeum maritimum对盐度胁迫的响应表现出不同的代谢产物的时间积累模式。植物生态学报。2018;45(11):1096-109。gydF4y2Ba
- 13。gydF4y2Ba
NegrãoS,SchmöckelSM,测试仪M.评估植物的生理反应以盐度应力。安乐伦敦。2017; 119(1):1-11。gydF4y2Ba
- 14gydF4y2Ba
陈丽娟,陈丽娟。非生物胁迫诱导光抑制过程中光合作用的调节。摩尔。2015;8(9):1304 - 20。gydF4y2Ba
- 15gydF4y2Ba
Sánchez-Blanco MJ,Álvarezs,ortuñomf,ruiz-sánchezmc。根系对干旱和盐度的反应:根部分布和水运输。根工程柏林海德堡:斯普林克。2014:325-52。gydF4y2Ba
- 16gydF4y2Ba
Munns R.基因和耐盐性:将它们携带在一起。新植物。2005; 167(3):645-63。gydF4y2Ba
- 17gydF4y2Ba
王勇,吴文辉。高等植物钾离子的转运与信号转导。植物学报。2013;64(1):451-76。gydF4y2Ba
- 18gydF4y2Ba
朱杰克。盐胁迫下离子稳态的调节。CurrOp植物BIOL。2003; 6(5):441-5。gydF4y2Ba
- 19gydF4y2Ba
Bassil E,Tajima H,Liang Yc,Ohto Ma,Blumwald E. rapidopsis nagydF4y2Ba+gydF4y2Ba/HgydF4y2Ba+gydF4y2Ba反转运体NHX1和NHX2控制液泡pH和KgydF4y2Ba+gydF4y2Ba调节生长、花发育和繁殖的内稳态。植物细胞。2011;23(9):3482-97。gydF4y2Ba
- 20。gydF4y2Ba
Assaha DVM,Ueda A,Saneoka H,Alyahyai R,Yaish MW。na的作用gydF4y2Ba+gydF4y2Ba和KgydF4y2Ba+gydF4y2Ba糖植物盐胁迫适应的转运体。杂志。2017;8:509。gydF4y2Ba
- 21.gydF4y2Ba
张H,Wei S,Hu W,Xiao L,Tang M.丛枝菌根真菌relizophagus Irregularis增加了钾含量和编码钾通道的基因的表达gydF4y2Ba枸杞gydF4y2Ba.前植物SCI。2017; 8:440。gydF4y2Ba
- 22.gydF4y2Ba
盖mard, Pilot G, Lacombe B, Bouchez D, Bruneau D, Boucherez J, Michauxferrière N, Thibaud JB, Sentenac hgydF4y2Ba+gydF4y2Ba释放到木质中。细胞。1998; 94(5):647-55。gydF4y2Ba
- 23.gydF4y2Ba
Yakhin OI,Lubyanov AA,Yakhin IA,Brown博士。植物科学中的生物刺激剂:全球视角。前沿植物科学。2016;7:12684。gydF4y2Ba
- 24.gydF4y2Ba
横山H, Hayman EP, Hsu WJ, Poling SM, Bauman AJ。橡胶在银胶菊植株中的化学生物诱导。科学。1977;197(4308):1076 - 8。gydF4y2Ba
- 25.gydF4y2Ba
2-(3,4-二氯苯氧基)三乙胺(DCPTA)对番茄产量的影响。植物生长规律。1990;9(2):127-36。gydF4y2Ba
- 26.gydF4y2Ba
Keithly Jh,Yokoyama H. 2-(3,4-二氯苯氧基)三乙胺(DCPTA)对萝卜生长和发育的影响(gydF4y2Ba萝卜gydF4y2Bal .)。美国化学学会论文摘要。1986;192(3):44。gydF4y2Ba
- 27.gydF4y2Ba
王LJ,张P,王立,王P,黄某。各种化学调节剂对玉米萌发过程中耐寒性的影响。J Intent agr。2018; 17:2662-9。gydF4y2Ba
- 28.gydF4y2Ba
Keithly Jh,Yokoyama H,Gausman HW。2-(3,4-二氯苯氧基)三乙胺(DCPTA)对甜菜生长发育的影响。植物SCI。1990; 68(1):57-64。gydF4y2Ba
- 29。gydF4y2Ba
2-(3,4-二氯苯氧基)三乙胺对银胶菊(gydF4y2Ba光argentatumgydF4y2Ba)细胞悬浮培养。[J] .食品科学,1992;40(5):924-6 .]gydF4y2Ba
- 30.gydF4y2Ba
本尼迪克特CR,罗森菲尔德CL,马汉JR,马达万S,横山H.柑橘类胡萝卜素生物合成的化学调控.植物科学.1985;41(3):169-73。gydF4y2Ba
- 31。gydF4y2Ba
顾文荣,李喆,翟志新。叔胺生物调节剂对玉米叶片光合作用和叶绿素荧光参数的调控《阿格利司Boreali-Sin。2008; 23(3): 85 - 9。gydF4y2Ba
- 32。gydF4y2Ba
戴维斯TD,Sankhla N,Smith BN。2-(3,4二氯苯氧基) - 三甲胺对杂志光合作用的影响gydF4y2Baphoudolusulus vulgaris.gydF4y2Baacta Photosynth Res. 1986;8(3): 275-81。gydF4y2Ba
- 33。gydF4y2Ba
袁LD,顾Wr,Sun J,Wang Yc,Li J,Wei S.低温胁迫下玉米幼苗叶绿素含量和荧光参数的调控。庄稼。2012; 5:63-7。gydF4y2Ba
- 34。gydF4y2Ba
张辉,顾文荣,王永成,李丽娟,曾凤峰,杨志峰,杨栋梁,魏胜。二氯异丁醇对盐胁迫下玉米幼苗根系生长、渗透调节及细胞膜透性的影响。生态学报。2015;34(9):2474-81。gydF4y2Ba
- 35。gydF4y2Ba
谢TL,顾人,孟义,李继,李立,王YC,魏某,魏S.外源性DCPTA通过提高玉米幼苗的生长和光合能力来改善模拟干旱状况。SCI批准。2017; 7(1):12684。gydF4y2Ba
- 36。gydF4y2Ba
朱海峰,顾文荣,王永春,姜志忠,谢特立,李军,魏胜。低温胁迫下DCPTA对玉米幼苗叶片生理生化特性的影响。核农学报,2015;29(3):549-56。gydF4y2Ba
- 37。gydF4y2Ba
Nuss ET, Tanumihardjo SA。玉米:全球营养背景下最重要的主食作物。食品科学;2010;9(4):417-36。gydF4y2Ba
- 38gydF4y2Ba
Zhang J, Yu H, Zhang Y, Wang Y, Li M, Zhang J, Duan L, Zhang M, Li Z. effects of AtLOS5介导的玉米根离子通量和叶片水分状况对盐胁迫的影响。J Exp Bot. 2016;67(5): 1339-55。gydF4y2Ba
- 39gydF4y2Ba
盐度诱导的细胞膨大营养状态的变化可能影响玉米叶片的生长抑制。植物生态学报。2005;32(2):141-52。gydF4y2Ba
- 40。gydF4y2Ba
Farooq M,Hussain M,Wakeel A,Siddique KHM.玉米盐胁迫:效应、抗性机制和管理。综述。Agron Sustain Dev.2015;35(2):461-81。gydF4y2Ba
- 41。gydF4y2Ba
Flowers TJ,Flowers SA.《为什么盐度对植物育种家造成如此困难的问题?》Agr水资源管理。2005;78(1):15-24。gydF4y2Ba
- 42。gydF4y2Ba
张敏,曹勇,王智,王志强,史军,梁旭,宋伟,陈强,赖俊,蒋超。HKT1家族钠转运蛋白的一个反转录转座子引起叶片Na的变异gydF4y2Ba+gydF4y2Ba玉米中的排除和耐盐性。新植物。2017; 217(3):1161-76。gydF4y2Ba
- 43。gydF4y2Ba
李XY。干旱胁迫下大豆幼苗生长的调控。大豆科学。2016; 36:86-90。gydF4y2Ba
- 44。gydF4y2Ba
Farquhar Gd,Sharkey TD。气孔电导和光合作用。植物理性。1982; 33(1):317-45。gydF4y2Ba
- 45.gydF4y2Ba
叶绿素荧光:体内光合作用的探针。植物学报。2008;59(1):89-113。gydF4y2Ba
- 46.gydF4y2Ba
Pinhero RG,Rao MV,Paliyath G,Murr DP,Fletcher Ra。抗氧化酶活性的变化及其与遗传和紫杉蛋白的关系诱导的玉米幼苗的冷却耐受性。植物理性。1997年; 114(2):695-704。gydF4y2Ba
- 47.gydF4y2Ba
黄志强,黄志强,黄志强,等。盐生植物对多种胁迫的生理响应。acta botanica yunnanica(云南植物研究). 2013;40:883-96。gydF4y2Ba
- 48.gydF4y2Ba
Ji HT, Pardo JM, Batelli G, Van Oosten MJ, Bressan RA。盐过度敏感(SOS)途径:已建立和新出现的作用。摩尔。2013;6(2):275 - 86。gydF4y2Ba
- 49.gydF4y2Ba
丛枝菌根共生通过改善光合作用、水分状况和钾胁迫缓解刺槐盐胁迫gydF4y2Ba+gydF4y2Ba/ NagydF4y2Ba+gydF4y2Ba体内平衡。植物学报2017;8:1739。gydF4y2Ba
- 50.gydF4y2Ba
Pandolfi C、Azzarello E、Mancuso S、Shabala S.驯化提高了该地区的耐盐性gydF4y2Ba玉米gydF4y2Ba植物。acta botanica yunnanica(云南植物研究). 2016;gydF4y2Ba
- 51.gydF4y2Ba
张HX,Hodson Jn,Williams JP,Blumwald E.工程耐盐芸苔植物:转基因植物中产量和种子油质的表征,具有较高的真空钠积累。P Natl Acad Sci USA。2001; 98(22):12832-6。gydF4y2Ba
- 52.gydF4y2Ba
姜春,郑强,刘铮,徐伟,刘丽,赵国龙。拟南芥的过表达gydF4y2Ba+gydF4y2Ba/HgydF4y2Ba+gydF4y2Ba逆向转运基因增强。树木。2012;26(3):685 - 94。gydF4y2Ba
- 53.gydF4y2Ba
张海霞,张海霞。转基因耐盐番茄植株在叶片中积累盐分,但在果实中不积累盐分。生物科技Nat》。2001;19(8):765 - 8。gydF4y2Ba
- 54.gydF4y2Ba
Pitann B,Mohamed Ak,Neubert Ab,Schubert S. tonoplast nagydF4y2Ba+gydF4y2Ba/HgydF4y2Ba+gydF4y2Ba新开发的玉米(gydF4y2Ba玉米gydF4y2Ba)杂种在盐胁迫的第二阶段导致耐盐性。J植物Nutr土壤SCI。2013; 176(2):148-56。gydF4y2Ba
- 55。gydF4y2Ba
崔泰华,田勇,田勇,张海峰,张志强。盐渍化条件下小麦的离子关系和渗透调节。植物生态学报。2009;36(12):1110-9。gydF4y2Ba
- 56。gydF4y2Ba
Maathuis FJ。一价阳离子转运体在植物盐度反应中的作用。中国生物医学工程学报。2006;57(5):1137-47。gydF4y2Ba
- 57。gydF4y2Ba
亚迪。分离叶绿体中的铜酶:多酚氧化酶。gydF4y2BaBeta寻常魅力gydF4y2Ba.植物杂志。1949;24(1):1 - 15。gydF4y2Ba
- 58。gydF4y2Ba
营养盐胁迫下的根构型和水力导度gydF4y2Ba黄连木乳香树gydF4y2BaL.幼苗。oecologia。2012年; 170(4):899-908。gydF4y2Ba
确认gydF4y2Ba
我们要感谢美国期刊专家(gydF4y2Bahttps://www.aje.cngydF4y2Ba)英语语言编辑。gydF4y2Ba
资金gydF4y2Ba
本工作得到了中国国家重点研发计划的国家重点研究和发展方案,对中国国家重点研发计划和“东北农业大学学术”项目(17XG23)的“学术骨干”项目(17xg23)提供了支持的全国科学版(2016YFD0300103和2017YFD0300506)。融资机构并不涉及研究和收集,分析,数据的诠释或写作稿件的设计。gydF4y2Ba
作者信息gydF4y2Ba
隶属关系gydF4y2Ba
贡献gydF4y2Ba
LJL进行了整个实验并起草了手稿。WRG和SW构思和设计了实验。LJL和Syz收集了数据并分析了结果。SYZ,CFL,GLZ,CXC和CRQ帮助解释结果并准备稿件。WRG,SW,ZHW和WHL负责手稿修订。所有作者阅读并认可的终稿。gydF4y2Ba
通讯作者gydF4y2Ba
伦理宣言gydF4y2Ba
伦理批准和同意参与gydF4y2Ba
不适用。gydF4y2Ba
同意出版gydF4y2Ba
不适用。gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者声明他们没有相互竞争的利益。gydF4y2Ba
附加信息gydF4y2Ba
出版商的注意gydF4y2Ba
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。gydF4y2Ba
补充信息gydF4y2Ba
附加文件1:表S1。gydF4y2Ba
用于qPCR分析的引物序列列表。gydF4y2Ba
额外的文件2。gydF4y2Ba
研究数据。gydF4y2Ba
权利和权限gydF4y2Ba
开放访问gydF4y2Ba本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料都包含在本文的知识共享许可中,除非在该材料的信用额度中另有说明。如果资料不包括在文章的知识共享许可协议中,并且你的预期用途没有被法律规定允许或超过允许用途,你将需要直接从版权所有者获得许可。如欲查阅本许可证副本,请浏览gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.Creative Commons公共领域奉献豁免(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)适用于本文提供的数据,除非在数据的信贷额度中另有说明。gydF4y2Ba
关于这篇文章gydF4y2Ba
引用这篇文章gydF4y2Ba
李璐,顾伟,张璐。gydF4y2Ba等等。gydF4y2Ba外源2-(3,4-二氯苯氧基)三乙胺通过提高玉米的光合能力、改善水分状况和维持钾素来缓解盐胁迫gydF4y2Ba+gydF4y2Ba/ NagydF4y2Ba+gydF4y2Ba体内平衡。gydF4y2Ba植物生物学gydF4y2Ba20,gydF4y2Ba348(2020)。https://doi.org/10.1186/s12870-020-02550-wgydF4y2Ba
已收到gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
迪伊gydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12870-020-02550-wgydF4y2Ba
关键词gydF4y2Ba
- DCPTAgydF4y2Ba
- 盐度的压力gydF4y2Ba
- 光合作用gydF4y2Ba
- 水的状态gydF4y2Ba
- 离子体内平衡gydF4y2Ba