摘要
背景
Gleditsia sinensis林。豆科(Leguminosae)是一种雌雄异株的多年生乔木,具有重要的药用价值和经济价值。这些特性可以根据植物的性别加以利用。然而,在开花前,通过形态学的方法很难准确地鉴定植物的性别。
结果
本文采用散装分离分析方法,筛选了植物中具有性别特异性的SSR标记g . sinensis.5株雄性植株和5株雌性植株分别汇集成雄性和雌性植株,并进行全基因组测序。经过高通量测序,共获得5350359条序列,其中检索到20655210个SSRs。其中,SSRs的重复数量最多。雄株可达857,874株,占总雄株数的60.86%。雌性植株可达1447603株,占雌性植株总模型的56.25%。在所有核苷酸重复序列类型中,A/T-rich motif数量最多。通过聚类共筛选出309,516个女性株特异性ssr。引物设计完成后,对男女基因库进行扩增,筛选出5对引物(27、34、36、39、41)扩增男女基因库中的差异条带。利用这5对引物,对10个性别已知的个体进行PCR验证,构建了基因库。 The female plants amplified a single fragment of lengths (i.e., 186, 305, 266, 203, and 260 bp) and no male plant strip, thereby completing the identification of the male and female sexes of theg .制成。
结论
本研究提供了准确的雄性和雌性植物的性别识别策略,从而提高了苜蓿的利用率g . sinensis资源。
背景
Gleditsia sinensis林。是中国重要的原生树种[1].可用于环境保护,园林绿化,并作为经济树种和木材。此外,g . sinensis具有很高的药用价值,包括抗糖尿病、抗高血糖、抗氧化、抗炎、抗癌和抗凝血活性。Gleditsiae Sinensis果实,果实Gleditsiae,Abnormalis Gleditsiae在《中国药典》中,脊柱被记载为中药的药用部位g . sinensis.的类黄酮和类固醇Gleditsiae脊柱在肿瘤治疗中起着重要作用[2,3.].皂苷除具有抗癌、抗病毒作用外,还具有去污、起泡等作用,广泛应用于化妆品和洗涤剂的生产,具有较高的经济价值。
随着研究的深入,市场需求不断增加g . sinensis逐年增加。g . sinensis是一种雌雄异株植物。雌树结荚能力强,营养期长,而雄树不结荚。因此,在生产中必须保持理想的男女比例g . sinensis提高经济效益。大量的雄性树木将浪费土地和劳动力,因为它们的生长速度缓慢。然而,g . sinensis树有较长的幼年期,通常需要6-8年开花结果。因此,在营养阶段,树木的性向很难确定。虽然基于其花形态、生理代谢产物等外在特征差异的性别鉴定在成熟阶段很容易识别,但准确性和可靠性不高。因此,开发具有性别特异性的分子标记对于在移栽前的苗期识别雄树至关重要。
简单序列重复序列(Simple sequence repeat, SSR),又称微卫星,是一类重复的DNA序列,在植物基因组中特别丰富,对基因组和染色体的功能和进化有重要影响[4,5].它也是一种基于PCR技术的DNA分子标记技术。SSR是由若干个核苷酸(一般为1 ~ 6个)重复组成的一组核苷酸,SSR两侧的序列一般为相对保守的单拷贝序列[6].SSR标记与其他分子标记相比具有数量丰富、信息量大、共显性等优点。每个位点由所设计引物的序列决定。因此,合作开发引物方便了不同实验室之间的合作[7].随着许多植物基因组序列的快速积累,许多SSR标记已经在许多植物中出现,如水稻[8],棉花[9]、油菜[10].这些SSR标记已广泛应用于基因图谱构建、基因作图、指纹作图以及标记辅助育种[11].在之前的研究中,我们鉴定了SSRs,并分析了不同碱基重复序列的分布和频率g . sinensis基因组(12].在本研究中,我们结合散装分离分析(BSA)和下一代测序鉴定了性别特异性SSR标记。所鉴定的标记将有助于早期的性别和育种鉴定g . sinensis,从而有助于在生产中保持理想的雌雄比例,节省土地和提高豆荚产量。
结果
SSR位点的数量和分布g . sinensis
在5350359条男性和女性的序列中,有20655210条(38.6%)含有SSRs,表明SSRs高度富集;共461166个序列包含1个以上SSR, 582826个SSR包含复合形式。此外,3,627,691个支架由男性基因组组装g . sinensis.序列总长度为1,375,655,435 bp,含SSR的序列数为933,173个,频率为25.72%。此外,已识别的SSRs总数为1,409,677。在分布上,每976 bp有1个SSR。从女性基因组中共组装了3,713,022个支架,序列总长度为1,359,709,142 bp。含SSR的序列数为1,464,359个,频率为39.43%,共鉴定出2,573,292个SSR。在女性中g . sinensis基因组分布,每929 bp设置1个SSR位点。具体的SSR检索结果汇总在表中1.
SSR基序类型统计与分析
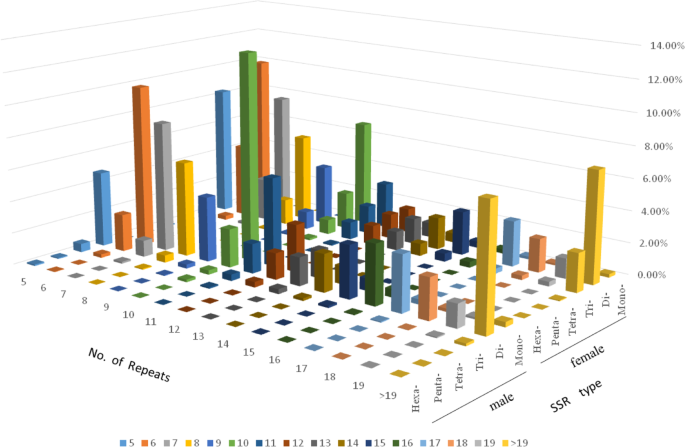
统计不同类型的SSR基序。具体结果见表2.在本表中,从单核苷酸重复ssr到6个核苷酸重复ssr的重复ssr分布在雌雄植株中。其中,双核苷酸重复基序数量最多,雄性为857,874个,占总数的60.86%,雌性为1,447603个,占总数的56.25%。单核苷酸和三核苷酸重复基序数量也较多,而四核苷酸到六核苷酸重复基序数量较少,五核苷酸重复基序最少。雌性植物中有2200个五核苷酸重复基序,占雌性植物SSR总数的0.09%。雄株共有1184个五核苷酸重复基序,占雄株SSR总数的0.08%。比较分析表明,雄性和雌性植物的基因组序列几乎完全不同(图2)。1).我们进一步根据每个SSR重复模块的序列组成进行细分。单核苷酸、二核苷酸和三核苷酸重复基序的结果汇总在表中3..在该表中,雄性和雌性植物中单核苷酸重复基序的主要重复基序是A/T。男性二核苷酸重复基序以AC/GT为主,女性为AG/CT为主,三核苷酸重复基序以AAG/CTT为主。
SSR聚类与多态性分析
SSRs的聚类结果汇总在表中4.从包含SSR的序列中筛选出侧翼长度大于20 bp的SSR序列1,309,516条,其中雄性312,951条,雌性516,961条。对特定SSR序列进行聚类,聚类结果显示在Table中5.
SSR多态性评价
在表6女性特异性SSR长度多态性主要集中在SSLP = 1位点,共142,676个,占总数的56.46%。SSLP = 2和SSLP = 3的含量也较高,分别占21.64%和10.26%。
BSA池PCR扩增结果
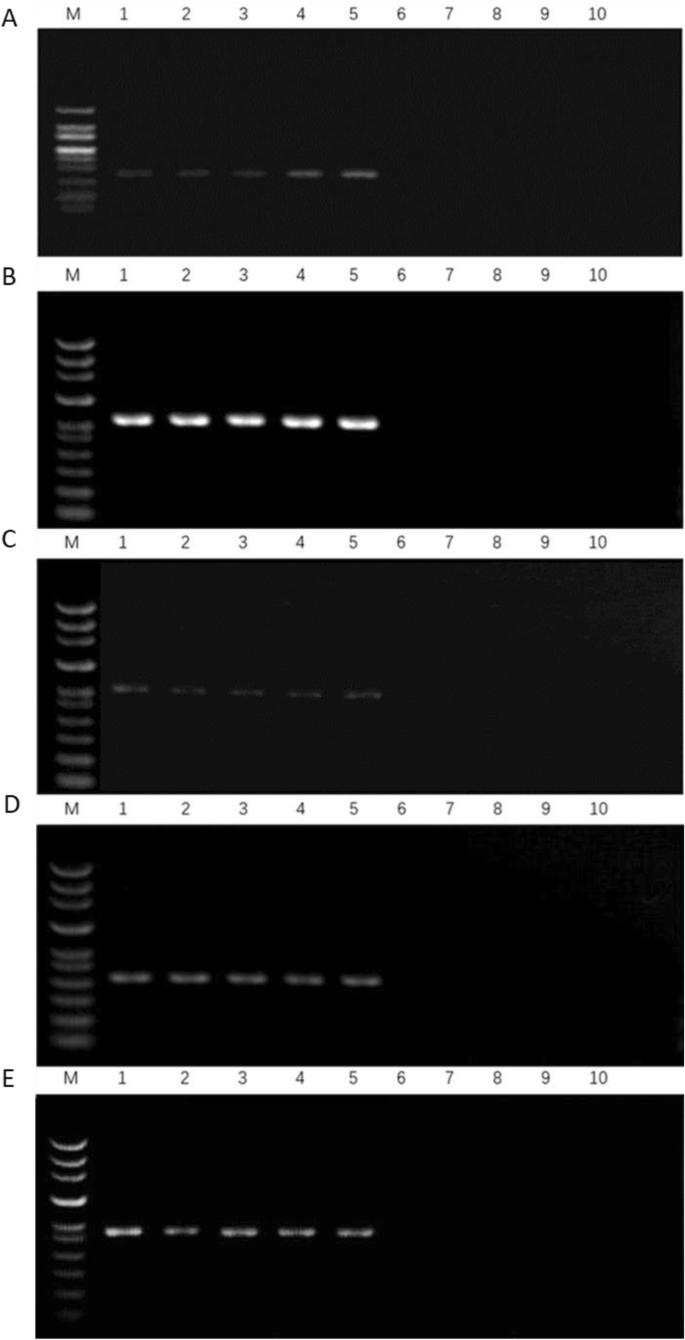
从检测到的引物中随机选取50对引物,分别从男性和女性基因库中扩增PCR基因。扩增产物经1%琼脂糖凝胶电泳检测。结果表明,50对引物中有5对(27、34、36、39和41)在雌性基因库中扩增了不同的条带,而在雄性基因库中没有扩增。引物的详细信息见表7.
已知性别植物的PCR鉴定
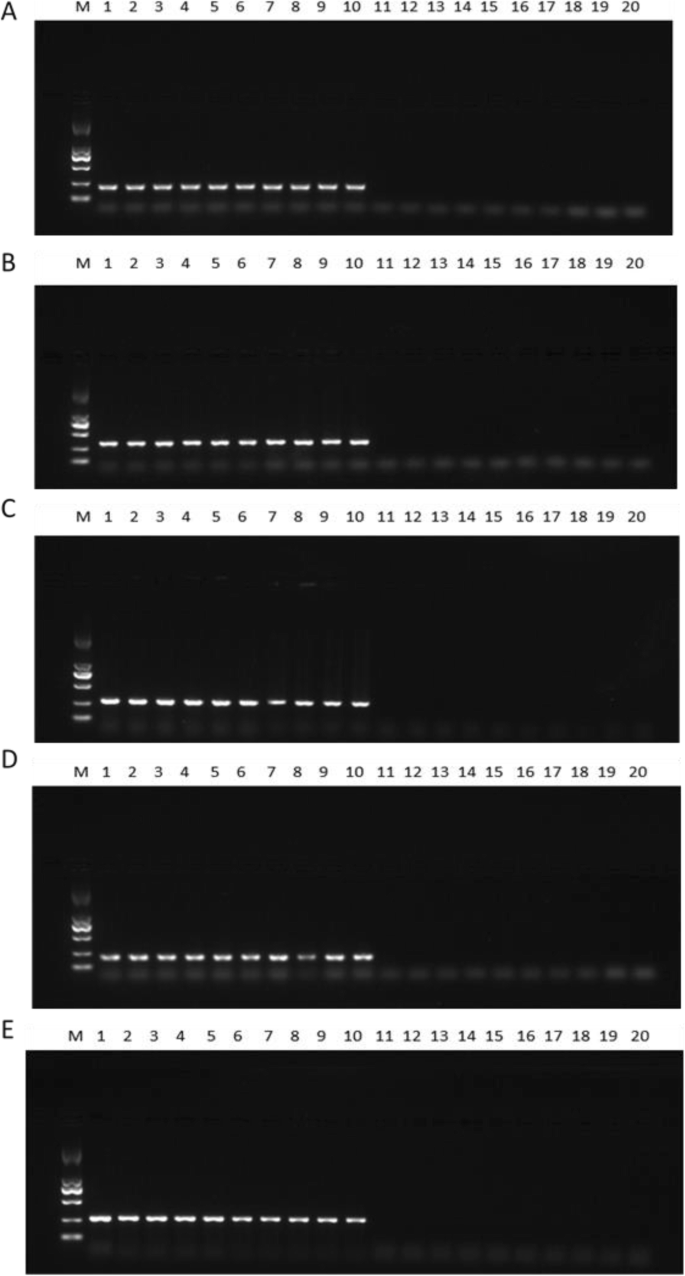
用5对筛选的引物在10株植物中进行PCR扩增,这些植物之前已经构建了基因库(图2)。2).同时,利用筛选的5对引物对新乡20株植物进行PCR扩增(图;3.).这种比较在性别识别方面显示了100%的准确性。雌性植株扩增了长度为186、305、266、150和260 bp的单个片段,没有雄性植株条带。
讨论
随着测序技术的迅速发展,大量植物基因组被测序并发表在公共数据库中,从而为在基因组水平上搜索SSR位点和大规模开发SSR标记提供了极好的机会。先前发表的大量报告证明了SSR标记是基于基因组测序数据的。例如,平均每1.14 kb确定一个SSR位点拟南芥基因组(13],在白菜基因组中平均每4 kb获得一个SSR位点[14].在本研究中,发现了2,065,210个SSR位点g . sinensis雄性平均每976 bp有1个SSR位点,雌性平均每929 bp有1个SSR位点。考虑到只有部分的基因序列g . sinensis,结果可能不能直接与上述其他植物的SSR数据进行比较。然而,研究结果表明SSR广泛分布于我国g . sinensis基因组。
在本研究中,大多数植物的SSR显性基序类型存在差异。其中以二核苷酸和三核苷酸重复基序为主。其中以二核苷酸重复单元为主芸苔属植物显著[15西瓜[16),茶树[17],而三核苷酸重复单元在小米的基因组中占主导地位[18]和柑橘[19].目前,SSR主要重复出现在g . sinensis二核苷酸重复序列在雄性植物和雌性植物SSRs中分别占56.25%和60.86%,其次是单核苷酸重复序列和三核苷酸重复序列。植物转录组SSR的研究g . sinensis的SSR重复元件g . sinensis在转录组中,该SSR重复元件主要基于二核苷酸重复[20.].这为确定该属的亲缘关系和系统发育进化提供了新的途径Gleditsia.因此,基因组和转录组g . sinensis以二核苷酸重复单元为主。中母题的主导地位g . sinensis可能是由于基序在翻译过程中被呈现为某些氨基酸,而存在于这些氨基酸中的蛋白质占了物种的很大比例[16].
近年来,对Gleditsia主要集中在引种栽培、繁殖技术、化学成分分析、抗逆性、种源检测等方面。分子标记的缺乏限制了植物的分子鉴定和遗传多样性Gleditsia并影响了种质资源保护策略的制定Gleditsia种质资源。随着分子生物学的发展,分子标记在各种植物研究中得到了广泛的研究。SSR分子标记的高多态性与相关生物学分析方法相结合,在药用植物遗传图谱构建、遗传多样性测定、品种鉴定、种子纯度检测、标记辅助育种等方面发挥着重要作用。林等人。[20.]构建了18个DNA指纹g . sinensis利用3个引物扩增的8个多态位点对种质资源进行鉴定,其结果为植物种质鉴定提供了理论依据g . sinensis培育新品种[21].然而,迄今为止,利用微卫星DNA序列标记进行植物早期性别鉴定的报道很少。DNA分子标记技术应用于雌雄异株植物性别鉴定,可以提高鉴定结果的准确性和可靠性,且不受发育时间和组织特异性的影响。雌雄异株植物的早期性别鉴定可以获得可靠的鉴定信息。另一项研究使用了微卫星(GATA)4探针仅在雄性木瓜植株中鉴定出一个5 kb的条带[22].此前的研究表明,微卫星标记可以用于鉴定雄性和雌性木瓜。SSR标记在植物早期性别鉴定中的准确率杨树davidiana是100% [23].我们的结果与与性染色体相关的SSR标记100%的准确性一致g . sinensis.目前,通过将表达序列标记(EST)与SSR标记相结合,解决了传统SSR标记开发成本高的缺点。EST在种间的发生率高于基因组SSR标记。此外,之前的一份报告指出了一个引物EST-Eu059与男性性别有关杜仲利用140对EST-SSR引物进行筛选,表明利用EST-SSR分子标记进行植物性别鉴定是可行的[24].
目前,关于雌雄异株植物的性别决定和分化机制知之甚少g . sinensis.性别表达调控机制的深入研究将为基因调控提供重要的见解g . sinensis对遗传研究和育种应用非常有用。特别是转录组测序策略已应用于检测不同性别类型的差异表达基因,如Salix suchowensis [25],芦笋officinalis[26],Diospyros柿子[27等等。我们目前正在利用该方法检测性别偏倚表达基因,进一步分析将有望为基因调控提供新的见解g . sinensis性表达。
结论
早期的形态特征Gleditsia植物是相似的,因此限制了这些植物的潜在用途。在本研究中,SSR标记(即27、34、36、39和41)与女性的性别有关g . sinensis植物已被筛出。这些SSR标记可用于雌性植物发育早期的性别鉴定,准确率和效率均为100%。同时,通过放大得到的波段显示出清晰的结果,高重复性和鲁棒稳定性。它提供了准确的雌雄植物性别识别策略,从而提高了植物的利用率g . sinensis资源。
材料与方法
植物材料
完整的和无虫的嫩叶g . sinensis采集自中国河南省博爱县小井镇保存森林(5男5女)进行性别标记,并在液氮中带入实验室。此外,在博爱地区和新乡地区分别选取了10份样品(男5份,女5份)和20份样品(男10份,女10份)进行植物材料验证和进一步研究。所有土地所有者都允许我们在他们的私人土地上取样。这些材料被鉴定为g . sinensis作者是中国河南师范大学的李教授。该材料保存于河南师范大学生物标本博物馆。
DNA提取
采用植物基因组DNA试剂盒(北京百特克生物技术有限公司)从黄芪幼叶中提取DNAg . sinensis根据套件说明书。以…为例g . sinensis在臼中加入液氮充分研磨成细粉,转移到离心管中,加入550 μi Buffer P1和4 μL RNase a,大力搅拌1 min,室温下静置10 min。加入130 μL Buffer P2,搅拌1分钟后,以12000转/分的速度离心3分钟。将上清液移液至分离柱A中,12000转/分离心1分钟,收集滤液。将滤液转移到新的离心管中,加入1.5体积的Buffer P3并混合均匀。将混合物加入吸附柱AC中,12000转/分离心1分钟,废渣倒入收集管中。加入500 μL漂洗液WB, 12000转/分离心1分钟,废液弃用。将吸附柱AC放回空的收集管中,13000转/分离心3 min,取出吸附柱AC,放入干净的离心管中,在吸附膜中间加入50 μL洗脱缓冲液,室温静置3 ~ 5 min, 12000转/分离心1 min,收集DNA。用纳米滴分光光度计定量纯化的DNA。
男女DNA库的建立:根据BSA原理[28],将来自博爱的5种雌性和雄性植物的等量DNA分别混合形成雌性和雄性体块。用超声法将两个DNA块分割。利用Illumina Nextera文库试剂盒回收400 bp片段用于文库建设。选择性杂交方法(珠粒富集程序)用于在基因组文库中富集SSR片段,如所述[29].8个探针,即P (AG)10, p (ac)10, p (aac)8, p (acg)8, p (aag)8, p (agg)8, P (ACATAT)6,用于SSR富集。利用Illumina MiSeq平台对扩增后的基因组文库末端250 bp (PE250)进行测序。原始读取按照要求进行过滤。
SSR搜索与统计
微型卫星识别工具[30.]从所有序列中寻找SSR位点。在搜索中使用的参数是mono-10, di-6, tri-5, tetraa -5, penta-5和hexa-5。复合序列中两个ssr之间允许的最大间隔为100bp。
SSR聚类分析
我们使用Perl程序对重复序列进行掩码,用字母r代替,去掉了侧翼序列小于20 bp的ssr序列,因为侧翼序列较短,不适合比对相似性。使用CDhit软件对剩余序列进行聚类。序列相似性为95%,覆盖率为70%,-gap 1-gep-ext空缺惩罚分数为0,进行聚类分析。其中,具有两个或多个ssr的序列可用于单独的统计聚类组。
鉴定性联ssr
利用CDhit软件对雄性和雌性植物含有ssr的序列进行独立聚类,鉴定出具有性别特异性的ssr。设置核苷酸序列的相似度为80%,覆盖率为70%,空缺惩罚评分为-gap 1-gep-ext 0。只在雌性植株中检测到的簇被认为是雌性特异性ssr,而只在雄性植株中检测到的簇被认为是雄性特异性ssr。
SSR多态性评价
利用Perl程序分析了聚类中重复序列的长度。如果一个聚类中重复序列的长度相同,则该聚类的多态性得分为1。如果集群中重复序列的长度不同,则该集群的多态性得分为2(如果有两个长度可用),3(如果涉及三个长度),以此类推。
SSR引物设计
引物3 v2.3.6设计引物[15]多态性得分≥2的SSR序列。PCR产物控制在100-400 bp,目标片段从重复序列的第一个碱基扩增到重复序列的后5个碱基。此外,其他参数为默认值。所有引物均按以下标准筛选:(1)引物设计排除单核苷酸和复杂重复基序。(2)每个SSR标记只包含一个SSR类型,以避免扩增时通过第二个SSR对多态性的影响。(3)设计的引物必须在一个簇内,且簇内ssr的长度多态性大于2。(4)每个设计的引物必须支持两个引物成簇。(5)去除相同引物结果。
PCR扩增和琼脂糖凝胶电泳
采用TAKARA公司的RR002A试剂盒进行PCR扩增,PCR扩增量为25 μL, DNA模板为1.0 μL (40 ng·μL)−1), 15.5 μL ddH2O、2.0 μL dNTP (0.00625 mM/μL)、1.0 μL正向引物(5 pmol)、1.0 μL反向引物(5 pmol)、2.5 μL 10 ×缓冲液、1.5 μL MgCl2 (2.5 mM/mL)、0.5 μL Taq DNA聚合酶(5 U/μL)。PCR程序如下:95°C变性5 min,然后在95°C、52°C和72°C重复30个周期30 s,最终在72°C延长7 min。PCR产物在1%琼脂糖凝胶上电泳分离。产物大小通过700 bp DNA阶梯的比较来估计。
数据和材料的可用性
数据集已上传到NCBI SRA数据库。SRA加入:PRJNA644493。SRA记录可透过以下连结查阅:
缩写
- 苏维埃社会主义共和国:
-
简单序列重复
- BSA:
-
散装隔离分析
- g . sinensis:
-
Gleditsia sinensis林。(豆科)
- 美国东部时间:
-
表达序列标签
参考文献
张建平,田晓辉,杨玉霞,刘庆霞,王强,陈丽萍,李海林,张卫东。皂荚属:民族医学、植物化学和药理学综述。中华药理学杂志2015;178:155-71。
李,王ZP、西安YX周霍奇金淋巴瘤,王X,刘W,金桥。皂荚类黄酮及其抗肿瘤活性。中国中药。2016;47(16):2812-6。
李娟,姜凯,王丽娟,尹刚,王娟,王勇,金一波,李强,王铁军。高效液相色谱-质谱联用(HPLC-MS /MS)测定Gleditsiae脊柱用于质量评估。中国生物医学工程学报,2018;41(8):1752-63。
李顺丰,苏涛,程国强,王伯祥,李霞,邓春林,高文杰。植物染色体进化与重复序列和表观遗传学的关系。基因。2017;8:290。
Samoluk SS, Chalup LMI, Chavarro C, Robledo G, Bertioli DJ, Jackson SA, Seijo G.异染色质进化落花生通过对重复DNA的全基因组分析进行调查。足底。2019;249:1405-15。
张忠才,侯晓林。SSR分子标记的开发策略。Hereditas。2004;26(5):763 - 8。
肖燕,夏伟,马杰,Mason AS,范华,石鹏,雷霞,马震,彭敏。棕榈属种间微卫星标记的全基因组鉴定与传递能力。前沿植物科学,2016;10(7):1578-88。
McCouch SR, Teytelman L, Xu Y, Lobos KB, Clare K, Walton M, Fu B, Maghirang R, Li Z, Xing Y, Zhang Q, Kono I, Yano M, Fjellstrom R, DeClerck G, Schneider D, Cartinhour S, Ware D, Stein L. 2240个水稻新SSR标记的开发与定位(栽培稻l .)。DNA, 2002;9(6): 199-207。
金基伦古,邓勇,蔡旭,马旺加,周泽,王旭,王勇,张泽,王凯,刘峰。种间杂交棉花D基因组二倍体的SSR遗传连锁图谱Gossypium davidsonii而且Gossypium klotzschianum.中华分子化学杂志,2018;19(1):204。
盖塔RT,皮雷JC,伊尼格斯-卢伊F,莱昂E,奥斯本TC。重新合成的基因组变化芸苔属植物显著以及它们对基因表达和表型的影响。植物学报。2007;19(11):3403-17。
肖光勇,吴伟林,谭文文,等。马来西亚榴莲品种的遗传变异和DNA指纹分析(SSR)中国科学院学报,2018;2(6):e4266。
韩松,吴震,王旭,等。从头组装和表征Gleditsia sinensis转录组和随后的基因鉴定和SSR挖掘。生物化学学报,2016;15(1):1 - 12。
张磊,张晓明,张晓明,等拟南芥thalianaand水稻基因组。基因组生物学,2006;7(2):14-24。
inigez - luy FL, Voort AV, Osborn TC。开发了一套基于快速循环基因组序列的SSR标记芸苔属植物oleraceal基因型。应用理论与实践。2008;17(6):977-85。
石娟,黄松,詹娟,余娟,王霞,华伟,刘松,刘刚,王慧。全基因组微卫星的鉴定及标记物的开发芸苔属植物作物物种。DNA, 2013;21(1): 53-68。
朱华,宋鹏,古德华,郭玲,李勇,孙松,翁勇,杨玲。西瓜基因组简单序列重复序列的全基因组特征及其在比较作图和遗传多样性分析中的应用。BMC基因组学杂志,2016;17(1):557。
刘s,等。茶树遗传研究中简单序列重复序列的全基因组鉴定及多态SSR标记的开发(茶树).Mol Breed. 2018;38:59。
潘dey G, Misra G, Kumari K, Gupta S, Parida SK, Chattopadhyay D, Prasad M.谷子全基因组微卫星标记的大规模基因分型[Setaria italica(l)]。DNA, 2013;20(2): 197-207。
林芳芳,邢建林,孟YQ,黄鹏,郑晓强。EST-SSR的开发和评估Gleditsia sinensis林。基于转录组序列。植物学报,2017;18(1):148-54。
张阿斯,罗勇,范dc,张振华。遗传多样性和指纹Gleditsia sinensis基于SCoT的种质资源分析。37 Guihaia。2017;(11):1378 - 85。
Parasnis AS,罗摩克里希纳W, Chowdari KV, Gupta VS, Ranjekar PK,罗摩克里希纳W微卫星(GATA)n揭示了木瓜的性别特异性差异。应用理论。1999;99(6):1047-52。
杨晓明,杨晓明,杨晓明,杨晓明。白杨的遗传连锁定位(杨树tremulal .,美洲山杨Michx)。植物基因组学报。2009;5(3):505-15。
林kq,李勇,赵德东。SSR的挖掘与标记的发展杜仲奥利弗转录组。植物学报。2016;14(6):1548-58。
林志,项超,刘宏伟,杨林,麦春春,余丽琴,魏玉玲,李海军,张海军,周勇。现代植物育种对中国小麦优势品种的影响(小麦通过SSR和功能标记揭示。中国农学通报,2018;65(1):55-65。
刘娟,尹涛,叶楠,陈勇,尹涛,刘敏,Hassani D.灌木柳树雌雄差异表达基因的转录组分析(柳树suchowensis).科学通报,2013;8:e60181。
李顺丰,张国军,张新军,袁建华,邓春林,高文军。比较转录组分析揭示与花园芦笋性别表达相关的差异表达基因(芦笋officinalis).BMC植物生物学,2017;17:143。
李松,孙鹏,杜刚,王玲,李宏,付军,索勇,韩伟,刁松,麦勇,李峰。柿子雌雄花蕾转录组测序及比较分析(Diospyros柿子研究)。科学学报,2019;246:987-97。
徐晓霞,孙晓玲,张勇,张乐林,方志勇,Friedt W.大白菜CMS 06J45雄性育性恢复基因AFLP和SSR标记的鉴定芸苔属植物拉伯l . ssp。学报).植物科学进展。2014;29(5):344 - 344。
Magoc T, Salzberg SL. FLASH:快速调整短读长以改善基因组组装。生物信息学。2011;27(21):2957 - 63。
Untergasser A, cutcutachi, Koressaar T, Ye J, Faircloth BC, Remm M, Rozen SG。Primer3——新的功能和接口。中国生物医学工程学报,2012;40(15):115。
致谢
在这篇论文即将结束之际,我想对所有在我写作过程中帮助过我的人表示衷心的感谢。
资金
本工作由中医药公共卫生服务补助专项“全国中医药资源普查工程”(财社[2017]66号)资助。资助机构在研究设计、数据收集、分析和解释以及撰写手稿方面没有任何作用。
作者信息
从属关系
贡献
LJJ设计了这项研究。YCL进行了实验。所有作者对数据进行了分析和讨论。YCL准备了数据,LJJ写了文章。所有作者阅读并批准最终稿。
相应的作者
道德声明
伦理批准并同意参与
不适用。
发表同意书
不适用。
相互竞争的利益
作者宣称他们之间没有利益冲突。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
李娟,叶昌。微卫星基因的全基因组分析与性别连锁标记的鉴定Gleditsia sinensis.BMC植物生物学20.338(2020)。https://doi.org/10.1186/s12870-020-02551-9
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12870-020-02551-9
关键字
- 苏维埃社会主义共和国
- Gleditsia sinensis林。
- 性识别