摘要
背景
盐度是世界农业面临的最严重威胁之一。甜菜是一种重要的产糖作物,它通过一种人们知之甚少的机制表现出对盐的耐受性。蛋白质组学数据可以提供重要的线索,有助于最终理解这一机制。
结果
在盐胁迫下甜菜叶片(70 DAPs)和根系(76 DAPs)中鉴定出差异丰度蛋白(DAPs)。预测了这些DAPs的功能,包括代谢与细胞、环境信息和遗传信息处理。我们假设这些过程协同工作以维持细胞内稳态。一些DAPs与耐盐性密切相关,如胆碱单加氧酶、甜菜碱醛脱氢酶、谷胱甘肽s -转移酶(GST)和f型H+运输腺苷三磷酸酶。10个DAPs编码基因的表达模式与iTRAQ数据一致。
结论
在甜菜适应盐胁迫的过程中,叶片和根通过不同的分子代谢调节机制来应对。本研究揭示了高等植物盐胁迫响应的分子机制,并鉴定出了一些与盐胁迫响应相关的候选蛋白。
背景
土壤盐分高是对植物最严重的非生物威胁之一,会降低作物产量和品质[1,2,3.].与其他植物非生物胁迫不同,盐度通过Na引起渗透胁迫和离子毒性+和Clˉ积累[4].后者可导致细胞膜紊乱、活性氧(ROS)的产生、代谢毒性、光合作用的抑制和养分获取的衰减[5,6].然而,一些耐盐品种,例如甜菜(普通贝塔。寻常的)能适应这些条件,并取得好收成。甜菜是最重要的制糖作物之一。作为一种新近驯化的作物,栽培甜菜从野生祖先那里继承了耐盐特性普通贝塔。maritima(b . maritima或“海甜菜”)[7].
蛋白质组分析比转录组分析更能直接洞察分子表型。相对定量和绝对定量等压标签[8,9,10]是蛋白质组量化最可靠的标记技术之一,以前曾用于分析盐胁迫诱导的甜菜蛋白质组变化。而Li等人仅分析了甜菜单体添加系M14膜蛋白的变化[11].在Yu等人。12]仅在短期盐胁迫(30 min和1 h)下诱导,且仅检测了M14叶片蛋白质组和磷蛋白质组的变化。最后,Wu等人研究了幼苗的蛋白质组变化,但只研究了幼苗和根的蛋白质组变化,并且在很长时间的暴露(50 mm NaCl 72小时)后[13].虽然这些研究是有用的,但我们注意到植物蛋白质组对盐胁迫的反应取决于盐胁迫的强度、持续时间和所检查的器官[14,15].特别地,盐治疗可以是渐进的(盐胁迫)或立即的(休克)[16].这些会引起不同的植物反应,并可能影响结果的解释[7].
本研究采用基于itraq的定量蛋白质组学分析方法,对NaCl胁迫下的甜菜品种“O68”的叶片和根中差异丰度蛋白(DAPs)进行了鉴定。在叶片和根中分别鉴定出70个和76个DAPs。利用基因本体论(GO)、京都基因和基因组百科全书(KEGG)、同源蛋白群(COG)和STRING对这些DAPs的功能进行预测。这些结果为研究胁迫反应的分子机制提供了新的思路,特别是提高了我们对甜菜盐胁迫反应的认识。
结果
盐度对甜菜生理指标的影响
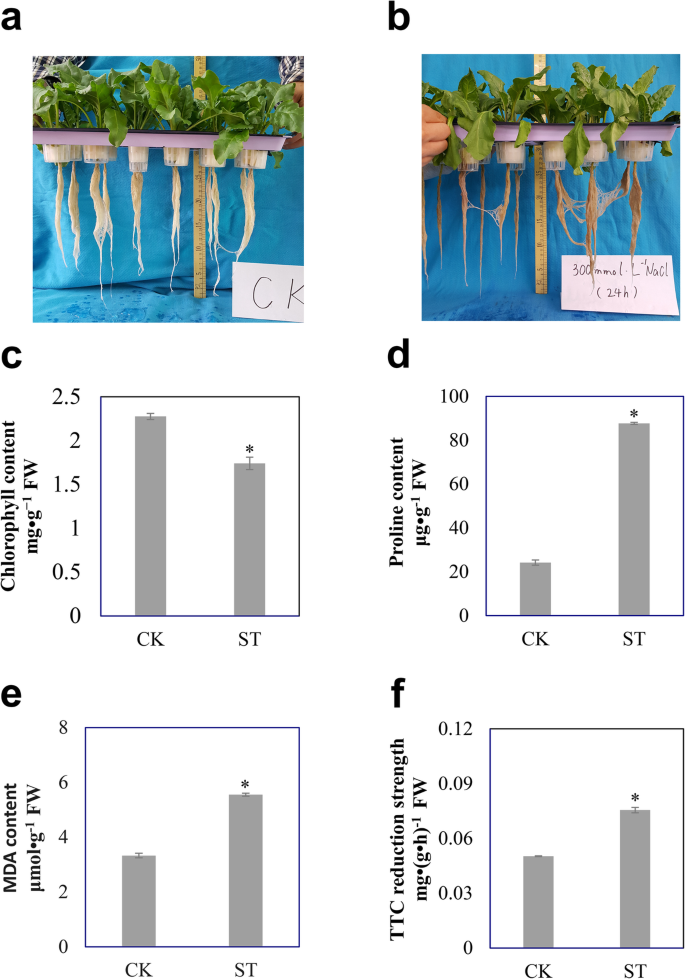
甜菜幼苗暴露在NaCl胁迫下,叶片和根的形态和生理都发生了变化,如叶片明显萎蔫,根系颜色变深(图2)。1a, b).与对照植物相比,叶片中叶绿素含量降低至76%(图。1c),但显示脯氨酸增加3.6倍(图;1d), MDA(丙二醛)含量增加1.6倍(图。1e).通过监测TTC(三苯四唑氯化物)测定根系活性;盐胁迫下的还原能力是对照植物的1.5倍(图2)。1f)。
iTRAQ的主要数据分析和蛋白质鉴定信息
从叶片和根中分别产生31438和39522个MS/MS计数。在叶片中,根据UniProt数据库鉴定出10121个独特的多肽和3175个蛋白质,其中1966个蛋白质(61.6%)至少有两个独特的多肽。在根中鉴定出13248个独特肽和3935个蛋白质,其中2541个(64.6%)蛋白质至少有两个独特肽。多肽的长度和数量分布如图S所示1.统计分析表明,大多数多肽含有8-15个氨基酸。蛋白质的肽数分布表明,90%的识别蛋白含有少于8个片段(图S2).在叶片和根中分别鉴定出60个和70个低分子量蛋白质(Mr < 10 kDa), 300个和417个高分子量蛋白质(Mr > 100 kDa)(图S3.).小于10%、10-30%和30-100%盖度在叶片中分别占57.6%、33.9%和8.4%(图S4a)和根的55.6、30.6%和13.8%(图S4b).蛋白质覆盖度分布显示,叶片中蛋白质覆盖度小于10、10 -30%和30 100%的分别占57.6%、33.9%和8.4%(图S .)4a),根为55.6,30.6%和13.8%(图S . a)4b)。
差异丰度蛋白(DAPS)的鉴定
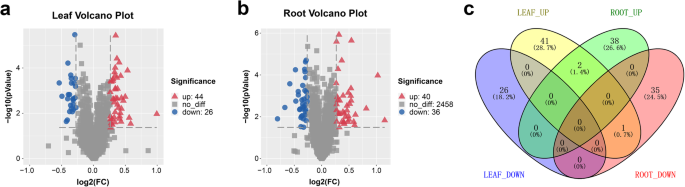
使用至少两种独特肽的蛋白质来筛选DAPs,使用折叠变化> 1.2和p值< 0.05。在叶片中鉴定出70个DAPs,其中44个上调,26个下调。2a).在根中鉴定出76个DAPS,其中40个上调,36个下调(图。2b).这些dap之间的重叠如图所示。2c.对于单个蛋白质来说,对盐胁迫的反应取决于它们的位置,是在叶中还是在根组织中。叶片和根中均有2个蛋白(1.4%)表达上调,1个蛋白(0.7%)表达相反。表S中显示了dap的详细描述1和S2.
iTRAQ鉴定的DAPS生物信息学分析
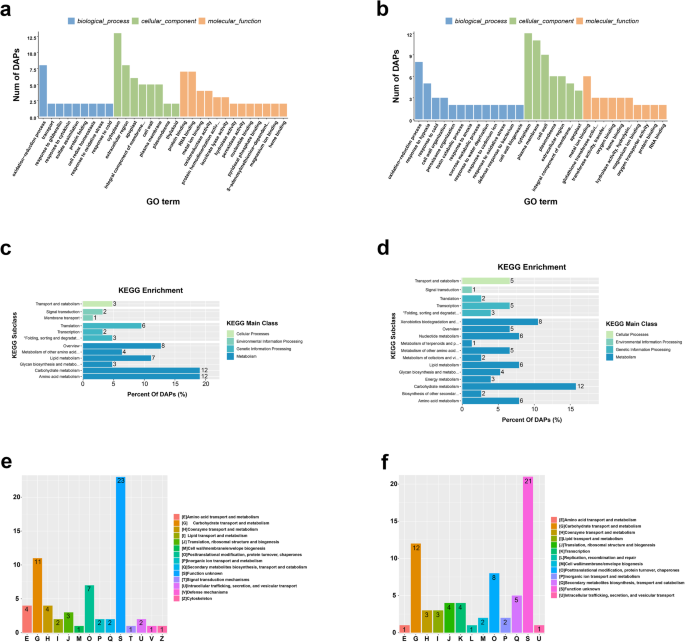
通过GO富集、KEGG通路富集和COG分析,研究了盐应力响应DAPs的假定功能(图2)。3.).GO富集分析表明,氧化还原过程(GO:0055114)是叶片和根系生物过程中富集最显著的阶段。此外,转运(GO:0006810)、对赤霉素的响应(GO:0009739)、对细胞分裂素的响应(GO:0009735)、硫酸盐同化(GO:0000103)和细胞氧化还原稳态(GO:0045454)在叶片中得到了增强(图5)。3.a).丰富了根系对缺氧反应(GO:0001666)、细胞壁组织(GO:0071555)、过氧化物酶体组织(GO:0007031)、毒素分解代谢过程(GO:0009407)、缺氧反应(GO:0034059)、蔗糖代谢过程(GO:0005985)、缺水反应(GO:0009414)和对细菌防御反应(GO:0042742)(图4)。3.b).叶和根在细胞质(GO:0005737)、质膜(GO:0005886)、细胞壁(GO:0005618)、胞外膜(GO:0009506)、胞外区(GO:0005576)、膜整体组分(GO:0016021)和外质体(GO:0048046)中富集程度相似,但类囊体(GO:0009579)仅在叶中富集。叶片中富集最多的分子功能类别是蛋白质结合(GO:0005515)和RNA结合(GO:0003723)。根中金属离子结合(GO:0046872)和谷胱甘肽转移酶活性(GO:0004364)。
利用KEGG方法,将叶片和根中的DAPs分为4类:细胞过程、环境信息处理、遗传信息处理和代谢。具体而言,70个叶片DAPS被进一步划分为12个亚类,并映射到43条通路(图。3.c),而根中的76个dap进一步划分为17个子类,映射到45个通路(图。3.d).一条与膜转运相关的通路(ko02010)在叶片中特别富集,根中富集的代谢相关通路更多。
在叶片和根中发现的70和76 DAPS分别被分为14和13个COG类。其中,在这两个地方最大的组是功能未知,碳水化合物运输和代谢,翻译后修饰,蛋白质周转和伴侣。然而,叶片中含有的DAPs分为防御机制和细胞骨架(图2)。3.e)而根中含有的DAPs被分类为转录(图。3.f)。
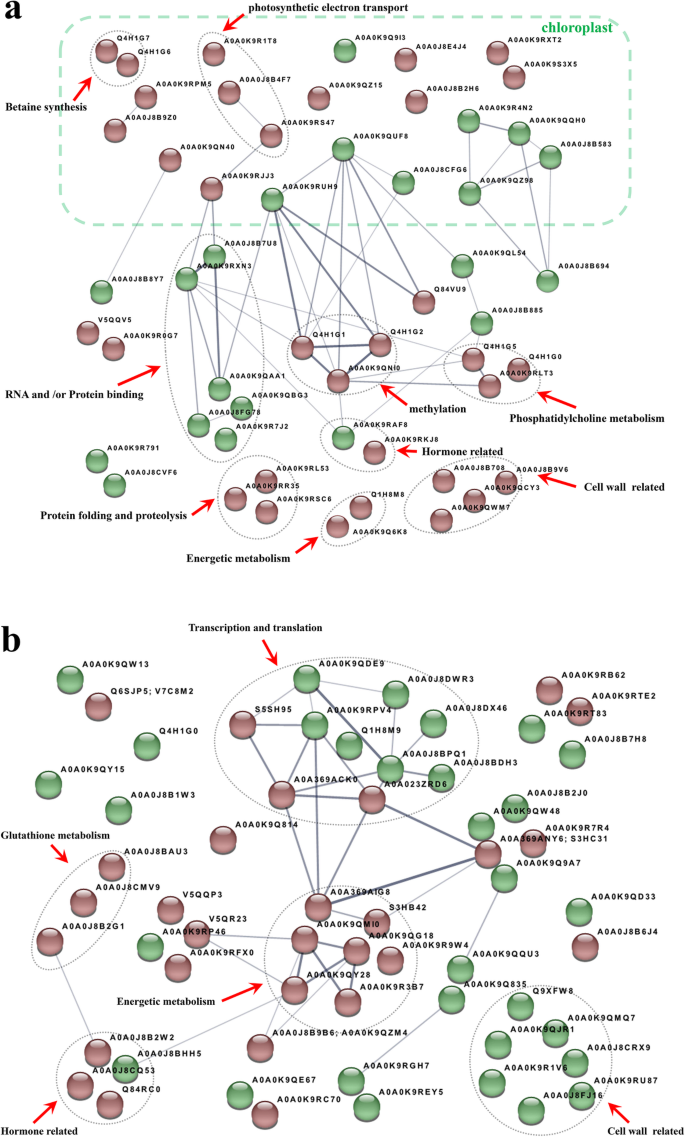
利用STRING蛋白质相互作用数据库分析蛋白质-蛋白质相互作用(PPI) [17],其中分别鉴定出31和26个相互作用蛋白(图2)。4).在这些DAPs中,有8条KEGG途径在叶片中显著富集,包括:氨基酸生物合成(bvg01230)、代谢途径(bvg01100)、半胱氨酸和蛋氨酸代谢(bvg00270)、次生代谢产物生物合成(bvg01110)、碳代谢(bvg01200)、甘油磷脂代谢(bvg00564)、硫代谢(bvg00920)和光合作用(bvg00195)。6条KEGG途径在根中显著富集,包括:糖酵解/糖异生(bvg00010)、代谢途径(bvg01100)、嘌呤代谢(bvg00230)、次生代谢产物生物合成(bvg01110)、RNA聚合酶(bvg03020)和嘧啶代谢(bvg00240)。
DAPS编码基因的转录分析
为了将DAPs的丰度与相应基因的转录水平相关联,我们选择了12个DAPs(叶片和根各6个,其中一个是两者共同的)进行qRT-PCR分析。12种DAPs中有10种在转录本和蛋白质水平之间有相同的表达趋势,而其他两种DAPs在转录本水平上没有明显变化(表2)1).这种差异可能是由于转录和翻译之间盐胁迫反应的时间差异。
讨论
盐胁迫对植物不同器官有不同的影响。本文中,我们在叶和根中分别鉴定了1966和2541个含有两种以上独特多肽的蛋白质。此外,在叶片和根中分别鉴定出70和76个DAPs,其中只有3个在叶片和根中均有差异表达。甜菜叶片和根系蛋白质的功能差异表明其对盐胁迫的响应不同,对抗逆性的贡献也不同。虽然我们知道由于iTRAQ的技术限制,这些结果可能不能代表盐胁迫适应下叶和根中蛋白质模式的全部情况,但下面将讨论一些关键DAPS及其相关代谢途径可能的生物学意义。
叶绿体DAPs对盐胁迫的响应分析
叶绿体只存在于叶片中,是植物对盐胁迫最敏感的细胞器[18].我们的研究表明,在高盐胁迫下,叶片中的叶绿素含量降低了0.76倍,这与高盐度破坏叶绿体并影响光合作用的事实一致[19].不出所料,在鉴定的叶片DAPs中,有22个与叶绿体有关,其中14个上调,8个下调。在盐胁迫下,光合电子传递链上的psbq样蛋白1 (A0A0K9RS47)、质体青苷(A0A0J8B4F7)和NAD(P)H醌氧化还原酶亚基U (A0A0K9R1T8)表达上调,这可能是维持光合作用的努力。此外,STRING网络分析显示,psbq样蛋白1与另一个上调蛋白肽基脯氨酸顺反异构酶fkbp16-4 (PPI) (A0A0K9RJJ)相互作用(图5)。4A),与之前的研究一致[20.].这表明植物对盐胁迫的反应是通过增加PPIs来加速蛋白质合成。另一个上调的蛋白是硫氧还蛋白Y1 (A0A0K9QN40),它调节光合酶的活性[21].此外,DNA修复rad52样蛋白(A0A0K9RXT2)和DNA损伤修复/耐受蛋白drt100样蛋白(A0A0K9S3X5)也是叶绿体中上调的蛋白。这些DAPs可能有助于保护叶绿体DNA免受盐胁迫的损伤,并增强耐盐性[22,23].
甜菜碱被认为是最好的渗透调节剂,它不仅参与细胞的渗透调节,而且还参与大分子的稳定。例如,它保护TCA(三羧酸)循环的主要酶和末端氧化酶,并稳定光系统的外围肽[24,25,26].在植物中,甜菜碱由胆碱通过两个氧化步骤生成,并由两种在盐胁迫下显著上调的酶催化:胆碱单加氧酶(Q4H1G6)和甜菜碱醛脱氢酶(Q4H1G7) [27,28,29].此外,在调节淀粉积累过程中,SEX4 (starch - excess 4,也称为Dual specificity protein phosphatase 4, DSP4) (A0A0J8B9Z0)在光诱导的氧化还原变化和蛋白质磷酸化之间起桥梁作用[30.].SEX4可能有助于促进暂时性淀粉分解为可溶性糖,从而调节植物细胞的渗透压。
另一种上调蛋白LS (6,7-dimethyl-8-ribityllumazine synthase) (A0A0J8E4J4)已被证明催化核黄素合成的倒数第二步,并调节细胞内的氧化还原反应。此外,LS在JA信号通路中发挥作用,参与植物防御反应[31].ABC转运蛋白B家族成员26 (A0A0K9QZ15)也被上调,这可能与特定的转运功能有关。THI1 (Thiamine thiazole synthase) (A0A0K9Q9I3)下调。该蛋白参与保护细胞脱落酸(ABA)信号转导和干旱反应拟南芥[32].最后,质体烯醇化酶1 (A0A0J8CFG6)下调,与以往报道一致[33,34].
耐盐胁迫DAPs分析
盐胁迫以渗透失衡、离子损伤和活性氧(ROS)形成等形式影响植物的正常发育。可溶性糖和脯氨酸,如甜菜碱,也是必不可少的渗透调节剂。在叶片中检测到的脯氨酸增加了3.6倍,尽管脯氨酸代谢相关酶(如P5CS)不会在叶或根中累积。我们在根系中发现了两种不同积累的蔗糖合成酶(Q6SJP5和V7C8M2)。蔗糖合成酶(suse synthase, SuSy)是一种广泛存在于植物中的糖基转移酶,它催化蔗糖的分解和合成。在非生物胁迫下SuSy的积累已在几种植物中被发现,特别是在根部[35,36,37].SuSy不仅参与植物的渗透调节,还在一个分支点上发挥作用,将蔗糖分配到细胞壁生物合成或糖酵解[38].由此可见,在甜菜中,胆碱单加氧酶和甜菜碱醛脱氢酶可能在叶片的渗透调节中起作用,而SuSy可能在根系的渗透调节中起重要作用。
NaCl对植物的毒性主要是由钠离子和氯离子以及ROS的产生引起的。在叶片中,观察到的MDA增加1.6倍反映了应激引起的氧化损伤。在植物中,过量摄取钠+会影响矿物质营养素的吸收,如钙2 +、镁2 +和K+[39].但是,甜菜是一种耐盐植物,可以利用钠+而不是K+用于渗透调节、气孔调节和阴离子的长距离运输[40,41,42].与高水平的氯化物可以抑制NO的吸收这一事实相一致3.−时,根系中高亲和性硝酸盐转运蛋白(A0A0J8B2J0)显著减少。ROS的增加和氧化爆发会影响光合作用、代谢和信号转导。然而,植物也有自己的解毒系统。首先,外源毒素或细胞毒素由细胞色素P450单加氧酶等酶代谢。其次,像GST这样的酶催化加工产品和糖(或谷胱甘肽)之间的偶联反应。第三,这些缀合物被ATP偶联转运蛋白识别,并被运输到液泡或分泌[43,44].2个CYP家族成员(A0A0K9RP46和A0A0K9RFX0), 3个GST家族成员(A0A0J8B2G1;A0A0J8CMV9;A0A0J8BAU3)和f型H+-转运atp酶(A0A369ANY6)差异表达。根系活性结果显示TTC减少能力增加了1.5倍,可能是由于GSTs的积累。因此,这些蛋白可能在根系抗盐胁迫解毒中发挥重要作用。
甜菜对盐胁迫的反应是分区化[45].总的来说,叶柄和老叶含盐量较高,而新叶含盐量较低,这保证了它们的正确功能[46].与根中不同,叶片中CYP和GST没有积累,但有两个过氧化物酶家族成员(A0A0K9R0G7和A0A0J8B8Y7)表达差异。在叶片中检测到查尔酮合成酶(CHS) (A0A0K9R791)和黄酮-3-羟化酶(F3H) (A0A0J8CVF6)。这些是类黄酮代谢中的关键酶,在非酶清除ROS中发挥重要作用[47,48],因此这些蛋白质可能参与解毒。这一发现可能是由于功能叶(第三对幼木)的取样。需要进一步的研究来确定新叶和老叶之间的差异。
植物也利用非共生血红蛋白(NsHb)的过表达作为一种策略,通过提高抗氧化酶系统的活性来减少氧化应激造成的损伤[49,50,51].非共生血红蛋白V5QQV5在叶片中表达上调,V5QQP3和V5QR23在根中表达上调。后者被上调了两倍以上,这表明它在抵抗盐胁迫中的作用被低估了。
与体外质体及细胞壁相关的DAPs分析
GO分析结果表明,在根和叶中,都有大量的DAPs与外质体和细胞壁相关。但根和叶的细胞壁DAPs对盐胁迫的响应不同。外质体是第一个遇到环境信号的植物隔室[52],而外质体蛋白参与对这些信号的反应,以及与质膜一起感知和转导信号[53,54].应激信号首先由细胞壁检测到,并将其传递到细胞中以调节细胞的活动[55,56].有趣的是,与外质体和细胞壁相关的DAPs在叶片中表达上调。其中,β-半乳糖苷酶(A0A0J8B708)、β- d -木糖苷酶5 (A0A0K9QCY3)、endo1,3;1,4-β- d -葡聚糖酶(A0A0J8B9V6)和木葡聚糖内转葡萄糖化酶/水解酶蛋白24样(A0A0K9QWM7)富集显著。在高等植物中,β-半乳糖苷酶是唯一能在内部裂解β-1,4-半乳糖并从细胞壁多糖中去除半乳糖残留物的酶[57].木聚糖是植物细胞壁中的主要多糖,β- d -木聚糖酶是一种o -糖基水解酶,可水解木聚糖中的糖基键[58].endo -1,3(4)-β- d -葡聚糖酶对纤维素微纤维具有特殊的消化作用,在调节植物细胞壁结构方面发挥重要作用[59].木葡聚糖内转葡萄糖酶/水解酶(XTHs)在木葡聚糖交联的形成中发挥重要作用[60].甜菜叶片中这些基因的上调表明了对盐胁迫的反应,从而维持了细胞壁的延展性。叶片细胞可能会增加体积以补偿叶绿素损伤,从而确保能量供应。
而下调以下DAPs则表明,甜菜根通过抑制细胞壁松弛来抵抗盐胁迫。α-木糖苷酶1 (A0A0K9RU87)、木葡聚糖内转移葡萄糖化酶/水解酶(A0A0J8CRX9和A0A0K9QMQ7)、β-半乳糖苷酶5 (A0A0K9R1V6)、膨胀素样A2 (A0A0K9QJR1)和富脯氨酸蛋白(PRP) 3 (A0A0J8FJ16)下调。膨胀素是一种细胞壁松弛蛋白,其积累是小麦品种耐盐的生化机制[61],而PRP是一种参与细胞壁构建和防御的结构蛋白。
代谢相关DAPs分析
与参与碳水化合物和能量代谢的DAPs不可或缺的事实一致,我们发现nadh -泛素还原酶复合体1 MLRQ亚基(Q1H8M8)和细胞色素c氧化酶亚基5C (A0A0K9Q6K8)在叶片中上调。在根中,发现2个EMP成分6-磷酸果糖激酶(A0A0K9R9W4)和甘油醛-3-磷酸脱氢酶(A0A0K9R3B7)、琥珀酰辅酶a连接酶、属于TCA的β亚基(S3HB42)、ADH (A0A0K9QY28)、PDC1 (A0A0K9QG18)和PDC2 (A0A0K9QMI0)、ATP合成酶α (A0A369AIG8)和β亚基(S3HC31)上调。PDC(丙酮酸脱羧酶)和ADH(酒精脱氢酶)可以将乳酸的生产转化为对植物毒性小得多的乙醇或中间乙醛。这些结果表明,甜菜通过提高能量代谢来适应盐胁迫。
磷脂酰胆碱(PC)不仅在细胞膜中具有结构作用,而且是信号分子的来源。丝氨酸脱羧酶(SDC: Q4H1G0)催化PC生物合成的第一步:丝氨酸转化为乙醇胺[62].胆碱/乙醇胺激酶(CEK: A0A0K9RLT3)催化胆碱代谢的初始反应步骤生成磷酸乙醇胺[63].磷酸乙醇胺n -甲基转移酶(PEAMTs: Q4H1G5)是一种催化磷酸乙醇胺生产胆碱的限速酶[64].在叶片中,SDC、CEK和PEAMTs的上调可能与细胞膜合成以及甜菜碱和磷脂酸(PA)的合成有关。不出所料,SDC (Q4H1G0)和GPI乙醇胺磷酸转移酶1亚型X2 (A0A0J8B1W3)在根中以及与木脂素产生有关的硬蛋白(A0A0K9QD33)中下调。这些结果与我们对细胞壁相关DAPs的分析一致,即在盐胁迫下,叶细胞努力增加体积,而根细胞则保持体积。
同样,叶片中参与蛋白质折叠和降解的DAPs也有所增加,如小管蛋白折叠辅因子D (A0A0K9RSC6)、天冬氨酸蛋白酶失联素-1 (A0A0K9RL53)和泛素羧基末端水解酶12样(A0A0K9RR35)。与此相反,折叠素亚基4亚型X1 (A0A0K9RGH7)、DnaJ蛋白同源物ANJ1(A0A0K9REY5)和碱性7S球蛋白2样(A0A0K9QE67)在根中表达下调。
参与转录和翻译过程的DAPs分析
植物需要不断地适应环境,其中一种机制是通过调节转录和翻译。在叶片中,我们观察到6种与RNA和/或蛋白质结合相关的DAPs下调,特别是富含甘氨酸的RNA结合蛋白2 (GR-RBP2) (A0A0J8FG78),它可以影响线粒体基因组编码的基因的表达,从而调节呼吸[65].GR-RBP在应激反应中起着显著作用[66,67].在根中,许多参与转录和翻译的DAPs被下调,如dna定向的RNA聚合酶II、IV和V亚基3 (A0A0K9RPV4), DEAD-box atp依赖的RNA解旋酶7 (A0A0J8BDH3)或H/ACA核糖核蛋白复合体亚基2样蛋白(A0A0J8BPQ1)。与叶片不同,50S核糖体蛋白L14 (A0A023ZRD6)和50S核糖体蛋白L22 (A0A369ACK0)均高于对照。由于这两个核糖体位于线粒体中,我们假设在盐胁迫下,甜菜的整体转录和翻译减少,而根细胞局部增强了线粒体相关蛋白的合成。这种特殊的调节可能有助于确保线粒体的正常功能以获得足够的能量。
DAPs与植物激素的关系分析
植物激素是受特定环境信号诱导的活性物质,在极低浓度下具有明显的生理效应。赤霉素调控蛋白(A0A0K9RKJ8)在叶片中积累。在根中,1-氨基环丙烷-1-羧酸氧化酶(ACO)参与乙烯生物合成途径,而长链酰基辅酶a合成酶(LACS)可激活茉莉酸(JA)的生物合成前体[68].ACO1 (A0A0J8B2W2)、lacs4 -like (A0A0K9RTE2)和生长素结合蛋白ABP19a (Q84RC0)表达上调,脱落酸受体PYL4 (A0A0J8BHH5)表达下调。叶片和根均表现出羧酯酶1(A0A0J8CQ53)的升高,该酶能将非活性水杨酸甲酯(MeSA)和茉莉酸甲酯(MeJA)脱甲基为活性水杨酸和茉莉酸。
结论
我们利用iTRAQ揭示了甜菜叶片和根系对盐胁迫的不同响应,分别鉴定出70和76个dap。叶和根在盐胁迫下表现出不同的应对策略。叶片在整体水平上表现出相对强劲的代谢,特别是在确保光合作用方面,以获得应对环境压力所必需的能量。叶片细胞的稳态可能主要归因于甜菜碱的积累和利用酶和非酶系统清除活性氧。根在整体水平上表现出相对较低的代谢活性。根中GST家族成员的积累可能有利于根的生存。本研究发现的DAPs功能的研究将有助于探索甜菜抗盐胁迫的机制。我们的分析加深了对甜菜不同器官响应盐胁迫的分子机制的理解,为今后提高甜菜的耐盐性奠定了基础。
方法
植物材料及处理
“O68”品种是传统杂交育种的优良亲本,具有较强的耐盐性,是研究甜菜盐胁迫响应机制的良好选择。用300 m mol·L处理−1在NaCl处理下,该品种的相对发芽率可达70%以上,幼苗可正常生长[69].此外,它具有很强的叶柄外植体再生能力,非常适合用于分子育种。种子来自我们自己的实验室(中国黑龙江),在水中浸泡10小时,用0.1% (v/v) HgCl消毒2用蒸馏水反复冲洗,在26℃的萌发箱中湿滤纸上萌发2天。发芽后,将出芽种子转移到塑料盆(45厘米× 20厘米× 14厘米,每盆12株)中,并注入四分之一浓度的Hoagland溶液。发芽种子在16/8光周期下,24°C(白天)/18°C(夜间)的phytotron (Friocell 707, Germany)中培养。自然界中盐浓度的增加通常是逐渐发生的。因此,为了使盐处理更接近《自然》中发现的盐处理,用半强度的Hoagland培养基处理四周大的植物(三对幼木),并添加增加浓度的NaCl(每12小时增加50 mM),直到最终浓度达到300 mM。在此之后,继续治疗24 h。以无nacl营养液为对照。收集代表第三对幼木的叶子和根,立即在液氮中冷冻,并保存在−80°C下,直到进一步使用。
生理指标检测
采用丙酮萃取法(0.1 g)、茚三酮比色法(0.5 g)、硫代巴比酸法(1 g)测定第三对幼木新鲜叶片不同样品质量的叶绿素含量[70].采集新鲜根(0.5 g),用TTC还原法测定根系活性[70].数据由UV-2100PC紫外可见分光光度计(UNICO。LTD),每个处理重复3次。
蛋白质提取,蛋白质消化和iTRAQ标记
ITRAQ分析在LC Sciences(杭州,中国)进行。每10株植物的叶或根组织被汇集成一个生物复制。进行3个生物重复,进行基于itraq的比较蛋白质组学分析。从每个样品中提取叶和根的总蛋白质,如所述[71].蛋白质浓度用BioDrop μLite微检测器(BioDrop,英国)测定,蛋白质质量用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)测定。每个样品100 μg蛋白质在37℃下用20 mM二硫苏糖醇(DTT)还原60 min,在室温下用40 mM(终浓度)碘乙酰胺烷基化30 min,用于消化。用质量比蛋白:胰蛋白酶为100:1的Sequencing Grade Modified Trypsin在37°C下消化12小时,然后再次消化4小时。在胰蛋白酶消化后,肽在Waters sep-Pak C18色谱柱(Waters Inc.,美国)中脱盐并真空干燥。肽在40 μl 100 mM TEAB中重组,并根据制造商的8-plex iTRAQ试剂盒(AB sciex Inc., US)处理方案进行处理。用iTRAQ试剂114、115和116标记来自CK重复(叶和根)的多肽,用iTRAQ试剂117、118和121标记来自盐胁迫重复(叶和根)的多肽。经Waters sep-Pak C18柱脱盐,真空干燥。
Nano-LC-ESI-MS / MS分析
用52 μl 10 mM甲酸铵溶液溶解肽粉,pH为10,在Waters E2695液相色谱系统中使用BEH C18色谱柱(5 μm, 4.6*250 mM, Waters Inc)分离。多肽在每个叶片样品中组合成17个组分,在每个根样品中组合成18个组分,并进行冷冻干燥。每个组分用5 μl 0.1%甲酸(FA)重新溶解,并通过easy - lc 1000耦合Q Exactive (Thermo Scientific, US)质谱仪的NanoLC-MS/MS系统进行分析。在2.0 kV电喷雾电压下,通过ESI源喷射洗脱液,在Q Exactive中进行串联质谱(MS/MS)分析。MS扫描光谱范围为350 ~ 1800 m/z,在Orbitrap中获得,分辨率为70,000。自动选择dd-MS2扫描光谱,dd-MS2分辨率为17500。
蛋白质鉴定与定量
使用MaxQuant (version 1.5.5.1)进行iTRAQ蛋白鉴定和定量[72,73].用于蛋白质鉴定b .寻常的采用UniProt蛋白数据库,以误发现率(FDR) < 0.01为标准。库搜索参数如下:固定修饰包括半胱氨酸残基上的氨基甲基、iTRAQ 8 plex (n项)和iTRAQ 8 plex (K项);将蛋氨酸的氧化修饰设定为可变修饰。肽段质量公差为±10 ppm,片段质量公差为0.2 Da。
生物信息学分析
利用GO和KEGG数据库分析蛋白质的生物学和功能特性[74,75].采用超几何检验发现DAPs的GO项和KEGG通路显著富集。如果p-value < 0.05,则认为GO项或KEEG通路显著富集DAPs。聚类同源蛋白系统(Clusters of Orthologous Groups of Proteins System)也用于DAPs的功能分类。
RNA提取和qRT-PCR
用MiniBEST Plant RNA Extraction Kit (TaKaRa, Japan)从叶片和根中提取总RNA。用高容量cDNA逆转录试剂盒(High-Capacity cDNA Reverse Transcription Kits)在20 μl的反应量中逆转录约2 μg总RNA (ThermoFisher Scientific, US)。反应在25°C下孵育10分钟,然后在37°C下孵育120分钟,在85°C下孵育5分钟。所有引物列在表S中3..PP2A+UBQ5而且PP2A+25岁的年代分别作为叶和根的内源对照。qRT-PCR采用Primer-BLAST在线设计基因特异性引物[76].qRT-PCR反应使用iTaq Universal SYBR®Green Supermix (BIO-RAD, Hercules, CA)在CFX Real-time PCR系统(BIO-RAD, CA)上进行。通过对每个PCR产物进行熔解曲线来防止非特异性扩增。计算不同样本中miRNAs的表达水平,参照比较2−△△CT方法。
数据处理和统计分析
生理参数和qPCR分析数据分别计算各处理3个重复的平均值和SD值,用Duncan 's multiple range test (p< 0.05),独立样本t检验(p <0.05)。
数据和材料的可用性
本研究中所使用的材料将免费提供给通讯作者:cuijie2006@163.com.质谱蛋白质组学数据已通过iProX合作伙伴存储库保存到ProteomeXchange Consortium [77]使用数据集标识符PXD017954 (https://www.iprox.org/page/project.html?id=IPX0002058000).
缩写
- b .寻常的:
-
普通贝塔。寻常的
- iTRAQ:
-
等压标签相对和绝对量化
- 衣冠楚楚的:
-
不同丰度蛋白质种类
- 走:
-
基因本体论
- KEGG:
-
京都基因与基因组百科全书
- 齿轮:
-
蛋白质的同源基团簇
- MDA:
-
丙二醛
- TTC):
-
氯化三苯基四氮唑
- 罗斯福:
-
错误发现率
- 存在:
-
定量rt - pcr
参考文献
- 1.
在受盐影响的土壤中影响作物生产的土壤过程。植物学报。2010;37(7):613-20。
- 2.
Munns R, Gilliham M.作物耐盐性的代价是什么?植物学报。2015;208(3):668-73。
- 3.
测试员M, Davenport R. Na+耐受性和钠+高等植物的运输。学报学报。2003;91(5):503-27。
- 4.
M.耐盐机理。植物科学进展。2008;39(1):651-81。
- 5.
盐渍土壤中限制植物生长的生理过程:一些教条和假设。植物细胞环境。1993;16(1):15-24。
- 6.
Garthwaite AJ。Bothmer Rv, Colmer TD:野生耐盐性大麦种与Na的限制进入有关+和cl−进入嫩芽。中国机械工程学报,2005;26(4):344 - 344。
- 7.
Skorupa M, gozynbiewski M, Kurnik K, niedojadso J, kludsy J, Klamkowski K, Wójcik K, Treder W, Tretyn A, Tyburski J.盐胁迫与盐休克-以甜菜及其盐生植物祖先为例。BMC植物生物学2019;19:57。
- 8.
龙瑞,高原,孙辉,张涛,李旭,李明,孙勇,康杰,王忠,丁伟,等。利用iTRAQ定量蛋白质组学分析鉴定了两种种子萌发阶段的盐反应蛋白Medicago物种。科学通报2018;8(1):9553。
- 9.
Wiese S, Reidegeld KA, Meyer HE, Warscheid B.蛋白质标记iTRAQ:蛋白质组学研究中的定量质谱新工具。蛋白质组学,2007;7(3):340 - 50。
- 10.
刘j y。门建林,常明春,冯春萍,袁立刚:基于itraq的蛋白质定量组学揭示了小鼠的代谢变化菇中孢子菌丝对冷胁迫的反应。中国生物医学工程学报,2017;
- 11.
李红,潘颖,张颖,吴超,马超,于波,朱宁,高杰,陈松。甜菜单体添加系M14膜蛋白质组的盐胁迫响应。中国生物医学工程学报。2015;
- 12.
于波,李娟,高杰,Dufresne C,杨楠,齐松,张勇,马超,杜伯伟,陈松,等。甜菜单体添加系M14对盐胁迫的定量蛋白质组学和磷蛋白质组学研究。中国生物医学工程学报,2016;
- 13.
吴国强,王建林,冯荣军,李世杰,王春梅。基于itraq的比较蛋白质组学分析揭示了甜菜耐盐的分子机制(甜菜属l .)。中国生物化学杂志,2018;
- 14.
季伟,丛瑞,李松,李锐,秦忠,李勇,周霞,陈松,李娟。大豆叶片和根系蛋白质组学的iTRAQ分析为研究短期盐胁迫响应机制提供了依据。前沿植物科学,2016;7:573。
- 15.
王艳,丛艳,王艳,郭忠,岳健,邢忠,高旭,柴霞杜氏采用等压标签进行相对和绝对定量(iTRAQ)的蛋白质组学定量分析。中国生物化学杂志2019;20:599。
- 16.
盐应激或盐休克:我们研究的是哪些基因?中国科学(d辑:自然科学),2013;
- 17.
Cv M, Jensen LJ。Snel B, Hooper SD, Krupp M, Foglierini M, Jouffre N, Huynen MA, Bork P: STRING:已知和预测的蛋白质-蛋白质关联,在生物体中整合和转移。核酸研究,2005;33:D433-7。
- 18.
索娟,赵强,陈松,戴松。叶绿体盐度响应的基因表征。国际分子化学杂志,2017;18(5):1011。
- 19.
Yamane K, Oi T, Enomoto S, Nakao T, Arai S, Miyake H, Taniguchi M.盐度胁迫下叶绿体口袋的三维超微结构。植物细胞环境学报,2018;41(3):563-75。
- 20.
尹德华,李世寿,朴海杰,吕骥,钟伟,刘小仁,金伯国,安锦昌,赵宏。过度的OsCYP19-4提高水稻对冷胁迫的耐受性及提高产量(栽培稻).中国生物医学工程学报,2016;36(1):344 - 344。
- 21.
Pasternak C, Haberzettl K, Klug G.硫氧还蛋白参与了球形红杆菌光合装置的氧调节形成。中华微生物学杂志,1999;18(1):100-6。
- 22.
Samach A, Melamed-Bessudo C, Avivi-Ragolski N, Pietrokovski S, Levya AA。植物识别RAD52的同系词和特征拟南芥RAD52例如基因。植物学报。2011;23(12):4266-79。
- 23.
藤森N,铃木N,中岛Y,铃木S.植物DNA损伤修复/耐受100蛋白修复uv - b诱导的DNA损伤。DNA修复。2014;21:171-6。
- 24.
马提诺CD,德芬S, Pizzuto R, Loreto F, Fuggi A.菠菜叶片渗透调节中游离氨基酸和甘氨酸甜菜碱的响应。生态学报,2003;29(3):344 - 344。
- 25.
Holmström KO, Somersalo S, Mandal A, Palva TE, Welin B.生产甘氨酸甜菜碱的转基因烟草提高了对盐度和低温的耐受性。中国机械工程学报,2000;26(3):344 - 344。
- 26.
瑞欧N,鲁杜利尔DL。渗透调节的AzuspirilZum bradense:在盐胁迫下,甜菜碱转运促进生长和固氮。中华微生物学杂志,1990;
- 27.
McCue KF, Hanson AD。耐旱耐盐:向认识和应用迈进。生物技术。1990;8(12):358-62。
- 28.
李志强,李志强,李志强。盐丛中甜菜碱的生物合成研究(滨藜属spp.)在盐度胁迫下。Biologia。2013;68(5):879 - 95。
- 29.
杨晓明,王晓明,王晓明,等。甜菜碱生物合成酶在大麦叶片中的组织定位。植物学报,2013;16(2):117-22。
- 30.
Sokolov LN, Dominguez-Solis JR, Allary A- l, Buchanan BB, Luan S.氧化还原调节的叶绿体蛋白磷酸酶与淀粉每日结合并在其积累中发挥作用。《美国国家科学院学报》上。103(25): 9732 - 2006; 7。
- 31.
肖松,戴琳,刘峰,王铮,彭伟,奚东。拟南芥COS1的研究进展coronatine insensitive1调控茉莉酸介导的植物防御和衰老所必需的抑制因子。植物学报。2004;16(5):1132-42。
- 32.
李春林,王敏,吴晓明,陈德华,吕海杰,沈建林,乔忠,张伟,THI1是一种硫胺素噻唑合酶,与Ca相互作用2 +蛋白激酶CPK33在拟南芥中调控s型阴离子通道和气孔关闭。植物物理学报。2016;170:1090-104。
- 33.
闫松,唐志,苏伟,孙伟。水稻根系盐胁迫响应蛋白的蛋白质组学分析。蛋白质组学。2005;5(1):235 - 44。
- 34.
姜艳,杨波,李志强,李志强。盐胁迫响应蛋白的比较蛋白质组学分析拟南芥的根源。中国机械工程学报,2007;26(3):357 - 357。
- 35.
冷驯化和反驯化对大白菜幼苗蔗糖合酶和蔗糖磷酸合酶有调控作用,但不影响酸性转化酶。中国植物科学,2001;29(4):344 - 344。
- 36.
Sharif I, Aleem S, Farooq J, Rizwan M, Younas A, Sarwar G, Chohan SM。棉花盐胁迫的影响、耐盐机理及防治对策。植物学报,2019;25(4):807-20。
- 37.
燕L,东风J罗伯特•T Jine C,天宝L, Jing H,杰L,燕Z, Cankui Z,志强L .桑树的生理和蛋白质反应(桑属阿尔巴。l)对盐旱复合胁迫的影响。中华分子生物学杂志,2019;20(10):2486。
- 38.
Albrecht G, Mustroph A.蔗糖合酶在小麦根系中的定位:蔗糖合酶原位活性的增加与缺氧下纤维素沉积引起的细胞壁增厚有关。足底。2003;217(2):252 - 60。
- 39.
杨晓明,杨晓明,杨晓明,等。植物耐盐性研究进展。环境科学学报,2005;30(3):324-49。
- 40.
苏巴拉奥GV,惠勒RM,斯图尔特GW,莱文LH。红甜菜中的钠能在多大程度上替代钾?植物营养学报,1999;22(11):1745-61。
- 41.
苏巴拉奥GV,惠勒RM,斯图尔特GW,莱文LH。在中等生理盐水条件下,低钾提高了红甜菜对钠的吸收。植物学报,2000;23(10):1449-70。
- 42.
皮Z, Stevanato P,孙芳,杨勇,孙霞,赵红,耿刚,于磊。甜菜缺钾和钠代钾诱导的蛋白质组学变化。中国植物学报,2016;29(3):344 - 344。
- 43.
索诺M,罗奇MP,科尔特ED,道森JH。Heme-containing加氧酶。化学通报1996;96(7):2841-87。
- 44.
Rea PA,李志生,陆永平,Drozdowicz YM, Martinoia E.从液泡GS-X泵到多特异性ABC转运体。植物物理学报,1998;49:727-60。
- 45.
沙赫扎德M,维策尔K, Zörb C, Mühling KH。玉米叶片亚细胞离子模式的生长相关变化(玉米l)在盐胁迫下。中国农业科学,2012;29(1):46-56。
- 46.
张志刚,张志刚。盐渍条件下甜菜植株的调节、生长、光合作用和蒸腾作用。作物学报,1985;10(1):1 - 13。
- 47.
水稻类黄酮通路基因;OsDfr而且乌山它们是由脱水、高盐和ABA诱导的,含有与转录激活子OsC1-MYB相互作用的应激响应启动子元件。植物科学进展(英文版);2004;26(3):344 - 344。
- 48.
哦M-M, Trick HN, Rajashekar CB。次生代谢和抗氧化剂参与了生菜的环境适应和胁迫耐受性。中国植物学报。2009;26(2):344 - 344。
- 49.
赵玲,顾睿,高鹏,王刚,玉米非共生血红蛋白基因,ZmHb,参与对淹没、高盐和渗透胁迫的响应。《植物细胞与组织》杂志,2008;29(2):366 - 366。
- 50.
Cantrel C, Vazquez T, Puyaubert J, Reze N, Lesch M, Kaiser WM, Dutilleul C, Guillas I, Zachowski A, Baudouin E.一氧化氮参与低温反应性磷脂脂的形成和基因表达拟南芥.植物学报。2011;39(2):415-27。
- 51.
Garrocho-Villegas V, Gopalasubramaniam SK, Arredondo-Peter R.植物血红蛋白:发现60年后我们所知道的。基因。2007;398(2):78 - 85。
- 52.
Hoson T. Apoplast作为对环境信号的响应部位。植物科学进展,1998;26(1):1 - 7。
- 53.
高DJ, Knight MR, Trewavas AJ, satelmacher B, Plieth C.自报告表达pH和Ca2+指标的拟南芥揭示了非生物胁迫下细胞质和外质体中的离子动态。植物科学进展。2004;34(3):898-908。
- 54.
霍斯特WJ。APOPLAST在高等植物铝毒性和铝抗性中的作用综述。中国农业科学,2004,26(5):529 - 529。
- 55.
朱俊,Alvarez S, Marsh EL, lenobble ME, Cho I-J, Sivaguru M, Chen S, Nguyen HT, Wu Y, Schachtman DP,等。玉米初生根伸长区细胞壁蛋白质组。2水分亏缺下水溶性和轻离子结合蛋白的区域特异性变化。植物科学进展。2007;32(4):344 - 344。
- 56.
孔凤杰,小松松。水淹胁迫下小麦根系细胞壁蛋白质组学研究。生物化学与生物物理学报。2010;1804(1):124-36。
- 57.
王晓明,王志强,王志强,等。半乳糖苷酶基因的反义抑制(TBG6)会使番茄开裂。中国机械工程学报,2003;29(3):344 - 344。
- 58.
李国强,李国强。糖基水解酶的结构与机理研究。结构。1995;3(9):853 - 9。
- 59.
周海林,何世杰,曹永荣,陈涛,杜伯祥,褚长春,张建生,陈世勇。OsGLU1可能是一种来自水稻的膜结合内-1,4- β - d -葡聚糖酶,它影响植物节间伸长。植物分子生物学杂志,2006;30(1):319 - 319。
- 60.
傅mm。刘超,吴芳:大麦木葡聚糖内转糖酶/水解酶基因家族的全基因组鉴定、鉴定及表达分析(大麦芽).分子。2019;24:1935。
- 61.
李芳,韩艳艳,王伟:扩张素参与干旱胁迫下脱落酸和吲哚-3-乙酸介导的小麦细胞生长。植物细胞学报,2012;31(4):671-85。
- 62.
杨春华,李志强,李志强,李志强。拟南芥丝氨酸脱羧酶1 (SDC1)在磷脂和氨基酸代谢中的作用。中国植物科学,2018;9:972。
- 63.
Lin Y-C, Kanehara K, Nakamura Y.拟南芥胆碱/乙醇胺激酶1 (CEK1)是一种主要的胆碱激酶,定位于内质网(ER),参与内质网应激耐受。植物学报。2019;223(4):1904-17。
- 64.
陈伟,陈志伟,陈志伟,陈志伟。磷酸乙醇胺损失的研究N-甲基转移酶取消磷脂酰胆碱的合成,是致命的。中国生物医学工程学报,2019;29(1):344 - 344。
- 65.
Vermel M, Guermann B, Delage L. Grienenberger J-M, charles - drouard LM, Gualberto†JM:植物线粒体特异的rm型rna结合蛋白家族。中国科学:自然科学(英文版),2002;29(3):379 - 379。
- 66.
金志勇,朴世杰,张波,郑昌华,安世杰,高昌华,赵凯,韩欧,姜华。一种富含甘氨酸的rna结合蛋白的功能表征拟南芥在非生物胁迫条件下。植物学报,2007;26(3):339 - 344。
- 67.
金俊杰,郑海杰,李海杰,金佳,高昌华,吴勇,吴珊珊,韩玉生,姜辉。拟南芥富含甘氨酸的rna结合蛋白7通过调控气孔启闭影响非生物胁迫响应。植物学报,2008;36(3):455 - 466。
- 68.
施耐德K, Kienow L, Schmelzer E, Colby T, Bartsch M, Miersch O, Wasternack C, Kombrink E, Stuible惠普。一种新型过氧化物酶体酰基辅酶拟南芥具有催化活化茉莉酸生物合成前体的能力。中国生物医学工程学报,2005;29(4):529 - 529。
- 69.
石松,崔娟,卢震,程东,罗成。甜菜种质耐盐性的筛选。中国甜菜糖。2008;4:7-9。
- 70.
植物生理学实验指南:高等教育出版社;2006.
- 71.
张刚,张娟,文霞,赵超,张宏,李霞,尹松Pelteobagrus vachelli急性缺氧下的肝脏:代谢反应的意义。蛋白质组学。2017;17。
- 72.
Cox J, Mann M. MaxQuant能够实现高肽识别率,个性化p.p.b.范围的质量精度和蛋白质组范围的蛋白质定量。生物技术学报。2008;26(12):1367-72。
- 73.
Cox J, Neuhauser N, Michalski A, Scheltema RA, Olsen JV, Mann M. Andromeda:集成到MaxQuant环境中的肽搜索引擎。中国生物工程学报(自然科学版),2011;
- 74.
Ashburner M, Ball CA, Blake JA, Botstein D, Butler H, Cherry JM, Davis AP, Dolinski K, Dwight SS, Eppig JT,等。基因本体论:生物学统一的工具。基因本体联盟。中国科学,2000;25(1):25 - 9。
- 75.
金久M,荒木M,后藤S,服部M,平川M,伊藤M,片山T,川岛S,奥田S,德松T,等。将基因组与生命和环境联系起来。核酸研究,2007,36(数据库):D480-4。
- 76.
叶j, Coulouris G, Zaretskaya I, Cutcutache I, Rozen S, Madden TL. Primer-BLAST:一种设计聚合酶链反应靶特异性引物的工具。BMC生物信息学。2012;13:134。
- 77.
马俊,陈涛,吴松,杨超,白梅,舒凯,李凯,张刚,金志,何峰,等。iProX:一种集成蛋白质组资源。核酸学报2019;47(D1): D1211-7。
确认
感谢甜菜功能基因探索与利用实验室的参与。
资金
本研究由国家自然科学基金(31571731)资助,进行研究设计和大部分实验。国家自然科学基金(31771864)资助我们进行数据分析和稿件写作。国家现代农业产业技术体系项目(car -21- 04b -01)资助我们培育实验材料。
作者信息
从属关系
贡献
李建林、崔杰和程元元构思了本研究,并设计和监督了实验。JL Li和CF Luo进行了实验。Li JL, Liu TJ和Wang CY对数据进行了分析,并编制了图表和表格。李俊良和戴昌撰写了手稿。所有作者都审阅并批准了手稿。
相应的作者
道德声明
伦理批准并同意参与
不适用。
发表同意书
不适用。
相互竞争的利益
作者宣称他们之间没有利益冲突。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
李俊,崔俊,程迪。et al。盐胁迫下甜菜iTRAQ蛋白谱分析:叶片和根的不同应对机制。BMC植物生物学20.347(2020)。https://doi.org/10.1186/s12870-020-02552-8
收到了:
接受:
发表:
关键字
- iTRAQ
- 盐胁迫
- 甜菜属
- 蛋白质组学
- 差异丰富的蛋白质种类