摘要
背景
本研究旨在揭示白花和紫花中花青素的生物合成代谢途径丹参利用代谢组学和转录组学,鉴定不同的花青素代谢产物,并分析参与花青素生物合成的差异表达基因。
结果
我们分析了代谢组学和转录组学数据美国miltiorrhiza花。在白花和紫花之间共鉴定出1994个差异表达基因和84个类黄酮代谢产物美国miltiorrhiza.转录组学和代谢组学综合分析表明,紫花苷3,5- o -二葡萄糖苷、malvidin 3,5-二葡萄糖苷和紫花苷3- o -半乳糖苷是紫花的主要成因美国miltiorrhiza。共鉴定出100个编码10种酶的unigenes为参与花青素生物合成的候选基因美国miltiorrhiza花。低表达答基因降低了花青素含量,但增加了黄酮类化合物的积累美国miltiorrhiza花。
结论
我们的结果为花青素代谢产物和参与花青素生物合成途径的候选基因提供了有价值的信息美国miltiorrhiza.
背景
丹参丹参,在中国被称为“丹参”,属于唇形科,是一种多年生草本植物鼠尾草属。这种植物在中国被广泛种植了两千年。美国miltiorrhiza是一种重要的药用植物,根茎被广泛用于治疗心脑血管疾病[1].从根中提取的提取物美国miltiorrhiza黄酮类化合物由许多化学成分组成,包括酚酸、黄酮类化合物和多糖,这些都是中药中的常用成分。特别是丹参酮,一种二萜醌美国miltiorrhiza,具有广泛的药理作用,可用于治疗阿尔茨海默病[2]及预防骨质疏松症[3.].
美国miltiorrhiza知母。F. alb是一种种内品种美国miltiorrhiza知母。产于中国山东省[4].形态差异在本物种的品种包括花的颜色的差异,例如,花的颜色美国miltiorrhizaBrge。是紫色的,而美国miltiorrhiza知母。f·阿尔巴是白色的。花的颜色受许多内外因素的影响,但花青素的含量和类型是决定花颜色最重要的因素之一。花青素属于类黄酮家族,是重要的天然着色剂,广泛分布于叶、花、果、根等植物中。迄今为止,已鉴定出超过635种花青素[5].Cyanidin (Cy)、delphinidin (Dp)、pelargonidin (Pg)、peonidin (Pn)、petunidin (Pt)和malvidin (Mv)是六种常见的花青素色素,是紫色、蓝色和红色的来源[6].花青素的生物合成由苯丙类和类黄酮生物合成途径中的一系列酶催化[7,8].参与花青素生物合成的基因已在许多植物物种如拟南芥[9],菠菜[10]和紫花苜蓿[11].研究发现,颜色突变经常出现在水果、花和叶子中。苹果的颜色变化可以受到单基因突变的影响[12].酶和转录因子编码基因的表达在调控花青素生物合成中起着多重关键作用[13].例如,高表达的二氢黄酮醇4-还原酶(DFR)、花青素合成酶(ANS)和花青素3- o -糖基转移酶(UFGT)通常会增加水果的颜色积累[14], R2R3-MYB、碱性螺旋-环-螺旋(basic helix-loop-helix, bHLH)和WD40转录因子可形成MBW复合物,调控花青素的生物合成[15,16,17].色素的形成依赖于羟基化、糖基化、甲氧基化和酰基化来维持稳定[18,19].一些独特的转运蛋白,包括GST、ABC转运蛋白、MATE和SNARE在植物花青素转运中发挥重要作用[20.].
UPLC/ESI-Q TRAP-MS/MS是目前植物代谢物鉴定分析领域的热门方法,具有灵敏度高、通量大、分离速度快、覆盖范围广等优点。目前,该技术已广泛应用于番茄、草莓、芦笋等植物的代谢产物分析[21,22,23].近年来,代谢组学与转录组学结合被广泛应用于研究代谢物的生物合成,以揭示植物中代谢物的生物合成途径[24,25].在本研究中,我们对花卉花青素生物合成的调控网络进行了研究美国miltiorrhiza使用代谢组学和转录组学。我们旨在鉴定不同的花青素代谢产物,并分析参与花青素生物合成的差异表达基因(DEGs)。本研究结果不仅提供了候选基因,而且为植物花色素苷生物合成的代谢工程提供了有价值的信息美国miltiorrhiza.
结果
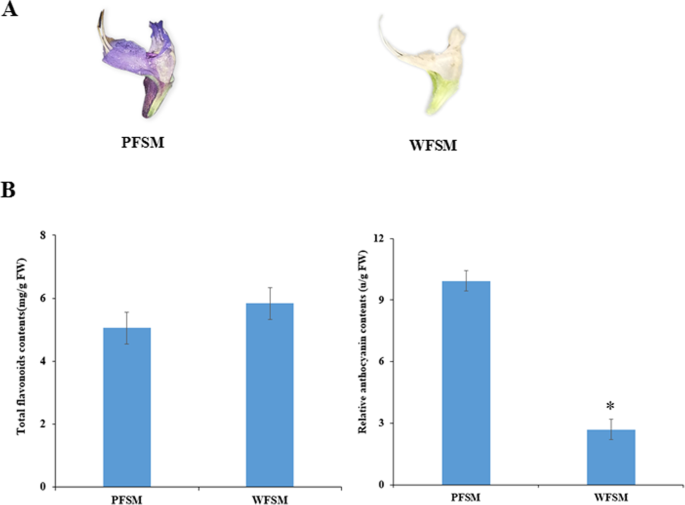
植物花中总黄酮和花青素的测定美国miltiorrhiza
类黄酮是植物中主要的色素分子,尤其是花青素。在我们的研究中,总黄酮和花青素美国miltiorrhiza花被测量了。结果表明,黄酮类化合物含量约为5.83 mg/g鲜重,高于PFSM的5.05 mg/g鲜重。WFSM的花青素相对含量为2.72个单位/g鲜重,显著低于PFSM的9.93个单位/g鲜重(图3)。1).
花卉类黄酮代谢产物美国miltiorrhiza
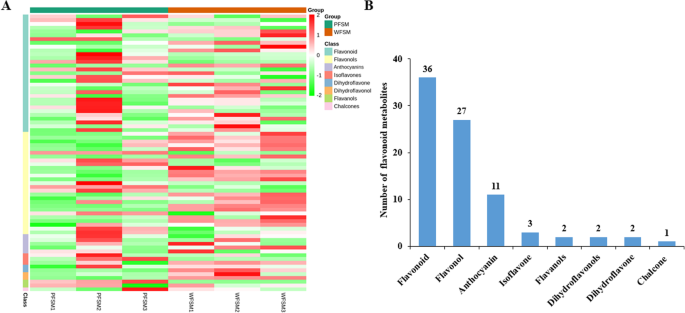
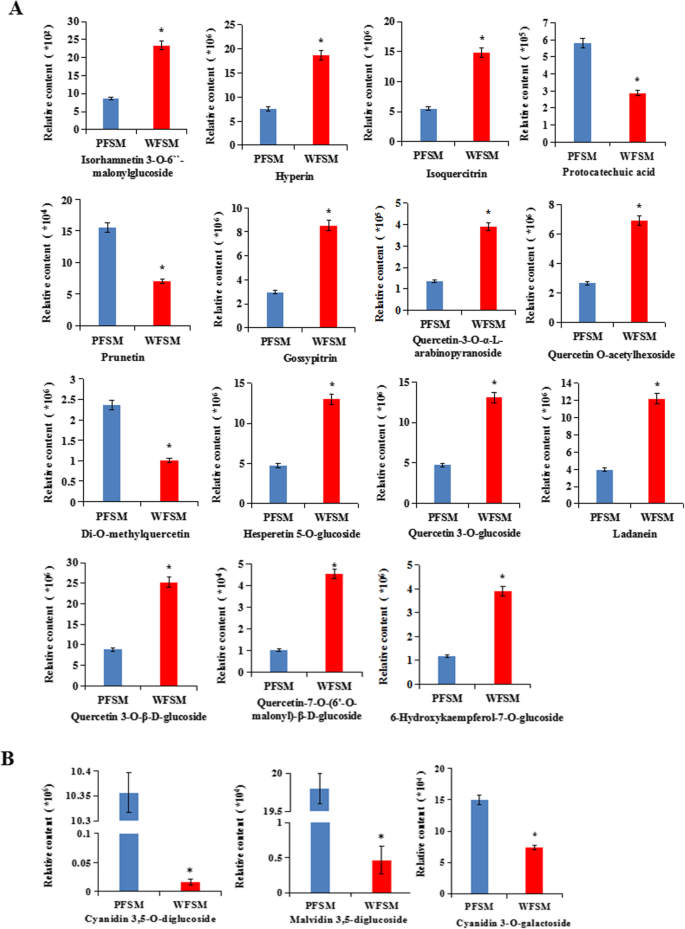
比较白花和紫花黄酮类代谢产物的差异美国miltiorrhiza,对UPLC/ESI-Q TRAP-MS/MS采集的数据进行分析。在这项工作中,共鉴定了84种不同的类黄酮代谢产物美国miltiorrhiza(表2).利用R软件进行单位方差缩放(UV)后绘制代谢物热图,并对不同样品间代谢物的积累模式进行层次聚类分析(HCA)(图2)。2a). 84种类黄酮代谢产物被分为8类,其中黄酮36种,黄酮醇27种,花青素11种,异黄酮3种,黄烷醇2种,二氢黄酮2种,二氢黄酮2种,查尔酮1种(图。2b).到目前为止,很少有研究对黄酮类物质进行定性或定量研究美国miltiorrhiza或者它们的生物合成途径。根据我们的数据,大多数类黄酮在花的骨架美国miltiorrhiza包括芹菜素,槲皮素和山奈酚。大部分的类黄酮美国miltiorrhiza花为o -糖苷类,仅有少量为c -糖苷类。在类黄酮代谢产物中,异鼠李素、木犀草素、异槲皮苷、槲皮素、金丝桃素、金丝桃醇、芹菜素、山柰素及其苷类在黄酮类化合物中含量丰富美国miltiorrhiza.使用绝对对数的识别准则2WFSM与PFSM的84种黄酮代谢产物中,FC≥1、VIP值≥1的黄酮含量有18种(占总量的21.4%)差异显著,其中上调代谢产物12种,下调代谢产物6种。其中槲皮素3-O-β- d -葡萄糖苷、金丝桃苷、橙皮素5- o -葡萄糖苷、异槲皮苷、橙皮素5- o -葡萄糖苷、拉丹素含量显著高于PFSM(2.48 ~ 3.11倍)(图4)。3.一个)。
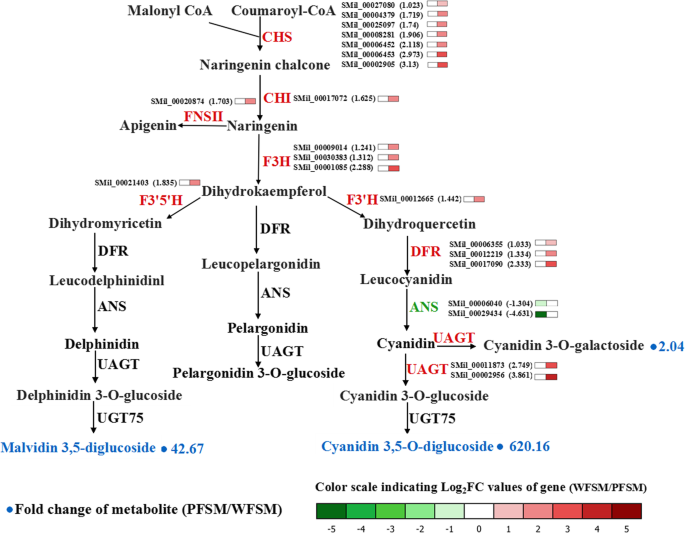
共鉴定出11种花青素美国miltiorrhiza,包括花青素、飞燕草素、芍药素、天竺葵素、飞燕草素和麦芽糖素。其中,PFSM中花青素3,5- o -二葡萄糖苷、malvidin 3,5-二葡萄糖苷和花青素3- o -半乳糖苷含量显著高于WFSM,分别为620.16倍、42.67倍和2.04倍(图2)。3.b).花青素3,5- o -二葡萄糖苷、malvidin 3,5-二葡萄糖苷和花青素3- o -半乳糖苷可能是紫花的主要原因美国miltiorrhiza。
花的差异表达基因美国miltiorrhiza
目的:了解花卉花青素生物合成的分子基础s . miltiorrhiza通过分析转录组来鉴定花中的差异表达基因。从花中获得了4895万个干净的读数美国miltiorrhiza.使用BLASTX程序在KEGG、NR、Swiss-Prot、KOG、GO和Pfam数据库中搜索所有干净的读取,进行功能注释。基于上述数据库共对28539个unigenes进行了功能注释。过滤条件为|Log2FDR < 0.05, 1994鉴定出ffc |≥1和FDR < 0.05的差异表达基因(DEGs)美国miltiorrhiza,包括1173个上调基因和821个下调基因。4a和表S3.).在DEGs的GO富集分析中,1994年有1304个DEGs涉及GO的三大类别,即生物过程、细胞成分和分子功能,其中在生物过程类别中鉴定出19个花青素生物合成过程和33个类黄酮生物合成过程(图2)。4b)。
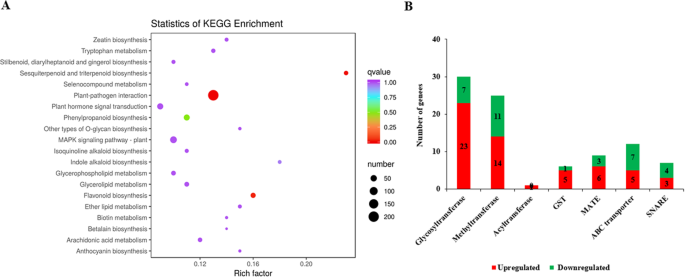
为了了解它们的生物学功能和基因相互作用,KEGG数据库对1994个deg中的807个进行了注释。q值< 0.05的KEGG代谢途径富集分析表明,DEGs在许多代谢过程中富集,包括类黄酮和花青素生物合成途径(图5)。5a).在这1994个DEGs中,我们发现30个糖基转移酶基因,25个甲基转移酶基因和1个酰基转移酶基因催化不同类型的黄酮类化合物和花青素的合成。在进一步的分析中,我们还检测到6个GST基因、12个ABC转运体基因、9个MATE基因和7个SNARE基因,这些基因可能在花青素向植物液泡转运中发挥重要作用(图2)。5b)。
结合转录组和代谢组分析,揭示了花色素苷的生物合成美国miltiorrhiza
结合转录组学和代谢组学的数据分析,我们了解了花色素的生物合成途径美国miltiorrhiza.结果表明,黄酮类化合物和花青素含量较高美国miltiorrhiza.其中,WFSM与PFSM相比,CHS、CHI和f3’h催化的类黄酮含量较高,ANS催化的花青素含量较低。为了理解这一发现,比较了WFSM和PFSM的转录组。通过对黄酮类化合物,特别是花青素生物合成途径的单基因分析,挖掘了紫白花代谢的关键基因美国miltiorrhiza.总共研究了100个在类黄酮和花青素生物合成途径中编码10种酶的unigenes1).21个关键unigenes表达水平不同;WFSM和PFSM中分别有19个上调和2个下调的unigenes。详细分析了花青素通路的核心基因,结果显示早期基因(CHS,气等)或晚期基因(DFR,UFGT等)均有较高的表达水平答与紫色花朵相比,白色的基因。在deg组中,7CHS, 1气3F3H, 1F3'H, 1F3’5是什么, 1fn2、3DFR,和2UAGT基因上调1.033 ~ 3.13倍(Log2FC)答基因(SMil_00006040和SMil_00029434)下调了−1.304-至−4.631倍(图2)。6及表S4).这些二磷酸腺苷类化合物影响植物花色素苷的生物合成美国miltiorrhiza.
植物花中负责花青素合成的关键基因美国miltiorrhiza
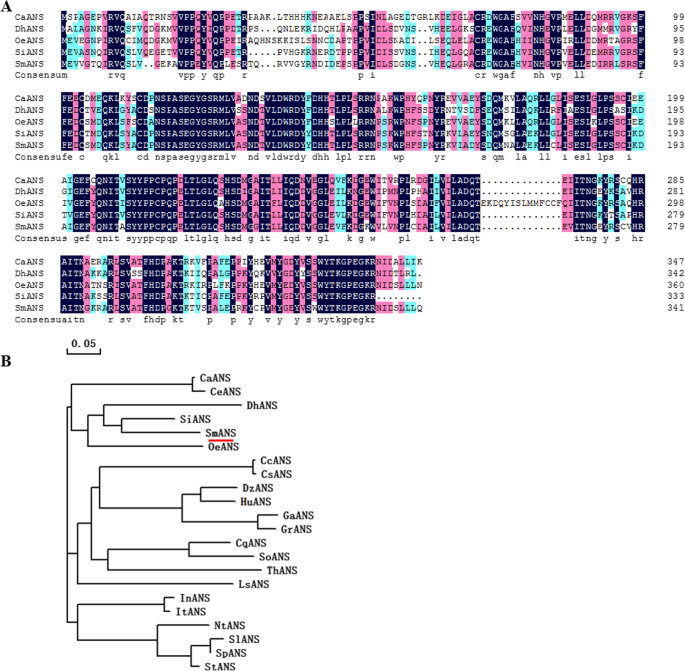
2的微分表达式答基因进一步分配给答NCBI数据库中的家庭。Blast分析表明,SMil_00029434蛋白与SmANS的序列同源性为99.41% (美国miltiorrhiza而SMil_00006040蛋白的氨基酸同源性分别为81.19、71.01、69.3和68.59% (胡麻属indicum, XP_020551541.1), OeANS (油橄榄, XP_022887681.1), DhANS (Dorcoceras hygrometricum, KZV49046.1), CaSnRK1 (Coffea阿拉比卡, XP_027087242.1)。7a).系统发育分析显示SMil_00006040蛋白与ANS蛋白关系密切胡麻属indicum而且油橄榄(无花果。7b).在NCBI数据库中没有SMil_00006040基因序列的报道。我们认为SMil_00006040基因是一个新的答基因美国miltiorrhiza.
植物花色素苷生物合成的转录因子研究美国miltiorrhiza
转录因子通过调控植物花青素的基因表达参与植物花青素的生物合成过程。在我们的数据中,有90个不同表达水平的转录因子与花青素的生物合成相关(表2)2).在这些转录因子中,有14个基因被标注为myb相关基因,包括MYB36、MYB44、MYB113等myb显性蛋白。本研究还发现9个基因编码bHLH, 1个WD40基因,以及其他转录因子。这些转录因子可能有助于花青素代谢产物的生物合成美国miltiorrhiza.
转录组数据的QRT-PCR
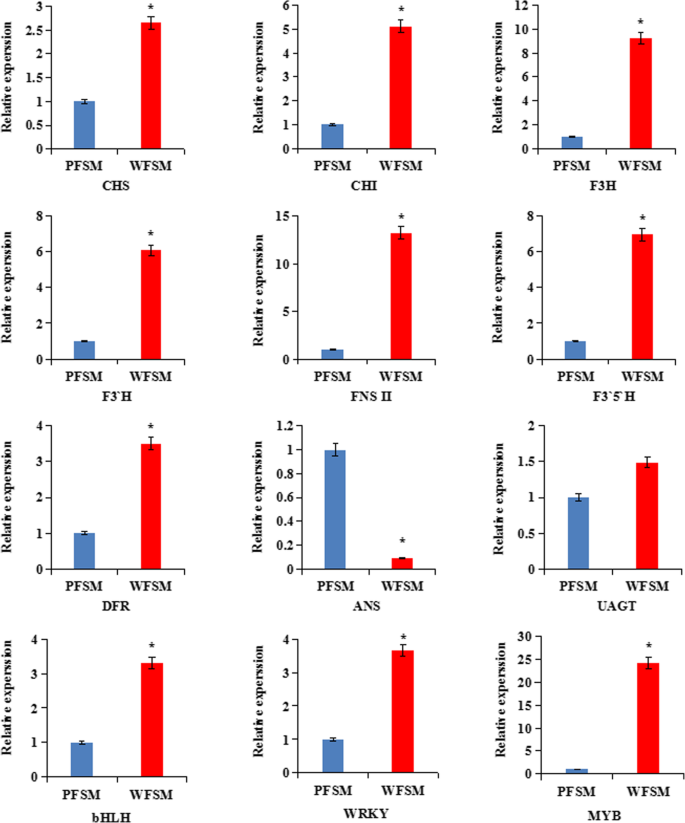
为了验证转录组信息的可信度,我们进一步选择了12个deg来验证测序结果。qRT-PCR结果显示,与PFSM相比,WFSM中有11个基因表达量较高,1个基因表达量较低;我们的qRT-PCR结果与RNA-Seq方法的结果一致(图。8).
讨论
花中花青素的鉴定美国miltiorrhiza
花青素是蔬菜、水果、药用植物等植物中的次生代谢产物,具有多种多样的生物学功能,包括抗氧化、调节防御反应和抵御紫外线辐射[26].花青素是在苯丙氨酸代谢途径的末端合成的,花青素生物合成的前体是丙二酰辅酶a和香豆油酰辅酶a。大多数花青素是通过CHS和CHI缩合合成的;F3H, F3 ' h,或F3 ' 5'H氧化;或DFR和ANS/LDOX催化[27,28,29].在本研究中,为了阐明花青素在白色和紫色花中的生物合成美国miltiorrhiza,代谢组学和转录组学通路分析美国miltiorrhiza花。共鉴定出73种黄酮类化合物和11种花青素美国miltiorrhizaUPLC/ESI-Q TRAP-MS/MS(表S .2).我们发现,与PFSM相比,WFSM的总黄酮含量更高,花青素含量更低(图2)。1而且3.).青花素3,5- o -二葡萄糖苷、青花素3- o -半乳糖苷和malvidin 3,5-二葡萄糖苷在WFSM和PFSM的花青素代谢产物中存在显著差异。在上述花青素中,PFSM的花青素3,5- o -二葡萄糖苷含量比WFSM高620.16倍(图2)。3.b),且PFSM中花青素3,5- o -二葡萄糖苷的含量也高于其他花青素。这一结果表明,花青素3,5- o -二葡萄糖苷是PFSM的主要花青素.
有趣的是,我们发现不仅在PFSM中,在WFSM中也存在花青素、peonidin、peonidin、pelargonidin、delphinidin和malvidin(表S)2).昆塔纳等人[30.提示在花青素通路的早期阶段存在突变,导致白花中没有花青素Anagallis莫内林.段等。[11]报道了紫色紫花苜蓿花中检测到malvidin和petunidin,而奶油色紫花苜蓿花中没有彩色花青素。在本研究中,我们发现6种常见的花青素色素同时存在于白花中美国miltiorrhiza。花色的决定因素可能与色素的数量、金属离子或花青素的不同分子构象有关。这些色素少量存在于白花中美国miltiorrhiza提示完整的花青素代谢途径诱导了该物种白花的花青素生物合成.
植物花中参与花青素生物合成的基因美国miltiorrhiza
花的转录组分析美国miltiorrhiza鉴定了参与花青素生物合成过程的ungenes,并显示了差异表达基因。在花青素生物合成途径中,编码CHS、CHI、FNS II、F3H、F3’h、F3’5’h、DFR和UAGT的基因在WFSM中表达水平高于PFSM(图2)。6),导致白花中类黄酮含量较高美国miltiorrhiza.ANS是花青素途径的关键酶,在白花青素转化为花青素的过程中起重要作用[31].在本研究中,我们检测到两种差异表达答与PFSM相比,WFSM中SMil_00006040和SMil_00029434基因表达下调(表S4).Blast分析表明,SMil_00006040基因为一个新基因答基因美国miltiorrhiza.的低表达水平答基因可能抑制了花青素的形成,导致了白花的形成。根据代谢组学和转录组学数据,我们推测低表达的答基因降低了花青素含量,但增加了黄酮类物质的积累美国miltiorrhiza.
ANS基因在植物花中的功能美国miltiorrhiza
ANS是花青素生物合成途径中催化花青素形成的四个双加氧酶之一。一些研究表明,缺乏答而且DFR花青素生物合成途径中的基因会导致色素沉着丧失[32,33].的white-fruitedDuchesnea籼(酒糟科)表型的下调与答基因(34].被抑制的表达答基因导致石竹中缺乏花青素[35].李等人。[36的过度表达SmANS提高了花色素苷含量,但降低了丹酚酸B的生物合成美国miltiorrhiza。白花的美国miltiorrhiza是各种各样的吗美国miltiorrhiza物种。我们的分析表明,白花性状是由于低表达答基因。在接下来的研究中,我们会过度表达答基因(SMil_00006040和SMil_00029434)在白花植物中的功能研究美国miltiorrhiza(无花果。7).
花青素生物合成相关的转录因子
花青素的生物合成主要受转录因子在转录水平的调控。迄今为止,已发现Myb、bHLH、WD40、锌指、MADs和WRKY蛋白的转录因子调控花青素的生物合成[37,38].其中,MYB转录因子在花青素生物合成的调控中起着关键作用。特别是MYB75/PAP1是控制花青素生物合成的主要调控因子拟南芥[39].在花青素生物合成途径中,植物中的花青素生物合成受MYB-bHLH-WD40 (MBW)复合物控制,如拟南芥[26],玉米[40]和花椰菜[41].除了myb外,锌指转录因子(AtZAT6)也通过直接结合花青素中多个基因的启动子参与花青素的合成拟南芥[42].bHLH转录因子已被证实对花青素的生物合成有积极的调控作用拟南芥[43].MdWRKY11可以增加F3H、FLS、DFR、ANS、UFGT的表达,促进苹果花青素的积累[44].的IbMADS10基因调控花青素生物合成增加甘薯花青素色素积累[45].在我们的研究中,我们分析了转录组数据,发现包括MYB、AP2/ERFs、WRKY、bHLH、MADs、WD40、锌指、NACs、bZIP和LBD在内的90个重要转录因子在WFSM和PFSM之间的表达水平存在显著差异(表2)2).我们推测这些差异表达的转录因子可能是花青素生物合成的候选调控因子美国miltiorrhiza花。
结论
我们利用代谢组学和转录组学揭示了花青素生物合成的代谢途径。在两个品种中共鉴定出1994个差异表达基因和84种不同的类黄酮代谢产物美国miltiorrhiza.在花青素生物合成途径的分析中,我们鉴定出100个编码10种酶的unigenes,这些酶参与了花的花青素生物合成美国miltiorrhiza。转录组和代谢组数据的综合分析表明,低表达的答基因降低了白花中花青素的含量,但增加了黄酮类化合物的积累美国miltiorrhiza.紫花青素3,5- o -二葡萄糖苷、麦芽糖苷3,5-二葡萄糖苷和紫花青素3- o -半乳糖苷是紫花的主要原因美国miltiorrhiza。我们的结果为花青素代谢产物和参与花青素生物合成途径的候选基因提供了有价值的信息美国miltiorrhiza.
方法
植物材料
白花的美国miltiorrhiza(WFSM)和紫色花美国miltiorrhiza(PFSM)是在美国miltiorrhiza河北省农林科学院经济作物研究所种质资源中心鲜花采自2019年8月健康植物。所有材料在液氮中冷冻,并保存在−80°C下,用于RNA和代谢物提取。所有实验均分为3个生物重复。
总黄酮含量测定
大约2.5克美国miltiorrhiza采用硝酸铝比色法测定花中总黄酮含量。简而言之,将0.5 mL粗花提取物与5.5 mL 50%乙醇和l mL 5%纳米混合2解决方案。然后,1ml 10% A1(N03.)3.孵育6分钟后加入溶液,再孵育6分钟。随后,加入10 mL 4% NaOH溶液和7 mL 50%乙醇。混合物的最终体积为25毫升。混合物静置15分钟,然后用紫外分光光度计(V-5100B, METASH, Shanghai, China)在506 nm波长下测量吸光度。芦丁作为标准溶液制备校准曲线,结果以芦丁的鲜重当量表示[46].
花青素相对含量测定
美国miltiorrhiza花(0.1 g)用1 mL甲醇(0.1% HCl)碾碎,并在10 mL离心管中洗涤两次。样品的最终体积为5 mL(包括甲醇(0.1% HCl))。组织匀浆振荡30 s,在4°C和12000 g下离心10 min,用紫外分光光度计(V-5100B, METASH)在530 nm波长下测量上清液的吸光度。花青素相对浓度的计算公式为:Q = V * A530 / M(单位/g FW),其中V为溶液体积,M为样品重量。甲醇(0.1% HCl)作为空白对照[47].
代谢物提取
使用混合磨机(MM 400, Verder Retsch, Shanghai, China)和氧化锆珠在30 Hz频率下粉碎冻干的花1.5分钟。然后称取100 mg粉末,用1.0 mL 70%甲醇水溶液(V/V = 70%)在4℃下提取过夜。在10,000 g离心10分钟后,提取液被CNWBOND Carbon-GCB SPE墨盒(250 mg, 3 mL;ANPEL,上海,中国www.anpel.com.cn/cnw),通过0.22 μm微滤膜(SCAA-104;ANPEL,上海,中国http://www.anpel.com.cn/),然后进行UPLC-MS/MS分析。
超高效液相色谱(UPLC)条件
UPLC, shimo -pack UFLC岛津CBM30A系统,中国上海www.shimadzu.com.cn/)对样品提取物进行分析。UPLC分析在以下条件下进行,UPLC:色谱柱,Waters (China Shanghai) ACQUITY UPLC HSS T3 C18 (1.8 μm, 2.1 mm*100 mm);溶剂体系,水(0.04%乙酸):乙腈(0.04%乙酸);梯度程序,95:5 V/V在0分钟,5:95 V/V在11.0分钟,5:95 V/V在12.0分钟,95:5 V/V在12.1分钟,95:5 V/V在15.0分钟;流速,0.40 mL/min;温度,40°C;注量:2 μL。流出液交替连接到esi -三重四极线性离子阱(Q trap)-MS。
ESI-q trap-MS /女士
线性离子肼飞行时间(LIT)和三重四极子(QQQ)扫描在三重Q TRAP上进行,API 6500 Q TRAP LC/MS/MS系统(应用生物系统公司,上海,中国)配备ESI涡轮离子喷雾接口,工作在正离子模式和负离子模式。系统由Analyst 1.6软件(AB Sciex,上海,中国)控制。ESI源设置参数为:离子源、涡轮喷雾;源温度500℃;离子喷涂电压(IS) 5500 V。离子源气体I (GSI)、气体II (GSII)和幕气(CUR)分别设置为55.0 psi、60.0 psi和25.0 psi;碰撞气体(CAD)较高。用10 μmol/L和100 μmol/L聚丙烯乙二醇溶液分别在QQQ和LIT模式下进行仪器调试和质量校准。QQQ扫描是在碰撞气体(氮气)设置为5 psi的多重反应监测(MRM)实验中获得的。通过进一步的DP和CE优化,完成了对各个MRM跃迁的聚类势(DP)碰撞能(CE)的测量。 A specific set of MRM transitions was monitored for each period according to the metabolites eluted within the period.
代谢物的鉴定和定量分析
基于MIM-EPI (multiple ion monitoring-enhanced product ions,多离子监测增强产物离子)逐步建立市售标准代谢产物数据库(Metware Biotechnology Co., Ltd.)武汉,中国)和公共代谢物数据库MassBank, KNAPSAcK, HMDB, MoToDB, METLIN,对代谢物数据进行定性分析。代谢物定量分析采用多重反应监测[48,49].采用统计函数prcomp在R (www.r-project.org).用VIP≥1和绝对对数测定各组间代谢物有显著性差异2FC(折叠变化)≥1。
RNA提取和Illumina测序
使用RNAprep Pure Plant Kit(天根生物技术,北京,中国)从冷冻花朵中提取总RNA。在1.2%琼脂糖凝胶上监测RNA降解和污染情况。使用NanoDropTM 2000分光光度计(Thermo Scientific, Shanghai, China)定量纯化的RNA浓度。使用Agilent 2100生物分析仪(Agilent Technologies, Santa Clara, CA, USA)检测总RNA的质量。利用Oligo (dT)磁珠从总RNA中富集Poly (A) mRNA。Poly (A) mRNA随后用RNA片段试剂盒(Ambion, Austin, TX, USA)进行片段。利用逆转录酶和随机六聚体引物将碎片RNA转录成第一链cDNA。用DNA聚合酶I和RNase H合成第二链cDNA (Invitrogen, Carlsbad, CA, USA)。在末端修复和添加poly (a)尾后,分离出合适长度的片段并连接到测序适配器上。这些片段在Illumina HiSeq™2500平台上测序。
RNA测序(RNA-seq)数据分析和注释
为了获得高质量的读取,fastq格式的原始读取通过内部Perl脚本进行处理。从原始数据中通过去除适配器序列、低质量读取和包含poly - n的读取来获得干净的读取。所有下游分析均基于干净、高质量的数据。使用以下数据库对基因功能进行注释:京都基因与基因组百科全书(KEGG)通路数据库、NCBI非冗余(Nr)数据库、Swiss-Prot蛋白数据库、真核同源群簇(KOG)数据库、基因本体(GO)数据库和Pfam数据库。
通过RSEM (version 1.2.26)估计基因表达水平[50].采用DESeq R包(1.10.1)对两组差异表达基因进行分析。DESeq提供了使用基于负二项分布的模型来确定差异表达基因的统计例程。所有统计检验的结果均采用Benjamini和Hochberg错误发现率进行多次检验校正。基因被确定在调整后显著差异表达P-value < 0.05根据DESeq。基于Kolmogorov-Smirnov检验,采用topGO R包对差异表达基因进行GO富集分析。途径分析根据KEGG数据库阐明差异表达基因的显著途径(http://www.genome.jp/kegg/) [51].我们使用KOBAS软件测试了KEGG通路中差异表达基因的统计富集[52].
花青素生物合成相关基因的QRT-PCR表达分析
总RNA美国miltiorrhiza根据Quantscript逆转录酶试剂盒(天根生物科技,北京,中国)对花进行逆转录。以cDNA为模板,检测基因表达。花青素生物合成相关基因的特异性引物美国miltiorrhiza肌动蛋白基因(内控)列于表S1.定量实时聚合酶链式反应(qRT-PCR)由实时PCR ABI Prism 7500系统(软件为7500和7500快速实时PCR系统,V2.0.1,福斯特城,加州,美国)使用SYBR®Premix Ex Taq™II (TaKaRa代码No.;RR820A,http://www.takarabiomed.com.cn).对比CT法(2-ΔΔCT方法)定量表达基因[53].
统计分析
使用Excel 2010软件(Microsoft Office, USA)进行统计分析。数据以均数±标准差(SD)表示。统计学显著性水平由差异最小的(p< 0.05)。
数据和材料的可用性
所有相关的支持数据集都包含在本文及其补充文件中。
缩写
- Cy:
-
花青色素
- Dp:
-
花翠素
- 答:
-
天竺葵色素
- Pn:
-
Peonidin
- Pt:
-
矮牵牛配基
- Mv:
-
二甲花翠素
- DFR:
-
Dihydroflavonol 4-reductase
- 答:
-
花青素合成酶
- UFGT:
-
花青素3-O-glucosyltransferase
- CHS:
-
查耳酮合酶
- 气:
-
查耳酮异构酶
- F3H:
-
二氢黄酮3-hydroxylase
- F3'H:
-
类黄酮3 '单氧酶
- F3’5是什么:
-
类黄酮3 ',5 ' -羟化酶
- fn 2:
-
黄酮合酶II
- UGT75:
-
花青素3- o -葡萄糖苷5- o -葡萄糖苷转移酶
- bHLH:
-
基本helix-loop-helix
- 度:
-
差异表达基因
- UPLC:
-
超高效液相色谱法
- 点燃:
-
线性离子肼飞行时间
- 调:
-
三重四极
- 助教:
-
气我
- GSII:
-
气体二世
- 坏蛋:
-
窗帘气体
- 计算机辅助设计:
-
碰撞气体
- MRM:
-
多重反应监测
- DP:
-
Declustering潜在
- CE:
-
碰撞能量
- MIM-EPI:
-
多重离子监测增强产物离子
- 主成分分析:
-
主成分分析
- HCA:
-
层次聚类分析
- OPLS-DA:
-
偏最小二乘判别分析
- KEGG:
-
京都基因与基因组百科全书
- Nr:
-
NCBI冗余
- KOG:
-
同源群的真核聚类
- 走:
-
基因本体论
- 存在:
-
实时定量聚合酶链反应
- SD:
-
标准差
- 紫外线:
-
单位方差缩放
参考文献
- 1.
周玲,左卓,周淑娟。丹参化学、药理、药代动力学及临床应用综述。中华临床药物学杂志2005;45:1345-59。
- 2.
张秀珍,钱诗诗,张玉军,王仁强。美国miltiorrhiza:抗阿尔茨海默病药物的来源。医药生物学杂志,2016;54(1):18-24。
- 3.
朴斌,宋海生,权哲,赵三生,张莎,金美英,等。的影响美国miltiorrhiza补充液化钙提取物对缺钙卵巢切除小鼠骨质疏松症的影响。中国生物医学工程学报,2017;17(1):545。
- 4.
李玉玲,辛晓明,陈志勇,史荣军,苗志明,丁俊,等。内生真菌美国miltiorrhiza知母。f·阿尔巴是天然抗氧化剂的潜在来源。机器人。2015;56:5。
- 5.
何娟,朱建民。花青素:一种具有健康促进作用的天然色素。食品科学与技术,2010;1:163-87。
- 6.
水果花青素生物合成调控的新认识。植物科学进展,2013;18:477-83。
- 7.
黄酮类化合物生物合成的调控。黄酮类化合物,2006。https://doi.org/10.1007/978 28822 0 387−−−−2 _4.
- 8.
黄酮类化合物:生物合成,生物功能和生物技术应用。前沿植物,2012。https://doi.org/10.3389/fpls.2012.00222.
- 9.
李雪峰,李志军,李志军,等。花青素的积累及对花青素含量的影响拟南芥在去除花序茎后(斩首)。植物化学学报。2005;43(6):521-5。
- 10.
蔡霞,林琳,王霞,徐成,王强。菠菜花青素积累与花青素生物合成基因转录水平相关。基因组。2018;61(7):487 - 96。
- 11.
段浩辉,王仁仁,崔广旭,周晓辉,段晓荣,杨海辉。利用rna测序分析鉴定控制紫花苜蓿花色素变化的调控网络和中枢基因。BMC植物生物学2020;20:10 10。
- 12.
谢小斌,李松,张富峰,赵军,陈玉春,赵强,等。bHLH转录因子MdbHLH3在低温下促进苹果花青素积累和果实着色。植物细胞环境学报。2012;35(11):1884-97。
- 13.
齐藤K,米仓神原K,中林R,东Y,山崎M, Tohge T,等。拟南芥类黄酮生物合成途径:结构和遗传多样性。中国生物医学工程学报,2013;
- 14.
Han Y, Vimolmangkang S, Soria-Guerra RE, Korban SS.将苹果ANR基因导入烟草,可抑制花中CHI和DFR基因的表达,导致花青素的损失。中国机械工程学报,2012;29(7):344 - 344。
- 15.
赵敏,李伟,李志刚。TTG1/bHLH/Myb转录复合物对花青素生物合成途径的调控拟南芥幼苗。植物J. 2008; 53:814-27。
- 16.
白少林,陶瑞瑞,尹林,倪建杰,杨群生,闫晓华,等。两种B-box蛋白PpBBX18和PpBBX21在梨果皮中通过与Pyrus pyrifolia ELONGATED HYPOCOTYL 5竞争作用拮抗调控花青素的生物合成。中国植物学报,2019;30(6):344 - 344。
- 17.
陈坤林,杜丽娟,刘海林,刘丽丽。葡萄风信子中新发现的R2R3-MYB MaMybA与MaAN2不同,在烟草中具有强烈的洋红色花青素色素沉着。BMC植物生物学2019;19:390。
- 18.
吴强,吴娟,李世生,张海军,冯春春,尹德东,等。揭示睡莲蓝色花形成的转录组测序和代谢产物分析。BMC Genomics. 2016;17:897。
- 19.
娄强,刘勇,齐勇,焦松,田飞,姜林,等。转录组测序和代谢产物分析揭示了飞燕草素代谢在葡萄风信子花色中的作用。中国机械工程学报,2014;26(12):357 - 357。
- 20.
雷志祥,周超,季晓霞,魏刚,黄玉春,于文祥,等。转录组分析揭示了黄酮类化合物生物合成和积累的相关基因石斛兰catenatum来自不同的地方。科学代表2018。24751 018 https://doi.org/10.1038/s41598−−−y.
- 21.
朱刚,王珊珊,黄忠,张松,李强,张超,等。番茄育种中果实代谢组的重组。细胞。2018;172:249 - 61。
- 22.
Paolo B, Saverio O, Mirko M, Matteo B, Lara G, Azeddine SA。草莓果实发育和成熟过程中的基因表达和代谢产物积累(Fragaria×ananassa)。足底。2018;248(5):1143 - 57。
- 23.
董涛,韩瑞,于娟,朱明,张勇,龚颖,等。绿色和紫色芦笋花青素积累及相关基因的代谢组和转录组分子分析(芦笋officinalis食品化学,2019;271:18-28。
- 24.
王濛J, B, G,王Y,唐XF,王SM,等。代谢组学结合转录组学揭示了苯丙类代谢通量的重定向银杏叶.农学通报,2019;67(11):3284-91。
- 25.
李东,陈刚,马波,钟春春,何乃杰。桑叶的代谢谱和转录组分析为类黄酮的生物合成提供了新的见解。农业化学学报,2020;
- 26.
黄志刚,李志刚。生殖器官花青素合成调控的研究进展。植物科学进展(英文版);2011;
- 27.
李卡V,权C,潘struga R.陷阱-ware:陷阱-结构域蛋白在植物生物学中的作用。生物技术学报。2007;23:147-74。
- 28.
赵东,陶娟,韩春,葛娟。草本牡丹黄酮合成基因差异表达及黄酮积累揭示的花色多样性(芍药棺罩)。Mol生物学杂志2012;39(12):11263-75。
- 29.
周涛,王晓超,于一波,肖燕,钱文杰,肖波,等。紫叶茶树总儿茶素(或花青素)与黄酮类生物合成相关基因表达水平的相关性分析作物学报,2016;42(4):525。
- 30.
李文杰,李文杰,李文杰,等。植物花色遗传研究Anagallis monelli中国生物医学工程学报。2008;43(6):1680-5。
- 31.
Ben Simhon Z, Judeinstein S, Trainin T, Harel Beja R, Bar Ya'akov I, Borochov Neori H,等。缺乏花青素的“白色”石榴(石榴L.)由白花青素双加氧酶(LDOX;ANS)基因。公共科学学报。2015;10(11):e0142777。
- 32.
Bogs J, Jaffe FW, Takos AM, Walker AR, Robinson SP.葡萄转录因子VvMYBPA1在果实发育过程中调节原花青素合成。植物物理学报。2007;143:1347-61。
- 33.
Clark ST, Verwoerd WS。一种系统的方法,以确定相关基因靶点的颜色色素的损失在植物。BMC生物信息学。2011;12:343。
- 34.
Debes MA, Arias ME, Grellet-Bournonville CF, Wulff AF, Martínez Zamora MG, Castagnaro AP,等。白果Duchesnea Indica(蔷薇科)ANS基因表达受损。中国科学(d辑),2011;29(4):344 - 344。
- 35.
岛田,井上勇,佐田。非花青素产生的花青素合成酶石竹目物种。植物学报,2005;44(6):950-9。
- 36.
李海燕,刘建林,裴涛,白志强,韩瑞林,梁志松。过量表达SmANS可促进花青素积累,改变花青素中酚酸含量丹参而且丹参知母f·阿尔巴植株。国际分子生物学杂志,2019;20(9):2225。
- 37.
Terrier N, Torregrosa L, Ageorges A, Vialet S, Verries C, Cheynier V,等。VvMybPA2的异位表达促进葡萄原花青素的生物合成,并提示途径中的其他靶点。植物科学进展。2008;32(2):344 - 344。
- 38.
Lloyd A, Brockman A, Aguirre L, Campbell A, Bean A, Cantero A,等。MYB - bhlh - wd重复(MBW)色素调控模型的研究进展:添加WRKY因子和增选花青素MYB调控甜菜素。中国生物医学工程学报,2017;29(4):344 - 344。
- 39.
杨晓明,杨晓明,杨晓明,杨晓明,等。蔗糖诱导花青素生物合成途径的研究进展拟南芥.植物学报。2006;14:637 - 46。
- 40.
Hichri I, Barrieu F, Bogs J, Kappel C, Delrot S, Lauvergeat V.黄酮类化合物生物合成途径转录调控的研究进展。中国机械工程学报,2011;26(8):344 - 344。
- 41.
赵丽伟,李磊。紫色花椰菜花青素合成调控网络的研究。足底。2012;36(4):1153 - 64。
- 42.
石华,刘刚,魏勇,陈哲。锌指转录因子ZAT6在过氧化氢诱导花青素合成中起重要作用拟南芥.中国生物医学工程学报,2018;29(1):344 - 344。
- 43.
石明志,谢元元。植物花青素的生物合成与代谢工程拟南芥.生物科技,2014;8:47-60。
- 44.
王楠,刘伟,张涛,姜松,徐辉,王勇,等。红肉苹果的转录组分析揭示了MdWRKY11在类黄酮和花青素生物合成中的新作用。农业食品化学,2018;6(27):7076-86。
- 45.
Lalusin A、Ocampo E、Fujimura T.等拟南芥植株在甘薯中过表达IbMADS10基因后,花青素水平较高。中国农业科学,2011;36(2):30-6。
- 46.
张敏,陈海霞,李建林,裴勇,梁勇。不同热处理方法对苦荞提取物抗氧化性能的影响。食品科学与技术。2010;43(1):181-5。
- 47.
孟晓晨,张玉军,王晓强。花发育过程中花青素、还原糖和可溶性蛋白含量的变化佩妮矮牵牛.华南师范大学学报,2001;2:96-9。
- 48.
陈伟,龚琳,郭志,王伟,张宏,刘旭,等。一种大规模检测、鉴定和定量广泛靶向代谢物的新综合方法:在水稻代谢组学研究中的应用。植物学报。2013;6:1769-80。
- 49.
王志荣,崔云云,Vainstein A,陈文文,马海峰。fig (无花果l)果实颜色:类黄酮生物合成途径的代谢组学和转录组学分析。前沿植物科学,2017。https://doi.org/10.3389/fpls.2017.01990.
- 50.
李俊杰,蒋荣荣,布朗杰比,黄华,毕克尔。下一代mRNA测序(RNA-Seq)数据的稀疏线性建模用于异构体发现和丰度估计。美国国家科学院。2011; 108:19867 - 72。
- 51.
金久M,荒木M,后藤S,服部M,平川M,伊藤M,等。将基因组与生命和环境联系起来。核酸研究,2007;36:480-4。
- 52.
毛晓霞,蔡涛,李志刚,魏磊。基于KEGG Orthology (KO)的基因组自动注释和通路识别。生物信息学。2005;21:3787 - 93。
- 53.
Schmittgen TD, Livak KJ。对比CT法分析实时PCR数据。Nat protocol . 2008; 3:1101-8。
确认
感谢LetPub (www.letpub.com),以便在准备这篇手稿时提供语言上的帮助。
资金
河北省中药产业技术体系种质资源评价与应用项目(HBCT201806201)、中国农业科研体系项目(CARS-21)、湖北省科技创新计划项目(2019ZYYD064)资助。资助者在研究设计、数据收集、分析和解释、发表决定或手稿准备中没有任何作用。
作者信息
从属关系
贡献
LD和TJ构想并设计了实验。XL、CX和SQ进行实验。MD, WT和RK分析了数据。TJ和MD撰写了论文。作者们阅读并批准了论文的最终版本。
相应的作者
道德声明
伦理批准并同意参与
不适用。
发表同意书
不适用。
相互竞争的利益
作者宣称他们没有利益冲突。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
补充文件1补充表S1
.qRT-PCR特异性引物序列。
附加文件2补充表S2
.WPSM和PFSM中不同的类黄酮代谢产物。
附加文件3补充表S3。
WFSM与PFSM基因表达差异。
附加文件4补充表S4。
WPSM与ppfsm花青素生物合成差异表达基因。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
蒋涛,张敏,文昌。et al。花青素调控网络的综合代谢组学和转录组学分析丹参知母。花。BMC植物生物学20.349(2020)。https://doi.org/10.1186/s12870-020-02553-7
收到了:
接受:
发表:
关键字
- 药用植物
- 花青素
- 转录组
- 代谢物
- 美国Miltiorrhiza