摘要
背景
高密度遗传定位是多年生果树控制特定性状位点定位的重要工具。桃是一种重要的经济果树,也是蔷薇科基因组学和遗传学研究的模式树种。在桃中,尽管已有许多分子标记、遗传图谱和QTL定位的报道,但在标记数量、图谱密度、QTL精度和候选基因鉴定等方面仍有待进一步研究。
结果
采用特异性位点扩增片段测序(SLAF-seq)技术,构建了高密度单核苷酸多态性(SNP)的桃树连锁图谱。该遗传图谱由7998个SLAF标记组成,标记间距为1098.79 cM,标记间平均距离为0.17 cM。共检测到果实质量(FW)、果实直径(FD)、果皮红色百分比(PSC)、食味品质(EQ)、果实风味(FV)、果肉红色(RF)、果核周围红色(RP)、果核附着(AP)、果实发育周期(FDP)和果实纤维含量(FFC)等10个果实相关性状的40个qtl和885个带注释的候选基因。在2015年和2016年,共鉴定出18个可溶性固形物含量QTL,在LGs 1、4、5和6上标记了540个基因。在LG1上检测到32个果实酸度含量(FA) qtl,鉴定出2、4、5、6和1232个候选基因。分析了2个SSC候选基因和4个FA候选基因在亲本及其后代中的表达谱。
结论
基于slf -seq构建了桃树的高密度遗传图谱,该图谱的构建有助于桃树重要农艺性状位点的鉴定。共鉴定出12个果实相关性状的90个qtl,其中大部分与前人报道的qtl重叠,并获得了一些新的qtl。筛选和鉴定了大量果实相关性状的候选基因。这些结果可提高我们对果实品质性状遗传控制的认识,并为桃树果实品质的标记辅助选择提供有用的信息。
背景
桃子(碧桃(l)作为世界温带地区美味健康的夏季水果而闻名,2017年全球总产量约为247万吨(http://www.fao.org/faostat/en/#data).桃是一种重要的多年生果树,染色体较少(2n = 2x = 16),基因组较小(~ 230 Mbp),幼期短(2 ~ 4年)[1]。这些特性使桃成为蔷薇科果树遗传图谱构建、重要农艺性状定位和目标候选基因鉴定的模式植物。
果实品质是一个涉及果实外观、质地、口感、风味等方面的复杂性状。Infante et al.(2008)综述了通过物理、化学和感官参数评价桃果实品质,以及主要果实品质性状的遗传和分子育种[j]。2]。这些品质性状大多是由多个基因座定量遗传和控制的。遗传图谱构建和QTL分析是鉴定果实品质性状相关候选基因的有效策略[j]。3.]。
Chaparro等利用种内F2后代首次报道了桃树图谱,包括83个随机扩增多态性DNA (RAPD)标记、1个同工酶和4个形态标记[4]。随后,随着分子标记技术的发展,构建了大量的桃树遗传连锁图谱[5,6,7,8,9]。
Sosinski等人检测到可溶性固形物、pH、耐寒性、成熟日期和果实大小的12个qtl [5]。Dirlewanger等人鉴定出32个与糖和酸含量相关的qtl,并观察到qtl之间存在上位性[10]。与孟德尔农艺性状密切相关的分子标记也被检测到。自由石(F)位于G4,低酸(D)和桃(G)位于G5,花粉不育(Ps)、扁平(S)和败育果(Af)位于G6 [6]。果实重量(FW)、果汁总可溶性固形物(SSC)和果汁可滴定酸度(FA)的qtl在G4上靠近endoPG CAPS标记的远端位置发现,成熟日期(MD)的qtl也在G4上发现[7]。Fresnedo-Ramírez等人鉴定出5个qtl,分别占果实赤道直径(FD)表型变异的29%和鲜重(FW)表型变异的17% [11]。Hernández Mora等人通过对来自欧洲不同育种计划的18个家族的综合分析,确定了桃子7个最重要农艺性状的47个qtl [12]。
连锁组4和连锁组5分别对果实粉质(M)和果肉出血(FBL)和果肉褐变(FBr)有显著QTL效应[8]。Sánchez等人鉴定了桃果中挥发性化合物的QTL, QTL图谱显示了包含在相同挥发性模块中的挥发性QTL聚类。位于LG4顶部的一个独特位点控制单萜模块[13]。Eduardo等人在连锁组4中鉴定了壬醛、芳樟醇和p- month -1-en-9-al的三个主要qtl。编码两种推测的萜烯合成酶和一种脂氧合酶(Lox)的基因可能分别参与了芳樟醇和p- month -1-en-9-al和nonanal的生物合成[j]。14]。Bielenberg等检测到10个与冷需要量(CR)有关的qtl和19个与开花日期(BD)有关的qtl [15]。在连锁组LG6中发现了两个石硬表型相关的qtl。三个基因(prupe . 6g1509001、prupe . 6g1476001和prupe . 6g1565001)被鉴定为SH性状的候选基因[9]。
近年来,利用表达QTL (eQTLs)来鉴定果实品质性状QTL区域内的候选基因。例如García-Gómez等人(2019)鉴定出杏果实品质性状相关的qtl,并通过基因表达分析获得LG3中皮肤颜色的候选基因MYB转录因子和LG4中SSC的三个候选基因[16]。Carrasco-Valenzuela等人(2019)利用传统qtl、eqtl(表达qtl)和转录组分析进行了综合分析,确定了与桃子果实软化速率相关的候选基因,并指出生长素生物合成相关基因触发了桃子果实融化的快速软化[17]。尽管已有许多分子标记、遗传图谱和QTL分析的报道,但QTL定位的准确性有待提高,而且缺乏关于决定某一性状遗传的基因数量和位置的简明信息[12]。
本研究利用特异位点扩增片段测序(slf -seq)技术开发的SNP标记构建了高密度遗传图谱,并鉴定出与果实质量、果实直径、果皮颜色、果肉红色、果核周围红色、果核粘附性、果实发育周期、果实纤维含量、果实风味、食味品质、果皮质量、果皮质量等12个品质性状相关的稳定qtl。可溶性固形物含量和果实酸度含量),在一个F1群体中施用2年。随后,我们筛选了位于这些稳定QTL区域内的候选基因,并使用qPCR进行基因表达分析进行验证。本研究结果将有助于了解桃果品质形成的遗传基础,从而为通过MAS和/或遗传操作提高果实品质提供理论依据。
结果
果实相关性状表型鉴定
2015年和2016年对202个F1群体个体的12个果实相关性状进行了分析。数量性状包括果实发育期(FDP)、果实重(FW)、果实直径(FD)、果皮红度(PSC)、食性(EQ)、果实风味(FV)、可溶性固形物含量(SSC)和果实酸度(FA)。FW、FD、PSC、FV和EQ在子代中呈正态分布,FDP呈显著的非正态分布(图2)。1).因此,在随后的分析中,FDP被视为一种定性性状。家长的SSC和FA1在果实贮藏期间测定后代。SSC在2015年和2016年储存期间均呈小幅上升趋势,而FA在2016年有所增加,但在2015年保持稳定。此外,2016年的SSC和FA均高于2015年(图2)。2).品质性状包括果肉红(RF)、果核周围红(RP)、果核附着(AP)、果实纤维含量(FFC)和果实纤维含量(FDP)。采用Kruskal-Wallis检验检测这些品质性状的qtl。
桃高密度遗传连锁图谱的构建
8037个SLAF高质量多态性标记中,7998个根据其在基因组中的位置分布到8个连锁群(LGs)中碧桃基因组(图51).遗传图谱全长1098.79 cM,相邻标记间平均距离为0.17 cM。LG1是最大的LG1,包含1699个标记,覆盖143.89 cM,平均距离仅为0.08 cM,相邻标记间的最大间距仅为2.67 cM。LG8的标记最少,为386个,长113.03 cM,相邻标记间的平均距离为0.29 cM,最大间距为5.86 cM(表1)1).此外,利用Spearman相关确定了物理图谱和遗传图谱之间的共线性。共线性水平较高,得分小于或等于1.0(图5)2).
果实相关性状的qtl鉴定
利用MapQTL6.0软件对12个果实相关性状进行QTL分析。FW、FD、PSC、EQ和FV呈正态分布,共检测到21个qtl。鉴定出4个FW的qtl,其中2个位于LG 4(7和6.4%),3个位于LG 5(5.3%), 4个位于LG 6(5.8%)。鉴定出4个FD的qtl,其中2个位于lg4(5.9%和10.3%),另外2个位于lg5(6.8%和6.0%)。鉴定出5个与PSC相关的qtl,其中2个qtl位于lg4(7%和7.5%),其余3个qtl位于lg1(6.4%)、lg3(4.9%)和lg6(6.6%)。2个EQ qtl分别位于lg1上(7%和6.8%)。共鉴定出6个FV qtl,其中2个位于lg1(7.7%和8.1%),2个位于LG5(13.9%和5.3%),2个位于LG3(10.4%)和LG4(6.7%)(表1)2).
共鉴定出RF、RP、AP、FDP和FFC 5个品质性状的19个QTL(2年内同一QTL视为1个QTL)。两个重叠的RF qtl位于lg1上。在2015年和2016年分别鉴定出4个RP的qtl。共鉴定出5个AP qtl,其中3个位于LG 4上,另外2个位于LG 3和LG 7上。共鉴定出4个与FDP相关的qtl,其中1个位于LG 7,另外3个位于LG 4。鉴定出4个FFC qtl,其中2个位于lg3上,另外2个位于lg2和lg7上(表2)2,图53.).此外,大多数qtl都是在2015年和2016年确认的,并且在同一位置(表1)2,图53.).这些质量性状的位点在不同年份的稳定性证实了qtl的可靠性。
基于2015年和2016年桃果实贮藏期实测数据,分别检测了SSC和FA的动态qtl。在2015年和2016年,在LGs 1、4、5和6上共鉴定出18个SSC qtl。LG1上的10个qtl位于41.102 ~ 42.728 cM (pp01: 13177641)。15291518), 66.897 ~ 67.265厘米(Pp01: 24241572 . .24284070), 75.744 ~ 77.560厘米(Pp01: 25898412 . .26757867), 91.990 ~ 120.785厘米(Pp01: 29246116 . .42673647)。LG4上的两个qtl位于149.153 ~ 149.934 cM (Pp04: 28,137,742)。30186866)。LG5上的两个qtl位于27.451 ~ 30.996 cM (Pp05: 846,656)。 1,094,221). Four QTLs on LG6 were located at 29.965 ~ 37.885 cM (Pp06: 4,716,586.. 5,153,723) (Fig.3.,图53.).共检测到32个FA qtl,其中3个qtl位于LG1上,3个qtl位于LG2上,9个qtl位于LG4上,6个qtl位于LG5上,11个qtl位于LG6上。3.,图53.).
果实相关性状QTL区间的潜在候选基因
根据桃基因组物理位置的QTL区间,对12个果实相关性状的潜在候选基因进行了研究。对于SSC,在上述18个QTL区域中鉴定出540个带注释的候选基因(表5)1).这些候选基因参与了次生代谢物的生物合成、果糖和甘露糖代谢以及脂肪酸代谢等过程(图5)4).
对于FA,在32个QTL区域中检测到1232个注释基因(表5)1).这些候选基因集中在次生代谢物的生物合成、内质网的蛋白质加工、淀粉和蔗糖代谢、光合生物的碳固定和c5支链二酸代谢等过程中(图5)5).这些候选基因还包括可能与FA有关的atp -柠檬酸裂解酶、铝活化苹果酸转运蛋白、液泡质子atp酶和生长素外排载体家族蛋白等基因。此外,还鉴定出蔗糖转运蛋白2、udp -葡萄糖6-脱氢酶家族蛋白、6-磷酸葡萄糖醇内酯酶、果糖激酶样蛋白2、糖转运蛋白、果糖-2,6-二磷酸酶和葡萄糖-6-磷酸脱氢酶等可能与果实含糖量有关(表5)1).
在剩余的10个果实相关性状中,共检测到885个QTL区域上标注的候选基因,FW和FD候选基因130个(FW和FD候选基因完全重叠),PSC候选基因11个,EQ候选基因21个,RF候选基因186个,AP候选基因125个,RP 3个,FDP 6个,FV 401个,FFC 2个(表5)2).这些果实品质性状的候选基因在次生代谢途径中显著富集(图5)6- s9).此外,FW的候选基因还参与了内质网中氨基酸的生物合成和蛋白质加工(图5)6).FV的候选基因集中在碳代谢、柠檬酸循环(TCA循环)以及果糖和甘露糖代谢等过程中7).EQ的候选基因也在淀粉和蔗糖代谢等过程中富集(图5)8),而RFs富含ABC转运蛋白和苯丙类生物合成(图5)9).
SSC和FA候选基因的表达分析
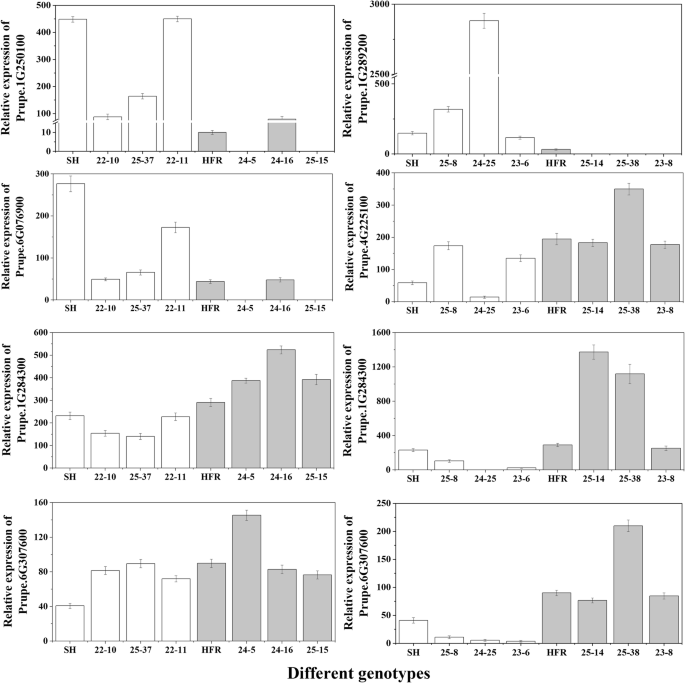
为了进一步确定候选基因与果实SSC和FA之间的关系,我们选择了6个候选基因,其中2个为SSC基因,4个为FA基因,对它们在亲本和具有代表性的后代中的表达进行了评估。在SSC性状中,HFR、24-5、24-16和25-15表现出高SSC,而SH、22-10、22-11和25-37表现出低SSC(图2)。4).qRT-PCR结果显示,Prupe.1G250100和Prupe.6G076900在成熟阶段SH和HFR存在显著差异。6个杂交种中Prupe.1G250100和Prupe.6G076900的表达量与SSC的变化呈负相关(图2)。5).Prupe.1G250100和Prupe.6G076900分别编码atp -柠檬酸裂解酶A-2和o -糖基水解酶家族17蛋白。
果实贮藏期间,SH、23-6、24-25和25-8的FA含量较高,而HFR、25-14、25-38和23-8的FA含量较低(图2)。4).Prupe.1G289200在SH和高FA子代中的表达高于HFR和低FA子代(图2)。5).成熟期低FA果实中Prupe.4G225100、Prupe.1G284300和Prupe.6G307600的表达量高于高FA果实(图2)。5).Prupe.1G289200、Prupe.1G284300、Prupe.4G225100和Prupe.6G307600分别编码6-磷酸葡萄糖醇内酯酶、udp -葡萄糖6-脱氢酶、ATPase H+转运V0亚基E (ATPase, V0复合物,亚基E)和葡萄糖-6-磷酸脱氢酶。由于Prupe.1G284300和Prupe.6G307600参与糖代谢途径,我们还检测了Prupe.1G284300和Prupe.6G307600在不同ssc的亲本和子代中的表达。结果表明,Prupe.1G284300的表达与果实SSC呈显著正相关(图2)。5).
讨论
桃高密度SNP遗传图谱
aflp、rapd、RFLPs、SSRs和SNPs等分子标记已广泛应用于桃的遗传图谱构建和QTL鉴定[j]。4,5,14,18]。以往构建的桃树连锁图谱主要使用aflp、rapd、RFLPs和SSRs标记;由于这些标记的可用性较低,导致地图密度不够高,相邻标记间隙较大[4,5,18,19,20.,21]。近年来,利用大量SNP标记构建高密度遗传图谱,筛选果实品质相关性状的qtl [j]。8,9,14,15]。SNP是植物基因组中最常见的遗传变异,是构建高密度遗传图谱、完成分子标记辅助育种的重要遗传标记[22,23]。下一代高通量测序技术最近促进了全基因组SNP标记的大规模发现。slf -seq是一种经济高效的SNP发现和基因分型技术,已应用于许多植物物种的遗传图谱构建和QTL检测[24,25,26,27,28,29]。此外,高密度SNP阵列还被用于果实性状的高通量基因分型、遗传图谱构建和全基因组关联研究[30.]。IPSC 9k SNP阵列已上市,用于桃子[31]。然而,该阵列较为昂贵,且阵列上的snp在桃树基因组中分布不均匀,某些基因组区域的相邻标记间隙高达1254 kb [31]。
本研究利用8个连锁群和7998个SLAF标记构建了桃树高密度遗传连锁图谱。该遗传图谱长度为1098.79 cM,平均距离为0.17 cM/标记。Dirlewanger et al.(1998)建立了覆盖712 cM的桃树图谱,标记对之间的平均密度为4.5 cM [32]。Blenda et al.(2007)发表了覆盖737cm桃基因组的151个AFLP和21个SSR标记图谱,平均标记间距为4.7 cM [33]。Pop-DG桃种内连锁图谱覆盖桃基因组818.2 cM,标记间平均间隔4.0 cM [34]。Martínez-García等(2013)构建了包含588个SNP标记的桃树图谱,图谱覆盖面积为454 cM,平均距离为0.81 cM/标记位点[8]。Nuñez-Lillo等(2015)构建了1830个snp和7个SSR标记的连锁图谱,分布在8个连锁组中,长度为389.2 cM,平均间隔为0.21 cM/对[3.]。Guo等人(2018)发表了一份包含1310个SNP标记的连锁图谱,标记距离为454.2 cM,平均标记距离为0.347 cM [9]。与已发表的连锁图谱相比,本研究构建的遗传群覆盖的遗传距离更长,标记密度更高。遗传图谱长度和密度的差异可能与亲本之间的遗传距离、标记的数量以及不同研究中使用的群体大小有关。标记数量和密度的增加可以提高QTL数量和定位精度[35,36]。实验结果表明,基于slf的SNP标记可高效构建高密度遗传图谱。
桃果实相关性状的qtl鉴定
果实品质是一种复合性状,由于果实品质性状的遗传控制具有多基因性,因此果实品质性状的育种是复杂的[37]。控制桃果实品质的qtl定位已被广泛报道[j]。7,8,38,39,40,41]。果重(FW)和果径(FD)是典型的多基因控制数量性状。FW的qtl连接到lg6 [10], [2,4,6]7], [2, 4, 5]42], 1, 4, 6, 7 [43]和LG 1,2,3,5,6,7 [44]。FD qtl出现在连锁组1、2、3和7 [42]。García-Gómez等人(2019)报道,在‘G × C’后代中,LG1上的FW和LG1和LG3上的果实直径最重要的qtl [16]。Cao等(2016)通过GWAS绘制了FW在每个支架上的关联区域[45]。我们在LG4、5和6上鉴定出FW和FD的qtl。QTL qP-FW4.1的区域1(Pp04: 15,082,371..16,710,388)接近FW-2010-15 (Pp04:17,625,270) [45]和FW标记SNP_IGA_410336 (pp04:10 665,019) [44];QTL qP-FW4.22(Pp04: 6316366 . .6,320,223)接近于FW-2010-12 (Pp04:8,634,341) [45];qP-FW5.12(Pp05: 7318892 . .7,816,084)接近SNP_IGA_574551(Pp05: 6,287,541) [41]、FW-2010-19 (Pp05: 9432987) [45];qP-FW6.12(Pp06: 28159465 . .28,159,465)接近FW-2010-21 (Pp06: 20,400,960) [45]。此外,我们的结果还显示,FW和FD的大部分qtl高度一致,这可能是由于果实重和果实直径之间存在显著的相关关系。
色素沉着(果皮和果肉颜色)是商品桃重要的果实品质性状。Verde et al.(2002)检测到2个果皮颜色qtl;一个QTL放置在lg2中,另一个放置在lg6中[46]。Eduardo et al.(2011)报道外部颜色(EC)的qtl位于LG 3,6,7 [7]。Frett (et et, 2014)检测到皮肤腮红的4个QTL: LG3上的一个主要QTL blush . pp . zc -3.1和lg4和7上的三个次要QTL (blush . pp . zc -4.1;blush.pp.zc - 4.2;blush.pp.zc - 7.1) [47]。最重要的qtl定位在LG3中,用于杏子的皮肤和果肉颜色(García-Gómez et al., 2019) [16]。在我们的研究中,PSC的qtl在LG 1、3、4和6中被鉴定出来。QTL qP-PSC3.1区域1(Pp03: 10648307 . .10,838,614)与腮红的主要QTL, blush . pp .ZC-3.1在腮红的LG3上重叠2SNP连锁图,位于支架3:4,8211,129 .13,891,040。然而,QTL qP-PSC4.1的位置1(Pp04: 19804890 . .19,842,35)与次要qtl不同blush.pp.zc - 4.1(scaffold _ 4: 2,337,191..3,966,620)和Blush.Pp.ZC-4.2 (scaffold _ 4: 4,306,550..5,226,293) [47]。此外,在本研究中,果肉红色(RF)和坑周围红色(RP)定位在Pp01: 24,39,147区域。26,479,742和Pp01: 26,671,055..LG1分别为27,176,678。Yamamoto et al.(2005)报道,在LG 3的中间绘制了石头周围的肉色[18]。Cao等人(2016)发现与结石周围肉色相关的SNP位于scaffold_6: 2,183,867, scaffold_8: 16,905,885,脚手架d_8: 16,795,565,脚手架_1:31,040,363,脚手架d_1:45,251,328 [45]。这些结果表明,桃果肉花青素含量的差异可能与多种基因有关。
果香对消费者来说很重要,因此是桃品种开发的重要目标。可溶性糖和酸是水果风味的重要组成部分。本研究在LG 1、3、4和5上分别鉴定出FV的qtl。QTL qP-FV1.2区域2(Pp01: 27653862 . .28,166,262)接近标记BPPCT020 (Pp01:34,255,110. 34,255,594),该标记与葡萄糖,山梨醇,总糖和可溶性固形物含量有关[48]。qP-FV4.11(Pp04: 15270537 . .17,635,472)与SSC-2007-14 (Pp04: 17,057,020)重叠[45]。qtl qP-FV5.1的区域1(Pp05: 638231 . .638,231)和qP-FV5.21(Pp05: 1499828 . .1499,831)与酸果和非酸果的D位点重叠(scaffold_5: 467,067. 2,270,122) [32]。fresnedo - ramyi ' rez等人(2015)和Boudehri等人(2009)也发现G5Flav基因座与D基因座相关[42,49]。QTL qP-FV5.11(Pp05: 638231 . .638,231)也与SNP_IGA_544640 (scaffold_5: 629,641)非常接近,显示出与水果可滴定酸度的最强关联[50]。
SSC的qtl先前已被报道与桃树LG1、2、4、5、6相关[10,12,38,46,51,52]。在杏中,García-Gómez等人(2019)找到了LG4中SSC最显著的qtl [16]。结果表明,SSC在LG1、lg4、lg5和lg6上均存在qtl。在LG1上,SSC的qtl区域(pp1:13,17,641.)15,291,518和Pp01: 24,241,572..24,284,070)非常接近SSC-2007-1 (Pp01: 15,691,351)和SSC-2007-4 (Pp01: 24,175,076)的报告位置[45]。然而,在其他连锁群中,我们检测到的ssc的QTL位置与其他研究者不同,如qSSC。V-Ch4-2010位于scaffold_4: 17,988,261 [38], QTLSSC-LG5位于Pp05:12,106,999。18240259年(49]和qSSC。6was located between the markers ss_629062 (7,918,349) and ss_630302 (12,571,791) on LG6 [42]。
对于果实的酸含量,控制果实“非酸”性状的D主基因位于lg5 (scaffold_5: 467,067. 2,270,122) [32]。此外,pH和可滴定酸度qtl位于D基因附近[10]。我们还在LG5上检测到了果实酸度含量(FA)的QTL位点(Pp05: 629,308)。677,913和Pp05: 846,656。1,140,022,与D位点一致。此外,我们还在LG1、lg4和lg6上检测到FA的qtl。Eduardo et al.(2011)报道FA和果实pH的qtl位于LG4 [7]。我们在LG6上检测到FA的QTL区域接近qTA6.1(7,550,351)。8,127,200)和qTA6.2(23,319,780..26118990) (18]。
根据Kruskal-Wallis检验,FDP在子代中呈非正态分布。在LG 1、2、3、4、5和6上检测到FDP的qtl [12,40,53]。Pirona et al.(2013)在标记M12a (Pp04:9,219,594)和BPPCT023 (Pp04: 14,731,772)之间定位了主要QTL qMD4.1 [53]。我们检测到5个FDP qtl,其中2个位于LG 7上,3个位于LG 4上。qP-FDF4.31(Pp04: 16,420,904)接近qMD4.1。
综上所述,虽然我们也发现了一些新的qtl,但大多数桃果品质性状的定位结果与前人的研究结果重叠或相似,表明这些基因组区域对桃果品质性状具有重要的控制作用。这些稳定的qtl在不同遗传群体中可作为优选定位、候选基因鉴定和标记辅助选择(MAS)的重点。
桃果实相关性状的候选基因
通过表型相关的数量性状位点(qtl)筛选和鉴定果实相关性状的候选基因。Eduardo等人(2013)发现了两个候选基因,编码两个推测的萜烯合成酶和一个脂氧合酶(Lox),它们分别参与芳樟醇和p- month -1-en-9-al和nonanal的生物合成[14]。Pirona et al. (2013)确定了南汽(ppa008301m)作为桃成熟日期控制候选基因的QTL分析[53]。PpYUC11和prupe . 6g1509001被鉴定为控制桃石硬表型的候选基因[9,54]。Nuñez-Lillo等人(2015)分别从QTL区域筛选了5个和9个成熟日期和粉度候选基因[3.]。曹等(2016;2019)根据桃子全基因组关联研究发现了大量控制农艺性状的候选基因[45,55]。Nuñez-Lillo等人(2019)鉴定了桃子可溶性固形物含量、成熟期和粉质性的候选基因[56]。Carrasco-Valenzuela等(2019)通过整合常规QTL和表达QTL (eQTL),鉴定了生长素生物合成途径中与果实软化速率相关的基因[17]。在杏中,鉴定出可溶性固体的候选基因(ppa001122m、ppa000854m和ppb001660m),它们与二糖和d -甘露糖结合以及转录因子有关MYB10被发现是决定肤色的最佳候选基因[16]。
在我们的研究中,鉴定出542个SSC注释基因,这些注释基因包括22个转录因子和一些与软化相关的细胞壁重塑降解基因,如果胶裂解酶样超家族蛋白、聚半乳糖醛酸酶、扩张蛋白和木糖基转移酶。Etienne et al.(2002)研究了果实发育过程中糖分积累与软化过程之间的关系[51]。然而,在这些候选基因中,没有一个基因被注释为参与糖转运或代谢。Cao et al.(2016)也得出了类似的结果[45]。然而,在FA的候选基因中,大量基因被注释为参与糖和酸的合成、代谢和运输等过程,如:葡萄糖-6-脱氢酶(Prupe.1G284300)、葡萄糖-6-磷酸脱氢酶(Prupe.6G307600)、果糖-2,6-双磷酸酶(Prupe.6G053800)、果糖样酶(Prupe.1G289300)、蔗糖转运蛋白(Prupe.1G271500)、糖转运蛋白(Prupe.2G024100)、V-ATPases (Prupe.4G225100)、蔗糖转运蛋白(Prupe.1G271500)、糖转运蛋白(Prupe.2G024100)。液泡质子atp酶(Prupe.6G092300)。udp -葡萄糖6-脱氢酶参与代谢淀粉和蔗糖的代谢途径[57]。葡萄糖-6-磷酸脱氢酶(G6PDH)已被证明可以控制伴随NADP还原为NADPH的葡萄糖-6-磷酸的不可逆脱氢[58]。qPCR结果显示,果实成熟期Prupe.1G284300和Prupe.6G307600在亲本和杂交种中的表达与SSC呈正相关,与FA呈负相关。这些数据表明,Prupe.1G284300和Prupe.6G307600可能参与了桃果实的糖和酸的形成。然而,候选基因在桃果实SSC和FA性状形成中的确切功能有待进一步研究。
利用基于slf的SNP标记构建了高密度遗传图谱,鉴定出大量果实品质性状的qtl和候选基因,特别是果实风味和食味品质性状。水果的味觉感知不仅受SSC和酸含量的影响。在我们的研究中,水果风味的qtl与大量的糖和酸度相关性状共存,涉及碳代谢、柠檬酸循环、果糖和甘露糖代谢、淀粉和蔗糖代谢等过程。内在品质的评价可以为水果品质的综合评价及其商业潜力提供原始数据[2]。这些结果对进一步了解桃内在品质的遗传机制具有重要意义,也可用于设计适当的育种策略,以提高商品桃品种的内在品质,对消费者具有重要意义。
结论
本研究基于slf -seq方法构建了桃树的高密度遗传图谱。该图谱全长1098.79 cM,相邻标记间平均距离0.17 cM,共定位了90个果实品质相关性状的qtl。从这些qtl对应的基因组区域,鉴定出大量控制果实品质性状的候选基因。水果风味的候选基因主要集中在柠檬酸盐、果糖、甘露糖和蔗糖的代谢和运输上。食用品质的候选基因在淀粉、蔗糖的合成和代谢中富集。对于SSC,候选基因参与果糖、甘露糖和脂肪酸的代谢。对于FA,候选基因与淀粉、蔗糖和c5支链二酸的代谢有关。根据qPCR结果,Prupe.1G284300和Prupe.6G307600可能参与桃果实糖和/或酸性性状的形成。为了提高桃果实品质性状的选择效率,可以基于重要候选基因的基因组序列,利用CAPS和/或dCAPS方法开发相应的分子标记。综上所述,本文研究的高密度遗传图谱、QTL和候选基因为桃果相关性状的标记辅助育种(MAS)提供了有用的信息,为进一步的QTL分析、图谱克隆和功能研究奠定了基础。
方法
植物材料
F1桃树群体202个个体由杂交而来碧桃简历。“沙红”(SH)和碧桃简历。使用“红芙蓉”(HFR)。SH于1999年被陕西省作物品种审定委员会认定。HFR于2000年被中国北京市作物品种审定委员会认定。课题组于2003年从中国农业科学院郑州果树研究所国家果树种质资源库引进SH和HFR。SH是“仓仓Wase”的芽突变,其特点是成熟时间早,果实重量中等,果皮部分着色,糖含量中等,酸度中等,粘石。HFR是由‘秋雨’和‘秀丰’杂交而成,其特点是成熟时间较晚,油桃果实中等重,果皮部分着色,含糖量高,酸度低,半无石粒。200株F1后代于2008年在苗圃中培育,次年春季在西北农林科技大学桃树实验示范站(33°59'N, 107°39'E)的田间自根种植(4 × 1.0 m)。亲本和杂交种在自然降雨条件下生长,不灌溉,每年春季施用氮磷钾肥。每年修剪一次,病虫害采用常规技术防治。在果核硬化前进行手工间伐,每棵树可装载60-90个果实。根据视觉颜色变化和吸光度差指数(IAD),在商业成熟时每棵树收获15个果实。选择IAD在0.8 ~ 1.5之间的水果[59]。此外,在F1选择12个基因型(22-10、22-11、23-6、23-8、24-5、24-16、24-25、25-8、25-14、25-15、25-37和25-38)进行qPCR分析。选择24-5、24-16和25-15可溶性固形物含量较高,而22-10、22-11和25-37可溶性固形物含量较低;23-6、24-25和25-8果实酸度较高,23-8、25-14和25-38果实酸度较低。
DNA提取、SLAF文库构建及测序
使用植物基因组DNA试剂盒(Tiangen,北京,中国)按照制造商的方案从幼叶中提取亲本和后代的基因组DNA。用1%琼脂糖凝胶和ND-1000分光光度计(NanoDrop, Wilmington, DE, USA)电泳检测DNA的浓度和质量。文库建设采用高通量测序的slf -seq策略。的参考基因组碧桃l.(http://www.ncbi.nlm.nih.gov/genome/388)选择限制性内切酶组合。Rsa我和有应用III (New England Biolabs, NEB, USA)消化每个样品的基因组DNA。被消化的片段在它们的3 '端加入单核苷酸A。测序接头的连接,PCR扩增,PCR产物的纯化和测序遵循制造商的建议,其中PCR片段从264到364 bp进行纯化,测序使用Illumina HiSeq™2500系统(Illumina Inc., San Diego, CA, USA)。
slf -seq数据分析和基因分型
SLAF标记的鉴定和基因分型参照Zhang等的方法。27,60]。简单地说,在过滤掉低质量的reads(质量评分< 20e)后,根据双工条形码序列对剩余的reads进行排序。利用SOAP软件将末端修剪为5bp的clean reads定位到桃源参考基因组上[61]。SLAF基因座的定义阈值为95%以上的序列一致性,每个SLAF基因座的等位基因由次要等位基因频率评估来定义。利用GATK软件(https://software.broadinstitute.org/gatk/best-practices/#variant-disco)及BWA (http://bio-bwa.sourceforge.net/),去除snp大于3个的slf。超过4个等位基因的slaf被定义为重复slaf并被丢弃。
根据亲本和子代SNP位点对所有SLAF多态性位点进行基因分型。利用HighMap软件对多态SLAFs的标记码进行分析,采用异花授粉群体型(两个杂合二倍体亲本杂交),该群体型由ab × cd、ef × eg、hk × hk、lm × ll和nn × np 5种分离型组成。然而,本文只对3种分离型(lm × ll、nn × np和hk × hk)进行了基因分型。为了保证遗传图谱的质量,使用以下规则对有效的基因座进行筛选。首先,将低深度基因型设为缺失,剔除每个位点缺失数据点超过10个的基因型。其次,进行卡方检验,和阈值P-value设置为0.01。lm × ll型和nn × np型的偏析比为1:1,hk × hk型的偏析比为1:2:1。最后,完整性低于70%的snp和多态性不同源的亲本标记以同样的方式处理。
果实相关性状的表型数据
2015年和2016年根据Frett et al.(2012)和Wang et al.(2005)的方法对桃果实品质性状进行了表型鉴定[62,63]。果实发育期(FDP)是指从开花到果实成熟的天数。果实重(FW)和果实直径(FD)是每棵树随机取10个果实样本的平均值。红色皮肤颜色的百分比(PSC)是对覆盖表面的视觉估计。果肉红(RF)和果核周围红(RP)分别通过视觉估计果肉和果核周围红的存在来确定,其评分为存在1分或不存在0分(表1)1).肉与坑的附着(AP)分为自由石(肉与坑完全分离)、半自由石(肉与坑部分分离)和粘石(肉与坑不分离)3.).食用品质(EQ)、果实风味(FV)和果实纤维含量(FFC)是通过9个育种家和每棵树至少10个成熟果实的品尝评估来确定的。EQ和FV在1到5的范围内进行定性测量,FFC在1到3的范围内进行测量(表1)3.).
测定可溶性固形物含量(SSC,平均糖度)和果实酸度含量(FA)的水果样品也在商业成熟时收集,保存在25±0.5°C,相对湿度为75-85%。贮藏期间每隔一天测定果实的SSC和FA(每次至少5个果实),直至平均硬度小于1 kg/cm2.用折光计(ATAGO,型号PAL-1)测量SSC,用水果酸度计(Korea,型号GMK-835F)测量FA。12个果实品质性状的表型标准化方法见表3..
连锁图谱构建及QTL分析
HighMap软件(http://highmap.biomarker.com.cn/.)用于链接图的构建[64]。将SLAF标记定位到桃源参考基因组,并划分为8个连锁群(LGs)。计算标记间的修正赔率对数(MLOD)评分,剔除评分低于5.0的SLAF标记。利用Kosambi作图函数计算cM的遗传距离。从共线性分析的角度评价连锁图的质量。地图图2.3 (https://www.wur.nl/en/show/Mapchart-2.30.htm)制作链接组图。
MapQTL6.0软件(https://www.kyazma.nl/index.php/mc.MapQTL/sc.Evaluate/)进行QTL定位。采用Kruskal-Wallis检验检测候选qtl (P值< 0.01)。此外,基于1000个排列检验,LOD分数大于0.99置信水平阈值的qtl被宣布为显著性。具有最高LOD分数的邻近相关基因座(P< 0.02)作为辅助因子进行多QTL模型分析。
候选基因的鉴定
利用定位相关标记在物理图谱上识别qtl的同源区域。qtl中对应的基因参照GDR桃基因组[65]。每个性状的qtl对应的基因被映射到KEGG数据库(fttp://)fttp.genome.jp/pub/kegg/pathway)进行kegg通路富集分析。KEGG术语与更正P值< 0.05被认为是显著富集。
实时定量PCR (qPCR)的RNA提取及基因表达分析
使用改良的PowerPlant®RNA分离试剂盒从桃肉中分离总RNA。用紫外分光光度计和琼脂糖凝胶电泳检测RNA的质量和完整性。使用PrimeScript RT Reagent Kit gDNA Eraser (Takara, Beijing, China)将总RNA转化为cDNA。
qPCR引物序列采用Beacon Designer 8.0软件设计(表5)3.).qPCR采用iQ5实时PCR系统(BioRad, Plano, TX, USA)。PCR在10 μl体积中完成,体积中含有1 μl cDNA,每个引物1 μl, ddH 2 μl2O和5 μl SYBR预混Ex Taq II (2×) (Takara)。qPCR程序如下:在95°C下1分钟,然后在95°C下15秒,60°C下20秒,72°C下20秒的40个循环。将混合样品加热至95℃10 s,冷却至65℃15 s。然后将样品以0.1°C/s的速率加热到95°C进行熔化曲线分析。以桃18S核糖体RNA (18S rRNA)作为内参基因。相对表达水平分析采用2−ΔΔCt方法。每个样品一式三份分析。
数据和材料的可用性
本研究期间的原始序列数据集可在序列读取档案(SRA)中获得,登录号为PRJNA612130 [https://www.ncbi.nlm.nih.gov/bioproject/PRJNA612130]。本研究过程中产生或分析的所有其他数据均包含在本文及其补充信息文件中。
缩写
- 弗兰克-威廉姆斯:
-
水果的重量
- FD:
-
水果直径
- PSC:
-
红色皮肤的百分比
- 情商:
-
食用品质
- 射频:
-
肉红
- 总机:
-
红色围坑
- 记者:
-
坑的粘附性
- 自由:
-
果实发育期
- 阵线:
-
水果的味道
- FFC:
-
水果纤维含量
- SSC:
-
可溶性固形物含量
- 费尔南多-阿隆索:
-
果酸含量
- 即时通讯:
-
区间映射
- 统一民族运动党:
-
多QTL模型
- cM:
-
厘摩
- 格林:
-
连锁群
- 装备:
-
染色体
- LOD:
-
概率对数
- QTL:
-
数量性状位点
- 妊娠:
-
扩增片段长度多态性
- RAPD:
-
随机扩增多态性DNA
- RFLP:
-
限制性片段长度多态性
- 苏维埃社会主义共和国:
-
简单序列重复
- SLAF-seq:
-
特定位点扩增片段测序
- SNP:
-
单核苷酸多态性
参考文献
王晓明,王晓明,王晓明,等。桃(Prunus persica)高质量基因组草图鉴定了遗传多样性、驯化和基因组进化的独特模式。植物学报,2013,45(5):487-94。
以品质为导向的水果育种:桃(碧桃(l)蟠桃。粮食农业环境学报,2008;6(2):342-56。
刘建军,刘建军,刘建军,等。桃粉性和成熟期相关候选基因的鉴定[j]。碧桃(l)使用QTL分析和深度测序。树基因基因组。2015;11(4):86。
张建军,张建军,李建军,等。桃形态同工酶和Rapd标记的定位与连锁分析。理论与应用,1994;87(7):805-15。
张建军,张建军,张建军,等。利用AFLP和RFLP标记构建桃树[Prunus Persica (L.]用于标记辅助选择。植物学报。1998;41(4):61-8。
李建军,李建军,李建军,等。桃(Prunus persica (L.))第二代遗传连锁图谱的建立影响花和果实的形态特征。树基因基因组。2006;3(1):1 - 13。
Eduardo I, Pacheco I, chitera G, Bassi D, Pozzi C, Vecchietti A,等。两个桃种内群体果实品质性状的QTL分析及成熟期多效效应的重要性。树基因基因组。2011;7(2):323-35。
Martinez-Garcia PJ, Parfitt DE, Ogundiwin EA, Fass J, Chan HM, Ahmad R,等。桃果实品质性状的高密度SNP定位与QTL分析。树基因基因组。2013,9(1):19-36。
郭绍林,伊克巴尔森,马荣军,宋军,于明林,高铮。基于限制性位点相关DNA测序的桃石硬表型高密度遗传图谱构建及数量性状位点分析。生物医学工程学报,2018;19(1):612。
Dirlewanger E.桃果实品质控制qtl定位(碧桃(l)蟠桃。理论与应用遗传学1999;98(1): 18-31。
陈建军,陈建军,陈建军,等。基于家系分析的4个桃品种果实大小和重量的QTL定位及育种价值评估。树基因基因组。2016;12(2):25。
Hernandez Mora JR, Micheletti D, Bink M, Van de Weg E, Cantin C, Nazzicari N,等。桃多代关键育种性状的综合QTL检测。生物医学工程学报,2017;18(1):404。
Sanchez G, Martinez J, Romeu J, Garcia J, Monforte AJ, Badenes ML,等。桃树挥发油的模块化反映在QTL定位群体的遗传和环境响应水平上。植物学报,2014;14(1):137。
Eduardo I, Chietera G, Pirona R, Pacheco I, Troggio M, Banchi E,等。桃果精油香气挥发性化合物的遗传解剖:QTL分析和候选基因的密集SNP图谱鉴定。基因学报,2013;9(1):189-204。
Bielenberg DG, rah B, Fan SH, Gasic K, Abbott AG, Reighard GL,等。基于snp连锁图谱构建的序列分型及桃树需寒和开花日期的QTL分析[j]碧桃(l)类等)。科学通报,2015;10(10):e0139406。
García-Gómez BE, Salazar JA, Dondini L, Martínez-Gómez P, Ruiz D.杏果实品质性状qtl的鉴定(李属armeniacaL.),并通过qPCR进行基因表达分析进行生物学验证。动物学报,2019;39(2):28。
Carrasco-Valenzuela T, Muñoz-Espinoza C, Riveros A, Pedreschi R, Arús P, Campos-Vargas R,等。表达QTL (eQTLs)分析揭示桃子果肉软化速率相关候选基因[j]。碧桃(l)类等)。植物科学,2019;10:1581。
山本涛,山口M, Hayashi T.利用SSR、STS、AFLP和RAPD构建桃树遗传连锁图谱。植物生理学报,2005;39(3):394 - 394。
卢志祥,Sosinski B, Reighard GL, Baird WV, Abbott AG。桃砧木抗根结线虫遗传连锁图谱的构建及AFLP标记的鉴定。基因组。1998;41(2):199 - 207。
李建军,李建军,李建军,等。桃果实成熟期性状的遗传标记[j]。类等)。植物学报,2010;35(1):391 - 391。
张建军,张建军,张建军,等。RFLP分析在桃子遗传连锁定位中的应用。Hortscience。1992;27(2):160 - 3。
陈宏,谢伟,何宏,于宏,陈伟,李军,等。用于水稻生物学和分子育种的高密度SNP基因分型阵列。植物学报,2014;7(3):541-53。
吴健,李立林,李敏,可汗马,李晓光,陈华,等。利用SNP和SSR标记构建梨果实相关qtl的高密度遗传连锁图谱及鉴定。实验学报,2014;65(20):5771-81。
张军,张启祥,程天荣,杨文荣,潘海涛,钟建军,等。观赏木本植物梅李(Prunus mume Sieb)抽泣性状控制位点的高密度遗传图谱构建与鉴定。调查)。DNA学报,2015;22(3):183-91。
张云云,王丽华,辛海虹,李德华,马彩霞,丁霞,等。基于特定长度扩增片段(SLAF)测序大规模标记开发的高密度芝麻遗传图谱构建。植物生理学报,2013;13(1):1 - 4。
张震,尚华,石毅,黄磊,李军,葛强,等。特异位点扩增片段测序(SLAF-seq)高密度遗传图谱的构建及其在棉花铃重数量性状位点(QTL)分析中的应用(陆地棉)。植物学报,2016;16(1):79。
张健,张强,程涛,杨伟,潘华,钟健,等。观赏木本植物梅李(Prunus mume Sieb)抽泣性状控制位点的高密度遗传图谱构建与鉴定。调查)。DNA学报,2015;22(3):183-91。
何永勇,袁文杰,董明明,韩玉军,尚福德。首个桂花基因图谱(桂花Lour.)使用特定位点扩增片段测序。植物科学,2017;8:1621。
尚建林,李宁,李宁宁,徐云云,马思文,王建民。基于特异长度扩增片段测序(slf -seq)大规模SNP发现的西瓜高密度遗传图谱构建Sci Hortic-Amsterdam。2016; 203:38-46。
李翔,辛格杰,秦敏,李生,张翔,张敏,等。200K SNP基因分型阵列的开发及其在梨遗传定位、基因组组装改进和全基因组关联研究中的应用植物学报。2019;17(8):1582 - 1594。
Verde I, Bassil N, Scalabrin S, Gilmore B, Lawley CT, Gasic K,等。桃源9K SNP阵列的研制与评价及种质资源SNP检测与验证科学通报,2012;7(4):362 - 362。
Dirlewanger E, Pronier V, Parvery C, Rothan C, Guye A, Monet R.桃树遗传连锁图谱[l]使用形态和分子标记。理论与应用,1998;97(5-6):888-95。
Blenda AV, Verde I, Georgi LL, Reighard GL, Forrest SD, Munoz-Torres M,等。桃树砧木对桃树短寿命综合征的遗传连锁图谱构建及分子标记鉴定。植物基因组学。2007;3(4):341-50。
Ogundiwin EA, Peace CP, Gradziel TM, Parfitt DE, Bliss FA, Crisosto CH.李树果实品质基因图谱。生物医学工程学报,2009;10(1):587。
李立林,张军,黄磊,韩峰,严生,王磊,等。基于特定长度扩增片段测序(SLAF-seq)大尺度标记的高密度遗传图谱构建及其在大豆异黄酮含量QTL分析中的应用大豆。BMC基因组学。2014; 15(1): 1086。
王福荣,张建新,陈勇,张云云,龚建伟,宋志强,等。棉花纤维相关关键qtl候选基因的鉴定及巴氏棉基因渐渗重组自交系有利等位基因的衍生植物学报,2010;18(3):707 - 708。
Lambert P, Campoy JA, Mauroux J-B, Rossini L, Aranzana MJ, Patocchi EDA,等。桃6个主要基因紧密相关SNP标记的鉴定[j]Batsch]使用高密度SNP阵列,目的是标记辅助选择(MAS)。树基因基因组,2016;4(4):647-661。
zzeballos JL, Abidi W, Gimenez R, Monforte AJ, Moreno MA, Gogorcena .桃果实品质性状相关qtl定位[j]。碧桃(l)使用SNP图谱。树基因基因组。2016;12(3):1-17。
李建军,李建军,李建军,等。桃果实品质性状的QTL分析[j]碧桃(l)使用密集的SNP图谱。1984年国际桃子研讨会。2013年,703 - 10。
Dirlewanger E, Cardinet G, Boudehri K, Renaud C, Monllor S, Illa E,等。欧洲ISAFRUIT项目桃主要果实品质成分的qtl检测。植物学报,2009;8:533 - 38。
Quilot B, Kervella J, Genard M, Lescourret F.利用生态生理模型和QTL方法分析桃果品质的遗传控制。[J] .中国生物医学工程学报,2009;31(4):893 - 893。
Fresnedo-Ramirez J, Bink MCAM, van de Weg E, Famula TR, Crisosto CH, Frett TJ,等。桃及近缘种育种种质果实性状的QTL定位。动物学报,2015;35(8):166。
Desnoues E, Baldazzi V, Genard M, Mauroux JB, Lambert P, conent C,等。糖和酶活性的动态qtl为桃果实发育过程中糖代谢的遗传调控提供了综述。实验学报,2016;67(11):3419-31。
da Silva LC, Bassi D, Bianco L, Pacheco I, Pirona R, Rossini L. F2桃果实重量和大小的遗传分析碧桃(l)蟠桃后代。动物学报,2015;35(2):71。
曹凯,周志康,王强,郭健,赵鹏,朱光荣,等。桃12个农艺性状的全基因组关联研究。学报,2016;7(1):1 - 10。
Verde I, Quarta R, Cedrola C,等。BC1桃群体农艺性状的QTL分析。植物学报。2002;592:291-7。
傅丽娟,李春华,王晓明,等。桃树红晕相关性状位点的定位[j]。类等)。树基因基因组,2014,10(2):367-81。
沈志军,马荣军,于明林,蔡志祥,徐建林。利用油桃与扁平油桃的杂交群体定位控制桃子风味品质的qtl。园艺学报,2010;37(11):1735-44。
Boudehri K, Bendahmane A, Cardinet G, Troadec C, Moing A, Dirlewanger E.桃果实酸度控制位点D的表型和精细遗传特征。植物学报,2009;9(1):59。
Micheletti D, Dettori MT, Micali S, Aramini V, Pacheco I, Linge CD,等。桃种质资源多样性及snp主基因关联的全基因组分析。科学通报,2015;10(9):e0136803。
艾蒂安·C, Rothan C, Moing A, Plomion C, Bodenes C, Svanella-Dumas L,等。桃糖和有机酸含量的候选基因和qtl [Prunus persica (L.)]类等)。理论与应用,2002;35(1):145-59。
Quilot B, Wu BH, Kervella J, Genard M, Foulongne M, Moreau K.桃李品种与野生近缘种P-davidiana高级回交品质性状的QTL分析。理论与应用,2004;109(4):884-97。
Pirona R, Eduardo I, Pacheco I, Linge CD, Miculan M, Verde I,等。桃成熟日期主要控制位点候选基因的精细定位与鉴定。植物学报,2013;13(1):166。
潘磊,曾伟,牛磊,陆志,刘宏,崔刚,等。PpYUC11是桃树石硬表型的强候选基因,参与果实成熟过程中IAA的生物合成。实验学报,2015;66(22):7031-44。
曹凯,李勇,邓超,Gardiner SE,朱刚,方伟,等。比较群体基因组学鉴定了桃果实驯化性状相关的基因组区域和候选基因。植物学报;2019;17(10): 1954 - 70。
Nunez-Lillo G, Balladares C, Pavez C, Urra C, Sanhueza D, Vendramin E,等。桃可溶性固形物含量、成熟期和粉度的高密度遗传图谱及QTL分析。Sci Hortic-Amsterdam。2019; 257:108734。
薛平平,McIntyre CL, Jenkins CL, Glassop D, van Herwaarden AF, Shorter R.小麦茎部水溶性碳水化合物代谢变化的分子分析。植物生理学报,2008;36(2):441 - 454。
孔文峰,陈建勇,侯志祥,温鹏飞,詹锦江,潘qh,等。桃果实葡萄糖-6-磷酸脱氢酶活性及亚细胞定位。植物生理学报,2009;32(1):1 - 4。
卢里·S,弗里德曼H, Weksler A, Dagar A, Eccher Zerbini P.早熟和晚熟桃子采收成熟度评价及软化预测。中国生物医学工程学报,2013;36(6):1010 - 106。
孙旭,刘东,张旭,李伟,刘宏,洪伟,等。slf -seq:一种大规模从头发现SNP和使用高通量测序进行基因分型的有效方法。科学通报,2013;8(3):583 - 587。
李荣强,李彦彦,Kristiansen K,王军。SOAP:短寡核苷酸比对程序。生物信息学。2008;24(5): 713 - 14所示。
Frett TJ, Gasic K, Clark JR, Byrne D, Gradziel T, Crisosto C.桃果实品质的标准化表型分析。碧桃(l)蟠桃。中国生物医学工程学报,2012;33(4):391 - 391。
王磊,朱刚,方文武,马荣,于敏,蒋强,等。桃的描述词和数据标准。北京:中国农业出版社;2005.
刘东,马超,洪伟,黄磊,刘明,刘宏,等。利用高通量测序数据构建和分析高密度连锁图谱。科学通报,2014;9(6):98855。
Verde I, Jenkins J, Dondini L, Micali S, Pagliarani G, Vendramin E,等。桃子2.0版本:高分辨率的连锁图谱和深度重测序改善了染色体尺度的组装和连续性。生物医学工程学报,2017;18(1):225。
致谢
感谢李福瑞和赵磊在样品采集方面的协助。
资金
国家重点研发计划项目(批准号:2019YFD1000200)和陕西省重点研发计划项目(批准号:2018NY-048)资助。资助者不参与研究的设计、数据的收集、分析和解释,也不参与撰写论文。
作者信息
从属关系
贡献
PS进行了所有实验和数据分析。CPZ, MYH, LBX, JJM和DZ分析结果并修改稿件。PS、ZX、SYZ、XJW、XFM和JCZ对14个果实相关性状进行表型分型。作者们阅读并批准了最后的手稿。
相应的作者
道德声明
伦理批准并同意参与
不适用。
发表同意书
不适用。
相互竞争的利益
作者声明他们没有利益冲突。
额外的信息
出版商的注意
施普林格·自然对已出版的地图和机构关系中的管辖权要求保持中立。
补充信息
附加文件1图S1
.SNP标记构建遗传图谱。黑色条表示SLAF标记。x轴为连锁群数,y轴为遗传距离,单位为厘根。
附加文件2图S2
.遗传图谱上标记位置与桃树基因组共线性分析。x轴表示每个桃树LG的遗传距离,y轴表示LG的物理长度。地图上的标记用圆点表示。
附加文件3图S3
.果实相关性状的QTL定位。连锁组、遗传距离(以厘米器官为单位)和标记名称分别显示在每个连锁组的上方、左侧和右侧。利用地图软件绘制不同RGB颜色的qtl,用不同的颜色来识别不同的性状。qtl由位于每个连锁组右侧的块状竖条表示。细线对应LOD-2,黑柱对应LOD-1置信区间。
附加文件4图S4
果实可溶性固形物含量候选基因的KEGG途径富集分析。
附加文件5图5
果实酸度候选基因KEGG通路富集分析。
附加文件6图6
果实重候选基因的KEGG途径富集分析。
附加文件7图7
水果风味候选基因的KEGG途径富集分析。
附加文件8图8
水果食性品质候选基因KEGG通路富集分析。
附加文件9图9
果肉红色候选基因KEGG通路富集分析。
附加文件10表S1
.果实可溶性固形物含量(SSC)和酸含量(FA)相关的候选基因。
附加文件11表S2
.候选基因与果实品质性状有关,包括果实重量、果实直径、果实发育周期、果皮红色百分比、果实食用品质、果实风味、果肉红色、果核周围红色、果核粘附性和果实纤维含量。
附加文件12表S3
.本研究使用的引物列表。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,该协议允许以任何媒介或格式使用、共享、改编、分发和复制,只要您适当地注明原作者和来源,提供知识共享许可协议的链接,并注明是否进行了更改。本文中的图像或其他第三方材料包含在文章的知识共享许可协议中,除非在材料的署名中另有说明。如果材料未包含在文章的知识共享许可中,并且您的预期用途不被法律法规允许或超过允许的用途,您将需要直接获得版权所有者的许可。如欲查阅本许可证副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域免责声明(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非在数据的信用额度中另有说明。
关于本文
引用本文
史鹏,徐忠,张绍平,张志强。et al。桃高密度snp遗传图谱的构建及果实相关qtl和候选基因的鉴定[j]。碧桃(l)类等)。BMC Plant Biol20.438(2020)。https://doi.org/10.1186/s12870-020-02557-3
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12870-020-02557-3
关键字
- SNP-based地图
- 桃子
- SLAF
- QTL
- 果实品质相关性状