抽象的
背景
乙醛酸还原酶(glyoxylate reductase, GR)多基因家族已经在不同植物中得到了描述,其亚型在植物中表现出不同的生化特征。然而,很少研究阐明GR同工酶的生物学作用,特别是对水稻。
结果
本文报道了OsGR1和OsGR2在水稻中的酶学特性和生理作用。结果表明:两种酶均偏好NADPH而非NADH作为辅助因子,且NADPH依赖性的乙醛酸还原活性是各组织和不同生长期GR活性的主要来源;OsGR1蛋白含量高于OsGR2蛋白,OsGR1蛋白也是GR活性的主要来源。通过生成和表征各种OsGR- 预测稻米,包括过表达,单一和双敲除线,我们发现在正常生长条件下各种转基因系中没有发生表型差异,而在光源促进的条件下被注意到矮化生长表型。
结论
我们的结果表明,具有不同酶促特性的OSGR1和OSGR2,在正常生长条件下冗余的酶促特征冗余地冗余,而两者则在高光荧光条件下同时需要。
背景
植物乙醛酸还原酶(GR;EC 1.1.1.26/79)是醛类代谢的关键酶,以NAD(P) H为辅助因子,催化乙醛酸和琥珀酸半醛(SSA)还原成乙醇酸和γ-羟基丁酸[1,2].GR活性首先在菠菜叶粗提物中检测到。随后,成功地从烟草和菠菜叶中纯化GR;两者都倾向于NADPH而不是NADH作为辅助因子[3.,4,5].后来,分子鉴定了两个GR同工酶拟南芥,进一步分析证实AtGR1 (At3g25530)定位于细胞质,而AtGR2 (At1g17650)定位于质体和线粒体[6].近年来,以NADPH为辅助因子,研究了苹果、水稻和水稻GR同工酶的催化特性A.thaliana分析表明乙醛酸(K米= 19.1 ~ 53.2 μM)优于SSA (K米= 870 ~ 8960 μM)作为所有GR亚型的底物[6,7].
以前的证据发现表达的表达GR基因在非生物胁迫(如盐度、干旱和淹没)下上调,并伴随着γ-羟基丁酸的积累,表明GR参与了SSA在非生物胁迫下的解毒[8,9].Zarei等。[7[是否存在在外源甲氧苯胺酯的存在下,AtGR与野生型(WT)相比,-RNAi系对低温胁迫更敏感AtGR-overexcression线进一步支持Atgrs催化催化的糖氧化合物还原与应力阻力密切相关A. Thaliana..值得注意的是,乙醛酸生产的一个主要来源是植物的光呼吸代谢,其中乙醇酸被乙醇酸氧化酶(GLO)氧化为乙醛酸[10,11,12].一般而言,光呼吸乙醛酸可以通过过氧化物酶体中的丝氨酸:乙醛酸转氨酶和谷氨酸:乙醛酸转氨酶快速解毒,但一直认为光呼吸促进条件下过氧化物酶体泄漏的乙醛酸需要GRs清除[10,11,13].然而,迄今为止还没有分子遗传学证据来证明这一观点。此外,乙醛酸是植物中草酸盐生物合成的有效前体[14]据报道,草酸盐,包括重金属排毒,离子平衡,病原体防御和组织支持的各种功能[15,16].有人注意到,草酸盐法不一定取决于光孔率[14,17,这可能是由于参与乙醛酸调节的其他一些衰老途径[7,14,18,19].因此,来自乙醛酸盐的草酸盐也可能以复杂的方式调节,并且尚未报告GR是否介导含甘油酯依赖性草酸盐积累的调节。
迄今为止,GR在各种植物物种中鉴定基因[20.],但只有GR亚型来自A.thaliana分子和生物化学表征[6,20.].GRS的功能和机制仍然很大程度上是未知的,特别是在作物植物中的体内角色的研究尤其很少。通过用序列进行爆炸Atg1.和atg2.,两个GR在水稻基因组中鉴定出了同源物(即。OSGR1.-os02g0562700和OSGR2.-os01g0574600)。这里,为了了解与乙醛酸代谢相关的催化性质和生理作用,OSGR1和OSGR2生物化学和遗传研究。结果表明,在细胞溶溶胶或叶绿体中局部化的两种OSGR同工酶具有明显的生化和酶特性。此外,我们为两者产生了各种遗传修饰的稻米线OsGR基因。单次或双次没有发现表型差异OsGR在正常的自然条件下突变体甚至在高光源条件下观察到单突变体的均匀差异,而仅注意到发育不良的生长OSGR1 / OSGR2.高光呼吸条件下的双突变体。综上所述,我们的研究结果表明,这两个OsGR亚型具有不同的酶学特性,在水稻高光呼吸条件下,它们在功能上是冗余的,但同时也是必需的。
结果
OsGR1和OsGR2的表达模式和亚细胞定位
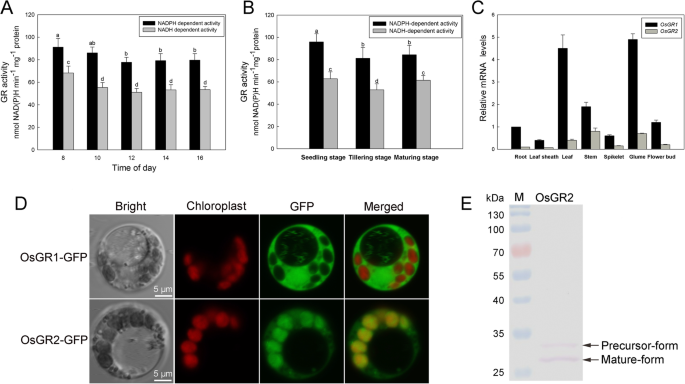
到目前为止,Atg1.和atg2.是所有研究中最广泛的吗GRs来自不同的植物[6,8,9].水稻基因组包含两个GR同源染色体:OSGR1.位于2染色体上,OSGR2.在1号染色体上。之间的相似性OSGR1.,OSGR2.,Atg1.和atg2.(Table1,附加文件1).OsGR1和OsGR2均可能使用NAD(P)H作为辅助因子,因此我们分别检测了水稻叶片NAD(P)H依赖的GR总活性。nadh依赖的活性远远高于nadh依赖的活性,两者都表现出全天的波动(图1)。1a). GR活性在不同生长期存在差异,在营养旺盛期最高(图5)。1b).两者的文本丰度OsGR通过实时定量PCR(QRT-PCR)测定基因。如图1所示。1c,OSGR1.显示出更高的转录水平OSGR2.在所有的器官中测试过。而且,OSGR1.在叶子和灌注中丰富,在其他器官中均表达,而OSGR2.主要用叶子护套,灌溉和叶子表示。蛋白质组学数据表明,OSGR1至OSGR2的蛋白质丰度比在叶子中的1.2至1.4范围为1.2〜1.4(表2).结果表明,OsGR1和OsGR2广泛分布于水稻光自养组织中,其nadph依赖活性主要贡献于水稻总GR活性。
OsGR亚型的表达模式和亚细胞定位。一个水稻NAD(P) h依赖GR活性的日变化顶部第二片叶在5叶期从水稻植株上脱落。b水稻不同发育阶段NAD(P) h依赖的GR活性为了确定,从上面开始的第二片叶子被分离了。cmRNA转录本丰度OSGR1.和OSGR2.采用qRT-PCR方法检测不同组织中细胞的数量。绘制各组织相对mRNA水平OSGR1.根中mRNA水平为1。数值为3次重复的平均值±SD。相同的字母表示的平均值没有显著差异P根据Duncan的多重范围试验< 0.05。dOsGR1和OsGR2的亚细胞定位。OsGR-GFP融合构建物在水稻原生质体中瞬时表达,转染14-16 h后在共聚焦显微镜下对细胞进行成像。红色信号代表叶绿素自身荧光。结果代表了三个独立的实验。比例尺,5 μm。e从OsGR2-GFP转化的原生质体中提取的蛋白用单克隆抗gfp抗体进行western blot分析。pre -form是OsGR2-GFP的前体蛋白,其n端CTP在胞浆中合成;Mature-form是位于叶绿体中,n端CTP被裂解的OsGR2-GFP。结果代表了三个独立的实验
OsGR1和OsGR2的亚细胞定位首先由WoLF PSORT和Plant-mPLoc预测[21,22],结果OSGR1可以是细胞质蛋白和可能位于叶绿体中的OSGR2。为了通过实验证明,在水稻原生质体中瞬时表达与绿色荧光蛋白(GFP)融合的预测,OSGR1和OSGR2。如图1所示。1D,观察到OSGR1-GFP以定位在胞质溶胶中,而OSGR2-GFP在叶绿体中。通常,叶绿体蛋白在Cytosol中合成,用N-末端叶绿体过渡肽(CTP)连接为前体形式;前体形式通过CTP引导到叶绿体中,然后在进口到叶绿体后被蛋白水解除去[23,24].从瞬时表达OsGR2-GFP的水稻原生质体中提取的蛋白质用于抗gfp抗体的western blot检测。结果显示,大量的OsGR2-GFP蛋白是不含CTP的成熟形态(图5)。1e),进一步证明OsGR2定位于叶绿体。
OsGR1和OsGR2的酶学特性
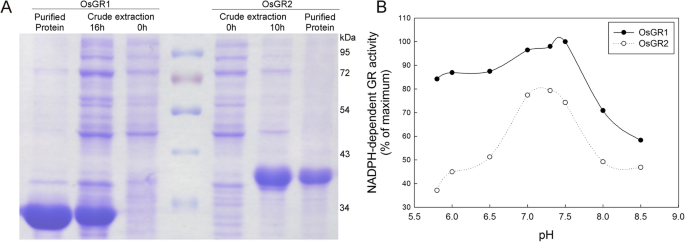
OsGR同工酶的酶学性质研究较少。最近对OsGR1和OsGR2的NADPH动力学进行了初步研究[7].为了进一步探索OsGR1和OsGR2的功能,我们比较分析了两个OsGR亚型的乙醛酸依赖的酶学差异。一个6 × his标签被融合到一个全长OSGR1.和一个截断的OSGR2.序列(没有n末端CTP),那么这些OsGR将序列克隆到pcoldiv载体中并表达E.coli..随后从中纯化OSGR1和OSGR2蛋白质E.coli.通过HIS-TAG亲和层析的粗提物。SDS-PAGE分析表明,OSGR1和OSGR2亚基的分子量分别为约30kDa和37kDa(图。2一种);对于OSGR1和OSGR2,观察到类似的最佳pH值为7.0-7.5(图。2b)。动力学分析在生理温度(30℃)和pH7.4处进行。如表所示3., OsGR1和OsGR2对NADPH的亲和力远高于对NADH的亲和力。的glyoxylate-linkedK米(NADPH)OsGR1和OsGR2的值分别为17.6和53 μMK米(NADH)值分别为420.2和403.9 μM。同时测定了两种OsGRs与乙醛酸的NAD(P) h依赖动力学。的NADPH-linkedK米(乙醛酸)OSGR1和OSGR2的值为30.4和72.1μm,并且NADH连接K米(乙醛酸)值为267.7和144.6μm(表3.), 分别。此外,这V马克斯与NAD(P)H高于OSGR2的OSGR1。值得注意的是,甘油酯是植物中草酸盐生物合成的有效前体,水稻叶片含有高水平的草酸盐,范围为25至120 mm [14,17,25].因此,我们测试了草酸盐对OSGRS催化的乙醛酸还原的反馈效果。如表所示4,当使用NADPH作为辅助因子时K我OSGR1的草酸盐的值为21.2mm,对于OSGR2为290.8mm。当使用NADH作为辅助因子时,K我草酸值则低得多,OsGR1为3.6 mM, OsGR2为8.2 mM。以上结果表明,OsGR1和OsGR2对乙醛酸具有较高的亲和力,且两者都倾向于NADPH作为辅助因子,NADH依赖的活性对草酸抑制的敏感性远高于NADPH依赖的活性。
描述的OsGR基因改造植物
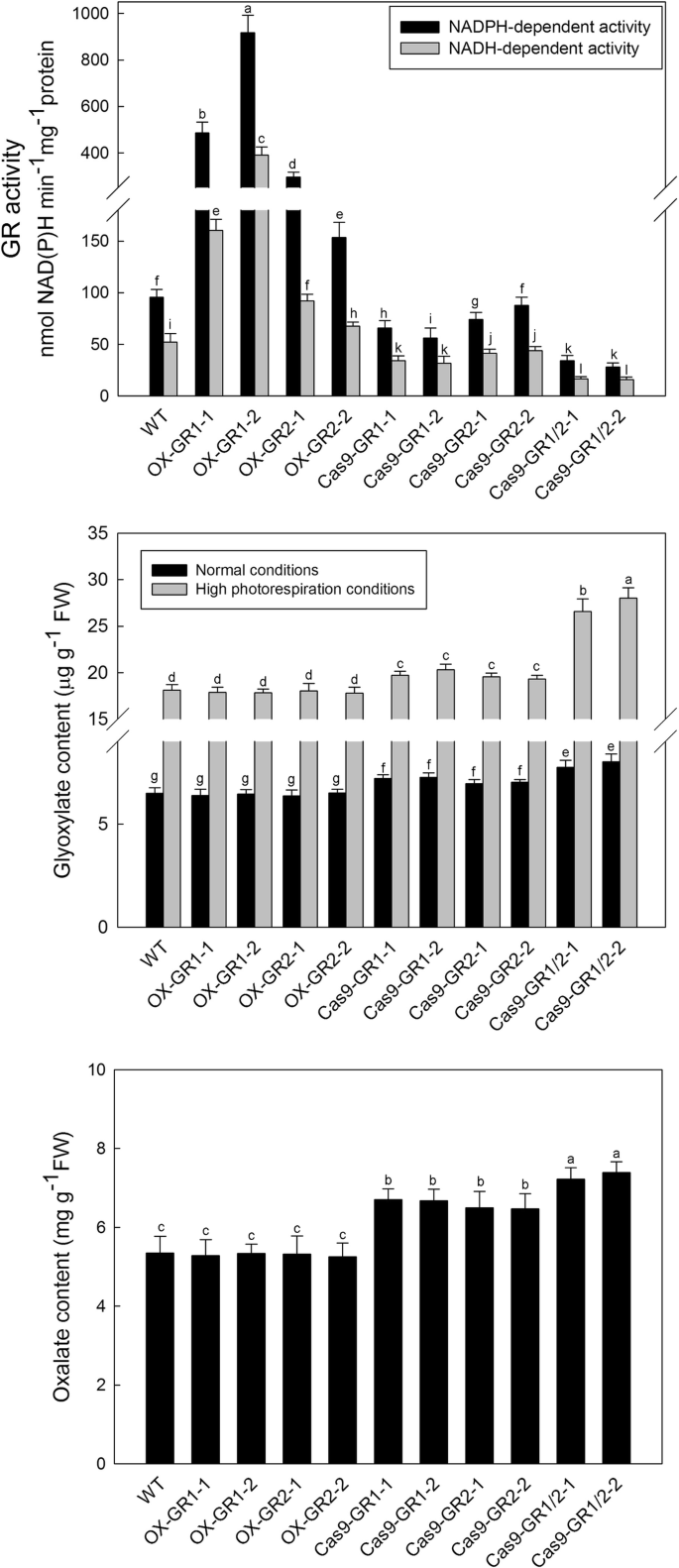
到目前为止,可以在OSGR同种型的生物学作用上找到很少的数据,特别是对于米饭。在这项研究中,开放阅读框架OSGR1.和OSGR2.被用来构建OsGR敲除系采用CRISPR-Cas9系统生成,T2杂合子系在这里进行分析。果然,在树叶中OsGR-overexpression(牛-OsGR)行OsGR基因在mRNA水平上上调(附加文件2),相应地,GR活动升高了5-8倍-OsGR1线和1 - 3折叠在OX-OsGR2线条(图。3.时)。OSGR1.和OSGR2.使用pYLCRISPR/Cas9系统(其他文件2和3.),叶片GR活性分别降低35-45%和20-25%OSGR1.和OSGR2.表明OsGR1是GR总活性的主要贡献者(图。3.一种)。在里面OSGR1./OSGR2.双突变体,GR活性均以60-75%跌幅(图。3.a).残留活性可能来自一些其他的酶,如羟丙酮酸还原酶(HPR),被报道为减少乙醛酸的副反应[5,26].随后,分析了这些遗传修饰的水稻线中的乙醛水平。在正常生长条件下,WT的乙醛酸含量约为6.5μgg−1FW,增加0.4 ~ 0.8 μg g−1fw in.OSGR1.和OSGR2.敲除突变体,1.2-1.5μgg−1fw in.OSGR1 / OSGR2.而OX-突变体中乙醛酸含量无明显下降OsGR线条(图。3.b)。此外,所有植物在高光荧光条件下累积了更多的甲氧化物,WT增加到约18.0μgg−1弗兰克-威廉姆斯,OSGR1 / OSGR2.双突变体高达28.0 μg g−1弗兰克-威廉姆斯(无花果。3.b)。此外,测量了这些稻米在正常生长条件下这些稻米的草酸水平。草酸盐含量增加了20%至25%OSGR1.和OSGR2.单个敲除突变体,在30 - 40%之间OSGR1 / OSGR2.双突变体(无花果。3.C)。两者中没有观察到变化 -OSGR1.和牛OSGR2.线条(图。3.C)。
OsGR亚型在体内的催化特性。一个nad(p)H依赖性乙醛化合物在不同的情况下减少活性OsGR- 预测植物。b乙醛酸的积累在不同的OsGR-在正常生长和高光呼吸条件下的转基因植物。c草酸的积累在不同的OsGR-正常生长条件下的转基因植物。OX-GR1和OX-GR2代表OSGR1.和OSGR2.过度表达植物;Cas9-GR1和Cas9-GR2代表OSGR1.和OSGR2.单基因敲除突变体;Cas9-GR1/2代表OSGR1.和OSGR2.双基因敲除突变体。数值为3次重复的平均值±SD。相同的字母表示的平均值没有显著差异P < 0.05 according to Duncan’s multiple range tests
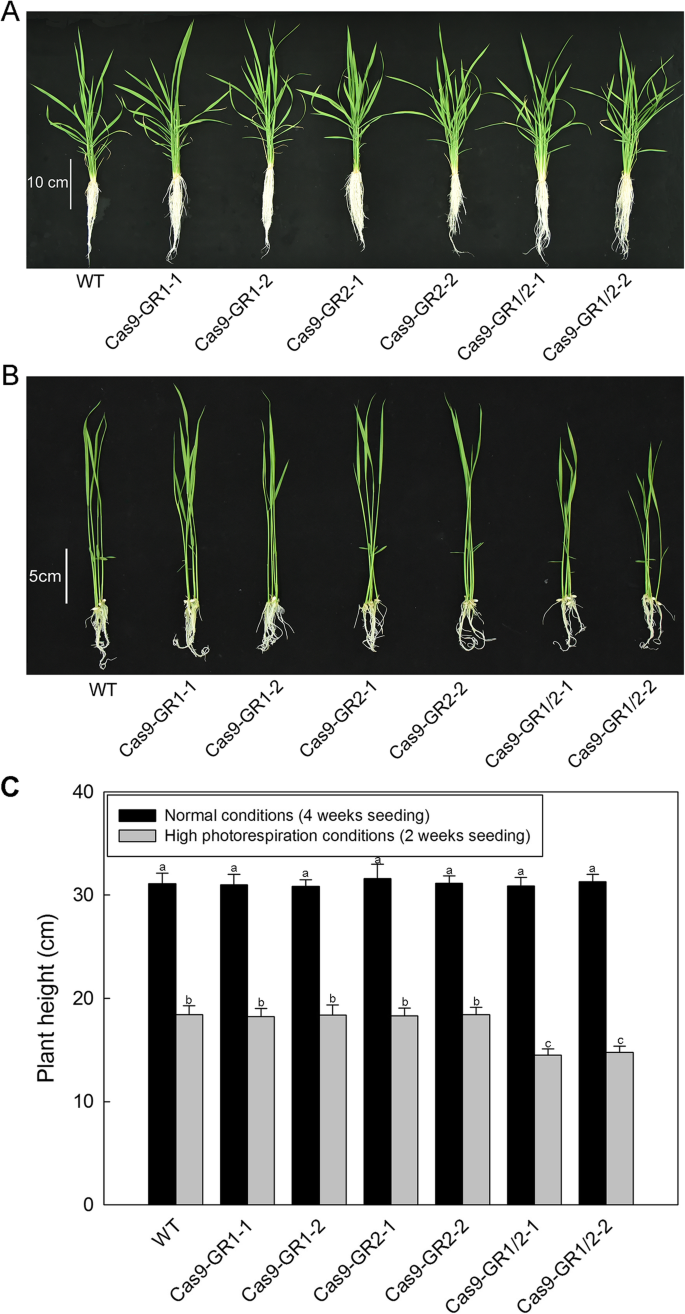
在正常情况下,这些OsGR-转基因植株与WT相比,表型差异不显著(图5)。4a).但低CO促进光呼吸作用时2浓度和连续光[27,28),OSGR1 / OSGR2.双突变体显示出发育不良生长(图。4b,附加文件4).牛-OSGR1.和牛OSGR2.在正常和光呼吸促进条件下,品系没有表现出明显的表型差异(数据未显示)。这些结果有力地支持了OsGR1和OsGR2参与了某些应激条件下的乙醛酸解毒过程,这些应激条件刺激了光呼吸,尽管它们在大多数情况下可能起着冗余的作用。
讨论
一般来说,多基因家族中不同基因成员的生物学作用是不同的[29,30.,31.,32.,33.].这GR多基因家族存在于多种植物中,例如拟南芥,Sinorhizobium Meliloti.,苹果和大米[2,7],其GR亚型表现出不同的表达模式、生化特征和功能。GR可能参与了乙醛和丁二醛的解毒过程拟南芥在特定的压力条件下吸烟[1,6].Zarei等。[7]进一步证明NADPH/NADH比值可能调控GR的表达拟南芥并调节它们在醛类解毒中的作用。然而,从文献资料来看,关于GR在水稻中的生理作用还缺乏详细的资料。
在这里,我们首先证明了nadph依赖的乙醛酸还原活性是水稻不同组织和不同生长期的主要GR活性(图。1a, b),类似于菠菜和烟草的GR [4,34.].此外,转录水平和蛋白质丰度的分析表明OSGR1是水稻中的主要GR同种型(图。1c,表2).GR的亚细胞定位仍然存在争议,最近的研究证明了拟南芥Atg1在细胞质中局部化,而Atgr2局部化在塑体和线粒体中[7,20.].在本研究中,共聚焦显微镜观察OsGR1定位于细胞质,而OsGR2定位于叶绿体(图。1d), western blot进一步证实OsGR2是一种叶绿体蛋白(图)。1e)。
确定酶特性是间接揭示酶生物学功能的常规方法[29,35.,36.].GR蛋白首先从烟草和菠菜叶片中纯化,然后进行生化和酶学特征分析,表明该蛋白与乙醛酸相连K米(NADPH)来自烟草和菠菜的GR的值分别为0.32和0.13mm [4].GR异构型拟南芥,苹果和水稻不仅表现出了还原乙醛的催化活性,还表现出了还原琥珀酸半醛的催化活性[7].本研究比较研究了乙醛酸依赖型OsGR1和OsGR2的酶学性质。OsGR1和OsGR2在生理pH(7.0-7.5)范围内活性最高(图5)。2b),双方喜欢NADH作为辅助因子(表3.),与来自其他物种的GR同工酶一致[2,4,6].如表所示3., NADPH-linkedK米(乙醛酸)OSGR1为30.2μm,显着低于OSGR2(72.1μm),表明OSGR1对乙醛的亲和力比OSGR2具有更高的亲和力。然而,植物中拟甲酰化酯的生理浓度范围为100至300μm[17,18,37.,这比nadph连接的更高K米(乙醛酸)OsGR1和OsGR2的值。因此,OsGR1和OsGR2均可有效催化水稻生理浓度下乙醛酸的还原。此外,水稻是一种积累草酸的植物,水稻的草酸含量在20 ~ 100 mM之间[14,25].基于K我(草酸)OsGR1和OsGR2(表4),在生理条件下,内源性草酸可能会部分抑制nadph依赖的OsGR1的乙醛酸还原活性,而不是OsGR2,因此,在体内OsGR1和OsGR2可能以类似的有效方式降低乙醛酸。然而,OsGR1和OsGR2的nadh依赖的乙醛酸还原活性可能被生理浓度的草酸抑制,GR的nadh依赖活性可能在水稻乙醛酸解毒过程中没有实际作用。
光呼吸乙醛酸是在过氧化物酶体中产生的,通常在高光呼吸或其他应激条件下积累,如果不及时代谢或清除,对植物细胞具有很高的毒性[38.,39.].此外,乙酰氧酯是一种小有机酸,其可以将其从过氧血清中扩散到其他细胞室[11,19,40,41.,42.,43.,44.].以往的研究认为,GRs可以清除从过氧化物酶体逃逸的光呼吸乙醛酸,但目前尚无直接的分子遗传证据[10,11,13].为了进一步验证OsGR1和OsGR2是否在乙醛酸的体内解毒作用,各有不同OsGR在转基因水稻中检测乙醛酸含量。我们注意到,即使在高光呼吸条件下,WT和OX-OsGR系的乙醛酸水平是相同的(图。3.b),可能是因为WT中的背景GR活性足够高,以除去从过氧酶体缺失的光致血红蛋白,因此不必要的过表达。之前的研究还报告说,存在某些体塑料反应,其补偿植物中乙醛酸的损失[14,18,19,38.].尽管如此,乙醛酸水平在OsGR敲除突变体,特别是在双突变体中(图。3.b),在高光源条件下,该值变得更高(图。3.b)。然而,出乎意料的是,它们的单个和双突变体都不在正常条件下显示出表型变化(图。4a、c),双突变体只有在高光呼吸条件下才会出现负表型(图5)。4B,C和附加文件4).This implicates that the glyoxylate accumulation due to deficiency of OsGR1 and OsGR2 might have not yet attained the toxic threshold for rice plants under normal conditions, and the two OsGR isoforms are both required for efficiently removing glyoxylate under high photorespiration conditions (e.g. drought, heat, high light). Overall, the datas stronly support that OsGR1 and OsGR2 are indeed involved in glyoxylate detoxification under certian stressfull conditions that stimulate photorespiration, although both may function redundantly sometimes. In addition, oxalate contents of variousGR- 还分析了预处理的稻米线。从图中看到。3.C,随着乙醛酸的增加OsGR敲除突变体(无花果。3.b),草酸盐在两者中增加了25-30%OSGR1.和OSGR2.单个突变体,并在30-40%OSGR1./OSGR2.双突变体。这些结果进一步证实了我们之前的结论,即乙醛酸是草酸生物合成的有效前体,OsGR1和OsGR2可能参与了水稻草酸代谢的调控。这些生物学过程的分子机制尚不清楚,有待进一步研究。
结论
GR活动不仅存在日变化,而且在不同生长阶段也有波动。OsGR1是一个细胞质蛋白,而OsGR2定位于叶绿体。OsGR1对总GR活性贡献更大,且对乙醛酸的亲和力高于OsGR2,尽管两者都能有效催化水稻NADPH作为首选辅助因子还原乙醛酸。在正常条件下,OsGR1和OsGR2以非强制性的方式参与乙醛酸的解毒,这可能是因为OsGR1和OsGR2缺乏导致积累的乙醛酸在正常条件下可能没有达到水稻植株的毒性阈值。然而,在高光呼吸条件下,这两种OsGR亚型同时需要应对乙醛酸的过量生产。
方法
植物材料和生长条件
栽培稻简历。利用我们实验室保存的中华11号(粳稻品种组)进行转基因株系的生成和功能分析(Xu et al., 2006)。预发芽的水稻种子通常在KimuraB完全营养液中生长[45.]在温室条件下(14小时光/ 10小时暗,平均温度为30/25°C(轻/暗),相对湿度60-80%,平均光强度为600μmolm−2年代−1).为了促进光呼,在连续光线下培养水稻植物(21厘米,3.0厘米直径),然后是CO2管中的水平迅速下降,促进光源的通量[27,28].
质粒建设
使用EZ-10 Total RNA Mini-Preps Kit(生工生物技术,中国)从水稻叶片中提取总RNA,并用纳米光度计(IMPLEN,德国)对纯化后的RNA进行评估。使用HiScript第一链cDNA合成试剂盒(Vazyme, China)合成第一链cDNA。设计引物包含两个GR基因完整的开放阅读框。为了获得GR过表达转基因株系,将每个GR序列克隆到pYLox中。使用ClonExpress超一步克隆试剂盒(Vazyme,中国)。为生成CRISPR-Cas9敲除系,特异性靶向序列OSGR1.和OSGR2.(附加文件3.),并克隆到pYLCRISPR/Cas9Pubi载体中[46.].目的构建蛋白异源表达载体E.coli.,全身OSGR1.和截断OSGR2.(没有N-末端CTP)序列被克隆到PColdi载体中。前879年的序列OSGR1.第一个153 bpOSGR2.是用来产生OSGR1.-GFP-pBI121和OSGR2.-GFP-pBI121vectors [33.].
RNA分离和QRT-PCR
使用如上所述(Vazyme)的立体第1链CDNA合成试剂盒合成第一链cDNA。专为QRT-PCR设计了特定的引物对OSGR1.和OSGR2.(附加文件5).QRT-PCR反应混合物由0.2μm(每种)底漆组成,10μl2×SYBR绿色PCR母混合物(Toyobo,Japan)和2μl适当的稀释cDNA。使用DNA发动机Opticon 2实时PCR检测系统和Opticon Monitor软件(Bio-rad,CA)进行分析。数据被标准化为扩增osactin1.基因(Os03g0718100)。
定量蛋白质组学分析
根据Lu等人获得蛋白质提取物。(2013)有一些修改[38.].将1.0 g水稻叶片在液氮中研磨,然后在含有6 M氯化胍(GdnHCl)和1%蛋白酶抑制剂混合物(Abcam,美国)的5 ml冰冷Tris-HCl (100 mM, pH 8.5)中重悬,获得粗蛋白提取物,蛋白量采用BCA法测定(Thermo Fisher Scientific,美国)。然后,将200 μg裂解液加入到4体积的甲醇中,然后加入等量的氯仿和3体积的ddH混合2o用混合加入管中。将溶液以14,000g离心5分钟。弃去上层水层,用四个体积的甲醇洗涤蛋白质沉淀,并将管再次离心。弃去上清液,沉淀的蛋白质沉淀是风干的。后,通过BGI(BGI-Shizhen,China)进行色谱 - 串联质谱(LC-MS / MS)分析。
一代转基因水稻
将不同载体转化成水稻愈伤组织Agobacterium介导的感染(应变EHA105) [47.].T0阳性株系T1种子在完全木村B营养液中发芽,然后移栽到土壤中生长,直到T2种子收获。然后,用两个独立株系的T2杂合子植株进行GR活性测定和胁迫处理。
蛋白质的表达大肠杆菌和他们的净化
将OsGR序列克隆到pColdI载体中,转化成大肠杆菌Rosseta(DE3)细胞并筛选含有氨苄青霉素的LB板。蛋白质在感应上表达大肠杆菌如前面所述,进行了一些修改[48.].简而言之,转变大肠杆菌将细胞与1 mM异丙基-硫代-β- d -1-硫代半乳糖吡喃苷(IPTG)在16°C下以180 rpm振荡10-16小时。之后,上清液大肠杆菌根据制造商的Ni-Ida树脂(Bio-rad,USA)的制造商纯化细胞裂解物。将Ni-Ida树脂(Bio-rad)填充在生物级MT5柱(10×64mm)上,高达2mL,然后用3柱体积(CV)的洗涤缓冲液(50mM PBS,pH 8.0平衡)平衡,10 mm咪唑,300 mm NaCl)。通过与等体积的结合缓冲液(100mM PBS,pH 8.0,20mM咪唑,600mM NaCl)混合制备过滤的上清液,并将其装载到Ni-Ida树脂柱上。用10个CV洗涤柱,用含有150mM咪唑和300mM NaCl的50mM PBS(pH8.0)洗脱结合的蛋白质。通过超滤脱盐的洗脱级分,并通过12%SDS-PAGE检查。将所有纯化的蛋白质储存在50mM PBS(pH7.0)中,含有10%甘油在-75℃下含有10%甘油,用于随后的测定。
GR活性测定
根据Zarei等人在生理温度(30℃)下,监测GR催化活性作为NAD(P)H的氧化。[7,除非在不同的动力学和表征研究中需要特定的变化。典型的反应混合物包括50 mM PBS (pH 7.4), 0.2 mM NADPH(或1.0 mM NADH)和1 mM乙醛酸。用50 mM PBS (pH为5.8 ~ 8.5)测定不同pH值的影响。为了测定动力学参数,底物的催化作用在一定浓度(0.01-0.1 mM NADPH)范围内进行K米(NADPH);0.1-1.0 mM NADH测定K米(NADH);0.01-0.1 mM乙醛酸K米(乙醛酸)NADPH作为Cofactor;0.1-0.5mM甲酰基化物用于确定K米(乙醛酸)以NADH作为辅助因子)K米根据线织机和毛刺的方法从双倒数图计算。此外,然后绘制倒数曲线图的斜率,以抵抗草酸盐的浓度(用NADPH为辅助弧剂,2.0-15.0mm,NADH作为COFACTOR的2.0-15.0mm)进行评估K我数据(49.].
亚细胞定位和western blot分析
据Zhang等人的研究,水稻原生质体被分离出来。50.],将10μg的GFP标记构建体近似转染到100μl原生质体中(约2.0×105),然后将原生质体在25℃的黑暗中孵育14-16小时[50.,51.].共焦图像是由LSCM 780系统(蔡司,德国)捕获的。从表达OsGR2-GFP的水稻原生质体中提取蛋白,用12% SDS聚丙烯酰胺凝胶(SDS- page)分离,用湿转移法在硝化纤维素膜上电印迹,用gfp抗体(Abcam, USA)检测OsGR2-GFP。
乙醛酸和草酸盐的测定
徐等报道了乙醛酸和草酸盐的含量[17].根据样品的可用性,取0.2-0.5 g叶子分成等份,在1 - 4ml 0.5 N HCl中均质,在80°C下加热10分钟。加入蒸馏水至5 ~ 25ml, 12000 rpm离心10 min,离心2 ~ 3ml,过滤(0.45 μm)后进行HPLC分析。
乙醛酸与苯肼反应生成苯腙,并用高效液相色谱法定量。色谱柱为Hypsil C18 (5 μm, 4.6 × 250 mm),固定相为Waters 550 (Waters, USA),流动相为5%甲醇和95%磷酸缓冲液(13 mm二磷酸钾;1 mM磷酸二钾pH 6.0),检测波长324 nm。对草酸的测定,流动相为含0.5% KH的溶液2阿宝40.5 mM四丁基硫酸氢铵(TBA)在pH 2.0条件下用正磷酸缓冲,流速为1 mL min−1在220 nm处检测。
可用性数据和材料
本研究期间生成或分析的所有数据都包含在本发布的文章及其补充信息文件中。
缩写
- gr:
-
乙醛酸还原酶
- SSA:
-
琥珀型半醛
- CTP:
-
叶绿体过境肽
- 存在:
-
实时定量聚合酶链反应
- GFP:
-
绿色荧光蛋白
- TBA:
-
四丁基硫酸氢硫酸氢铵
- IPTG:
-
Isopropyl-thio -β-D-1-thiogalactopyranoside
参考文献
- 1.
Allan WL, Clark SM, Hoover GJ, Shelp BJ。植物乙醛酸还原酶在逆境中的作用:一个假说。j . 2009, 423(1):第15 - 22。
- 2.
Kutner J,Shabalin Ig,Matelska D,交给KB,Gasiorowska O,Sroka P,Gorna MW,Ginalski K,Wozniak K,轻微W.结构,生化和进化表征对乙醛酸/羟丙基酯还原酶的结构,生化和进化表征,显示它们分为两个不同的亚属亚属。生物化学。2018; 57(6):963-77。
- 3.
植物中乙醇酸和乙醛酸的氧化和还原。一、乙醇酸氧化酶。生物化学杂志。1953;201(2):707-18。
- 4.
我是泽里奇,我要去AM。树叶中一种新的乙醛酸还原酶的性质。j . 1962; 84(3): 541 - 6。
- 5。
Zelitch I.来自烟叶中结晶乙醛酸还原酶的分离和作用。J Biol Chem。1955年; 216(2):553-75。
- 6。
SIMPSON JP,DI LEO R,DHANOA PK,ALLAN WL,MAKHMOUDOVA A,CLARK SM,HOOVER GJ,MULLEN RT,SHELP BJ。塑性局部化的鉴定和表征拟南芥乙醛酸还原酶亚型:与胞质亚型的比较以及对细胞氧化还原稳态和醛解毒的影响。实验机器人。2008;59(9):2545-54。
- 7。
Zarei A,Brikis CJ,Bajwa VS,Chiu Gz,Simpson JP,Deell Jr,Bozzo GG,Shelp BJ。植物甲醛/琥珀酸型半醛还原剂:对比生化特性,在寒冷胁迫期间的功能,以及亚细胞定位。前植物SCI。2017; 8:1399。
- 8。
Allan WL, Simpson JP, Clark SM, Shelp BJ。γ羟基丁酸积累拟南芥烟草植物是对非生物胁迫的一般反应:假定受氧化还原平衡和乙醛酸还原酶异构体的调控。实验机器人。2008;59(9):2555-64。
- 9。
Allan WL,Breitkreuz Ke,Waller JC,Simpson JP,Hoover GJ,Rochon A,Wolyn DJ,Rentsch D,Snedden Wa,Shelp Bj。琥珀酸型半醛的解毒拟南芥糖氧基化还原酶和NAD激酶突变体进行浸没应激。植物学。2012; 90(1):51-61。
- 10.
Foyer Ch,Bloom AJ,Queval G,Noctor G.光致血管代谢:基因,突变体,能量学和氧化还原信号传导。Annu Rev植物Biol。2009; 60(1):455-84。
- 11.
Dellero Y, Jossier M, Schmitz J, Maurino VG, Hodges M.光呼吸乙醇酸-乙醛酸代谢。实验机器人。2016;67(10):3041-52。
- 12.
关键词:水稻,乙醇酸氧化酶,同工酶,催化,功能中国生物医学工程学报,2017;
- 13.
Bauwe H,Hagemann M,Fernie AR。光呼吸:玩家,合作伙伴和起源。趋势植物SCI。2010; 15(6):330-6。
- 14。
关键词:水稻,草酸合成,乙氧基酸,抗坏血酸,前体引用本文:实验机器人。2010;61(6):1625-34。
- 15.
Franceschi VR, Nakata PA。植物中的草酸钙的形成与功能。植物生物学杂志。2005;56(1):41-71。
- 16。
黄建平,陈建平,张建平,等。草酸在菌核病发展过程中诱导植物细胞程序性死亡的研究进展。植物与微生物的相互作用。2008;21(5):605-12。
- 17。
徐H,Ji X,He Z,Shi W,Zhu G,Niu J,Li B,Peng X. Oraphalate积累和调节与米叶中的乙醇氧化酶无关。J Exp Bot。2006; 9(57):1899-908。
- 18。
关键词:水稻,乙醇酸氧化酶,诱导反义抑制,光合作用引用本文:实验机器人。2009;6(60):1799-809。
- 19。
Hoover GJ, Jørgensen R, Rochon A, Bajwa VS, Merrill AR, Shelp BJ。植物中乙醛酸酶还原催化重要氨基酸残基的鉴定。蛋白质组学。2013;
- 20.
在植物细胞中,乙醛酸还原酶亚型1定位于细胞质,而不是过氧化物酶体。中国生物医学工程学报(英文版),2012;
- 21.
Horton P,Park KJ,Obayashi T,Fujita N,Harada H,Adams-Collier CJ,Nakai K. Wolf Psort:蛋白质定位预测指标。核酸RES。2007; 35:W585-7。
- 22.
周凯奇,沈海斌。Cell-PLoc:一套网络服务器,用于预测各种生物体中蛋白质的亚细胞定位。Nat Protoc。2008;3(2):153 - 62。
- 23.
沉B,朱C,姚Z,崔L,张j,阳c,肝,彭x。一种优化的过渡肽,用于有效靶向水稻中叶绿体中的不同外来蛋白质。SCI批准。2017; 7:46231。
- 24.
Bruce Bd。叶绿体过境肽:结构,功能和进化。趋势细胞BIOL。2000; 10(10):440-7。
- 25.
水稻氮素形态调控的草酸积累及其与光合作用的关系(栽培稻l .)。植物生物学杂志。2005;47(7):831 - 836。
- 26。
givan cv,kleczkowski la。高等植物叶片中乙氧酯和羟基吡合他分的酶化还原。植物理性。1992; 100(2):552-6。
- 27。
Waszczak C,Kerchev Pi,MühlenbockP,Hoeberichts Fa,Katrien VDK,MHAMDI A,Willems P,Denecker J,Kumpf RP,Noctor G,Messens J,Breusegem VF。短根缺乏减轻了细胞死亡表型拟南芥光呼吸促进条件下的过氧化氢酶2突变体。植物细胞。2016;28(8):1844 - 59。
- 28。
关键词:外源乙醇酸分解代谢途径,黄瓜,光合作用,生物产量2环境。前植物SCI。2019; 10:702。
- 29。
研究了酵母NAD的两种同工酶+- 通过GPD1和GPD2编码的依赖性甘油3-磷酸脱氢酶在OSMOODOPT和氧化还原调节中具有不同的作用。Embo J. 1997; 16(9):2179-87。
- 30.
通过基因特异性抑制Frk1和Frk2在番茄中的表达,揭示了果糖激酶同工酶的不同生理作用。植物杂志。2002;129(3):1119 - 26所示。
- 31.
Park SG,Cha M,Jeong W,Kim I.硫醇过氧化物酶同工酶的不同生理功能酿酒酵母.中国生物医学工程杂志。2000;275(8):5723-32。
- 32.
M'rah S,Ouerghi Z,Berthomieu C,Havaux M,Jungas C,Hajji M,Graignon C,LachaâlM.NACL的影响NACL对生长,离子积累和光合参数的影响Thellungiella halophila.植物生理学杂志。2006;163(10):1022-31。
- 33.
Yamagami T,Tsuchisaka A,Yamada K,Haddon Wf,Harden La,神学is.1-氨基 - 环丙烷-1-羧酸合酶同工酶中的生化多样性拟南芥基因家族。中国生物医学工程学报,2004;
- 34.
Tolbert Ne,Yamazaki Rk,Oeser A.羟丙基磺酸盐和乙醛化合物中的定位和性质在菠菜叶片颗粒中。J Biol Chem。1970; 245(19):5129-36。
- 35.
为什么有两种环氧化酶同工酶。临床医学杂志,2001;
- 36.
Escamilla-Treviño LL, Shen H, Uppalapati SR, Ray T, Tang Y, Hernandez T, Yin Y, Xu Y, Dixon RA。柳枝稷(黍virgatum)具有不同家族的肉桂酰辅酶a还原酶,具有独特的生化特性。新植醇。2010;185(1):143 - 55。
- 37.
温格勒A,李PJ,李古德RC。大麦和大麦甘氨酸积累突变体乙醛酸和甲酸盐的光呼吸代谢Amaranthus Edulis..Planta。1999; 207(4):518-26。
- 38。
卢y,李y,杨q,张z,陈y,张某,彭x。抑制乙醇酸氧化酶的抑制导致甘油酯积累,通过去激活水稻来抑制光合作用。physiol platararum。2014; 150(3):463-76。
- 39。
Liepman AH, Olsen LJ。过氧化物酶体丙氨酸:乙醛酸转氨酶(AGT1)是一种具有多种底物的光呼吸酶拟南芥.植物j . 2001; 25(5): 487 - 98。
- 40.
EPRINGSEV AT,Fedorin DN,Salnikov Av,Igamberdiev Au。乙醛酸血糖酶的血氧族和细胞溶质形式的表达及性质苋属caudatus植物生理学杂志。2015;
- 41.
张Z,徐y,谢Z,李X,肝,彭X.乙酸盐氧化酶与水稻过氧化氢酶的结合 - 调节细胞内H的潜在开关2O2的水平。摩尔。2016;9(5):737 - 48。
- 42.
Werner Ak,Witte C.氮气动员的生物化学:嘌呤环分解代谢。趋势植物SCI。2011; 16(7):381-7。
- 43.
挑选tr,brautigam a,schulz ma,obata t,fernie ar,weber apm。PLGG1,塑性乙醇酸甘油糖转运蛋白,需要光致磷,并定义独特的代谢物转运蛋白。Proc Natl Acad Sci U S A. 2013; 110(8):3185-90。
- 44.
本宁C.证据支持电压依赖吸收模型的生长素进入Cucurbita囊泡.足底。1986;169(2):228 - 37。
- 45.
Yoshida S, Forno DA, Cock JH, Gomez KA。水稻生理研究实验室手册。马尼拉:国际水稻研究所;1976.
- 46.
关键词:单子叶和双子叶植物,CRISPR/Cas9,基因组编辑,单子叶和双子叶植物摩尔。2015;8(8):1274 - 84。
- 47.
水稻的高效转化(栽培稻L.)通过农杆菌介导的T-DNA界限的序列分析。工厂J. 1994; 6(2):271-82。
- 48.
刘j,崔l,谢z,张z,刘e,peng x。两个nca1同种型以互斥的方式与过氧化酯酶相互作用,以减少其在水稻中的活性。BMC植物BIOL。2019; 19(1):105-10。
- 49.
Lineweaver H, Burk D.测定酶解常数。J Am Chem Soc. 1934;56(3): 658-66。
- 50.
关键词:水稻,绿色组织,原生质体,瞬时基因表达,光/叶绿体相关过程工厂方法。2011;7(1):30。
- 51.
Yoo S,Cho Y,Sheen J.拟南芥叶肉原生质体:一种用于瞬时基因表达分析的多功能细胞系统。Nat Protoc。2007;2(7):1565 - 72。
致谢
作者要感谢刘耀光教授(华南农业大学生命科学学院)提供的pYLox。5和pYLCRISPR/Cas9载体。
资金
这项工作得到了广东基本和应用研究的主要计划(2019B030302006),是中国国家自然科学基金(31770256)和中国广东省自然科学基金(2019A1515011438)。资助机构在设计本研究和收集,分析和解释方面没有作用,以及撰写稿件。
作者信息
从属关系
贡献
PXX设计了实验。ZZS,LX和LL大多数实验并分析了数据。XZ,HJY和HH辅助实验。ZZS和PXX写了稿件。所有作者阅读并认可的终稿。
相应的作者
道德声明
伦理批准并同意参与
不适用。
同意出版
不适用。
相互竞争的利益
提交人声明他们没有竞争利益。
额外的信息
出版商的注意
《自然》杂志对已出版的地图和附属机构的管辖权主张保持中立。
补充信息
额外的文件1。
OsGR和AtGR亚型在蛋白和核苷酸水平上的多序列比对(MSA)。
额外的文件2。
OSGR1.和OSGR2.不同的成绩单在不同的叶子中的丰富OsGR-转基因植株采用qRT-PCR检测。在此基础上绘制了不同水稻品种的相对mRNA水平OSGR1.WT的mRNA水平为1。
额外的文件3。
对生成的Crispr-Cas9进行分子评价OSGR1.和OSGR2.单双突变体。
额外的文件4。
OsGR-敲除突变体在光呼吸促进条件下生长。Cas9-GR1和Cas9-GR2代表OSGR1.和OSGR2.单基因敲除突变体;Cas9-GR1/2代表OSGR1.和OSGR2.双基因敲除突变体。这些结果是三个独立实验的代表。
额外的文件5。
引物用于实时定量PCR。
权利和权限
开放获取本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.“创作共用公共领域”豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信用额度中另有说明。
关于这篇文章
引用这篇文章
张卓,梁新,卢磊。等等。两种乙醛酸还原酶亚型在水稻高光呼吸条件下功能上是多余的,但却是必需的。BMC植物BIOL.20.357(2020)。https://doi.org/10.1186/s12870-020-02568-0
收到了:
接受:
发表:
关键词
- 乙醛酸还原酶
- 乙醛酸
- 光呼吸
- 草酸盐
- 大米