- 研究文章GydF4y2Ba
- 开放访问GydF4y2Ba
- 发表:GydF4y2Ba
中锌指C2H2基因的全基因组特征GydF4y2BaCucumis sativusGydF4y2Ba四种功能分析GydF4y2BaCsZFPsGydF4y2Ba响应压力GydF4y2Ba
BMC植物生物学GydF4y2Ba体积GydF4y2Ba20.GydF4y2Ba, 文章编号:GydF4y2Ba359.GydF4y2Ba(GydF4y2Ba2020.GydF4y2Ba)GydF4y2Ba
摘要GydF4y2Ba
背景GydF4y2Ba
C2H2型锌手指蛋白(ZFPS)在植物中形成相对大的转录调节剂,并在植物生长,发育和应力反应中发挥许多作用。但是,C2H2 ZFPS在黄瓜中的综合分析(GydF4y2BaCsZFPsGydF4y2Ba)仍然缺乏黄瓜中的调节功能。GydF4y2Ba
结果GydF4y2Ba
在目前的研究中,全基因组鉴定和表征GydF4y2BaCsZFPsGydF4y2Ba,包括进行基因结构,基因组定位,系统发育关系和基因表达。还进行了通过瞬时转化的4个选定基因的功能分析。共有129个全长GydF4y2BaCsZFPsGydF4y2Ba被鉴定,可根据系统发育分析分为四组。129GydF4y2BaCsZFPsGydF4y2Ba在7条染色体上不均分布。启动子GydF4y2BaCIS.GydF4y2Ba-元素分析表明GydF4y2BaCsZFPsGydF4y2Ba可能涉及调节植物激素和/或非生物应激反应,93GydF4y2BaCsZFPsGydF4y2Ba被预测为1 ~ 20个mirna的靶标。此外,亚细胞定位分析表明,10个测试CsZFPs定位于核和转录组分析GydF4y2BaCsZFPsGydF4y2Ba证明这些基因涉及根和花卉发育,授粉和水果脊柱。此外,瞬态过度表达GydF4y2BaCSA1G085390.GydF4y2Ba和GydF4y2BaCSA7G071440GydF4y2Ba进入GydF4y2Ba烟草benthamianaGydF4y2Ba植物透露,它们可以分别减少和诱导造成病原体攻击的休假坏死,它们可以通过初始诱导h增强盐和干旱胁迫GydF4y2Ba2GydF4y2BaO.GydF4y2Ba2GydF4y2Ba。此外,GydF4y2BaCSA4G642460GydF4y2Ba和GydF4y2BaCSA6G303740GydF4y2Ba5天转型后可以诱导细胞死亡。GydF4y2Ba
结论GydF4y2Ba
识别与功能分析GydF4y2BaCsZFPsGydF4y2Ba证明了一些关键人物GydF4y2BaCsZFPsGydF4y2Ba可能会对生物和非生物应激作出基本作用。这些结果可以为了解理解角色的基础GydF4y2BaCsZFPsGydF4y2Ba为今后黄瓜的遗传工程研究奠定了基础。GydF4y2Ba
背景GydF4y2Ba
植物经常患有各种生物和非生物胁迫,这对植物生长和发展产生不利影响[GydF4y2Ba1GydF4y2Ba那GydF4y2Ba2GydF4y2Ba],而转录因子(TFS)是参与各种生物和环境压力过程的重要调节因素[GydF4y2Ba3.GydF4y2Ba].其中,锌指蛋白(ZFPS)占相对大的真核转录因子家族[GydF4y2Ba4.GydF4y2Ba].在GydF4y2Ba拟南芥GydF4y2Ba和水稻,近15和13%的转录因子是ZFPs(分别为176和189)[GydF4y2Ba5.GydF4y2Ba那GydF4y2Ba6.GydF4y2Ba].根据半胱氨酸(Cys, C)和组氨酸(His, H)残基的数目和顺序,ZFPs可分为C2H2、C2HC、C2HC5、C3HC4、CCCH、C4、C4HC3、C6、C8等亚群[GydF4y2Ba7.GydF4y2Ba那GydF4y2Ba8.GydF4y2Ba].其中,C2H2-type zinc finger proteins (C2H2-ZFPs)是一类被广泛研究的经典蛋白。c2h2型锌指蛋白,也被称为TFIIIA型锌指,锌指结构域包含两个Cys和两个His残基,被描述为CX2-4CX3FX5LX2HX3-5H,形成保守且最具特征的dna结合基元[GydF4y2Ba9.GydF4y2Ba那GydF4y2Ba10.GydF4y2Ba].在植物中,C2H2锌指蛋白具有与其他真核生物不同的相似结构。在C2H2-ZFPs中可以检测到锌指螺旋中高度保守的QALGGH基序。根据锌指的数量和形态,C2H2-ZFPs可分为三组,即三组- c2h2 (tC2H2)锌指、多邻接- c2h2 (maC2H2)锌指和分离对- c2h2 (spC2H2)锌指[GydF4y2Ba11.GydF4y2Ba],而且,每个组还可以分为不同的子组[GydF4y2Ba5.GydF4y2Ba].此外,C2H2-ZFPS显示出广泛的结构和功能,从DNA或RNA结合到蛋白质 - 蛋白质相互作用的参与[GydF4y2Ba5.GydF4y2Ba],其作为关键转录调节因子的功能,以发挥不良应力的重要作用,例如干旱,低温,盐和氧化应激[GydF4y2Ba10.GydF4y2Ba].GydF4y2Ba
在几种植物中研究了C2H2-ZFP的基因组鉴定和功能分析,同时存在一些应激相关的C2H2-ZFP,其中包括176名成员GydF4y2Ba拟南芥GydF4y2Ba基因组[GydF4y2Ba5.GydF4y2Ba],189米(GydF4y2Ba奥雅萨苜蓿GydF4y2BaL.)[GydF4y2Ba6.GydF4y2Ba], 122 (GydF4y2BaTriticum aestivum.GydF4y2BaL.)[GydF4y2Ba7.GydF4y2Ba],301 inGydF4y2BaBrassica Rapa.GydF4y2BaL. [GydF4y2Ba12.GydF4y2Ba), 109年GydF4y2Ba杨树trichocarpaGydF4y2Ba[GydF4y2Ba13.GydF4y2Ba],189在Foxtail Millet(GydF4y2BaSetaria Italica.GydF4y2BaL.)[GydF4y2Ba9.GydF4y2Ba],大豆321 (GydF4y2Ba大豆GydF4y2BaL.)[GydF4y2Ba14.GydF4y2Ba],玉米(GydF4y2BaZea Mays.GydF4y2BaL.)[GydF4y2Ba15.GydF4y2Ba],建议C2H2-ZFPS广泛参与植物生长,发展和防御反应[GydF4y2Ba16.GydF4y2Ba那GydF4y2Ba17.GydF4y2Ba那GydF4y2Ba18.GydF4y2Ba那GydF4y2Ba19.GydF4y2Ba].例如,在GydF4y2Ba拟南芥GydF4y2Ba那GydF4y2BaAZF1GydF4y2Ba(GydF4y2BaAT5G67450GydF4y2Ba) 和GydF4y2BaAZF2GydF4y2Ba(GydF4y2BaAT3G19580GydF4y2Ba)可以作为转录抑制因子抑制渗透胁迫和aba抑制基因的表达,从而对植物生长产生负面影响[GydF4y2Ba20.GydF4y2Ba].GydF4y2BaZat18.GydF4y2Ba(GydF4y2BaAT3G53600.GydF4y2Ba)通过干旱胁迫和过表达进行转型诱导GydF4y2BaZat18.GydF4y2Ba改善抗旱的突变GydF4y2BaZat18.GydF4y2Ba导致植物耐受降低减少对干旱胁迫[GydF4y2Ba19.GydF4y2Ba].而且,高表达GydF4y2BaZAT7GydF4y2Ba根组织可以通过激活防御基因来积极提高盐胁迫耐受性[GydF4y2Ba21.GydF4y2Ba].与此同时,这是GydF4y2Ba拟南芥蒂利亚纳GydF4y2Ba超人(Sup)蛋白是最好的研究C2H2之一,已被证明调节Carpel Number和Ovule Development [GydF4y2Ba22.GydF4y2Ba],黄瓜中同源的SUP (GydF4y2BaCsSUPGydF4y2Ba那GydF4y2BaCSA3G141870GydF4y2Ba)已被鉴定和研究,它们可能在雌花的芽和胚珠发育中发挥重要作用[GydF4y2Ba23.GydF4y2Ba].在GydF4y2Baponcirus trifoliataGydF4y2Ba(L.)RAF。,表达GydF4y2BaPtrZPT2-1GydF4y2Ba被冷,干旱和盐胁迫和过度表达强烈诱发GydF4y2BaPtrZPT2-1GydF4y2Ba在烟草中通过增加渗透调节溶质的水平来增强其冷,干旱和耐盐性,并降低H的积累GydF4y2Ba2GydF4y2BaO.GydF4y2Ba2GydF4y2Ba[GydF4y2Ba24.GydF4y2Ba].在大豆中,C2H2型锌指蛋白的转录,GydF4y2BaGMSCOF-1GydF4y2Ba,而不是通过脱水和高盐度[GydF4y2Ba25.GydF4y2Ba].此外,过度的GydF4y2BaGMSCOF-1GydF4y2Ba提高冷响应基因的表达水平以提高转基因植物的耐寒性。这些结果表明,C2H2-ZFPs在不同的胁迫信号转导途径下具有转录激活或抑制作用,控制着下游基因的转录水平。而黄瓜C2H2-ZFPs的综合鉴定及胁迫相关功能分析(GydF4y2BaCucumis sativusGydF4y2Bal .)仍然是难以捉摸的。GydF4y2Ba
黄瓜是世界上重要的蔬菜作物[GydF4y2Ba26.GydF4y2Ba].黄瓜的质量和产率容易受到不良环境应激的影响,例如高干旱,盐度和营养缺乏,因为它的根部大大蔓延在浅层土壤中,[GydF4y2Ba27.GydF4y2Ba].在过去的几年里,迅速发展的基因组信息和完整的黄瓜基因组测序为我们提供了机会,以确定有趣的蛋白质家族,这些蛋白质家族在各种胁迫的基因组水平上发挥重要作用[GydF4y2Ba28.GydF4y2Ba].从而,探索黄瓜的功能GydF4y2BaCSZFP.GydF4y2Ba(GydF4y2BaCGydF4y2Baucumis.GydF4y2BaS.GydF4y2BaativusGydF4y2BaZ.GydF4y2Ba公司GydF4y2BaFGydF4y2Ba荷兰国际集团(ing)GydF4y2BaP.GydF4y2Ba在生物/非生物胁迫下,我们进行了生物信息学分析,以确定主要的GydF4y2BaCSZFP.GydF4y2Ba具有进一步基因结构,基因组定位和系统发育关系分析的成员。然后,对非生物胁迫组织进行QRT-PCR分析,例如冷,盐,热量和干旱处理的黄瓜和根。此外,所选的瞬时过度表达GydF4y2BaCsZFPsGydF4y2Ba研究了烟草植株的亚细胞定位、防御激活以及对干旱、盐和病原菌侵染胁迫的响应。本研究为该化合物的功能表征提供了线索GydF4y2BaCsZFPsGydF4y2Ba及其在黄瓜分子育种的潜在应用与应力耐受性相关。GydF4y2Ba
结果GydF4y2Ba
黄瓜ZFP基因的基因组鉴定GydF4y2Ba
使用多种植物的ZFP蛋白序列作为搜索查询,从黄瓜基因组中鉴定了总共144个非冗余CSZFP序列作为潜在的旨在基因。来自相同基因基因座的非代表性替代剪接形式的原因被视为相同的基因,最后129GydF4y2BaCSZFP.GydF4y2Ba从黄瓜基因组数据库中检索基因(表GydF4y2Ba1GydF4y2Ba).SMART和PFAM分析证实了这129中存在235 C2H2锌指域的存在GydF4y2BaCSZFP.GydF4y2Ba基因。相比之下,GydF4y2BaCSZFP.GydF4y2Ba比那个还小吗GydF4y2Ba拟南芥GydF4y2Ba(176)[GydF4y2Ba5.GydF4y2Ba,大米(189)[GydF4y2Ba6.GydF4y2Ba],GydF4y2BaBrassica Rapa.GydF4y2BaL.(301)[GydF4y2Ba12.GydF4y2Ba,狐狸尾巴(189)[GydF4y2Ba9.GydF4y2Ba,大豆GydF4y2Ba14.GydF4y2Ba]和玉米(211)[GydF4y2Ba15.GydF4y2Ba]但是超过小麦(122)[GydF4y2Ba7.GydF4y2Ba],GydF4y2Ba杨树trichocarpaGydF4y2Ba[GydF4y2Ba13.GydF4y2Ba].因此,ZFP基因家族的数量在不同的物种之间有很大的差异。GydF4y2Ba
此外,这些的详细生理和生化信息GydF4y2BaCsZFPsGydF4y2Ba,包括基因ID、氨基酸长度(aa)、分子量(MW)、等电点(pI)和预测的各蛋白亚细胞定位见表GydF4y2Ba1GydF4y2Ba。单独来看,每个CsZFP的氨基酸长度从84 aa (Csa3G731900)到1608 aa (Csa1G008490)不等,平均长度为338 aa。Csa3G731900 ~ 181.16 kDa,平均为37.59 kDa。蛋白质重要的理化性质pI值分别为9.96 (Csa6G312040) ~ 4.69 (Csa5G625970, Csa6G150550)。然后,在硅质预测中发现大多数CsZFPs(99)位于细胞核亚细胞定位,28个位于叶绿体,1个位于细胞壁(Csa7G406990), 1个位于内质网(Csa2G292740)。这与玉米ZFPs的预测一致,大多数位于细胞核,但也有少数位于叶绿体、细胞质或线粒体[GydF4y2Ba15.GydF4y2Ba].GydF4y2Ba
CSZFP基因的染色体定位,基因复制和系统发育分析GydF4y2Ba
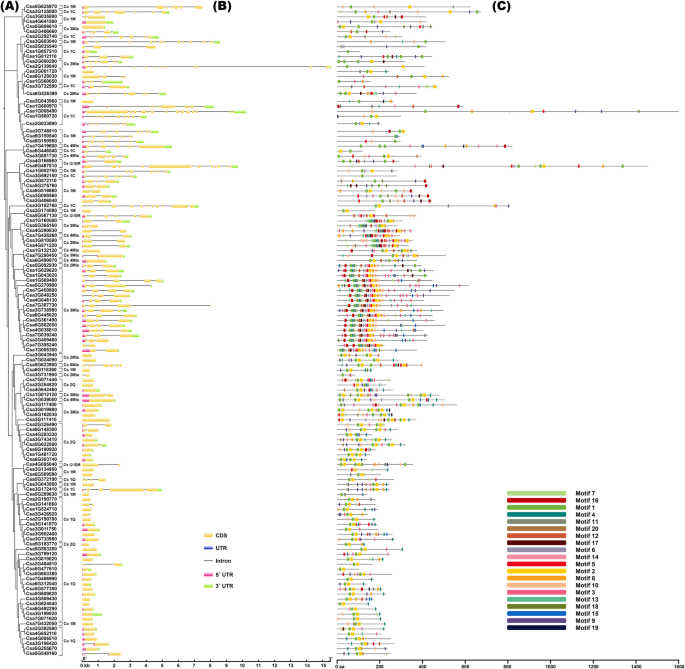
为了全面了解C2H2-ZFP基因在黄瓜中的分布,对129的染色体定位进行了分析GydF4y2BaCsZFPsGydF4y2Ba在7条染色体上显示在图中。GydF4y2Ba1GydF4y2Ba,17,15,37,11,21,16和12GydF4y2BaCSZFP.GydF4y2Bas呈上CHR1(GydF4y2BaCHR.GydF4y2Baomosome.GydF4y2Ba1GydF4y2Ba),CHR2,CHR3,CHR4,CHR5,CHR6和CHR7。其中,CHR3包含最大数量GydF4y2BaCSZFP.GydF4y2Ba基因(37)和CHR4含有最小数量的GydF4y2BaCSZFP.GydF4y2Ba基因(11)GydF4y2BaCSZFP.GydF4y2BaS在7个黄瓜染色体上分布广泛但不均匀。此外,基因复制分析表明,在黄瓜基因组的进化过程中没有发生片段复制和串联复制。与GydF4y2Ba拟南芥GydF4y2Ba(176)和米饭(189),数量越多GydF4y2BaCsZFPsGydF4y2Ba这可能是由于黄瓜基因组中缺少片段复制事件[GydF4y2Ba5.GydF4y2Ba那GydF4y2Ba6.GydF4y2Ba].GydF4y2Ba
为了评估CSZFP的系统发育关系,使用氨基酸序列通过多个序列对准构建未生根的系统发育树。根据大豆和植物特异性氨基酸残基和保守基序序列之间的距离,如大豆和GydF4y2Ba杨树trichocarpaGydF4y2Ba[GydF4y2Ba13.GydF4y2Ba那GydF4y2Ba14.GydF4y2Ba], CsZFPs中的C2H2-ZF域可以分为五种主要类型,如附加文件所示GydF4y2Ba1GydF4y2Ba:表S1:(i)含有植物特异性保守氨基酸序列“qalggh”和保守间距“x2-c-x2-c-x7-qalggh-x3-h”的结构域被指定为q型,其中x是任何氨基酸和数量表示保守氨基酸残基之间的共有间隔。(ii)Q型ZF的某些修饰的结构域,包括在图案中的Q型Zf中的1至5个降解的氨基酸和两个半胱氨酸(Cys,C)和两个组织(他,H)之间的间距中的某些修饰。,被归类为m型;基于氨基酸的保守基序和保守间隔,M型ZF进一步分为M1至M13亚型。(iii)在第二个Cys和第一个在第二个Cys之间具有超过12(Z1型)和小于12(Z2型)氨基酸的C 2 H 2-ZFPS结构域被分类为Z型。(iv)在第二次CYS和第一个与第一个氨基酸之间的C2H2-ZFPS结构域和第一个氨基酸分为C型。(v)D型在C2H2-ZF区域中不含第二个。GydF4y2Ba
此外,基于C2H2-ZF结构域的类型和数量,CSZFPS进一步分为九个基团,如图4所示。GydF4y2Ba2GydF4y2Baa和附加文件GydF4y2Ba1GydF4y2Ba:表S2:(1)CS1Q(GydF4y2Ba1GydF4y2Ba圣集团GydF4y2Ba问:GydF4y2Ba类型GydF4y2BaCSGydF4y2BaZFP,包含31名成员)和CS2Q()GydF4y2Ba2GydF4y2Ba它们的蛋白序列中分别含有1个和2个保守基序“QALGGH”。(2) Cs1M群包含2 ~ 5个m型保守基序序列,有24个CsZFPs被归为Cs1M。(3) Cs(2-5) M组包含2 ~ 5个M型保守基序序列,有4个成员属于这一组。(4) Cs1C (GydF4y2Ba1GydF4y2Ba圣集团GydF4y2BaCGydF4y2Ba类型GydF4y2BaCSGydF4y2BaZFP)包含一个C型保守的主题序列。将14个CSZFP分为CS1C。(5)CS2MIX(GydF4y2Ba混合GydF4y2BaTure),CS3MIX,CS4MIX和CS8MIX组含有保守的主题序列的混合类型。和9,29,5和1个CSZFP分别可以分别聚集到CS2MIX,CS3MIX,CS4MIX和CS8MIX中。总之,CS1Q含有最大数量的C 2 H 2-ZF基因(31),其次是Cs3Mix(29)和CS1M(24),并且只有一个基因(CSA5G623900)属于CS8Mix。GydF4y2Ba
基因结构和图案测定GydF4y2Ba
基因结构的分歧(例如外显子内和保守的主题多样性)提供了进化的基因功能的潜在见解[GydF4y2Ba29.GydF4y2Ba].如图1所示。GydF4y2Ba2GydF4y2Bab,内含子的数量从0变化(GydF4y2BaCSA7G432050GydF4y2Ba)至14 (GydF4y2BaCsa1G008490GydF4y2Ba).此外,同一类群中关系最密切的成员在内含子数量、外显子长度和/或位置上具有相似的外显子/内含子结构(图1)。GydF4y2Ba2GydF4y2Bab)。例如,大多数GydF4y2BaCsZFPsGydF4y2Ba在Cs1Q组中没有内含子,而只有GydF4y2BaCSA2G404810GydF4y2Ba含有两个内含子,可以在CS2Q组中观察到相同的基因结构。虽然可以在CS2MIX,CS3MIX,CS4MIX和CS8MIX组中找到最大数量的内部内部内的内部内部内部内的内部内部内部。这些结果表明,CSZFPS的基因结构变化可能在进化过程中在其功能分歧中发挥重要作用。GydF4y2Ba
利用MEME程序预测黄瓜CsZFP序列中假定的转换基序,如图所示。GydF4y2Ba2GydF4y2BaC,鉴定了20个不同的基序。通常,MOTIF 1,4和基序5,6,14形成了两个典型的C2H2结构域,并发现它们中的一种或两种在CSZFP蛋白中存在,以形成保守的指状折叠的统治。MOTIF 1含有特定于锌手指螺旋中的植物特定保守的“QALGGH”,其先前被归类为Q型锌手指基序,并报告了在特定DNA碱基识别中发挥关键作用[GydF4y2Ba5.GydF4y2Ba].此外,129个CSZFP中的43个在锌指螺旋中保存了“Qalggh”图案。图案2,8和10形成了Sprt样锌丝带域,其作为Zn的作用GydF4y2Ba+GydF4y2Ba绑定区(附加文件GydF4y2Ba1GydF4y2Ba:表S1,2,附加文件GydF4y2Ba2GydF4y2Ba:图S1)。最后,CsZFP系统发育树中亲缘关系最密切的成员具有相似的基序组成,表明同一类群内的CsZFP蛋白存在功能相似性。GydF4y2Ba
顺式作用调节元件的预测GydF4y2Ba
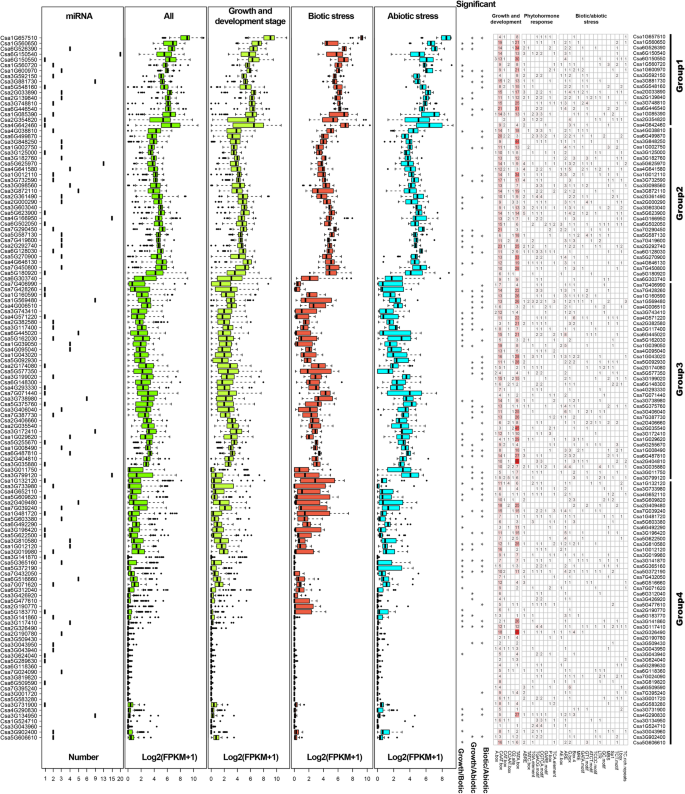
更好地理解的功能GydF4y2BaCsZFPsGydF4y2Ba特别是在生物和非生物应激条件下,采用1.5kb属于启动子地区的CSZFPS翻译开始部位(TSS)上游的1.5 kB非编码序列,以预测GydF4y2BaCIS.GydF4y2Ba- PlantCare数据库中的注释元素(图。GydF4y2Ba3.GydF4y2Ba和额外的文件GydF4y2Ba1GydF4y2Ba:表S3,4)。结果表明,启动子序列GydF4y2BaCsZFPsGydF4y2Ba有各种各样的GydF4y2BaCIS.GydF4y2Ba- 在所有启动子地区都存在广泛存在的Caat-Box,CCAT-Box和Tata-Box等元素,暗示GydF4y2BaCsZFPsGydF4y2Ba参与植物生长和发展的调控。而且,这是GydF4y2BaCIS.GydF4y2Ba- 在相应的情况下,还检测到对生物和非生物胁迫和植物激素的反应GydF4y2BaCsZFPsGydF4y2Ba其中,ABRE(脱落酸响应元件)、CGTCA-motif、TATC-box、TGACG-motif (MeJA响应元件)、TCA-element(水杨酸响应元件)是对植物激素响应的元件,AE-box、G-box、MBS和LTR等与生物和非生物条件相关。此外,根据表达水平GydF4y2BaCsZFPsGydF4y2Ba在生长发育过程中以及对压力的反应中GydF4y2BaCsZFPsGydF4y2Ba可以分为四组。而且,这些第1组GydF4y2BaCsZFPsGydF4y2Ba在生长和发展阶段以及生物和非生物应激期间表达更高的表达水平,通常包含更多GydF4y2BaCIS.GydF4y2Ba- 推动者区域中的再抑制元素。在第4组中发现相反的结果(图。GydF4y2Ba3.GydF4y2Ba),较低表达GydF4y2BaCsZFPsGydF4y2Ba含量较少GydF4y2BaCIS.GydF4y2Ba-Elements,展示了数量GydF4y2BaCIS.GydF4y2Ba- 调节元素在调节表达方面发挥着重要作用GydF4y2BaCsZFPsGydF4y2Ba。GydF4y2Ba
靶向CsZFPs转录本的miRNAsGydF4y2Ba
miRNA是高度保守的非编码RNA,其可以调节其目标mRNA的翻译[GydF4y2Ba30.GydF4y2Ba].因此,为了了解转录后调整的洞察GydF4y2BaCsZFPsGydF4y2Ba,潜在的miRNA瞄准GydF4y2BaCsZFPsGydF4y2Ba预测成绩单。如图1所示。GydF4y2Ba3.GydF4y2Ba和额外的文件GydF4y2Ba1GydF4y2Ba:表S5,许多miRNAs可靶向共93个GydF4y2BaCsZFPsGydF4y2Ba转录物。对应的miRNA目标的数量GydF4y2BaCsZFPsGydF4y2Ba抄本范围为1 ~ 20。例如,文字记录GydF4y2BaCSA2G382580GydF4y2Ba,九个miRNA靶向它,包括CSA-MIR-N10,CSA-MIRN8-3P,CSA-GROM-23,MIRN6,PC-3P-318,270,PC-5P-100,383,PC-5P-274,347,CSA-MIRN6-3P和PC-3P-45,338具有切割和/或翻译抑制。尽管GydF4y2BaCSA2G354820GydF4y2Ba仅由CSA-MIR-N01针对翻译抑制的目标。GydF4y2Ba
典型CSZFPS的位置检测GydF4y2Ba
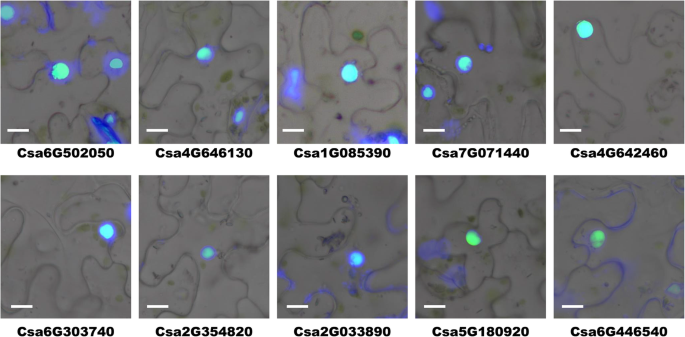
在硅预测中表明大多数CSZFP位于核。为了验证此结果并显示CSZFPS功能模式,选择来自不同组的10个典型的CSZFP以进行亚细胞定位分析。如图1所示。GydF4y2Ba4.GydF4y2Ba,所有测试的CSZFP,包括CAS6G502050,CAS6G303740,CAS4G646130,CAS4G642460,CAS1G085390,CAS7G071440,CAS2G35420,CAS2G03890,CAS5G180920,CAS2G03890,CAS5G180920和CSA6G446540,与预测一致,表明CSZFP可能会导致黄瓜中的生物作用。核[GydF4y2Ba31.GydF4y2Ba].然而,除了激活或抑制细胞核中的基因转录之外,含有蛋白质的锌指结构结构域还可以涉及蛋白质 - 蛋白质相互作用,组蛋白甲基化,双支架RNA结合的调节[GydF4y2Ba32.GydF4y2Ba].因此,这些CsZFPs的精确功能有待进一步的实验探索。GydF4y2Ba
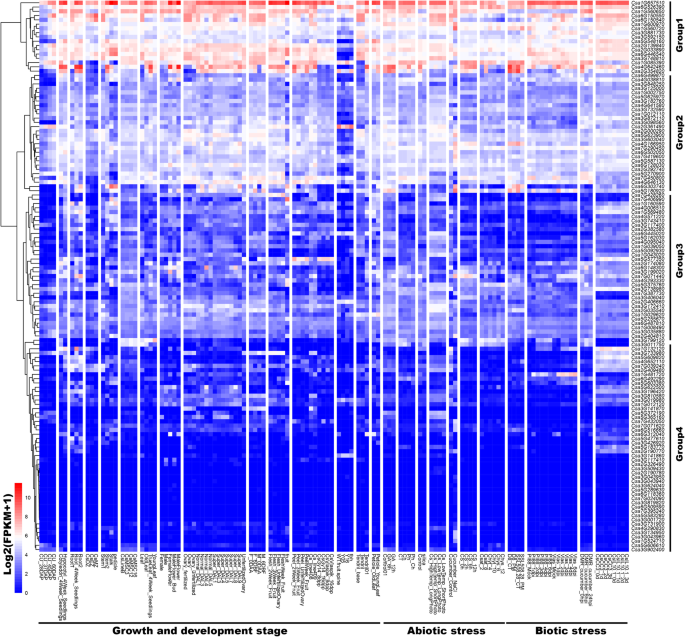
CsZFP基因在黄瓜不同生长发育阶段的表达谱分析GydF4y2Ba
试图发现GydF4y2BaCsZFPsGydF4y2Ba在黄瓜不同的生长发育阶段,各蛋白的表达量不同GydF4y2BaCsZFPsGydF4y2Ba利用现有RNA-seq转录组数据进行分析。根据数据集的log2-transformed FPKM (fragments per kilobase of transcript per million fragments mapped)值,不同的表达模式GydF4y2BaCsZFPsGydF4y2Ba在Heatmap图中示出(图。GydF4y2Ba5.GydF4y2Ba和额外的文件GydF4y2Ba1GydF4y2Ba:表S6)。这些GydF4y2BaCsZFPsGydF4y2Ba在不同的组织中表达,主要包括根,子叶,缺杆子,茎,叶,花,种子。根据他们的表达水平,这些GydF4y2BaCsZFPsGydF4y2Ba可以聚集成四组,其中第4组中的基因显示所有组织中的表达水平或低表达水平,但对第1组基因的表达水平要高得多,并且对不同的处理显着响应显着响应(图。GydF4y2Ba3.GydF4y2Ba).例如,经过4天的种植,表达水平GydF4y2BaCsZFPsGydF4y2Ba在根分化区、伸长区和分生区三个发育区表现出不同的模式。其中,表达水平GydF4y2BaCsa1G657510GydF4y2Ba和GydF4y2BaCSA6G150550.GydF4y2Ba在三个部分中高度诱导,相比之下,26份GydF4y2BaCsZFPsGydF4y2Ba显示没有表情。然而,两个基因(GydF4y2BaCSA1G132120GydF4y2Ba和GydF4y2BaCsa5G548160GydF4y2Ba)在根分化区大量表达,而在分生区则没有表达。在4周幼苗的子叶和下胚轴中,有显著性差异GydF4y2BaCsa1G657510GydF4y2Ba显着表达了。另外,这些基因的表达水平在茎,茎和椎弓根中不同。基因表达值GydF4y2BaCsa1G657510GydF4y2Ba茎(最大FPKM 626.52),茎(最大FPKM 2958.85)和椎弓根(最大FPKM 1661.78)中相对较高。在旧的和年轻的叶子中,每个的FPKM表达水平GydF4y2BaCSZFP.GydF4y2Ba范围从0 (GydF4y2BaCSA1G524710GydF4y2Ba)至603.39 (GydF4y2BaCsa1G657510GydF4y2Ba)和0(GydF4y2BaCSA2G190780GydF4y2Ba)至362.59(GydF4y2BaCsa1G657510GydF4y2Ba), 分别。在水果和果皮中,GydF4y2BaCSA6G303740GydF4y2Ba和GydF4y2BaCSA7G406990.GydF4y2Ba表现出果实的高表达水平,但不是果皮。所有这些结果表明不同的表达GydF4y2BaCsZFPsGydF4y2Ba可能在各种组织中重要而多样化。GydF4y2Ba
除检测各基因的表达水平外GydF4y2BaCSZFP.GydF4y2Ba在不同的组织发育阶段,如授粉后的不同时间点,不同果实的果刺,分析了它们的功能。授粉后28、37、45和60天,大部分GydF4y2BaCsZFPsGydF4y2Ba随着时间的发展,表达模式增加。其中,表达水平GydF4y2BaCSA6G150550.GydF4y2Ba授粉后28 ~ 60 d显著增加(15.41 ~ 335.51)。而GydF4y2BaCSA7G450800.GydF4y2Ba表达表达模式表达的模式,其表达水平从第28天(3.31)到第60天(1.12)降低。而且,表达水平GydF4y2BaCsZFPsGydF4y2Ba在水果脊柱上,果实为0.5和1.6厘米,长时间表现出独特的表达模式。表达水平GydF4y2BaCsa1G560650GydF4y2Ba和GydF4y2BaCSA2G139840GydF4y2Ba差异不显著,但多数呈随果实发育而增加的趋势。GydF4y2Ba
生物和非生物应激下CSZFP的表达分析GydF4y2Ba
深入了解…的表达GydF4y2BaCsZFPsGydF4y2Ba响应于生物和非生物胁迫,首先,开采RNA-SEQ转录组数据集的LOM2转化的FPKM值,如图2所示。GydF4y2Ba5.GydF4y2Ba。在嗜酸盐蛋白(GA)治疗中,大部分GydF4y2BaCsZFPsGydF4y2Ba显示没有显着表达12小时治疗的变化,但表达水平GydF4y2BaCSA4G642460GydF4y2Ba从253.87增加到647,以及其他GydF4y2BaCsZFPsGydF4y2Ba(GydF4y2BaCSA4G166950GydF4y2Ba和GydF4y2BaCSA7G450800.GydF4y2Ba)响应于GA治疗而显示出类似的表达模式。尽管,GydF4y2BaCSA6G446540GydF4y2Ba那GydF4y2BaCSA5G623900.GydF4y2Ba那GydF4y2BaCsa3G748810GydF4y2Ba, 和GydF4y2BaCsa3G098560GydF4y2Ba在各自的转录水平中显示出降低模式。响应盐压力,GydF4y2BaCsa1G600970GydF4y2Ba那GydF4y2BaCSA2G404810GydF4y2Ba, 和GydF4y2BaCSA7G419600GydF4y2Ba高度诱导。此外,响应于生物应力,大部分GydF4y2BaCsZFPsGydF4y2Ba在感染霜霉病的4周龄叶子中表达或减少表达模式,表明这些GydF4y2BaCsZFPsGydF4y2Ba对霜霉病有不同的反应。综上所述GydF4y2BaCsZFPsGydF4y2Ba从第1,2和3组,3个可能在黄瓜生长和发展中发挥更重要的作用,以及对生物和非生物胁迫的反应。GydF4y2Ba
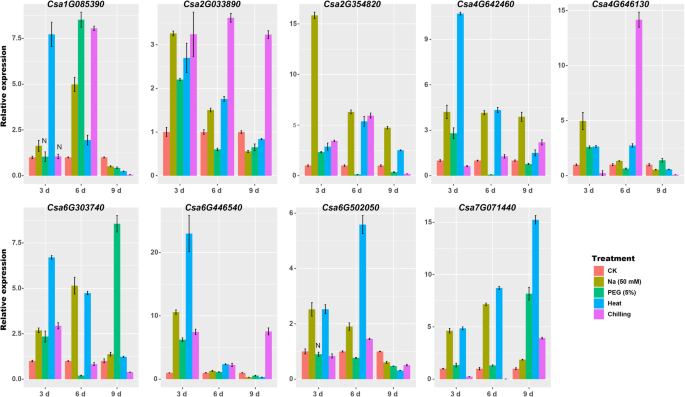
此外,9GydF4y2BaCsZFPsGydF4y2Ba,表明了相对较高的表达水平和/或已在其他植物(例如:GydF4y2Ba拟南芥GydF4y2Ba对盐、干旱、热、冷胁迫下的表达模式进行qRT-PCR分析(图1)。GydF4y2Ba6.GydF4y2Ba).七个GydF4y2BaCsZFPsGydF4y2Ba显着诱导3 d盐处理和两个GydF4y2BaCsZFPsGydF4y2Ba(GydF4y2BaCSA1G085390.GydF4y2Ba和GydF4y2BaCSA6G303740GydF4y2Ba)与对照相比,在6 d盐处理中高度表达。最显着的案例是基因GydF4y2BaCSA2G354820GydF4y2Ba在3天的盐处理下诱导超过15倍。然后在干旱胁迫的情况下,表达水平GydF4y2BaCSA1G085390.GydF4y2Ba那GydF4y2BaCSA6G303740GydF4y2Ba, 和GydF4y2BaCSA7G071440GydF4y2Ba峰值达到峰值,分别与6d,9 d和9 d干旱治疗分别改变7.5倍。虽然其他人表现出较低的表达,以应对干旱胁迫。响应热应力,八GydF4y2BaCsZFPsGydF4y2Ba在处理3 d或6 d时上调,9 d时下调至低表达水平。最高的诱导率是GydF4y2BaCSA6G446540GydF4y2Ba结果显示>在3d时的表达量是对照的20倍。然而,GydF4y2BaCSA7G041440GydF4y2Ba随着时间的时间逐步地诱导,9天与控制相比达到15倍。在冷凝压力的情况下,两个GydF4y2BaCsZFPsGydF4y2Ba(GydF4y2BaCSA1G085390.GydF4y2Ba和GydF4y2BaCSA4G646130GydF4y2Ba)在处理6 d时显著诱导,变化为7.5倍和14倍,其余均轻微诱导。结果显示,所有9个GydF4y2BaCsZFPsGydF4y2Ba对这四种非生物胁迫均有反应。GydF4y2Ba
Csa4G642460和Csa6G303740是细胞死亡诱导剂GydF4y2Ba
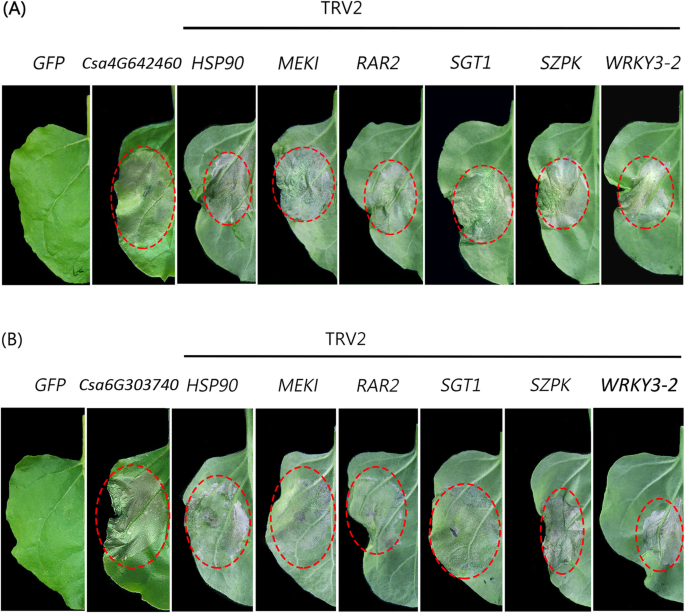
5天后瞬时表达GydF4y2BaCSA4G642460GydF4y2Ba和GydF4y2BaCSA6G303740GydF4y2Ba在GydF4y2BaN. Benthamiana.GydF4y2Ba在相应的区域,可以观察到细胞的死亡(图。GydF4y2Ba7.GydF4y2Baa和b)。揭示细胞是否死亡GydF4y2BaN. Benthamiana.GydF4y2Ba具体的,GydF4y2BaCSA4G642460GydF4y2Ba和GydF4y2BaCSA6G303740GydF4y2Ba瞬时表达GydF4y2BaSolanum lycopersicum.GydF4y2Ba。观察到这一点GydF4y2BaCSA4G642460GydF4y2Ba和GydF4y2BaCSA6G303740GydF4y2Ba在番茄的叶子中也是细胞死亡的诱导剂(附加文件GydF4y2Ba2GydF4y2Ba:图S2)。细胞死亡通常依赖于植物免疫系统,是多种受体和防御信号转导途径的结果。为了验证哪些信号转导途径参与GydF4y2BaCSA4G642460GydF4y2Ba和GydF4y2BaCSA6G303740GydF4y2Ba调节细胞死亡,一系列负责R (GydF4y2BaR.GydF4y2BaEsistance)蛋白质功能,例如Hsp90,SGT1和RAR2,以及包括MEK1和SIPK的MAPK级联基因,并通过病毒诱导的基因沉默(Vigs)方法逐一沉默。如图1所示。GydF4y2Ba7.GydF4y2BaA和BS,在沉默这些基因后GydF4y2BaN. Benthamiana.GydF4y2Ba,细胞死亡诱导能力GydF4y2BaCSA4G642460GydF4y2Ba和GydF4y2BaCSA6G303740GydF4y2Ba没有废除。总之,GydF4y2BaCSA4G642460GydF4y2Ba和GydF4y2BaCSA6G303740GydF4y2Ba是细胞死亡诱导剂,诱导能力不需要上面GydF4y2BaR.GydF4y2Ba信号转导途径中的基因。GydF4y2Ba
细胞死亡分析。那些GydF4y2BaN. Benthamiana R.GydF4y2Ba基因(GydF4y2BaHSP90.GydF4y2Ba那GydF4y2BaSGT1GydF4y2Ba那GydF4y2BaRAR2GydF4y2Ba那GydF4y2BaMEK1GydF4y2Ba那GydF4y2BaSIPKGydF4y2Ba和GydF4y2BaWRKY3-2GydF4y2Ba)受到Vigs的方法瞬间沉默。然后GydF4y2Ba一种GydF4y2BaCSA4G642460GydF4y2Ba和GydF4y2BaB.GydF4y2BaCSA6G303740GydF4y2Ba在沉默植物的叶子中瞬时过度表达。虽然GFP,GydF4y2BaCSA4G642460GydF4y2Ba, 和GydF4y2BaCSA6G303740GydF4y2Ba在不沉默的植物的叶子中是平行的过表达作为控制的叶子。与每个TRV构建体的三种独立重复一起获得类似的结果。Junliang Yin的照片是由Junliang Yin绘制的GydF4y2Ba
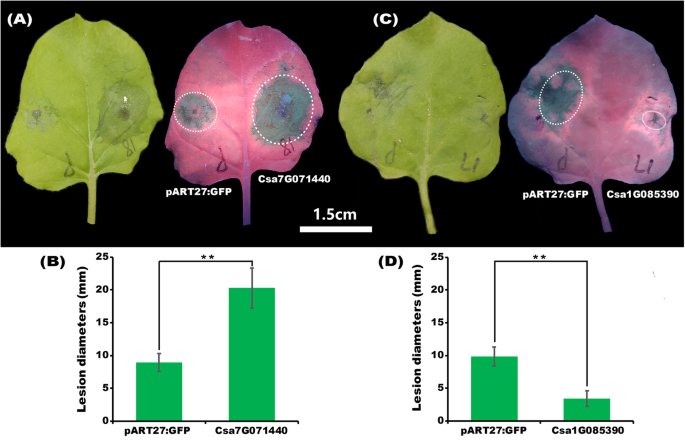
Csa1G085390促进而Csa7G071440抑制本氏菌病原菌定植GydF4y2Ba
以前的瞬态表达测试显示GydF4y2BaCSA1G085390.GydF4y2Ba和GydF4y2BaCSA7G071440GydF4y2Ba不是细胞死亡诱导剂为了进一步分析GydF4y2BaCSA1G085390.GydF4y2Ba和GydF4y2BaCSA7G071440GydF4y2Ba这是对生物胁迫的反应。的病原体GydF4y2BaN. Benthamiana.GydF4y2Ba那GydF4y2Ba5种GydF4y2Ba(菌株88,069)被接种到烟草叶中以检查这两个瞬时转基因植物的表型。如图1所示。GydF4y2Ba8.GydF4y2BaA和c,病变的大小在GydF4y2BaCSA7G071440GydF4y2Ba瞬时表达的植物大于阴性对照植物中的植物。然而,观察到相反的现象GydF4y2BaCSA1G085390.GydF4y2Ba瞬时表达植物,指示GydF4y2BaCSA1G085390.GydF4y2Ba和GydF4y2BaCSA7G071440GydF4y2Ba对病原体攻击的反应不同。左侧病灶直径的统计分析支持上述结果(图1)。GydF4y2Ba8.GydF4y2BaB和d)病灶直径GydF4y2BaCSA7G071440GydF4y2Ba瞬时表达的植物显着大于阴性对照植物的植物,而那个GydF4y2BaCSA1G085390.GydF4y2Ba瞬时转基因植物显着较小。GydF4y2Ba
CSA1G085390和CSA7G071440通过初始诱导H增强盐和耐旱性GydF4y2Ba2GydF4y2BaO.GydF4y2Ba2GydF4y2Ba在n benthamianaGydF4y2Ba
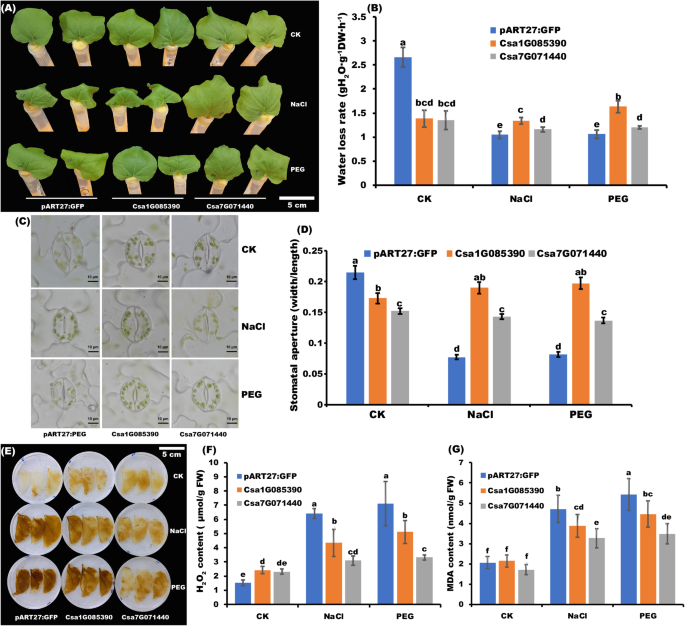
CSA1G085390.GydF4y2Ba和GydF4y2BaCSA7G071440GydF4y2Ba这两个是典型的吗?GydF4y2BaCsZFPsGydF4y2Ba这表明它们可能在盐和干旱胁迫下发挥着重要的作用(图1)。GydF4y2Ba6.GydF4y2Ba).为了验证这一假设,暂态转基因植物(GydF4y2BaCSA1G085390.GydF4y2Ba和GydF4y2BaCSA7G071440)GydF4y2Ba在盐和干旱胁迫下分析。如图1所示。GydF4y2Ba9.GydF4y2BaA,脱离的叶子GydF4y2BaN. Benthamiana.GydF4y2Ba在4小时内不受正常情况(CK)的任何压力治疗良好的生长。然而,用75mmol NaCl和5%PEG处理,阴性对照植物中的叶片变得枯萎和轧制。与CK病情和阴性对照植物相比,叶子GydF4y2BaCSA1G085390.GydF4y2Ba短暂的转基因植物是健康的,在干旱胁迫下没有滚动,但盐胁迫下降,但是GydF4y2BaCSA7G071440GydF4y2Ba瞬时转基因叶片对这两种胁迫均表现出抗性。然后检测上述植物的失水率(图1)。GydF4y2Ba9.GydF4y2Bab),瞬时转基因叶片的失水率在CK条件下比负对照下降。而NaCl和PEG处理下,负对照叶片失水率显著下降,而瞬时转基因叶片失水率没有显著下降,说明在这两种胁迫下,吸收水分能力更强的瞬时转基因植株的失水率更高。由于瞬时转基因植物和对照植物叶片失水率的差异与叶片气孔开度的差异有关,因此分析了气孔开度的状况。在正常条件下,瞬时转基因植株叶片气孔开度明显降低(图1)。GydF4y2Ba9.GydF4y2Bac).此外,负对照植株气孔开度的减小幅度高于瞬时转基因植株,这与两种胁迫下的失水率均较低的趋势一致(图5)。GydF4y2Ba9.GydF4y2Bad).此外,HGydF4y2Ba2GydF4y2BaO.GydF4y2Ba2GydF4y2Ba通过DAB染色和精确测量评估(图。GydF4y2Ba9.GydF4y2BaE和f)。在正常情况下,棕色(表示HGydF4y2Ba2GydF4y2BaO.GydF4y2Ba2GydF4y2Ba)在短暂的转基因植物中,区域显着增加。在两个压力下,棕色在所有植物中都变得更深,但瞬时转基因植物的增加低于阴性对照的升高,这与H的准确含量一致GydF4y2Ba2GydF4y2BaO.GydF4y2Ba2GydF4y2Ba在图中。GydF4y2Ba9.GydF4y2Bae。此外,还测量MDA含量,并且观察到瞬时转基因植物中MDA的较低含量,而不是在两个应力下的阴性对照中的含量(图。GydF4y2Ba9.GydF4y2Bag)。所有结果都表明GydF4y2BaCSA1G085390.GydF4y2Ba和GydF4y2BaCSA7G071440GydF4y2Ba可以通过H的初始积累改善应力阻力GydF4y2Ba2GydF4y2BaO.GydF4y2Ba2GydF4y2Ba通过触发早期的自卫系统。GydF4y2Ba
瞬时转基因(GydF4y2BaCSA1G085390.GydF4y2Ba和GydF4y2BaCSA7G071440GydF4y2Ba)和阴性对照(pART27:GFP)在盐、干旱胁迫和正常条件下(CK)处理4 h。GydF4y2Ba一种GydF4y2Ba盐和干旱胁迫下瞬时转基因与负对照植株的表型比较。相应的水处理作为负对照处理(CK)。失水率的测量GydF4y2BaB.GydF4y2Ba,过氧化氢(hGydF4y2Ba2GydF4y2BaO.GydF4y2Ba2GydF4y2Ba)内容GydF4y2BaFGydF4y2Ba和丙二醛(MDA)GydF4y2BaGGydF4y2Ba上述叶片中的内容分别。不同的字母表示在0.05的水平上的显着差异。GydF4y2BaCGydF4y2Ba瞬时转基因和阴性对照植物叶片气孔观察。各处理各30个叶片。GydF4y2BaD.GydF4y2Ba瞬时转基因和对照植物叶片中气孔孔的定量。不同的字母表示在0.05的水平上的显着差异。GydF4y2BaE.GydF4y2BaHGydF4y2Ba2GydF4y2BaO.GydF4y2Ba2GydF4y2Ba通过3,3’-二氨基联苯胺(DAB)染色检测瞬时转基因植物和对照植物的叶片。比例尺:5厘米。Junliang Yin的照片是由Junliang Yin绘制的GydF4y2Ba
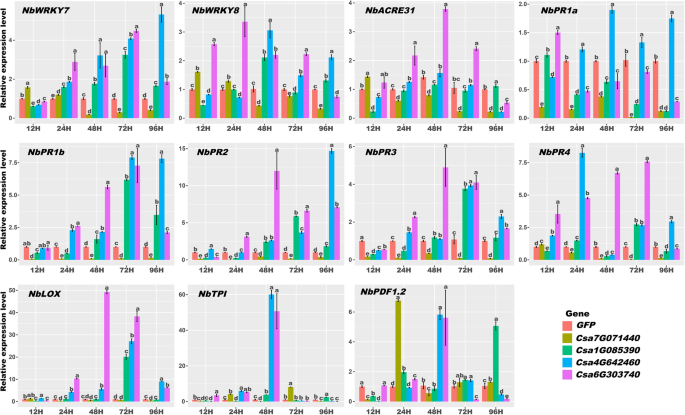
瞬时转基因植物Csa1G085390、Csa7G071440、Csa4G642460和Csa6G303740致病相关(PR)基因表达分析GydF4y2Ba
如上所述,GydF4y2BaCsZFPsGydF4y2Ba可以被非生物和非生物应激诱导。因此,四GydF4y2BaCsZFPsGydF4y2Ba, 包括GydF4y2BaCSA1G085390.GydF4y2Ba那GydF4y2BaCSA7G071440GydF4y2Ba那GydF4y2BaCSA4G642460GydF4y2Ba, 和GydF4y2BaCSA6G303740GydF4y2Ba,瞬时过度表达GydF4y2BaN. Benthamiana.GydF4y2Ba树叶。然后是三个PTI相关基因(GydF4y2Banbwrky7.GydF4y2Ba那GydF4y2Banbwrky8.GydF4y2Ba和GydF4y2Banbacre31.GydF4y2Ba),三个SA反应基因(GydF4y2Banbpr1a.GydF4y2Ba那GydF4y2Banbpr1b.GydF4y2Ba和GydF4y2BaNBPR2.GydF4y2Ba)和五个JA依赖性免疫基因(GydF4y2Banbpr3.GydF4y2Ba那GydF4y2BaNBPR4.GydF4y2Ba那GydF4y2Banblox.GydF4y2Ba那GydF4y2BaNBTPI.GydF4y2Ba和GydF4y2BaNbPDF1.2GydF4y2Ba)在这些转基因植物中进行表达分析。如图1所示。GydF4y2Ba10.GydF4y2Ba,大多数基因GydF4y2BaCSA7G071440GydF4y2Ba短暂的转基因植物在12小时内下降,例如GydF4y2Banbwrky7.GydF4y2Ba那GydF4y2Banbwrky8.GydF4y2Ba那GydF4y2Banbpr1a.GydF4y2Ba那GydF4y2Banbpr1b.GydF4y2Ba那GydF4y2BaNBPR2.GydF4y2Ba和GydF4y2BaNbPDF1.2GydF4y2Ba,显示过度表达GydF4y2BaCSA7G071440GydF4y2Ba可以降低PR基因表达以抑制植物防御。这可能是为什么观察到较大疾病病变的原因GydF4y2BaCSA7G071440GydF4y2Ba转基因植物在病原体感染后,如图所示。GydF4y2Ba8.GydF4y2Ba然而,这些基因的表达水平在GydF4y2BaCSA1G085390.GydF4y2Ba特定时间点瞬时转基因植物。例如,GydF4y2Banbwrky7.GydF4y2Ba高度诱导24至48小时。GydF4y2BaNBTPI.GydF4y2Ba在48小时的时间点调节。这可以给出解释GydF4y2BaCSA1G085390.GydF4y2Ba瞬时转基因植株对病原侵染具有抗性。GydF4y2Ba8.GydF4y2Ba此外,这些基因的表达水平在其他两种瞬时转基因植物(GydF4y2BaCSA4G642460GydF4y2Ba和GydF4y2BaCSA6G303740GydF4y2Ba)从12小时至96小时。作为例证,GydF4y2BaNbwrky 8.GydF4y2Ba在12 h内被高度诱导,而GydF4y2Ba公关GydF4y2Ba基因,如GydF4y2Banbpr1b.GydF4y2Ba那GydF4y2BaNBPR2.GydF4y2Ba那GydF4y2Banbpr3,GydF4y2Ba从24小时到72小时,显着提高了监管GydF4y2BaCSA6G303740GydF4y2Ba转基因植物。另外,相同的表达变化GydF4y2Banbwrkys.GydF4y2Ba和GydF4y2BaNBPRS.GydF4y2Ba观察到GydF4y2BaCSA4G642460GydF4y2Ba转基因植物。这些结果可以证明GydF4y2BaCSA4G642460GydF4y2Ba和GydF4y2BaCSA6G303740GydF4y2Ba基因可以触发GydF4y2Ba公关GydF4y2Ba激活过敏反应的基因(如图所示的留下细胞死亡。GydF4y2Ba7.GydF4y2Ba).GydF4y2Ba
讨论GydF4y2Ba
锌指c2h2型蛋白广泛存在于真核生物界,在激素信号传导、DNA或RNA结合、应激反应等诸多生物过程中发挥着重要作用[GydF4y2Ba9.GydF4y2Ba那GydF4y2Ba33.GydF4y2Ba].此外,在几种植物系统中进行了C2H2型ZFP的基因组鉴定,而不是在黄瓜中进行。因此,为了在黄瓜中获得C2H2型ZFP的功能,综合分析GydF4y2BaCsZFPsGydF4y2Ba在目前的研究中进行了。最后,129个全长GydF4y2BaCsZFPsGydF4y2Ba被识别出来(表GydF4y2Ba1GydF4y2Ba),可以根据植物特异性保守氨基酸序列“qalggh”的变化和C 2 H 2-ZF结构域内的金属配体之间的距离分为四组(图。GydF4y2Ba2GydF4y2Ba).基于数量和结构ZF结构域的C2H2-ZFP的原理分类已经在酵母中进行了研究GydF4y2Ba拟南芥GydF4y2Ba[GydF4y2Ba5.GydF4y2Ba那GydF4y2Ba34.GydF4y2Ba].在不同的植物种类中,保守基序“QALGGH”的修饰被广泛用于分类[GydF4y2Ba35.GydF4y2Ba].在黄瓜中,大多数CsZFPs包含一个或两个带有QALGGH基序的C2H2结构域,被鉴定为Cs1Q和Cs2Q亚群GydF4y2Ba1GydF4y2Ba:表S2)。相同的典型组已被识别GydF4y2BaBrassica Rapa.GydF4y2BaL.这表明这些蛋白质可以参与植物特异性生命处理[GydF4y2Ba12.GydF4y2Ba那GydF4y2Ba31.GydF4y2Ba].此外,已经鉴定了不含该典型ZF结构域的其他三组,意味着这些C2H2-ZFP的功能多样性在植物生长和发育中。通过定位分析,预计大多数CSZFPS位于核中,这些CSZFPS已经通过亚细胞定位分析证实,表明它们确实是核中的转录因子,但来自位于细胞中的CS1Q组的CSA7G406990属于位于内浆网的CS1C组的墙壁和CSA2G292740(表GydF4y2Ba1GydF4y2Ba和额外的文件GydF4y2Ba1GydF4y2Ba:表S2),表明同一系统发育组的CsZFPs成员不一定对应相同的亚细胞定位。此外,除C2H2-ZFPs在细胞核内的DNA或RNA结合功能外[GydF4y2Ba31.GydF4y2Ba[未在核中定位的CSZFP的成员可能具有其他特殊功能,并在信号转导中发挥重要作用。GydF4y2Ba
基因家族分析的结构和物理化学特性可以在进化过程中表明每个成员的多样性[GydF4y2Ba36.GydF4y2Ba].我们的结果表明了分子量,理论Pi值,染色体位置和外显子数的各种变化,其阐明了黄瓜可能通过基因重复和/或在逆转转录后融入基因组区域中发生的进化变化[GydF4y2Ba9.GydF4y2Ba].基因的复制模式,包括片段复制和串联复制,被认为是基因组进化的特征特征和主要驱动力[GydF4y2Ba37.GydF4y2Ba].串联重复被定义为在染色体上彼此相邻的同源基因[GydF4y2Ba38.GydF4y2Ba].在目前的研究中,基因重复分析显示,没有发生串联和节段性重复,这与黄瓜基因组缺乏近期全基因组重复事件和串联复制的事实一致[GydF4y2Ba39.GydF4y2Ba那GydF4y2Ba40GydF4y2Ba].数量较少的GydF4y2BaCSZFP.GydF4y2Ba基因与GydF4y2Ba拟南芥GydF4y2Ba,水稻和强奸,也可能归因于黄瓜基因组中最近的重复事件。GydF4y2Ba
CSZFPS是植物生长和发育的调控中的重要转录因子,激素代谢和压力反应。尽管GydF4y2BaCIS.GydF4y2Ba- 在促进区中存在的元素在响应于多种刺激的基因的转录水平中起关键作用[GydF4y2Ba41.GydF4y2Ba].我们的结果确定了几个GydF4y2BaCIS.GydF4y2Ba- 与植物生长和发育,植物激素,生物和非生物应激相关的元素,包括Tata-Box,ABRE,G盒,在相应的启动子区GydF4y2BaCsZFPsGydF4y2Ba(图。GydF4y2Ba3.GydF4y2Ba和额外的文件GydF4y2Ba1GydF4y2Ba:表S3)。所有这些GydF4y2BaCIS.GydF4y2Ba-调节元素已在研究GydF4y2Ba拟南芥GydF4y2Ba[GydF4y2Ba42.GydF4y2Ba那GydF4y2Ba43.GydF4y2Ba].因此,预测广泛GydF4y2BaCIS.GydF4y2Ba- 推动者区域中的分子GydF4y2BaCsZFPsGydF4y2Ba建议这一点GydF4y2BaCsZFPsGydF4y2Ba可能在响应各种胁迫和植物激素调节中起重要作用。除功能外GydF4y2BaCIS.GydF4y2Ba- 重构元素,MiRNA也在植物生长,应力和其他形态过程的发展中起重要作用[GydF4y2Ba44.GydF4y2Ba].例如,在各种代谢和生物过程中,在小麦函数中以小麦函数鉴定的Tae-miR9674a-5p,tae-miR9781和Tae-miR9655-3p [GydF4y2Ba7.GydF4y2Ba].在黄瓜中,miRNA目标的数量对应GydF4y2BaCsZFPsGydF4y2Ba转录物的范围为1至20(图。GydF4y2Ba3.GydF4y2Ba和额外的文件GydF4y2Ba1GydF4y2Ba:表S5),表明不同的miRNA可以调节翻译过程GydF4y2BaCsZFPsGydF4y2Ba在多种生理和应激诱导的细胞反应期间,与杜兰姆小麦的研究一致[GydF4y2Ba7.GydF4y2Ba].GydF4y2Ba
所有预测GydF4y2BaCIS.GydF4y2Ba-调节元件和miRNAs的响应GydF4y2BaCsZFPsGydF4y2Ba提示它们可能参与黄瓜的生长发育和各种胁迫。此外,多项研究表明,大部分C2H2-ZFPs作为转录因子被广泛应用于植物生长发育中[GydF4y2Ba45.GydF4y2Ba那GydF4y2Ba46.GydF4y2Ba].在目前的研究中,通过公开的RNA-SEQ数据分析,表达模式GydF4y2BaCsZFPsGydF4y2Ba证明这些基因参与组织和器官发育,尤其是根和花卉发育(图。GydF4y2Ba5.GydF4y2Ba),说明该基因家族在黄瓜生长和发育中的重要功能。从研究中获得了相同的结论GydF4y2Ba芸苔GydF4y2Ba哪显示了高表达水平的大部分GydF4y2Bab·拉伯GydF4y2Ba在至少一种测试组织中观察到C2H2-ZFP基因,此外,其中一百一百是在六个组织中显着表达的[GydF4y2Ba12.GydF4y2Ba].这些基因可能主要在组织生长和黄瓜物种的发育中起作用,并应得的分子水平进一步研究。例如,GydF4y2BaJCZFP8.GydF4y2Ba的C2H2锌指蛋白基因GydF4y2Ba麻风树GydF4y2BaL.参与了转基因烟草的毛状体发育[GydF4y2Ba47.GydF4y2Ba].C2H2-TypeZinc手指蛋白命名GydF4y2Ba锌指蛋白1GydF4y2Ba(GydF4y2Baatzp1.GydF4y2Ba)负面规定GydF4y2Ba拟南芥蒂利亚纳GydF4y2Ba根发发起和伸长率[GydF4y2Ba48.GydF4y2Ba].GydF4y2Ba
除功能外GydF4y2BaCsZFPsGydF4y2Ba在黄瓜生长和发育中,转录分析分析已经证明,许多C 2 H 2型锌指蛋白的转录物水平在不同的非生物胁迫条件下升高,例如低温,盐,干旱,渗透胁迫和氧化应激[GydF4y2Ba8.GydF4y2Ba].例如,GydF4y2BaZat12.GydF4y2Ba据报道曾涉及多种非生物胁迫GydF4y2Ba拟南芥GydF4y2Ba[GydF4y2Ba49.GydF4y2Ba].此外,GydF4y2BaZat18.GydF4y2Ba在对干旱胁迫的反应中被发现是一个积极的调节因子GydF4y2Ba拟南芥GydF4y2Ba[GydF4y2Ba19.GydF4y2Ba].在香蕉,两个c2h2-zfps,命名为GydF4y2BaMac2H2-1GydF4y2Ba和GydF4y2BaMac2H2-2GydF4y2Ba,被鉴定为转录阻遏物,以抑制果实成熟中的乙烯生物合成基因的表达[GydF4y2Ba50.GydF4y2Ba].在黄瓜中,有一个C2H2锌指转录因子GydF4y2BaZat12GydF4y2Ba褪黑素处理可上调其表达,通过调节多胺和脱落酸代谢来缓解寒冷胁迫[GydF4y2Ba51.GydF4y2Ba].此外,GydF4y2BaATAZF2GydF4y2Ba在非生物胁迫条件下调节ABA-抑制和生长素诱导基因的重要作用[GydF4y2Ba20.GydF4y2Ba那GydF4y2Ba52.GydF4y2Ba].三种其他TFIIIA锌指蛋白的表达分析,GydF4y2BaAZF1GydF4y2Ba那GydF4y2BaAZF2GydF4y2Ba和GydF4y2BaAZF3GydF4y2Ba表明,GydF4y2BaAZF1GydF4y2Ba和GydF4y2BaAZF3GydF4y2Ba而不是在ABA处理下[GydF4y2Ba53.GydF4y2Ba].有趣的是,在我们的研究中,基因的基因GydF4y2BaATAZF2GydF4y2Ba在黄瓜GydF4y2BaCSA4G642460GydF4y2Ba这是响应干旱,盐和热应激而没有的调节,而不是对冷应激的反应(图。GydF4y2Ba6.GydF4y2Ba),与上述结果一致,证明了它们在这三种非生物胁迫下基本起作用。此外,GydF4y2BaZFP245GydF4y2Ba,C2H2型锌指蛋白质在干旱胁迫下高度诱导和过表达GydF4y2BaZFP245GydF4y2Ba增加了水稻的耐受性对抗胁迫[GydF4y2Ba54.GydF4y2Ba那GydF4y2Ba55.GydF4y2Ba那GydF4y2Ba56.GydF4y2Ba].尽管GydF4y2BaCSA6G303740GydF4y2Ba,直言基因GydF4y2BaZFP245GydF4y2Ba,响应于干旱胁迫以及热应激而言,显着调节,表明它可能涉及在黄瓜中的干旱和热应力的调节中。GydF4y2Ba
在目前的研究中,九GydF4y2BaCSZFP.GydF4y2Ba干旱、低温、高温和盐胁迫显著诱导了这些基因,表明这些基因参与了对非生物胁迫的响应(图1)。GydF4y2Ba6.GydF4y2Ba).作为一个重要的ROS,HGydF4y2Ba2GydF4y2BaO.GydF4y2Ba2GydF4y2Ba用作对非生物应激的植物反应中的信号分子[GydF4y2Ba28.GydF4y2Ba].的瞬时过表达式GydF4y2BaCSA1G085390.GydF4y2Ba和GydF4y2BaCSA7G071440GydF4y2Ba进入GydF4y2BaN. Benthamiana.GydF4y2Ba通过初始诱导H可以增强盐和干旱胁迫GydF4y2Ba2GydF4y2BaO.GydF4y2Ba2GydF4y2Ba(图。GydF4y2Ba9.GydF4y2Ba).ROS和氧化还原提示可以通过逆行信号传递来激活压力适应过程以调节代谢势态[GydF4y2Ba57.GydF4y2Ba].在这里,H的初始累积GydF4y2Ba2GydF4y2BaO.GydF4y2Ba2GydF4y2Ba在这些转基因植物中,用作信号分子,以激活防止干旱和盐胁迫的防御机制。除了,GydF4y2BaCSA1G085390.GydF4y2Ba促进和GydF4y2BaCSA7G071440GydF4y2Ba抑制病原体殖民化GydF4y2BaNGydF4y2Ba。GydF4y2BaBenthamianaGydF4y2Ba,建议GydF4y2BaCSA1G085390.GydF4y2Ba能削弱植物的防御免疫反应吗GydF4y2BaCSA7G071440GydF4y2Ba可以加强回应。考虑到这两个基因不是细胞死亡诱导者的事实,它们可能不涉及植物过敏途径。此外,这两个基因介导的确切防御途径仍不清楚,需要进一步研究。GydF4y2Ba
CSA4G642460GydF4y2Ba和GydF4y2BaCSA6G303740GydF4y2Ba在他们的过表达植物中可以诱导细胞死亡,但细胞死亡不能通过切片来挽救GydF4y2BaHSP90.GydF4y2Ba那GydF4y2BaSGT1GydF4y2Ba那GydF4y2BaRAR2GydF4y2Ba那GydF4y2BaMEK1GydF4y2Ba那GydF4y2BaSIPKGydF4y2Ba和GydF4y2BaWRKY3-2GydF4y2Ba基因(图。GydF4y2Ba7.GydF4y2Ba),表明一定有其他关键调控因子参与这一信号转导。此外,PR基因在这两种转基因植物中均有高度诱导,说明PR基因可能是一种潜在的候选基因GydF4y2BaCSA4G642460GydF4y2Ba和GydF4y2BaCSA6G303740GydF4y2Ba由于细胞死亡诱导者通常在病原体感染时发挥阳性作用,因此诱导过敏反应,GydF4y2BaCSA4G642460GydF4y2Ba和GydF4y2BaCSA6G303740GydF4y2Ba也可能在植物对病原体的抗性中发挥作用。但其在黄瓜抗病原菌中的作用有待进一步研究。有趣的是,Csa6G303740也受到盐胁迫的诱导,说明它可能也参与了黄瓜的盐胁迫响应。在今后的研究中,需要进一步分析这两个基因在生物和非生物胁迫下的稳定转化,并确定其分子机制GydF4y2BaCsZFPsGydF4y2Ba在这些压力下。GydF4y2Ba
结论GydF4y2Ba
在目前的研究中,129个全长GydF4y2BaCsZFPsGydF4y2Ba被鉴定,可根据系统发育分析分为九组。129GydF4y2BaCsZFPsGydF4y2Ba在7条染色体上不均分布,在进化过程中没有进行串联复制事件。启动子GydF4y2BaCIS.GydF4y2Ba-Element分析表明,CSZFP可能涉及调节植物激素或非生物应激反应,以及不同的GydF4y2BaCsZFPsGydF4y2Ba受多种mirna调控。此外,亚细胞定位分析表明,大部分CsZFPs位于细胞核和RNA-seq分析GydF4y2BaCsZFPsGydF4y2Ba证明这些基因参与组织和器官的发育。的表达式剖析GydF4y2BaCSZFP.GydF4y2Ba通过qRT-PCR分析表明,9种植物对非生物胁迫的响应均为典型GydF4y2BaCsZFPsGydF4y2Ba显着参与干旱,冷,热和盐胁迫。此外,瞬态过度表达GydF4y2BaCSA1G085390.GydF4y2Ba和GydF4y2BaCSA7G071440GydF4y2Ba进入GydF4y2BaN. Benthamiana.GydF4y2Ba植物透露,它们可以减少并分别诱导造成病原体攻击的坏死,并且它们可以通过H的初始诱导来增强盐和干旱胁迫GydF4y2Ba2GydF4y2BaO.GydF4y2Ba2GydF4y2Ba。此外,GydF4y2BaCSA4G642460GydF4y2Ba和GydF4y2BaCSA6G303740GydF4y2Ba是烟草和番茄中的细胞死亡诱导剂。GydF4y2Ba
方法GydF4y2Ba
黄瓜ZFP基因的鉴定GydF4y2Ba
以识别所有GydF4y2BaZFP.GydF4y2Ba黄瓜中的基因,进行了两种搜索方法。首先,从葫芦基因组学数据库下载黄瓜(Cucumber_chineselong_v2_pep.fa)的蛋白质序列(GydF4y2Bahttp://cucurbitgenomics.org/organism/2GydF4y2Ba).然后,ZFP蛋白序列的GydF4y2Ba拟南芥GydF4y2Ba利用截断e值1e-10的本地BLASTP搜索作为查询来识别潜在的候选物种。其次,以“锌指”为关键词查询葫芦基因组数据库(GydF4y2Bahttp://cucurbitgenomics.org/search/genome/2GydF4y2Ba).最后,将所有检索到的非冗余序列提交到InterProScan (GydF4y2Bahttp://www.ebi.ac.uk/Interpro/GydF4y2Ba)和智能(GydF4y2Bahttp://smart.embl-heidelberg.de/GydF4y2Ba)来评估C2H2结构域(IPR000690、IPR003604、IPR013085、IPR032553、IPR034736、IPR013087、IPR019406、IPR014898)的存在。GydF4y2Ba
蛋白质表征,氨基酸特性,染色体定位,基因结构和复制分析GydF4y2Ba
基因位点,染色体位置,外显子-内含子结构GydF4y2BaCSZFP.GydF4y2Ba从基因组GFF3注释文件中提取基因。近似的位置GydF4y2BaCsZFPsGydF4y2Ba利用Mapinspect软件定位7条染色体[GydF4y2Ba36.GydF4y2Ba].基因重复分为串联重复和分段重复事件。根据Fang等人确定串联复制。[GydF4y2Ba58.GydF4y2Ba].ExPASy Server10中的蛋白质鉴定分析工具(GydF4y2Bahttps://prosite.expasy.org/GydF4y2Ba用于预测CSZFP的长度,分子量(MW),理论等电点,不稳定性指数,氨基酸组合物和原子组合物。GydF4y2Ba
将黄瓜C2H2-ZFP分类为组的多序列对准和分类GydF4y2Ba
通过使用具有默认参数的Clustalw2(V2.1)进行全长蛋白序列的多序列比对。使用MEGA7封装构建一个没有基于LG模型的邻接方法的UGA7封装构建的未生根的系统发育树,并进行了1000次的引导[GydF4y2Ba59.GydF4y2Ba].使用寿命的互动树(ITOL,V3.2.317,GydF4y2Bahttp://itol.embl.de.GydF4y2Ba).使用MEME MOTIF搜索工具识别CSZFP的保守主题(GydF4y2Bahttp://memesuite.org/tools/meme.GydF4y2Ba)[GydF4y2Ba60GydF4y2Ba].在本研究中使用了默认参数,除了最大数量的图案被设置为20。并用TBtools软件(GydF4y2Bahttps://github.com/cj-chen/tbools.GydF4y2Ba).此外,智能数据库[GydF4y2Ba61GydF4y2Ba]用于分析129GydF4y2BaCsZFPsGydF4y2Ba手动搜索C2H2-ZF域的数字,序列,以及C2H2-ZF域之间的空间长度。根据大豆和大豆中描述的方法GydF4y2Ba杨树trichocarpaGydF4y2Ba[GydF4y2Ba12.GydF4y2Ba那GydF4y2Ba13.GydF4y2Ba[CSZFP中的C2H2-ZF结构域分为五种主要类型。然后,基于C2H2-ZF结构域的类型和数量,CSZFPS进一步分为九组。结果显示了详细信息。GydF4y2Ba
MicroRNA靶位点分析及CIS作用监管元素GydF4y2Ba
这GydF4y2BaCGydF4y2Baucumis.GydF4y2BaS.GydF4y2BaativusGydF4y2Ba从miRBase数据库获得miRNA序列GydF4y2Bahttp://mirbase.org/GydF4y2Ba[GydF4y2Ba62GydF4y2Ba],黄瓜miRNAs的成熟序列收集自以前报道的出版物[GydF4y2Ba26.GydF4y2Ba那GydF4y2Ba63GydF4y2Ba].检测潜在的miRNA靶位点GydF4y2BaCSZFP.GydF4y2Ba,获得的mirna用psRNATarget服务器(GydF4y2Bahttp://plantgrn.noble.org/psrnatarget/GydF4y2Ba)[GydF4y2Ba64GydF4y2Ba].上游1500 bp的DNA序列GydF4y2BaCSZFP.GydF4y2Ba基因用于做到GydF4y2BaCIS.GydF4y2Ba-通过PlantCARE数据库(GydF4y2Bahttp://bioinformatics.psb.ugent.be/webtools/plantcare/html/GydF4y2Ba)[GydF4y2Ba65GydF4y2Ba].GydF4y2Ba
CSZFP基因的RNA-SEQ数据分析GydF4y2Ba
的表达谱分析GydF4y2BaCSZFP.GydF4y2Ba我们收集了每个基因的表达水平GydF4y2BaCSZFP.GydF4y2Ba由fpkm值表示(GydF4y2BaFGydF4y2BaragmentsGydF4y2BaP.GydF4y2Ba呃GydF4y2BaK.GydF4y2Ba葫芦基因组数据库(GydF4y2Bahttp://cucurbitgenomics.org/organism/2GydF4y2Ba).黄瓜的热爱GydF4y2BaCSZFP.GydF4y2Ba利用R包“pheatmap”生成基因。GydF4y2Ba
植物材料和处理GydF4y2Ba
黄瓜(GydF4y2BaCucumis sativusGydF4y2BaL. cv。金都1,新天油有限公司,杨凌,陕西,中国)种子在蒸馏水中彻底冲洗,并在28°C的培养箱中发芽在28°C的湿纱布中2天[GydF4y2Ba66GydF4y2Ba].在人工生长室中播种在混合基质(泥炭:蛭石:Perlite = 2:1:1)中播种,平均为12h / 12小时/夜光。温度设定为28°C / 18℃/夜/夜。在双叶阶段,将均匀的幼苗转移到填充15L的Hoagland营养溶液的15L型1/4强度的塑料容器中。三天后,Hoagland溶液的强度升至1/2。移植后七天,对幼苗进行四个实验组:(i)对照,在28℃/ 18℃/夜温度下在腔室中温育幼苗;(ii)盐胁迫,将75mM氯化钠(NaCl)加入到营养溶液中;(iii)热应激,在另一种相同的生长室中用40℃/ 32℃/夜温度处理幼苗;(iv)冷却胁迫,幼苗暴露于18℃/ 5℃/夜温度以进行冷冻处理[GydF4y2Ba67GydF4y2Ba].在3,6和9天的治疗后收集根部。溶液pH使用0.2米H保持在6.0GydF4y2Ba2GydF4y2Ba所以GydF4y2Ba4.GydF4y2Ba或1米KOH。将所有取样材料收获以用液氮冷冻并在RNA提取之前储存在-80℃。GydF4y2Ba
RNA提取和QRT-PCR分析GydF4y2Ba
根据YIN等人所述的制造商的指示(Invitrogen,Carlsbad,CA)进行来自黄瓜根和cDNA合成之后的总RNA提取。(2018)[GydF4y2Ba68GydF4y2Ba].根据制造商的协议,使用Sybr Green Master Mix(Vazyme,南京)对CFX 96实时PCR系统(BIO-RAD)进行QRT-PCR。20μl反应系统含有10μl2×SYBR预混物EXTAQ TM,0.4μL,每种10μm引物,1μL稀释的cDNA和8.2μlDDHGydF4y2Ba2GydF4y2BaO.热剖面在94°C预孵育3min,然后在94°C 5 s, 55 ~ 63°C 15 s, 72°C 15 s循环40次。的相对表达水平GydF4y2BaCsZFPsGydF4y2Ba用2计算了GydF4y2Ba-ΔΔctGydF4y2Ba方法 [GydF4y2Ba69GydF4y2Ba].底漆序列GydF4y2BaCsZFPsGydF4y2BaqRT-PCR内参基因见附加文件GydF4y2Ba1GydF4y2Ba: S7表。GydF4y2Ba
CSZFP蛋白的亚细胞定位分析GydF4y2Ba
确认子蜂窝定位GydF4y2BaCsZFPsGydF4y2Ba,十GydF4y2BaCsZFPsGydF4y2Ba从不同的群体中选择了亚细胞分析。简而言之,全长GydF4y2BaCsZFPsGydF4y2Ba采用Phanta HS Master Mix (Vazyme, Nanjing, China)扩增。然后将PCR产物插入GydF4y2BaXhoGydF4y2Ba我消化了向量第2部分:GFP(NEB,北京,中国)通过使用Clonexpress II一步一步克隆套件(Vazyme,南京,中国)。这GydF4y2BaCSZFP.GydF4y2Ba:GFP融合结构转化为GydF4y2Ba农杆菌肿瘤术GydF4y2Ba菌株GV3101和pART27:GFP转化为阴性对照。烟草(GydF4y2Ba烟草benthamianaGydF4y2Ba)叶片采用渗透法进行转化。两天后,将注射后的叶子放置在玻片上,通过荧光显微镜(Olympus FV3000,东京,日本)以488 nm的激发波长观察。GydF4y2Ba
四个典型CSZFP的瞬态过度表达响应生物和非生物应激的NENTHAMIANA。GydF4y2Ba
四种典型的GydF4y2BaCsZFPsGydF4y2Ba(GydF4y2BaCSA1G085390,CSA7G071440,CSA4G642460GydF4y2Ba和GydF4y2BaCSA6G303740GydF4y2Ba):GFP融合载体是瞬态转换为GydF4y2BaN. Benthamiana.GydF4y2Ba植物的GydF4y2Ba农杆菌肿瘤术GydF4y2Ba菌株GV3101, pART27:GFP转化为阴性对照。处理12、24、48、72和96 h后收集农渗叶片,快速液氮冷冻,−80℃保存提取RNA。然后用2计算发病相关(PR)基因的相对表达量GydF4y2Ba-ΔΔctGydF4y2Ba方法和引物序列显示在附加文件GydF4y2Ba1GydF4y2Ba:表S8。此外,表型GydF4y2BaCSA1G085390.GydF4y2Ba和GydF4y2BaCSA7G071440GydF4y2Ba研究评估了转基因植物对病原体攻击的反应(GydF4y2Ba5种GydF4y2Ba).短暂表达2天后,离体叶片接种游动孢子GydF4y2Bap . 5GydF4y2Ba(应变88,069)[GydF4y2Ba70GydF4y2Ba].接种5天后,使用手持式长波长UV灯(Blak射线B-100AP,紫外产物)测量和可视化测量病变直径,并且使用Carl Zeiss成像系统采用图。GydF4y2Ba
瞬态表达式第27部分:GFP,GydF4y2BaCSA1G085390.GydF4y2Ba:GFP,和GydF4y2BaCSA7G071440GydF4y2Ba: GFP融合在GydF4y2BaN. Benthamiana.GydF4y2Ba2 d后,从植株上切取叶片,研究这些叶片对干旱(1% PEG)和盐(400 mM NaCl)胁迫的响应。此外,对失水率进行了Zhu等人的描述[GydF4y2Ba36.GydF4y2Ba].在PEG和盐处理4 h后,用Olympus BX51(新injuku, Tokyo, Japan)显微镜观察叶片背面表皮的气孔。利用ImageJ技术对叶片气孔开度进行定量测定。最后,HGydF4y2Ba2GydF4y2BaO.GydF4y2Ba2GydF4y2Ba和MDA浓度的测定采用Yin等[GydF4y2Ba26.GydF4y2Ba].而且,HGydF4y2Ba2GydF4y2BaO.GydF4y2Ba2GydF4y2Ba通过组织化学染色二氨基苯胺(DAB)方法检测积累[GydF4y2Ba71GydF4y2Ba].GydF4y2Ba
benthamiana的VIGS测定GydF4y2Ba
细胞死亡GydF4y2BaCSA4G642460GydF4y2Ba和GydF4y2BaCSA6G303740GydF4y2Ba转化5 d后观察转基因植株。同样的表型GydF4y2BaCSA4G642460GydF4y2Ba和GydF4y2BaCSA6G303740GydF4y2Ba暂时性的表达GydF4y2BaSolanum lycopersicum.GydF4y2Ba转化6 d后观察叶片。细胞死亡诱导信号转导途径相关基因(GydF4y2BaHSP90.GydF4y2Ba那GydF4y2BaSGT1GydF4y2Ba那GydF4y2BaRAR2GydF4y2Ba那GydF4y2BaMEK1GydF4y2Ba那GydF4y2BaSIPKGydF4y2Ba, 和GydF4y2BaWRKY3-2GydF4y2Ba)被扩增并构建为PTRV2载体[GydF4y2Ba72GydF4y2Ba],与pTRV1按与最终OD等比混合GydF4y2Ba600GydF4y2Ba0.25。pTRV2:GFP作为对照。这些载体转化到四叶期的下部叶片GydF4y2BaN. Benthamiana.GydF4y2Ba通过GydF4y2Ba农杆菌肿瘤术GydF4y2Ba菌株GV3101,3周后,构建的载体GydF4y2BaCSA4G642460GydF4y2Ba:GFP,和GydF4y2BaCSA6G303740GydF4y2Ba:GFP在叶片上部瞬时表达。在转化5天后,分析上部叶片的细胞死亡程度。GydF4y2Ba
数据和材料的可用性GydF4y2Ba
基因组数据、序列和表达谱GydF4y2BaCSZFP.GydF4y2Ba目前研究中使用的基因在葫芦科基因组学数据库中可用(GydF4y2Bahttp://cucurbitgenomics.org/search/genome/2GydF4y2Ba).本研究期间生成或分析的所有数据都包含在此已发布的文章中及其附加文件中。在当前研究期间生成和分析的数据集可从相应的作者获得合理的请求。GydF4y2Ba
缩写GydF4y2Ba
- ZFPS:GydF4y2Ba
-
锌指蛋白GydF4y2Ba
- CSZFPS:GydF4y2Ba
-
黄瓜中的C2H2 ZFPSGydF4y2Ba
- TFs:GydF4y2Ba
-
转录因子GydF4y2Ba
- 半胱氨酸:GydF4y2Ba
-
半胱氨酸GydF4y2Ba
- 他的:GydF4y2Ba
-
组氨酸GydF4y2Ba
- 阿巴:GydF4y2Ba
-
脱落酸GydF4y2Ba
- NACL:GydF4y2Ba
-
氯化钠GydF4y2Ba
- AtZP1:GydF4y2Ba
-
锌指蛋白1GydF4y2Ba
参考文献GydF4y2Ba
- 1。GydF4y2Ba
Wang L,Sadeghnezhad E,Nick P.基因表达的上游 - 微管在冷信号中的作用是什么?J Exp Bot。2019; 71(1):36-48。GydF4y2Ba
- 2。GydF4y2Ba
关键词:牡丹,灰霉病,抗病性,花期,抗病性GydF4y2BaBotrytis cinereaGydF4y2Ba。HortScience。2019年,54(2):328 - 30。GydF4y2Ba
- 3.GydF4y2Ba
方泽,江武出,何YQ,MA DF,刘YK,王SP,张YX,YIN JL。小麦DOF转录因子基因家族DOF转录因子基因家族的基因组鉴定,结构表征及表达分析(GydF4y2BaTriticum aestivum.GydF4y2Bal .)。农学。2020;10(2):294。GydF4y2Ba
- 4.GydF4y2Ba
Sakamoto H,Maruyama K,Sakuma Y,Meshi T,Iwabuchi M,Shinozaki K,Yamaguchi-Shinozaki K.GydF4y2Ba拟南芥GydF4y2BaCys2 / His2型锌 - 手指蛋白在干旱,冷和高盐度应力条件下用作转录阻遏物。植物理性。2004; 136(1):2734-46。GydF4y2Ba
- 5。GydF4y2Ba
Englbrecht CC,Schoof H,Bohm S. C2H2锌手指蛋白的保护,多样化和扩张GydF4y2Ba拟南芥蒂利亚纳GydF4y2Ba基因组。BMC基因组学。2004;5(1):39。GydF4y2Ba
- 6.GydF4y2Ba
agarwal p,arora r,ray s,singh ak,singh vp,takatsuji h,kapoor s,tyagi ak。水稻中C2H2锌 - 手指基因家族的基因组及其系统发育及表达分析。植物mol biol。2007; 65(4):467-85。GydF4y2Ba
- 7.GydF4y2Ba
法拉吉S,Rasouli Sh,Kazemitabar Sk。基因组探索杜兰姆小麦C2H2锌手指家庭(GydF4y2Ba小麦属植物turgidumGydF4y2Bassp。Durum):洞察生物过程特别是应激反应的作用。Biometals。2018;31(6):1019 - 42。GydF4y2Ba
- 8.GydF4y2Ba
C(2)H(2)型锌指转录因子参与植物逆境响应植物科学。2012;185 - 186:78 - 85。GydF4y2Ba
- 9.GydF4y2Ba
模式植物谷子WD40蛋白家族的全基因组研究和表达分析GydF4y2BaSetaria Italica.GydF4y2Bal .)。Plos一个。2014; 9(1):E86852。GydF4y2Ba
- 10。GydF4y2Ba
关键词:植物,锌指,C2H2,非生物胁迫杂志杆菌。2019;165(4):690 - 700。GydF4y2Ba
- 11.GydF4y2Ba
Iuchi S.三类C2H2锌手指蛋白。细胞mol寿命。2001; 58(4):625-35。GydF4y2Ba
- 12.GydF4y2Ba
Alam I,Batool K,Cui DL,Yang YQ,Lu Yh。C2H2锌手指蛋白基因家族的综合基因组调查,结构分类及表达分析GydF4y2BaBrassica Rapa.GydF4y2BaL. Plos一个。2019; 14(5):E0216071。GydF4y2Ba
- 13。GydF4y2Ba
刘q,王z,xu x,张h,li c。C2H2锌 - 手指家族转录因子的基因组分析及其对杨树中非生物胁迫的反应(GydF4y2Ba杨树trichocarpaGydF4y2Ba).Plos一个。2015; 10(8):E0134753。GydF4y2Ba
- 14。GydF4y2Ba
袁S,李X,李河,王l,张c,陈l,郝q,张x,陈H,山z,杨z,陈S,秋d,ke d,周X.基因组识别和大豆C2H2锌指蛋白的分类及其在豆科植物分中共生中的表达分析。前微生物。2018; 9:126。GydF4y2Ba
- 15.GydF4y2Ba
Wei K,Pan S,Li Y.玉米C2H2锌 - 手指基因家族的功能表征。植物MOL BIOL REP。2016; 34(4):761-76。GydF4y2Ba
- 16。GydF4y2Ba
王F,童悟,朱H,孔W,彭R,刘Q,姚Q.来自SweetPotato的一种新型Cys2 / His2锌手指蛋白基因,GydF4y2BaIBZFP1.GydF4y2Ba,参与转基因的盐和耐旱性GydF4y2Ba拟南芥GydF4y2Ba。足底。2016;243(3):783 - 97。GydF4y2Ba
- 17.GydF4y2Ba
Tao Z,Huang Y,Zhang L,王X,刘G,王H. Bnlate,Cys2 / His2型锌 - 手指蛋白,通过对硅墙中的木质素积累产生负调节木质素积累来增强硅纹抗破碎性GydF4y2Ba芸苔栗鸟GydF4y2Ba。Plos一个。2017; 12(1):E0168046。GydF4y2Ba
- 18.GydF4y2Ba
Kam J,Gresshoff PM,更短的R,Xue GP。Q型C2H2锌指亚家族的转录因子GydF4y2BaTriticum aestivum.GydF4y2Ba主要在根系中表达并富含含有耳压缩主题和响应干旱胁迫的成员。植物mol biol。2008; 67(3):305-22。GydF4y2Ba
- 19.GydF4y2Ba
尹m,王y,张l,李俊,泉w,杨l,王q,陈z.的GydF4y2Ba拟南芥GydF4y2BaCys2/His2锌指转录因子GydF4y2BaZat18.GydF4y2Ba是植物耐受胁迫的正调节因素。J Exp Bot。2017; 68(11):2991-3005。GydF4y2Ba
- 20.GydF4y2Ba
拟南芥Cys2/His2锌指蛋白AZF1和AZF2在非生物胁迫条件下对脱落酸抑制和生长素诱导基因具有负调控作用。植物杂志。2011;157(2):742 - 56。GydF4y2Ba
- 21.GydF4y2Ba
Ciftci-yilmaz S,Morsy Mr,Song L,Coutu A,Krizek Ba,Lewis MW,Warren D,Cushman J,Connolly El,Mittler R. Cys2 / His2型锌手指蛋白质Zat7的耳动矩阵致钥匙在防御反应中的作用GydF4y2Ba拟南芥GydF4y2Ba盐度压力。J Biol Chem。2007; 282(12):9260-8。GydF4y2Ba
- 22.GydF4y2Ba
Isernia C, Bucci E, Leone M, Zaccaro L, Di Lello P, Digilio G, Esposito S, Saviano M, Di Blasio B, Pedone C等。核磁共振结构的单一QALGGH锌指域GydF4y2Ba拟南芥蒂利亚纳GydF4y2Ba超人蛋白质。Chembiochem。2003; 4(2-3):171-80。GydF4y2Ba
- 23.GydF4y2Ba
摘要:黄瓜超人在雄蕊和果实发育中具有保守功能,在花的形成中具有独特的作用。《公共科学图书馆•综合》。2014;9 (1):e86192。GydF4y2Ba
- 24.GydF4y2Ba
刘德,杨立,罗米,吴q,刘某,刘y。分子克隆与表征GydF4y2Baptrzpt2-1GydF4y2Ba,一种从Trifoliate橙色编码Cys2 / His2型锌指蛋白的ZPT2家族基因(GydF4y2Baponcirus trifoliataGydF4y2Ba(L.)RAF。)增强植物耐受多重非生物应激的耐受性。植物SCI。2017; 263:66-78。GydF4y2Ba
- 25.GydF4y2Ba
Kim JC,Lee Sh,Cheong Yh,Yoo Cm,Lee Si,春Hj,云DJ,Hong Jc,Lee Sy,Lim Co等。来自大豆,SCOF-1的新型冷诱导锌手指蛋白增强了转基因植物的耐寒性。工厂J. 2001; 25(3):247-59。GydF4y2Ba
- 26。GydF4y2Ba
Yin J,Jia J,Lian Z,Hu Y,Gu J,Huo,Zhu Y,Gong H.硅通过增加多胺积累和氧化损伤来增强黄瓜的耐盐性。EcoTox环境安全。2019; 169:8-17。GydF4y2Ba
- 27。GydF4y2Ba
朱友,贾耶,杨升,夏yc,张hl,jia jb,周r,nie py,yin jl,ma df,liu lc。响应于盐胁迫的黄瓜圆形RNA的鉴定。BMC植物BIOL。2019; 19(1):164。GydF4y2Ba
- 28。GydF4y2Ba
朱y,龚h,尹j。硅在植物中脱盐耐盐的作用:综述。植物。2019; 8(6)。GydF4y2Ba
- 29。GydF4y2Ba
8 .胡锐,齐刚,孔勇,孔丹,高强,周刚。大豆中NAC结构域转录因子基因家族的综合分析GydF4y2Ba杨树trichocarpaGydF4y2Ba。中国生物医学工程学报。2010;10:15 15。GydF4y2Ba
- 30.GydF4y2Ba
小分子核糖核酸(microrna)在植物生物和非生物胁迫响应中的作用。生物化学与生物技术,2014;GydF4y2Ba
- 31。GydF4y2Ba
锌指蛋白:经典的锌指蛋白出现在当代植物科学中。植物生理学杂志。1999;39(6):1053 - 1058。GydF4y2Ba
- 32。GydF4y2Ba
汉康,吕C,郭继,乔泽,隋,血清,王B.C2H2锌手指蛋白:植物中非生物应激反应的母源监管机构。前植物SCI。2020; 11:115。GydF4y2Ba
- 33。GydF4y2Ba
刘y,刘d,胡r,hua c,阿里我,张a,刘b,吴m,黄l,甘玉。atgis,一个c2h2锌 - 手指转录因子GydF4y2Ba拟南芥GydF4y2Ba通过烟草中的GA信号调节腺体滴毛组发育。Biochem Bioph Res Co. 2017; 483(1):209-15。GydF4y2Ba
- 34。GydF4y2Ba
Bohm S, Frishman D, Mewes HW。酵母基因组中C2H2锌指基序的变化及锌指蛋白的分类。微生物学与微生物学杂志1997;25(12):2464-9。GydF4y2Ba
- 35。GydF4y2Ba
Kubo K,Sakamoto A,Kobayashi A,Rybka Z,Kanno Y,Nakagawa H,Takatsuji H.Cys2 / His2绣着者的锌 - 手指蛋白家族:进化和目标序列识别的一般机制。核酸RES。1998年; 26(2):608-15。GydF4y2Ba
- 36。GydF4y2Ba
朱yx,杨莉,刘,杨杰,周XK,夏yc,嘿嘿,嘿,锣,锣,ma df,yin jl。基因组鉴定,结构表征和黄瓜水素基因家族的表达模式分析。BMC植物BIOL。2019; 19:345。GydF4y2Ba
- 37。GydF4y2Ba
Moore Rc,Purugganan MD。重复基因进化的早期阶段。P Natl Acad Sci USA。2003; 100(26):15682-7。GydF4y2Ba
- 38。GydF4y2Ba
Cannon SB,Mitra A,Baumgarten A,Young Nd,May G.节段性和串联基因重复在大基因家族中的演变中的作用GydF4y2Ba拟南芥蒂利亚纳GydF4y2Ba。BMC植物BIOL。2004; 4:10。GydF4y2Ba
- 39。GydF4y2Ba
黄S,Li R,张Z,Li L,GU X,风扇W,LUCAS WJ,Wang X,Xie B,Ni P等人。黄瓜的基因组,GydF4y2BaCucumis sativusGydF4y2BaL. Nat Genet。2009; 41(12):1275-81。GydF4y2Ba
- 40.GydF4y2Ba
玲j,姜w,张y,yu h,mao z,顾x,黄s,谢b。衣服基因家族的基因组分析GydF4y2BaCucumis sativusGydF4y2Ba。BMC基因组学。2011;12:471。GydF4y2Ba
- 41.GydF4y2Ba
关键词:干旱,转录调控网络,干旱,低温,高温,非生物胁迫植物科学与技术,2014;GydF4y2Ba
- 42.GydF4y2Ba
Mittler R, Kim Y, Song L, Coutu J, Coutu A, Ciftci-Yilmaz S, Lee H, Stevenson B, Zhu JK.(中国科学技术出版社)Zat10基因的功能增益和功能损失突变增强了植物对非生物胁迫的耐受性。2月。2006;580(28 - 29日):6537 - 42。GydF4y2Ba
- 43.GydF4y2Ba
CIFTCI-YILMAZ S,Mittlle R.植物的锌手指网络。细胞mol寿命。2008; 65(7-8):1150-60。GydF4y2Ba
- 44.GydF4y2Ba
鲁XY,黄XL。植物miRNA和非生物应激反应。Biochem Biophysical Res Communce。2008; 368(3):458-62。GydF4y2Ba
- 45.GydF4y2Ba
Morita MT, Sakaguchi K, Kiyose SI, Taira K, Kato T, Nakamura M, Tasaka M. A C2H2-type zinc finger protein, SGR5, SGR5参与了重地性的早期事件GydF4y2Ba拟南芥GydF4y2Ba花序梗。植物j . 2006; 47(4): 619 - 28。GydF4y2Ba
- 46.GydF4y2Ba
cysteine2/ histidin2 -type transcription factor ZINC FINGER OF的翻译结果GydF4y2Ba拟南芥蒂利亚纳GydF4y2Ba6-activated C-REPEAT-BINDING FACTOR通路是褪黑素介导的抗冻胁迫的关键GydF4y2Ba拟南芥GydF4y2Ba。松果体学报,2014;25(2):1 - 7。GydF4y2Ba
- 47.GydF4y2Ba
关键词:烟草,锌指蛋白,C2H2, JcZFP8,毛状体发育GydF4y2Ba麻风树GydF4y2BaL.基因。2018; 658:47-53。GydF4y2Ba
- 48.GydF4y2Ba
韩格,魏X,董X,王,王,隋n,郭继,元f,z,李x,张y等。GydF4y2Ba拟南芥GydF4y2Ba锌指蛋白1通过直接抑制bHLH基因,作用于GL2下游,抑制根毛的起始和伸长。植物细胞。2020;32:206-25。GydF4y2Ba
- 49.GydF4y2Ba
锌指蛋白Zat12在非生物胁迫和活性氧信号转导中起着重要作用GydF4y2Ba拟南芥GydF4y2Ba。植物杂志。2005;139(2):847 - 56。GydF4y2Ba
- 50。GydF4y2Ba
汉族,傅友,匡吉夫,陈杰,卢WJ。两种香蕉果实熟化相关的C2H2锌指蛋白是乙烯生物合成基因的转录压缩机。Postharvest Biol Tech。2016; 116:8-15。GydF4y2Ba
- 51。GydF4y2Ba
赵H,张克,周X,XI L,王Y,徐H,Pan T,Zou Z.褪黑素通过CSZAT12的上调调节CSZAT12和多胺和脱落酸代谢的调节,减轻黄瓜幼苗的冷却胁迫。SCI批准。2017; 7(1):4998。GydF4y2Ba
- 52。GydF4y2Ba
Drechsel G,Raab S,Hoth S.GydF4y2Ba拟南芥GydF4y2Ba锌指蛋白2是种子萌发过程中ABA信号的负调控因子。植物生理学杂志。2010;GydF4y2Ba
- 53。GydF4y2Ba
Sakamoto H,Araaki T,Meshi T,Iwabuchi M.表达了一个子集GydF4y2Ba拟南芥GydF4y2BaCys2/ his2型锌指蛋白基因家族在水分胁迫下的表达。基因。2000;248(1 - 2):23-32。GydF4y2Ba
- 54。GydF4y2Ba
黄杰,王俊峰,王qh,张浩生。一种水稻锌指蛋白的鉴定,其表达受干旱、寒冷而不受盐度和脱落酸的暂时性诱导。DNA Seq。2005;16(2):130 - 6。GydF4y2Ba
- 55。GydF4y2Ba
黄XY,Chao Dy,Gao JP,Zhu Mz,Shi M,Lin HX。先前未知的锌指蛋白,DST,通过气孔孔控制调节水稻中的干旱和耐盐性。基因开发。2009; 23(15):1805-17。GydF4y2Ba
- 56。GydF4y2Ba
黄杰,太阳SJ,徐DQ,杨X,王ym,王紫玉,唐清,张h。张开水稻对冷,干旱和氧化应激的影响,其过表达对锌指蛋白Zfp245进行过表达介导的基因。Biochem Biophysical Res Communce。2009; 389(3):556-61。GydF4y2Ba
- 57。GydF4y2Ba
Suzuki N,Koussevitzky S,Mittlle R,Miller G. ROS和氧化还原信号在植物对非生物胁迫的反应中。植物细胞环境。2012; 35(2):259-70。GydF4y2Ba
- 58。GydF4y2Ba
蒋炜,杨啊,张h,李文,陈h,ma d,尹j。小麦超氧化物歧化酶(SOD)家族的基因组 - 范围鉴定及转录表达分析(GydF4y2BaTriticum aestivum.GydF4y2Ba).Peer J. 2019; 7:E8062。GydF4y2Ba
- 59。GydF4y2Ba
何YQ,黄WD,杨L,Li YT,Lu C,朱yx,MA DF,YIN JL。乙烯 - 不敏感3(EIN3 / EIL)的基因组分析GydF4y2BaTriticum aestivum.GydF4y2Ba。农作物科学。2020。GydF4y2Bahttps://doi.org/10.1002/csc2.20115GydF4y2Ba。GydF4y2Ba
- 60。GydF4y2Ba
江吴,尹吉尔,张特,何益,帅姆,陈舍,曹,李文,马德夫,陈马。小麦生长素响应GH3家族基因的基因组鉴定,表征分析及表达分析(GydF4y2BaTriticum aestivum.GydF4y2Bal .)。Mol Biol rep. 2020。GydF4y2Bahttps://doi.org/10.1007/S11033-020-05477-020-05477-5GydF4y2Ba。GydF4y2Ba
- 61。GydF4y2Ba
Leatunic I,Deerks T,Bork P. Smart:2015年最近的更新,新的发展和地位。核酸Res。2015; 43(数据库问题):D257-60。GydF4y2Ba
- 62。GydF4y2Ba
Kozomara A, griffith - jones S. miRBase:使用深度测序数据注释高可信度的microRNAs。2013;42(D1): D68-73。GydF4y2Ba
- 63.GydF4y2Ba
金W,吴F.响应黄瓜MicroRNA的鉴定与表征GydF4y2BaPseudoperonospora cubensisGydF4y2Ba感染。基因。2015; 569(2):225-32。GydF4y2Ba
- 64.GydF4y2Ba
戴旭,赵px。PsRNATarget:植物小RNA靶标分析服务器。核酸研究2011;39(Web服务器版):W155-9。GydF4y2Ba
- 65.GydF4y2Ba
Lescot M,Dehais P,Thijs G,Marchal K,Moreau Y,Van de Peer Y,Rouze P,Rombauts S. Plantcare,植物顺式行动监管元素数据库和工具门户网站GydF4y2Ba在Silico.GydF4y2Ba促进剂序列分析。核酸RES。2002; 30(1):325-7。GydF4y2Ba
- 66.GydF4y2Ba
朱应祥,徐锡斌,胡永红,韩文华,尹建林,李洪林,龚洪杰。硅通过增加根系对水分的吸收来提高耐盐性GydF4y2BaCucumis sativusGydF4y2Ba中国科学院植物研究所2015;GydF4y2Ba
- 67.GydF4y2Ba
朱y,尹j,梁y,刘j,jia j,霍H,吴z,杨r,龚h.转录组动力学对黄瓜植物中盐胁迫硅介导机制提供了深入了解。EcoTox环境安全。2019年; 174:245-54。GydF4y2Ba
- 68.GydF4y2Ba
Yin J,Liu M,MA D,Wu J,Li S,朱Y,韩B.番茄果实成熟过程中循环RNA及其目标的鉴定。Postharvest Biol Tec。2018; 136:90-8。GydF4y2Ba
- 69.GydF4y2Ba
Livak KJ,Schmittgen TD。使用实时定量PCR和2分析相对基因表达数据GydF4y2Ba-ΔΔctGydF4y2Ba方法。方法。2001; 25(4):402-8。GydF4y2Ba
- 70.GydF4y2Ba
尹军,顾斌,黄刚,田勇,全杰,林qvist - kreuze H,单伟GydF4y2Ba5种GydF4y2Ba在马铃薯感染的早期表达抑制宿主防御。前植物SCI。2017; 8:2155。GydF4y2Ba
- 71.GydF4y2Ba
徐茹,朱y,葛q,李y,sun j,张y,刘x。比较生理反应GydF4y2BaSolanum nigrum.GydF4y2Ba和GydF4y2BaSolanum torvum.GydF4y2Ba镉压力。新植醇。2012;196(1):125 - 38。GydF4y2Ba
- 72.GydF4y2Ba
黄格,刘泽,顾b,赵h,佳杰,风扇gj,蒙友,杜y,山wx。一个rxlr效应器分泌GydF4y2BaPhytophthora parasitica.GydF4y2Ba在各种植物中是一种毒力因子和触发细胞死亡。莫尔植物途径。2019; 20(3):356-71。GydF4y2Ba
致谢GydF4y2Ba
我们感谢永利乔教授对初始项目设计和数据分析的有益评论。我们感谢华钊博士(西北A&F大学干旱地区作物压力生物学国家重点实验室,为杨凌,中国杨凌)进行了共聚焦实验辅助。GydF4y2Ba
资金GydF4y2Ba
本研究由中国国家自然科学基金(第31701111号)资助,河北农业大学基金会(Grant Digult Yj201853),河北省自然科学基金会的绿色渠道基金(C2019204308)教育部湿地生态学与农业用途工程研究中心开放项目计划(No.KF201909)。这些资助机构参与了研究和收集,分析和解释的设计,以及稿件的写作,以及开放式付款。GydF4y2Ba
作者信息GydF4y2Ba
从属关系GydF4y2Ba
贡献GydF4y2Ba
YJL和ZYX:设计这项工作;WLX和YJL:写了稿件;Zyx,ZJ,HR,Lyt,ZXK,HY,HYQ:进行了大部分实验和分析;ZXM和JXC:基本上贡献到这项工作的完成;所有作者阅读并认可的终稿。GydF4y2Ba
通讯作者GydF4y2Ba
伦理宣言GydF4y2Ba
伦理批准并同意参与GydF4y2Ba
不适用。GydF4y2Ba
同意出版GydF4y2Ba
不适用。GydF4y2Ba
相互竞争的利益GydF4y2Ba
作者们宣称他们没有相互竞争的利益。GydF4y2Ba
额外的信息GydF4y2Ba
出版商的注意事项GydF4y2Ba
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。GydF4y2Ba
补充信息GydF4y2Ba
表S1。GydF4y2Ba
C2H2-ZF结构域的类型和亚类型及其特征。GydF4y2Ba表S2。GydF4y2BaC2H2-ZFPS中C2H2主题的详细信息。GydF4y2Ba表S3。GydF4y2Ba这GydF4y2BaCIS.GydF4y2Ba的启动子区域的调控元件分析GydF4y2BaCsZFPsGydF4y2Ba。GydF4y2Ba表S4。GydF4y2Ba详细信息GydF4y2BaCIS.GydF4y2Ba的启动子区域的调控元件GydF4y2BaCsZFPsGydF4y2Ba。GydF4y2Ba表S5。GydF4y2Ba米兰斯的详细信息有针对性的GydF4y2BaCsZFPsGydF4y2Ba。GydF4y2Ba表S6。GydF4y2BaRNA-SEQ分析GydF4y2BaCSZFP.GydF4y2Ba黄瓜不同生长,发育阶段的基因,以及对生物和非生物胁迫的反应。GydF4y2Ba表S7。GydF4y2Ba底漆序列GydF4y2BaCSZFP.GydF4y2Ba中存在的基因。GydF4y2Ba表S8。GydF4y2BaQRT-PCR病原体应答基因的底漆序列。GydF4y2Ba
附加文件2图S1。GydF4y2Ba
主题序列和图案中的保守残留。GydF4y2Ba图S2。GydF4y2Ba番茄叶片细胞死亡分析。GydF4y2Ba第27部分:GFP.GydF4y2Ba那GydF4y2BaCSA4G642460GydF4y2Ba和GydF4y2BaCSA6G303740GydF4y2Ba瞬时表达GydF4y2BaSolanum lycopersicum.GydF4y2Ba。GydF4y2Ba
权利和权限GydF4y2Ba
开放访问GydF4y2Ba本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问GydF4y2Bahttp://creativecommons.org/licenses/by/4.0/GydF4y2Ba。Creative Commons公共领域奉献豁免(GydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/GydF4y2Ba)适用于本文中提供的数据,除非另有用入数据的信用额度。GydF4y2Ba
关于这篇文章GydF4y2Ba
引用这篇文章GydF4y2Ba
尹军,王磊,赵军。GydF4y2Ba等等。GydF4y2Ba中锌指C2H2基因的全基因组特征GydF4y2BaCucumis sativusGydF4y2Ba四种功能分析GydF4y2BaCsZFPsGydF4y2Ba响应应力。GydF4y2BaBMC植物BIOL.GydF4y2Ba20.GydF4y2Ba359(2020)。https://doi.org/10.1186/s12870-020-02575.1.GydF4y2Ba
已收到GydF4y2Ba:GydF4y2Ba
公认GydF4y2Ba:GydF4y2Ba
发表GydF4y2Ba:GydF4y2Ba
DOIGydF4y2Ba:GydF4y2Bahttps://doi.org/10.1186/s12870-020-02575.1.GydF4y2Ba
关键词GydF4y2Ba
- 乙炔锌指蛋白GydF4y2Ba
- 黄瓜GydF4y2Ba
- 系统发生GydF4y2Ba
- 压力GydF4y2Ba
- 功能分析GydF4y2Ba