- 研究文章gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
比较转录组分析可深入了解葡萄的调控途径和时空表达特征(gydF4y2Ba葡萄gydF4y2Ba)在不同节上的休眠芽gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba20.gydF4y2Ba,文章号:gydF4y2Ba390gydF4y2Ba(gydF4y2Ba2020gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
芽休眠是植物为适应不利环境而发展起来的一种战略机制。小道消息(gydF4y2Ba葡萄gydF4y2Ba)是最古老的果蔓品种之一,由于其巨大的经济效益,世界各地都种植葡萄树。为了更好地理解相邻月份之间芽休眠的分子机制,使用rna测序技术和成对比较分析了Rosario Bianco葡萄6个月的芽和3个节点的转录组。从11月到次年4月,在相邻月份之间进行了两两比较。gydF4y2Ba
结果gydF4y2Ba
从5个比较中共获得11647个差异表达基因(DEGs)。根据DEG剖面聚类分析结果和采样周期的气候状况,将6个月划分为3个关键过程(11 - 1月、1 - 3月和3 - 4月)。相邻月份的DEG曲线和三个主要休眠过程的两两比较表明,整个葡萄芽休眠期主要受抗氧化系统、次生代谢、细胞周期与分裂、细胞壁代谢和碳水化合物代谢的调控。此外,还有一些deg,如gydF4y2BaVvGA2OX6gydF4y2Ba而且gydF4y2BaVvSS3gydF4y2Ba,表现出时间和空间上的差异表达模式,并在4月前后趋于常态化。gydF4y2Ba
结论gydF4y2Ba
从这些结果可以推测葡萄芽休眠的分子机制,为进一步研究奠定基础。gydF4y2Ba
背景gydF4y2Ba
休眠是多年生木本植物的一种适应策略,为更好地忍受恶劣的气候条件,暂时停止可见的生长,从而影响下一季的营养生长和果实产量[gydF4y2Ba1gydF4y2Ba].休眠主要可根据过渡阶段分为异态休眠、内休眠和生态休眠三个阶段[gydF4y2Ba2gydF4y2Ba].Díaz-Riquelme等。[gydF4y2Ba3.gydF4y2Ba]在葡萄芽年周期的研究中使用了相同的分类。最初,大多数研究集中在芽休眠期间的生理生化变化分析。这类研究包括芽内水的形式和含量的变化,以及存在的激素(如ABA和GA)和碳水化合物(如淀粉和蔗糖)的变化[gydF4y2Ba4gydF4y2Ba,gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba,gydF4y2Ba7gydF4y2Ba,gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba].gydF4y2Ba
近年来,RNA-seq (RNA-seq)技术已广泛应用于梨[gydF4y2Ba10gydF4y2Ba,gydF4y2Ba11gydF4y2Ba],葡萄藤[gydF4y2Ba1gydF4y2Ba,gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba],桃子[gydF4y2Ba14gydF4y2Ba]、日本杏[gydF4y2Ba15gydF4y2Ba],甜樱桃[gydF4y2Ba16gydF4y2Ba,gydF4y2Ba17gydF4y2Ba]、猕猴桃[gydF4y2Ba18gydF4y2Ba]、荔枝[gydF4y2Ba19gydF4y2Ba].此外,蛋白质组学技术的广泛应用,如等压相对和绝对定量标签(iTRAQ)和串联质量标签(TMT) [gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba21gydF4y2Ba,gydF4y2Ba22gydF4y2Ba],在蛋白质水平的休眠调节网络研究方面取得了重大进展。与休眠相关的调节途径已被证明参与了能量代谢的调节[gydF4y2Ba21gydF4y2Ba]、植物激素[gydF4y2Ba1gydF4y2Ba,gydF4y2Ba23gydF4y2Ba,gydF4y2Ba24gydF4y2Ba],细胞分裂和生长[gydF4y2Ba25gydF4y2Ba],碳水化合物代谢[gydF4y2Ba12gydF4y2Ba]、信号转导、氧化应激[gydF4y2Ba26gydF4y2Ba,gydF4y2Ba27gydF4y2Ba],次生代谢[gydF4y2Ba22gydF4y2Ba],以及表观遗传控制[gydF4y2Ba14gydF4y2Ba,gydF4y2Ba28gydF4y2Ba].发现了大量调节信号通路的协调关键基因。例如,gydF4y2Ba与mad - box相关的休眠gydF4y2Ba(gydF4y2Ba大坝gydF4y2Ba)和开花基因gydF4y2Ba开花的时间gydF4y2Ba(gydF4y2Ba英国《金融时报》gydF4y2Ba),gydF4y2BaCENTRORADIALIS 1gydF4y2Ba(gydF4y2BaCENL1gydF4y2Ba),gydF4y2BaSOC1gydF4y2Ba(gydF4y2Baco1过表达抑制因子gydF4y2Ba)已被建议调节内休眠[gydF4y2Ba29gydF4y2Ba,gydF4y2Ba30.gydF4y2Ba,gydF4y2Ba31gydF4y2Ba,gydF4y2Ba32gydF4y2Ba,gydF4y2Ba33gydF4y2Ba].在内休眠的诱导和解除过程中gydF4y2Ba大坝gydF4y2Ba表达谱表明可能存在剂量依赖的芽爆抑制因子[gydF4y2Ba14gydF4y2Ba,gydF4y2Ba34gydF4y2Ba].gydF4y2Ba
葡萄是最古老的果实葡萄品种之一,其果实主要分为食用葡萄、酿酒葡萄或两者兼有,因其巨大的经济效益而在世界各地广泛种植。根据对中国东南部藤森葡萄的研究结果,葡萄酒的冬季休眠期可分为初始休眠期(12月初)、深度休眠期(1月初)和后期休眠期(2月初)[gydF4y2Ba35gydF4y2Ba].在二月底,花蕾满足了寒冷的要求,并在来年春天开花[gydF4y2Ba1gydF4y2Ba].许多工作集中于阐明葡萄和其他水果作物芽休眠的遗传网络和潜在的分子机制,其中涉及数千个基因[gydF4y2Ba12gydF4y2Ba].然而,从初冬开始的芽休眠到初春开始的芽萌发,相邻月份之间葡萄芽内的代谢途径如何变化仍不清楚。这可能是由于样本数量较少或采样时间跨度较长,这都阻碍了对葡萄冬芽越冬过程中代谢途径变化的准确描述。以Min等人的研究为例[gydF4y2Ba12gydF4y2Ba]和Khalil-Ur-Rehman等人[gydF4y2Ba1gydF4y2Ba]为例,采样时间间隔为3个月或6个月,难以描述葡萄在短越冬期内具体调控的变化规律和控制手段。葡萄芽休眠对生产有重要影响,因此了解其发生和解除的机制至关重要。因此,为了探索葡萄芽从休眠诱导期到深度休眠期再到休眠解除期的直观动态代谢变化,从次年11月到次年4月,每月采集葡萄冬芽3个节点(上、中、下)。采用RNA-seq技术在6个时间点内分析休眠芽的动态代谢变化及相关基因(包括新基因)在相邻月份间的表达趋势。同时,还初步探讨了不同节点芽在同一采样时间窗内基因表达的时空差异。这些发现为更深入、更详细地研究葡萄等果树的休眠机制开辟了道路,也为研究时空差异表达现象提供了新的视角。gydF4y2Ba
结果gydF4y2Ba
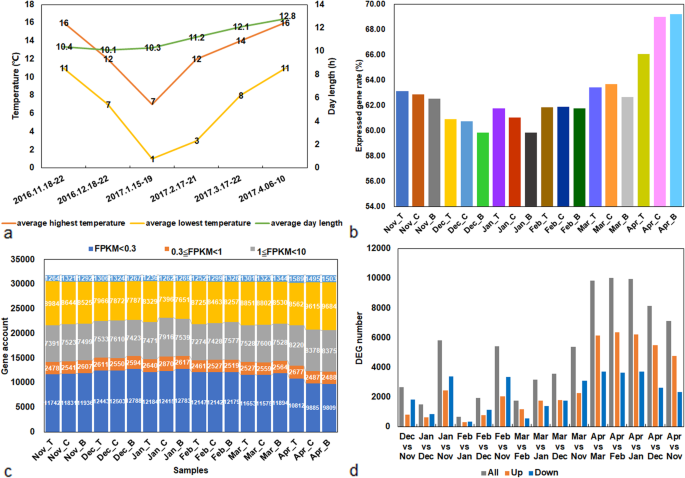
取样的基本环境条件gydF4y2Ba
从2016年11月(11月)到2017年4月(4月),12月(12月)平均日长最短,为10.1 h, 1月(1月)平均日长仅延长0.2 h, 4月平均日长增至12.8 h。平均气温呈现先降低后升高的趋势,均出现在2017年1月,分别为7°C(平均最高气温)和1°C(平均最低气温)。gydF4y2Ba1gydF4y2Ba一、表gydF4y2Ba1gydF4y2Ba).此外,采样当天的湿度从30%变化到87%(表gydF4y2Ba1gydF4y2Ba).gydF4y2Ba
RNA-Seq数据的全局分析gydF4y2Ba
从葡萄芽的不同休眠阶段和不同节点获得RNA-seq数据。从葡萄芽中构建了36个cDNA文库,共产生159590万个原始测序reads。经过一系列严格的质量控制和数据修整,共获得159390万个高质量的干净reads,包含268.83 G核苷酸序列,准确率超过99.78%。从单个样本类型中,超过88%的高质量reads被映射到葡萄参考基因组,86.01%或更多的基因组被唯一映射(补充表)gydF4y2Ba1gydF4y2Ba).gydF4y2Ba
只有59.86 ~ 69.21%的基因(共31,858个基因)的FPKM值≥0.3(图5)。gydF4y2Ba1gydF4y2Bab和c,补充表gydF4y2Ba2gydF4y2Ba而且gydF4y2Ba3.gydF4y2Ba).超过一半的基因转录值超过1(图2)。gydF4y2Ba1gydF4y2Bac、补充表格gydF4y2Ba2gydF4y2Ba而且gydF4y2Ba3.gydF4y2Ba).这些结果很好地反映了葡萄休眠芽的RNA-seq数据。gydF4y2Ba
基于Pearson相关系数的平方,评价样本的可重复性程度,用R表示gydF4y2Ba2gydF4y2Ba价值。总体而言,所有生物重复均表现出高度相关的表达,可以基于该数据集进行进一步的统计分析。此外,RgydF4y2Ba2gydF4y2Ba12月与11月、1月与12月、2月(2月)与1月、3月(3月)与2月的比值较高gydF4y2Ba2gydF4y2Ba四月与三月的比值相对较低(补充图;gydF4y2Ba1gydF4y2Ba).这些结果表明,在葡萄芽休眠释放期间发生了平稳的过渡,而在转录组更复杂的3月至4月期间发生了剧烈的变化。gydF4y2Ba
DEG谱的成对比较和聚类分析gydF4y2Ba
本研究共鉴定出11647个deg,并对不同阶段的deg进行两两比较,以研究芽休眠转变过程中基因表达的整体变化。2月与1月相比,发现了最低数量的DEGs(665个),其中321个上调,344个下调。与此相反,4月与2月的比较发现,最高的DEGs(10332个)为6373个,下调3659个,其次是4月与1月的比较,共计9957个,其中6225个上调,3732个下调。此外,4月与其他4个月的比较发现了显著差异(图2)。gydF4y2Ba1gydF4y2Bad,表gydF4y2Ba2gydF4y2Ba).gydF4y2Ba
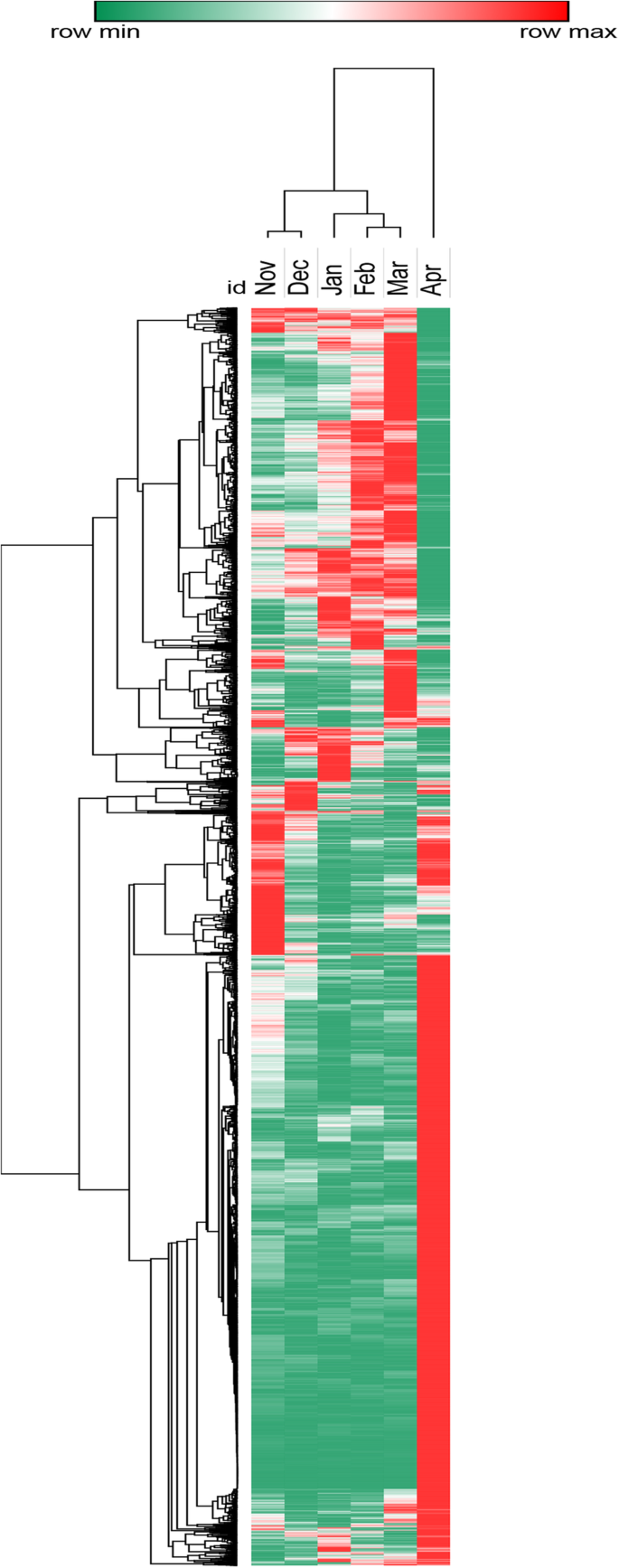
对所有11647个deg的聚类分析显示,每月收集的样本根据表达变化模式分为三个主要组(图2)。gydF4y2Ba2gydF4y2Ba).聚类结果表明,1月和3月可能是葡萄芽休眠过渡过程中的转折点,4月可能是葡萄芽休眠解除的开始。因此,根据聚类分析结果和采样期气候,将6个月大致分为11月至1月、1月至3月和3月至4月三个主要阶段,具体比较内容如下:gydF4y2Ba
葡萄休眠期间总DEGs的功能标注gydF4y2Ba
对deg进行GO、KEGG和MapMan分析。显著富集的GO术语涉及生物过程(BP)、细胞成分(CC)和分子功能(MF)。数字gydF4y2Ba3.gydF4y2Baa显示了每个GO类别在逐月比较中显著丰富的前10个术语。GO分析结果显示,“刺激反应”、“应激反应”、“化学刺激反应”和“内源性刺激反应”是BP的主要类别,且在3个以上的两两比较中显著富集。在CC术语中,“细胞外区域”、“细胞”、“细胞部分”和“质膜”在4个或4个以上比较中富集。最后,在MF方面,只有“催化活性”在三对中被富集,而“水解酶活性,作用于糖基键”,“氧化还原酶活性”和“转录因子活性”在两组比较中被鉴定(图。gydF4y2Ba3.gydF4y2Ba一个;补充表gydF4y2Ba4gydF4y2Ba).gydF4y2Ba
KEGG分析显示,“纤维素生物合成”、“茉莉酸生物合成”和“天冬酰胺生物合成II和III”在两种以上比较组合中均显著富集(图2)。gydF4y2Ba3.gydF4y2Bab、补充表gydF4y2Ba5gydF4y2Ba).此外,在其中一个比较中,有几个重要的途径脱颖而出。例如4月与3月的“抗坏血酸生物合成I (l -半乳糖途径)”,3月与2月的“光合作用光反应”和“产氧光合作用”,以及1月与12月的“淀粉降解”,几个途径不满足显著富集的条件(gydF4y2BapgydF4y2Ba-value≤0.05),但在休眠过程中也起着不可缺少的作用。例如“从蛋氨酸中合成乙烯”(4月与3月的最小p值为0.052409)、“s -腺苷蛋氨酸生物合成”(2月与1月的最小p值为0.116349)和“淀粉生物合成”(12月与11月的最小p值为0.0931243)(补充表)gydF4y2Ba5gydF4y2Ba).gydF4y2Ba
我们还通过MapMan分析,概述了休眠过渡过程中一些重要代谢途径和相关功能基团的变化。发现DEGs参与多种功能,其中前5类为“细胞壁”、“淀粉-糖代谢”、“光反应”、“脂类”和“次生代谢”(图。gydF4y2Ba3.gydF4y2Bac,补充图。gydF4y2Ba2gydF4y2Ba模拟)。例如,“细胞壁”、“脂类”、“次生代谢”、“光反应”类的DEGs主要下调,而“淀粉-糖代谢”类的DEGs在12月和11月主要上调(补充图。gydF4y2Ba2gydF4y2BaD). Apr vs Mar,可以预见,Mapman条目标注的deg数量最多。除淀粉代谢明显下调外,其他通路均明显上调(图2)。gydF4y2Ba3.gydF4y2Bac)。gydF4y2Ba
差异表达基因(DEGs)参与芽休眠期间的抗氧化系统gydF4y2Ba
氧化应激被认为是促进葡萄芽休眠释放的重要因素[gydF4y2Ba36gydF4y2Ba],包括在花蕾休眠过渡过程中ROS的生成和清除。在本研究中,共有136个deg参与细胞内氧化还原平衡,其中98个deg在4月较休眠期上调,38个deg下调(补充表)gydF4y2Ba6gydF4y2Ba).度的gydF4y2Ba酶类gydF4y2Ba(gydF4y2BaVvPODgydF4y2Ba;例如,VIT_10s0116g01780, VIT_18s0001g06850和VIT_12s0028g01840),gydF4y2Ba抗坏血酸盐过氧化物酶gydF4y2Ba(gydF4y2BaVvAPXgydF4y2Ba;例如,VIT_04s0023g03750和VIT_18s0001g06370),gydF4y2Ba谷胱甘肽过氧化物酶gydF4y2Ba(gydF4y2BaVvGPX2gydF4y2Ba;VIT_05s0102g00120),gydF4y2Ba硫氧还蛋白gydF4y2Ba(gydF4y2BaVvTrxgydF4y2Ba;例如,VIT_01s0026g01460和VIT_04s0023g02700)在休眠释放前都保持低表达水平,在4月表达水平升高(图2)。gydF4y2Ba4gydF4y2Baa,补充表gydF4y2Ba6gydF4y2Ba).相比之下,gydF4y2BaVvAPX2gydF4y2Ba(VIT_08s0040g03150),gydF4y2BaVvGPX6gydF4y2Ba(VIT_02s0025g03600),gydF4y2Ba锰超氧化物歧化酶1gydF4y2Ba(gydF4y2BaVvMSD1gydF4y2Ba;VIT_13s0067g02990和VIT_06s0004g07950),gydF4y2BaSOD1的铜伴侣gydF4y2Ba(gydF4y2BaVvCCSgydF4y2Ba;VIT_14s0030g01150),gydF4y2Ba过氧化氢酶gydF4y2Ba(gydF4y2BaVvCAT2gydF4y2Ba;VIT_18s0122g01320)在4月份显著抑制,其中,gydF4y2BaVvCAT2gydF4y2Ba36个谷胱甘肽- s转移酶(GST)编码基因中有21个在4月份下调,但在休眠期间表达量较高。然而,有两个gydF4y2Ba呼吸爆裂氧化酶同源物gydF4y2Ba(gydF4y2BaRbohgydF4y2Ba;VIT_02s0025g00510和VIT_01s0150g00440)基因,它们编码ROS合成的关键蛋白[gydF4y2Ba37gydF4y2Ba,表达量更高(图;gydF4y2Ba4gydF4y2Baa,补充表gydF4y2Ba6gydF4y2Ba).gydF4y2Ba
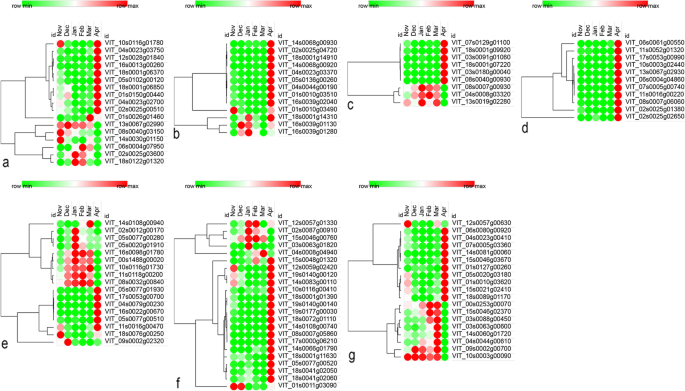
不同途径涉及的关键DEGs的表达分析。每一列代表一个实验条件,每一行代表一个基因。红色表示6个月内DEG的最高表达,绿色表示最低表达。gydF4y2Ba一个gydF4y2Ba抗氧化系统中的关键deg。gydF4y2BabgydF4y2Ba次级代谢中的关键DEGs。gydF4y2BacgydF4y2Ba细胞周期和细胞分裂中的关键DEGs。gydF4y2BadgydF4y2Ba细胞壁代谢中的关键DEGs。gydF4y2BaegydF4y2Ba淀粉-蔗糖代谢中的关键DEGs。gydF4y2BafgydF4y2Ba植物激素途径中的关键DEGs。gydF4y2BaggydF4y2Ba其他途径中的关键DEGsgydF4y2Ba
此外,还发现了一个编码金属硫蛋白(MT)的基因(VIT_08s0007g00330),在6个月内表达量较高,在3月达到峰值,然后在4月显著下降,这与重金属的解毒、必需金属离子的稳态[gydF4y2Ba38gydF4y2Ba],以及葡萄低温积累过程中的基因调控[gydF4y2Ba25gydF4y2Ba],桃子[gydF4y2Ba39gydF4y2Ba),而gydF4y2Ba杨树gydF4y2Ba芽(gydF4y2Ba40gydF4y2Ba]并可能在抗氧化过程中发挥作用(图。gydF4y2Ba4gydF4y2Baa,补充表gydF4y2Ba6gydF4y2Ba).gydF4y2Ba
在芽休眠期,DEGs参与次生代谢gydF4y2Ba
次级代谢已被报道参与葡萄的芽休眠过程[gydF4y2Ba12gydF4y2Ba].共218个DEGs涉及黄酮、苯丙素、类异戊二烯、类生物碱、简单酚类和蜡代谢,其中57%在4月表达量最高,15%在4月表达量最低(补充表)gydF4y2Ba6gydF4y2Ba).gydF4y2Ba
在与类黄酮代谢相关的50个deg中,有34个在4月份的丰度高于休眠期(补充表)gydF4y2Ba6gydF4y2Ba).编码花青素合成酶(gydF4y2BaVvANSgydF4y2Ba;VIT_02s0025g04720),推测黄酮3-羟化酶(gydF4y2BaVvF3HgydF4y2Ba;VIT_18s0001g14310和VIT_04s0023g03370),查尔酮合成酶(gydF4y2BaVvCHSgydF4y2Ba;VIT_14s0068g00930、VIT_14s0068g00920、VIT_05s0136g00260)在4月份诱导较强。gydF4y2BaVvANSgydF4y2Ba在4月份,苯丙类代谢相关的66个deg中,有46个在4月份出现不同程度的上调gydF4y2Ba肉桂醇脱氢酶gydF4y2Ba(gydF4y2BaVvCAD9gydF4y2Ba;VIT_18s0001g14910和VIT_04s0044g00190),gydF4y2Ba4-coumarate-CoA连接酶gydF4y2Ba(gydF4y2BaVv4CLgydF4y2Ba; VIT_16s0039g02040),gydF4y2Bacaffeoyl-CoA O-methyltransferasegydF4y2Ba(gydF4y2BaVvCCoAMTgydF4y2Ba;VIT_01s0010g03510和VIT_01s0010g03490)gydF4y2Ba苯丙氨酸解氨酶gydF4y2Ba(gydF4y2BaVvPALgydF4y2Ba;VIT_16s0039g01130和VIT_16s0039g01280)(图gydF4y2Ba4gydF4y2Bab、补充表gydF4y2Ba6gydF4y2Ba).gydF4y2Ba
在芽休眠期间,DEGs参与细胞周期和细胞分裂gydF4y2Ba
在芽休眠期间,大多数细胞在细胞周期的G1期受到抑制[gydF4y2Ba41gydF4y2Ba,gydF4y2Ba42gydF4y2Ba].因此,一旦芽在春季恢复生长,控制g1到s阶段过渡的基因,如gydF4y2Ba型细胞周期蛋白gydF4y2Ba(gydF4y2BaCYCDsgydF4y2Ba),可能会在发芽前被强烈激活[gydF4y2Ba42gydF4y2Ba,gydF4y2Ba43gydF4y2Ba].本研究筛选了77个参与细胞周期和细胞分裂的DEGs,其中58个在4月被高度诱导,19个在4月被下调gydF4y2BaVvCYCDsgydF4y2Ba(VIT_07s0129g01100, VIT_03s0091g01060, VIT_18s0001g09920, VIT_18s0001g07220, VIT_03s0180g00040)和gydF4y2BaVvCYCB1; 2gydF4y2Ba(VIT_08s0040g00930)。此外,与细胞分裂相关的DEGs中有近60%在4月份表达量较低,但在整个休眠过程中表达量较低。而其余在4月下调的基因在休眠期间表达量相对较高。例如,编码染色体凝结调节因子(RCC1)家族蛋白的基因(VIT_08s0007g00930、VIT_04s0008g03320和VIT_13s0019g02280)在4月显著受到抑制(图2)。gydF4y2Ba4gydF4y2Bac、补充表gydF4y2Ba6gydF4y2Ba).gydF4y2Ba
在休眠转变过程中,DEGs参与细胞壁代谢gydF4y2Ba
共鉴定出284个与细胞壁代谢相关的deg。其中近82%在休眠期呈下调趋势,4月休眠期呈上调趋势,只有约18%呈相反趋势(补充表)gydF4y2Ba6gydF4y2Ba).休眠释放期被激活的细胞壁代谢过程主要包括纤维素合成、各种细胞壁降解相关酶的合成(如纤维素酶、β -葡聚糖酶、果胶酸裂解酶)、细胞壁修饰相关酶和蛋白的合成(如木葡聚糖内转葡萄糖酶/水解酶、膨胀素)、细胞壁前体合成等。例如,木葡聚糖内转葡萄糖酶/水解酶(gydF4y2BaVvXTHsgydF4y2Ba;VIT_10s0003g02440、VIT_06s0061g00550、VIT_11s0052g01320)、扩增素编码基因(如VIT_13s0067g02930、VIT_06s0004g04860、VIT_17s0053g00990)、内切葡聚糖酶(endo1,3(4)- β葡聚糖酶)编码基因(如VIT_07s0005g00740、VIT_02s0025g01380、VIT_02s0025g02650、VIT_08s0007g06060、VIT_11s0016g00220)在4月休眠释放期和发芽期开始时均比休眠期高数百倍(图2)。gydF4y2Ba4gydF4y2Bad,补充表gydF4y2Ba6gydF4y2Ba).gydF4y2Ba
在花蕾休眠期间与淀粉-蔗糖代谢相关的DEGsgydF4y2Ba
在不同品种的芽休眠过渡过程中,淀粉和可溶性糖等碳水化合物的组成不同,其中包括葡萄。gydF4y2Ba12gydF4y2Ba,gydF4y2Ba44gydF4y2Ba]和梨[gydF4y2Ba45gydF4y2Ba].在本研究中,有56个deg与淀粉和蔗糖有关,包括参与碳水化合物合成、代谢、运输和信号传递的deg。一方面,9个淀粉合成DEGs和18个淀粉代谢DEGs在4月前保持高表达水平,4月后急剧下降(补充表)gydF4y2Ba6gydF4y2Ba).例如,的四个平行线gydF4y2Ba淀粉合成酶gydF4y2Ba(gydF4y2BavvsgydF4y2Ba;VIT_16s0098g01780、VIT_00s1488g00020、VIT_14s0108g00940、VIT_10s0116g01730)在11月至3月间保持较高表达水平,1月或3月达到峰值,4月急剧下降(图。gydF4y2Ba4gydF4y2Bae、补充表gydF4y2Ba6gydF4y2Ba).淀粉代谢基因的FPKM值,如gydF4y2BaBETA-AMYLASEgydF4y2Ba(gydF4y2BaVvBAMgydF4y2Ba;VIT_05s0077g00280, VIT_02s0012g00170, VIT_05s0020g01910),从11月到1月依次上升,然后下降,1月从1300到2800(图。gydF4y2Ba4gydF4y2Bae、补充表gydF4y2Ba6gydF4y2Ba).gydF4y2Ba
另一方面,蔗糖代谢基因如四种gydF4y2Ba蔗糖合酶gydF4y2Ba(gydF4y2BaVvSUSgydF4y2Ba;VIT_05s0077g01930、VIT_11s0016g00470、VIT_17s0053g00700、VIT_04s0079g00230)和3个转化酶(VIT_05s0077g00510、VIT_16s0022g00670、VIT_09s0002g02320)在4月表达量较休眠期显著增加。此外,蔗糖-质子转运体2 (gydF4y2BaVvSUC2gydF4y2Ba;VIT_18s0076g00250)从11月到2月逐渐减少,到4月逐渐增加,而蔗糖合成基因,包括蔗糖磷酸合酶(gydF4y2BaVvSPS1gydF4y2Ba;VIT_11s0118g00200)和蔗糖磷酸合酶(gydF4y2BaVvSPPgydF4y2Ba;VIT_08s0032g00840)显示出相反的变化模式gydF4y2BaVvSUC2gydF4y2Ba(无花果。gydF4y2Ba4gydF4y2Bae、补充表gydF4y2Ba6gydF4y2Ba)gydF4y2Ba.gydF4y2Ba
在休眠转变过程中,DEGs与植物激素相关途径有关gydF4y2Ba
共鉴定出299个deg参与激素合成、降解、信号转导。其中,脱落酸(ABA)代谢相关基因35个,赤霉素(GA)代谢相关基因32个,生长素代谢相关基因72个,细胞激元(CTK)代谢相关基因12个,乙烯(ETH)相关基因92个,茉莉酸(JA)相关基因23个,水杨酸(SA)相关基因13个,油菜素类固醇(BR)相关基因20个(补充表)gydF4y2Ba6gydF4y2Ba).gydF4y2Ba
例如,9-顺式环氧类胡萝卜素双加氧酶(gydF4y2BaVvNCED4gydF4y2Ba;ABA的关键生物合成基因VIT_02s0087g00910)在11月至1月呈上升趋势,1月达到峰值,4月逐渐下降至最低水平(图。gydF4y2Ba4gydF4y2Baf,补充表gydF4y2Ba6gydF4y2Ba).gydF4y2BaVvXERICOgydF4y2Ba(VIT_12s0057g01330)从11月到2月表达量逐渐增加,3月急剧下降,4月几乎增加了3倍,但与2月和1月相比仍处于较低水平(图1)。gydF4y2Ba4gydF4y2Baf,补充表gydF4y2Ba6gydF4y2Ba).ABA失活相关基因,如gydF4y2BaVvCYP707A4gydF4y2Ba(VIT_12s0059g02420)从11月到1月逐渐下降,然后在4月上升到最高,表现出与gydF4y2BaVvNCED4gydF4y2Ba(无花果。gydF4y2Ba4gydF4y2Baf,补充表gydF4y2Ba6gydF4y2Ba).gydF4y2Ba
GA等生物合成基因两个gydF4y2BaVvGA20oxgydF4y2Ba(VIT_18s0001g01390和VIT_15s0048g01320)和5个gydF4y2BaVvGA2oxgydF4y2Ba(VIT_05s0077g00520, VIT_19s0177g00030, VIT_19s0140g00120, VIT_19s0140g00140, VIT_10s0116g00410)在休眠期表达量低,4月表达量显著上调gydF4y2BaVvGA3oxgydF4y2BaVIT_15s0046g00760和VIT_04s0008g04940基因的结果与上述基因相反(图2)。gydF4y2Ba4gydF4y2Baf,补充表gydF4y2Ba6gydF4y2Ba).在本研究中,5个假定的ga反应gydF4y2BaGast1蛋白同源物gydF4y2Ba基因(gydF4y2BaVvGASAgydF4y2Ba;VIT_18s0072g01110、VIT_14s0108g00740、VIT_14s0066g01790、VIT_08s0007g05860、VIT_17s0000g06210)在11月至3月间维持极低表达水平,4月后显著升高(图2)。gydF4y2Ba4gydF4y2Baf,补充表gydF4y2Ba6gydF4y2Ba).gydF4y2Ba
JA也是一种通用的植物激素,在胁迫防御以及种子萌发、植物生长、脱落和衰老中起关键作用[gydF4y2Ba46gydF4y2Ba].近年来,JA在花蕾休眠中的参与和调控已成为关注的焦点[gydF4y2Ba47gydF4y2Ba,gydF4y2Ba48gydF4y2Ba].JA生物合成相关基因在休眠发育过程中表现出显著差异。gydF4y2Ba12-oxophytodienoate还原酶2gydF4y2Ba(gydF4y2BaVvOPR2gydF4y2Ba;例如,VIT_18s0041g02060和VIT_18s0041g02050),gydF4y2Ba烯氧化物环化酶4gydF4y2Ba(gydF4y2BaVvAOC4gydF4y2Ba;VIT_14s0083g00110和VIT_01s0011g03090)gydF4y2Ba烯氧化物合酶gydF4y2Ba(gydF4y2BaVvAOSgydF4y2Ba;VIT_18s0001g11630和VIT_03s0063g01820)均在4月上调表达,但在休眠期保持低表达水平,尤其是在1月至3月之间(图2)。gydF4y2Ba4gydF4y2Baf,补充表gydF4y2Ba6gydF4y2Ba).gydF4y2Ba
转录因子编码基因gydF4y2Ba
芽休眠状态由控制各种关键基因表达的转录因子(tf)正调控或负调控[gydF4y2Ba49gydF4y2Ba].共有493个deg参与了葡萄花蕾的休眠过程,隶属于25个主要的TF家族(表2)gydF4y2Ba3.gydF4y2Ba,补充表gydF4y2Ba7gydF4y2Ba).例如,在4月芽休眠开始释放时,80%的WRKY tf编码基因均表现出高表达水平gydF4y2BaVvWRKY40gydF4y2Ba(VIT_09s0018g00240)和gydF4y2BaVvWRKY41gydF4y2Ba(VIT_15s0046g01140),其中4月份的表达量分别是最低水平月份的12倍和27倍(补充表gydF4y2Ba7gydF4y2Ba).90%的bHLH家族成员在4月份表达量高于12 - 2月份,其中近51%的bHLH家族成员在1月份表达量较低(补充表gydF4y2Ba7gydF4y2Ba).大约75%的MYB tf在4月被激活,尽管在整个休眠发展过程中表达量普遍保持较低。例如,gydF4y2BaVvMYB15gydF4y2Ba而且gydF4y2BaVvMYB111gydF4y2Ba的高度诱导,而gydF4y2BaVvMYB5gydF4y2Ba而且gydF4y2BaVvMYB61gydF4y2Ba均大幅下调(补充表gydF4y2Ba7gydF4y2Ba).ap2样ABA抑制因子1 (gydF4y2BaABR1gydF4y2Ba)基因,该基因对ABA有强烈的反应,是ABA的负调节因子,在11月、12月和4月表达量较高,而在1月和3月之间表达量显著降低(补充表)gydF4y2Ba7gydF4y2Ba).gydF4y2Ba
的表达模式gydF4y2Ba大坝gydF4y2Ba与桃、梨内休眠期的过渡相一致[gydF4y2Ba50gydF4y2Ba,gydF4y2Ba51gydF4y2Ba].gydF4y2BaVvDAM2gydF4y2Ba(VIT_18s0001g07460)在本研究中被鉴定为非DEG,但总体表达模式与假设相符。的整体表达gydF4y2BaVvDAM2gydF4y2Ba(VIT_18s0001g07460)从11月到3月呈上升趋势,2月表达量略有下降,3月表达量最高,4月开始释放芽休眠,表达量下降至最低(补充表)gydF4y2Ba7gydF4y2Ba).gydF4y2Ba
DEGs参与其他与休眠相关的代谢途径gydF4y2Ba
共发现90个deg与光合作用有关,包括参与光系统I (PSI)、光系统II (PSII)和光合电子传递的deg。56个DEGs在休眠期间表达量相对较低,在4月芽开始断裂时表达量大幅上调,例如PSI和PSII多肽亚基(如VIT_14s0081g00060、VIT_06s0080g00920、VIT_05s0020g03180和VIT_04s0023g00410)和PSII的光收获复合物(叶绿素结合;例如,VIT_12s0057g00630, VIT_01s0010g03620, VIT_18s0089g01170)(图gydF4y2Ba4gydF4y2Bag,补充表gydF4y2Ba6gydF4y2Ba).然而,参与呼吸的基因在本研究中也有明显的表达差异。在4月,TCA循环25个deg中有17个表达被激活,包括ATP柠檬酸合成酶(VIT_01s0127g00260)和苹果酸脱氢酶(VIT_07s0005g03360, VIT_15s0046g03670和VIT_15s0021g02410)(图2)。gydF4y2Ba4gydF4y2Bag,补充表gydF4y2Ba6gydF4y2Ba).gydF4y2Ba
自噬是一种进化保守的分解代谢过程[gydF4y2Ba52gydF4y2Ba].本研究共发现8个自噬相关基因。表达水平gydF4y2BaVvATG101gydF4y2Ba(VIT_00s0253g00070),gydF4y2BaVvATIgydF4y2Ba(VIT_15s0046g02370),gydF4y2BaVvTORgydF4y2Ba(VIT_03s0088g00450),gydF4y2BaVvATG2gydF4y2Ba(VIT_03s0063g00600),gydF4y2BaVvATG13agydF4y2BaVIT_04s0044g00610在自然休眠时表达量高于休眠释放时。gydF4y2BaVvATIgydF4y2Ba2月达到峰值(图;gydF4y2Ba4gydF4y2Bag,补充表gydF4y2Ba6gydF4y2Ba).gydF4y2Ba
此外,有3个基因(VIT_09s0002g00700、VIT_14s0060g01720和VIT_10s0003g00090)与休眠/生长素相关家族蛋白相似gydF4y2Ba拟南芥gydF4y2Ba.这些基因在11月至3月间表达量极高,在4月芽休眠开始释放时表达量急剧下降(图2)。gydF4y2Ba4gydF4y2Bag,补充表gydF4y2Ba6gydF4y2Ba).gydF4y2Ba
新基因分析gydF4y2Ba
测序结果共获得1249个新基因,并通过Blast2GO对其进行功能预测和GO注释。1249个新基因中有662个是DEGs,它们也被BP、MF和CC标注,如“调控茉莉酸介导的信号通路”、“对赤霉素的反应”、“对脱落酸的反应”、“防御反应的调节”、“对氧化应激的反应”、“碳水化合物代谢过程”、“信号转导”、“氧化还原酶活性”、“细胞壁”(补充表)gydF4y2Ba8gydF4y2Ba).具体来说,这些新基因编码茉莉酸zimm结构域蛋白8 (Novel00062)、过氧化物酶超家族蛋白(Novel00457)、胚胎发生晚期丰富蛋白(LEA;渗透素(Novel00636),gydF4y2BaVvF3HgydF4y2Ba(Novel00736),gydF4y2Ba-葡聚糖磷酸化酶2gydF4y2Ba(gydF4y2BaVvPHS2gydF4y2Ba;Novel01068)和冷休克结构域蛋白3 (Novel00454)(补充表gydF4y2Ba8gydF4y2Ba).gydF4y2Ba
此外,还发现了一些显著的新基因,如gydF4y2Ba自噬3gydF4y2Ba(gydF4y2BaAPG3gydF4y2Ba;Novel00335),它不是一个DEG,但可能在芽休眠过程中起重要作用(补充表gydF4y2Ba8gydF4y2Ba).随着测序方法和基因组质量的不断提高,更多所谓的新基因将被标注在葡萄基因组中。gydF4y2Ba
RT-qPCR验证RNA-seqgydF4y2Ba
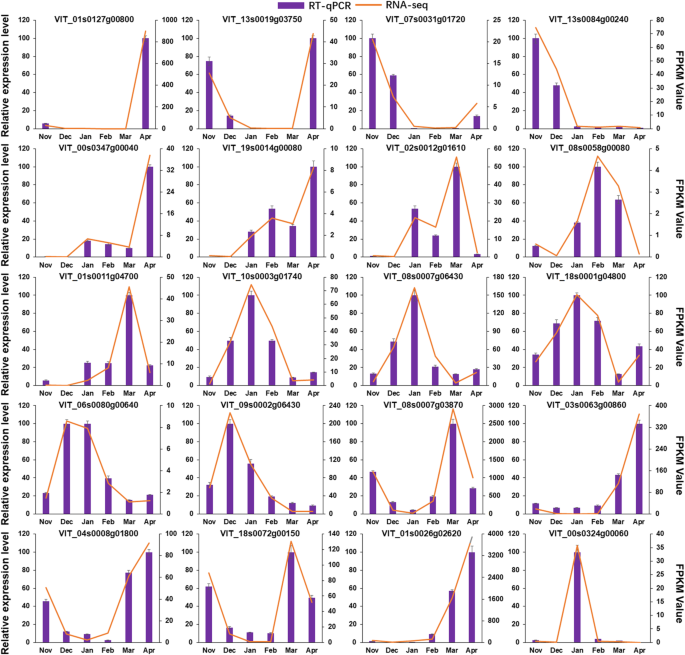
为验证转录组分析结果的准确性和重复性,随机选取20个deg进行RT-qPCR分析。基因特异性RT-qPCR引物对列于表中gydF4y2Ba4gydF4y2Ba.虽然少数基因在几个月内存在轻微差异(如VIT_01s0011g04700, VIT_06s0080g00640, VIT_04s0008g01800),但所选20个DEGs在RT-qPCR和RNA-Seq之间的表达模式基本一致,说明RNA-Seq生成的表达数据的可靠性(图2)。gydF4y2Ba5gydF4y2Ba).gydF4y2Ba
不同节点DEGs的时空表达gydF4y2Ba
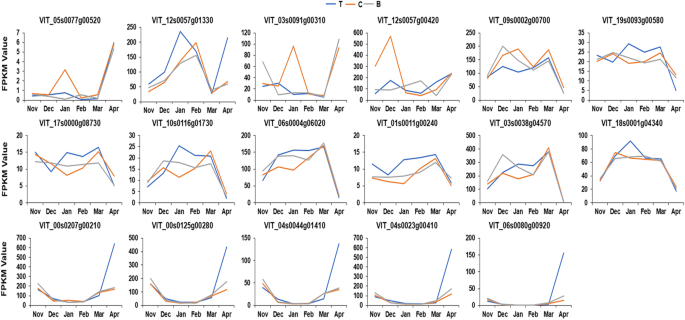
对FPKM值的分析表明,在不同节点上几种deg的表达有一些有趣的趋势。一般来说,同一基因在不同节点上的表达量在次年11月到次年3月之间可能有所不同。但在3月和4月之间出现了常态化现象,即与之前的变化无关,最终趋于一致。这一现象在激素代谢、淀粉-蔗糖代谢和光合作用途径中均有发现。例如,的表达式折线图gydF4y2BaVvGA2OX6gydF4y2Ba(VIT_05s0077g00520)表明,顶部芽、中心芽和底部芽到达FPKM顶点的时间点不同。顶部芽在11月至1月缓慢增长至一个小峰值,中心芽在11月至12月略有下降,然后在12月至1月急剧增长至一个小峰值,同时底部芽处于缓慢下降阶段。2 . 1 - 3月,花蕾顶部和中部先减少后略有增加;底芽在此期间先增加到一个小峰值,然后下降,所有芽的FPKM从3月到4月迅速增加(图2)。gydF4y2Ba6gydF4y2Ba,补充表gydF4y2Ba9gydF4y2Ba).此外,gydF4y2BaVvXERICOgydF4y2Ba(VIT_12s0057g01330)顶芽表达高峰出现在1月,比中、底芽表达高峰提前1个月;2月后,3种蛋白的表达模式相似(图2。gydF4y2Ba6gydF4y2Ba,补充表gydF4y2Ba9gydF4y2Ba).gydF4y2Ba
淀粉-蔗糖代谢相关基因的表达,如淀粉合酶3 (gydF4y2BaVvSS3gydF4y2Ba;VIT_10s0116g01730),gydF4y2BaVvPHS2gydF4y2Ba(VIT_06s0004g06020)和AGPase (VIT_03s0038g04570),在底部芽和中心芽中比顶部芽早1个月达到第一个峰值。此外,底部芽又延长了下调时间,自2月以来三者的走势基本保持一致(图1)。gydF4y2Ba6gydF4y2Ba,补充表gydF4y2Ba9gydF4y2Ba).gydF4y2Ba
丝氨酸羟甲基转移酶(光呼吸相关酶)编码基因(VIT_18s0001g04340)在中心芽上的表达量在12月达到峰值,其次是顶部芽,最后是底部芽,然后在2 - 3月之间表达量均略有下降,然后急剧下降(图。gydF4y2Ba6gydF4y2Ba,补充表gydF4y2Ba9gydF4y2Ba).此外,节点表达在时间和空间上也存在差异gydF4y2BaVvHVA22FgydF4y2Ba(VIT_17s0000g08730),gydF4y2BaVvGH3.1gydF4y2Ba(vit_01s0091g00310)和果糖激酶I编码基因(VIT_01s0011g00240)(图2)。gydF4y2Ba6gydF4y2Ba,补充表gydF4y2Ba9gydF4y2Ba).此外,在光合相关基因的表达模式中还发现了另一个有趣的现象。大多数基因在底部芽和中心芽的表达模式非常相似,但底部芽与其他两个芽在时间和表达水平上始终存在差异。此外,这种差异在不同基因中的表现也表现出一定程度的相似性,如VIT_00s0207g00210、VIT_00s0125g00280、VIT_04s0044g01410、VIT_04s0023g00410、VIT_06s0080g00920等。gydF4y2Ba6gydF4y2Ba,补充表gydF4y2Ba9gydF4y2Ba).gydF4y2Ba
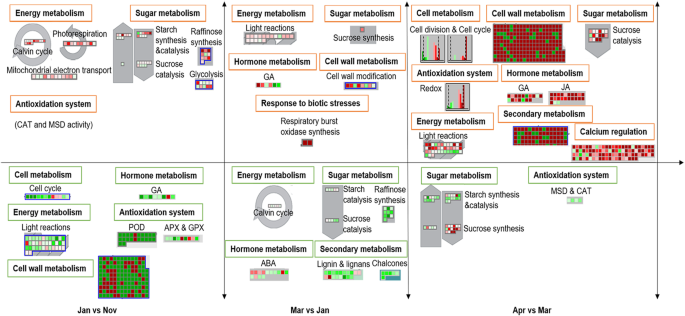
三个关键休眠过程的主要调节途径gydF4y2Ba
根据这些结果,将6个月的休眠期分为三个主要过程。结合Mapman分析和上述通路描述,在1 - 2个月间确定了几种主要的代谢调节通路。11月至1月期间,主要变化包括能量代谢(如Calvin循环、光呼吸、线粒体电子传递)、糖代谢(如淀粉合成与催化、蔗糖降解、棉子糖合成、糖酵解)和抗氧化系统(如CAT和MSD活性)上调。然而,下调的主要途径包括细胞周期、细胞壁代谢、激素代谢中的GA合成和信号通路、能量代谢(如光反应中的PSI和PSII活性)、过氧化物酶(POD)、谷胱甘肽过氧化物酶(GPX)、抗坏血酸过氧化物酶(APX)等抗氧化酶活性(图)。gydF4y2Ba7gydF4y2Ba).Mar和Jan的比较对,包括PSI和PSII活性的主要激活途径,糖代谢中蔗糖的合成,GA的合成和激素代谢的信号,细胞壁的修饰,以及对生物应激的反应(如呼吸爆发氧化酶的合成)。下调通路包括能量代谢的Calvin循环、糖代谢的蔗糖和淀粉降解及棉子糖合成、ABA信号通路、次生代谢(如查尔酮和木质素的合成)(图)。gydF4y2Ba7gydF4y2Ba).进入Apr后,与Mar相比,大部分与生长发育相关的通路被重新激活,包括细胞周期与分裂、细胞壁合成与修饰、蔗糖降解、除CAT和MSD外的抗氧化酶活性、GA和JA合成及激素代谢信号、能量代谢的光合作用、各种次生代谢(查尔酮、苯丙素、木质素、简单酚类)、钙调控。此外,Apr与Mar抑制的主要途径是糖代谢(如淀粉合成、淀粉催化和蔗糖合成)以及CAT和MSD的活性(图2)。gydF4y2Ba7gydF4y2Ba).gydF4y2Ba
讨论gydF4y2Ba
关键休眠转换时间点gydF4y2Ba
通过两两比较发现,2月与1月的DEG数量最小,表达变化趋势相似,说明1 - 2月的情况与4月相似,每个月的DEG数量都非常多,其次是11月与其他月份的比较;4月和11月的差异在所有比较组合中分别最大和最小。4月比2月最多(10032个),4月比1月次之(9957个),基因差异仅为75个。4月与12月的deg数为8137个,与1月的差异为1820个,显著大于前一对。此外,3月与1月和2月相比,deg数量分别为3191和1754,增加了近45%。但统计结果表明,日平均最低气温和最高气温均在1月(1 ~ 7℃),1月平均日长10.3 h,仅比12月最短日长长0.2 h,从3月中下旬开始,平均日长超过12 h。以往研究表明,黑加仑在休眠初期的基因活性最低,而在发芽时的基因活性最高[gydF4y2Ba27gydF4y2Ba].根据本研究的DEGs聚类结果,在4月表现出较高的表达活性,11月和12月表现出较低的基因活性,根据这些现象可以推测11月是休眠的进入点,1月是芽休眠最深的时期,3月开始出芽,4月部分芽开始发芽。Yamane也报道了类似的观察期[gydF4y2Ba53gydF4y2Ba],以翌年10月至次年3月的破芽率计算。日本杏在12月下旬至次年1月间开始解除花蕾休眠;但从1月开始,花蕾率持续增加,花蕾时间持续缩短;因此,2 - 3月的休眠期较少。gydF4y2Ba10gydF4y2Ba]也报道了类似的休眠期划分和比较模型,该模型对11月15日、12月15日、1月15日和2月15日采集的“苏里”梨芽的转录组进行了分析和比较。gydF4y2Ba
关键代谢途径的改变和关键基因的表达gydF4y2Ba
这些测序结果表明,DEGs主要富集于氧化还原平衡、次生代谢、细胞功能(如细胞壁代谢、细胞周期和细胞分裂)和淀粉-蔗糖代谢。根据采样期的气候状况,DEG值和聚类分析结果表明,1月至11月(加深休眠期)、3月至1月(非深度休眠期)、4月至3月(解除休眠期)可视为葡萄休眠过渡的关键时期。氧化应激及其响应在花蕾休眠释放和花蕾破裂过程中起着重要作用。有人假设,在休眠后恢复生长和细胞分裂需要重新激活基本代谢途径和随后生成ROS [gydF4y2Ba18gydF4y2Ba].HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba是ROS的一种形式,最近被报道与细胞生长、细胞分裂和其他细胞过程有关[gydF4y2Ba54gydF4y2Ba,gydF4y2Ba55gydF4y2Ba,gydF4y2Ba56gydF4y2Ba,gydF4y2Ba57gydF4y2Ba]和·OH可能在细胞壁松动中发挥积极作用[gydF4y2Ba58gydF4y2Ba].研究表明,氢氰胺(HC)能迅速降低CAT和MSD的活性,其次是H的活性gydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba和超氧化物水平,这是伴随着甜樱桃和葡萄的蓓蕾破裂[gydF4y2Ba16gydF4y2Ba,gydF4y2Ba59gydF4y2Ba,gydF4y2Ba60gydF4y2Ba,gydF4y2Ba61gydF4y2Ba,gydF4y2Ba62gydF4y2Ba].CAT和MSD活性在1月比11月明显上调,但在4月比3月明显被抑制,并伴随着抑制gydF4y2BaVvCAT2gydF4y2Ba而且gydF4y2BaVvMSD1gydF4y2Ba在本研究中,休眠的表达在4月开始释放。然而,在氧化爆发的反应,表达gydF4y2BaGPXgydF4y2Ba,gydF4y2Ba圆荚体gydF4y2Ba,gydF4y2Ba销售税gydF4y2Ba,gydF4y2BaAPX型gydF4y2Ba,gydF4y2BaTrxhgydF4y2Ba,以及与缺氧有关的基因(例如蔗糖合酶(gydF4y2Ba超对称性理论gydF4y2Ba)被刺激以清除休眠释放芽中的ROS [gydF4y2Ba26gydF4y2Ba,gydF4y2Ba36gydF4y2Ba,gydF4y2Ba63gydF4y2Ba].这与本研究的发现相吻合,上述各种抗氧化酶的活性在1月和11月被抑制,而在4月被高度诱导,DEGs的表达也相应发生变化。此外,最近的研究表明,钙信号在与活性氧的反应中起着重要的作用。NADPH氧化酶通过产生ROS来调控植物的生长发育,通过Ca来控制植物细胞的扩张gydF4y2Ba2 +gydF4y2Ba激活(gydF4y2Ba64gydF4y2Ba],并将钙信号通路和蛋白质磷酸化与增加的ROS生成结合在一起[gydF4y2Ba65gydF4y2Ba].在本研究中也发现了一些钙信号DEGs在4月高表达,如VIT_05s0020g04420、VIT_08s0040g00470、VIT_01s0010g03020(补充表)gydF4y2Ba6gydF4y2Ba).gydF4y2Ba
植物发育过程如细胞周期和细胞分裂的停止似乎是休眠的标志,而恢复营养生长总是伴随着芽中细胞分裂的重新激活[gydF4y2Ba42gydF4y2Ba].从11月到1月,随着葡萄芽休眠的开始和加深,细胞周期和细胞分裂暂停。然而,在4月和3月,这些都极度上调,这与活性密切相关gydF4y2BaCYCDsgydF4y2Ba.gydF4y2BaCYCDsgydF4y2Ba随着休眠的加深而下调,但随着4月芽开始发芽而高度诱导。在梨中也观察到类似的结果gydF4y2BaCYCDsgydF4y2Ba从内休眠到生态正常的过渡阶段表达量较低,在发芽前表达量增加[gydF4y2Ba51gydF4y2Ba].这些结果表明,与非休眠芽相比,休眠芽的细胞分裂和细胞伸长更慢,这进一步证实了休眠释放后芽细胞活性的恢复。gydF4y2Ba
细胞壁和次生代谢也被报道在葡萄的芽休眠转变中起重要作用[gydF4y2Ba20.gydF4y2Ba]和黑醋栗[gydF4y2Ba27gydF4y2Ba],两者之间有密切的关系[gydF4y2Ba20.gydF4y2Ba].苯丙烷丰度的增加可能是长日芽恢复活跃生长的结果,这可能有助于增加细胞壁代谢[gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba66gydF4y2Ba].类黄酮化合物在短时间内比长时间内减少gydF4y2Ba苍耳子gydF4y2Ba[gydF4y2Ba67gydF4y2Ba]而与类黄酮生物合成相关的酶在长日葡萄的茎尖中含量更高[gydF4y2Ba66gydF4y2Ba].次生代谢和相应的DEGs等gydF4y2BaVvANSgydF4y2Ba,gydF4y2BaVvF3HgydF4y2Ba,gydF4y2BaVvCHSgydF4y2Ba,以及gydF4y2BaVvCADgydF4y2Ba,gydF4y2BaVv4CLgydF4y2Ba,gydF4y2BaVvCCoAMTgydF4y2Ba而细胞壁代谢和相应的DEGs(如gydF4y2BaExpansinmgydF4y2Ba而且gydF4y2BaVvXTHgydF4y2Ba)在4月与3月、3月与1月呈高诱导表达,11月和1月呈抑制表达。gydF4y2BaExpansinmgydF4y2Ba,一种因细胞壁松动而参与细胞扩张的基因,在葡萄的冷冻需求满足期上调[gydF4y2Ba25gydF4y2Ba].gydF4y2Ba
碳水化合物在芽休眠中的作用在葡萄等物种中也有报道[gydF4y2Ba20.gydF4y2Ba],桃子[gydF4y2Ba68gydF4y2Ba]、猕猴桃[gydF4y2Ba69gydF4y2Ba].贮藏碳水化合物是春季休眠期和花蕾期代谢变化的主要能量来源[gydF4y2Ba70gydF4y2Ba].在休眠过程中,为了抵抗寒冷的冬季条件,部分淀粉储备被淀粉降解酶水解成可溶性糖[gydF4y2Ba71gydF4y2Ba]和α-淀粉酶已被报道在低温胁迫下上调[gydF4y2Ba72gydF4y2Ba].同样,淀粉催化和蔗糖合成在1月比11月和3月比1月分别上调。此外,β-淀粉酶编码基因在12月和3月高表达,在1月达到峰值。此外,蔗糖催化过程在4月和3月显著上调,蔗糖降解基因在4月和3月高表达。这可能是由于蔗糖被转化为已糖(如葡萄糖和果糖),为芽细胞合成各种必需化合物提供碳和能量[gydF4y2Ba70gydF4y2Ba].gydF4y2Ba
不同节芽的时空表达差异gydF4y2Ba
基因表达的时间和空间差异已被报道gydF4y2Ba芸苔属植物gydF4y2Ba[gydF4y2Ba73gydF4y2Ba),gydF4y2Ba答:芥gydF4y2Ba[gydF4y2Ba74gydF4y2Ba].然而,葡萄不同节芽从内休眠开始到释放的基因时空表达规律至今未见报道。许多葡萄品种的一年生枝从底部节点到顶部节点都能分化出花芽,第二年开花结果。虽然不同节芽的发育时间存在显著差异,但在萌发、拉开花序、开花时间等方面均无显著差异[gydF4y2Ba75gydF4y2Ba].这说明葡萄枝条的分化过程从下到上是不同的,最后出现了‘逐渐同步’的现象[gydF4y2Ba75gydF4y2Ba].gydF4y2Ba
几种主要负责植物激素合成和信号传导(GA、ABA和IAA)、淀粉和蔗糖代谢以及光合作用的DEGs在不同芽节的表达存在明显的时空差异,并在不同时间达到峰值或低谷。例如,gydF4y2BaGA2OX6gydF4y2Ba(VIT_05s0077g00520),gydF4y2BaVvXERICOgydF4y2Ba(VIT_12s0057g01330),gydF4y2BaGH3.1gydF4y2Ba(VIT_03s0091g00310),gydF4y2BaVvSS3gydF4y2Ba(VIT_10s0116g01730),gydF4y2BaVvPHS2gydF4y2Ba(VIT_06s0004g06020)和AGPase (VIT_03s0038g04570)在三个节点上的表达模式可能彼此不同,或者其中一个节点可能与其他两个节点相差很远;但与11月至3月间的变化无关,最终在3月至4月间呈现出基本一致的表达趋势,即趋同。gydF4y2Ba
多数光合相关基因的表达模式在底部芽和中心芽中非常相似。然而,底芽与其他两个芽在时间和表达水平上始终存在差异,并且这种变化模式在不同基因中的表现惊人地一致。gydF4y2Ba
芽的活动在整株水平上协调,但在单个芽的水平上表现出差异[gydF4y2Ba76gydF4y2Ba].这可能反映了葡萄花蕾在休眠过程中不同生长部位的几种DEGs在时间和空间上的表达存在显著差异。同一基因在不同节芽中的表达趋势基本一致,说明不同节芽的发育过程相同;但不同节芽的基因表达量和时间不同[gydF4y2Ba75gydF4y2Ba].不同节点芽中不同基因的表达量在休眠期间的变化趋势基本一致。说明各节芽发育阶段相似,进入相似的发育过程。因此,休眠期可能被认为是每个节点芽发育过程中“逐渐同步”的关键阶段。这种现象可能发生在植物整个生命过程中的所有器官或发育阶段。为了更深入地探索这些现象,未来可以采用更密集的采样模式,例如每周采样一次或每两周采样一次,以确定更具体的变化趋势。gydF4y2Ba
与之前研究的相似点和不同点gydF4y2Ba
巧合的是,冬季采样次数在Díaz-Riquelme等人的研究中。gydF4y2Ba3.gydF4y2Ba]也与当前研究中使用的方法非常相似。本研究采用冬季较细采样,12月和2月增加采样,主要观察葡萄芽休眠形成初期(初冬)至休眠解除初期(初春)芽内代谢途径及相关基因表达水平的持续变化。相比之下,前人[gydF4y2Ba3.gydF4y2Ba]也在夏季和初秋进行了采样,绘制了在休眠进入和内部休眠和生态休眠之间过渡期间发生的事件的图片。这也为今后有关果树休眠的研究提供了思路。关于研究技术,目前的工作使用RNA-seq技术,而Díaz-Riquelme等。[gydF4y2Ba3.gydF4y2Ba]使用微阵列。RNA-seq总体上显示更多的DEGs,为基因功能分析提供了更多的信息,而涉及休眠阶段的生物学机制是相似的。差异也可能出现,因为两项研究调查了不同的基因型。此外,本研究还揭示了在同一时间采样的不同分支节点芽在时间和空间上的基因表达差异。gydF4y2Ba
结论gydF4y2Ba
本研究为葡萄休眠转变的遗传调控提供了新的视角,采用下一代测序(RNA-seq)技术显示了休眠转变过程中基因表达的关键变化。研究结果为芽休眠调节网络模型的提出提供了依据。氧化还原平衡、次生代谢产物、细胞功能(如细胞壁代谢、细胞周期、细胞分裂)、碳水化合物代谢等相互作用,并响应外界因素,调节休眠进程。此外,还提出了不同节点芽在时间和空间表达上的“渐进同步”的新思想,并将在未来进一步探索。gydF4y2Ba
方法gydF4y2Ba
样本采集和天气记录gydF4y2Ba
三岁的gydF4y2Ba葡萄gydF4y2Ba简历。Rosario Bianco ' (' Rosaki ' × ' Muscat of Alexandria ')葡萄经江苏农林职业学院许可种植在中国江苏农业博园(N32°0 ' 41.99″,E119°15 ' 7.11″)。2016年11月(11月)植株落叶进入休眠后,随机抽取12根枝条进行修剪,每次观察每株上相同的30 ~ 40根枝条。为了获得更清晰的葡萄芽休眠和休眠期间不同芽节点的表达变化谱,由于4月份发芽率约为30%,因此从次年11月至4月每月对不同节点的芽进行采样。花蕾从底部收割(B;3、4、5个花蕾(C;第8、9、10个花蕾(T;2016年11月、12月(12月)20日,2017年1月(1月)、2月(2月)、3月(3月)20日和4月8日,各分支的第14、15和16个芽。每个节点每月至少采集30个芽。将相同采样时间的相同节点样品混合,立即在液氮中冷冻,然后在−80°C保存,直到RNA提取。 The temperature, humidity, and length of day were measured during each investigation and sampling, and the average day length and temperatures of the 5 days before and after the sampling day were calculated.
准备RNA-seq文库gydF4y2Ba
使用Foregene RNA分离试剂盒(中国成都Foregene有限公司)进行总RNA提取,并使用2100生物分析仪(安捷伦科技公司,美国加州圣克拉拉)检查RNA质量。从每个休眠阶段收集的所有样本的总RNA汇集成36个样本(6个月× 3个生长位置× 2个重复),这些样本在Illumina HiSeq™2500平台上测序(Illumina, San Diego, CA, USA)。gydF4y2Ba
测序和差异基因表达分析gydF4y2Ba
通过从原始序列数据(原始reads)中去除低质量的reads和包含适配器和超过10%的匿名核苷酸(N)的reads来获得干净的reads。随后进行的分析均基于干净的高质量数据。干净的读取被映射到gydF4y2Ba诉酿酒用葡萄gydF4y2Ba参考基因组(gydF4y2Baftp://ftp.ensemblgenomes.org/pub/release-23/plants/gtf/vitis_vinifera/gydF4y2Ba)制图软件HISAT(2.0.4版本)。Illumina测序获得的序列保存在NCBI Sequence Read Archive(登录号PRJNA488534)。gydF4y2Ba
HTSeq [gydF4y2Ba77gydF4y2Ba](版本0.6.1)用于计数映射到每个基因的reads。根据映射到该基因的基因长度和读数,计算每个基因的期望的每百万碱基对测序的转录序列的片段数(FPKM)。利用DESeq软件(版本1.10.1),根据库间各转录本的计数值进行差异表达分析和计算[gydF4y2Ba78gydF4y2Ba].转录本表达显著差异的阈值为“调整后的p值(padj) < 0.05”和“|日志”gydF4y2Ba2gydF4y2Ba叠化(日志gydF4y2Ba2gydF4y2BaFc) |≥1”。FPKM < 0.3的基因被认为未表达,因此在至少一组中被排除[gydF4y2Ba79gydF4y2Ba].gydF4y2Ba
葡萄休眠期间总DEGs的功能标注gydF4y2Ba
当进一步比较不同月份之间的差异表达基因(DEGs)时,每个月在三个节点中使用两个重复,因此,这相当于每月6个生物重复。不同芽节点上的表达模式相当于2个重复序列。gydF4y2Ba
基因本体论(GO)和京都基因和基因组百科全书(KEGG)路径注释通过Plant MetGenMAP工具进行[gydF4y2Ba80gydF4y2Ba] (gydF4y2Bahttp://bioinfo.bti.cornell.edu/cgi-bin/MetGenMAP/home.cgigydF4y2Ba),阈值为FDR≤0.05gydF4y2BapgydF4y2Ba-value分别≤0.05。所有deg的功能注释也使用MapMan (Vvnifera_145,gydF4y2Bahttp://mapman.gabipd.org/web/guest/mapmanstoregydF4y2Ba) [gydF4y2Ba81gydF4y2Ba].利用Morpheus工具获取11月、12月、1月、2月、3月和4月基因表达水平的热图(gydF4y2Bahttps://software.broadinstitute.org/morpheus/gydF4y2Ba).gydF4y2Ba
新基因预测及功能注释gydF4y2Ba
所有测序reads数据的基因组定位结果使用Cufflinks软件进行组装[gydF4y2Ba82gydF4y2Ba](版本2.1.1),并使用Cuffcompare (Cufflinks包的一部分)将这些结果与已知的结果进行比较gydF4y2Ba诉酿酒用葡萄gydF4y2Ba参考基因组鉴定新基因及其基因组定位。所有新基因序列通过Blast2GO软件直接爆破[gydF4y2Ba83gydF4y2Ba](版本2.7.1),获取它们的基因描述和功能注释。gydF4y2Ba
实时定量PCR (RT-qPCR)检测DEGsgydF4y2Ba
随机选择20个基因,通过RT-qPCR验证RNA-seq技术揭示的表达模式。根据3 ' UTR序列信息,采用Primer3软件设计基因特异性RT-qPCR引物对(gydF4y2Bahttp://primer3.ut.ee/gydF4y2Ba) [gydF4y2Ba84gydF4y2Ba].针对缺乏3’UTR序列信息的基因,设计引物在编码区进行退火。纯化的RNA样本使用Revert Aid™第一链cDNA合成试剂盒(Fermentas, Glen Burnie, MD, USA)按照制造商的方案进行反转录。RT-qPCR使用Applied Biosystems®7500 Real-Time PCR仪(Applied Biosystems, Foster City, CA, USA)。每20 μl反应混合物由10 μl EvaGreen 2× qPCR MasterMix-ROX (ABM, Richmond, BC, Canada)、2.0 μl cDNA样品、0.6 μl正向引物、0.6 μl反向引物和6.8 μl无核酸酶H组成gydF4y2Ba2gydF4y2BaO.反应程序采用以下程序:10分钟(95°C),然后在95°C和62°C分别进行15秒和1分钟的35个循环,最终冷却至4°C。每个cDNA样本重复3次进行RT-qPCR分析。对每个被测基因的三次重复反应的周期阈值(Ct)取平均值,然后将这些值归一化到gydF4y2Ba肌动蛋白gydF4y2Ba基因(AB073011,正向引物GGAAGCTGCGGGAATTCATGAG,反向引物CCTTGATCTTCATGCTGCTGGG)。各基因的相对表达量通过2gydF4y2Ba——ΔΔCTgydF4y2Ba公式(gydF4y2Ba85gydF4y2Ba].gydF4y2Ba
数据和材料的可用性gydF4y2Ba
测序数据可在NCBI Sequence Read Archive (SRA)数据库中获得,登录号为PRJNA488534。在本研究过程中产生或分析的所有数据都包含在本文中(及其补充信息文件)。gydF4y2Ba
缩写gydF4y2Ba
- RNA-seq:gydF4y2Ba
-
RNA-sequencinggydF4y2Ba
- 度:gydF4y2Ba
-
差异表达基因gydF4y2Ba
- 阿坝:gydF4y2Ba
-
脱落酸gydF4y2Ba
- HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba:gydF4y2Ba
-
过氧化氢gydF4y2Ba
- OgydF4y2Ba2gydF4y2Ba−gydF4y2Ba:gydF4y2Ba
-
超氧阴离子自由基gydF4y2Ba
- 哦:gydF4y2Ba
-
羟基自由基gydF4y2Ba
- iTRAQ:gydF4y2Ba
-
等压标签相对和绝对定量gydF4y2Ba
- 台湾海陆运输公司:gydF4y2Ba
-
串联质量标签gydF4y2Ba
- 11月:gydF4y2Ba
-
11月gydF4y2Ba
- 12月:gydF4y2Ba
-
12月gydF4y2Ba
- 简:gydF4y2Ba
-
1月gydF4y2Ba
- 2月:gydF4y2Ba
-
2月gydF4y2Ba
- 3月:gydF4y2Ba
-
3月gydF4y2Ba
- 4月:gydF4y2Ba
-
4月gydF4y2Ba
- 诉酿酒用葡萄gydF4y2Ba:gydF4y2Ba
-
葡萄gydF4y2Ba
- FPKM:gydF4y2Ba
-
每百万碱基对测序的转录本序列中每千碱基的期望片段数gydF4y2Ba
- padj:gydF4y2Ba
-
调整gydF4y2BapgydF4y2Ba价值gydF4y2Ba
- 日志gydF4y2Ba2gydF4y2Ba舰队指挥官:gydF4y2Ba
-
日志gydF4y2Ba2gydF4y2Ba叠化gydF4y2Ba
- Ct:gydF4y2Ba
-
循环阈值gydF4y2Ba
- 走:gydF4y2Ba
-
基因本体论gydF4y2Ba
- KEGG:gydF4y2Ba
-
京都基因和基因组百科全书gydF4y2Ba
- RT-qPCR:gydF4y2Ba
-
实时定量PCRgydF4y2Ba
- 英国石油公司:gydF4y2Ba
-
生物过程gydF4y2Ba
- 答:gydF4y2Ba
-
蜂窝组件gydF4y2Ba
- MF:gydF4y2Ba
-
分子功能gydF4y2Ba
- ROS:gydF4y2Ba
-
活性氧gydF4y2Ba
- 销售税:gydF4y2Ba
-
Glutathione-S-transferasegydF4y2Ba
- MT:gydF4y2Ba
-
金属硫蛋白gydF4y2Ba
- 遗传算法:gydF4y2Ba
-
赤霉素gydF4y2Ba
- 与原:gydF4y2Ba
-
细胞分裂素gydF4y2Ba
- 乙:gydF4y2Ba
-
乙烯gydF4y2Ba
- 是:gydF4y2Ba
-
Jasmonate酸gydF4y2Ba
- 山:gydF4y2Ba
-
水杨酸gydF4y2Ba
- TF:gydF4y2Ba
-
转录因子gydF4y2Ba
- ABR1:gydF4y2Ba
-
ap2样ABA抑制因子1gydF4y2Ba
- PSI:gydF4y2Ba
-
光系统IgydF4y2Ba
- PSII:gydF4y2Ba
-
光系统IIgydF4y2Ba
- 李:gydF4y2Ba
-
胚胎发生后期蛋白质丰富gydF4y2Ba
- HC:gydF4y2Ba
-
氢氰氨化gydF4y2Ba
- 圆荚体:gydF4y2Ba
-
过氧化物酶gydF4y2Ba
- GPX:gydF4y2Ba
-
谷胱甘肽过氧化物酶gydF4y2Ba
- APX型:gydF4y2Ba
-
抗坏血酸盐过氧化物酶gydF4y2Ba
- 答:芥gydF4y2Ba:gydF4y2Ba
-
拟南芥gydF4y2Ba
- 国际宇航科学院:gydF4y2Ba
-
indole-3-acetic酸gydF4y2Ba
参考文献gydF4y2Ba
- 1.gydF4y2Ba
Khalil-Ur-Rehman M,孙林,李春霞,Faheem M,王伟,陶建明。葡萄芽休眠的比较RNA-seq转录组学分析。BMC植物学报,2017;17(1):18。gydF4y2Ba
- 2.gydF4y2Ba
Lang G, Early J, Martin G, Darnell R. Endo, Para和生态休眠:休眠研究的生理学术语和分类。Hortscience。1987;22:271-7。gydF4y2Ba
- 3.gydF4y2Ba
Díaz-Riquelme J, Grimplet J, Martínez-Zapater JM, Carmona MJ。葡萄芽发育过程中的转录组变异(gydF4y2Ba葡萄gydF4y2Bal。)。植物学报。2012;12(1):181。gydF4y2Ba
- 4.gydF4y2Ba
Erez A, Faust M, Line M.桃芽诱导、发育和休眠释放过程中水分状态的变化。科学通报。1998;43(3):344 - 344。gydF4y2Ba
- 5.gydF4y2Ba
傅士德,刘东,李志强,李志强。休眠苹果花蕾中游离水与束缚水的关系。Hortscience。1991;26(7):887 - 90。gydF4y2Ba
- 6.gydF4y2Ba
刘D,浮士德M,米勒德MM, Line MJ,斯图亚特GW。用质子磁共振成像技术测定夏季休眠苹果花蕾的水分状态。中国科学:地球科学,2004,18(3):344 - 344。gydF4y2Ba
- 7.gydF4y2Ba
Iwasaki K.冷冻、氰胺钙和去除芽垢对仙粉黛葡萄(Vitis vinifera L.)芽的破芽、生根和抑制剂含量的影响。生态环境科学学报,2001;23(2):344 - 344。gydF4y2Ba
- 8.gydF4y2Ba
埃默森詹。三种葡萄的内源性脱落酸与休息和萌芽的关系。自然科学进展,1999;23(3):377 - 382。gydF4y2Ba
- 9.gydF4y2Ba
Or E, Belausov E, Popilevsky I, Bental Y.在炎热气候下生长的葡萄内源ABA水平与休眠周期的关系。中国生物医学工程学报。2000;32(2):339 - 339。gydF4y2Ba
- 10.gydF4y2Ba
刘刚,李伟,郑萍,徐涛,陈琳,刘东,Hussain S,滕勇。“苏里”梨(Pyrus pyrifolia白梨组)芽休眠过程转录组RNA-Seq分析。BMC基因组学杂志,2012;13(1):700。gydF4y2Ba
- 11.gydF4y2Ba
白S, Saito T, Sakamoto D, Ito A, Fujii H, Moriguchi T.日本梨(Pyrus pyrifolia Nakai)花芽内休眠过渡的转录组分析。中国生物医学工程学报。2013;34(7):339 - 344。gydF4y2Ba
- 12.gydF4y2Ba
闵忠,赵霞,李锐,杨波,刘敏,方勇。葡萄芽休眠相关基因的比较转录组分析。科学通报,2017;225:213-20。gydF4y2Ba
- 13.gydF4y2Ba
郭德龙,奚芳芳,余永华,张晓宇,张国华,钟国元。鲜食葡萄‘Kyoho’与其早熟突变体‘feng早’浆果发育的RNA-Seq比较分析。BMC Genomics. 2016;17(1):795。gydF4y2Ba
- 14.gydF4y2Ba
Yu J, Conrad AO, Decroocq V, Zhebentyayeva T, Williams DE, Bennett D, Roch G, Audergon JM, Dardick C, Liu Z,等。不同的基因表达模式决定了杏和桃的内休眠向生态休眠的转变。植物科学进展2020;11:180。gydF4y2Ba
- 15.gydF4y2Ba
张震,卓霞,赵凯,郑涛,韩艳,袁春,张强。转录组分析揭示了激素和糖在梅李芽休眠中的重要作用。科学通报2018;8(1):5090。gydF4y2Ba
- 16.gydF4y2Ba
Ionescu IA, López-Ortega G, Burow M, Bayo-Canha A, Junge A, Gericke O, Møller BL, Sánchez-Pérez R.甜樱桃花芽破裂过程中转录组和代谢产物的变化。中国植物科学,2017;8:1233。gydF4y2Ba
- 17.gydF4y2Ba
Vimont N, Fouché M, Campoy JA, Tong M, Arkoun M, Yvin JC, Wigge PA, Dirlewanger E, Cortijo S, Wenden B.从花蕾形成到开花:转录组状态决定甜樱桃花蕾休眠的发育阶段。BMC基因组学。2019;20(1):974。gydF4y2Ba
- 18.gydF4y2Ba
Hoeberichts FA, Povero G, Ibañez M, Strijker A, Pezzolato D, Mills R, Piaggesi A.在猕猴桃(猕猴桃)中使用天然生物刺激剂打破芽休眠的下一代测序。科学通报,2017;225:252-63。gydF4y2Ba
- 19.gydF4y2Ba
张红,李红,赖斌,夏红,王辉,黄霞。热带多年生植物芽发育的形态特征和基因表达谱,gydF4y2Ba荔枝gydF4y2Ba比如说。前沿植物学报2016;7:1517。gydF4y2Ba
- 20.gydF4y2Ba
George IS, Fennell AY, Haynes PA。葡萄光周期调控休眠诱导的鸟枪蛋白质组学分析。中国生物医学工程学报,2018;gydF4y2Ba
- 21.gydF4y2Ba
Khalil-Ur-Rehman M,王伟,董勇,Faheem M,徐勇,高志,郭申Z,陶杰。利用转录组学和蛋白质组学分析深入研究氢氰胺在葡萄芽休眠中的作用。中华分子生物学杂志,2019;20(14):3528。gydF4y2Ba
- 22.gydF4y2Ba
李施Du H, Y, D,风扇W,王Y,王G,王c .蛋白质组学揭示关键蛋白质参与增长区别在终端休眠,休眠苜蓿芽。中国生物医学工程学报,2018;gydF4y2Ba
- 23.gydF4y2Ba
Noriega X, Pérez FJ。葡萄芽从内休眠释放过程中ABA生物合成基因下调,生长素和细胞分裂素生物合成基因上调。植物生长学报,2017;36(4):814-23。gydF4y2Ba
- 24.gydF4y2Ba
邱颖,管素生,温春,李鹏,高志,陈霞。生长素和细胞分裂素协调草莓流落轮腋芽休眠和出芽。BMC植物生物学,2019;19(1):528。gydF4y2Ba
- 25.gydF4y2Ba
Mathiason K, He D, Grimplet J, Venkateswari J, Galbraith DW, Or E, Fennell A.葡萄枝叶在冷胁迫条件下的转录谱分析揭示了基因表达模式与最佳破芽的协调。中国生物医学工程学报。2009;9(1):81-96。gydF4y2Ba
- 26.gydF4y2Ba
苏达万B,张春生,赵海峰,许志强,颜玉芳。氰胺氢在夏季通过短暂激活基因表达和活性氧和氮的积累来打破葡萄芽休眠。BMC植物学报,2016;16(1):202。gydF4y2Ba
- 27.gydF4y2Ba
Hedley PE, Russell JR, Jorgensen L, Gordon S, Morris JA, Hackett CA, Cardle L, Brennan R.黑醋栗芽休眠释放相关候选基因(gydF4y2Ba酷栗初步gydF4y2Bal .)。中国生物医学工程学报。2010;10(1):202。gydF4y2Ba
- 28.gydF4y2Ba
Santamaría M, Hasbún R, Valera M, Meijón M, Valledor L, Rodríguez JL, Toorop PE, Cañal M, Rodríguez R.板栗花蕾发育过程中H4组蛋白乙酰化和基因组DNA甲基化模式。植物营养学报,2009;26(3):344 - 344。gydF4y2Ba
- 29.gydF4y2Ba
Böhlenius H, Huang T, Charbonnel-Campaa L, Brunner AM, Jansson S, Strauss SH, Nilsson O. CO/FT调控模块控制树木开花时间和季节性生长停止。科学。2006;312(5776):1040 - 3。gydF4y2Ba
- 30.gydF4y2Ba
Ruonala R, Rinne PLH, Kangasjärvi J, van der Schoot C.胡杨肋分生组织中CENL1的表达影响茎伸长和向休眠的过渡。植物学报。2008;20(1):59-74。gydF4y2Ba
- 31.gydF4y2Ba
徐志勇,Adams JP, Kim H, No K, Ma C, Strauss SH, Drnevich J, Vandervelde L, Ellis JD, Rice BM。开花位点T重复协调了多年生杨树的繁殖和营养生长。自然科学进展,2011;26(3):357 - 357。gydF4y2Ba
- 32.gydF4y2Ba
Rinne PLH, Welling A, Vahala J, Ripel L, Ruonala R, Kangasjärvi J, van der Schoot C.杨树休眠芽低温诱导开花位点T并招募ga诱导的1,3 -β-葡萄糖聚糖酶重新打开信号管道并释放休眠。植物学报。2011;23(1):130-46。gydF4y2Ba
- 33.gydF4y2Ba
王杰,高志,李辉,九松,曲勇,王磊,马超,徐伟,王松,张超。休眠相关MADS-box (DAM)基因与SOC1基因共同调控甜樱桃的低温需求及花发育。国际分子化学杂志,2020;21(3):921。gydF4y2Ba
- 34.gydF4y2Ba
Sasaki R, Yamane H, Ooka T, Jotatsu H, Kitamura Y, Akagi T, Tao R.日本杏内休眠相关PmDAM基因的功能和表达分析。中国生物医学工程学报。2011;26(1):344 - 344。gydF4y2Ba
- 35.gydF4y2Ba
范江W,汉族H, X,曹J,李g .氰氨化钙和水杨酸dormancy-release葡萄芽。园艺学报,2007;34(2):317-24。gydF4y2Ba
- 36.gydF4y2Ba
Halaly T, Pang X, Batikoff T, Crane O, Keren A, Venkateswari J, Ogrodovitch A, Sadka A, Lavee S, Or e。足底。2008;228(1):79 - 88。gydF4y2Ba
- 37.gydF4y2Ba
马托瑞斯,Dangl JL。呼吸爆发氧化酶在生物相互作用、非生物胁迫和发育中的作用。植物学报,2005;8(4):397-403。gydF4y2Ba
- 38.gydF4y2Ba
Tomsett AB, Thurman DA。植物耐金属性的分子生物学。植物细胞环境。1988;11(5):383-94。gydF4y2Ba
- 39.gydF4y2Ba
Jiménez S, Reighard GL, Bielenberg DG。DAM5和DAM6基因表达受低温抑制,且与破芽率呈负相关。中国生物医学工程学报,2010;29(1):344 - 344。gydF4y2Ba
- 40.gydF4y2Ba
朴珊,戴凯思,韩k - h。三角杨树年度生长周期的转录谱。树物理学报,2008;28(3):321-9。gydF4y2Ba
- 41.gydF4y2Ba
Devitt ML, Stafstrom JP。豌豆腋芽生长-休眠周期中的细胞周期调控。植物分子生物学,1995;29(2):255-65。gydF4y2Ba
- 42.gydF4y2Ba
霍瓦特DP,安德森JV,赵WS, Foley ME。知道什么时候生长:调节蓓蕾休眠的信号。植物科学进展,2003;8(11):534-40。gydF4y2Ba
- 43.gydF4y2Ba
清水佐藤,森辉。腋芽生长和休眠的控制。植物科学进展。2001;27(4):344 - 344。gydF4y2Ba
- 44.gydF4y2Ba
卢比奥,丹塔斯D,布雷桑-史密斯R, Pérez FJ。葡萄芽内休眠与抗寒性的关系。植物生长学报,2016;35(1):266-75。gydF4y2Ba
- 45.gydF4y2Ba
郑秋娟,李敏,祁xx,吴娟,殷红,邓金林,张树林。基于数字基因表达谱的差异表达基因鉴定gydF4y2BaPyrus pyrifoliagydF4y2BaNakai简历。虎尾芽在早期落叶后释放。树Genet基因组,2015;11(3):34。gydF4y2Ba
- 46.gydF4y2Ba
戴维斯PJ。植物激素:它们的性质、发生和功能。进:Davies PJ,编辑。植物激素:生物合成,信号转导,行动!多德雷赫特978-1-4020-2686-7:施普林格荷兰;2010.1 - 15 p。。gydF4y2Ba
- 47.gydF4y2Ba
郝霞,杨艳,岳晨,王玲,Horvath DP,王霞。综合转录组分析揭示了山茶花腋芽在准、内、生态臭和冲芽期的差异基因表达谱。中国植物科学,2017;8:553。gydF4y2Ba
- 48.gydF4y2Ba
Howe GT, Horvath DP, Dharmawardhana P, Priest HD, Mockler TC, Strauss SH.杨树营养芽休眠自然启动和释放过程中转录组的广泛变化。植物科学进展(英文版);gydF4y2Ba
- 49.gydF4y2Ba
Anderson JV, Chao WS, Horvath DP。营养芽休眠调控的研究进展。植物科学2001;49(5):581-9。gydF4y2Ba
- 50.gydF4y2Ba
Leida C, Conesa A, Llácer G, Badenes ML, Ríos G.桃在芽休眠释放过程中组蛋白修饰和DAM6基因表达的调控与品种相关。New Phytol. 2012;193。gydF4y2Ba
- 51.gydF4y2Ba
Saito T, Bai S, Ito A, Sakamoto D, Saito T, Ubi BE, Imai T, Moriguchi T休眠相关MADS盒基因MADS13在不同低温条件下释放内休眠的梨(Pyrus pyrifolia Nakai)中的表达和基因组结构树物理学报,2013;33(6):654-67。gydF4y2Ba
- 52.gydF4y2Ba
白硕,金基。自噬的表观遗传控制:核事件获得更多关注。中国生物医学工程学报,2017;26(5):781-5。gydF4y2Ba
- 53.gydF4y2Ba
日本杏芽休眠和破芽的调控(gydF4y2Ba李属却已gydF4y2Ba西博尔德和祖克)和桃子[gydF4y2Ba碧桃gydF4y2Ba(l)Batsch]:近期研究综述。日本园艺学报,2014:CH-Rev4。gydF4y2Ba
- 54.gydF4y2Ba
李丽娟,李丽娟,李丽娟。过氧化氢在植物代谢和细胞信号通路调控中的作用。生物化学学报。2007;54(1):39。gydF4y2Ba
- 55.gydF4y2Ba
贝斯特维克CS,布朗IR,班尼特MH,曼斯菲尔德JW。莴苣细胞对丁香假单胞菌超敏反应中过氧化氢积累的定位。植物细胞学报。1997;9(2):209-21。gydF4y2Ba
- 56.gydF4y2Ba
Queval G, Issakidis-Bourguet E, Hoeberichts FA, Vandorpe M, Gakière B, Vanacker H, Miginiac-Maslow M, Van Breusegem F, Noctor G.拟南芥光呼吸突变体cat2的条件氧化应激反应表明氧化还原状态是日光长度依赖基因表达的关键调节因子,并确定光周期是h2o2诱导细胞死亡的调控关键因素。植物学报,2007;26(4):344 - 344。gydF4y2Ba
- 57.gydF4y2Ba
Potikha TS, Collins CC, Johnson DI, Delmer DP, Levine A.过氧化氢参与棉纤维次生壁分化。植物科学进展。1999;19(3):344 - 344。gydF4y2Ba
- 58.gydF4y2Ba
•DJ。增强细胞壁延展性的酶和其他药剂。植物学报。1999;50(1):391-417。gydF4y2Ba
- 59.gydF4y2Ba
李志强,李志强,李志强,等。过氧化氢酶活性变化的研究进展。1.6)与葡萄藤(Vitis vinifera L.)芽的休眠有关。植物学报。1986;81(4):1140-2。gydF4y2Ba
- 60.gydF4y2Ba
Pérez杨建军,李丽娟。过氧化氢酶在葡萄休眠后破芽过程中的作用。植物营养学报,2005;26(3):344 - 344。gydF4y2Ba
- 61.gydF4y2Ba
Pérez杨建平,刘建伟,刘建伟gydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba参与了氰化氢在葡萄芽中的破休眠作用。植物生长学报。2008;55(2):149-55。gydF4y2Ba
- 62.gydF4y2Ba
裴西-米勒T,斯科特K, Ablett E, Tingey S, Ching A, Henry R.与葡萄休眠结束相关的基因。2 . Funct Integr Genomics, 2003;gydF4y2Ba
- 63.gydF4y2Ba
Keilin T, Pang X, Venkateswari J, Halaly T, Crane O, Keren A, Ogrodovitch A, Ophir R, Volpin H, Galbraith D.葡萄芽EST的数字表达谱分析为葡萄芽休眠释放过程中的分子事件提供了新的视角。植物科学进展,2007;17(4):446 - 457。gydF4y2Ba
- 64.gydF4y2Ba
福尔曼J,德米奇克V,博思韦尔JH,米洛纳P,米德玛H,托雷斯MA,林斯特德P,科斯塔S,布朗利C,琼斯JD。NADPH氧化酶产生的活性氧调节植物细胞的生长。大自然。2003;422(6930):442。gydF4y2Ba
- 65.gydF4y2Ba
铃木N, Miller G,莫拉莱斯J, Shulaev, Torres MA, Mittler R.呼吸爆发氧化酶:ROS信号转导的引擎。植物学报。2011;14(6):691-9。gydF4y2Ba
- 66.gydF4y2Ba
李志强,李志强,李志强,等。光周期诱导植物生长停止过程的蛋白质组学分析gydF4y2Ba诉锐利gydF4y2BaMichx。葡萄藤。蛋白质组学学报,2010;8(1):44。gydF4y2Ba
- 67.gydF4y2Ba
泰勒AO。光周期对苍耳中苯丙烷衍生物生物合成的影响。植物物理学报。1965;40(2):273。gydF4y2Ba
- 68.gydF4y2Ba
marat C, Vandamme M, Gendraud M, Pétel G.桃营养芽的休眠:休眠及释放过程中芽中碳水化合物吸收电位与碳水化合物浓度的关系。科学通报。1999;39(3):344 - 344。gydF4y2Ba
- 69.gydF4y2Ba
理查德森AC,沃尔顿EF,米金斯JS,博尔丁HL。猕猴桃芽在开始休眠和从休眠中释放时碳水化合物的变化。科学通报。2010;124。gydF4y2Ba
- 70.gydF4y2Ba
Mohamed HB, Vadel AM, Geuns JM, Khemira H.氢氰酰胺处理后优质无籽葡萄扦插休眠释放期间碳水化合物的变化。科学通报。2012;140:19-25。gydF4y2Ba
- 71.gydF4y2Ba
Mohamed HB, Vadel AM, Geuns JM, Khemira H.休眠葡萄芽组织对低温响应的生化变化:可能在休眠释放中的作用。科学通报。2010;44(4):457 - 457。gydF4y2Ba
- 72.gydF4y2Ba
辛华,朱伟,王磊,向勇,方林,李娟,孙鑫,王宁,Londo JP,李生。葡萄和葡萄对冷胁迫响应的全基因组转录谱分析。公共科学学报,2013;8(3):e58740。gydF4y2Ba
- 73.gydF4y2Ba
Park MR, Wang YH, Hasenstein KH。芸苔属发芽根基因表达谱分析。植物分子生物学报告,2014;32:541-8。gydF4y2Ba
- 74.gydF4y2Ba
拟南芥中PHYA和PHYB基因的时空表达模式。植物学报,1995;7(3):413-27。gydF4y2Ba
- 75.gydF4y2Ba
刘丹SX,穆谦,吴卫民,张震,方景贵。葡萄不同分枝节点花蕾花基因表达水平分析。中国农业科学。2015;48(10):2007-16。gydF4y2Ba
- 76.gydF4y2Ba
Martín-Fontecha ES, Tarancon C, cuba P.生长或不生长,休眠芽诱导的节能程序。植物学报,2018;41:102-9。gydF4y2Ba
- 77.gydF4y2Ba
Anders S, Pyl PT, Huber W. htseq -一个用于处理高通量测序数据的Python框架。生物信息学,2015,31(2):166 - 9。gydF4y2Ba
- 78.gydF4y2Ba
Anders S, Huber W: RNA-Seq数据在基因水平的差异表达- DESeq包。海德堡gydF4y2Ba:gydF4y2Ba欧洲分子生物学实验室(EMBL) 2012。gydF4y2Ba
- 79.gydF4y2Ba
上官林,穆强,方旭,张凯,贾红,李霞,鲍艳,方娟。利用rna测序揭示藤森葡萄果实发育过程中的生物网络。公共科学学报,2017;12(1):e0170571。gydF4y2Ba
- 80.gydF4y2Ba
钟建刚,李志刚,李志刚,李志刚,李志刚。植物MetGenMAP:一种植物系统生物学综合分析系统。植物科学进展。2009;29(4):344 - 344。gydF4y2Ba
- 81.gydF4y2Ba
Thimm O, Bläsing O, Gibon Y, Nagel A, Meyer S, Krüger P, Selbig J, Müller LA, Rhee SY, Stitt M. MAPMAN:一个用户驱动的工具,将基因组学数据集显示在代谢途径和其他生物过程的图表上。植物学报,2004;37(6):914-39。gydF4y2Ba
- 82.gydF4y2Ba
Trapnell C, Williams BA, Pertea G, Mortazavi A, Kwan G, van Baren MJ, Salzberg SL, Wold BJ, Pachter L. RNA-Seq转录本组装和定量揭示了细胞分化过程中未注释的转录本和异型转换。生物技术学报。2010;28(5):511-5。gydF4y2Ba
- 83.gydF4y2Ba
Conesa A, Götz S, García-Gómez JM, Terol J, Talón M, Robles M. Blast2GO:功能基因组学研究中注释、可视化和分析的通用工具。生物信息学。2005;21(18):3674 - 6。gydF4y2Ba
- 84.gydF4y2Ba
Rozen S, Skaletsky H.在WWW上为一般用户和生物学家程序员提供的Primer3。在:生物信息学方法和协议gydF4y2Ba.gydF4y2Ba施普林格;2000.p . 365 - 86。gydF4y2Ba
- 85.gydF4y2Ba
Livak KJ, Schmittgen TD。相关基因表达数据的分析采用实时定量PCR和2gydF4y2Ba−ΔΔCTgydF4y2Ba方法。方法。2001;25(4):402 - 8。gydF4y2Ba
确认gydF4y2Ba
不适用。gydF4y2Ba
资金gydF4y2Ba
国家重点研发计划项目(2018YFD1000305)、江苏省自然科学基金项目(SBK2020020002)、国家自然科学基金项目(31772283)、江苏省博士后科研经费计划项目(2020Z052)、江苏省重点研发计划项目(BE2018389)资助。资助机构在研究设计、数据收集、分析和解释以及撰写手稿方面没有发挥任何作用。gydF4y2Ba
作者信息gydF4y2Ba
从属关系gydF4y2Ba
贡献gydF4y2Ba
构思设计实验:LFSG, JGF。分析数据:LFSG, XF, MXC, ZCW, ZQX。RT-qPCR: YXH。撰写论文:LFSG, MXC。修改论文:LFSG, JGF, PJG。所有的作者都参与了最终手稿的开发,并阅读并批准了它。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
伦理批准并同意参与gydF4y2Ba
不适用。gydF4y2Ba
发表同意书gydF4y2Ba
不适用。gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者声明,这项研究是在没有任何商业或财务关系的情况下进行的,这些关系可能被解释为潜在的利益冲突。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。gydF4y2Ba
补充信息gydF4y2Ba
附加文件1:图S1。gydF4y2Ba
组间比较的相关性。gydF4y2Ba图S2。gydF4y2Ba不同对的Mapman分析。(a) 3月与2月代谢情况概况(b) 2月与1月代谢情况概况(c) 1月与12月代谢情况概况(d) 12月与11月代谢情况概况。gydF4y2Ba
附加文件2:表S1。gydF4y2Ba
RNA-Seq数据信息。gydF4y2Ba表S2。gydF4y2Ba基因表达信息。gydF4y2Ba表S3。gydF4y2Ba各基因的FPKM值。gydF4y2Ba表S4。gydF4y2BaGO各对分析数据。gydF4y2Ba表S5。gydF4y2Ba各对KEGG分析数据。gydF4y2Ba表S6。gydF4y2BaMapman数据集。gydF4y2Ba表S7。gydF4y2Ba转录因子分析。gydF4y2Ba表S8。gydF4y2Ba所有新基因的基因组定位和序列长度信息。gydF4y2Ba表S9。gydF4y2Ba基因在不同节点的时空表达差异分析。gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.创作共用公共领域奉献弃权书(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)适用于本条所提供的资料,除非在资料的信用额度中另有说明。gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
上官,L,陈,M,方,X。gydF4y2Baet al。gydF4y2Ba比较转录组分析可深入了解葡萄的调控途径和时空表达特征(gydF4y2Ba葡萄gydF4y2Ba)在不同节上的休眠芽。gydF4y2BaBMC植物生物学gydF4y2Ba20.gydF4y2Ba390(2020)。https://doi.org/10.1186/s12870-020-02583-1gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12870-020-02583-1gydF4y2Ba
关键字gydF4y2Ba
- 小道消息gydF4y2Ba
- 芽休眠gydF4y2Ba
- RNA-seqgydF4y2Ba
- 时空表达gydF4y2Ba