抽象的
背景
番茄灰斑病苯磺酸苯磺酸镁(美国黄瓜)是严重阻碍番茄生产的病害。迄今为止,仅钐已有报道表明番茄对该病具有抗性,但番茄对该病抗性的分子机制尚不清楚。为了更好地了解番茄对烟草的抗性机理美国黄瓜在本研究中使用实时定量逆转录聚合酶链反应(QRT-PCR)的分析,生理指标,显微镜观察和转基因技术。
结果
我们的结果表明SlERF01型强烈诱导美国黄瓜以及外源施用水杨酸(SA)和茉莉酸(JA)。此外,过度的SlERF01型增强对药物的超敏反应美国黄瓜提高番茄防御基因的表达。此外,木质素、胼胝质和过氧化氢(H2O2)在转基因株系中增加S. lycopersici。综合起来,我们的结果显示SlERF01型在多个SA,JA和反应性氧气(ROS)信号传导途径中发挥了不可或缺的作用,以提供抵抗力美国黄瓜入侵。我们的发现也表明SlERF01型可以激活表达式PR1型基因与增强抗病性美国黄瓜.
结论
我们确定了这一点SlERF01型编码一个新的番茄AP2/ERF转录因子(TF)的基因。功能分析显示SlERF01型积极调节番茄抗性美国黄瓜. 我们的发现表明SlERF01型在多种SA、JA和ROS信号通路中发挥关键作用,以抵抗细胞的侵袭S. lycopersici。本研究的发现不仅有助于更好地理解番茄对病原菌的应答机制,而且为番茄抗病育种提供了针对性的策略美国黄瓜.
背景
在植物与病原菌的长期竞争关系中,植物形成了一系列抵御病原菌威胁的防御机制,包括细菌、病毒、真菌和昆虫等[1,2].已经建立了两种防御系统,PAMP触发的免疫(PTI)和效应触发的免疫(ETI),以防止致病侵犯[3.]. PTI和ETI的许多早期信号成分激活一系列下游综合防御反应,以防止进一步的损伤[4].事实上,PTI和ETI之间发生了实质性的防御反应重叠[5].
各种防御信号反应包括活性氧(ROS)爆发、胼胝质和木质素积累,并导致局部细胞和组织死亡[6,7],其被称为过敏反应(HR),在致病性侵袭的位置,以限制病原体生长[8,9,10].因此,HR与抗性基因(R基因) - 抗性抗性相关,导致局部细胞和组织死亡,具有相应的下游防御反应[11,12,13]. 过氧化氢(H2O2)可诱发HR[14],其与随后的木质素和胼累积,通过加强细胞壁来限制病原体的生长。
如果在感染部位诱导植物防御反应,则在其他植物组织中激活全身防御反应,以防止病原体进一步侵袭。系统获得的电阻(SAR)的特点是持久,广谱效果[15];这些效果可以通过PTI和ETI介导的病原体识别引发,并且与局部细胞和距离组织中的水杨酸(SA)的水平有关。以前的研究表明,防御激素SA通过调节蛋白诱导SAR相关基因表达在SAR信号通路中起重要作用NPR1.和转录辅激活子[16].
灰色叶斑病,是由苯磺酸苯磺酸镁并且是辣椒,棉,菠菜和茄子等植物物种的破坏性真菌疾病被认为是全球培养番茄果实产量和质量的主要因素[17].然而,目前尚无有效的方法来控制这种疾病。因此,培育抗病品种是防治灰斑病最有效的策略。只有不完全显性基因钐提供强烈的抵抗力美国黄瓜[18].目前迫切需要其他疾病R基因的鉴定和进一步应用。此外,还探讨了番茄抗氧化的机理美国黄瓜人们对这一点仍知之甚少。因此,确定钐-介导的抗药性反应美国黄瓜而抗病番茄品种的选育迫切需要其它R基因。
AP2 / ERF样转录因子(TFS)已被证明在疾病抵抗力中发挥着重要作用[19].迄今为止,在番茄基因组中共鉴定了137个含有ERF结构域的蛋白,其中大多数涉及对生物和非生物胁迫或激素的响应;然而,这些蛋白质中只有少数已被鉴定[20]. 有证据表明,ERF蛋白诱导了与发病相关基因的表达(PR.)与GCC盒相互作用的基因对病原体的反应[21].在番茄中,PTI4-6和LEERF1与GCC盒交互并调节表达式PR.基因[22].此外,ERF1通过病原体,乙烯(ET)和茉莉酸(JA)进行转型调节,并通过ET和JA协同诱导。众所周知,SA信号转导途径可以用ET / JA途径拮抗作用。有趣的是,PTI4和ATERF1的表达由SA和JA和ET诱导[23,24]. 这些结果表明,Pti4、Pti5和Pti6间接调控SA应答,Pti4/5/6在拟南芥中的表达增强了SA调控基因的表达水平PR1型和PR2型基因[11].
在这项研究中,为了更好地了解抵抗力的机制美国黄瓜在番茄中,一个新的番茄AP2 / ERF TF,SlERF01型,被识别出来。我们的数据显示SlERF01型直接或间接参与辩护响应美国黄瓜在番茄通过多个信令调节网络。这项研究不仅揭示了初步函数SlERF01型同时也为培育抗病番茄品种提供了新的R基因资源。
结果
基因克隆及系统发育分析SlERF01型
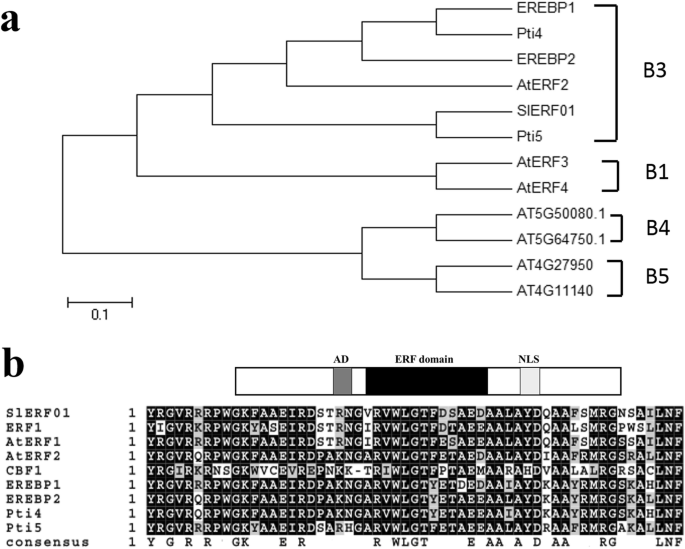
全长CDSlERF01型用从番茄中提取的cDNA进行PCR克隆(所用的PCR引物列于表S中)1).CDSSlERF01型编码一个240个氨基酸的蛋白质,具有一个AP2/ERF结构域,属于ERF-tfb-3家族(图。1一种)。保守蛋白质序列数据库的分析显示,只有ERF领域之间只能保守SlERF01型以及其他ERF蛋白(图。1b) 是的。进一步分析表明SlERF01型与其他ERF蛋白在整个假定蛋白序列上的相似性较低;然而,序列比对显示ERF区域具有高度的同源性。因此,系统发育分析结果表明SlERF01型可能编码一种新的ERF蛋白,参与抗病反应。
系统发育树及序列比对SlERF01型.一个植物系统发育树SlERF01型和其他ERF蛋白;通过Clustalw与AP2 / ERF结构域的氨基酸序列结合构建系统发育树。ERF蛋白的亚颗粒由虚线除以。Sakuma等人描述了分类。(2002)。b对齐SlERF01型用其他ERF蛋白质。SlERF01型由ERF域,推定的NLS和推定广告组成,如图2所示。1B黑色和浅灰色分别代表相同和保守的氨基酸,深色代表相同氨基酸的较大百分比
细胞的亚细胞定位SlERF01型
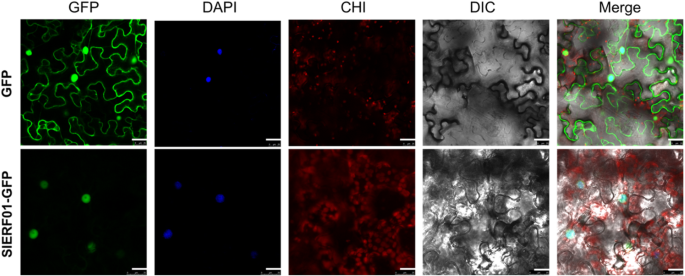
一个SlERF01型-开发了GFP融合构建体。的SlERF01型●GFP融合结构随后转化为A.肿瘤学家GV3101株,以空GFP载体作为阴性对照。N. Benthamiana.然后感染叶子。结果表明SlERF01型局限于细胞核(图。2).
SlERF01型提高抗病能力美国黄瓜在西红柿里
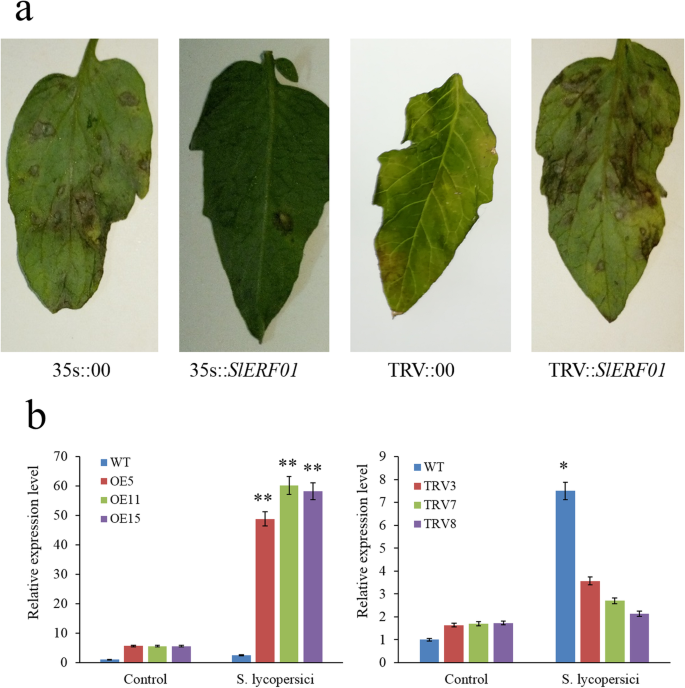
确定SlERF01型番茄抗性美国黄瓜,过表达和TRV介导的VIGS载体被构建用于进一步分析。三SlERF01 -最终产生表达量最高的番茄系(5、11和15)和表达量最低的3个TRV系(3、7和8)供进一步分析(图。3.).过度的SlERF01型导致3 dpi的典型HR型表型美国黄瓜,转基因SIERF01过表达(OE)植物的易感性症状明显不如易感植物那样严重。与用空对照载体(35秒:00)转化的植物相比,转基因系表现出增强的抗性美国黄瓜感染.
过度的SlERF01型提高番茄的抗病性。一个野生植物的疾病症状,SlERF01型-过表达转基因植物和沉默植物接种美国黄瓜. 转基因(35 学生::SlERF01型)植物表现出高度抗性表型,并且沉默(TRV::SlERF01型)植物表现出严重的病害症状。用空向量转换的MT植株(35 s::00);经沉默载体转化的MO抗性植株(TRV::00)。b表达水平SlERF01型在野生型植物中,OE植物和Vigs植物。通过QRT-PCR分析三个OE线(OE5,OE11和OE15)和三种Vigs(TRV3,TRV7和TRV8)。每个样品包括三种生物学重复。星号表示转基因系和控制线之间表达水平的显着差异(**,P < 0.01; *,P< 0.05,学生t检验)
此外,人力资源较弱,较慢SlERF01型-沉默(TRV)的植株比用空控制载体(TRV::00)转化的植株要多。观察到典型病变SlERF01型- 在3 dpi的植物,在TRV :: 00植物的叶子上没有观察到明显的敏感症状(图。3.a)感病植株叶片上有明显的坏死病变和中心穿孔症状。这些结果表明SlERF01型提高了番茄的抗病性美国黄瓜.
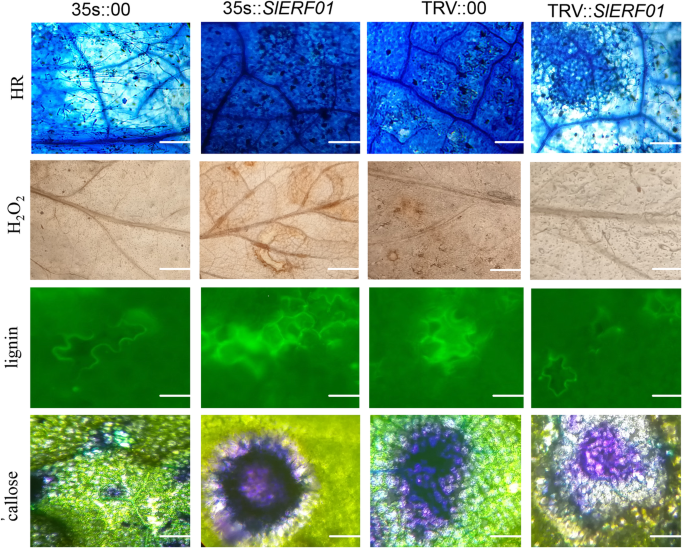
通过检测HR相关细胞死亡和H2O2,通过用耳蛋白蓝,DAB,TB和AB染色来染色,木质素和调用(图。4). 对于台盼蓝染色,3 dpi处的强HR美国黄瓜在SlERF01型-overexpressing (35 s::SlERF01型)植物。相反,在空载体中未观察到可见HR(35 s::00)3 dpi的植物;菌丝逐渐生长,病变加重,透明。与OE植物的叶片相比SlERF01型- 植物对植物敏感美国黄瓜感染。与感染病毒的TRV::00株相比,TRV::SlERF01株的HR受损美国黄瓜3 dpi时;菌丝扩散,病变加重并穿孔。然而,在TRV::00植株的叶片上观察到强烈的HR。综合起来,这些结果表明SlERF01型可以激发番茄叶片中的HR。
另外,h2O2在35个品种的叶片中观察到了产量 学生::SlERF01型用DAB染色法测定番茄植株(图。4).在3 dpi,与TRV :: 00植物中的比较,H2O2TRV ::积累SlERF01型植物太弱,无法察觉。H2O2TRV::00植株的积累早于TRV::SlERF01植株。相比之下,H2O2累积发生在OE植物中早先,比35 S :: 00植物更强。这些结果表明SlERF01型可以诱导H2O2作为国防部对美国黄瓜感染。为了进一步探讨潜在的机制,在35秒::中分析了木质素和调用生产SlERF01型OE工厂,TRV::SlERF01型植物与空载体(35 s::00和TRV::00)3 dpi的电厂。35个品种叶片木质素和胼胝质的积累 学生::SlERF01型OE植物大于3dpi的35s :: 00空载体植物的叶子中的植物(图。4). 然而,TRV叶片的荧光强度和面积:SlERF01型-Silenced植物比TRV :: 00植物叶片中的植物弱。在上述所有结果的基础上,我们得出结论SlERF01型过量表达提高番茄对烟草的抗性美国黄瓜与对照植物相比。
沉默的SlERF01型减少与抗辩相关基因的表达水平PR1型感染后美国黄瓜
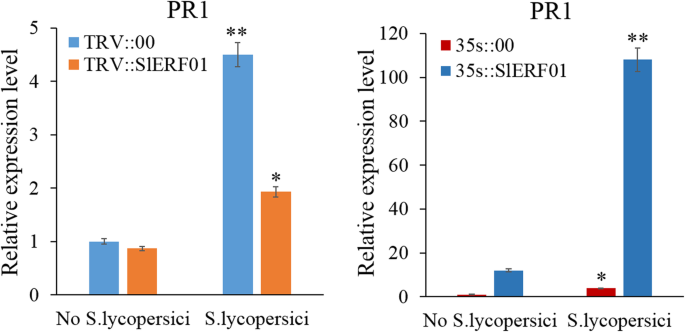
在之前的转录组测序实验中,我们发现了差异表达基因的表达水平SlERF01型和PR1型在“植物激素信号转导”途径中显著上调[25].在本研究中,QRT-PCR用于识别之间的调节关系SlERF01型和PR.在植物激素信号转导途径中。如图。7, 一次SlERF01型沉默,表达水平PR1型与TRV::00植株相比,明显受到抑制。此外,与35 s::00植株相比,表达水平较低PR1型基因在35 S ::中显着上调SlERF01型OE植物(图。7).因此,我们提出SlERF01型增强疾病抵抗力美国黄瓜通过调节番茄中PR1基因的表达。
SlERF01型可能需要SA和JA信号通路来增强番茄的抗病性
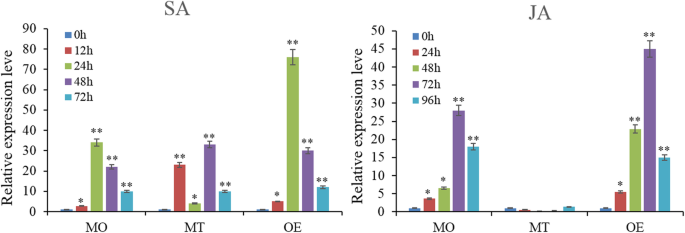
以上结果表明SlERF01型可以提高抗病能力美国黄瓜在番茄中。此外,我们以前的研究表明SlERF01型参与显著丰富的京都基因和基因组百科全书(KEGG)途径“植物激素信号转导”。采用qRT-PCR方法检测其转录水平SlERF01型与SA-和ja诱导的抗性有关SlERF01型感染。与对照(喷水)相比,0.2 mM外源SA在转录水平上分别增加了约34倍(在抗钼植物中)和76倍(在OE转基因植物中)。5). 经SA处理后,其表达明显增强SlERF01型显着上调并在24小时达到尖峰;响应于Mo耐药植物和OE转基因植物中的SA诱导而显示该基因表达模式。在MT控制材料中,表达SlERF01型在用SA治疗后12小时和48小时上调,24小时迅速下降,表现出不规则的变化。因此,在MT控制材料中,表达SlERF01型在不同的时间点上调,但响应SA诱导没有表现出相同的模式。
同样,与JA的治疗也显着增强了表达SlERF01型,其峰值表达量分别是对照植株的28倍(MO抗性植株)和45倍(OE转基因植株)。这些结果表明SlERF01型可以通过SA和JA治疗显着上调。在莫耐药中,表达SlERF01型响应JA归纳而上调。但是,表达了SlERF01型在MT的不同时间点没有明显上调,并且对JA诱导没有反应。
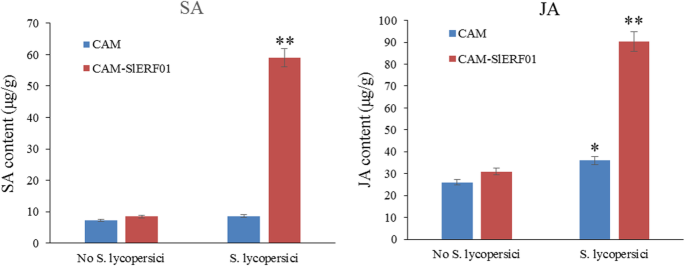
众所周知,SA和JA在对病原体的植物防御反应中起重要作用。分析激素响应美国黄瓜感染后,采用液相色谱-质谱法(LC-MS)测定T1代细胞中JA和SA的含量SlERF01型-overexpressing植物。t1代的SA和JA水平SlERF01型-高表达的番茄植株明显高于对照植株美国黄瓜(图。6). 接种后,小鼠体内SA水平升高SlERF01型-overexpressing植物比空载体植物中的那些大5倍,并且Ja水平大约比空载体植物中的3倍(图。6). 因此,过度表达SlERF01型能显著提高SA和JA的产量,再次表明SlERF01型可能同时参与SA和JA信号通路,提高番茄的抗病性美国黄瓜.
讨论
SlERF01型是一个新的番茄AP2 / ERF TF,它在核中局部地定位
迄今为止,在番茄基因组中鉴定了约137个编码具有保守AP2 / ERF结构域的蛋白质的基因,AP2 / ERF蛋白在各种非生物和生物应激反应的转录调节中起重要作用。以前的研究表明,A-亚组TFS参与了非生物应激反应的调节。然而,几乎所有AP2基因的B子组在生物应激反应中具有重要的功能。此外,已经鉴定了越来越多的B-亚家族基因是参与细菌,真菌和病毒疾病的抗性[26].
在本研究中,SlERF01型从番茄中分离得到一种新的表达载体美国黄瓜治疗。此外,系统发育分析显示SlERF01型属于ERF蛋白的B-3亚家族,已经显示出几种B-3亚家族成员调节植物疾病抗性[27]. 大肠杆菌保守蛋白序列分析SlERF01型与ERF1的相似性较低;然而,ERF结构域区域的序列同源性非常高(图。1b) 是的。我们的结果显示SlERF01型可能编码一种新的ERF蛋白,参与抗病反应。亚细胞定位分析表明SlERF01型是一种核定位蛋白,这与以往许多ERF蛋白的研究结果一致。
SlERF01型提高番茄的抗病性美国黄瓜
众所周知,ERFs的过度表达可以增强植物对真菌、细菌和病毒的抗病性。以往的研究表明,AaERF1的过表达可以正调控细胞凋亡青蒿抵抗灰葡萄孢[28]. 此外,研究表明,表达烟草OPBP1基因的水稻植株表现出更强的抗病性Magnaporthe Grisea.和茄丝核菌[29].
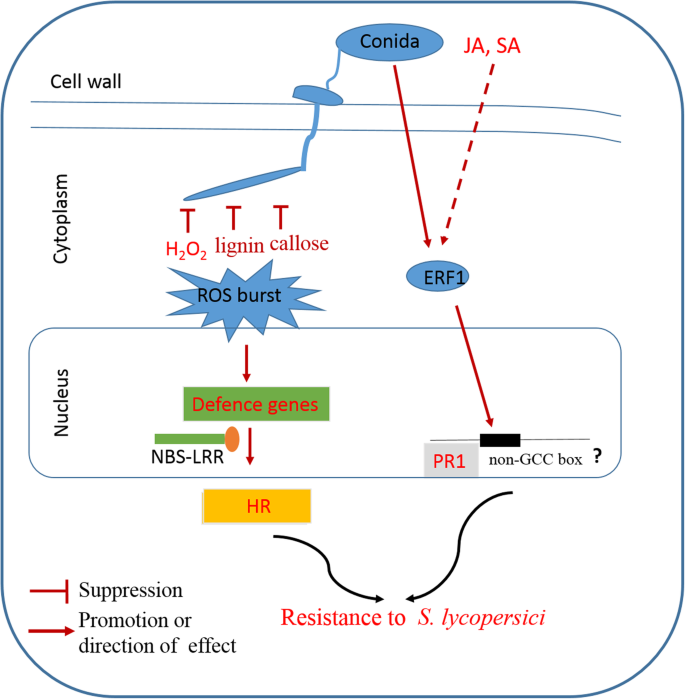
我们目前的研究结果表明SlERF01型能显著增强抗性吗美国黄瓜与对照植物相比的感染.观察到典型病变SlERF01型-Silenced植物,在TRV :: 00植物上没有观察到明显的敏感性症状。此外,研究表明HR和H的积累2O2,木质素和胼callose在耐敏感品种方面都是强大的,导致抗病性改善[30,31]. 与之前的研究一致,我们的研究表明SlERF01型不仅导致hr诱导的细胞死亡,而且增加了H的积累2O2转基因番茄植株与对照植株的木质素和胼胝质含量比较。这些结果表明SlERF01型也可能参与抵抗美国黄瓜通过ROS信号(图。8).
SlERF01型积极调节PR1型并提高番茄的抗病性
一些ERF-TFs,如OsERF1、Pti4和AtERF1,最近被认为在抗病反应中起作用。正如引言中所讨论的,ERFs在植物中的过度表达可以通过调节PR.基因表达 [32].规定PR.ERF转录因子通过结合GCC盒子或基因启动子区域中的DRE/CRT顺式作用元件来表达基因已被广泛研究[33,34,35]. 此外,研究表明GCC盒两侧的序列影响结合效率,提示多个erf可能调控不同的基因集[36]. 因此,ERFs可以直接或间接调控PR基因的表达,增强植物的抗病性。在这里,我们还发现SlERF01型基因上调了表达PR1型基因并增强了番茄抗性S. lycopersici。
SlERF01型可能需要SA和JA信号通路来增强番茄的抗病性
在以前的转录组测序实验中,我们发现SlERF01型表达由美国黄瓜在抗病材料和感病材料中都有表达,并且在接种疫苗后在抗病材料中高度上调美国黄瓜[25]. 此外,SA和JA是重要的信号分子,参与了植物对生物和非生物胁迫的抗病反应[37,38].我们的结果表明SlERF01型外源SA在MO抗性植物和OE转基因植物中均有诱导作用,表明SlERF01型可能是SA信号通路的反应成分。前人的研究也表明外源性应用水杨酸可以诱导细胞表达水杨酸PR.增强对多种病原体的抵抗力[39]. 我们的数据与以前的研究结果一致,即ERF1通过激活下游基因的表达对ET和SA产生反应PR.基因[19].但是,表达了SlERF01型表现出不规则的模式,并在24小时在MT敏感植物下调 SA治疗后h,表明SlERF01型抗性植株和感病植株表现出明显的表达特征。SlERF01型可能通过各种信号通路的协同作用参与对病原体攻击的串扰反应。这些结果与实验结果一致AhRRS5型抗性和易感花生品种之间的不同[40]. 此外,SA和JA/(ET)信号通路在抗病反应中被认为是拮抗或协同的[41,42,43].以前的研究表明,OSERF1将SA和JA信号通路集成在防御响应中对抗病原体[44]. 我们的结果一致表明SlERF01型外源JA也能诱导SlERF01型可能在介导SA和JA信号通路之间的通讯中起作用。以往的研究表明,ROS和SA通路具有平行的功能,以确保SAR的最佳诱导[45].结合上述研究的结果,我们的结果表明SlERF01型不仅对SA和JA有反应,而且增加了H的积累2O2,木质素和转基因番茄植物的胼call。在这里,我们建议SlERF01型在SA、JA和ROS之间的串扰中起着关键作用,提供了对美国黄瓜入侵(无花果。8).
结论
在这项研究中,我们确定SlERF01型作为番茄中的新型基因,编码定位于核的AP2 / ERF TF。过表达和基因沉默数据的分析显示SlERF01型积极调节番茄抗性美国黄瓜. 有趣的是,SlERF01型在多种SA、JA和ROS信号通路中发挥关键作用,以抵抗细胞的侵袭S. lycopersici。初步功能分析表明SlERF01型通过上调PR1基因的表达来诱导抗病。本研究为今后番茄品种抗病分子机制和育种策略的研究提供了有价值的资源。
方法
植物材料和美国黄瓜接种
抗性品种Motelle(MO)的番茄植株由中国农业科学院提供。转基因株系MT和MT的幼苗烟草从我们的实验室获得。随后在25-28℃和60%相对湿度下在14h / 10h光/暗光周期下在温室中生长番茄和烟草植物。
美国黄瓜从番茄植株中分离,并在培养皿中于25–28℃接种于马铃薯葡萄糖琼脂(PDA)上 °C持续10分钟 12岁以下天数 12小时 h光周期。随后,用分生孢子悬浮液(1)接种4周龄的MO、Moneymaker和MT番茄幼苗 × 104分生孢子mL− 1.),而对照植物则喷洒杀菌水。在相对湿度为> 80%的温室(25-28°C)中种植。接种后评价疾病指标,接种0 d和3 d采收叶片(dpi)进行进一步分析。
基因克隆与生物信息学分析
利用PCR克隆试剂盒进行同源重组,克隆5’-和3’-端cDNA序列。利用Primer 6.0软件对目的序列设计特异性引物,并对目的基因进行扩增SlERF01型通过按照以下反应方案实施的PCR克隆:94℃持续3分钟;35循环为94℃,30s,60℃,45 s,72°C为30 s Kb− 1.; 和72 °C持续10分钟 构建部分CAM-SLERF01载体,用于阳性克隆的鉴定。研究中使用的所有引物如表S所示1.
的SlERF01型通过检查NCBI保守域数据库(CDD)检查序列(https://www.ncbi.nlm.nih.gov/structure/cdd/wrpsb.cgi.)并用dnaman5.0对鉴定的序列进行分析(数据S2)。利用MEGA 5.2构建了番茄AP2/ERF家族蛋白的系统发育树。
亚细胞定位
全长SLERF01型通过PCR与高保真聚合酶一起扩增没有终止密码子的开放阅读框(ORF)与引物GFP -SLERF01型-F和GFP-SLERF01型-R。PCAM35 ::SlERF01型-GFP融合构建体通过将PCR产物插入其KPNI和XBAI位点之间的PCAM35 :: GFP载体中来制备。PCAM35 :: GFP(控制)和PCAM35 ::SLERF01型-GFP载体随后转化成根癌农杆菌gv3101。选择单克隆,然后在含有相应抗生素的Luria-Bertani(LB)液体培养基中培养。转变农杆菌通过离心浓缩细胞,然后收获它们,稀释至OD6000.4,并注射到N. Benthamiana.通过注射器离开。农业渗透后第2天,用激光扫描共聚焦显微镜(FV10-ASW,Olympus)对绿色荧光蛋白(GFPs)进行成像。
番茄的转变
全长编码DNA序列(CDS)SlERF01型经PCR扩增并克隆到含有XhoI和XbaI位点的部分CAM载体中。一个pCAM-SLERF01型构建过度表达载体,以及PCAM-SlERF01型将重组质粒和pCAM质粒转入大肠杆菌中A.肿瘤学家菌株GV3101 (BioVector NTCC Inc., Beijing, China)。pCAM -SlERF01型通过番茄遗传转化技术,将过表达载体和空载体转入感病品种MT中[46].在Mr(Murashige和Skoog(MS)介质补充有0.2毫克L的Mr(Murashige and Skoog(MS)培养基上使用十天番茄幼苗并预制2天− 1.Zeatin和1.0 mg l− 1.吲哚乙酸(IAA),pH 5.8)媒体。
一个殖民地A.肿瘤学家选自液体介质,其补充有相应的抗生素。然后收集细菌细胞,之后将番茄子叶浸入细菌悬浮液中3-5分钟并与合作共同化2天。将感染的子叶转移到合适的培养基中并使其生长2周,并且每3周转移外植体。在适应依赖后,将具有良好良好的根的小植物移植到土壤中。
两个不同的A.肿瘤学家菌株用于病毒诱导的基因沉默(VIGS)。一个携带TRV1,它编码复制和运动所需的病毒蛋白,而另一个TRV2则携带用于VIGS的外壳蛋白和序列[47]. 目标序列SlERF01型通过PCR与特定引物扩增。用EcoRI和BamHI消化后,将TRV载体连接到PCR产物中。TRV ::SlERF01型,TRV :: 00和TRV ::PDS.在含有50mg mL的LB培养基中构建并繁殖载体− 1.卡那霉素。然后将重组质粒转入大肠杆菌A.肿瘤学家菌株GV3101,之后将转化的细胞在诱导培养基中培养(10mM 2-(N-MOLPHOLINO)乙磺酸(MES),10mM MgCl2, 2.50 μg mL− 1.卡那霉素,100 μg mL− 1.利福平和200μm丙酮霉菌酮)到OD6000.3。LST,TRV1和TRV2以1:1的体积比混合在一起,并孵育3小时;然后通过含有约0.5-1ml的1mL注射器用每种混合物用每种混合物渗透3-4叶阶段的Mo植物农杆菌细胞培养溶液。在指定的时间点进行对处理的植物进行进一步分析,测试中包含3个生物重复。
实时定量逆转录聚合酶链反应(qRT-PCR)分析及生理指标测定
通过QRT-PCR进行过表达和Vigs植物的表达分析。通过Trizol试剂从番茄叶中提取总RNA [48].根据制造商的指示,通过逆转录试剂盒(Takara)合成cDNA。QRT-PCR系统由10μl2×转型顶部绿色QPCR超混(Transgen,China),0.5μl前进/反向引物,以及2μlDNA模板和DDH2o被添加以使总体积为20μl。QRT-PCR程序如下:95℃持续10分钟,其次是95℃的40个循环5s,62℃,15s和72℃。2——∆∆CT方法[49随后用于分析QRT-PCR数据,用EF1α作为内参基因[50].使用的QRT-PCR引物列于表S中1.
对于外源激素处理,将0.2mM SA和0.4mm的JA溶液喷洒到番茄植物上(用水喷洒水溶液)(SA:0,12,24,48和72小时; JA:0,24,48,72和96 h)。通过高效液相色谱(HPLC)测量内源SA和JA激素的水平。根据LLUGANY等人描述的修饰方法从叶子中提取SA和JA。[51],之后通过AB Sciex Qtrap 5500仪器(美国)根据制造商的指示测量它们的浓度。从三种单独的植物中收集样品,用于分析SA含量,JA含量和基因表达。根据学生的T-Tests,三个独立实验的数据进行了统计分析,P < 0.05被认为具有统计学意义。
显微镜观察
台盼蓝染色[52]采用3,3-二氨基联苯胺(DAB)染色、甲苯胺蓝(TB)染色和苯胺蓝(AB)染色观察肿瘤进展美国黄瓜感染与H2O2,木质素和胼calloseSlERF01型-过度表达和SlERF01型-VIGS植物。接种后0 d和3 d采集叶片。
TB染色观察细胞死亡,在Farmer's溶液(95%乙醇:氯仿:醋酸,体积比为6:3:1)中脱色3小时 h,在0.1%台盼蓝溶液中65℃煮沸 2°C h、 然后转移到饱和水合氯醛溶液中4分钟 H最后在光学显微镜下观察这些叶子。
生产的生产2O2DAB染色检测[53].将感染的番茄叶在0.1%DAB溶液中在黑暗中在0.1%DAB溶液中温育12小时,然后在96%乙醇溶液中煮沸10分钟。在光学显微镜下最终观察到叶子。通过使用Tb染色方法观察木质素[54].将感染的番茄叶片置于甲醛:乙酸:乙醇(FAA)溶液中24 h,然后用0.05% TB溶液染色。随后在光学显微镜下观察这些叶子。用AB染色法检测胼胝质[55].将受感染的番茄叶置于FAA溶液中,用100%乙醇溶液清除,然后用0.07 m k染色2HPO4在0.01%AB溶液中放置24小时 H最后在荧光显微镜下观察叶片。从三株植物中采集叶片样品进行HR,H2O2木质素和胼胝质的积累。
数据和材料的可用性
缩写
- 美国黄瓜:
-
苯磺酸苯磺酸镁
- PTI公司:
-
PAMP触发的免疫力
- ETI公司:
-
效应器触发免疫
- 活性氧:
-
活性氧物种
- 人力资源:
-
过敏反应
- 合成孔径雷达:
-
系统获得性抗性
- PR1:
-
致病相关蛋白1样
- R基因:
-
耐药基因
- 存在:
-
实时定量逆转录 - 聚合酶链反应
- 伟大的人:
-
病毒诱导基因沉默
- 山:
-
水杨酸
- JA:
-
茉莉酸
参考文献
- 1.
Henry E, Yadeta KA, Coaker G,等。植物细菌性病原体的识别:局部免疫、系统免疫和跨代免疫。新植醇。2013;199(4):908 - 15所示。
- 2.
Jones JDG,Dangl JL。植物免疫系统。自然。2006;444(7117):323–9.
- 3.
Thomma BPHJ,Nurnberger T,Jooosten Mhaj。PAMP和效果:模糊的PTI-ETI二分法。植物细胞。2011; 23(1):4-15。
- 4.
程翔,田春娟,李安,等。植物-病原体相互作用的分子机制研究进展。Hereditas。2012;34(2):134 - 44。
- 5.
Tsuda K,Sato M,Glazebrook J等。MAMP触发和SA介导防御反应之间的相互作用。植物J。2008;53:763–75.
- 6.
Zvereva AS,Pooggin嗯。植物抵抗病毒和非病毒病原体的沉默和天然免疫。病毒。2012;4(11):2578–97.
- 7.
Torres MA, Jones JD, Dangl JL。活性氧信号对病原体的响应。植物杂志。2006;141(2):373 - 8。
- 8。
Vleeshouwers VG,van Dooijewert W,Govers F,Kamoun S,Colon LT.超敏反应与宿主和非宿主对晚疫霉的抗性有关。足底。2000;210(6):853–64.
- 9。
敏锐的神经。植物-病原相互作用中的基因间互补。Genet年鉴。1990;24(1):447–63.
- 10。
张杰,卢慧,李鑫,等。效应触发和病原体相关分子模式触发免疫不同程度地促进了对丁香假单胞菌的基础抗性。植物与微生物的相互作用。2010;23(7):940-8。
- 11
Baker B,Zambryski P,Staskawicz B,Dinesh Kumar SP.植物-微生物相互作用中的信号传导。科学。1997;276(5313):726–33.
- 12
de wit pjgm。病原体无毒性与植物抵抗:识别的关键作用。趋势植物SCI。1997年; 2(12):452-8。
- 13
王立光,李华,小艾克,等。乙烯生物合成与信号网络。植物细胞。2002;14(补充):131–51。
- 14
李曼S,Serrano ML,Haridon F,等。活性氧与植物对真菌病原的抗性。植物化学。2015;112:54–62.
- 15
Durrant我们,Dong X.全身获得的阻力。Annu Rev phytopathol。2004; 42:185-209。
- 16
傅ZQ,东X.全身获得性阻力:将局部感染转变为全球防御。Annu Rev植物Biol。2013; 64(1):839-63。
- 17
西蒙斯,例如。完美的酸铵IV状态。Harv Pap Bot。2001; 61(1):199-208。
- 18
王俊峰,陆顺丰,等。番茄抗病基因的常规和分子标记辅助选择与聚合。Sci Hortic。2016;201:346-54。
- 19。
等。乙烯信号转导中的核事件:由乙烯- insensitive3和乙烯- response - factor1介导的转录级联反应。基因Dev。1998;12(23):3703 - 14。
- 20。
OHTA M,Matsui K,Hiratsu K,等。II级ERF转录压缩机的镇压域共享一个主要镇压的重要主题。植物细胞。2001; 13(8):1959-68。
- 21。
Gu YQ, Wildermuth MC, Chakravarthy S等。番茄转录因子pti4、pti5和pti6在拟南芥中表达后可激活防御反应。植物细胞。2002;14:817-31。
- 22。
Tournier B,Sanchez-Ballesta MT,Jones B等。番茄ERF家族的新成员表现出特异的表达模式和不同的DNA与GCC盒元件的结合能力。费布斯莱特。2003;550:149–54.
- 23
顾永强,杨超,Thara VK,等。Pti4由乙烯和水杨酸诱导,其产物被Pto激酶磷酸化。植物细胞。2000;12:771 - 86。
- 24
onate-sanchez l,singh kb。鉴定病原体感染后明显诱导动力学的拟南芥乙烯响应元件结合因子。植物理性。2002; 128:1313-22。
- 25
杨豪,赵tt,姜jb等。SM介导的SM介导的过敏反应的转录组分析。前植物SCI。2017; 8:1257-71。
- 26
Nakano T,Suzuki K,Fujimura T等。拟南芥和水稻ERF基因家族的全基因组分析。植物生理学。2006;140(2):411–32.
- 27
Gutterson n,Reuber TL。AP2 / ERF转录因子调节抗病途径。CurrOp植物BIOL。2004; 7(4):465-71。
- 28
杨基、刘勇、张S。丝裂原活化蛋白激酶途径的激活与烟草抗病性有关。国家科学院学报。2001;98(2):741–6.
- 29
番茄MAPKKKε是与植物免疫相关的细胞死亡信号网络的正调节器。植物j . 2010; 64(3): 379 - 91。
- 30
Romero D, Eugenia Rivera M, Cazorla FM等。甜瓜-白粉病亲和非亲和互作中氧化破裂和细胞壁强化的组织化学比较分析。植物生理学杂志。2008;
- 31
陈勇,张松,康智,等。甜菜坏死黄脉病毒与甜菜植株互作中过氧化氢的积累与分配。作物学报,2012;38(5):865-70。
- 32
陈国华,李国华,等。植物激素串扰对植物抗性和适应性的影响。前植物科学。2015;6:639–52.
- 33。
Sakuma Y、Liu Q、Dubouzet JG、Yamaguchi Shinozaki K。拟南芥DREBs的ERF/AP2结构域的DNA结合特异性,参与脱水和冷诱导基因表达的转录因子。生物化学Biophys Res Common。2002;290(3):998–1009.
- 34。
Lorenzo O,Piqueras R,Jose J等人。乙烯响应因子1与植物防御中的乙烯和茉莉酸盐途径的信号集成在植物防御中。植物细胞。2003; 15:165-78。
- 35
Zuo KJ,秦吉,赵Jy等。烟草中的过度表达Gberf2转录因子通过激活下游基因的表达来增强褐斑抗病性。基因。2007; 391(1-2):80-90。
- 36
Romero I,Vazquez-Hernandez M,Escribano Mi等。五种ERF基因在串血管血管基的表达谱和DNA结合亲和力。在低温下用高水平的CO 2处理了红衣主教。前植物SCI。2016; 7:370-83。
- 37
Divi UK、Rahman T、Krishna P。油菜素类固醇介导的拟南芥胁迫耐性与脱落酸、乙烯和水杨酸途径相互作用。BMC植物生物学。2010;10(1):151–65.
- 38
关键词:ABA,抗病性,抗病性,抗病性植物科学与技术,2009;
- 39
Bari R,Jones JDG。植物激素在植物防御反应中的作用。植物mol biol。2009; 69(4):473-88。
- 40。
张超,陈浩,蔡涛,等。花生NBS-LRR基因AhRRS5的过表达增强了烟草对青枯菌的抗性。植物生物技术2016;15:39-55。
- 41
Van Loon LC,Rep M,Pieterse CMJ。诱导型防御相关蛋白在感染植物中的意义。Annu Rev phytopathol。2006; 44(1):135-62。
- 42
Beckers GJM,Spoel SH.微调植物防御信号:水杨酸盐与茉莉酸盐。植物生物学。2006;8(1):1–10.
- 43
Mur-LAJ,Kenton P,Atzorn R,等。水杨酸盐和茉莉酸盐信号之间的浓度特异性相互作用的结果包括协同作用、拮抗作用和导致细胞死亡的氧化应激。植物生理学。2006;140(1):249–62.
- 44
Nahar K,Kyndt T,Nzogela YB等。脱落酸与水稻迁移线虫相互作用中的古典防御途径相互作用。新植物。2012; 196:901-13。
- 45。
王C,El-Shetehy M,Shine MB,等人。自由基介导全系统获得的阻力。细胞批准。2014; 7(2):348-55。
- 46。
欧阳B。陈,等。渗透素和几丁质酶基因转化番茄及其对枯萎病的抗性。霍尔特科学生物技术杂志。2005;80:517–22.
- 47
AndréC.Velásquez,Chakravarthy S,Martin GB。病毒诱导的基因沉默(Vigs)在Nicotiana Benthamiana和番茄中。j Vis exp。2009; 28(28):1-4。
- 48
吴T,秦ZW,周XY等。黄瓜中花卉施氮测定的转录组剖面分析。J植物理性。2010; 167(11):905-13。
- 49
Livak KJ,Schmittgen TD。使用实时定量PCR和2-的相对基因表达数据分析△△CT方法。方法。2001; 25:402-8。
- 50。
Rotenberg D,Thompson Ts,德国TL等。病毒诱导基因沉默的有效实时RT-PCR分析的方法。J Virol方法。2006; 138(1-2):49-59。
- 51。
Llugany M,Martin SR,BarcelóJ,et al.暴露于真菌感染和/或机械应激的镉超积累植物Noccaea(Thlaspi)praecox中的内源性茉莉酸和水杨酸水平。植物细胞代表2013;32:1243–9.
- 52。
王X,El Hadrami A,Adam LR,等。代表US-1和US-8基因型的马铃薯晚疫病菌菌株对马铃薯防御反应的差异激活和抑制。植物病理学。2008;57(6):1026–37.
- 53
Thordal-Christensen H,张Z,Wei Y等。h的亚细胞定位2O2在植物中。H2O2大麦粉末霉菌相互作用期间乳头基和过敏反应的积累。工厂J. 1997; 11:1187-94。
- 54
O'Brian TP,Feder N,McCully我。甲苯胺蓝对植物细胞壁的多色染色。原生质体。1964;59:368–73.
- 55
希思麦克。光线和电子显微镜研究宿主和非宿主植物的相互作用与豇豆生锈尿道的不同植物。豇豆。物理植物差。1974; 4:403-14。
致谢
我们承认静福李教授为修改稿件进行修改的努力。我们还感谢君明李(中国农业科学院),他提供了番茄品种(耐腐败的MO和易感品种的货币制造者)。
资金
这项工作是支持的“青年才俊”项目东北农业大学(18 qc08)的设计研究和收集,国家重点研发计划13日五年计划(2016 yfd01703)解释的数据,中国的国家重点研发项目(2017 yfd0101900)实验试剂,和中国农业研究系统(CARS-23-A-16)进行语言编辑。
作者信息
隶属关系
贡献
JL和XX构思并设计了实验。FS和HW进行RNA提取和表达模式分析。HZ和TZ准备了植物材料并进行了人工接种。JJ进行了JA和SA的测定。HY进行了番茄的转化、亚细胞定位并撰写了手稿。所有作者都审阅并批准了最后的手稿。
通讯作者
道德宣言
伦理批准并同意参与
不适用。
出版许可
不适用。
相互竞争的利益
作者声明他们没有相互竞争的利益。
附加信息
出版商说明
《自然》杂志对已出版的地图和附属机构的管辖权主张保持中立。
补充信息
权利和权限
开放存取本文是根据知识共享署名4.0国际许可证授权的,该许可证允许以任何媒体或格式使用、共享、改编、分发和复制,只要您给予原作者和来源适当的信任,提供到知识共享许可证的链接,并指出是否进行了更改。本文中的图像或其他第三方材料包含在文章的知识共享许可证中,除非在材料的信用额度中另有说明。如果材料未包含在文章的知识共享许可证中,并且您的预期用途不受法律法规的允许或超出允许的用途,您将需要直接获得版权持有人的许可。要查看此许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/. 知识共享公共领域放弃(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信用额度中另有说明。
关于这篇文章
引用这篇文章
杨,H.,Shen,F.,Wang,H.等。功能分析SlERF01型抗病基因美国黄瓜.BMC植物生物学20,376 (2020). https://doi.org/10.1186/s12870-020-02588-w
收到:
接受:
出版:
关键词
- 西红柿
- SlERF01型
- 电阻响应
- S. Lycopersici.