- 研究文章
- 开放获取
- 发布:
Gibberlin代谢和信号转导(GA MST)途径中的基因组鉴定与表征培养种子和浆果发育(SBD)葡萄(vitis ViniferaL.)
BMC植物生物学体积20., 文章编号:384.(2020.)
摘要
背景
葡萄对嗜酸甘油蛋白(GA)非常敏感,它们在种子和浆果发育(SBD)期间至关重要,或者通过与其他激素相互作用,例如植物蛋白,脱落酸(ABA)和细胞蛋白(CK)。然而,在Grapevine中未经对Ga代谢和信号转导(MST)途径的系统分析。
结果
在本研究中,总内源GA3.在该过程中,SBD期间的含量显着降低,并且在该过程中鉴定了Ga代谢(GAM; 31)中的48个已知基因和信号转导(ST; 17)途径。在Gam途径中,在31个基因中,VVGA20Ox1-1,VvGA3ox4–1型,和vvga2ox1-1可能是在绿色浆果阶段(GBS)相互作用的主要因素,伴随着较高的积累率。GA生物合成在GBS的GA失活大于GA灭活,证实了种子在GA合成中的重要性。内源GA之间的可见相关性3.含量和基因表达谱表明,Ga生物合成途径基因的转录调节是石头硬化阶段(SHS)在GA积累的关键机制。有趣的是,我们观察到之间的负面反馈监管VvGA3oxs-VVGA1–4型,VvGA2oxs-VVGA1–4型,和vvgid1b-vvgai1-4保持GA的平衡3.浆果中的含量。此外,11个miRNAs可能通过介导其靶基因参与GA-MST通路的调控,如VvGA3ox型,VvGID1B,和vvgamyb..进一步鉴定出许多在蟾蜍,ABA和CK MST途径中的基因,并发现在浆果中具有特殊的图案,并且Ga和这些激素之间的串扰可以通过多激态路径的相互作用基因网络在SBD期间调节复杂过程。最后,基于多激态MST途径基因的表征,提出了SBD期间GA介导的多激态调节网络的提出模型。
结论
我们的研究结果为葡萄SBD过程中ga介导的调控网络提供了新的视角。同时还阐明了ga介导的多激素ST在SBD中的复杂性,为进一步研究葡萄特异性基因的功能提供了有价值的信息。
背景
葡萄(vitis Vinifera枸杞(L.)是全球栽培的多年生水果作物,具有重要的经济价值,可作为生鲜食品、干制食品和饮料,对人类健康起着重要的作用,并因其药用价值而受到重视。种子浆果发育(SBD)是其生命周期中极为重要的阶段之一。葡萄对赤霉素(gibberellin, GA)高度敏感,赤霉素是葡萄SBD过程中重要的激素之一。以往研究的分子遗传学分析表明GA信号参与浆果生长发育的各个阶段[1.],如促进浆果扩张,显着影响水果套,着色和发展,以及浆果的成熟。几项研究证明了GA的外源预灌注3.对“醉金香”和“红地球”种子败育的诱导作用[2.,3.]. 此外,GA能提高果实库强度[4.];因此,GA可以通过影响能量补充间接影响果实发育。在过去的20年里,一组参与GA信号通路的基因被鉴定出来,香蕉中关键基因的生物学功能得到了广泛的研究[5.]和苹果[6.]. 葡萄GA信号通路在整个转录组水平上调控SBD的分子相互作用网络尚不清楚。
DELLA稳定性的控制是GA反应的一个关键因素,也是IAA等其它植物激素的重要切入点[7.aba [8.],影响植物生长发育。因此,我们推测在SBD过程中,介导GA代谢和信号转导(MST)通路的DELLA蛋白与多激素MST通路之间存在一个网络。完全了解GA、ABA、生长素和CK-MST途径是阐明葡萄SBD发生机制的基础。随着葡萄基因组序列的发布(http://genomes.Cribi.unipd.it/Data/v2/v2/)和高通量分析工具的增加的能力越来越好,有更好的机会来系统地研究与MST路径相关的基因。
浆果发育过程中的形态和生理变化明显地暗示了许多基因的表达水平的变化,包括GA-MST途径中的基因。根据葡萄果实发育四个阶段的RNA序列数据,我们对葡萄果实中GA、生长素、CK和ABA-MST途径的相关基因进行了鉴定和表征,并检测了它们在SBD过程中的时空表达谱以及GA的积累变化3.IAA、ZR和ABA含量随浆果发育的变化,从而深入了解SBD在全转录组水平上的信号调控网络。建立了葡萄中ga介导SBD与其它激素协同调控的复杂调控网络。本研究成果可为进一步阐明赤霉素与ABA、生长素、CK调控SBD的分子机制和潜在相互作用提供参考。
结果
SBD期间的形态学,生理学和生化变异
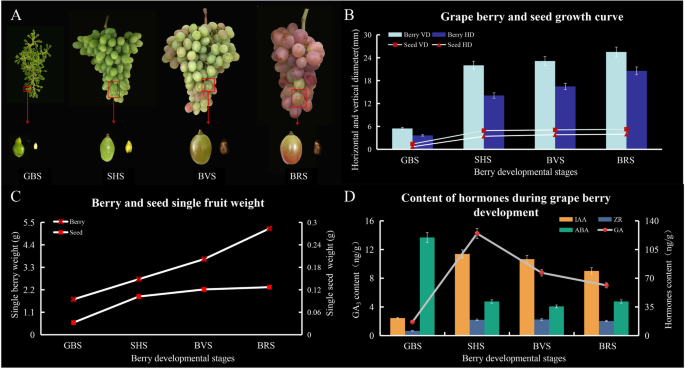
数字1.a表明葡萄果实从绿果期(GBS)到成熟期持续生长,而葡萄种子则在SHS作用下发育成熟和硬化。从GBS到SHS,果实和种子的发育曲线和平均重量均呈快速增长趋势,但在果实转化期(BVS)和成熟期(BRS)保持稳定(图1)。1.B和c)。在初始浆果生长和GBS期间,由于细胞分裂和扩张,浆果尺寸沿着符号生长曲线增加。SHS定义为滞后阶段,其中细胞扩张停止,种子硬化,胚胎迅速发展,糖开始积累。BVS标志着BRS的开头,其中浆果由于额外的Mesocarp细胞膨胀,花青素,葡萄糖和果糖的积累以及有机酸积累的下降而导致浆果的第二次矩形增长。
内源GA含量3.,IAA,ZR和ABA
内源性荷尔蒙GA的水平3.果实发育过程中,IAA、ZR含量呈上升和下降趋势,ABA含量呈下降趋势。GA含量最高3.,IAA和ZR在SHS观察,而ABA是GBS。ga的总量3.,IAA和Zr(表达为Ng / G FW)从GBS的1.90,21.38和5.81ng / g fw逐渐增加到SHS的GBS至14.24,99.62和19.28 ng / g FW,从7.00,78.93减少BRS的17.84 ng / g fw(图。1.d)。在成熟的浆果中,在GBS的119.73 ng / g fw下检测到ABA,以41.67 ng / g fw。
GA-MST通路基因的鉴定
在葡萄中,在本研究中鉴定了共48个非冗余GA MST相关基因。每个人都以酶促反应命名并提到拟南芥GA-MST通路。在48个gamst相关基因中,分别有31个和17个与GAM和ST有关。这些基因属于9个不同的基因家族,均为单基因拷贝。两个基因在SBD期间的表达水平没有变化,包括vvga20ox1-2和VvGA20ox2–1型有2个转录物被观察到轻微上调或下调。大约44个转录本被认为是显著差异表达的基因(表1)1.和2.).
在浆果发育期间GA MST路径中基因的硅表征
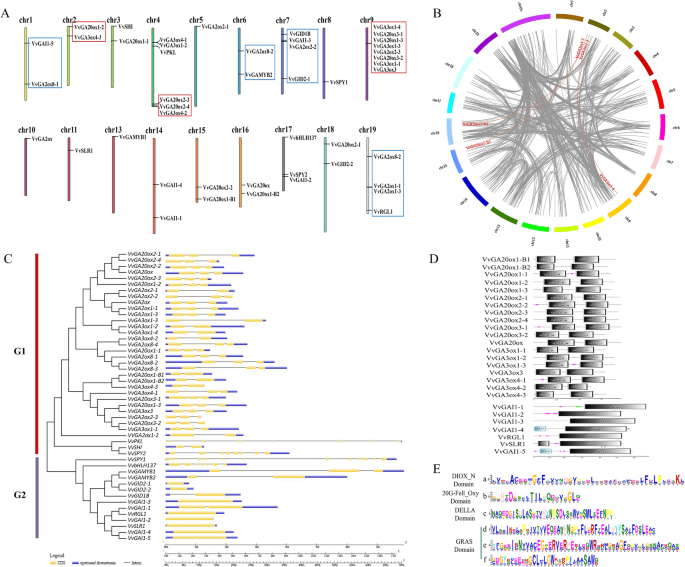
基因的染色体分布和共同性
Ga MST途径中总共48个基因可以分配为19个葡萄染色体中的18个(CHR 2除外),并且观察到染色体上的基因的不均匀分布。CHR9覆盖大部分基因(8),然后是CHR4(6),CHR7(4),CHR19(4),CHR17(3)和1-2的剩余CHL。结果表明,基因,如VvGA20oxs型和vvga3oxs.,在GA生物合成途径中倾向于定位在相同的CHRS上,即CHR 4和9,而vvga2oxs.在GA非活动途径中,定位在相同的CHRS上,即CHR1,7和19,也是GA信号途径中的基因,如VvGID1B(CHR7),VvGAIs(Chr1、7、14和17)和vvrgl1.(CHR9)。这些结果表明,类似的功能基因在葡萄基因组中具有某种守护属性(图。2.一个)。
遗传算法MST通路基因的染色体定位、序列特征分析、基因复制及系统发育分析。A.GA MST通路基因的染色体定位。BGA MST途径基因的同时分析。灰线表示葡萄基因组中的所有同时性块,而红线表达重复的基因对。CGA MST途径蛋白质的NJ系统发育树和GA MST途径基因的外显子结构。使用三种不同的传说2种具有长基因组序列的基因(vvpkl.和VvSPY1型)使用70 kB和17 kB的传说,其他基因使用短传奇。黄色表示外显子;黑色表示内含子;蓝色表示的UTR。D的域VvGA20oxs型和vvga3oxs.家庭和della蛋白。EDIOx_N结构域和20g-Fell_Oxy结构域序列在所有GA20Ox和GA3OX蛋白方面高度保守,并且在Della蛋白中高度保守GRAS结构域,而Della结构域仅在SLR,GAI1-4和GAI1-5蛋白中。每个位置的字母(氨基酸)的高度代表守恒程度。(在线颜色图)
此外,12个基因(即。,VvGA3ox4–1型/VVGA3OX1-2,vvga3ox1-4/VvGA20ox3-1/vvga20ox1-3/vvga3ox1-3/vvga2ox2-3/VvGA20ox3-2/VVGA3OX1-1/vvga3ox3.,和vvga2ox1-1/VvGA2ox1–3型)在葡萄Chr4,9和19上聚集成三个串联复制事件区域(图。2.b)。除了串联复制事件,三个分离复制事件(即,VVGA20Ox1-B1/VvGA3ox4–3型,VVGA20Ox1-B2/VvGA3ox4–3型,和vvga3ox1-4/vvga3ox1-3)也鉴定了(图。2.b),表明GA MST途径中的一些葡萄基因可能是通过基因重复产生的。此外,分离复制事件还可以为GA MST基因进化关系和功能预测提供参考。
GA MST通路的系统发育树及基因外显子-内含子组织
系统发育树将GA MST通路中基因编码的蛋白分为G1和G2两类(图1)。2.c). GA代谢途径的所有基因都聚在G1中,而除vvpkl.,VvSHI公司,和VvSPY2型,将剩余的基因在Ga ST途径中聚集成G2。
与他们的位置不同,VvGA20oxS更接近vvga2oxs.比vvga3oxs.. 对GA-MST途径基因外显子-内含子结构的进一步分析表明,与它们的系统发育树相似,G1中大多数基因的外显子数为3或2,而G2中的外显子数为1(图。2.d) 是的。然而,GA-MST通路中所有基因的外显子和内含子的数目都有很大的差异。八个基因(即。,第2–1页,第2–2页,vvgai1-3.,vvrgl1.,VVGAI1-2,vvslr1.,vvgai1-4,和vvgai1-5.)葡萄基因组中没有内含子;鉴于vvpkl.是最长的基因,有70个 kb基因组序列在GA-MST通路中,包含了本研究中最多的外显子(29个),其次是外显子VvSPY1型有16个外显子,VvSPY2型和VvbHLH137型其余42个基因都有1-3个外显子(图。2.d)。
保守领域和主题的特征
DIOX_N域和20G-Fell_Oxy域是20的共同域VvGA20oxs型和vvga3oxs..在相同的域的基础上,我们确定了DIOx_n结构域的高度保守的主题(图。2..f-a)和20g-fell_oxy域(图。2..F-B)。此外,VvGA20oxs型和vvga3oxs.都是在相同的Chrs上类似于VvGA20oxs型和vvga3oxs.,在7个DELLA蛋白中发现了3个高度保守的GRAS结构域。DELLA域在vvgai1-4,vvslr1.,和第1–5节。此外,它们聚集到系统发育树的相同分支中,表明它们可能具有相似的功能。
基因在GA MST通路中的表达分析
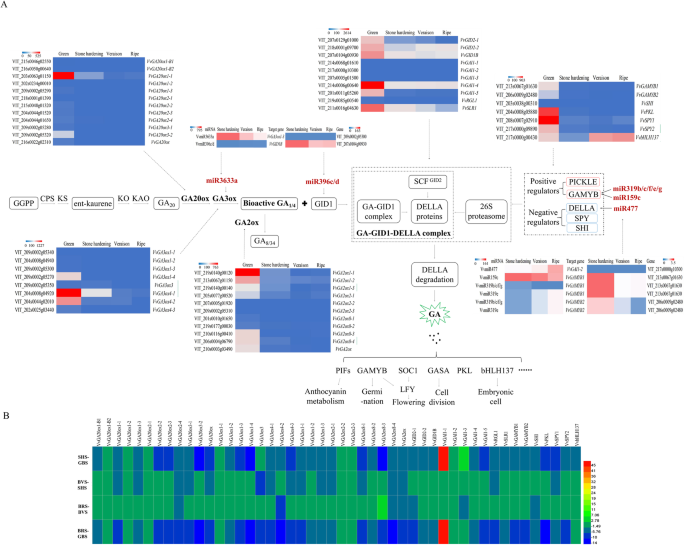
生物合成途径
在该研究中,参与Ga生物合成途径(包括12a0ox和8Ga3ox)的20个基因(图。3.a和b;额外的文件1.:表S1),对于控制生物活性GA水平特别重要。在12VvGA20oxs型,VVGA20Ox1-1在GBS表达水平最高,在所有四个阶段均有显著表达。VVGA20Ox1-B1,VVGA20Ox1-B2,vvga20ox1-2,和VvGA20ox2–1型SBD时无表达。一些成员VvGA20oxs型家庭表现出显着降低的表达vvga20ox1-3,VvGA20ox2–2型,VvGA20ox2–4型,VvGA2ox3–1型,和VvGA20ox. 类似地,在另一个重要的酶GA3ox家族的8个成员中VvGA3ox4–1型高于对照组VvGA3ox4–2型和vvga3ox1-4.它们在浆果的GBS中表达量最高,从GBS到BRS的表达量显著降低到最低水平,而其他成员在SBD中只有少量或无表达.
灭活途径
vvga2oxs.是一种用于GA失活途径的酶。这里,11VvGA2ox在浆果中发现了基因。vvga2ox1-1,其中vvga2ox1-1,VVGA2OX2-1,VvGA2ox8-3,VvGA2ox8-4,和VvGA2ox,表达量最高,且在浆果发育的四个阶段均有显著差异(图5)。3.a和b;额外的文件1.:表S1)。他们在GBS的表达最高。尽管如此,VVGA2OX2-2,vvga2ox2-3,VvGA2ox8-1,和VvGA2ox8-2在浆果发展的四个阶段几乎没有表达或改变。
信号转导途径
一个VvGID1B鉴定基因(GA受体),分别在GBS和BVS处具有最高和最低的表达水平(图。3.一个)。我们在葡萄浆果中识别出GID2家族的两个成员,在GBS上表现出表达峰。第2–1页从SHS到BRS逐渐减少,而第2–2页展示了SHS的最低表达。我们确定了七种Della家族基因,包括vvgai1-1.,VVGAI1-2,vvgai1-3.,vvgai1-4,vvgai1-5.,vvrgl1.,和vvslr1..vvgai1-4有最高的表达,其次是vvslr1.和vvgai1-5.其余基因在葡萄果实发育过程中表达降低;vvgai1-4,vvslr1.,和vvgai1-5.主要表达特别是在GBS(图。3.a和b;额外的文件1.:表S1)。
监管因素
我们揭示了两个积极的作用成分vvgamyb.和vvpkl.主要在浆果中的GBS表达,而另外四种负作用组件VvSPY1型,VvSPY2型,和VvbHLH137型也在四个阶段的浆果中检测到,而且只有VvSHI公司在浆果中的四个阶段具有低表达水平(图。3.a和b;额外的文件1.:表S1)。共有10个VVMIRNA,如vvga3oxs.VvmiR3633a,VvGIB1B型对于VVMIR396C / D,VVGAI1-2对于VvmiR477,VvGAMYB1对于VVMIR159C和VVMIR319B / C / E / F / G,和VvGAMYB2对于VVMIR319B / C / E / E / E / e / g,可以通过介导其靶基因来涉及GA信号途径的调节。这些VVMIRNA及其靶基因表现出浆果的相反表达趋势,表明这些VVMIRNA在SBD期间具有对这些潜在的靶基因的阴性调节作用(图。3.a和b;额外的文件1.:表S1)。此外,在这些VVMIRNA中,VVMIR3633A在SHS浆果中具有最高的表达,而其余的浆果略微表达。靶基因VvGID1B对于VVMIR396C / D也在SHS中展示最高表达,这意味着VVMIR3633A可以通过调节表达水平来压制SHS的GA生物合成vvga3ox1-3.鉴于VVMIR396C / D具有低表达水平,导致高表达VvGID1B可以增强GA信号接收性。
多态MST途径基因的表达表征
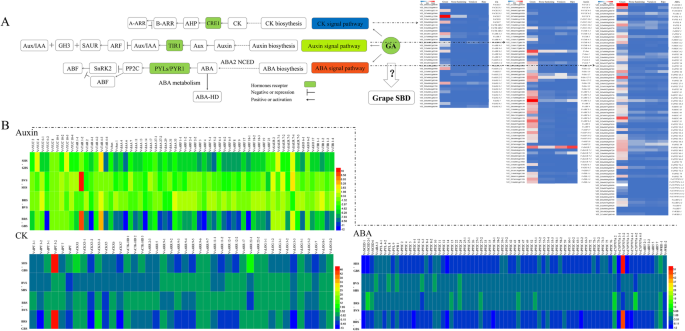
从我们的数据集中,我们还鉴定了生长素、CK和ABA MST通路的62、36和73个基因。VvYUC10-4,VvTAR4–1型,vvaux.,vvarf2-2,和VvSAUR2生长素MST途径,vvnced1.和VvPP2C49型ABA MST途径,和VvCKX5型与相应基因家族的其他成员相比,CK MST通路的表达量更高。4.;额外的文件2.:表S2)。
生长素MST途径
这两个VvYUC10-4和VvTAR4–1型内源性生长素生物合成中的关键酶显示GBS的表达峰增加,并在BVS上显着降低。vvarf2-2,这是压制一系列养肝响应的转录调节剂,表现出18个ARF基因成员的最高表达基因。他们中的大多数都展示了GBS的最高表达,然后在浆果的BVS之前显着降低。类似于vvarfs.,Aux / Iaa蛋白在GBS中也丰富。Auxin MST路径中的另一个重要元素是vvsaur.其转录依赖于活性生长素的水平。不同于vvarfs.和aux / Iaa蛋白,VvSAUR2通过浆果开发过程显示高转录水平。
ABA MST路径
vvnced1.和VvNECD2–1型是ABA生物合成率限制酶的基因,在GBS高度表达。另外,七VvCYP707As在这项工作中被确定为ABA代谢,其中五个在GBS中丰富。发现了五个ABA受体,但只有Vvpyl9.在葡萄浆果中高表达,主要在GBS中表达。然后,51VvPP2C从我们的数据库中确定基因成员。VvPP2C25-1和VvPP2C49型非常表达比其他人,37名PP2C基因家族成员也在GBS表达。VvABI5s公司主要在GBS表达,在SBD期间高于其他阶段。
CK MST路径
在CK-MST通路中,与CKX家族其他6个成员相比,VvCKX5型显示浆果中最高表达水平。类似的趋势VvCKX3-2,VvCKX5型,和VvCKX7型在GBS被检测到,然后显着降低至BRS。仅有的VvLOG1-2在GBS的10个LOG成员中显示出最高的水平。vvckxs.高于表达vvlogs.因此,我们推测细胞分裂素可能主要在SHS、BVS和BRS期间积累。这一结果与SBD期间内源CK含量的变化不一致。1.d)。
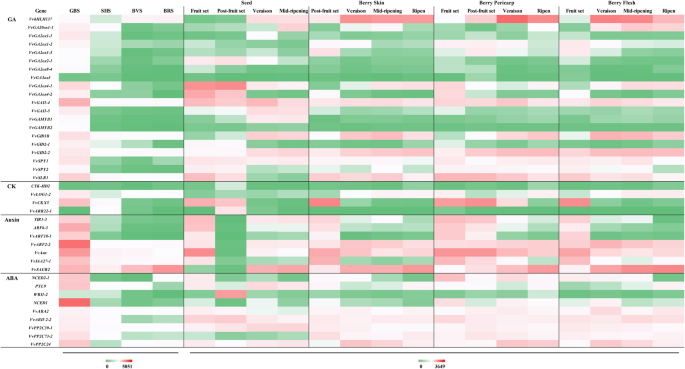
葡萄果实激素MST途径基因在转录组水平的器官特异性表达模式分析
评估我们的测序结果的有效性,基于数据来自V. Vinifera.简历。来自GEO数据集(GSE36128)的Corvina全球基因表达图谱,包括54个葡萄组织、器官或发育阶段[9]. 在种子、浆果皮、浆果果皮和浆果果肉发育过程中鉴定了64种基因的组织特异性表达模式(图。5.;额外的文件3.:表S3)。数字5.表明,种子,浆果皮肤,果皮和肉体中的8,1,3和2个基因表达模式分别与我们的数据类似。另外,50个基因在数据库中的至少两种组织中显示出相同的趋势,表明多种发布者调节这些基因表达。由于其在各种发育过程中的功能,我们发现在不同组织的同一时期不同的基因。例如,VVGA20Ox1-1和VvGA3ox4–1型在我们的数据中检测到veraison和成熟浆果的表达量较低,而在GEO数据集中的浆果皮和果肉中,veraison和成熟期的表达量均较高。推测花青素、葡萄糖和果糖的积累与GA有关,因此这两个基因在两个时期都有高表达。
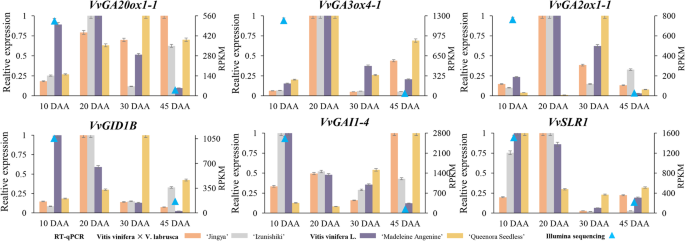
RT-QPCR与Illumina RNA-SEQ之间GA MST途径基因的数据分析
为了验证从RNA-Seq中获得的表达模式,有6个基因(即VVGA20Ox1-1,VvGA3ox4–1型,vvga2ox1-1,VvGID1B,vvgai1-4,和vvslr1.)通过RT-qPCR分析,筛选出在绿色浆果中高表达的GA-MST途径的核心基因(图1)。6.). RT-qPCR的表达谱与RNA-Seq的表达趋势相似,表明RNA-Seq的数据可以代表葡萄果实不同发育阶段基因的相对表达水平。相对表达水平VVGA20Ox1-1,VvGA3ox4–1型,vvga2ox1-1,VvGID1B,vvgai1-4,和vvslr1.从Illumina测序中,在GBS处高度检测到,在SHS处显著降低。数据显示,这6个基因在10%时表达最高 RT-qPCR结果显示,花后d(DAA)或20daa与Illumina测序结果基本一致。这种差异可能是由于不同物种在发育过程中的时间点略有不同。
讨论
以往的研究表明,GA调控网络参与了番茄果实的器官发生和发育[10]和草莓[11]. 此外,参与GA-MST途径的基因与辣椒果实发育有关[12豌豆[13],番茄[14),而拟南芥[15].少数研究[16]对葡萄中GA-MST和GA介导的多激素MST途径机制进行了研究。到目前为止,还没有关于葡萄SBD过程中GA介导的途径和生长素、ABA、CK等多种激素介导的途径基因的鉴定和比较的报道。
SBD期间GA MST通路的基因
基因复制事件被定义为串联或片段复制,已被确定为基因组重排和扩增的两个主要原因[17]. 霍卢布[18报道称,串联复制事件涉及在小于200 kB的染色体区域中的三个或更多个副本。在我们目前的研究中发现了三个串联复制事件区域CHR4,9和19。此外,还鉴定了三种分离复制事件,表明一些GA生物合成基因(即,vvga3oxs.和VvGA20oxs型)通过基因重复可能产生。总体而言,共线事件还可以支持GA生物合成基因进化关系和功能预测。基于系统发育树,我们发现基因的功能越多,它们的关系越近。更近的进化关系可以解释GA MST途径中基因结构的高度保守的基序和大的变化,表明葡萄基因组在其广泛的进化过程中发生显着变化。
vvga3oxs.和VvGA20oxs型在控制生物活跃的GA水平方面尤为重要[19),而vvga2oxs.通过GA灭活调节内源性GA平衡。在目前的研究中,VvGA20oxs型,vvga3oxs.和vvga2oxs.是多拷贝基因,并在浆果中表现出颞特异性表达模式,这与水稻的研究同意[20.] 和拟南芥[21].田间观察和少数生理学研究[22]指出,葡萄SBD是严格相关的,种子通常是植物激素的代谢中心[23]. 我们的研究表明,葡萄种子是内源GA生物合成的器官之一,而GBS和SHS是葡萄SBD的重要阶段。GA基因的表达分析表明VVGA20Ox1-1和VvGA3ox4–1型可能是内源性GA生物合成的关键因素。结合高表达的vvga2ox1-1在GBS中,GA失活可能是调节内源性GA平衡的关键因素。同时,GBS和SHS是内源GA代谢过程中的关键阶段,与内源GA含量相一致,从GBS到SHS,果实中GA含量逐渐增加,并在SHS达到表达高峰。这一现象可能是由于种子是内源GA生物合成的重要部位,而从GBS到SHS的时期对种子的发育有重要意义。
DELLA蛋白是GA信号通路的受体,是GA-MST通路的核心作用元件[24].我们的研究表明,GBS是在SBD期间响应GA和GA信号转导的关键阶段。vvgai1-4和vvslr1.也可能是GBS中GA信号转导的关键核心作用因子。GID1B是一种GA受体,在开启GA信号转导中起着关键作用。考虑到VvGID1B在GBS高表达,GBS可能是对GA信号强烈反应的活跃阶段。虽然先前的证据表明两个假定的GA受体在葡萄浆果发育过程中增加[25]这种差异可能是由于两个研究所用葡萄品种不同造成的。vvgid2.是米糠蛋白GID2的同源性[19],这可能是ga诱导DELLA通过蛋白酶体途径降解所必需的。在目前的工作中,第2–1页和第2–2页可能在GBS中发挥重要角色,第2–2页也可在BRS工作。GBS和SHS是葡萄果实GA生物合成、失活和信号转导的重要阶段。
SBD期间GA MST路径中的调节基因
通过转录因子和其他调节基因等许多调节剂,GA信号可以正面或负面调节。vvgamyb.[26],VvSHI公司[27),而vvpkl.[28]作用于德拉下游的,被认为是拟南芥.vvgamyb.,VvSHI公司,和vvpkl.在本研究的四个阶段中,低水平表达。VvSHI公司和vvpkl.在开花监管网络,叶片发育或抑制胚胎性状的表达,但不在种子和水果发展中发挥重要作用[27,28],鉴于vvgamyb.参与了Ga-della(vvslr1.)-vvmir159c-vvgamyb.信号途径,调节葡萄花卉发育和GA诱导的葡萄葡萄孢疗法[2.].类似于AtSPY[29],VvSPY2型作为GA信号压缩机的葡萄贝利也是如此。此外,VvbHLH137型是德拉的直接目标[24]在浆果中也有高表达水平,表明VvbHLH137型可能是DELLA下游参与SBD的关键靶基因。我们的结果表明VvSPY1型,VvSPY2型,和VvbHLH137型可能是在葡萄SBD期间调制GA信号转导的关键调节因素。
此外,许多ga相关的mirna及其靶标已在橙色中被识别[30.] 和奥雅萨苜蓿[1.],有助于探索miRNA在葡萄果实GA MST通路中的作用。miR159a与其靶点之间的功能相互作用GAMYB在水果开发中已在葡萄中证明[29]和番茄[31]. 此外,越来越多的研究证实miR319b[32], miR477 [33]和mir396 [34]是与果实发育相关的miRNAs,对GA有反应的miR159、miR319、miR477和miR396也已被证实[35].总体而言,VVMIR159,VVMIR319,VVMIR477和VVMIR396可以通过GA诱导并涉及SBD。因此,转录因子和miRNA可能有助于在GA合成和信号转导过程之间维持GA同性化。
SBD期间多激态MST途径基因
生长素在果实坐果和生长过程中起正向调节作用,在果实成熟和成熟过程中起负向调节作用[36].在本研究中,IAA含量在SHS中最高,直至BRS降低。GBS是一个关键阶段VvYUC10-4和VvTAR4–1型参与生长素的生物合成,随着生长素的积累直至SHS可能达到最高水平。种子在果实生长过程中产生的生长素在种子完全发育之前起到防止成熟和过早散播的作用[37].种子发育完全后,果实IAA含量降低。此外,GBS也是生长素信号转导过程中基因表达的重要阶段vvarf2-2AUX/IAA蛋白。在番茄中,生长素通过促进Aux/IAA蛋白的周转间接调节ARF活性[38].该促进允许ARFS成为活跃的,并对疾病响应基因的表达水平施加监管影响[38].因此,类似于番茄[39,40[ARF-IAA可以相互作用,以介导助枝素信号,并直接参与葡萄SBD。我们表示vvsaur.可能与刺激葡萄果实成熟的新功能有关。VvSAUR2特别在BVS和BRS浆果期间表现出高的表达,这与...不同ZMSAur2.涉及生长素介导的玉米细胞伸长[41.]. 米饭OSSAR39.基因负调控生长素的合成和运输[42.].VvSAUR2类似于奥索9,其表达模式与浆果中的活性养肝水平相反。这种现象可能是由复杂的网络引起的vvsaurs.葡萄中的生长素反应。
在以前的研究中[43.],ABA可以被视为葡萄中的候选成熟控制因素,但我们认为ABA也可能参与调节葡萄种子发育。ABA在水果开发期间很重要[44.],成熟[45.]和种子发育[46.].传统上,vvnced1.当ABA积累高并且ABA含量在未成熟的果实中较低时,基因仅在成熟开始时表达,在果实成熟过程中增加[43.].然而,在本研究中,矛盾的结论被绘制的是,在绿色浆果中比在成熟的浆果中的水平要高得多(图。1.d)。类似于苹果[44.[ABA含量也从年轻水果降至较旧的果实,然后在苹果果实中的成熟过程中增加。检测到绿色浆果中的最高ABA含量,意味着ABA可以作为调节种子发育的不可缺少的激素。此外,vvnceds.在GBS中处于较高水平。数控编码ABA生物合成关键速率限制酶的基因[43.[CYP707A是ABA代谢的关键酶。两者都在GBS大量检测到,但是vvnceds.表达明显高于VvCYP707As表达,建议vvnceds.发挥了比VVCYP707S.在GBS。唯一合理的解释是,葡萄种子发育所需的ABA水平高于成熟过程所需的ABA水平。在拟南芥[47.,48.[种子发育期间,在中期和晚期阶段出现了两个ABA积累的峰,但在本研究中观察到GBS的ABA水平的一个峰。该结果可能是由采样时间或不同物种引起的。此外,VvPP2C25-1和VvPP2C49型PP2C家族可能是葡萄SBD特别是GBS中负调控内源ABA含量和应答的关键因子。
通常,在通过细胞分裂阶段进展的年轻果实中发现细胞蛋白活性很快,而在成熟的果实中,活性低或不可检测。然而,最近的研究报告在成熟的猕猴桃肉中大量增加的细胞蛋白[49.葡萄[50.]提示细胞分裂素也参与了成熟相关过程的调控。在本研究中,ZR水平在SHS时达到两个峰值,在细胞分裂时活跃,在BRS时处于成熟期。葡萄[51.发现调节细胞蛋白生物合成(IPTS),活化(原木)和降解(CKXS)的基因被发现以浆果发育的四个阶段表达。以前的研究表明Vvipts.也发现在其他葡萄器官中[51.],与拟南芥[52.],番茄[53.]和大豆[54.].CKXS酶在葡萄浆内的细胞蛋白的不可逆降解仅限于早期发育阶段[24,55.].此外,如先前报告所述[24,55.],VvCKX5型显示GBS的最高表达,然后表现出逐步减少VvCKX5型转录本,这可能有助于葡萄浆果转毒后异戊烯腺嘌呤浓度的大幅增加[56.,57.].
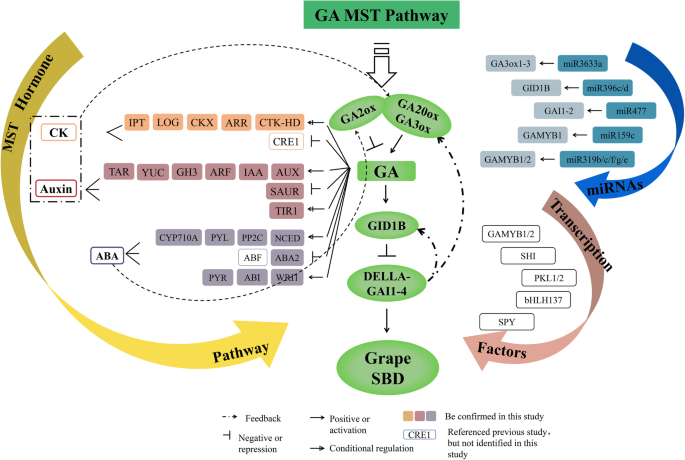
ga介导的葡萄SBD多激素调控网络模型
近年来,许多研究报道了一种或两种激素对浆果发育的调控作用[1.,53.,58.,59.].尽管如此,在葡萄浆果开发期间,很少有相关证据可在竞争期间串扰。在本研究中证明了GA下游植物激素信号传导和串扰的复杂浆果开发监管网络,并阐明了葡萄浆果中的关键节点和Nexus(图。7.).在本研究中,生物合成酶GA20oxs公司和Ga3oxs.和Ga受体基德1B在GBS高表达,同时gamst通路的阻遏蛋白DELLA也高表达。此外,GA3ox1型,GA20ox2,和基德1B可能是直接德拉的目标吗拟南芥[24].因此,我们认为存在反馈机制vvgai1-4-VvGA20ox,vvgai1-4-VvGA3ox型,和vvgai1-4-VvGID1B维持规范葡萄浆果发展的GA内容的平衡。此外,其他荷尔蒙[60.,61.]通过调节来影响GA水平VvGA20oxs型和vvga3oxs.表达式级别。总之,GA20oxs、GA3oxs和GA2oxs不仅是GA代谢中的核心作用酶,而且上游因子也对GA-MST途径中的其他激素作出反应(图。7.).此外,Ga和Iaa之间的串扰[62.],阿坝[63.],对照组[61.]在调节SBD时还证明了[63.].许多研究表明,生物活性GA至少部分地通过抑制Della蛋白的抑制作用来控制植物生长和发展[64.]. 此外,GA-生长素的相互作用[58.]和Ga-ck [65.]激素信号也由Della蛋白介导,以控制植物中的各种方法。GA可以在涉及早期水果开发的养羊酸下游拟南芥[66.]和番茄[36].此外,ABA还调节番茄果实套装和GA [66.].种子发展期间中期和后期阶段中的活跃ABA积累不同[43.[Ga Biosynathesis在种子发展的早期阶段似乎更活跃[67.]. 因此,需要进一步的功能研究来验证GA和多种激素在葡萄SBD中的作用网络。这一调控网络有助于剖析其他激素MST途径基因的分子机制,对GA作出反应,并为深入研究激素与葡萄SBD的关系提供理论依据。
结论
在本研究中,全内源性GA3.在SBD期间含量显着降低,通过使用转录组测序鉴定Ga M(31)和ST(17)途径中总共48个相关基因。大多数基因VvGA20ox,VvGA2ox,和VvGA3ox型gam通路家族在SBD期间表达多样,产生了GA生物合成的代谢通量。在gam通路中,31个基因中,VVGA20Ox1-1,VvGA3ox4–1型,和vvga2ox1-1可能是GBS在互动GA累积率时的主要因素。此外,VVGA20Ox1-1和VvGA3ox4–1型比vvga2ox1-1,符合Ga被合成种子发展的事实。内源GA之间的可见相关性3.含量和基因表达谱表明,GA生物合成途径基因的转录调节是SHS在SH的GA积累的关键机制。我们透露了反馈监管VvGA3oxs-VVGA1–4型,VvGA2oxs-VVGA1–4型,和vvgid1b-vvgai1-4,保持GA的平衡3.浆果中的含量。此外,11个miRNAs可能通过介导其靶基因参与GA-MST通路的调控,如VvGA3ox型,VvGID1B,和vvgamyb.. 此外,我们还发现GA与生长素、ABA与CK之间的串扰可能通过多激素途径基因的相互作用网络来调控SBD过程。最后,基于多激素MST途径基因的表达特征,提出了葡萄SBD过程中GA介导的多激素调控网络模型,为探索GA介导的葡萄SBD调控网络提供了新的思路。我们的研究结果为探索葡萄SBD过程中GA介导的调控网络提供了新的思路。
方法
植物材料
以生长于中国南京(N32°02′12.77”,E118°37′33.25”)的三年生‘藤森’葡萄为试验材料。这些植物材料是在中国句容江苏农林职业学院葡萄农场(我们的长期合作伙伴)的普通田间条件下种植的。在整个生长季节中,采集的浆果分别为绿浆果期(GBS)[开花后10天(10daf)]、石硬化期(SHS) (40daf)、浆果转化期(BVS) (65daf)和浆果成熟期(BRS) (90daf)。共12个样品,包括4个阶段的浆果,包括3个生物学重复,测序。Illumina测序的RNA从40个均匀和平均大小的浆果中纯化,种子从20个集群中取样,以研究每个阶段具有代表性的转录本的生物选择。
总RNA提取、cDNA文库构建及Illumina深度测序
使用Trizol试剂(Invitrogen,Carlsbad,Ca,USA)提取不同阶段的总RNA(即,GBS,SHS,BVS和BRS)浆果样品。在制造商的建议之后,使用Nebnext®ultATRMRNA库预备Kit使用Nebnext®ultATRMRNA库预备套件来生成测序库。使用Illumina Hiseq™2500上海汉义生物技术公司(上海,中国)测序转录组[68.].
加入代码
RNA-seq数据已存入NCBI,注册号为SRP068911 (https://www.ncbi.nlm.nih.gov/sra?term=SRP068911)和GSE153169(https://www.ncbi.nlm.nih.gov/geo/query/acc.cgi?acc=gse153169.).
GA-MST和多激素MST通路基因的鉴定与分析
利用NCBI进行BLAST P搜索,鉴定出GA MST通路基因和多激素MST通路基因拟南芥基因序列作为查询。我们从葡萄基因组数据中获得了葡萄基因组和一组注释的基因序列。通过对葡萄转录组的功能注释来确认这些基因,并确认初步结果的可靠性(RNA-Seq data accession SRP068911) [69.].
SBD期间的形态学,生理学和生化变异
从葡萄基因组中获得了每个GA-MST途径基因在染色体上的位置(http://www.genosope.cns.fr/externe/基因组浏览器/葡萄)。像愣69.]描述了,使用McScanx软件检测到基因复制事件(http://chibba.pgml.uga.edu/mcscan2/). 在mega6.0软件中,我们用蛋白质序列构建了系统发育树,采用了1000个自举重复的邻接方法[70],并利用基因结构显示服务器(http://gsds.cbi.pku.edu.cn/index.php.)使用智能搜索保守的域(http://smart.embl-heidelberg.de/).使用MEME 5.05在线计划搜索主题(http://meme-suite.org/tools/meme).优化后的模因参数为:重复次数,任意;最多15个主题;而每个基序的最佳宽度,在6 - 50个残基之间。
检查内源性GA3.,IAA,ZR和ABA
选择四个阶段,G,Sh,V和R的浆果。内源性GA3., IAA, ZR和ABA水平通过酶联免疫吸附分析试剂盒(ELISA) (Rapidbio,美国),根据制造商的说明和先前研究的描述[71.].每个有种子的浆果从20个集群中的40个浆果中取样作为重复。
GA和多激素MST通路基因的表达分析
用edgeR-R软件包分析计算差异表达[72.].如果具有“FDR <0.001”和“| LOG2折叠(| log2FC |)≥1”的转录物,则它们将被识别为转录水平的显着差异。和转录物| log2fc |<0.25应该没有变化,而转录物0.25 <| log2fc |<1被认为是表达水平的“稍微改变”[69.].
不同葡萄品种的RT-QPCR验证
RT-QPCR用于验证来自RNA-SEQ的GA MST途径基因的表达模式。四个阶段的总RNA样品(即10,20,30和50 daa)vitis Vinifera×V. Labrusca.(“Jingya”和“Izunishiki”)和V. Vinifera.湖('Queenora无籽'和'madeleine angenine')用改性的十六烷基三甲基溴化铵(CTAB)方法提取[73.].纯化后的RNA样本使用PrimeScript逆转录试剂盒与gDNA橡皮擦(Takara,大连,中国)进行逆转录。使用Primer3软件设计基因特异性引物(http://primer3.ut.ee/)(附加文件4.:表S4)。对于每个反应,总体积为20 μl含10 2μl × SYBR绿色反应混合物,2.0 μl稀释cDNA,0.2 各底漆μM。对每个cDNA样本进行3次重复,并按内控标准化处理。用2−ΔCT方法[74.].
可用性数据和材料
RNA-seq数据已存入NCBI,注册号为SRP068911 (https://www.ncbi.nlm.nih.gov/sra?term=SRP068911)和GSE153169(https://www.ncbi.nlm.nih.gov/geo/query/acc.cgi?acc=gse153169.).本研究期间生成或分析的所有数据都包含在此已发布的文章中及其附加文件中。
缩写
- 阿巴:
-
脱落酸
- CK:
-
cytokinin.
- 辅助/ IAA:
-
植物素 - 反应阻遏物蛋白/吲哚乙酸
- 东盟地区论坛:
-
助线响应因子
- CKX:
-
Cytokinin脱氢酶
- GA2ox:
-
赤霉素2-oxidase
- GA20ox:
-
Gibberellin 20-氧化酶
- Ga3ox:
-
赤霉素3-氧化酶
- 基德1:
-
吉布雷林不敏感Dwarf1
- 国家统计局:
-
9-cis-epoxycarotenoid加双氧酶
- PKL:
-
泡菜
- PP2C:
-
蛋白质磷酸酶2C
- 阿富汗二月:
-
小型助流素上升的RNA
- 施:
-
短茎节
- 间谍:
-
smindly
- 焦油:
-
色氨酸转氨酶
- 耶稣:
-
丝兰
参考文献
- 1.
唐yy,刘hh,guo sy,王b,李泽,冲k,xu yy。osmir396d miRNA影响吉布林素和芸苔类药物信号传导来调节植物架构。植物理性。2018; 176:946-59。
- 2.
王聪,张文英,方建刚。时空的表达miRNA159.家庭成员及其GAMYB赤霉素诱导葡萄单性结实调控的目的基因。实验机器人。2018;69:3639-50。
- 3.
郑C,徐旭Z,歌手SD,李杰,张HJ,高M,王L,宋JY,王XP。GA3处理对葡萄种子发育及相关基因表达的影响。公共科学图书馆一号。2013;8:e80044。
- 4.
张C,Tanabe K,Tamura F,Itai A,吉迪达M.吉布林林典的典范在果实生长期间日本梨果水果中的下沉需求。植物生长调节。2007; 52(2):161-72。
- 5。
陈俊,谢杰,段yj,hu hg,li wm。基因组鉴定和表达分析显示威廉姆斯香蕉与其矮种突变体之间涉及嗜酸染药蛋白代谢的组织特异性表达和差异调节基因。BMC植物BIOL。2016; 16:123。
- 6。
赵海杰、董杰、王婷。苹果赤霉素氧化酶的功能及表达分析。植物分子生物学报告。2010;28:231–8.
- 7。
Reid JB,戴维森SE,Ross JJ。植物连体独立于Della蛋白在调节胃泌菌素水平方面。植物信号表现。2011; 6:406-8。
- 8.
关键词:香蕉,WRKY, aba,抗寒性,WRKY转录因子农业化学学报。2017;65:3627-2635。
- 9
Fasoli M, Dal Santo S, Zenoni S, Battista Tornielli G, Farina L, Zamboni A, Porceddu A, Venturini L, Bicego M, Murino V, Ferrarini A, Delledonne M, Pezzotti M.葡萄藤表达图谱揭示了一个深度转录组转移,驱动整个植物进入成熟程序。植物细胞。2012;24:3489 - 505。
- 10.
De JM, Mariani C, Vriezen WH。生长素和赤霉素在番茄座果中的作用。实验机器人。2009;60:1523-32。
- 11.
Csukasi F,Osorio S,Gutierrez JR,Kitamura J,Giavalisco P,Nakajima M,Fernie Ar,Rthjen JP,Botella Ma,Valpuesta v,Medina-Escobar N.Gibberellin生物合成和发信号在草莓容器的开发过程中。新植物。2011; 191:376-90。
- 12.
Tsaballa A,Pasentsis K,Tsaftaris。τhe角色的角色赤霉素20-Oxidase辣椒果实发育中的基因(Capsicum Annuum.). 植物分子生物学报告。2012;30:556–65.
- 13.
ozga ja,yu j,Reinecke dm。授粉,发展 - 和胃肠杆菌蛋白3的特异性调节β-豌豆果实和种子中羟化酶基因的表达。植物生理学。2003;131:1137–46.
- 14.
Rebers M,Kaneta T,Kawaide H,Yamaguchi S,Yang Yy,Imai R,Sekimoto H,Kamiya Y.番茄花卉早期果实发育过程中嗜酸剂生物合成基因的调节。工厂J. 1999; 17:241-50。
- 15.
Fuentes S, Ljung K, Sorefan K, Alvey E, Harberd NP, Østergaard L.果实生长拟南芥通过DELLA依赖和DELLA非依赖的赤霉素反应发生。植物细胞。2012;24:3982–96.
- 16。
Chai LJ, Li YM, Chen SW, Perl A, Zhao FX, Ma HQ。RNA测序显示赤霉素处理无核葡萄幼果后主要植物激素通路基因的高分辨率表达变化。植物科学。2014;229:215-24。
- 17。
郭CL,郭RR,徐旭z,高M,李旭q,宋JY,郑Y,王XP。葡萄的进化及表达分析(vitis ViniferaL.)怀疑基因家族。J实验机器人。2014;65:1513–28.
- 18。
Holub EB。军备竞赛是Ncient历史拟南芥野花。纳特·雷夫·吉内特。2001;2(7):516–27.
- 19
Sasaki A,Itoh H,Gomi K,Ueguchi-Tanaka M,Ishiyama K,Kobayashi M,Jeong DH,A AN G,Kitano H,Ashikari M,Matsuoka M.在F箱突变体中磷酸盐素信号传导的磷酸化阻遏物的积累。科学。2003; 299:1896-8。
- 20。
Boonkaew T, Mongkolsiriwatana C, Vongvanrungruang A, Srikulnath K, Peyachoknagul S. Characterization ofGa0ox.高型和矮型椰子的基因(椰子L.)。基因基因组学。2018; 40:735-45。
- 21。
杜Q,Li Cl,Li DQ,Lu SF。基因组分析,分子克隆和表达分析显示特异性表达,反馈调节,应力响应性的组织,涉及嗜酸甘醇素代谢的综合性新基因丹参.BMC基因组学。2015;16:1087。
- 22。
Rasori A、Zilliotto F、Botton A、Bonghi C、Ramina A。桃果实和种子在发育和成熟过程中激素的相互作用。紧张行为。2010;884:53–60.
- 23。
Shiozaki s,ogata t,Horiuchi s.在开发和成熟过程中果皮的内源多胺和葡萄浆果的种子。SCI Hortic。2000; 83:33-41。
- 24。
Zentella R、Zhang ZL、Park M、Thomas SG、Endo A、Murase K、Fleet CM、Jikumaru Y、Nambara E、Kamiya Y、Sun TP。赤霉素早期信号转导中DELLA直接靶点的全局分析拟南芥.植物细胞。2007; 19:3037-57。
- 25.
Deluc Lg,Gremplet J,Wheatley MD,Tillett RL,Quilici Dr,Osborne C,Schooley Da,Schlauch Ka,Cushman JC,Cramer Gr。Cabernet Sauvignon葡萄浆果开发的转录组和代谢物分析。BMC基因组学。2007; 8:429。
- 26.
Achard P, Herr A, baucombe DC, Harberd NP。赤霉素调控的microRNA调控花的发育。发展。2004;131:3357 - 65。
- 27.
Baylis T,Cierlik I,Sundberg E,Mattsson J.短茎节/时尚的基因,蟾蜍素生物合成的调节剂,参与叶静脉发展拟南芥.新植物。2013; 197:737-50。
- 28.
Henderson JT, Li HC, Rider SD, Mordhorst AP, Romero-Severson J, Cheng JC, Robey J, Sung RZ, Vries SCD, Ogas J。泡菜在整个植物中抑制胚胎性状的表达,并可能在赤霉素依赖的反应中发挥作用。植物杂志。2004;134:995 - 1005。
- 29。
雅各布森SE,奥尔舍夫斯基NE。基因突变smindly拟南芥的基因座改变了胃肠杆菌素信号转导。植物细胞。1993年; 5:887-96。
- 30
关键词:甜橙,叶,花,果实,microrna,全基因组比较BMC基因组学。2014;15:695。
- 31
Silva Emd,Silva Gffe,Bidoia DB,Azevedo MDS,耶稣FAD,Pino Le,Peres Lep,Carrera e,López-díazi,诺伊拉FTS。microRNA159目标slgamyb.转录因子是番茄果实坐果所必需的。植物j . 2017; 92:95 - 109。
- 32
Saminathan T、Bodurrin A、Singh NV、Devarajan R、Nimmakayala P、Jeff M、Aradhya M、Reddy UK。石榴中microRNAs的全基因组鉴定(石榴L.)通过高通量测序。BMC植物BIOL。2016; 16:122。
- 33
刘M,Pirrello J,Chervin C,Roustan JP,Bouzayen M.乙烯控制果实成熟:重新探测转录调控复杂网络。植物理性。2015; 169:2380-90。
- 34.
LENG XP,Fang JX,Pervaiz T,Li Y,Wang XM,Liu D,Zhu XD,方JG。使用MicroRNA快速扩增互补DNA末端的葡萄鱼微窝年家族成员表达模式的表征。植物基因组。2015; 8(2):1-9。
- 35.
韩军,方建国,王超,尹亚龙,孙鑫,冷雪平,宋志成。对外源赤霉素敏感的葡萄微rna。BMC基因组学。2014;15:111。
- 36.
Pattison RJ,CSukasi F,Catalác.CataláC.在水果开发过程中调节养阴动作的机制。physiol植物。2014; 151:62-72。
- 37.
Sundberg E,ØstergaardL.生殖发展中的独特和动态的养羊酸活动。冷泉harb持猪肉。2009; 1:A001628。
- 38.
Goetz M, Vivian-Smith A, Johnson SD, Koltunow AM。生长素响应FACTOR8是果实发生的负调节因子拟南芥.植物细胞。2006;18:1873 - 86。
- 39。
Bassa C,Mila I,Bouzayen M,Audran-Delalande C.与下调相关的表型SL-IAA27.支持番茄中AUX / IAA家庭成员之间的功能多样性。植物细胞生理。2012; 53:1583-95。
- 40.
Hendelman A,Buxdorf K,Stav R,Kravchik M,Arazi T.抑制Lamina过剩番茄茄助线响应因子10(刹车除抑制。植物学报,2012;
- 41.
Knauss S,Rohrmeier T,Lehle L.植物素诱导的玉米基因ZMSAur2.编码在伸长组织中表达的短寿命的核蛋白。J Biol Chem。2003; 278:23936-43。
- 42。
康德斯,Rothstein S.助生响应索尔39基因调节水稻中的唾液水平。植物信号表现。2009; 4:1174-5。
- 43。
张敏,冷平,张国良,李兴祥。9-的克隆及功能分析顺式从桃和葡萄果实中编码伴酸生物合成期间编码关键酶的环氧基碳酸二恶英酶(nced)基因。J植物理性。2009; 166:1241-52。
- 44。
脱落酸对生长苹果果实山梨醇吸收的影响。实验机器人,1983;34:737-43。
- 45。
中山K,山口Shinozaki K。ABA信号在逆境反应和种子发育中的作用。植物细胞代表2013;32:959–70.
- 46。
Finkelstein RR,Lynch TJ。这拟南芥脱落酸反应基因Abi5.编码基本亮氨酸拉链转录因子。植物细胞。2000; 12:599-609。
- 47。
Koornneef M,Hanhart CJ,Hilhorst HWM,Karssen CM。在活的有机体内抑制种子发育和储备蛋白积累在脱落酸生物合成和反应性突变体中的重组中的累积拟南芥.植物理性。1989; 90:463-9。
- 48。
Karssen CM,Brinkhorstvanderswan DLC,布雷克兰AE,Koornneef M。内源脱落酸诱导种子休眠的研究拟南芥(l)heynh。Planta。1983; 157:158-65。
- 49.
Pilkington Sm,Montefiori M,Galer Al,Emery RJN,Allan AC,Jameson Pe。在开发猕猴桃中的内源性细胞蛋白涉及保持果肉叶绿素水平。Ann Bot。2013; 112:57-68。
- 50。
Böttcher C, Boss PK, Davies C.在发育成熟过程中细胞分裂素水平增加vitis Vinifera简历。Shiraz浆果。Am j enol vitic。2013; 64:527-31。
- 51。
BöttcherC,布尔贝格CA,BOSS PK,Davies C. cytokinin新陈代谢转录的变化和葡萄中的信号基因(vitis ViniferaL.)浆果与异戊酰腺素的熟化相关的升高相关。BMC植物BIOL。2015; 15:223。
- 52。
Miyawaki K, Matsumoto-Kitano M, Kakimoto T.细胞分裂素生物合成异戊基转移酶基因的表达拟南芥:组织特异性和由生长素,细胞蛋白和硝酸盐的调节。工厂J. 2004; 37:128-38。
- 53
陈晓东,李建平,张建平,等。细胞分裂素在番茄果实发育中的作用。植物营养与肥料学报。实验机器人。2012;63:5569-79。
- 54
Le DT, Nishiyama R, Watanabe Y, Vankova R, Tanaka M, Seki M, Ham LH, yamaguchi Shinozaki K, Shinozaki K, Phan Tran LS。正常和干旱条件下大豆细胞分裂素代谢基因的鉴定和表达与细胞分裂素水平的关系。《公共科学图书馆•综合》2012;7:e42411。
- 55
Pilati S,Perazzolli M,Malossini A,Cestaro A,DemattèL,Fontana P,RI AD,Viola R,Velasco R,Moser C. Grapevine Berry成熟的Genome-Wide转录分析揭示了一组类似地在三个季节调节的基因vèraison的氧化爆发的发生。BMC基因组学。2007; 8:428。
- 56
作者简介:Galuszka P, Popelková H, Werner T, Frébortová J, Pospíšilová H, Mik V, Köllmer I, Schmülling T, Frébort拟南芥拟南芥表达于烟草植物生长研究。2007;26:255-67。
- 57
Bilyeu KD, Cole JL, Laskey JG, Riekhof WR, Esparza TJ。玉米细胞分裂素氧化酶的分子生化特性。植物杂志。2001;125:378 - 86。
- 58.
胡建华,以色列A,奥里恩,孙tp。dela - arf /IAA相互作用介导赤霉素和生长素信号通路,控制番茄茄果实起始。植物细胞。2018;30:1710-28。
- 59.
Leclercq J、Ranty B、Sanchez Ballesta MT、Li ZG、Jones B、Jauneau A、Pech JC、LatchéA、Ranjeva R、Bouzayen M。成熟相关番茄CDPK相关激酶LeCRK1的分子和生化特性。J实验机器人。2005;56:25–35.
- 60.
斯里瓦斯塔瓦MK,Dwivedi UN。水杨酸延缓香蕉果实成熟的研究。植物科学。2000;158:87–96.
- 61.
卢璐,梁建军,朱欣,肖凯,李忠,胡建峰。生长素和细胞分裂素诱导的浆果在葡萄中结集部分依赖于增强的赤霉素生物合成。Tree geneet Genomes. 2016;12:41。
- 62.
Shinozaki Y,Hao Sh,Kojima M,Sakakibara H,Ozeki-Iida Y,Zzeki-Iida Y,Zeenki-Iida Y,Zheng Y,Fei ZJ,Zhong Sl,Giovannon JJ,Rose JKC,Okabe Y,Heta Y,Ezura H,Arizumi T.乙烯抑制番茄(番茄茄)通过改性胃泌菌素新陈代谢进行果实。工厂J. 2015; 83:237-51。
- 63.
Murcia G,Pontin M,Piccoli P. ABA和Gibberellin A3对糖转运蛋白基因表达模式的作用和转化酶的作用vitis Vinifera简历。在浆果成熟期间的马尔贝克。植物生长调节剂。2017;84:475 - 83。
- 64.
Richards DE、King KE、Ait Ali T、Harbersd NP。赤霉素如何调节植物生长发育:赤霉素信号的分子遗传分析。一年生植物生理学植物分子生物学。2001;52:67–88.
- 65.
Achard P、Baghour M、Chapple A、Hedden P、Straeten DVD。植物胁迫激素乙烯通过对花分生组织特性基因的DELLA依赖性调控来控制花的转化。国家科学院学报。2007;104:6484–9.
- 66。
Dorcey E, Urbez C, Blázquez AM, Carbonell J, Perez-Amador MA。拟南芥胚珠中依赖于受精的生长素响应通过调节赤霉素代谢来触发果实发育。植物j . 2009; 58:318-32。
- 67。
Kim YC,Nakajima M,Nakayama A,Yamaguchi I.吉布林林队的贡献拟南芥通过淀粉降解种子涂层。植物细胞生理。2005; 46:1317-25。
- 68。
上官LF MQ,Fang X,Zhang Kk,Jia HF,Li XP,Bao YQ,方JG。RNA测序显示表格葡萄('富士尼洛尼')水果开发期间的生物网络。Plos一个。2017; 12(1):E0170571。
- 69。
冷雪萍,王平,王琛,朱晓东,李雪萍,李海燕,穆青,李安,刘志军,方建国。葡萄果实发育三个阶段中类胡萝卜素代谢相关基因的全基因组鉴定和特性分析。Sci众议员2017;7:4216。
- 70。
Tamura K,SteCher C,Peterson D,Filipski A,Kumar S. Mega6:分子进化遗传学分析6.0版。mol Biol Evol。2013; 30:2725-9。
- 71。
杨建发、郭采发。9-顺式-环氧类胡萝卜素双加氧酶基因的克隆(新元1)柱花草及其在非生物胁迫下的表达。植物细胞代表2007;26:1383–90.
- 72。
罗宾逊医学博士,麦卡锡DJ,史密斯GK。edgeR:一个用于数字基因表达数据差异表达分析的生物导体包。生物信息学。2009;26:139-40。
- 73。
王聪,王新成,Kibet NK,宋聪,张长青,李晓云,韩军,方建国。对葡萄花和浆果短RNA文库进行深度测序,以发现新的microRNAs,并验证miRBase中存储的葡萄microRNAs的精确序列。杂志。2011;143:64 - 81。
- 74。
Livak KJ,Schmittgen TD。使用实时定量PCR和2-Δδ的相对基因表达数据分析计算机断层扫描方法。方法。2001;25:402–8.
确认
作者感谢中国南京农业大学园艺学院提供的研究实验室设施。
资金
作者感谢中国南京农业大学园艺学院提供的研究实验室设施。国家重点研发计划项目(no . 2018YFD1000106);江苏省自然科学基金项目(no . BK20181318);国家自然科学基金项目(no . 31972373, no . 31801809)。创始机构没有参与研究、收集、分析和解释数据的设计,也没有参与手稿的撰写。
作者信息
隶属关系
贡献
WW和CW构思和设计了研究。WW和YB进行了实验。LG和YZ贡献了强大的分析工具。WW,XW,ZL和HJ分析数据,WW和CW写了稿件。kp和jf修改了手稿。所有作者阅读并认可的终稿。
相应的作者
道德声明
伦理批准和同意参与
我们研究中使用的植物不是濒危物种。植物样品收集按照中国的当地立法进行。
同意出版物
不适用。
利益争夺
提交人声明他们没有竞争利益。
额外的信息
出版商说明
斯普林格自然保持中立,就管辖权的要求,在出版的地图和机构的联系。
补充信息
附加文件1:表S1。
GA MST途径基因在葡萄SBD四个阶段的基因表达模式。
附加文件2:表S2。
葡萄SBD三个阶段中蟾蜍,ABA和CK MST途径基因的基因表达模式。
附加文件3:表S3。
从全球转录组织地图集种子,浆果皮,果皮,果皮和肉体中Ga,蟾蜍,Aba和Ck Mst途径的64基因表达模式。
附加文件4:表S4。
QRT-PCR的GA MST途径基因的引物序列。
附加文件5:表S5。
本研究中使用的数据的名称,阶段和类型。
权利和权限
开放获取本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料包括在文章的创作共用许可中,除非在材料的信用线中另有说明。如果材料没有包含在文章的创作共用许可证中,而您的预期使用不被法律法规允许或超过允许的使用,您将需要直接获得版权持有人的许可。如欲浏览本许可证的副本,请浏览http://creativecommons.org/licenses/by/4.0/.“创作共用公共领域”豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用这篇文章
王,W.,Bai,Y.,Koilkonda,P。et al。Gibberlin代谢和信号转导(GA MST)途径中的基因组鉴定与表征培养种子和浆果发育(SBD)葡萄(vitis ViniferaL.)。BMC植物BIOL.20,384 (2020). https://doi.org/10.1186/s12870-020-02591-1
收到:
认可的:
发表:
关键字
- 葡萄果实和种子的发育
- GA-MST通路
- 多激态MST路径