摘要
背景
小麦瘟病,由Magnaporthe oryzae小麦属植物(MOT)致病型,是小麦的全球威胁(小麦l .)生产。抗风量小(R.)基因已被确定的日期,因此评估小麦抗性的潜在来源是很重要的。巴西小麦品种BR 18 - 特雷纳被认为是抗稻瘟病的最佳来源之一,并已广泛应用于巴西育种计划,但这种阻力的潜在基因是未知的。
结果
BR 18-Terena被用作两个重组自交系(RIL)F的开发中的共同父母6.与巴西品种anhuac 75和BRS 179居群。利用测序的MoT分离物BR32在苗期和抽穗期进行抗性表型分析,并观察到越位分离现象。结果显示,anhuac 75 × BR 18-Terena和br18 - terena × BRS 179群体的遗传图谱分别包含1779和1318个标记。在2B、4B(2个QTL)、5A和6A染色体上鉴定了5个与苗期抗性相关的QTL,其中4个与抽穗期抗性相关的QTL分别为1A、2B、4A和5A。苗期和抽穗期的QTL没有同时定位,但这两个性状之间存在显著的正相关关系,说明这些发育阶段的抗性可能是由不同基因控制的。BR 18-Terena为6个QTL提供了抗性等位基因,在两个发育阶段,一个QTL的表型效应最大,为24.8%,表明BR 18-Terena具有数量抗性。对100个巴西小麦品种的单倍型分析表明,11.0%的品种在一个以上的抽穗期QTL中已经具有br18 - terena样单倍型。
结论
本研究表明,br18 - terena对小麦稻瘟病具有数量抗性,在苗期和抽穗期共检测到9个与抗性相关的QTL。小麦瘟病抗性在很大程度上也是组织特异性的。持久数量抗性鉴定,可与小种特异性结合R.基因介导的抗性是有效防治小麦瘟病的关键。总的来说,这项工作有助于标记辅助选择,以开发新的品种,在面临这种新出现的疾病风险的地区栽培。
背景
小麦爆炸,或brusone,是由真菌病原体引起Magnaporthe oryzae小麦属植物(年检)病变型(同义词Pyricularia oryzae),是对全球小麦生产的潜在威胁。小麦瘟病最常见的症状是受感染的麦穗完全或部分漂白,但也可表现为小麦植株的叶和茎上的眼状灰色病变[1].1985年,巴西巴西州首次在Paraná鉴定了小麦爆炸[2],然后在其中2007年整个小麦种植南美地区,达到玻利维亚于1996年,巴拉圭和阿根廷的传播[3.].这种疾病一直局限于南美洲,直到2016年孟加拉国爆发了一场严重的小麦风暴[4.].南亚的爆炸的存在导致了令人担忧的是,印度的小麦产量是世界第二大小麦制片人,可能会受到严重影响。在巴西,爆炸是几十年的小麦产量的主要限制因素,特别是在潮湿,亚热带气候的中央沙特罗地区为疾病发展提供了理想的环境[3.].小麦爆炸,造成高达100%的作物损失的潜力,关键是要制定疾病管理策略,以造福于区域,其中爆炸流行和那些它是一个新兴的威胁。化学防治措施,对小麦爆炸的管理证明不可靠[5.那6.],并已在巴西观察到对strobilurin和三唑类杀菌剂的耐药性[7.那8.].因此,必须找出可靠的遗传抗性充分控制疾病。
而m . oryzae种复合体能够在超过50种禾草上引起瘟病,在种复合体中观察到宿主适应谱系[4.].感染小麦的分离物(小麦属植物非常贴切致病型)、水稻(选用牛叫声病型)、草坪草(黑麦草病型)、指粟(Eleusine病型)和谷子(狗尾草致病型)形成以下phylogenomic分析遗传上不同的基团[4.].致病型对备选宿主也显示出有限的致病性[1那9.].与稻瘟病一样,小麦瘟病抗性被认为是由宿主抗性(R.)基因和种族特异性毒性(AVR.)病原体内的基因[10.].目前在小麦中鉴定到的抗病基因很少。Rmg2(稻瘟病抗性2(染色体7A)和Rmg3(6B),在六倍体小麦(小麦)品种夫人,在苗期胙稻瘟病抗性和对温度敏感[11.].基因Rmg7(2A)和Rmg8(2B),来自四倍体(杜鲁姆)和六倍体小麦分别识别相同的毒力基因AVR-Rmg8并同时在幼苗和抽穗期提供阻力[12.].然而,两者之间R.只有基因Rmg8has been determined to be effective at temperatures above 24 °C [12.].基因Rmg1(syn。rwt4.) (1 d)Rmg6(syn。rwt3.)(1D)还提供幼苗和小麦头部的抵抗力[13.], 然而Rmg6对温度敏感,在25°C以上无效[14.].不幸的是,报告已经表明了这一点Rmg2, Rmg3和Rmg7已被更具侵略性的现场MoT分离物所克服[1],表明识别额外抵抗源的重要性。来自小麦野生相对的2ns / 2as染色体易位偏凸山羊草已经显示出在抽穗期胙小麦稻瘟病抗性,与品种携带2NS易位显示多达疾病症状的72%相比,减少那些没有2NS [15.].然而,2NS易位产生的抗性也被证明对最近的稻瘟病分离株不太有效[15.].在某些遗传背景中也是无效的[16.,表明不能仅仅依靠2NS易位的存在来提供足够的抗性。
多项研究表明,在对比小麦不同发育阶段的抗瘟性反应,如与2NS易位其赋予的头部,但对叶性没有影响[15.].一项对85名美国人进行的研究表明,美国人的健康状况很好小麦品种表明,苗期对稻瘟病的抗性可能不是抽穗期抗性的可靠指标[17.].马丁内斯等人也做了类似的观察[18.],发现阿根廷小麦品种的苗期病害严重程度与抽穗期呈较低的负相关。虽然这些研究证明了品种对苗期和苗头感染反应的差异,但在遗传水平上知之甚少。因此,更透彻地了解控制稻瘟病抗性的遗传对在小麦发育的不同阶段提供持续的抗性至关重要。
在水稻栽培稻已鉴定出100多个QTL,其中35个QTL为主要QTLR.基因已被克隆,并已进行分子特征分析[19.,这表明在水稻基因库中有相当大的与抗稻瘟病有关的自然变异。大麦基因库也可能是一个丰富的来源m . oryzae性,与由Aghnoum等人测试了欧洲大麦品种的9.0%。[20.对MoT和MoO两种病型均表现出完全的抗性。在小麦方面,只有9个R.基因(Rmg1-Rmg8那RmgGR119)。[21.],检测到的QTL很少,这可能表明抗性基因库比较有限。因此,彻底评估小麦中、高抗性的任何潜在来源尤为重要。巴西小麦品种br18 - terena、BRS 229和mg2 Brilhante在田间和对照条件下均表现出一致的中等抗性[6.那22.那23.,表明它们具有宝贵的抵抗力。特别是,br18 - terena与Urashima等人接种的72株稻瘟病菌均表现出广谱抗性[22.],并且还中等电阻当由Maciel的等与在苗期69株和27株在抽穗期接种。[24.].由于此一致,阻力适中,BR 18 - 特雷纳已经频频在巴西育种计划自其发布使用于1986年[25.],许多巴西小麦品种在系谱中含有br18 - terena [26.].然而,虽然BR 18-Terena的耐用性被广泛利用,但这种阻力的潜在遗传仍然是未知的。了解BR 18-Terena的阻力是由于定量还是R.基因介导的抗性对小麦育种家来说尤其重要,识别受抗性保护的发育阶段也是如此。
本研究的目的是首次了解br18 - terena对小麦稻瘟病抗性的遗传基础,以便鉴定特定的抗性,这可能有利于小麦育种计划的使用。br18 - terena(以下简称BR 18)作为巴西小麦品种anhuac 75和BRS 179的两个双亲本杂交的共同亲本。利用测序的MoT分离物BR32对两个重组自交系(RIL)群体进行了苗期和抽穗期的抗性表型研究[27.].的populations were genotyped using the Axiom® 35 k Wheat Breeders’ Array [28.为每种群体产生遗传联系地图,以允许鉴定与小麦抗抗抗性相关的QTL。
结果
爆炸表现型
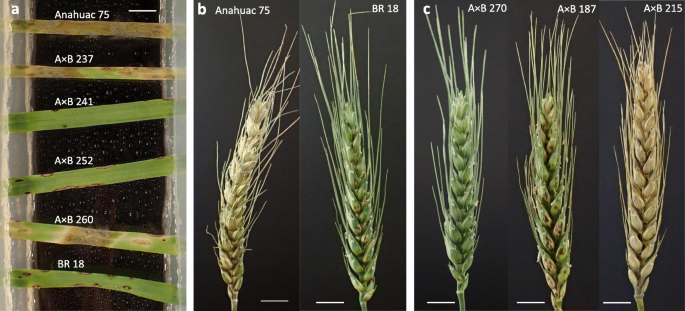
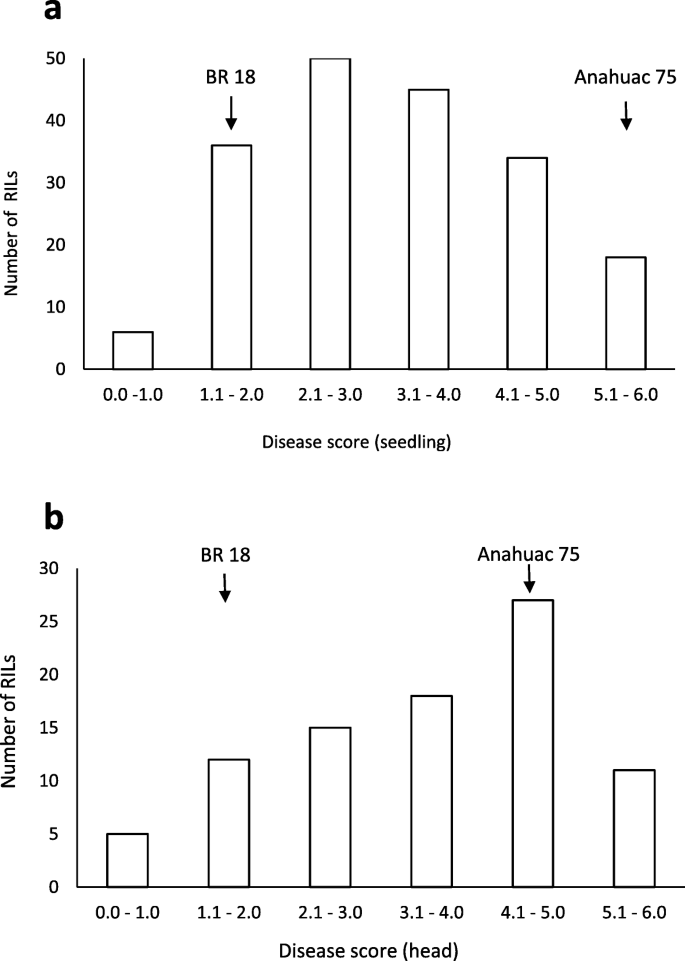
在幼苗抗稻瘟病试验中,anhuac 75的平均得分为5.1分(表1)1),显示水浸泡和灰色孢子花纹病变,其表示叶组织的完全敏感性(图。1一种)。相比之下,来自BR 18的叶子仍然是绿色,灰色坏死缠绕着棕色坏死(疾病得分1.6)。显着差异(P. < 0.001) between the predicted mean scores for Anahuac 75 and BR 18 for the seedling assays were observed (Table1).在anhuac 75 × BR 18 ril中,幼苗平均得分为3.2分,范围为0.8 ~ 6.0,表明发生了海侵分离1).在离体头部试验中,anhuac 75显示头部严重漂白(平均评分5.0),而BR 18(平均疾病评分2.0)仍为绿色,有轻微漂白和坏死(图)。1b).在离体头试验中,亲本间的预测平均分差异显著P.< 0.001水平(表1).在anhuac 75 × BR 18 ril中,头部疾病平均得分为3.5分,范围为0.9 ~ 6.0分,再次表明种群发生了海侵分离。离体叶片和离体头试验的疾病评分的频率分布如图所示。2.显著正相关(R2 = 0.284,P. = 0.007) between the predicted mean scores for the seedling and detached head experiments was observed, as shown in Fig.3.一个。
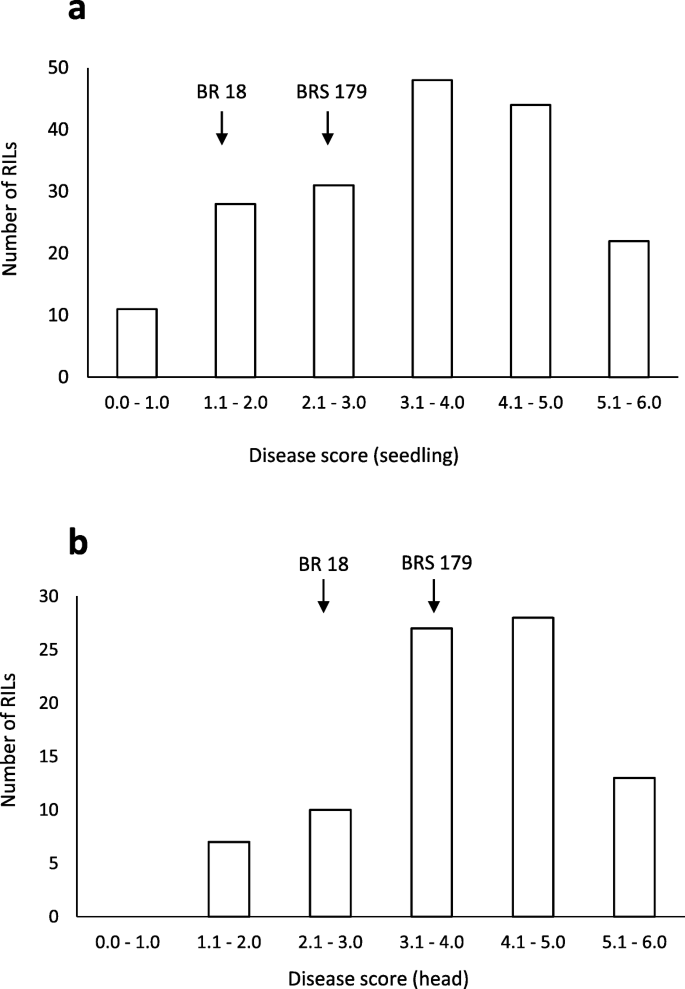
BR 18和BRS 179都显示以下苗接种类似的症状,与小坏死损害和灰色小病灶坏死环斑(图4.a). BRS 18和BRS 179的预测均分分别为1.8和2.7,两者之间无显著性差异(表1)2).Within the BR 18 × BRS 179 RIL population, the range of seedling scores was 0.4–6.0 indicating transgressive segregation, with a mean of 3.4 (Table2).如同幼苗测定,有在抽穗期在BR 18和BRS 179之间的敏感性差异不大。的平均得分分别为3.0和4.0,对于BR 18和BRS 179分别指示坏死损害和颖片的轻微漂白(图4.b).这些分数没有显著差异(P =0.346)(表2).A mean disease score of 4.0 was observed in the BR 18 × BRS 179 RILs, with a range of 1.3–6.0, indicating transgressive segregation (Table2).显示出脱离叶和分离的头部测定的疾病评分频率分布的直方图如图4所示。5..显著正相关(R2 = 0.318,P =0.003),结果如图3所示。3.b。
基因映射
在Anahuac 75×Br 18种群中,共有3641个标记物在AnaHuac 75和Br 18之间具有多态性,并且适合于遗传映射。用于共占状标记物的平均残余杂合性为3.3%,具有F的预期杂合子6.生成为3.1%。总共3180个标记分配给联动组,其中1779个标记有独特的遗传地图位置(表3.).的final genetic linkage map covered 3933.6 cM across the 21 wheat nuclear chromosomes, giving a marker coverage of one marker every 2.2 cM. The A genome was represented by 767 markers, the B genome by 739 markers and the D genome by 273 markers. The most marker dense linkage group was chromosome 1A, with 174 markers, whilst the most sparsely populated linkage group was 6D, with 16 markers.
在br18 × BRS 179群体中,适合进行遗传定位的多态标记共有4110个,共显性标记的平均残杂度为2.5%。一个连锁组共分配3096个标记,其中1318个标记具有唯一的地图位置(见表)4.).最终遗传图谱覆盖2856.6 cM,每2.2 cM覆盖1个标记。A基因组有690个标记,B基因组有556个标记,D基因组有72个标记。标记密集程度最高的连锁组为3A,有150个标记,而最稀疏的连锁组为7D,只有4个标记。
QTL定位
In the Anahuac 75 × BR 18 population, two QTL were identified which were associated with seedling resistance to MoT BR32 (Table5.).染色体4B甲QTL解释的表型变异的7.9%,而在图6A的QTL解释直到方差的5.9%,用BR 18在两个这些基因座(表的赋予抗性5.).鉴定出3个与头鼓风相关的QTL。在4A和5A染色体上鉴定出2个具有抗性等位基因br18的QTL,分别解释了17.8和18.8%的表型变异5.).在1A位点上鉴定到一个具有anhuac 75抗性的QTL,可解释高达10.4%的方差。QTL在相关染色体遗传图谱中的位置见附加文件1、2、3、4和5。
在BR 18 × BRS 179群体中鉴定出3个与稻瘟病苗期抗性相关的QTL6.).在4B和5A上鉴定出两种QTL,分别占表型方差的24.8%和16.8%,BRS 179有助于两个基因座的低疾病等位基因(表6.).2B染色体上额外的QTL解释了高达4.6%的群体内的变异,br18赋予低的疾病等位基因。在2B上鉴定出一个与抗头瘟相关的QTL,解释了19.6%的变异。在这个位点,br18授予抵抗(表6.).在用于相关的染色体遗传图谱的上下文QTL位置显示在附加文件6,图7和8。
巴西小麦品种面板的单倍型分析
鉴定了四个QTL,其与标题阶段的爆炸抗性相关。Anahuac 75在Anahuac 75×BR 18人群中赋予染色体1A上QTL的抗QTL等位基因(解释了10.4%的表型变异,var)。BR 18在BR 18×BRS 179群体中的染色体2B(19.6%VAR)上的QTL耐药等位基因,并在AAHUAC 75×BR 18群中的4A(17.8%VAR)和5A(18.8%VAR)上。将100个巴西小麦品种的单倍型与在相应的QTL区域的BR 18或AnaHuac 75中的那些进行比较,目的是鉴定具有与每个相似单倍型(98.0%相同的基因型呼叫)的品种到每个内部的抗性父母QTL区域(附加文件9.).的1A QTL interval, which represents the physical region of 517,894,785 – 586,284,850 bp on 1A, was populated by 422 markers, as shown in Additional File9..在巴西小麦组中,18.0%的品种在1A QTL区域内表现出与Anahuac 75相似的单倍型,如附加文件所示10..2B QTL区间(666,652,404 - 747,821,399 bp)由206个标记代表。在2B区域内,54.0%的巴西小麦品种中观察到类似br18的单倍型10.).的4.A QTL interval was represented by 73 markers and covered the smallest physical region (3,868,572 – 16,965,499 bp). Within this interval, 9.0% of the Brazilian wheat panel displayed a BR 18-like haplotype. The 5A QTL region (570,008,652 – 596,561,078 bp), was covered by 119 markers. A BR 18-like haplotype within this region was observed in 10.0% of the Brazilian wheat cultivars. In total, 16.0% of cultivars possessed a haplotype similar to the resistant parent (either BR 18 or Anahuac 75, depending on the loci) at two of the QTL regions identified, whilst 2.0% of cultivars possessed a haplotype similar to the resistant parent for three of the QTL regions (Additional File10.).
讨论
小麦的抗稻瘟病性具有发育阶段特异性
小麦爆炸可以影响早期幼苗阶段的小麦植物直到晚期生殖阶段,以可比的爆炸方式观察到水稻中的叶片和胰腺[1].一些研究比较了小麦品种在营养和生殖生长阶段的抗性,但结果还不确定,因为在苗期和抽穗期抗性之间都存在正相关或负相关[17.那18.那24.].在我们的研究中,两个群体的苗期和头瘟得分之间存在显著的正相关关系,但不同发育阶段与头瘟相关的QTL并不一致。这与Cruz等人的观察结果相似[17.他在一项对美国小麦品种的研究中发现,叶期和抽穗期的稻瘟病症状之间存在正相关关系,但他指出,在穗部观察到的表型中,只有57%可以用苗期的表型解释。本研究在br18 × BRS 179群体的2B染色体上发现了与苗期和穗部稻瘟病相关的QTL, QTL位于83.8 cM(参考cv的峰值标记为616,934 4,668 bp)。中国春季序列)和98.8 cM(峰值标记703,976,058 bp)。虽然两个QTL的置信区间部分重叠,但峰标记的位置表明它们可能是单独的QTL,因为作图距离对应于参考cv中峰标记之间87.0 Mb的物理距离。中国的春天。的Rmg8r基因也位于六倍体小麦的2B染色体上[10.],但已被定位于2B长臂的远端区域,这表明它不太可能代表本研究中看到的QTL。
在4B染色体上鉴定出2个QTL。QTL的QSdl.jic-4B.1和QSdl.jic-4B.2were identified at 129.4 cM (peak marker at 621,326,999 bp) and 127.4 cM (peak marker at 650,634,242 bp) in the Anahuac 75 × BR 18 and BR 18 × BRS 179 populations, respectively. Somewhat surprisingly, while BR 18 contributed the resistant allele in the Anahuac 75 × BR 18 population, it contributed the susceptible allele in the BR 18 × BRS 179 population. It is possible that the genes underlying this seedling-specific resistance form an allelic series or that independent but closely linked genes account for the difference in the contribution to resistance by BR 18 in the two populations. We also identified QTL associated with seedling and heading stage resistance on the long arm of chromosome 5A in both populations. BR 18 conferred the susceptible allele for a seedling QTL in the BR 18 × BRS 179 population at 233.5 cM (peak marker at 678,229,352 bp), whilst Anahuac 75 contributed the susceptible allele for a heading stage QTL in the Anahuac 75 × BR 18 population at 216.5 cM (peak marker at 595,145,761 bp). As there is a physical distance of 83.0 Mb between the peak QTL markers in the reference cv. Chinese Spring, it is unlikely that these are the same QTL. However, it is possible that the differential resistance contributed by BR 18 alleles on chromosome arm 5AL may be due to the presence of closely linked genes associated with seedling and heading stage resistance which are found within this region. Additional mapping studies using other wheat populations will determine whether these regions have an important association with blast resistance.
在麦锈病害系统,幼苗阻力在所有发育阶段提供阻力,并且常常种族特异性[29.].苗期抗性以专业授予R.这些基因通常编码核苷酸结合位点富亮氨酸重复序列(NBS-LRR)结构域蛋白。在植物发育后期表达的抗性属于成虫抗性(APR)。的Lr34, APR基因的最佳特征之一,仅在8°C以下的温度下对幼苗产生抗性,但在成年植株中提供持久的、部分的抗锈病[30.].在水稻稻瘟病系统中,叶期和穗期的抗性似乎各不相同R.基因。的NBS-LRRPB1赋予抗稻瘟病仅在穗,并且因此被认为是一个APR基因[31.], 同时Pi64,也编码NBS-LRR,在叶片和穗部均对MoO分离株具有抗性[32.].在我们的研究中,我们鉴定了几个针对特定发育阶段的QTL,如4B上的苗期特异性QTL。然而,在苗期和抽穗期的稻瘟病评分之间也存在中度正相关,这一结果也在美国小麦品种组中观察到[17.],这可能表明某些抗苗基因座在抽穗期确实起作用。这些位点的作用可能被其他在植物发育后期表达的基因所掩盖,只在头部产生抗性。但作为苗期抗性的主要QTLQSdl.jic-4B.2(24.8% var)在抽穗期未被鉴定出来,这表明具有更强抗性的基因座在穗部也具有抗性的可能性较小。疾病表型评分的直方图表明,与幼苗试验相比,头部试验的易感性水平更高。2和4.),也提示可能存在苗期特异性抗性基因。因此,我们的研究为小麦苗期和抽穗期抗稻瘟病可能受不同基因控制提供了遗传学依据,这一发现对小麦抗稻瘟病育种具有重要意义。由于稻瘟病对粮食生产的影响,开花期间的稻瘟病发展被认为是最具破坏性的,但在苗期严重感染可导致植株死亡,也为疾病的进一步传播提供了接种源。为了确保在植物发育的这两个重要阶段都具有抗性,我们的研究结果表明,在营养和生殖阶段赋予抗性的基因可能需要结合到一个品种中,这一过程需要开发遗传标记,通过育种计划跟踪有利等位基因的存在。
小麦稻瘟病与白粉病的联系
虽然一些论文已确定在爆炸小麦相关QTL,在大麦最近的一项研究发现了两个QTL,在染色体1H和7H,使用分离贸易部BR32 [20.].在相同的研究中,几种Blast QTL与已知的粉末状霉菌抗性基因共同定位,例如映射在5cm的抗性基因范围内的7H QTLMLT.在我们的研究中,接种MoT BR32分离物并没有在7A、7B或7D染色体上鉴定出任何与稻瘟病相关的QTL,这表明它不太可能与小麦的同源基因有关MLT此区域内。在大麦,Aghnoum等。[20.]没有看到与使用BR32分离高炉和霉菌在1H的关联,但作者并观察稻瘟病QTL的共定位与霉抗性基因座Mla6使用moo guy11隔离。基因RMo1对MoO Ken 54-20分离物具有几乎完全的抗性,也与MoO Ken 54-20分离物共分离MLA轨迹上的1H的大麦短臂[33.].两个小麦的同源物MLA轨迹是Sr33和Sr50,其提供茎锈病抗性和位于染色体1D [短臂34.].虽然在我们的研究中没有发现任何1D上的QTL,QHead.jic-1A在臂1AS染色体上与Sr33。In natural environment conditions the mildew susceptibility of the Anahuac 75 × BR 18 and BR 18 × BRS 179 populations was assessed over two years and no association with powdery mildew on 1A or 1D was observed (Unpublished observations, R Goddard). AsSr33并不已知与在小麦白粉病抗性相关,这是不可能有小麦稻瘟病和防霉性上1A之间的关系。
br18 - terena的抗性是定量的
在本研究中有9个与小麦瘟病相关的QTL。这些QTL的表型效应最大,为24.8%,表明br18的抗性是数量抗性。同时R.基因通常编码NBS-LRR结构域蛋白,定量抗性的基础的基因更多样化,在防御信号角色,基底的防御机制和毒素解毒[35.].4月的基因的Lr34编码ATP结合盒(ABC)转运蛋白,其提供经久耐几个植物病原体,并已显示出诱导通过脱落酸(ABA)调节的基因,在植物 - 病原体相互作用中起关键作用[植物激素36.].另一个APR基因Yr36的编码小麦激酶START1(WKS1.),赋予小麦条纹锈病的抵抗力(柄锈菌striiformisf . sp。tritici),通过蛋白磷酸化诱导产生褪绿和活性氧(ROS) [37.].有趣的是,最近的研究表明,BR 18具有基础抗性机制更大的活化以下贸易部感染,相比感病品种BRS Guamirim [38.].在br18的剑叶中,苯丙氨酸解氨酶(PAL)和多酚氧化酶(PPO)等防御酶的产量更高,抗氧化酶超氧化物歧化酶(SOD)的产量也更高,SOD保护细胞免受病原菌侵染后产生的过量ROS [38.].因此,这可能是一些BR 18的背景中所确定的QTL背后的基因可能在基础性反应中起作用。
定量抗性一般被认为比R.基因介导的抗性,因为它不太可能被不断变化的病原体种群克服[39.],其可以跨越几个环境和具有不同解释为什么BR 18示出了电阻m . oryzae隔离(6.那22.].在本研究中,br18在抽穗期对2B、4A、5A 3个QTL提供抗性。在巴西小麦品种组中,11.0%的品系在一个以上的QTL区域表现出类似br18的单倍型。这些品系中的几个,如Quartzo、Fundacep Raizes和TBIO Sinuelo,在所有三个QTL区域都具有类似BR 18的单倍型,在巴西塞拉多地区的田间条件下也被证明对抽穗期的稻瘟病表现出中等抗性[40].这表明,选择用于在图2A,图4B和5A中的QTL区域内的BR 18单倍型可提供对小麦抗稻瘟病的在抽穗期,这可能通过引入种族特异性电阻可进一步提高基础水平。一些研究已经观察到,在某些条件下BR 18可以显示中等敏感性[24.那41.].在本研究鉴定的9个QTL中,br18为6个QTL赋予了抗性等位基因,表明br18既有与稻瘟病抗性相关的正等位基因,也有与稻瘟病抗性相关的负等位基因。高度敏感的anhuac 75和中抗性的BRS 179也贡献了抗性等位基因,这表明br18的抗性还可以进一步提高。在苗期抗性和抽穗期抗性上,两个群体均发生了越位分离,表明亲本系通过在后代中组合不同的等位基因可以提高抗性。有趣的是,两个种群的抗性都是定量遗传的,然而几个ril的表型表明对MoT BR32分离株有接近免疫。这让人想起在大麦上的一项研究,在该研究中,CGN02857的完全抗性预计是单基因遗传,但观察到多基因抗性[20.].这表明大麦和小麦的个体遗传都可能表现出一种质的表型m . oryzae感染尚表现出定量抗性。
发展稳定的小麦抗抗抗性
确定数量抗性和R.在像巴西这样的国家,MoT病原体种群是多样化的,并且已建立良好的体系,因此,可能渗入到单一品种的基因对于帮助控制疾病尤其重要[24.].在水稻中,3个弱抗性QTL与主抗性QTL的叠加R.基因PI-TA和π已证明对几种分离株的blast resistance有积极的加性作用[42.].这证明了组合定量和的优点R.基因介导的抗性,只要了解抗性之间的上位性相互作用。在小麦中,新鉴定的稻瘟病抗性基因RmgGR119已被证明以一种附加的方式与Rmg8以增加抵抗巴西BR48分离物[43.].这表明,也有可能结合定量抗性,如在BR 18中看到的,与已知的R.类似的基因Rmg8和RmgGR119培育具有品种特异性和广谱抗性的小麦品种。一些R.基因,如Rmg2和RMG3,而2NS易位已经被证明对近期的治疗效果较差m . oryzae隔离(1那15.],结合耐药性来源将是防止进一步严重疾病暴发的关键。有趣的是,作为m . oryzae2016年从孟加拉国受感染小麦分离的菌株被发现与巴西分离株PY0925和BR32最密切相关[4.],本研究鉴定的br18抗性QTL也可能在孟加拉国有潜在的应用价值。还需要在孟加拉国用BR 18和其他具有稳定抗性的巴西品种进行额外试验,以确定这些抗性是否适合该特定环境。
结论
本研究首次从br18遗传背景研究小麦的抗稻瘟病性。由于BR 18已在巴西育种计划中广泛应用了几十年,不仅因为它具有稳定的抗稻瘟病能力,而且还因为它具有优越的品质性状和在恶劣环境条件下生长的能力[44.,了解这些有利特征背后的基因是特别重要的。我们共鉴定了9个与稻瘟病相关的QTL,表明抗性是定量的,其中6个位点的抗性等位基因为br18。重要的是,我们还发现,苗期和穗部的抗稻瘟病性似乎不是由同一位点控制的,这对小麦在不同发育阶段的抗稻瘟病育种具有指导意义。在br18和其他具有稳定抗性的品种中,与稻瘟病抗性相关的基因组区域的鉴定应有助于开发遗传标记,以便在育种计划中跟踪和结合这些特定的抗性。改良与稻瘟病抗性相关的基因组区域对于开发与感兴趣的性状密切相关并适合于高通量基因分型的遗传标记非常重要。确定稻瘟病抗性位点是否对产量、品质或抗病有多效性影响,以便确定哪些抗性适合在育种计划中进行选择,这也是至关重要的。随着QTL研究的不断深入,哪些基因座具有新的抗性,哪些基因座已经渗透到现有小麦品种中也将变得很明显。这些信息最终将为小麦育种者提供更全面的知识,以有效地控制小麦瘟病。
方法
植物材料
弹簧的种子小麦品种BR 18特雷纳(未知谱系)44., anhuac 75 (I-12300//Lerma-Rojo-64/II-8156/3/Norteno-67) [44.和BRS 179 (BR 35/PF 8596/3/PF 772003*2/PF 813//PF 83899) [44.]由巴西南大区Passo Fundo的Embrapa小麦公司提供。众所周知,阿纳瓦克75号易受爆炸影响[22.],而brs179是中度抗/易受感染的[45.].BR 18-Terena was used as a common parent in the development of two bi-parental crosses by single seed descent: Anahuac 75 × BR 18 and BR 18 × BRS 179. For both populations the last single seed selection was made at the F6.代,以及总共188个重组近交系(RIL)对每个横显影。
真菌培养液
MoT病型分离物BR32,已完全测序[27.], was selected from the JIC culture collection and maintained at 25 °C [46.].每项试验的接种物都是由滤纸砧木m . oryzae保持BR32菌丝的毒力的分离株。简单地说,滤纸砧木在完全培养基琼脂(CMA)上在22℃下生长14天。然后将最初的培养皿进行继代培养,再生长14天,然后收获分生孢子。用6ml ddH冲洗培养板制备分生孢子接种物2O和用玻璃棒除去分生孢子。将所得的分生孢子悬浮液通过两层粗棉布过滤,将分生孢子密度用血球计计数。For both seedling and head assays the conidial suspension was adjusted to 0.3–0.4 × 106.分生孢子每毫升。
小麦爆炸表现型
到运输部幼苗电阻用离脱叶测定法评估,使用Chen等人的方法。[47.].在F种子6.在4°C的黑暗条件下,在含有滤纸和4 ml 2 μM GA的9 cm培养皿中培养48 h3.(西格玛奥德里奇)。种子转移到20°C 24小时,然后种植在96槽托盘,每个托盘一粒种子,在泥炭基堆肥。幼苗在18/15°C、16 h/8 h光暗周期下生长至第2叶期。取每株幼苗的第二叶片,切成8 cm的薄片,正面朝上,置于10 × 10 cm透明塑料板上1%水琼脂条之间。每个板检测6个RIL基因型,每个板检测单叶,所有板均含有敏感对照。考虑到种子的有效性,在anhuac 75 × br18试验中使用anhuac 75作为敏感对照,而在br18 × BRS 179试验中使用Hobbit-sib (Dwarf A)。每个基因型接种5个重复的叶片。用气刷喷雾器对叶片喷施BR32分生孢子悬浮液,体积为25 ml / 15盘。盘子的盖子被H2O操作增加湿度和板平放于塑料托盘,一个透明的塑料盖的内侧。Trays were kept in the dark for 24 h after inoculation and incubated at 24 °C under a 16 h/8 h light-dark photoperiod. At 6 days post inoculation [dpi] leaves were scored for disease symptoms using a 0–6 scale (0 = no visible symptoms, 1 = pin-point brown necrotic lesions, 2 = brown necrotic lesions across the leaf, 3 = brown necrotic lesions and mild chlorosis of the leaf, 4 = grey lesions ringed with necrosis and chlorosis, 5 = extensive grey lesions and chlorosis across the leaf, 6 = grey sporulating lesions and water soaking across the entire leaf). A representative scoring scale can be seen in Additional File11..
使用脱离的头部测定评估头部的抗性。每种群,在幼苗阶段测试100条线和每个父母进行了测定。植物在2升盆中生长,含有基于泥炭型培养基,每罐三种植物,在18/15℃的玻璃盆中,在16 h / 8 H光黑暗的光周期下。在Zadoks生长阶段61(GS61)[48.在倒数第二节和最后一节之间,花头从茎上脱落。再次切茎,在水下,在终末节上方,直立放置于200 μl塑料移液头盒中2O.总共12名分离的头被包括每盒。最小的三个重复,从三个不同的植物,分别每基因型接种。头被喷到运行了与BR32分生孢子悬浮液,和盒子置于传播托盘和盖上塑料盖。Trays were kept in the dark for 24 h after inoculation and misted with H2O,增加湿度,促进真菌生长。盒子在24°C, 16 h/8 h的光暗周期下孵育。9 dpi头使用0 - 6范围内疾病症状得分(0 =没有明显症状,1 =顾客棕色病变,2 =小棕色病变,3 =棕色病变,漂白的颖片很小的区域,4 =几个棕色病变,漂白的颖片,5 =漂白的颖片,6 =完成漂白的头)。一个有代表性的评分标准可以在附加文件中看到12..
双亲群体的基因分型
对于从3周龄幼苗的人口叶片,采样,每种基因型采样六个幼苗池。使用Pallotta等人描述的方案提取基因组DNA。[49.].Axiom®35k小麦育种仪阵列[28.使用Affymetrix GeneTitan®分析仪以384样本格式(Bristol Genomics Facility, Bristol University, Bristol)对两个群体进行基因型分析。数据调用使用Axiom®Affymetrix分析套件(版本2.0.0.35),使用六倍体小麦的“Axiom®最佳实践基因分型工作流”。对于这两个群体,单形标记和缺失亲本基因型数据的标记被从分析中删除。基因型对多态标记的要求在附加文件中提出13..每个种群的遗传连锁组是使用MST地图的在线版本创建的[50.].从分析中省略了具有超过20%缺失数据的标记,并且链接需要映射尺寸阈值和15cm的映射距离阈值。Kosambi映射功能用于计算标记之间的遗传距离。从最终连杆基团中除去基因冗余标记,并根据IWGSC Refseq V1.0订购每种染色体的标记顺序[51.]小麦基因组组件为CV。中国春。
统计和QTL分析
表型性状的方差分析是通过Genstat第20版中的一般线性模型(GLM)进行的[52.].对于苗期和头期试验,平板/箱试验、重复试验和基因型试验均作为模型项。为了确定苗期与爆头试验之间的关系,计算了Pearson相关系数。在每个GLM内计算所有数据集的每个RIL的预测平均值,并用于QTL分析。采用单性状、单环境分析在Genstat上进行QTL分析。对于所有的分析,一个QTL的对数优势值(LOD)评分为3.0才被认为是显著的,并且绘制的步长为5 cM。首先使用简单区间作图(SIM)进行QTL检测,然后使用候选QTL作为辅助因子进行至少两轮复合区间作图(CIM)以确定QTL位置。通过拟合QTL模型估算QTL效应,并根据推荐的QTL命名规则分配QTL名称。QTL图像使用MapChart制作[53.].
巴西小麦品种单倍型分析
100个巴西小麦品种的种子由巴西Embrapa小麦公司提供(附加文件)9.)使用CTAB方法提取DNA [54.].该小组使用小麦90k Infinium iSelect试验进行基因分型[55.在Bristol Genomics Facility (Bristol University, Bristol)进行单核苷酸多态性(SNP)调用,使用Wang等人描述的方法[55.以获得81587个snp的原始数据。SNPs与IWGSC RefSeq v1.0组装对齐[51.并根据它们的染色体位置进行排序。杂合子SNP调用被归类为缺失数据,缺失数据超过5.0%的SNP被剔除。对已鉴定的抽穗期QTL,确定了QTL侧边标记在LOD 3阈值处的物理位置。对QTL区间内的标记进行鉴定,并将巴西品种面板的基因型调用与抗性亲本的基因型调用进行比较9.).在限定的QTL区域内,与抗性亲本表现出98.0%相同基因型的品种,即为抗性亲本单倍型。
数据和材料的可用性
本研究期间生成或分析的所有数据都包含在本发布的文章及其补充信息文件中。
缩写
- 全球语言监测机构:
-
一般线性模型
- Moo:
-
magnaporthe oryzae oryza致病型
- MOT:
-
Magnaporthe oryzae小麦属植物致病型
- QTL:
-
定量特质基因座
- 瑞来斯:
-
重组自交系
- SNP:
-
单核苷酸多态性
参考文献
- 1。
小麦瘟病:移动中的危险。植物学报。2017;42(3):210-22。
- 2。
五十岚S,Utiamada CM,五十岚LC,万马AH,洛佩斯RS。Ocorrência德稻瘟病请不要访问Paraná。Fitopatol胸罩。1986;11:351-2。
- 3.
Ceresini PC, Castroagudin VL, Rodrigues FA, Rios JA, Aucique-Perez CE, Moreira SI,等。小麦瘟病:从起源于南美到成为全球威胁。植物学报。2019;20(2):155-72。
- 4.
伊斯兰MT, Croll D, Gladieux P, Soanes DM, personons A, Bhattacharjee P,等。在孟加拉国出现的小麦瘟病是由一个南美血统的magnaporthe oryzae..BMC BIOL。2016; 14:11。
- 5。
Goulart Acp,Souza PC,Urashima。Danos Em Trigo Careados PelaInfecçãoPORPyricularia盘菌.总结Phytopathol。2007;33:358 - 63。
- 6。
Kohli MM, Mehta YR, Guzman E, De Viedma L, Cubilla LE。稻瘟病稻瘟病对小麦种植构成威胁。中国植物遗传育种杂志。2011;47:S130-S4。
- 7。
Castroagudín VL, Ceresini PC, de Oliveira SC, Reges JTA, Maciel JLN, Bonato ALV, et al。对qi杀菌剂的抗性在巴西小麦稻瘟病菌种群中广泛存在magnaporthe oryzae..植物病理学。2015; 105(3):284-94。
- 8。
Dorigan AF, de Carvalho G, Poloni NM, Negrisoli MM, Maciel JLN, Ceresini PC。对三唑类杀菌剂的耐药性羊草物种与巴西麦田的侵入性植物有关。Acta Scientiarum农学。2019; 41:E39332。
- 9。
Makaju SO, Jones K, Adhikari L, Kim DW, Khang CH, Missaoui AM。一年生黑麦草种质对高度侵袭性的新品系稻瘟病(灰叶斑病)的抗性。作物学报,2016;30(3):311-22。
- 10。
等。Rmg8,抗性新基因小子隔离的Pyricularia oryzae在普通小麦。植物病理学。2015; 105(12):1568至1572年。
- 11.
张世文,陈志强,陈志强,等小子隔离的magnaporthe oryzae.在小麦。51基因组。2008;(3):216 - 21所示。
- 12.
王淑珍,王淑珍,王淑珍,等。Rmg8和Rmg7,小麦基因的小麦稻瘟病抗性,识别相同的无毒基因AVR-Rmg8.莫尔植物途径。2018; 19(5):1252-6。
- 13。
Inoue Y, Vy TTP, Yoshida K, Asano H, Mitsuoka C, Asuke S, et al.;小麦稻瘟病菌通过宿主特异性决定因子的功能损失的进化。科学。2017;357(6346):80 - 2。
- 14。
高林林,王志强,王志强,等。植物寄生的基因对基因的关系燕麦属/小子隔离的Magnaporthe Grisea.对小麦品种。植物病理学。2002;92(11):1182 - 8。
- 15。
Cruz CD, Peterson GL, Bockus WW, Kankanala P, Dubcovsky J, Jordan KW,等。2NS易位偏凸山羊草赋予阻力小子致病型的magnaporthe oryzae..作物科学。2016;56(3):990 - 1000。
- 16。
TéllezLC,查韦斯A,Bobadilla N,Perez-Etigarribia P,Kohli M.面包小麦的可变抗性(小麦)线路携带2ns / 2as易位到小麦爆炸。植物品种。2019; 138(1):62-8。
- 17。
陈志强,陈志强,陈志强,等。美国小麦品种抗病性初步评价小子致病型的magnaporthe oryzae..工厂说。2012;96(10):1501 - 5。
- 18。
Martinez SI, Sanabria A, Fleitas MCPyricularia oryzae对籽粒品质的影响。沙特国王大学学报(自然科学版)2019;31(2):150-7。
- 19。
王BH,Ebbole DJ,王ZH。之间的军备竞赛magnaporthe oryzae.和米:多样性和相互作用AVR.和R.基因。农业工程学报。2017;16(12):2746-60。
- 20.
aghnoum r,bvindi c,menet g,d'hoop b,maciel jln,niks Re。大麦抵抗三种病理型的宿主/非健康状况及遗传学Magnaporthe稻瘟病真菌。Euphytica。2019; 215(7):116。
- 21.
伊斯兰MT, Kim KH, Choi J.小麦爆炸在孟加拉国的现状和未来影响。植物学报2019;35(1):1 - 10。
- 22.
浦岛AS,Lavorent NA,古拉特ACP,梅塔YR。小麦品种和毒力多样性的抗力谱Magnaporthe Grisea.在巴西隔离。Fitopatol胸罩。2004;29:511-8。
- 23.
马西埃尔JLN。疾病影响小麦:小麦爆炸。剑桥:伯利兹科学出版社有限公司;2019年第155-69。
- 24.
马西埃尔JLN,Ceresini PC,Castroagudin VL,砸落男,科玛GHJ,麦当劳BA。人口结构和小麦爆炸病原体的致病型多样性magnaporthe oryzae.在巴西出现后25年。植物病理学。2014; 104(1):95-107。
- 25.
Sousa pg。BR 18-Terena:巴西的小麦品种。Pesq Agrop Brasileira。2002; 37:1039-43。
- 26.
Sousa CN, Caeirão e .栽培:巴西的籼稻para品种e Instituições criadoras 1922 a 2014。巴西:Embrapa小麦;2014.p . 90 - 144。
- 27。
Chiapello H,Mallet L,Guerin C,Aguileta G,Amselem J,Kroj T等人。从真菌中解密基因组含量和分离物的进化关系magnaporthe oryzae.攻击不同的宿主植物。基因组生物学进展。2015;7(10):2896-912。
- 28。
Allen AM, Winfield MO, Burridge AJ, Downie RC, Benbow HR, Barker GLA等。适用于全球六倍体面包小麦高通量SNP基因分型的小麦育种家阵列的特性(小麦).植物生物技术J. 2017; 15(3):390-401。
- 29。
埃利斯JG,Lagudah ES,斯皮尔梅伊尔W,兹PN。培育抗锈小麦的过去,现在和未来。前植物SCI。2014; 5:641。
- 30.
kattinger SG, Lagudah ES, Spielmeyer W, Singh RP, Huerta-Espino J, McFadden H, et al.;一个假定的ABC转运体赋予小麦对多种真菌病原体的持久抗性。科学。2009;323(5919):1360 - 3。
- 31.
林林,井上,加藤,船男,Shirota M, Shimizu T,等。持久穗部抗稻瘟病基因PB1编码一个非典型CC-NBS-LRR蛋白,并通过局部基因组复制获得启动子生成。植物j . 2010; 64(3): 498 - 510。
- 32.
马军,雷春林,徐晓婷,郝凯,王金龙,程志军,等。Pi64,编码一种新的CC-NBS-LRR蛋白,赋予水稻对叶颈病的抗性。植物与微生物相互作用学报。2015;28(5):558-68。
- 33。
Inukai T, Vales MI, Hori K, Sato K, Hayes总理。RMo1在大麦中具有抗稻瘟病的能力,并且位于包含抗稻瘟病基因的复合体中MLA,一种抗白粉病基因。植物与微生物的相互作用。2006;19(9):1034-41。
- 34。
Mago R,张P,Vautrin S,Simkova H,Bansal U,Luo Mc,等。小麦Sr50基因揭示了在谷物抗病基因多样性丰富。自然植物。2015; 1(12):15186。
- 35。
波兰JA,巴林特-Kurti PJ,Wisser RJ,普拉特RC,尼尔森RJ。灰色地带:定量抗病的世界。趋势植物SCI。2009; 14(1):21-9。
- 36。
张志强,张志强,张志强,等。脱落酸是耐久小麦抗病基因编码的ABC转运体的底物的Lr34.新植物。2019; 223(2):853-66。
- 37。
王胜,李庆平,王金飞,闫艳,张国良,闫艳芳,等。YR36 / WKS1- 介导的磷酸化PsbO,是光系统II的外部成员,抑制光合作用并赋予小麦抗条锈病能力。摩尔。2019;12(12):1639 - 50。
- 38。
席尔瓦ET,里奥斯JA,阿劳约MUP,西尔韦拉PR,罗德里格斯FA。普通小麦旗叶和穗部的防御反应小麦对稻瘟病的基础抗性水平比较高的品种Pyricularia oryzae.植物别墅。2019; 68(4):645-58。
- 39。
Pilet-Nayel ML, Moury B, Caffier V, Montarry J, Kerlan MC, Fournet S,等。持久作物保护的金字塔策略对植物病原体的数量抗性。植物科学学报2017;8:1838。
- 40.
Fronza VME,Maciel Jln,Silva Ms,Scheeren PL,Soares SJ。巴西小麦品种在CerradoRegión的小麦爆炸反应。在:摘要书籍:第五届富士兴主题国际研讨会麦芽爆炸第二次国际研讨会;2016年。
- 41.
Rocha J, de Paula IG, Gloria HB, Pimentel AJB, Ribeiro G, de Souza MA。小麦营养和生殖阶段抗稻瘟病基因型的筛选。Euphytica。2019;215(3):59。
- 42.
陈小林,贾玉林,贾明华,品松SRM,王学勇,吴斌斌。水稻抗稻瘟病主要基因间的功能相互作用PI-TA和π,和次要抗稻瘟病数量性状位点。植物病理学。2018; 108(9):1095-103。
- 43.
王淑珍,王世忠,王淑珍,等。一种新的抗性基因与Rmg8具有很强的抵抗力小子隔离的Pyricularia oryzae在一个普通的小麦地方品种。植物病理学。2018;108(11):1299 - 306。
- 44.
Caierãoe,Scheeren pl,Silva Mse,De Castro Rl。葡萄园释放的小麦品种历史,在四十年的研究中。作物品种苹果生物科技。2014; 14(4):216-23。
- 45.
Cruz M,Prestes Am,Maciel JLN,Scheeren PL。DestéticoNostéticoNostáticoNostátádiosdopleraJoveme depleta everajovem e de planta evera jovem e de planta evera jovem e de planta everajovem e de planta evera jovem e de planta evera jovem e de planta e De Planta Astorala。Trop Plant Pathol。2010; 35:24-31。
- 46.
Tufan HA, McGrann GRD, Magusin A, Morel J-B, Miche L, Boyd LA。小麦稻瘟病:适应和非适应的组织病理学和转录组重编程Magnaporthe隔离。新植醇。2009;184(2):473 - 84。
- 47.
Chen X, Steed A, Travella S, Keller B, Nicholson P。Fusarium Graminearum.利用乙烯信号在双子叶植物和单子叶植物中殖民。新植醇。2009;182(4):975 - 83。
- 48.
Zadoks JC,Chang TT,Konzak CF.对于谷物生长阶段十进制代码。杂草res。1974; 14(6):415-21。
- 49.
帕洛塔MAWP,福克斯RL,Kuchel H,杰弗里斯SJ,Langridge P.标记辅助小麦在澳大利亚南部地区繁殖,第十届国际小麦遗传学研讨会论文集;2003.789-91。
- 50.
吴艳红,王志军,王志军,王志军。基于最小生成树的遗传连锁图谱构建方法。公共科学图书馆麝猫。2008;4(10):11。
- 51.
国际小麦基因组测序联盟(IWGSC)。利用完全注释的参考基因组改变小麦研究和育种的限制。科学。2018;361:661。
- 52.
VSN International。GenStat为窗口第20版。赫默尔亨普斯特德:VSN国际;2019年。
- 53.
Voorrips RE. MapChart:图形化表达连锁图和qtl的软件。J在这里。2002;93(1):77 - 8。
- 54.
尼科尔森P,酒糟AK,毛林N,帕里DW,Rezanoor HN。一PCR检测方法的建立,以确定和量化微结节nivalevarnivale和微结节nivalevar杰斯在小麦。physiol mol植物疗法。1996; 48(4):257-71。
- 55.
王SC,黄DB,福雷斯特K,阿伦A,超SM,黄BE等。使用高密度90000单核苷酸多态性阵列多倍体基因组小麦多样性的表征。植物生物技术J. 2014; 12(6):787-96。
致谢
作者感谢Luzie Wingen(JIC),为IWGSC Refseq V1.0组装提供了90 K Iselect SNP的对准。
资金
所有作者都由双边BBSRC-embrapa Newton基金项目(BB / N019113 / 1)提供资金。JRF由CAPES提供资金(88882.157188 / 2017-01和88881.133721 / 2016-01)。该资助者在研究设计,数据收集和分析中没有作用,决定发布或准备稿件。
作者信息
从属关系
贡献
PN、CU、JC、PLS、JLNM、EC、GAMT、LC、FMS和JMCF对实验进行了构思和设计。RG、AS、CC和JRF进行实验。RG, AS和PN对数据进行分析。稿件由RG, AS, JS, CU, JC, PN撰写。所有作者阅读并批准了最终的手稿。
相应的作者
伦理宣言
伦理批准和同意参与
不适用。
同意出版
不适用。
相互竞争的利益
提交人声明他们没有竞争利益。
额外的信息
出版商的注意
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
补充信息
附加文件1:图S1。
QTL在Anahuac 75×Br 18 f中的1A上识别6.瑞来斯的人口。
附加文件2:图S2。
aanhuac 75 × BR 18 F的QTL为4A6.瑞来斯的人口。
附加文件3:图S3。
对anhuac 75 × BR 18 F的4B位点进行了QTL定位6.瑞来斯的人口。
附加文件4:图S4。
aanhuac 75 × BR 18 F的QTL定位在5A上6.瑞来斯的人口。
附加文件5:图S5。
对anhuac 75 × BR 18 F的6A进行了QTL定位6.瑞来斯的人口。
附加文件6:图S6。
QTL identified on 2B in the BR 18 × BRS 179 F6.瑞来斯的人口。
附加文件7:图S7。
QTL identified on 4B in the BR 18 × BRS 179 F6.瑞来斯的人口。
附加文件8:图S8。
QTL定位在br18 × BRS 179 F的5A上6.瑞来斯的人口。
额外的文件9。
在1A,2B,4A和5A QTL区域的100个巴西品种的单倍型数据。
附加文件10:表S1。
在抗1A穗头性状的QTL上,与anhuac 75的单倍型相似率为98.0%;在抗2B、4A和5A穗头性状的QTL上,与br18 - terena的单倍型相似率为98.0%。
附加文件11:图S9。
代表性分离的叶子测定0-6评分比例。比例条表示1cm。
附加文件12:图S10。
代表性分离头试验0-6评分量表。比例条表示1cm。
附加文件13。
AnaHuac 75×Br 18和BR 18×BRS 179 F的基因型和表型数据集6.ril种群。
权利和权限
开放访问本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信贷额度中另有说明。
关于这篇文章
引用这篇文章
戈达德,R.,斯蒂德,A.,奇诺伊,C.et al。对巴西小麦品种Br 18-Terena的小麦爆炸抗性的遗传基础。BMC植物BIOL.20.398(2020)。https://doi.org/10.1186/s12870-020-02592-0.
收到了:
公认:
发表:
关键字
- 小麦爆炸
- magnaporthe oryzae.
- 定量特质基因座
- 幼苗抵抗
- 头阻力
- 单核苷酸多态性(SNP)基因分型
- 小麦