抽象的
背景
目前,烤烟的明显,均匀性和稳定性(DUS)测试(尼科尼亚塔哈瓦姆L.)取决于现场形态鉴定,这是有问题的,因为它是劳动密集,耗时,易受环境影响的影响。为了提高烟草DUS测试的效率和准确性,迫切需要开发分子标记的遗传多样性识别方法。
结果
总共有91个简单的序列重复(SSR)分别以多态性信息含量,NEI指数和SHANNON信息指数值分别获得0.3603,0.4040和0.7228的多态性信息含量,NEI指数和多态性放大带的重复(SSR)标记。聚类分析表明,33项研究品种是烤烟烟草DUS测试的标准品种,都可以彼此区分。进一步分析表明,至少需要25个标记来识别这些品种的遗传多样性。按照每个连杆组两个标记的原理,选择48对SSR标记物。相关分析表明,48SSR标记显示的遗传关系与使用91 SSR标记的那些一致。
结论
使用48 SSR标记构建了33种标准品种的烤烟的遗传指纹,开发了一种用于新烟草品种的SSR标记的识别技术。该研究提供了一种可靠的技术方法,用于确定新烟草品种的新颖性,为新烟草品种的认证和保护提供了坚实的技术基础。
背景
需要新的植物品种来提高农业生产和效率。保护植物新品种的知识产权是一种成熟的做法,也是人类文明进步的标志[1].植物新品种保护离不开一系列技术条件的支持。区别性、一致性和稳定性(DUS)是保护植物新品种的三个技术和科学标准[2那3.]1999年,中国正式加入《植物新品种保护公约》,成为国际植物新品种保护联盟(UPOV)成员。以UPOV DUS测试指南为例,中国制定了一系列作物DUS测试指南,并在植物新品种保护中推广使用这些指南[3.].2002年,UPOV发布了烟草的第一个DUS测试指南(尼科尼亚塔哈瓦姆L.)[4.].此后,中国制定并发布了第一个国内烟草DUS测试标准,即《烤烟独特性、均匀性和稳定性测试导则》(尼科尼亚塔哈瓦姆l .;YC / T 369-2010)[5.],这是基于对新品种的明显,均匀性,植物稳定性进行测试的一般指令(GB / T 19557.1-2004)[6.]及《全民戒烟计划》的烟草测试指引[4.].
DUS测试是一个复杂的技术过程[2那7.].目前,新植物品种的国内外DUS测试标准主要基于生物,农艺,质量和抗性特征的现场测量。例如,烤烟的中国DUS测试指南包括35个基本测量性状,其中16个特征必须测量16个特征[5.].在所有测量的特征中,用于候选人和近似品种中的一个质量特征或两种数量特征的差异用于判断明显。为了评估群体的均匀性,应采用至少95%的接受概率的1%的标准。为了评估候选品种的稳定性,应评估至少两个种植季节[4.那5.].
由于DUS检测是基于研究植物的明显形态特征,因此候选品种、标准品种和近似品种的结果和比较分析会受到环境因素的影响[8.].此外,不同的测试人员可能会受到影响不同的特征,导致某些特征评估中的不一致[9.].此外,所涉及的大量工作负载进一步增加了DUS测试中人为错误的可能性。应用基于分子标记的技术鉴定植物品种比传统DUS检测方法有几个优势,包括处理时间快、不受环境因素的影响和易于自动化[10]因此,基于分子标记的方法代表了快速DUS检测的新趋势[2那7.那11那12那13].在可用的许多分子标记技术中,简单的序列重复(SSR)分析被认为是新品种的DUS测试的理想选择[8.那14那15那16那17那18]标准作物品种的指纹识别[10那11那12由于多个相关优势,如SSR标记的丰度、高多态性和共显性[19那20SSR分析的稳定性、重复性和简单的操作步骤[10那21那22].
在本研究中,我们通过进行群体遗传学研究和构建33个标准烤烟品种的SSR指纹估算烤烟品种的清晰度,均匀性和稳定性来估计烟道固化的烟草品种的明显,均匀性和稳定性的基于分子标记的技术通常用于DUS测试[5.].为烤烟新品种的鉴定和保护提供了技术依据。
结果
遗传多样性分析
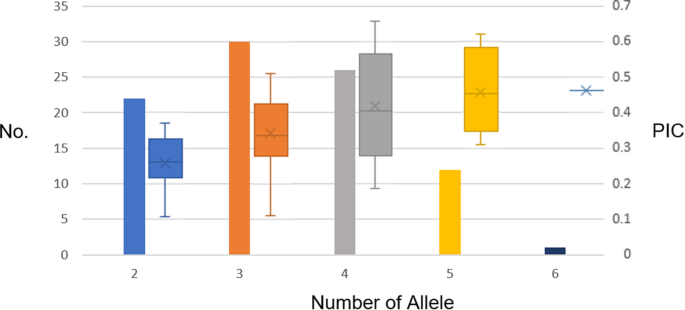
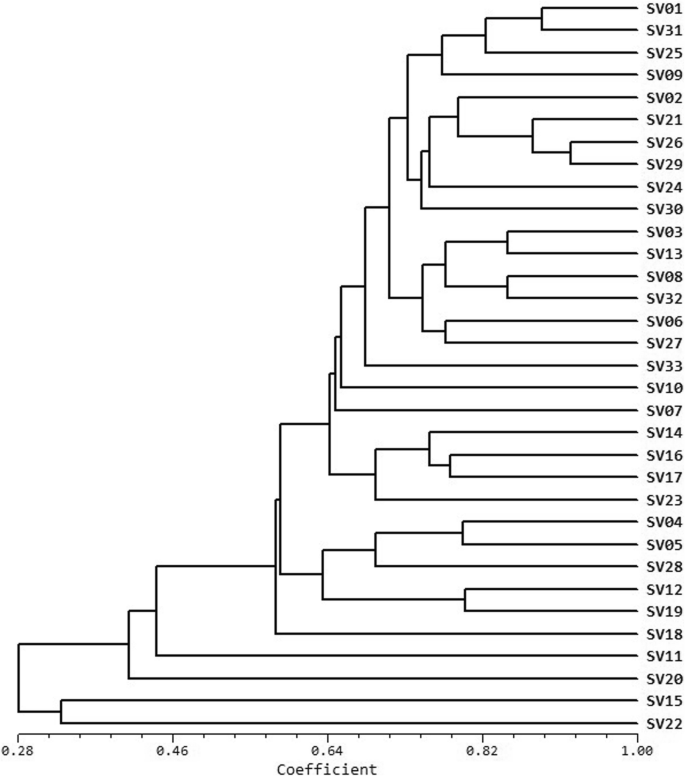
对270个候选SSR标记进行扩增,筛选出91对扩增带清晰的多态性SSR位点(附加文件)1:表S1)。在33个标准品种中对这91个SSR基因座的检查显示304个等位基因(每位基因座2-6个等位基因),平均每位基因座平均为3.34等位基因。这些等位基因包括67个罕见的等位基因,等位基因频率≤0.05。具有4或5个等位基因的SSR基因座也分别具有最多的罕见等位基因,28和22个罕见等位基因。这些罕见等位基因占稀有等位基因总数的75%。没有2个等位基因在基因座中检测到罕见的等位基因。91 SSR对的多态信息内容(PIC),NEI指数(H)和Shannon信息索引(I)分别为0.3603,0.4040和0.7228。等位基因编号的PIC值的BOXPLOT显示给定基因座的多态性随着等位基因的数量而增加(图。1).聚类分析表明,各种遗传相似性为0.5640±0.1744。根据具有算术平均值(Upgma)聚类树的未加权对组方法,可以使用91对SSR标记完全从彼此完全区分33个标准品种(图。2).
评估遗传多样性分析所需的最低引物数量
为了评估遗传多样性分析所需的最小底漆数,我们分析了测量的遗传多样性如何随着引物的数量而变化。从1个标记到90标记,重复每个标记数的随机采样试验50次,并且计算每个标记数的平均照片值。结果的散点图显示,随着标记的数量增加,PIC值逐渐倾向于平均照片值(图。3.).因此,使用更多的标记降低重复之间的变异系数(CV),如图底部的直方图所示。3.表演。通过计算CV趋势线,我们发现使用超过25个标记产生CV <5.0%,表明PIC值稳定。因此,25个标记的子集(在本研究中测试的91个标记中)足以揭示人群的遗传多样性。
利用SSR标记基因分型构建研究品种的遗传指纹图谱
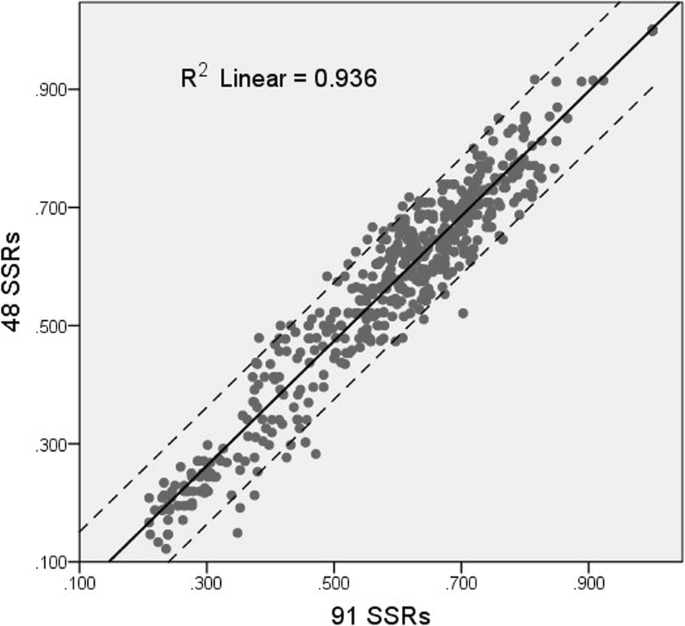
在使用每个连杆组的两个标记的原理之后,我们选择了从测试的91个标记中选择了48对SSR标记,用于建造常用于DUS测试的标准烤烟品种的遗传指纹。48标记的PIC,H和I值分别为0.3736,0.4223和0.7534。使用48对不仅符合最小底漆的要求,而且还足以完全区分33个品种彼此。此外,我们计算并绘制了遗传相似性基质,以比较48和91标记所显示的遗传关系的差异。散点图中的点沿着具有显着线性度的对角线布置,全部在线性配合的95%置信区间内。随后的相关性分析揭示了两组标记确定的遗传关系之间的显着相关性,具有0.967的Pearson相关系数(图。4.).
建设33个标准品种的SSR遗传指纹
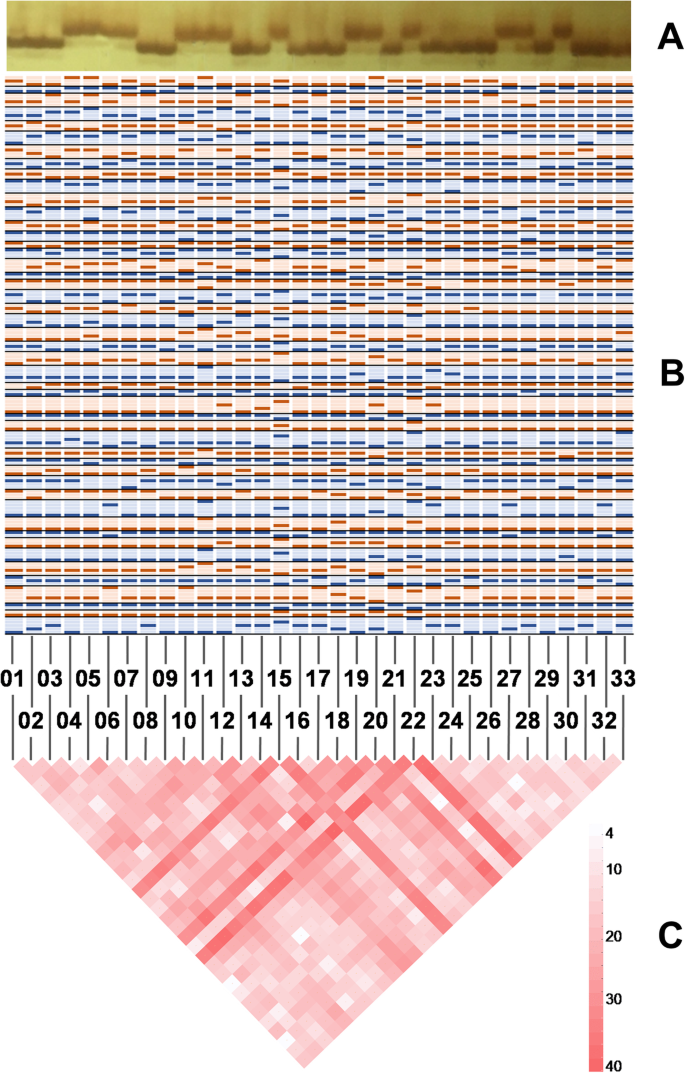
使用48对SSR标记构建了33个标准品种的遗传指纹,并产生了如图所示的带型。5.a-b.指纹包含162个等位基因,等位基因频率在0.0303到0.9394之间,平均等位基因频率为0.2963 ± 共有39个稀有等位基因,其等位基因频率为0.2897≤0.05.11个品种携带一个稀有等位基因,品种SV15、SV22、SV11和SV20分别含有15、7、6和4个稀有等位基因。供试品种间的分化位点数在4到40个之间,平均为20.15个 ± 7.716.图5.c表明,SV22、SV15和SV20比其他品种具有更多的分化位点,表明它们有着异常不同。
一个SSR标记PT50136的电泳图(原始电泳图见附加文件右侧2:图S1)。b使用48对SSR标记构建的33个标准品种的指纹带状图案。带状图案以蓝色和橙色交替排列以区分标记,并且每列代表各种列。c学习品种中差异化基因座数的三角矩阵
烤烟DUS检测的核心SSR标记
48对SSR表明,所有品种中至少有4个差异位点。因此,这套标记可用于烤烟新品种的分子DUS检测。因此,我们根据PCR带型筛选每个等位基因的参考品种。我们选择16个品种作为参考va品种:SV02、SV03、SV04、SV08、SV10、SV11、SV12、SV14、SV15、SV18、SV19、SV20、SV22、SV23、SV30和SV32。这16个品种都有一个特定等位基因的典型和清晰的扩增带。在使用48对SSR标记的DUS测试中,这些品种可以作为参考来评估候选品种的带型s根据表中给出的结果1。
讨论
在这项研究中,我们使用了一群标准烤烟烟草品种,通常用于DUS测试和扩增和评估的标志物基因座,其选自烟草的高密度SSR遗传联系地图。分析这些品种的遗传多样性揭示了PIC,H和I值分别为0.3603,0.4040和0.7228。这些值高于风扇等人在研究中提出的值。(pic = 0.299)[23],郑等 = 0.6567) [24, Dai等(PIC = 0.343) [25],基于同一遗传图谱。但是,我们的结果略低于Fricano等人。[26]徐等[27],这可能是因为弗里卡诺等人评估的人群。[26]徐等[27]不仅包括烤烟烟草,还包括众多其他品种。总体而言,DUS测试标准品种代表烤烟的表型和遗传变异。因此,这些品种可用于遗传研究,并构建一种用于鉴定烤烟品种的技术系统。
要合理评估种群的遗传多样性,需要有足够的遗传标记[28那29]。在不同物种中进行最小底漆的研究,如小麦(小麦L.)[30],大豆[甘氨酸最大(l)稳定。] [31)、野生稻(oryza rufipogon.女孩。)32],以及大米(栽培稻L.)[33那34].虽然我们的目标是揭示烟草品种之间的遗传差异,但我们还试图减少需要降低成本的标记数量,提高检测效率。我们发现,在本研究中评估的品种可以使用91对SSR标记完全不同于彼此的彼此区分,并且这些品种的遗传多样性类似于或略高于其他研究。然后,我们试图通过重复随机分配和遗传多样性系数的比较来减少引物的数量。模拟表明,只有25对SSR标记的子集是为了研究烤烟的遗传多样性。烟草是含有24对染色体的同种异体情况[35].为了保证每种染色体的相同数量的引物,选择48对SSR标记物。换句话说,每种染色体包含两对SSR标记。然后,除了由原始的91 SSR标记对揭示的那些之外,还分析了48 SSR标记对揭示的中断遗传关系之间的潜在相关性。两个SSR标记集显示的遗传关系彼此一致,其进一步证明了仅使用48对SSR标记。这接近米的最小SSR标记数,从50到70变化[33].特别是水稻和野生稻的遗传多样性显著高于烟草,进一步说明48对SSR标记足以研究烟草品种的遗传多样性。
在本研究中,通过使用48对SSR标记构建标准烤烟烟草品种的遗传指纹。因此,48SSR是核心标记,可应用于烤烟烟草品种的分子的DUS测试。来自YC / T 369-2010 [5.,本研究评价的33个品种差异明显,在4个SSR标记中差异最小。因此,利用上述48个SSR标记评价候选品种的差异时,候选品种与对照品种之间的差异标记数量必须在4个或4个以上;否则,候选品种与对照品种相似,按YC /T 369-2010进行田间表型鉴定[5.]或TG/195/1 [4.].因此,只需对相似品种进行田间试验,将大大提高DUS试验的效率。
目前,随着基因组研究和高通量测序的进展,单核苷酸多态性(SNP)标记已成为SSR标记的一个有吸引力的替代品[36那37].虽然单个位点的多样性水平低于SSR标记,需要更多的位点才能达到相同的SSR检测效果,但作为二态标记,SNPs可以提供客观、容易区分的结果,非常适合于DUS检测。利用SNPs进行作物品种鉴定的研究已经进行[38那39那40那41那42].接下来,我们打算对本研究中使用的33个品种进行重测序,以找到稳定可靠的SNP位点,并探索基于SNP的烟草DUS检测。
结论
利用48个SSR标记,对DUS检测中常用的标准烤烟品种进行遗传指纹分析。48个SSR标记被认为是未来烤烟DUS检测的核心SSR标记。分子SSR DUS检测将提高传统DUS检测方法的检测效率,同时降低成本。该方法对于保证新品种鉴定的客观性、公平性和准确性也至关重要。
方法
植物材料
33种标准烤烟品种(表2)由国家作物种质资源基础设施(NCGRI)提供;烟草、青岛)。
SSR标记
共选自前一项研究中的270种多态性SSR标记[23那43].
DNA提取
通过以下步骤进行33个品种的DNA提取。首先,将100毫克的新鲜叶片在液氮中研磨,并置于2ml EP管中。其次,加入了800μl萃取溶液(0.1mol / L Tris-HCl,0.2mol / L EDTA,0.1mol / L NaCl,10g / L钠Lauroyl Sareosine,pH 8.0),将管摇动5 min. Thirdly, 800 μL of an isometric phenol: chloroform: isoamyl alcohol (25: 24: 1) mixture was added, followed by shaking for 5 min, and centrifugation at 12000 rpm for 10 min. Fourthly, 600 μL of the supernatant was transferred to a new 1.5-ml centrifuge tube and isometric precooled isopropyl alcohol (− 20 °C) was added for DNA precipitation. Next, the sample was centrifuged at 12000 rpm for 10 min, and the supernatant was removed, followed by a wash with 75% ethyl alcohol and a rinse with pure alcohol. Lastly, the sample was dried on a sterile bench for 30 to 60 min until no alcohol residue remained, and the sample was suspended in 100–200 μL of ddH2O.
聚合酶链反应(PCR)扩增和电泳
在先前研究中报道的方法后进行PCR扩增和聚丙烯酰胺凝胶电泳[23那43].NaOH银染[44用于染色和显影聚丙烯酰胺凝胶。
数据分析
放大的SSR谱带模式使用二进制(0-1)数据格式记录在Excel 2013(美国雷德蒙微软公司)中。然后数据格式转换程序转换数据[45]输入PowerMarker v. 3.25的输入文件[46],ntsys v。2.10e [47],和波普金五世。1.32 [48].使用PowerMarker v来计算平均照片。3.25。H和i都使用popgene v计算。1.32。NTSYS v。2.10e用于计算遗传距离并绘制UPGMA集群树。软件SPSS v。22 [49用于生成Boxplots和散点图并执行相关性分析。每次标记数重复1-90个标记的随机取样50次,并计算平均照片值。一个Python(2.7)脚本用于随机采样实验和样品之间的PIC值变化的统计分析。其他数据分析和遗传指纹的插图在Excel 2013中进行。
数据和材料的可用性
在当前研究期间使用和/或分析的数据集可在合理的请求后从相应的作者获得(Min Ren,renmin@caas.cn).
缩写
- 简历:
-
变异系数
- DUS:
-
区别、统一、稳定
- H:
-
NEI索引
- 我:
-
香农信息指数
- NCGRI:
-
国家作物种质资源基础设施
- PCR:
-
聚合酶链反应
- 照片:
-
多态信息内容
- 补充说明:
-
Lauroyl钠肌肉酸钠
- SNP:
-
单核苷酸多态性
- 苏维埃社会主义共和国:
-
简单序列重复
- UPGMA:
-
算术平均无权对群法
- UPOV:
-
国际植物新品种保护联盟
参考文献
- 1。
王志刚,王志刚,王志刚。植物育种与生物技术的知识产权保护:相互作用与成果。作物科学。2016;56:1401-11。
- 2.
Bernet GP, Bramardi S, Calvache D, Carbonell EA, Asins MJ。分子标记在黄瓜新品种保护中的适用性。植物品种。2003;122:146-52。
- 3.
李Xh,李x,张世。新型植物品种保护与DUS测试技术系统。科学科学罪。2003; 36:1419-22。
- 4.
新品种。TG/195/1鉴别、均匀性和稳定性试验指导-烟草(尼科尼亚塔哈瓦姆L.)。日内瓦:UPOV;2002年。
- 5.
国家烟草垄断行政管理。YC / T 369-2010关于明显均匀性和稳定性烤烟的测试指南(尼科尼亚塔哈瓦姆L.)。北京:国家烟草垄断行政管理;2010年。
- 6.
全球质量监督管理局I和Q的C.GB / T 19557.1-2004关于新品种植物的明显,均匀性和稳定性的一般指令。北京;2004年。
- 7。
王yp,李海,沉q,张jh,王p,吴y。与米饭相关的分子标记物(栽培稻DUS测试中的性状。江苏农业科学杂志。2013;29:231-9。
- 8。
Singh RK, Sharma RK, Singh AK, Singh副总裁,Singh NK, Tiwari SP,等。定位序列标记微卫星标记在建立芳香稻特异性、均匀性和稳定性中的适用性。Euphytica。2004;135:135-43。
- 9。
邓林,韩智。花生荚品种鉴定和系谱分析的图像特征和DUS测试特征。食品农业学报。2019;99:2572–8。
- 10。
李XP,江LJ,刘N.SSR标记及其在玉米DNA指纹数据库建设中的应用。Mod Agric SCI Technol。2010; 26:47-9。
- 11.
Teng HT,LV B,张JY,Zhao Jr,Xu Y,Wang FG等。植物品种保护实践中涉及的DNA指纹轮廓。Biotechnol Bull。2009; 1:1-6。
- 12
张LW, Cai RR,元MH,道房颤,徐JT,林LH, et al。基于SSR标记的黄麻遗传多样性及DNA指纹分析。作物j . 2015; 3:416-22。
- 13
DNA标记在植物品种保护和登记中的应用。Theor Appl Genet. 2019; 132:1911-29。
- 14
程,施毅,沉WF,庄杰,杨舍。DNA指纹检测系统对水稻品种的建立与应用。adv activept。2008; 23:54-9。
- 15
陆格,吴谢,张德克,刘佛,陈,高gz等。基于SSR的表现性和均匀性评估油菜籽(芸苔栗鸟中国国家官方田间试验品种。农业科学。2008;41:32-42。
- 16
风扇JG,张海,龚·格,肖茹,郭SG,仁y等。SSR指纹数据库在西瓜DUS测试中SSR指纹数据库的构建与应用。j植物类型resour。2013; 14:892-9。
- 17。
王益,沉Q,张俊,李海,吴Y。基于SSR标记的DUS检测中大麦标准品种DNA指纹遗传多样性分析与建立。J triticeae作物。2013; 33:273-8。
- 18。
匡米,王宇,周越,方便,马l,杨wh。棉花棉签标准品种SSR指纹识别数据库的构建。科特斯科。2015; 27:46-52。
- 19。
王发方,杨勇,易敏敏,赵君荣,任军,王磊,等。基于ssr的我国玉米审定品种标准指纹库构建。中国农业科学。2017;50:1-14。
- 20。
桐ZJ,萧桦,娇FC,方德,曾吉姆,吴XF等。烟草中SSR标记的大规模开发,烤烟中的联动地图建设。品种sci。2016; 66:381-90。
- 21。
Becher SA,Steinmetz K,Weising K,Boury S,Peltier D,Renou JP等。天竺葵品种鉴定的微卫星。Thero Appl Genet.2000;101:643-51。
- 22。
刘志强,王志强,刘志强,等。茄子SSR富集文库SSR标记的开发(茄属植物melongenaL.)。Al Appl Genet。2009; 119:1143-53。
- 23。
范文清,孙X,杨亚杰,程乐瑞,张志发,任M.基于基因组关联的烟草高钾有利等位基因突变研究.烟草学报.2016;22:100–7。
- 24
郑俊,张CJ,阳效,冯义,冯QF,任米研究所与烟草中子系组成部分相关的SSR基因座。中国农业科学。2014; 30:102-6。
- 25
戴世生,任敏,蒋超,程玉忠,耿瑞敏。烟草基础亲本对主要病毒病抗性鉴定及遗传多样性研究。中国农业科学。2015;48:1228-39。
- 26
Fricano A, Bakaher N, Corvo MD, Piffanelli P, Donini P, Stella A,等。烟草(nictiana tabacum L.)种质资源的分子多样性、群体结构和连锁不平衡。BMC麝猫。2012;聪明的。
- 27
徐茹,刘毅,任米,穆杰米,张XW,陈yc等。SSR指纹地图烟草种质地图分析。中国脚本科学。2011; 32:62-5。
- 28
关键词:烟草,EST-SSR标记,遗传多样性,遗传多样性引用本文:中国科学(d辑:地球科学)2015;
- 29。
夏玉英,郭国平,李瑞华,陆玉华,邱文伟,赵卫文,等。利用SSR标记分析烟草遗传多样性和群体结构。Adv Mater Res. 2013; 850-851:1243-6。
- 30.
张xy,李cw,王lf,王hm,你gx,dong ys。估计在小麦品种中揭示遗传关系所需的最小SSR等位基因数。I.来自大规模种植品种的信息和中国小麦改善和生产中的基石养殖父母。Al Appl Genet。2002; 106:112-7。
- 31.
王B,Chang Rz,Tao L,Guan Rx,Yan L,Zhang Mh等人。SSR引物鉴定分析中国大豆栽培大豆遗传多样性的分析。莫尔植物品种。2003; 1:82-8。
- 32。
阳QW,陈民币,张WX,Shi JX,Ren JF。Oryza Rufipogon群体遗传结构分析所需的最小SSR等位基因数。中国j米sci。2005; 19:297-302。
- 33。
Agrama Ha,McClung Am,Yan WG。利用最小DNA标记基因座进行大米(Oryza Sativa L.)的精确种群分类。mol品种。2012; 29:413-25。
- 34。
元XP,王世,邓赫兹,徐Q,冯y,yu hy,等。SSR标记物的最低标记分析Oryza Sativa L. Chine SCI的遗传变异。2015; 29:578-86。
- 35。
刘易斯RS,尼科尔森JS。烟草的进化和美国烟草种质收集的现状。植物遗传资源学报。2007;54:727-40。
- 36
龚德平,黄磊,徐晓华,王赛,任米,王克,等.基于SLAF-seq.Mol-Bread构建烤烟高密度SNP遗传图谱.2016;36:100。
- 37
程乐瑞,陈晓聪,姜晨,马B,任M,程YZ,等.烟草(Nicotiana tabacum L.)抗黄瓜花叶病毒的高密度SNP遗传连锁图谱构建和数量性状位点定位.作物杂志,2019;7:539-47。
- 38
Jung JK,Park SW,Liu Wy,Kang Bc。胶囊SNP标志物中单核苷酸多态性的发现。Euphytica。2010; 175:91-107。
- 39
在高密度SNP数据集中使用基因组预测预测大麦DUS性状的意义。Theor Appl Genet. 2015; 128:2461-70。
- 40.
田海林,王发方,赵君荣,易红梅,王磊,王锐。玉米品种DNA指纹图谱的高通量兼容SNP芯片mazesnp3072的研制。摩尔品种。2015;35:136。
- 41.
方WP,Meinhardt LW,Tan HW,周L,Mischke S,Wang Xh等。基于SNP纳米流体阵列的单片叶片分析鉴定加工叶片茶叶的变异来源。作物J. 2016; 4:304-12。
- 42.
刘志新,李杰,樊XH,Htwe NMPS,王思敏,黄W,等。评估建立分子ID和表征来自Tokachi-nagaha的大豆品种遗传多样性所需的SNP数量。作物杂志。2017;5:326-36。
- 43.
任米,张cj,姜城,程立尔,贾旭,杨效应。基于高密度SSR连接组的烟香成分结合分析。Acta Tabacaria Sin。2014; 20:88-93。
- 44。
任M,佳熙,江赤,杨伊宫,王立克。肉豆蔻和胫甲特的比较研究在检测SRAP和陷阱中的染色。Biotechnol Bull。2008; 24:113-6。
- 45。
风扇WQ,GAI HM,Sun X,Yang AG,Zhang Zf,Ren M. DataFormater,SSR数据格式的软件,用于开发人口遗传分析。莫尔植物品种。2016; 14:265-70。
- 46。
刘克,缪斯SV。PowerMarker:遗传标记分析的综合分析环境。生物信息学。2005; 21:2128-9。
- 47。
Rohlf FJ。NTSYS-pc数字分类与多元分析系统,2.1版;2000.
- 48
叶福成,杨锐,Boyle TBJ,叶忠,西岩JM,杨锐,等。PopGene32,基于微软windows的人口遗传分析免费软件,版本1.32。2000.
- 49
IBM Corp. IBM SPSS Windows版本22.0统计信息。2013年。
- 50.
Bindler G, Plieske J, Bakaher N, Gunduz I, Ivanov N, Van Der Hoeven R,等。高密度烟草遗传图谱(尼科尼亚塔哈瓦姆L.),从大规模微卫星标记开发中获得。Theor Appl Genet 2011; 123:219-30。
致谢
不适用。
资金
国家自然科学基金项目(no . 2130135);国家农业科技创新计划项目(no . ASTIP-TRIC01)。资助方不参与研究的设计、数据的收集、分析和解释以及手稿的撰写。
作者信息
隶属关系
贡献
先生和HG构思和设计了研究;BH执行了这项研究并写了稿件;RG执行了材料收集;LC进行了遗传多样性数据分析;XY为遗传站点选择提供了建议;所有作者阅读并认可的终稿。
相应的作者
道德宣言
伦理批准和同意参与
不适用。
同意出版
不适用。
利益争夺
提交人声明他们没有竞争利益。
额外的信息
出版商的注意
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
权利和权限
开放存取本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料都包含在本文的知识共享许可中,除非在该材料的信用额度中另有说明。如果资料不包括在文章的知识共享许可协议中,并且你的预期用途没有被法律规定允许或超过允许用途,你将需要直接从版权所有者获得许可。如欲查阅本许可证副本,请浏览http://creativecommons.org/licenses/by/4.0/. 知识共享公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信贷额度中另有说明。
关于这篇文章
引用这篇文章
他,B.,Geng,R.,Cheng,L.et al。33标准烤烟品种的遗传多样性和指纹识别,用于清晰,均匀性和稳定性测试。植物生物学20,378 (2020). https://doi.org/10.1186/s12870-020-02596-w
已收到:
公认:
发表:
关键字
- 烟草
- DUS测试
- 遗传指纹
- 遗传多样性