抽象的
背景
银杏毕洛巴巴,是一种典型的雌雄异株植物,是一种广泛种植的传统药用植物。但其发育期较长,严重影响了银杏优良品种的选育。
结果
为阐明植物性别分化的复杂机制g . biloba叶。本研究共鉴定出3293个mirna,分布在花蕾和球果中g . biloba利用转录组、小RNA和降解组三种测序方法,包括1085个已知mirna和2208个新mirna。比较转录组分析在雄芽(MB) _vs_雌芽(FB)和小球果(MS) _vs_排卵球果(OS)中分别筛选出4346和7087个差异表达基因(DEGs)。共预测了6032个miRNA差异表达的靶基因。结合小RNA和转录组数据集的分析,鉴定出51对miRNA-mRNA相互作用对,可能参与了该过程g . biloba在分析降低测量的分析时验证了斯特罗比利的性分化。
结论
本研究中小RNA,RNA和降低测量数据的综合分析提供了候选基因并阐明了性分化的调节机制g . biloba从多个角度来看Strobili。
背景
银杏毕洛巴巴L.,常年的裸子植物,是植物王国的活化石,并在中国称为“吉隆安”树。叶子和坚果的提取物g . biloba含有大量的活性化合物,如黄烷醇苷、萜内酯等,可用于治疗心血管疾病[1].目前,g . biloba广泛种植,因其广泛应用于制药、食品、护肤品、景观等领域[2].但是,在不同品种中的活性成分的组成g . biloba是非常潜水员,对质量产生重大影响g . biloba叶子提取物。此外,g . biloba是一种典型的雌雄异株植物,具有独特的开花特征,在演化史上具有重要作用[3.].它有一个漫长的少年时期,需要近30年来从苗上开花,这严重影响了卓越的银杏品种的育种和培养[4.那5.].因此,研究生殖器官发展和性分化尤为重要G. Biloba。
植物性别分化和性别鉴定的生理和分子机制已被广泛研究多年。植物性别决定机制主要包括遗传性别决定和环境性别决定两个系统。雌雄异株植物是研究植物性别决定和分化过程的重要材料。到目前为止,已经发现和鉴定了一些参与植物性决定过程的基因。Y-Gene 1(SLY1)是与克隆和鉴定的性分化相关的第一个基因SILON LATIFOLIA.[6.].随后,两个疯子箱基因,spapetala3和sppistillata的特征是参与雄花原基的形成Spinacia oleracea[7.].在Cucumis sativus那Csacs2.基因被证实抑制雄花形成,促进雌花形成[8.].最近,有两个重要的性别分化基因,害羞的女孩(Sygi.),友好的男孩(弗拉丁),被克隆到了Actinidia chinensis.并确定用于维护男性职能[9.那10.].此外,开发单调男性花朵Cucumis Melo.性别测定基因表达的结果,CMWIP1.,它与CmbZIP48抑制心皮发育[11.].
MADS-box转录因子与花器官发育和性别分化密切相关。例如,从植物中分离到5个与性分化有关的b型MADS-box同源基因硅宾阿尔巴但没有相关的证据证明这五种基因是否位于性染色体上[12.].除了关键基因外,大多数植入植物激素,如环肽,乙烯(Eth),赤霉素(Ga)和细胞肝素(CTK),在植物中的性分化中也发挥着重要作用[13.].ETH和CTK主要促进雌花分化,已广泛应用于果蔬行业[14.].IAA(吲哚乙酸)和生长素样物质主要作用于植物细胞的伸长和促进女性表型。喷洒外源GAC. Sativus.增加了雄性黄瓜和雌雄同株黄瓜的雄性比例,并诱导雌花植物的雄花形成[8.].因此,植物激素在植物中发挥着重要作用和性分化。
microRNA (miRNA)是一种内源性非编码单链小RNA分子,由18-24个核苷酸组成,在进化中高度保守[15.].其主要功能是通过切割靶基因或抑制靶基因翻译过程来调节转录后靶基因的表达水平[16.].在植物中,miRNA参与许多生命过程的调控,包括植物生长发育、形态发生、器官分化、组织发育、信号转导、开花等调控,以及对生物和非生物胁迫的响应[17.那18.那19.].例如,DCL1的突变减少了成熟的miRNA合成,其改变了植物叶子的形态,延迟开花,并导致女性无菌[20.].叶片的生长和发育受MiRNA396的影响拟南芥蒂利亚纳.过表达miRNA396导致叶片大小变化,气孔密度降低,抗旱性增强[21.].此外,miRNA159的过度表达导致靶基因MYB33和MYB65的下调,导致植物中的开花和雄性不育[22.那23.].此外,miRNA在植物性测定中发挥着重要作用。miRNA172通过控制表达来调节玉米流苏的性分化AP2.基因。在雌雄同体玉米中,miRNA172e靶向IDS1转录因子与AP2同源,从而防止在雄性花中发育雌蕊和完整的雄花的发展。在女性花中,IDS1转录因子不受miRNA172e调节,因此女性花卉继续形成正常的雌蕊[24.].最近,一种y染色体编码的miRNA在Diospyros Lotus,一个脱衣厂,可以调节自动体组Wegi.基因,负责花粉堕胎[25.].
g . biloba是代表性的脱衣果之一。很少有研究提供有关开花遗传机制的信息g . biloba.虽然我们以前的工作克隆和职能报告了一些参与花发育的基因,包括三种疯狂箱转录因子基因[26.那27.那28.]和两个昼夜调节基因(GBCO.和GBFT.)在光/周期途径[4.那29.].但是,很少的文学报告的遗传调节性分化和性测定的遗传调节g . biloba,特别是对于斯特罗毕性分化的miRNA鉴定及其监管机制。进一步了解Strobili性分化的机制g . biloba,我们进行了小的RNA测序,转录组测序和雄性芽(MB和FB)的降解测序以及微杆菌(MS)并在该研究中排卵(OS)。我们的数据鉴定了一些重要的候选MiRNA及其靶基因,调节性分化,并为性分化的遗传机制提供了新的洞察g . biloba.
结果
球果花发育过程中的形态变化
了解女性和男性斯特罗比的形态发生g . biloba本研究观察了其发育过程中宏观和超微结构的变化。如图所示。1,雄性花蕾在短芽的顶点上承担,休眠阶段约6个月。在休眠阶段之后,雄性芽逐渐展开和成熟(图。1a e)。每个雄球果含有60-80个小孢子叶,每个小孢子叶由一个不育延伸体和两个椭圆形小孢子囊组成。1F-G)。女性花蕾主要被厚芽鳞片包围,直到3月中旬,芽鳞开始后开始展开。到4月中旬,每个卵子由授粉期间由细长的茎,胚珠环,整数和核心组成(图。1h-k)。扫描电镜(SEM)结果显示,授粉前胚珠分化为许多结构,包括珠孔、珠孔管和花粉室。1我)。
小RNA深度测序数据综述
用于鉴定参与花性分化和发育的mirnag . biloba,构建了4个MB,FB,MS和OS的四个小RNA文库。总共产生了大约794.89百万的原始读数。去除污染读数后,我们获得了从每个样本的清洁读数≥10.78m。从所有样品中获得总共3293个miRNA,其中1085名已知miRNA,2208是新的miRNA,它们根据张等人的方法命名。[30.)(附加文件1:表S1)。所有miRNA序列在18-25nt的范围内,主要集中在20-24nt中,其中21 nt是小核糖核酸库中最丰富的类型(附加文件2:图S1A)。上述结果与其他植物物种中成熟miRNA的典型长度一致[31.].成熟miRNA的5'末端的第一垒对u有强偏差(附加文件2:图S1B)。在所有基本站点中,基础A和U的比例超过50%,除了站点18和19(附加文件)2:图S1C)。这些统计结果基本上与植物miRNA的特征一致,表明高通量测序结果的准确性。
miRNA的差异表达
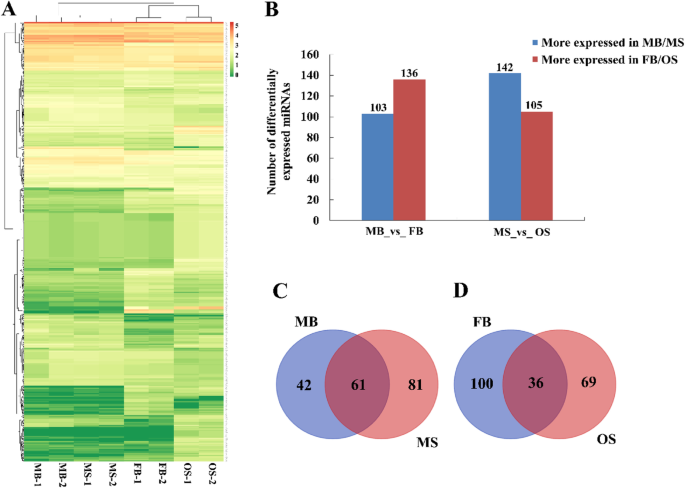
以假发现率(FDR) < =0.001和|log2 (Fold Change, FC) | > = 1作为筛选差异表达mirna的标准。并对其性别分化机制进行研究g . bilobastrobili,对差异表达的mirna进行层次聚类分析,将表达行为相同或相似的mirna聚类,对mirna进行分组(图。2一种)。在239个差异表达的miRNA之间,在MB和136 miRNA中更表达的103 miRNA在FB中更表达(图。2b)。在MS _VS_ OS之间,总共247 miRNA在MS _VS_ OS之间差异表达,其中142 MIRNA在MB和105 MIRNA中更为表达,在FB中更为表达(附加文件3.:表S2)。用于分析涉及性分化调节的miRNAg . bilobaStrobili,本研究主要分析了同一阶段的差异表达的miRNA。在雄性斯特罗比利和雌性斯特罗比亚中持续上调61名miRNA(图。2C);36在雌性斯特罗比中连续上调,并在雄性斯特罗比中下调(图。2d)。
差异表达miRNA靶基因功能注释
为了研究miRNA对靶基因的调控功能,我们对差异表达miRNA对应的靶基因进行了功能注释。6032个基因中有3043个靶基因被注释为45个GO类别,其中13个(2450个,80.51%)类别、11个(1308个,42.98%)类别和20个(2129个,69.96%)类别分别属于分子功能、细胞成分和生物过程(附文件)4.:图S2A)。为了进一步加深对蛋白质水平生物学功能的理解,我们对25个COG功能分类蛋白家族的2395个靶基因进行了注释(补充文件)4.:图S2B)。其中,“仅仅”的“一般函数预测”占最大比例(627个靶基因),其次是“复制,重组和修复”(492个靶基因)。总共1251个靶基因被成功注释为97 kegg途径,并且在附加文件中显示了具有较高数量注释基因的前50个代谢途径4.:图S2C。其中,参与植物激素信号转导(ko04075)、氨基酸生物合成(ko01230)和苯丙素生物合成(ko00940)的靶标基因分别为60、59和48个。差异表达miRNA对靶基因KEGG通路的富集分析表明,糖脂生物合成-globo系列(富集因子= 2.48,问:-Value = 0.165)和淀粉和蔗糖新陈代谢(富集因子= 1.44,问:-Value = 0.5)途径显着丰富(附加文件4.:图S2D)。值得注意的是,植物激素信号转导途径的富集因子为1.26。
差异表达基因的筛选
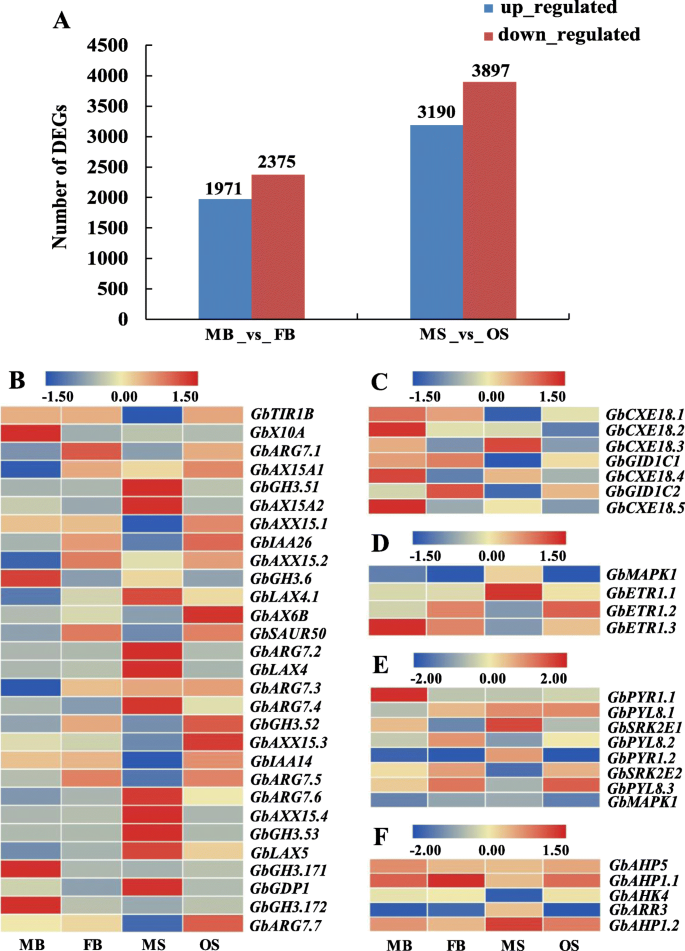
获得并通过使用折叠变化≥2和FDR <0.01作为筛选标准来获得次数。在MB和FB之间筛选了共4346次。其中,1971和2375℃分别在FB _VS_MB中上调和下调(图。3.一种)。通过比较MS和OS,获得7087次,在3190次上调和3897次下调的OS中。这些可参数可能在雄性和雌性斯特罗比的表型分化中起作用g . biloba.
miRNA和mRNA之间的监管分析
为了筛选miRNA-mRNA相互作用对,并且相互作用对中的miRNA和mRNA差异表达。使用差异表达的miRNA作为筛选标准,获得了通过差异表达的miRNA调节的差异表达的mRNA。结果表明,在MB中发现了具有上调miRNA的424个miRNA-mRNA调节对,在MB中观察到493 miRNA下调对(表1).其中,445对具有负相关(在相同的miRNA-mRNA相互作用中的miRNA和mRNA的表达模式在相同的器官中)。在OS中发现总共840 miRNA-mRNA调节对,在OS中发现,在OS中观察到776 miRNA下调对(表1).在MS _vs_ OS中共筛选到846对具有负调控关系的基因(表1)1).
在水稻性别分化调控过程中差异表达的mirna和靶基因(DEGs)的鉴定g . biloba
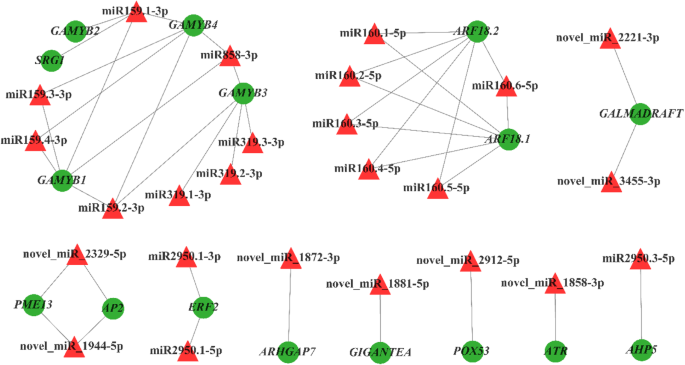
许多因素在性测定过程中发挥着至关重要的作用。已被证明对植物性别分化至关重要的植物激素[32.].基于靶基因的注释信息和MIRNA和MRNA之间的负调节关系,我们筛选候选MiRNA调节的靶基因与性测定的差异表达相关g . biloba.如表所示2,在花发育途径中发现5对miRNA-mRNA负相关,MB_vs_ FB中有2对miRNA-mRNA与2个靶基因(Gigantea.那POX53)和MS _VS_ OS中的三对miRNA-mRNA对应于两个靶基因(ATR.和AP2.).在mb_vs_ fb中,novel_mir_1881-5p argetsGIGANTEA和在fb中上调,novel_mir_2912-5p argetsPOX53和在FB中调节。在MS _VS_ OS中,Novel_mir_1858-3p目标ATR.基因,Novel_mir_1944-5p和novel_2329-5p同时定位AP2.基因,在OS中表达下调。
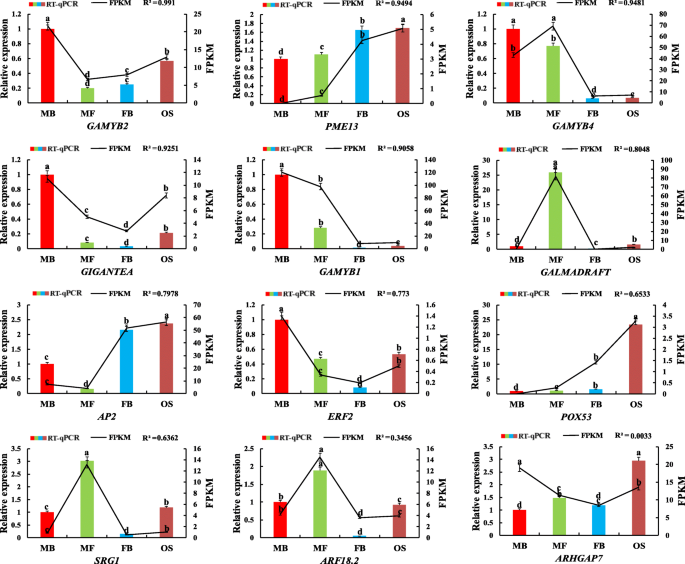
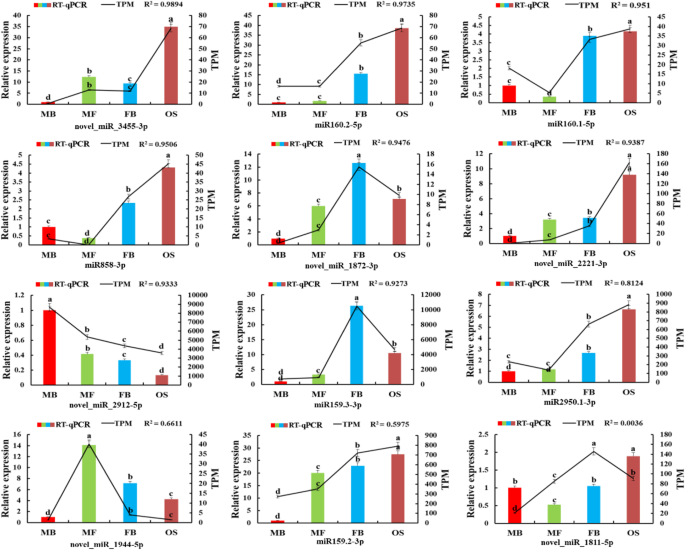
GA代谢通路共涉及23对负调控关系,16对5个靶基因(gamyb1.那gamyb2.那gamyb3.那gamyb4.那arhgap7.)在MB _vs_ FB;15对及5个靶基因(gamyb1.那SRG1.那gamyb4.那Galmadraft.那PME13.),在MS _vs_操作系统。此外,在FB中观察到8个已知miRNAs (miR159.1-3p、miR159.2-3p、miR159.3-3p、miR159.4-3p、miR858-3p、miR319.1-3p、miR319.2-3p、miR319.3-3p)和novel_miR_1872-3p的表达水平上调;在OS中,两个新的mirna (novel_miR_2221-3p和novel_miR_3455-3p)表达上调,而novel_miR_1944-5p和novel_miR_2329-5p表达下调(表2)2).相应的靶基因是转录因子gamyb(Gamyb1 gamyb2 gamyb3 gamyb4)和其他参与植物GA代谢途径的基因(Arhgap7,Galmadraft.),下调;然而PME13.在OS中上调。
对于ETH代谢途径,在MB _vs_ FB中观察到两对miRNA-mRNA负相关,对应于一个靶基因(ERF2)和FB中的下调表达。
在MS _VS_ OS中,12个对注释于IAA和两种靶基因的代谢途径(ARF18.1.那ARF18.2.).MiRNA160.1-5P,MiRNA160.2-5P,MiRNA160.3-5P,MiRNA160.4-5P,MiRNA160.5-5P,MiRNA160.5-5P,MiRNA160.6-5p在OS中调节。相应的靶基因是生长素响应因子18(ARF18.1.那ARF18.2.),下调。
根据转录组数据的分析,向植物激素信号转导途径注释235℃,其中MB _VS_FB和MS _VS_ OS中的81℃。分析了注释于IAA,Ga,Eth,CTK和ABA信号转导通路的基因的表达模式,以发现有52℃,其中IAA信号转导途径中29℃(图。3.b)、GA信号转导通路中的7个DEGs(图。3.c)、ETH信号转导通路中的4个DEGs(图。3.d),在ABA信号转导途径中的8次(图。3.e)和CTK信号转导途径中的5℃(图。3.f).这些参与激素信号转导的deg可能参与性别决定g . biloba.结合miRNA和mRNA之间的负相关调节,52次中只有1个具有负相关调节,即,AHP5参与CTK信号转导通路。在OS中,该基因表达下调,而相应的miRNA (miR2950.3-5p)表达上调(表)2).这种miRNA可能在花卉分化和性分化中发挥重要的监管作用g . biloba.
植物和雄性斯特罗毕的植物激素含量的比较g . biloba
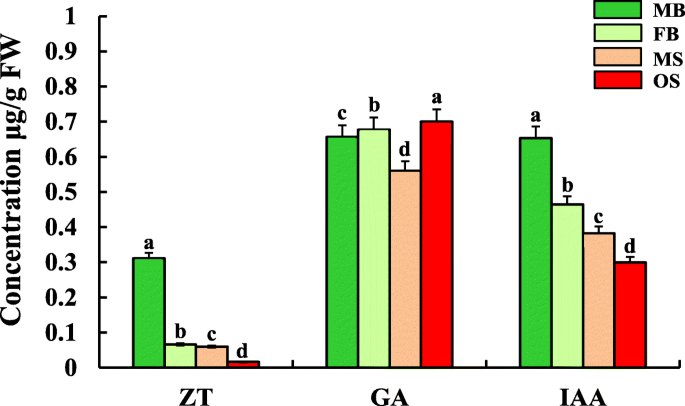
Zeatin(ZT),GA3.在女性和男性斯特罗比的不同发展阶段被发现了IAAg . biloba(图。4.).值得一提的是,雄、雌球果两个发育阶段激素含量的变化趋势是一致的。雄球果中ZT和IAA含量显著高于雌球果,GA含量显著高于雌球果3.在雌性斯特罗毕中显着高于雄性斯特罗比亚(图。4.).
通过降级方法确认
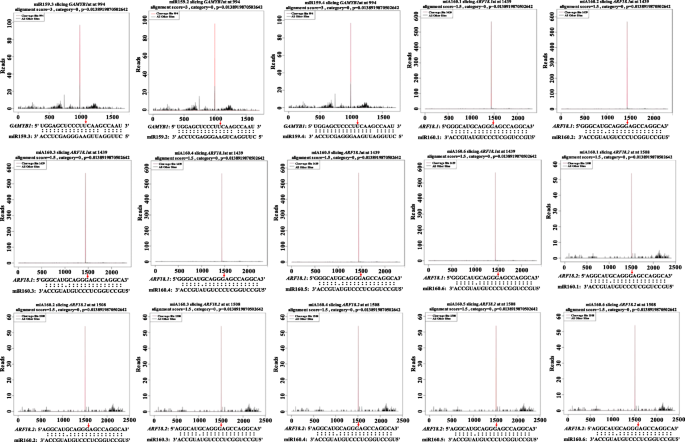
通过降解组测序共获得228.3万份干净数据g . bilobaStrobili(附加文件5.:表S3)。基于已知的miRNA库,通过Cleaveland软件进行了对应物种的小RNA测序数据库中MiRNA的预测,以及相应物种的劣化站点检测[33.].该分析显示155种降解的靶基因和156个靶基因降解位点。根据降级测序和先前分析结果的集成分析(附加文件6.通过降解组测序,共验证了15个miRNA-mRNA的调控关系,包括3个靶基因和9个mirna(图4)。5.).mir159.2-3p,mir159.3-3p和mir159.4-3p联合调节gamyb1.参与GA代谢途径。miR160.1-5p、miR160.2-5p、miR160.3-5p、miR160.4-5p、miR160.5-5p和miR160.6-5p共同调控ARF18.1.和ARF18.2.参与IAA的代谢途径(图。6.).3个靶基因上只有1个miRNA降解位点,降解位点为gamyb1.是994年吗ARF18.1.是1439年ARF18.2.是1508年。这些结果证实了多个mirna可以同时调控同一个靶基因。
RT-QPCR对miRNA及其靶基因的验证
用于验证涉及性分化过程中涉及的miRNA和相应靶基因的鉴定的表达模式g . biloba随机选取12个miRNAs和12个mRNAs进行RT-qPCR分析。我们比较了通过RNA-seq和RT-qPCR得到的四组表达数据(图)。7.和8.).RNA-Seq (FPKM/TPM)与qPCR的相关性(2——ΔΔCt)基因和mirna的结果使用对数倍变异测量进行计算。RT-qPCR观察到的大部分基因和mirna的表达变化趋势与高通量测序相似。在12个基因中,相关值(R2), 10个基因在0.6362 ~ 0.991之间(图。7.).对于mirnas,r210 miRNA的范围为0.661至0.9894(图。8.).综上所述,这些数据表明高通量测序与RT-qPCR具有良好的一致性,说明小RNA和mRNA转录组测序的可靠性和准确性。
讨论
候选miRNA-mRNA相互作用参与性别分化g . biloba
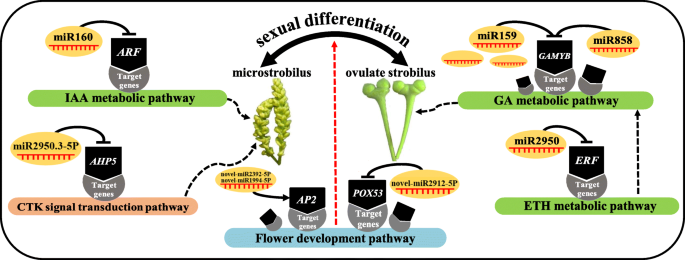
一些工作报道了筛选和表征的一些miRNAsg . biloba使用高通量测序,其中潜力参与种子生殖器萌发[34.,胚珠发育[3.]叶子中的主要代谢[35.]和萜烯内酯生物合成[36.].然而,对参与性别分化的miRNA来说很少g . biloba叶。最近,Du等人[37.使用转录组数据分析来筛选与银杏中的性别分化有关的一些基因。然而,单一转录组测序不能完全照亮植物性别分化的基因调节网络。多个测序的组合分析可以作为一种多功能工具,以分析植物寿命过程的机制。通过多组测序组合分析鸡眼的ascochyta枯燥抗性的复杂机制[38.].在山茶花,mir172-AP2.和miR156 -:调节对被确定为关键调节节点,以通过多组分析促进双花朵形式的多样性[39.].在本研究中,使用三种高通量方法,即转录组,小RNA和降低测量测量序列来阐明性分化的机制g . biloba.此外,我们还发现了可能调节性别分化的miRNA-mRNA相互作用对。单独的miRNA没有功能且易于降解。只有当miRNA与Argonaute (AGO)蛋白结合形成rna诱导沉默复合体(RISC)时,它才能发挥有效的作用,miRNA引导RISC到靶特异的mRNA区域[40].植物miRNA可以完全补充MRNA的编码区域,并通过诱导互补MRNA的降解来抑制基因的表达[41.].本研究共鉴定出51个miRNA-mRNA负相关调控关系。本研究结果表明,miRNA可能通过靶向参与激素生物合成和信号转导途径的转录因子基因以及花发育相关基因来调控两性分化g . biloba(图。9.).
性别分化g . biloba可能受到Eth和Ga Biosynthesis途径涉及的miRNA的影响
ETH是一种在植物性决定中起重要作用的植物激素,它作用于GA的下游。ETH是促进女性器官发育而抑制男性器官发育的因素[42.].这里,MIR2950.1-3P和MIR2950.1-5P靶向乙烯反应转录因子2(EMF2),在FB的下调g . biloba,与其他植物的结果相反[42.].性别分化调节功能的差异可能与所研究的物种不同有关。
MYB是植物中一个大型的转录因子家族,参与许多生命活动,如植物次生代谢[43.,荷尔蒙反应[44.,叶器官形成[45.],花开发[46.].目前,一些MYB转录因子已被确定为花卉发展监管机构[47.].在A. Thaliana.据报道,几种MYBS涉及茉莉酸介导的雄蕊成熟。转录分析表明,MyB108和MyB24具有重叠的功能,并在介导的雄蕊和花粉成熟的转录级联中在MyB21的下游作用[48.那49.].我们的研究结果与先前研究的结果一致,这表明Ga可以促进男性花的分化[8.].本研究发现miR159.1-3p、miR159.2-3p、miR159.3-3p、miR159.4-3p和miR858-3p被鉴定为靶蛋白gamyb1.MB, FB, MS和OS。的gamyb1.在FB和OS中下调,说明上述miRNAs靶向gamyb1.基因制作gamyb1.在雄球果中上调,从而促进雄球果的成熟g . biloba雄蕊。此外,众所周知,GA促进雌蕊的分化。例如,玉米是一种单一的植物,表现出一种表型,其中将雌性花转化成雄性花或花原原始朝向雌蕊分化偏置,导致GA生物合成期间的GA信号转导途径或基因突变。这些结果还表明内源性GA促进了玉米植物的女性花分化[42.].同样,我们的数据也表明了PME13.基因参与GA的生物合成,在OS中表达上调。此外,还测定了GA的含量3.OS中表达量显著高于MS,说明该基因表达量与GA呈正相关3.Strobili的内容g . biloba.因此,这些结果表明,Ga可能在生产雌性斯特罗比中发挥作用g . biloba.
性分化可能受到IAA生物合成调节剂的MIRNAg . biloba
IAA在植物花卉开发中发挥关键作用,如花卉原基形成和花器官差异化[50.].特别是,大多数研究表明IAA促进植物雌花的表达[51.].例如,几个东盟地区论坛和辅助/ IAAs在IAA代谢途径被识别出对糖苹果的花发育至关重要[52.].在A. Thaliana.那ARF3.整合函数钦am和APETALA2确定花的分生组织[53.].与此同时,另外两个成员(ARF6和ARF8)被证实在控制植物营养器官和花器官的生长发育中起重要作用[54.].此外,研究表明,损失ARF18活性导致石渣壁中的细胞膨胀,进一步促进了单片机的发展,增加了单片机中的光合产物,并最终增加了种子的重量[55.].在本研究中,已知miR160家族的6个成员被鉴定为靶标ARF18.1.和ARF18.2.这些基因仅在MS _vs_ OS中有差异表达,而在OS中表达下调。不同器官间IAA生物合成中所鉴定的靶基因表达量与miR160s表达量呈显著负相关(表1)2).鉴于MS中的IAA内容高于OS中的IAA内容(图。4.),可以推测MiR160s通过调节IAA代谢来形成雄性斯特罗比g . biloba.
miRNA调控CTK信号转导途径影响性别分化
积累的研究表明,CTK在雄花和雌花之间通常存在显著差异[56.那57.那58.].例如,用外源CTK治疗Mercurialis青蒿L.,一个小型植物LED花卉原基分化为雌蕊[56.].同样地,将外源性CTK治疗到菠菜,大麻,葡萄和其他植物的雄花引起的雄性花朵变成女性花朵,表明CTK可以促进花卉二曲的分化为女性花朵[59.].影响植物性别分化的影响的原因之一可能是性测定基因的调节功能。例如,Sygi.,发现来自Kiwifruit的第一种性别测定基因,通过负调节细胞蛋白信号来抑制通过负调节细胞蛋白信号的术语表型[9.].在本研究中,我们发现miR2950.3-5p可能调节CTK的信号转导(表)2).miR2950.3-5p仅在MS _vs_ OS中有差异表达,在OS和靶区均有上调表达AHP5基因往复式表达。鉴于初始和最终阶段中雄性斯特罗比中的Zt的含量高于雌性斯特罗比亚中的Zt(图。4.),我们的数据提示miR2950.3-5p影响CTK的代谢,进而可能促进雄性球果的发育,抑制雌性球果的形成g . biloba.
参与调节花卉发育途径的miRNA会影响性分化g . biloba
植物没有明显的继发性特征,男性和女性之间的差异主要表现在花卉器官中[60.].g . biloba是一种典型的雌雄异株植物,与花发育相关的基因一定参与了性分化的过程。MADS-box基因是大量存在的转录因子,具有保守性。它们参与几乎所有调节植物发育的途径,特别是花的发育[61.].与花发育有关的ABCDE模型中的大多数基因也属于疯子箱基因家族。AP2是疯狂箱转录因子之一,考虑在调节开花时间,调节种子的发展和维持植物顶端单位的能力[62.那63.].在MS _VS_ OS的情况下,两种新颖的miRNA(novel_mir_1944-5p和novel_mir_2329-5p)同时针对AP2.基因在OS中表达上调。同时,novel_miR_1858-3p-ATR.通过降解组测序分析确定相互作用对。ATR.在操作系统中表达了上调g . biloba并被注释参加花卉发展途径。此外,还发现另外两种新的miRNA(Novel_mir_1881-5p和novel_mir_2912-5p)是针对与上调的花发育有关的靶向基因Gigantea.和下调POX53分别在FB(表2).我们的结果推断出这些miRNA和靶基因之间的相互作用在性分化中发挥了监管作用g . biloba.它可以通过不仅直接与花发育相关的基因来调节性分化,而且间接转录因子。
结论
本研究首次尝试将mRNA和miRNA表达数据与降解组分析相结合,鉴定出参与调控性分化的miRNAg . biloba.通过小RNA和mRNA的整合分析,鉴定了51对可能参与调控性别分化的miRNA-mRNA相互作用g . biloba.该发现基于差异表达miRNA的筛查结合影响性分化的因素。相应的靶mRNA也显示出患有雄性和雌性斯特罗比的差异表达g . biloba.通过降低测量测序证实了总共15对51 miRNA-mRNA相互作用对的。男性和雌性斯特罗比利亚基因和miRNA的综合表达模式的综合表达模式的综合数据集提出了对性差异的新洞察力g . biloba,这些测序数据也将是进一步研究的宝贵资源g . biloba.
方法
植物材料及RNA提取
三十两岁的树木g . biloba简历。“嘉福寿”生长在中国长江大学银杏园(30.35°N, 112.14°E)。为了研究球果的形态发生,对雄球果和雌球果进行了研究g . biloba从3月8日到4月12日,用数码相机观测并记录了这一现象。3月13日收获的MB和FB, 4月5日收获的MS和OS都是在这里收获的g . biloba为了提取总RNA以构建测序文库,并用于RT-QPCR分析并测定激素的含量。选择总九棵独立的银杏树为实验,36个树枝作为实验块。每种生物重复组成的样品从三个银杏树上均匀地从12个非独立分支中选择的样品在术语生长条件下均匀。总共两个生物重复用于测序,以及三种生物重复,用于测定激素含量和定量实时PCR。收集样品,冷冻在液氮中并储存在-80℃的冰箱中以进一步分析。提取总RNA以构建测序文库,并使用小纤维通用RNA提取试剂盒(Takara,大连)进行RT-QPCR分析。量化RNA样品,通过Nanodrop TM一种分光光度计(Thermofisher,America)和Agilent 2100 BioAnalyzer(Agilent Technologies,America)评估质量。符合标准的RNA(OD260 /280≥1.8,OD260 /230≥1.0。RNA总RNA≥8.0,28s/18s≥1.5,地图的基线未提升,5S峰值正常。)是合格的样本。
扫描电子显微镜
形态学g . biloba用扫描电镜观察4月5日收获的鲜MS和OS的球果。MS和OS的超微结构分析方法参照Jin等[64.],并作以下修改。在25℃下使用2.5%戊二醛在25℃下快速固定新鲜样品,并在4℃下转移到冰箱中12小时。取出固定样品,用0.1M磷酸盐缓冲液冲洗2-3次,然后在分级乙醇系列(30,50,70,80,90和100%,每步15分钟中脱水)。将脱水材料转移到清洁烧杯中,并在每次浸入异烷基乙酸盐下浸渍15分钟。之后,将样品置于临界点干燥装置(高压封闭容器)中,以在31℃和72.8标准气氛压力下注入液态二氧化碳。使用Quanat-200扫描电子显微镜,在15kV加速电压下观察到样品。
测定植物激素含量
IAA、GA的提取及含量测定3.和ZT根据Onanuga等人描述的方法。[63.],并作以下修改。制备样品如下:取新鲜样品5 g,研磨成4℃粉末,加入预冷80%甲醇溶液50 ml。将样品粉与甲醇溶液混合搅拌12 h,在4℃超声粉碎30 min,然后在4℃12000 g/min离心10 min。提取上清液,35℃减压,旋转蒸发器浓缩至10ml;加入等体积石油醚萃取3次,丢弃有机相。用0.1 mol/L Na将水提液调至pH 8.52HPO.4.溶液和0.2g PVPP加入摇匀。使用0.45μm过滤器膜除去残余物后,用0.1mol / L柠檬酸将含水提取物的滤液调节至pH3.0。添加等同的乙酸乙酯用于萃取3次,丢弃水相,在35℃的减压下使用旋转蒸发器浓缩剩余的有机相至约2ml,用甲醇(色谱级)溶解并固定体积然后用0.45μm过滤器膜过滤以获得样品溶液。高效液相色谱(HPLC,HATCO Scientific™Ultimate™3000,USA)采用Agilent C-18色谱柱(5μm,4.6mm×250mm)用于IAA,GA3和ZT的定量分析[65.],并作以下修改。流动相是甲醇-1%乙酸(40:60);流速:0.6毫升/分钟;柱温:35°C;注射体积:2μL;检测在269 nm处。每个样品在六种技术复制中确定。
小RNA库的制备和测序
总共八个RNA样品(MB-1,MB-2,FB-1,FB-2,MS-1,MS-2,OS-1,OS-2)进行小RNA测序。使用小型RNA库预备套件构建了库,如以下步骤。使用T4 RNA连接酶1和T4 RNA连接酶2(截短的),用于连接3'-SR和5'-SR适配器。然后,进行逆转录合成的第一链和PCR扩增。页面凝胶用于电泳片段筛选目的,橡胶切割回收,因为碎片得到小RNA文库。在安捷伦生物分析仪2100系统上评估了图书馆质量。通过排序所获得的原始读数包含适配器序列或低质量读取。为了确保信息分析的准确性,使用自定义Perl脚本对原始读取进行了一系列质量控制检查,以获取干净的读取,包括删除包含适配器的读取,包含从RAW的PLOY-N和低质量读取的读取数据。通过去除小于18nt或长于30nt的序列来修剪读取和清洁。 All the downstream analyses were based on clean data with high quality. The transcriptional level of small RNA was quantified according to Transcripts Per Kilobase of exon model per Million mapped reads (TPM) method [66.].使用Bowtie软件(V1.0.0,-V 0)和NCRNA(如核糖体RNA(RRNA),运输RNA(TRNA)进行比较,将清洁读数与SILVA数据库,GTRNADB数据库,RFAM数据库和REPBASE数据库进行比较。核RNA(snRNA),小核仁RNA(Snorna)和重复序列被过滤[67.].剩余的读数用于从miRBase检测已知的miRNA(http://www.mirbase.org/),并通过与参考基因组序列的比较预测新的miRNAg . biloba[68.].通过Bowtie软件(v1.0.0,−v 0)收集18 - 25 nt的独特reads,并将其映射到参考基因组中。所有miRNA测序数据存储在NCBI SRA数据库中(PRJNA590093)。
DEGs转录组文库构建及筛选
与经过小RNA测序的样品相同的八个RNA样品用于mRNA转录组测序。根据KIT指令,使用Nebnext®Ultra™RNA库预备套件(NEB,E7530L,USA)构建RNA-SEQ库。通过illumina Hiseq4000平台测序获得原始读数。通过消除低质量读取和去除污染的适配器并除去大于5%的N比率来获得高质量序列(清洁读取)获得高质量序列(清洁读数)获得。69.].然后通过使用Hisat2工具软映射到参考基因组序列的清洁读取以获得映射读数,基于参考基因组序列进一步分析和注释g . biloba[68.].DESEQ软件(http://www.biocumon.org/packages/release/bioc/html/deseq.html.)分析样本组间差异表达基因(DEG) [70].基因表达水平的定量估计每百万片段映射(FPKM)每百万片段的转录物的片段。所结果的P.使用Benjamini和Hochberg的方法来调整值,用于控制虚假发现率。调整的基因P.将DESeq发现的-value < 0.05赋值为差异表达,以Fold Change≥2和FDR < 0.01为筛选标准,获得两个样本之间的差异表达基因集。所有转录组测序数据均可在NCBI SRA数据库(PRJNA590044)中获得。
降级图书馆建设
来自女性和男性斯特罗比的总RNAg . biloba3月13日和4月5日混合,按照NEB next Ultra II RNA library Prep kit (NEB, E7775, USA)试剂盒说明书构建降解菌库。降解文库使用Illumina Hiseq 4000平台进行测序[71.].降解读取使用自定义Perl脚本进行过滤。通过去除适配器和过滤低质量的原始标签,得到清洁标签和聚类标签。将聚类标签与参考基因组进行比较,获得标签在基因组上的分布[68.].将群集标签和RFAM数据库进行比较,以注释非编码RNA,并且未解除读取的读数用于降解现场分析。使用Cleaveland v4.4管道处理将读取转录组的读取链的读取映射,以预测miRNA裂解位点[33.].
microrna的识别
使用MIRBASE数据库中已知的miRNA前体序列将映射到参考基因组的读取映射到参考基因组的MiRdeep2软件包(V2.0.5,-G-1-1-1-1-1-1-1-1-1-1-1-1-1-1-1-1-1-1-1-1-1-1-1-1-1-1-1-1-1-1-1-1-1-1-1-1-1-1-1-1-1-1-1-1-1-1-1-1-1-1-1-1 -120 -b 0)来识别已知miRNA的表达[72.].Bowtie用于将预处理的读数映射到基因组序列,允许不超过两个不匹配和15个有效的对齐。序列长度设定为250以预测RNA的二次结构。同时,通过比较基因组上读取的位置信息来获得可能的前体。基于读取基因组的分布信息(MiRNA生产特征,成熟,星,环)和前体结构能量信息(Randfold,V2.0,-S 99; rnafold,v2.1.7,默认)。贝叶斯模型用于得分,并将植物特定的评分系统添加到MIDDeep-P,以实现新的miRNA的识别[73.].最后,使用miRNA靶向信息来测量miRNA的有效性。
筛选差异表达的miRNA
使用DESeq R (v1.18.0, default)计算的归一化因子对miRNA的原始读计数进行归一化,然后识别差异表达的miRNA [74.].以FDR和FC作为筛选差异表达miRNA的标准,|log2 (FC)| > = 1;罗斯福< = 0.001。
miRNA靶基因的预测和差异表达靶基因的注释
根据已知的miRNA和新麦芽糖的组合信息,相应物种的基因序列和miRNA和其靶基因之间的高互补性,使用靶器软件(V1.0.0,-V 0)进行靶基因的预测[75.].使用BLAST软件(V2.2.26,-B 100 -V 100-I 1E-5-5-5-5-5-5-5-5-5-5-5-5-5-5-5-5-5-5-5-5-5-5-5-5-5-5-5-5-5-5-5-5-5-5-5-5-5-5-5-5-5-5-5-5℃)与国家生物技术信息中心进行比较非冗余(NCBI NR)[76.], Swiss-Prot [77.],基因本体(GO)[78.],基因和基因组的京都百科全书(Kegg)[79.]和群体的蛋白质群(COG)[80]相似性的数据库(E-Value 1E-05)获取注释信息。
mRNA和miRNA的QRT-PCR验证
根据成熟mirna序列设计正向特异性引物(附加文件)7.:表S5),反向引物使用MiR-X miRNA第一链合成试剂盒提供的通用引物。MiR-X miRNA第一链合成试剂盒中包含的外部基因U6的上游和下游引物(TM:60℃)用作参考基因引物。RT-QPCR反应是使用LineGene 9600 Plus(中国FQD-96A)的TB GreentmAdvantage®套件(Takara,大连)进行。
mRNA的特异性引物(附加文件中的序列8.:根据靶基因的序列由软件引物5.0设计表S6。g . biloba 18岁基因用作参考基因[81.那82.].RT-QPCR反应根据ACEQ®QPCRSybr®GreenMaster混合物(Takara,大连)的使用说明书进行。用三种独立的生物三份子酸盐进行实验,每次三份组成,包括三种技术复制。麦芽糖和靶基因MRNA的表达g . biloba是由2——ΔΔCt方法 [83.].采用SPSS 22.0 (SPSS Inc., Chicago, IL, USA)软件对生物重复之间的标准误差进行分析。
数据和材料的可用性
在当前研究期间生成和/或分析的数据集可在NCBI存储库中提供[NCBI SRA数据库(PRJNA590044)和NCBI SRA数据库(PRJNA590093)]。本研究期间生成或分析的所有数据都包含在此已发布的文章中的附加文件中。在当前研究期间使用和/或分析的数据集可以从作者提供合理的请求(冯旭,xufeng198@126.com;刘晓梦,LiuXM925@163.com).
缩写
- 可见:
-
差异表达基因
- m:
-
男芽
- FB:
-
女芽
- 女士:
-
微杆菌
- 操作系统:
-
雌球果
- SLY1:
-
Y-Gene 1
- SYGI:
-
害羞的女孩
- FrBy:
-
友好的男孩
- 国际宇航科学院:
-
吲哚乙酸
- eth:
-
植金,乙烯
- GA:
-
吉布林素
- CTK:
-
细胞分裂素
- microrna的:
-
微
- SEM:
-
扫描电子显微镜
- ZT型:
-
玉米素
- ACS2:
-
1-氨基环丙烷-1-羧酸合酶
- CmWIP1:
-
C2H2锌指转录因子名为WIP蛋白
- BZIP48:
-
基本region-leucine拉链
- DCL1:
-
Dicer-like1.
- GBCO:
-
概要
- GBFT:
-
开花轨迹T.
- RT-qPCR:
-
定量实时RCR
- FPKM:
-
每百万次碎片每千碱基碎片映射
- SPL:
-
类似Squmosa启动子结合蛋白
- 前:
-
Argonaute.
- RISC:
-
RNA-induced沉默复杂
- EMF2:
-
乙烯反应转录因子2
- AP2:
-
APETALA2
- PVPP:
-
聚乙烯丙基吡咯烷酮
- HPLC:
-
高效液相色谱
- TPM:
-
每百万百万映射的外显子模型每千碱基读数
- 核糖体rna:
-
核糖体RNA
- TRNA:
-
运输RNA.
- SnRNA:
-
小核RNA
- Snorna:
-
小核仁RNA
- NCBI:
-
国家生物技术信息中心
- 罗斯福:
-
假发现率
- FC:
-
褶皱变化
- NCBI nr:
-
国家生物技术中心信息信息非冗余
- 走:
-
基因本体论
- Kegg:
-
Kyoto基因和基因组的百科全书
- COG:
-
同源组的蛋白质簇
参考
- 1。
Ahlemeyer B,Krieglstein J.神经保护作用银杏毕洛巴巴提取。细胞生物学与分子生物学。2003;60(9):1779-92。
- 2。
辛格B,kaur p,sopichand grd,ahuja ps。生物学和化学银杏毕洛巴巴.Fitoterapia。2008;79(6):401 - 18。
- 3.
张强,李军,桑勇,邢胜,吴强,刘欣银杏毕洛巴巴Mak var. epiphylla。《公共科学图书馆•综合》。2015;10 (5):e0127184。
- 4.
严建平,毛东,刘学明,王丽丽,徐峰,王国英,等。昼夜节律调节的CONSTANS同源物的分离和功能特性(GBCO.) 从银杏毕洛巴巴.植物细胞批准。2017; 36(9):1387-99。
- 5。
Mao D,YE JB,XU F.裸子植物开花基因的进展。不是Bot Horti Agrobo。2019; 47(1):1-9。
- 6。
Delichere C,Veuskens J,Hernould M,Barbacar N,Mouras A,Negrutiu I等。SlY1它是第一个从植物Y染色体中克隆出来的活性基因,编码WD-repeat蛋白。EMBO j . 1999; 18(15): 4169 - 79。
- 7。
pfent c,pobursky kj,sather dn,golenberg em。表征Spapetala3.和SpPISTILLATA, B类花的同一性基因在Spinacia oleracea,以及他们与性二甲症的关系。开发基因Evol。2005; 215(3):132-42。
- 8。
转录组分析表明GA通过乙烯依赖和乙烯非依赖途径调控黄瓜性表达(Cucumis sativusl .)。前植物SCI。2017; 8:10。
- 9。
赤城等。在猕猴桃中,通过细胞系特异性复制细胞分裂素反应调节因子,产生了一个y编码的女性化抑制因子。植物细胞。2018;30(4):780 - 95。
- 10。
Akagi T,Pilkington Sm,Varkonyi-Gasic E,Henry Im,Sugano SS,Sonoda M,等。两种染色体编码基因决定了猕猴桃中的性别。Nat植物。2019; 5(8):801-9。
- 11.
Eleblu JSY, Haraghi A, Mania B, Camps C, Rashid D, Morin H,等。的gynoeciousCMWIP1.转录因子与之相互作用CmbZIP48抑制卡皮克的发展。SCI批准。2019; 9:15443。
- 12.
Hardenack S,Ye D,Saedler H,Grant S. MADS箱基因表达的比较疯狂植物白露天的男性和女性花卉。植物细胞。1994年; 6(12):1775-87。
- 13。
Khryanin VN。植物激素对植物性别分化的作用。Russ J植物Physl。2002; 49(4):545-51。
- 14。
Gerashchenkov Ga,Rozhnova Na。植物激素在植物性别监管中的参与。Russ J植物Physl。2013; 60(5):597-610。
- 15.
吴国平,吴国平。核加工与microrna出口技术研究拟南芥.Proc Natl Acad Sci U S A A. 2005; 102(10):3691-6。
- 16。
桶DP。microrna:基因组学、生物起源、机制和功能。细胞。2004;116(2):281 - 97。
- 17。
郭HS,谢Q,Fei JF,Chua NH。microRNA将转录因子NaC1的mRNA切割引导到下调植物引线信号拟南芥侧根开发。植物细胞。2005; 17(5):1376-86。
- 18。
Medina C,Da Rocha M,Magliano M,Ratpopoulo A,Revel B,Marteu N等人。来自MicroRNA的特征拟南芥胆量突出显示MIR159在植物响应的MIR159对根结Nematode的作用Meloidogyne incognita..新植物。2017; 216(3):882-96。
- 19。
刘S,Mi X,张R,A Y,周Q,Yang T等人。MiRNA的综合分析及其目标揭示了MiR319C / TCP2调节茶叶灌浆的顶端芽(茶树).足底。2019;250(4):1111 - 29。
- 20。
Schauer Se,Jacobsen Se,Meinke DW,Ray A. Dicer-Like1:盲人男子和大象拟南芥发展。植物科学进展,2002;7(11):487-91。
- 21。
刘冬梅,宋勇,陈志新,于迪强。miR396的异位表达受到抑制平目的基因表达和改变叶片生长拟南芥.杂志。2009;136(2):223 - 36。
- 22.
Millar AA, Waterhouse PM。植物和动物的microrna:异同。功能整合基因组。2005;5(3):129-35。
- 23.
Palatnik JF,Allen E,Wu XL,Schommer C,Schwab R,Carrington JC,Weigel D.通过MicroRNA控制叶片形态发生。自然。2003; 425(6955):257-63。
- 24.
银行农协。玉米的MicroRNA、性别决定和花分生组织决定。基因组医学杂志。2008;9(1):204。
- 25。
Akagi T,Henry Im,Tao R,Comai L. Spl Science 2014; 346(6209):646-650。
- 26。
诚如成,程J,徐F,YE J,Wang Xh。调整E类MADS箱基因的分子克隆及表达分析,Gbsep., 从银杏毕洛巴巴.J Anim Plant SCI。2016; 26(1):253-60。
- 27。
王旭,程杰,徐F,李XX,张WW,廖友等。疯箱基因的分子克隆及表达分析(GbMADS2) 从银杏毕洛巴巴.不是Bot Horti Agrobo。2015B; 43(1):19-24。
- 28。
杨飞,徐飞,王小华,廖玉玲,陈庆伟,孟XX。MADS-box转录因子基因的特性及功能分析(GbMADS9) 从银杏毕洛巴巴.Sci Hortic。2016;212:104-14。
- 29。
王丽丽,严建平,周旭,程淑英,陈志新,宋清良,等。GBFT.,一个开花轨迹T.同族体从银杏毕洛巴巴,促进转基因植物开花拟南芥.Sci Hortic。2019;247:205-15。
- 30.
关键词:microRNA,作物改良,基因工程,基因工程abstract:植物科学。2018;274:193 - 200。
- 31。
王利伟,刘洪辉,李大东,陈海波。玉米种子萌发早期微rna的鉴定与表征。BMC基因组学。2011;12:154。
- 32。
aryal r,明兰开花植物的性别测定:木瓜作为一个模型系统。植物科学。2014;217:56 - 62。
- 33。
Addo-Quaye C, Miller W, Axtell MJ。CleaveLand:一个管道,使用降解数据,以发现剪切小RNA靶点。生物信息学。2009;25(1):130 - 1。
- 34。
崔J,赵杰,赵家,徐H,王L,Jin B.在血管舞蹈阶段从休眠阶段到积极阶段的血管壁过渡期间的细胞学和miRNA表达改变银杏毕洛巴巴L.树木。2016; 30(6):2177-88。
- 35。
王L,赵jg,张m,李wx,罗克,卢紫猫等。MicroRNA表达的鉴定与表征银杏毕洛巴巴l .树叶。中国林业科学。2015a;11(4):76。
- 36。
叶军,张旭,谭军,徐飞,程胜,陈志,等。全球的识别银杏毕洛巴巴通过高通量测序和降解组分析,了解microrna及其在三内酯代谢调控网络中的作用。Ind Crop Prod. 2020;148:112289。
- 37。
杜世,桑友,刘XJ,邢Sy,李杰,唐清HX等。来自不同性别类型的转录组剖面分析银杏毕洛巴巴acta botanica yunnanica(云南植物研究),2016;
- 38。
等。综合转录组、小RNA和降解组测序方法为鹰嘴豆抗子囊叶枯病提供了深入的了解。植物生态学报;2019;17(5):914-31。
- 39。
李X,李杰,风扇Z,刘Z,龙崎T,尹H.全球基因表达定义了褪色的双花卉驯化规范山茶花.Sci众议员2017;7:3197。
- 40.
Schwarz DS,Hutvagner G,Du T,Xu Zs,Aronin N,Zamore PD。在RNAi酶络合物组装中的不对称性。细胞。2003; 115(2):199-208。
- 41.
Yu B,王H. MicroRNA在植物中的翻译抑制。PROG MOL SUBCELL BIOL。2010; 50:41-57。
- 42.
Tanurdzic M, Banks JA。陆生植物的性别决定机制。植物细胞。2004;16:s61 - 71。
- 43。
Lea US,Slimestad R,Smedvig P,Lillo C.氮气缺乏增强了类黄酮途径中特异性MYB和BHLH转录因子的表达和最终产物的积累。Planta。2007; 225(5):1245-53。
- 44。
张天庆,赵玉玲,王永春,刘志勇,高长青。综合分析MYB基因家族及其在非生物胁迫下的表达和激素治疗Tamarix Hispida..前植物SCI。2018; 9:1303。
- 45。
顾志勇,朱军,郝强,袁玉文,段玉文,门SQ,等。一种新的R2R3-MYB转录因子通过调节牡丹器官特异性pschs的表达促进花瓣斑点形成(牡丹).植物生理学杂志。2019;60(3):599-611。
- 46.
Saha G,Park Ji,Ahmed Nu,Kayum Ma,Kang Kk,努力。黄土转录因子对大白菜雄性器官发展的特征及表达探析(Brassica Rapa ssp pekinensis).植物生理与生物化学。2016;104:200-15。
- 47.
Vimolmangkang S, Han YP, Wei GC, Korban SS.一个苹果MYB转录因子MdMYB3参与花色苷生物合成和花发育的调控。BMC Plant Biol. 2013;13:176。
- 48.
曼达卡尔,浏览MJ。MYB108与myb24共同作用,调控茉莉酸介导的雄蕊成熟拟南芥.植物杂志。2009;149(2):851 - 62。
- 49。
宋少森,齐涛涛,黄辉,任QC,吴德伟,常春强,等。zim结构域蛋白与R2R3-MYB转录因子MYB21和MYB24相互作用,影响茉莉酸调控的雄蕊发育拟南芥.植物细胞。2011; 23(3):1000-13。
- 50.
alabadi d,blazquez ma,Carbonell J,Ferrandiz C,Perez-Amador Ma。植物开发中激素的有效作用。int j dev bio。2009; 53(8-10):1597-608。
- 51.
徐克,黄杰,杨烨,姚雅。花卉性别分化的转录体分析麻风树L.使用RNA测序。Plos一个。2016; 11(2):E0145613。
- 52.
刘嘉德,冯SX,潘友,钟俊,陈义,元CC。糖苹果中花卉过渡和花卉发育的转录组分析及鉴定(Annona Squamosa.l .)。植物学报2016;7:1695。
- 53。
刘兴国,丁廷田,李冬梅,史波辉,李艳萍,曹晓伟,等。生长素反应因子3整合了AGAMOUS和APETALA2在花分生组织决定中的功能。植物j . 2014 b, 80(4): 629 - 41。
- 54。
刘n,吴S,van Houten J,Wang Y,Ding B,Fei ZJ等。MicroRNA 167通过MicroRNA 167的疾病响应因子6和8的下调导致番茄中的花卉发育缺陷和女性无菌性。J Exp Bot。2014A; 65(9):2507-20。
- 55。
刘军,华伟,胡震,杨辉,张磊,李锐,等。自然的变化ARF18基因同时影响多倍体油菜的种子重量和角果长度。中国科学院院刊2015;112(37):E5123-32。
- 56。
Dellaporta SL,Calderon-Urrea Da。开花植物中的性别测定。植物细胞。1993; 5(10):1241-51。
- 57。
慧红,杨yt,吴gj,彭cc,陈xy,zayed mz。转录组简档分析显示了花卉性别分化的调节机制麻风树铜RCAS L. SCI REP。2017; 7:16421。
- 58。
倪静,沙发,刘文伟,王启军,王德东,赵文伟,等。比较转录组分析揭示了细胞分裂素在促进油菜花雌性化中的调控网络Sapium sebiferum.BMC植物BIOL。2018; 18:96。
- 59。
程泽,朱斯,高XQ,张XS。细胞素素和生长素在体外调节WUS诱导和花序再生拟南芥.植物学报2010;29(8):927-33。
- 60.
李德德,盛y,牛hh,李紫血。基因相互作用调节葫芦科的性别测定。前植物SCI。2019; 10:1231。
- 61.
Fujiwara S,Nakagawa M,ODA A,Kato K,Mizoguchi T. PhotoPeriod Patway调节表达MAF5.和FLC.编码FLC系列的Mads-Box转录因子拟南芥.植物生物科技。2010; 27(5):447-54。
- 62.
Wurschum T,Gross-Hardt R,Laux T.APETALA2调节干细胞生态位拟南芥分生组织。植物细胞。2006;18(2):295 - 307。
- 63.
yant l,mathieu j,Dinh Tt,Ott F,Lanz C,Wollmann H,等。花卉过渡和花卉发展的策划拟南芥通过双功能转录因子APETALA2。植物细胞。2010;22(7):2156 - 70。
- 64.
金B,王L,王继,腾NJ,他XD,MU XJ,王YL。无菌花的结构和作用荚虫猕猴桃F.keteleeri.(亚恶魔)。植物BIOL。2010; 12(6):853-62。
- 65.
Onanuga AO,Jiang P,ADL S.棉花品种内源激素含量的测定(gossypiumhirsutum)由于磷和钾营养的影响。j农业sci。2012; 4:7。
- 66.
Fahlgren N,Howell Md,Kasschau Kd,Chapman Ej,Sullivan Cm,Cumbie Js等人。高吞吐量排序拟南芥小分子核糖核酸:频繁出生和miRNA基因死亡的证据。Plos一个。2007; 2(2):E219。
- 67。
Langmead B,Trapnell C,Pop M,Salzberg SL。超快和记忆高DNA序列对人类基因组的对准。基因组Biol。2009; 10(3):R25。
- 68。
关锐,赵颖,张辉,范国英,刘旭,周文伟,等。活化石的基因组草图银杏毕洛巴巴.傻瓜。2016; 5:49。
- 69。
Bolger Am,Lohse M,Usadel B. Trimmomatic:用于Illumina序列数据的灵活修剪器。生物信息学。2014; 30(15):2114-20。
- 70.
王力坤,冯志新,王旭,王新伟,张晓刚。Degseq:一个用于从RNA-seq数据中识别差异表达基因的R包。生物信息学,2010,26(1):136 - 8。
- 71.
德国MA,Pillay M,Jeong DH,Hetawal A,Luo SJ,Janardhanan P,等。通过平行分析RNA末端通过平行分析来全局鉴定MicroRNA-靶RNA对。NAT BIOTECHNOL。2008; 26(8):941-6。
- 72.
MirDeep2能够准确地识别7个动物分支中已知的和数百个新的microRNA基因。核酸学报2012;40(1):37-52。
- 73.
Yang XZ, Li L. MiRDeep-P:一种用于分析植物microRNA转录组的计算工具。生物信息学。2011;27(18):2614 - 5。
- 74.
利用DESeq2对RNA-seq数据的折叠变化和离散度进行调节估计。基因组医学杂志。2014;15(12):550。
- 75.
Allen E,谢Z,Gustafson Am,Carrington JC。植物中杂交siRNA生物发生期间的MicroRNA定向阶段。细胞。2005; 121(2):207-21。
- 76.
邓媛媛,李建强,吴顺峰,朱艳萍,陈永文,何福成。蛋白质注释系统中NR数据库的集成及其定位。第一版。2006;32:71-4。
- 77。
Apweiler R,Bairoch A,Wu Ch,Barker Wc,Boeckmann B,Ferro S等人。UNIPROT:通用蛋白质知识库。核酸RES。2004; 32:D115-9。
- 78。
Ashburner M,球CA,Blake Ja,Botstein D,Cherry JM。基因本体:生物学统一的工具。NAT Genet。2000; 25(1):25-9。
- 79。
Kanehisa M, Goto S, Kawashima S, Okuno Y, Hattori M. KEGG资源解码的基因组。核酸学报2004;32:D277-80。
- 80。
Tatusov RL, Galperin MY, Natale DA, Koonin EV。COG数据库:用于蛋白质功能和进化的基因组规模分析的工具。核酸学报2000;28(1):33-6。
- 81。
郑氏,燕姬,孟X,张文,廖义,叶杰,等。肉桂醛 - 4-羟化酶基因的表征和表达模式,参与木质素生物合成,以及响应各种应力和荷尔蒙治疗银杏毕洛巴巴.acta physiol植物。2018; 40(1):1-15。
- 82。
YE J,Cheng S,周X,Chen ZX,Kim Su,Tan JP等。全长转录组的全球调查银杏毕洛巴巴揭示涉及类黄酮生物合成的转录变体。Ind Crop Prod. 2019;139:111547。
- 83.
Schmittgen TD,Livak KJ。用比较CT法分析实时PCR数据。NAT PROTOC。2008; 3(6):1101-8。
致谢
作者要感谢扬子大学银杏花园的负责人,我们允许在这个实验中收集所有样品。
资金
本研究由国家自然科学基金项目(No. 31670608)资助。资助机构在研究的设计、数据的收集、分析和解释以及手稿的撰写中没有发挥任何作用。
作者信息
隶属关系
贡献
FX和SC构思并设计了实验。XL, JY, ZC, YL进行了各种实验。XL、WZ和SK分析了数据。稿件由XL和FX撰写。所有作者均已阅读并批准本稿件。
通讯作者
伦理宣言
伦理批准和同意参与
不适用。
同意出版
不适用。
相互竞争的利益
提交人声明他们没有竞争利益。
额外的信息
出版商的注意事项
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
补充信息
附加文件1:表S1
鉴定已知和新的miRNA。
附加文件2:图S1
深度测序小RNA的长度分布与表征。(a)小RNA序列的长度分布。(b)具有不同预测长度的miRNA的第一核苷酸偏差。(c)miRNA的每个位置处的相对核苷酸偏压。
附加文件3:表S2
不同时期雌、雄球果mirna表达差异g . biloba.
附加文件4:图S2
DE miRNAs靶基因功能注释。(A) GO分类直方图。(B) COG功能分类。(C)途径富集分析清单。(D) KEGG通路富集散点图。
附加文件5:表S3
统计银杏降解组测序数据。
附加文件6:表S4
小RNA,转录组和降解测序组合分析的综合信息。
附加文件7:表S5
RT-qPCR检测miRNA的引物。
附加文件8:表S6
通过RT-QPCR检测靶基因的引物。
权利和权限
开放访问本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料都包含在本文的知识共享许可中,除非在该材料的信用额度中另有说明。如果资料不包括在文章的知识共享许可协议中,并且你的预期用途没有被法律规定允许或超过允许用途,你将需要直接从版权所有者获得许可。如欲查阅本许可证副本,请浏览http://creativecommons.org/licenses/by/4.0/.Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用这篇文章
刘,xm。,程,sy。,ye,jb。et al。与斯特罗毕性分化相关的miRNA的筛选和鉴定银杏毕洛巴巴通过对小RNA,RNA和降低测量测序的整合分析。BMC植物BIOL.20,387(2020)。https://doi.org/10.1186/s12870-020-02598-8
已收到:
公认:
发表:
关键字
- 差异表达基因
- 银杏毕洛巴巴
- microrna的
- 叶性测定
- 靶基因