- 研究文章gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
小麦III类过氧化物酶基因家族成员,gydF4y2BaTaPRX-2A,gydF4y2Ba增强了对盐胁迫的耐受性gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba20.gydF4y2Ba文章编号:gydF4y2Ba392gydF4y2Ba(gydF4y2Ba2020gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
盐和干旱是制约作物产量的主要非生物胁迫。过氧化物酶(PRXs)参与多种非生物胁迫反应。此外,只有少数小麦PRXs在非生物胁迫响应机制中被表征。gydF4y2Ba
结果gydF4y2Ba
在本研究中,一个新的小麦过氧化物酶(PRX)基因被命名gydF4y2BaTaPRX-2A,gydF4y2Ba克隆了小麦III类PRX基因家族的一个成员,并对其对盐胁迫的响应进行了研究。通过对12种植物中III类prx的鉴定和进化分析,提出了植物的进化模型gydF4y2BaTaPRX-2AgydF4y2Ba,表明在进化过程中发生了一些外显子融合事件。我们还在13个涉及我们的进化模型的PRX区域中检测到PRX域的正选择,并在进化过程中发现2 - 6个正选择位点gydF4y2BaTaPRX-2AgydF4y2Ba进化。定量逆转录聚合酶链反应(qRT-PCR)结果显示gydF4y2BaTaPRX-2AgydF4y2Ba在根组织中表达量高于在叶和茎组织中表达量。gydF4y2BaTaPRX-2AgydF4y2Ba非生物胁迫和激素处理如聚乙二醇6000、NaCl、过氧化氢(HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba)、水杨酸(SA)、甲基茉莉酸(MeJA)和脱落酸(ABA)。转基因小麦植株过表达gydF4y2BaTaPRX-2AgydF4y2Ba对盐胁迫的耐受性高于野生型。共聚焦显微镜显示gydF4y2BaTaPRX-2AgydF4y2Ba-eGFP主要定位于细胞核。成活率、相对含水量、茎长均较高gydF4y2BaTaPRX-2AgydF4y2Ba-过表达小麦较WT小麦有显著差异,而根长无显著差异。超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)活性增强gydF4y2BaTaPRX-2AgydF4y2Ba-过表达的小麦与WT小麦相比,导致活性氧(ROS)积累和丙二醛(MDA)含量降低。下游胁迫相关基因表达水平表明gydF4y2BaRD22gydF4y2Ba,gydF4y2BaTLP4gydF4y2Ba,gydF4y2BaABAIgydF4y2Ba,gydF4y2BaGST22gydF4y2Ba,gydF4y2BaFeSODgydF4y2Ba,gydF4y2Ba猫gydF4y2Ba表现出更高的表达gydF4y2BaTaPRX-2AgydF4y2Ba在盐胁迫下,小麦比WT过表达。gydF4y2Ba
结论gydF4y2Ba
结果表明:gydF4y2BaTaPRX-2AgydF4y2Ba通过清除ROS和调节胁迫相关基因在盐胁迫应答中发挥积极作用。gydF4y2Ba
背景gydF4y2Ba
高盐和干旱等非生物胁迫对植物发育和生物量形成产生深远的负面影响,导致全球作物产量显著下降[gydF4y2Ba1gydF4y2Ba].为了适应这些非生物胁迫,植物进化出了复杂的生理和生化机制来缓解胁迫相关的损伤,例如释放活性氧[gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba].先前的研究表明过氧化氢(HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba)预处理可通过调节抗氧化酶活性、矿物质吸收和脯氨酸水平来提高小麦的耐盐性[gydF4y2Ba4gydF4y2Ba].在高等植物细胞中,ROS以多种形式存在,包括HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba,超氧自由基(OgydF4y2Ba2gydF4y2Ba.−gydF4y2Ba)和羟基自由基(OHgydF4y2Ba−gydF4y2Ba).活性氧是在非生物条件下产生的,通过破坏细胞膜脂类、核酸等引起细胞的快速损伤[gydF4y2Ba5gydF4y2Ba].植物通过激活抗氧化系统,建立了复杂的清除ROS系统,以维持ROS的稳定水平。在这种情况下,抗氧化系统主要是指几种内源性抗氧化酶对自由基的清除,如谷胱甘肽过氧化物酶(GPX)、抗坏血酸过氧化物酶(APX)、过氧化氢酶(CAT)和超氧化物歧化酶(SOD) [gydF4y2Ba6gydF4y2Ba,gydF4y2Ba7gydF4y2Ba,gydF4y2Ba8gydF4y2Ba].据报道,抗氧化酶(如。gydF4y2Ba,gydF4y2BaAPX, CAT)在植物遭受盐胁迫时也发生改变[gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10gydF4y2Ba].此外,据报道,prx可以通过催化氧化还原反应保护细胞免受ROS的侵害[gydF4y2Ba11gydF4y2Ba].gydF4y2Ba
prx存在于许多物种中,如微生物、动物和植物[gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba,gydF4y2Ba14gydF4y2Ba,gydF4y2Ba15gydF4y2Ba].这些化合物根据不同的分子结构和催化性能分为三个超家族。第一个超家族包括动物酶,如嗜酸性粒细胞PRX和GPX。第二个超家族广泛分布在许多物种中(细菌、动物、真菌、植物和酵母)。第三个超家族存在于植物、细菌和真菌中[gydF4y2Ba14gydF4y2Ba,gydF4y2Ba15gydF4y2Ba].根据原蛋白结构的不同,PRXs被分为三类:ⅰ类PRXs存在于细胞内,ⅱ类PRXs存在于细胞外,III类PRXs由大的多基因家族组成[gydF4y2Ba16gydF4y2Ba].I类prx在清除过量H中起关键作用gydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba[gydF4y2Ba16gydF4y2Ba,gydF4y2Ba17gydF4y2Ba,gydF4y2Ba18gydF4y2Ba],第II类PRXs(发现于真菌中)参与土壤碎片的降解[gydF4y2Ba16gydF4y2Ba,gydF4y2Ba19gydF4y2Ba], III类prx是植物特异性的[gydF4y2Ba20.gydF4y2Ba].在异allo六倍体小麦中已鉴定出超过110个III类PRXs [gydF4y2Ba21gydF4y2Ba].gydF4y2Ba栽培稻gydF4y2Ba包括138个第III类prx [gydF4y2Ba22gydF4y2Ba].73个序列编码的III类prxgydF4y2Ba拟南芥,gydF4y2Ba玉米中已鉴定出119个III类PRXs [gydF4y2Ba12gydF4y2Ba,gydF4y2Ba23gydF4y2Ba].gydF4y2Ba杨树trichocarpagydF4y2Ba包含93个第III类prx [gydF4y2Ba24gydF4y2Ba].gydF4y2Ba
III类PRXs在植物发育过程中具有多种功能,包括细胞壁硬化、细胞壁成分交联、抵御病原体感染、HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba移走、伤害[gydF4y2Ba12gydF4y2Ba,gydF4y2Ba16gydF4y2Ba,gydF4y2Ba25gydF4y2Ba].研究了大量的prxgydF4y2Ba答:芥gydF4y2Ba并对其功能进行了验证。例如,gydF4y2BaAtPRX72gydF4y2Ba在木质化过程中起重要作用[gydF4y2Ba26gydF4y2Ba),而gydF4y2BaAtPRX33gydF4y2Ba而且gydF4y2BaAtPRX34gydF4y2Ba在细胞伸长中起作用[gydF4y2Ba16gydF4y2Ba].一些研究已经证明了这一点gydF4y2BaAtPRX21, AtPRX62gydF4y2Ba,gydF4y2BaAtPRX71gydF4y2Ba作为对伤害和真菌胁迫的反应的一部分而分泌[gydF4y2Ba27gydF4y2Ba,gydF4y2Ba28gydF4y2Ba].的gydF4y2Ba陆地棉gydF4y2Ba基因gydF4y2BaGhPOX1gydF4y2Ba可通过产生活性氧引起棉纤维细胞伸长[gydF4y2Ba29gydF4y2Ba].据报道,一些PRXs通过协调水杨酸(SA)、茉莉酸(MeJA)和乙烯(ET),在宿主植物对抗坏死性或生物营养性病原体的防御中发挥核心作用[gydF4y2Ba20.gydF4y2Ba].例如,gydF4y2BaTaPRX111, TaPRX112gydF4y2Ba,gydF4y2BaTaPRX113gydF4y2Ba参与了植物对小麦线虫感染的反应[gydF4y2Ba30.gydF4y2Ba].在水稻中,PRXs的表达模式显示出重要的功能多样性,特别是在对胁迫的响应中[gydF4y2Ba31gydF4y2Ba].的gydF4y2Ba玉米gydF4y2Ba插件可以gydF4y2BaZmPRX26gydF4y2Ba,gydF4y2BaZmPRX42gydF4y2Ba,gydF4y2BaZmPRX71gydF4y2Ba,gydF4y2BaZmPRX75gydF4y2Ba,gydF4y2BaZmPRX78gydF4y2Ba参与了对各种非生物胁迫条件的响应[gydF4y2Ba12gydF4y2Ba].此外,GPXs是PRX家族的成员,在植物中具有重要的功能。的gydF4y2Ba答:芥gydF4y2BaGPX基因,gydF4y2BaAtGPX3,gydF4y2Ba在干旱胁迫和脱落酸(ABA)介导的信号传导下,它是一种普通的清道夫和信号转换器[gydF4y2Ba32gydF4y2Ba].六个gydF4y2BaGPXsgydF4y2Ba在gydF4y2BaCucumis巨大成功gydF4y2Ba都对ABA处理和非生物胁迫有响应。此外,已知有5种水稻GPXs在对H的反应中发挥作用gydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba而冷应激[gydF4y2Ba33gydF4y2Ba].一些小麦prx也被发现在抗旱性中发挥作用,正如微阵列实验所揭示的[gydF4y2Ba34gydF4y2Ba].两个小麦GPXs, W69和W106,在转基因中被证明可以提高耐盐性gydF4y2Ba拟南芥gydF4y2Ba[gydF4y2Ba7gydF4y2Ba].gydF4y2Ba
小麦是世界上一种重要的经济作物,但其产量常受非生物胁迫的限制[gydF4y2Ba35gydF4y2Ba,gydF4y2Ba36gydF4y2Ba].一些prx在抗盐胁迫中的作用已被报道;然而,这些反应背后的小麦PRXs分子机制仍有待充分了解。在这项研究中,我们克隆了一个PRX基因gydF4y2BaTaPRX-2AgydF4y2Ba从小麦(gydF4y2Ba小麦gydF4y2Ba),并研究了盐胁迫的耐受性gydF4y2BaTaPRX-2AgydF4y2Ba在转基因小麦。进化分析表明,在此过程中可能发生了一些外显子融合事件和正向选择gydF4y2BaTaPRX-2AgydF4y2Ba进化。基因表达模式分析证实gydF4y2BaTaPRX-2AgydF4y2Ba干旱、盐、HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba和ABA处理。我们的研究结果表明gydF4y2BaTaPRX-2AgydF4y2Ba通过提高抗氧化胁迫能力和调节胁迫相关基因来提高小麦的耐盐性。我们的工作将使研究人员对植物的非生物胁迫耐受机制有新的认识。gydF4y2Ba
结果gydF4y2Ba
分离与演化gydF4y2BaTaPRX-2AgydF4y2Ba
为了进一步了解III类PRXs基因的进化保守或差异,我们对III类PRXs的基因结构进行了识别、分类和描述。12个工厂的生产效益评估(gydF4y2Bat . aestivumgydF4y2Ba,gydF4y2Ba小麦属植物dicoccoidesgydF4y2Ba,gydF4y2Ba小麦属植物urartugydF4y2Ba,gydF4y2Ba山羊草属tauschiigydF4y2Ba,gydF4y2BaBrachypodium distachyongydF4y2Ba,gydF4y2Bao .漂白亚麻纤维卷gydF4y2Ba,gydF4y2Baz梅斯gydF4y2Ba,gydF4y2Ba答:芥gydF4y2Ba,gydF4y2Ba葡萄gydF4y2Ba,gydF4y2Ba卷柏moellendorffiigydF4y2Ba,gydF4y2BaPhyscomitrella金属盘gydF4y2Ba,gydF4y2Ba、衣藻reinhardtiigydF4y2Ba)用HMMER 3.1和Pfam 32.0批处理模式进行鉴定,其中PRX结构域(过氧化物酶。嗯,PF00141.23)(附加文件gydF4y2Ba1gydF4y2Ba:表S1和附加文件gydF4y2Ba2gydF4y2Ba:表S2)。我们排除了这12种植物的非典型PRX,它们与PRX结构域的一致性< 50%gydF4y2Ba3.gydF4y2Ba:表S3)。这些prx的分类基于两种方法,HMMER3.1扫描和邻居连接(NJ)系统发育重建(附加文件gydF4y2Ba2gydF4y2Ba:表S2和附加文件gydF4y2Ba4gydF4y2Ba:图S1)。在12种植物中,PRXs结构域内的外显子-内含子结构也进行了研究gydF4y2Ba5gydF4y2Ba:图S2)。gydF4y2Ba
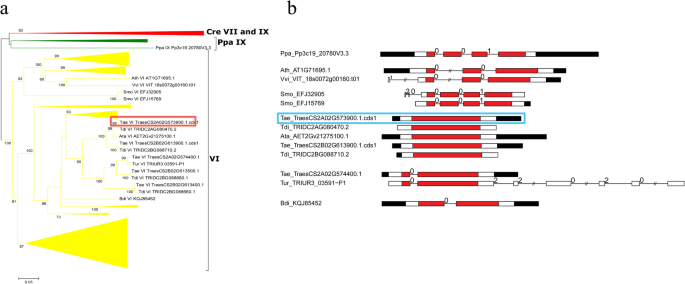
其中,我们克隆了一个成员(命名为gydF4y2BaTaPRX-2AgydF4y2Ba)对小麦品种“苏麦3号”的prx进行了分析。预测的gydF4y2BaTaPRX-2AgydF4y2Ba开放阅读框(ORF)为1026bp,推导出gydF4y2BaTaPRX-2AgydF4y2Ba蛋白质由342个氨基酸残基组成。来自国家生物技术信息中心(NCBI)的BLAST(基本局部对齐搜索工具)结果显示,在基因组中发现了一个PRX基因(GenBank: AJ878510.1)gydF4y2Bat . aestivumgydF4y2Ba“夏延”的E值最小。我们对12个工厂的prx进行了本地BLAST测试,结果表明gydF4y2Bat . aestivumgydF4y2Ba插件可以TraesCS2A02G573900.1。cds1 from subfamily VI contained 100% sequence similarity withTaPRX-2A。gydF4y2Ba为了研究该无性系的进化,我们从这12种植物中重建了一个只包含VI亚科PRXs的小型NJ系统发育树,并比较了它们的结构特征(图1)。gydF4y2Ba1gydF4y2Baa, b).如图所示,的外显子-内含子结构gydF4y2Bat . aestivumgydF4y2Ba克隆(TraesCS2A02G573900.1.cds1)为单外显子结构,而其余4个小麦和cds1为单外显子结构gydF4y2BaAe。tauschiigydF4y2Ba同源PRXs (Tdi_TRIDC2AG080470.2, Ata_AET2Gv21275100.1, tae_traescs2b02g6139001。cds1, and Tdi_TRIDC2BG088710.2) in this clade also had a one-exon structure, suggesting that this one-exon structure originated in these PRXs before theTriticum-AegilopsgydF4y2Ba(图。gydF4y2Ba1gydF4y2Bab)。gydF4y2Ba
系统发生树和基因结构gydF4y2BaTaPRX-2AgydF4y2Ba和相关的prxgydF4y2BaAe。tauschii,gydF4y2Ba和其他植物。gydF4y2Ba一个gydF4y2Ba本研究详细阐述了邻接树。使用MEGA-CC 7.0软件,采用p-distance模型,利用PRX结构域的氨基酸序列构建邻域连接树。大部分序列属于III类PRX的VI亚族,部分分支被压缩。详细信息见附加文件gydF4y2Ba4gydF4y2Ba:图S1。gydF4y2BabgydF4y2Ba本研究检测了一些prx的外显子-内含子结构。红框代表PRX区域;白框代表其他外显子区域;黑箱代表未翻译区域(utr);线代表PRX内含子;数字0、1和2表示外显子相。长内含子被“//”缩短。我们研究了PRX (TraesCS2A02G573900.1.cds1)gydF4y2Bat . aestivumgydF4y2Ba是用红色或青色框圈起来的吗gydF4y2Ba
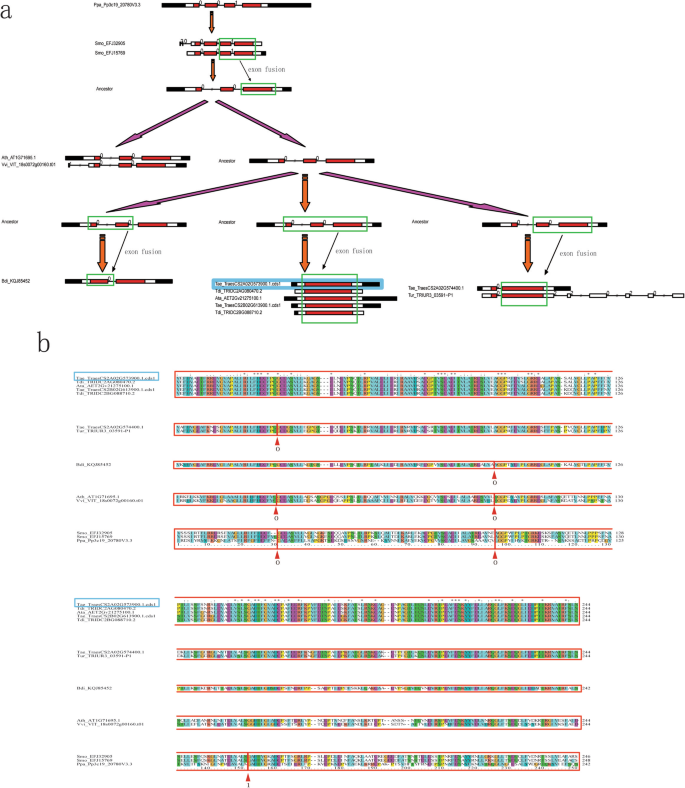
基于系统发育和外显子-内含子结构分析(附加文件gydF4y2Ba5gydF4y2Ba:图S2),我们提出了一个进化模型来确定起源gydF4y2BaTaPRXgydF4y2Ba-2A (TraesCS2A02G573900.1.cds1),参与了外显子融合过程(图2)。gydF4y2Ba2gydF4y2Baa).该模型表明被子植物和禾本科植物在羽化过程中发生了两轮外显子融合事件。第一次外显子融合事件(四个外显子变成三个外显子)发生在被子植物羽化过程中。类似于gydF4y2Bap .金属盘gydF4y2BaPRX (Pp3c19_20780V3.3)在四个外显子内包含一个保守的外显子-内含子结构,在PRX结构域附近有“001”外显子相。这种“001”外显子相内的4外显子结构在类似于2的祖先序列中保留了下来gydF4y2Ba美国moellendorffiigydF4y2BaPRXs (Smo_EFJ32905和Smo_EFJ15769)。然而,prx的外显子-内含子结构gydF4y2Ba答:芥gydF4y2Ba(Ath_AT1G71695.1)gydF4y2Ba诉,酿酒用葡萄gydF4y2Ba(Vvi_VIT_18s0072g00160.t01),gydF4y2Bao .漂白亚麻纤维卷gydF4y2Ba(Osa_Os04t0688200-01)突变为“00”外显子相内的三外显子结构,提示在monocot-eudicot进化分裂之前,在“001”外显子相内的四外显子结构的最后两个外显子发生了一次外显子融合事件。第二次外显子融合(3个外显子变成2个或1个外显子)发生在禾本科羽化过程中。如图所示。gydF4y2Ba2gydF4y2BaA,在“00”外显子相内的三外显子结构的前两个外显子可能已经融合变成了“0”外显子相内的二外显子结构(gydF4y2Bab . distachyongydF4y2BaKQJ85452)。类似地,最后两个外显子可能已经融合(gydF4y2Bat . aestivumgydF4y2BaTraesCS2A02G574400.1;gydF4y2Bat . urartugydF4y2BaTRIUR3_03591-P1)或者所有三个外显子都可以融合,从而合并成一个单外显子结构(gydF4y2BaAe。tauschii,gydF4y2BaAta_AET2Gv21275100.1;gydF4y2Bat . dicoccoidesgydF4y2BaTdi_TRIDC2AG080470.2 Tdi_TRIDC2BG088710.2;gydF4y2Bat . aestivumgydF4y2BaTraesCS2A02G573900.1。cds1, Tae_TraesCS2B02G613900.1.cds1). The alignments of these PRXs within the breakpoints of exon fusion events supported our proposed evolutionary model (Fig.2gydF4y2Bab)。gydF4y2Ba
确认这些PRX序列gydF4y2BaTaPRX-2AgydF4y2Ba在进化模型中,我们从7种植物的rna -测序(RNA-seq)数据中确定了cdna水平的证据(gydF4y2Bap .金属盘gydF4y2Ba,gydF4y2Ba答:芥gydF4y2Ba,gydF4y2Ba诉酿酒用葡萄gydF4y2Ba,gydF4y2Bab . distachyongydF4y2Ba,gydF4y2BaAe。tauschiigydF4y2Ba,gydF4y2Bat . dicoccoidesgydF4y2Ba而且gydF4y2Bat . aestivumgydF4y2Ba)(额外的文件gydF4y2Ba6gydF4y2Ba:表S4)。我们没有确定这些证据gydF4y2Ba美国moellendorffiigydF4y2Ba而且gydF4y2Bat . urartugydF4y2Ba因为他们的GFF3注释文件只是在支架中,而不是在染色体中。结果表明,大多数PRX序列(除了VIT_18s0072g00160。来自7个植物的t01和traescs2a02g57440.1)在RNA-seq数据(附加文件“信息”列中的FPKM和覆盖率值)中检测到gydF4y2Ba6gydF4y2Ba表S4),表明植物进化过程中发生了外显子融合事件。gydF4y2Ba
我们还检测到PRX结构域序列的阳性选择gydF4y2BaTaPRX-2AgydF4y2Ba和其他12个同源PRXs使用PAML 4.9(表gydF4y2Ba1gydF4y2Ba).根据站点特定模型的似然比检验,M2a(选择)模型显著高于M1a(中立)(自由度(df) = 2, 2ΔlnL = 68.4,gydF4y2BaPgydF4y2Ba< 0.005),说明部分氨基酸位点在进化过程中发生了正向选择。M7-M8比较(df = 2, 2ΔlnL = 7.47,gydF4y2BaPgydF4y2Ba< 0.025)也支持正选择假说。使用朴素经验贝叶斯和贝叶斯经验贝叶斯分析确定了这些积极选择的位点gydF4y2Ba7gydF4y2Ba:图S3a, b)。M2a和M8模型中分别发现2个(95 E和185 K,参考序列:Smo_EFJ32905)和6个阳性选择位点(95 E、110 S、117 Q、135 E、185 K和212 R)。进化节点的祖先序列也通过PAML 4.9和MEGAX(附加文件gydF4y2Ba7gydF4y2Ba:图S3)。gydF4y2Ba
的表达模式gydF4y2BaTaPRX-2AgydF4y2Ba在各种组织和压力治疗中gydF4y2Ba
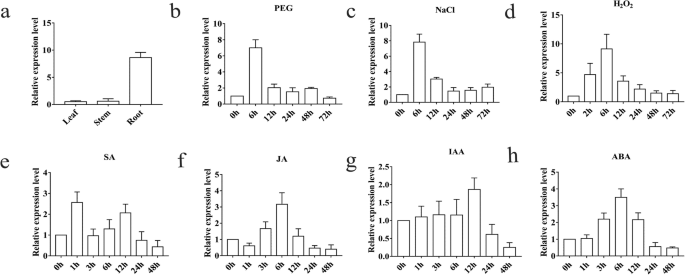
的表达模式gydF4y2BaTaPRX-2AgydF4y2Ba这是对压力相关信号的反应gydF4y2Ba,gydF4y2Ba我们在不同的组织(叶、茎和根)和不同的胁迫处理(PEG6000, NaCl, HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba, SA, MeJA, IAA,和ABA)。结果表明gydF4y2BaTaPRX-2AgydF4y2Ba在根、茎、叶中均有差异表达,其在根组织中的表达量显著高于在叶和茎组织中的表达量(图2)。gydF4y2Ba3.gydF4y2Baa).然后,我们检查表达模式gydF4y2BaTaPRX-2AgydF4y2Ba用qRT-PCR法对PEG 6000、NaCl和H进行处理gydF4y2Ba2gydF4y2BaOgydF4y2Ba2.gydF4y2Ba结果表明gydF4y2BaTaPRX-2AgydF4y2Ba在PEG 6000、NaCl和HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba在处理后6 h,表达量达到峰值(图。gydF4y2Ba3.gydF4y2Bab, c,和d)。我们还检测了四种植物激素的表达模式。如图所示。gydF4y2Ba3.gydF4y2Bae,gydF4y2BaTaPRX-2AgydF4y2BaSA处理1小时后,表达约2.5倍的上调(图。gydF4y2Ba3.gydF4y2Bae).同样,的表达水平gydF4y2BaTaPRX-2AgydF4y2Ba在JA和ABA处理后6 h达到峰值(图5)。gydF4y2Ba3.gydF4y2Baf, h)。然而,gydF4y2BaTaPRX-2AgydF4y2Ba在IAA处理后0-6小时内保持相对不变,但在12小时内表现出约1.5倍的上调(图5)。gydF4y2Ba3.gydF4y2Bag).这些结果表明gydF4y2BaTaPRX-2AgydF4y2Ba在各种非生物应激反应中。gydF4y2Ba
记录的分析gydF4y2BaTaPRX-2AgydF4y2Ba.gydF4y2Ba一个gydF4y2BaTaPRX-2AgydF4y2Ba正常条件下和不同胁迫处理下叶、根、茎的表达水平:(gydF4y2BabgydF4y2Ba) 20% (w/v) PEG 6000, (gydF4y2BacgydF4y2Ba200 mM NaCl, (gydF4y2BadgydF4y2Ba) 10 mM HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba, (gydF4y2BaegydF4y2Ba) 2 mM SA, (gydF4y2BafgydF4y2Ba100 μM MeJA, (gydF4y2BaggydF4y2Ba) 100 μM IAA, (gydF4y2BahgydF4y2Ba) 100 mM ABA。gydF4y2Ba18 srrnagydF4y2Ba作为内源性对照。基因相对表达量由循环阈值(Ct)值计算(公式2)gydF4y2Ba-ΔΔCTgydF4y2Ba.数据以三次重复计算的平均值±标准差表示gydF4y2Ba
亚细胞定位gydF4y2BaTaPRX-2AgydF4y2Ba蛋白质gydF4y2Ba
描述:描述…的功能gydF4y2BaTaPRX-2AgydF4y2Ba的ORFgydF4y2BaTaPRX-2AgydF4y2Ba在CaMV 35S启动子的控制下融合到pBIN35S-eGFP载体上(附加文件gydF4y2Ba8gydF4y2Ba:图S4a)。pBIN35S:eGFP空矢量控制和pBIN35S:gydF4y2BaTaPRX-2AgydF4y2Ba:将eGFP重组载体转入烟草叶片细胞gydF4y2Ba农杆菌属gydF4y2Ba渗透。观察注射后表皮细胞的变化gydF4y2Ban benthamianagydF4y2Ba用共聚焦显微镜观察叶片,发现gydF4y2BaTaPRX-2AgydF4y2BaeGFP主要定位于细胞核中gydF4y2Ba8gydF4y2Ba:无花果。S4bgydF4y2Ba1gydF4y2Ba- dgydF4y2Ba2gydF4y2Ba).此外,pBIN35S-gydF4y2BaTaPRX-2AgydF4y2Ba-eGFP和pBINgydF4y2Ba35个年代gydF4y2Ba-eGFP载体转化洋葱表皮细胞。与在烟草表皮细胞中观察到的定位结果一致gydF4y2BaTaPRX-2AgydF4y2BaeGFP也主要定位于洋葱表皮细胞的细胞核中gydF4y2Ba8gydF4y2Ba:无花果。S4bgydF4y2Ba3.gydF4y2Ba- dgydF4y2Ba4gydF4y2Ba).此外,web服务器cNLS的预测表明,在核定位信号(NLS)序列中存在5个序列gydF4y2BaTaPRX-2AgydF4y2Ba(附加文件gydF4y2Ba9gydF4y2Ba:图S5)。gydF4y2Ba
TaPRX-2AgydF4y2Ba转基因小麦耐盐性增强gydF4y2Ba
进一步确认的功能gydF4y2BaTaPRX-2AgydF4y2Ba在植物抗盐胁迫方面,对小麦品种KN199进行了改良gydF4y2BaTaPRX-2AgydF4y2Ba构建了3个独立的转基因株系(TaOE1, TaOE2和TaOE3)。表达谱gydF4y2BaTaPRX-2AgydF4y2Ba分析了在gydF4y2BaTaPRX-2AgydF4y2BaqRT-PCR转基因株系。结果表明,转基因株系的表达水平高于野生型(WT)植株gydF4y2Ba10gydF4y2Ba:无花果S6a)。我们随后测量了三个独立的转基因系和WT的PRX活性,发现转基因系的活性高于WT(附加文件gydF4y2Ba10gydF4y2Ba:图S6b)。综上所述,我们得出的结论是gydF4y2BaTaPRX-2AgydF4y2Ba过表达导致转基因系中PRX活性升高。gydF4y2Ba
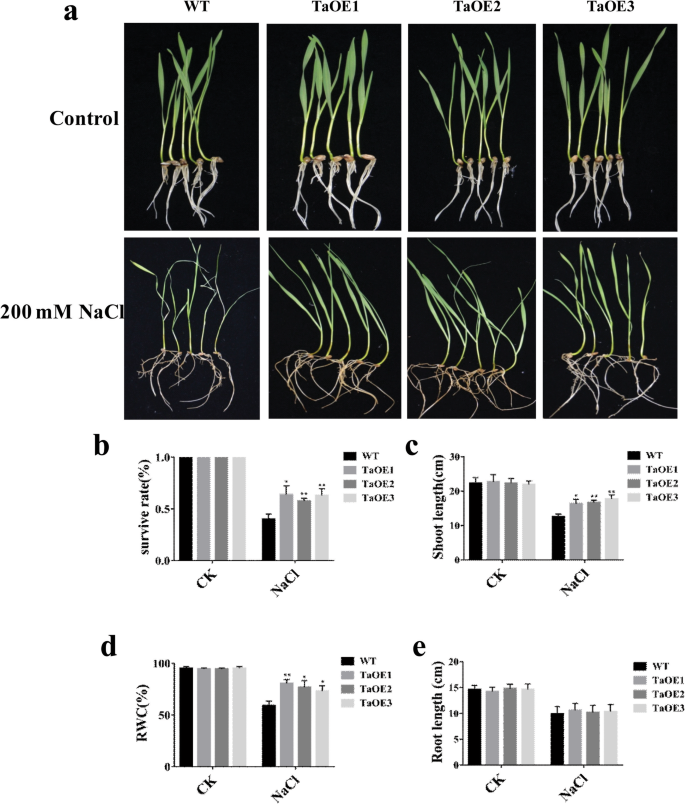
然后,我们测量了在盐胁迫条件下转基因品系(三个独立品系(TaOE1, TaOE2和TaOE3)与WT之间的表型差异。在非胁迫条件下,TaOE1-3和WT之间没有明显的表型差异。在盐胁迫条件下,转基因品系比WT生长更强。此外,WT的叶片在盐胁迫下变黄萎蔫,而TaOE的叶片仍保持绿色(图5)。gydF4y2Ba4gydF4y2Baa).我们还发现,WT植株经盐处理后的存活率仅为40%,而TaOE1、TaOE2和TaOE3植株的存活率分别为63.6、57.6和63%(图4)。gydF4y2Ba4gydF4y2Bab).然后我们比较了盐处理下WT和TaOE植株的茎长、相对含水量(RWC)和根长(图5)。gydF4y2Ba4gydF4y2Bac, d, e)。结果表明,转基因株系的茎长和RWC均高于WT株系。然而,WT和转基因株系之间的根长没有显著差异。综合来看,这些结果表明gydF4y2BaTaPRX-2AgydF4y2Ba过表达显著增强了小麦的耐盐性。gydF4y2Ba
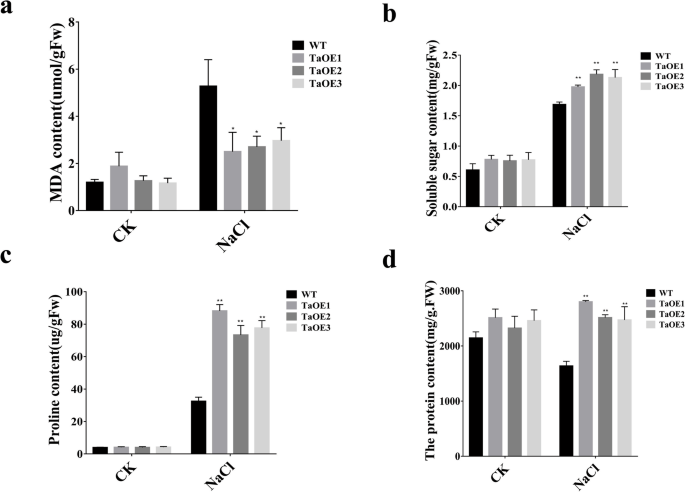
TaPRX-2AgydF4y2Ba增强了小麦的耐盐性。gydF4y2Ba一个gydF4y2Ba盐胁迫反应gydF4y2BaTaPRX-2AgydF4y2Ba-过表达转基因和WT小麦(品种“KN199”)。(gydF4y2BabgydF4y2Ba)生存率,(gydF4y2BacgydF4y2Ba)拍摄长度,和(gydF4y2BadgydF4y2Ba(根长gydF4y2BaTaPRX-2AgydF4y2Ba-过表达和WT植物。(gydF4y2BaegydF4y2Ba的相对含水量gydF4y2BaTaPRX-2AgydF4y2Ba-过表达和WT植物。数据以三次重复计算的平均值±标准差表示。每列上面的*和**表示与WT植株的显著差异(*gydF4y2BaPgydF4y2Ba< 0.05;**gydF4y2BaPgydF4y2Ba< 0.01)gydF4y2Ba
进一步探讨其内在机制gydF4y2BaTaPRX-2AgydF4y2Ba我们测定了TaOE和WT在非胁迫和盐胁迫条件下的生理生化指标(图1)。gydF4y2Ba5gydF4y2Ba模拟)。盐处理下,TaOE品系丙二醛(MDA)含量显著低于WT;它们还含有较高的可溶性糖、脯氨酸和可溶性蛋白质含量。此外,转基因株系的脯氨酸含量大约是WT株系的2倍(图5)。gydF4y2Ba5gydF4y2Bac).这些结果表明gydF4y2BaTaPRX-2AgydF4y2Ba增加小麦品种“KN199”耐渗透和抗氧化胁迫所必需的代谢物含量,从而提高耐盐性。gydF4y2Ba
TaPRX-2AgydF4y2Ba调控转基因小麦ROS的清除和胁迫相关基因的表达gydF4y2Ba
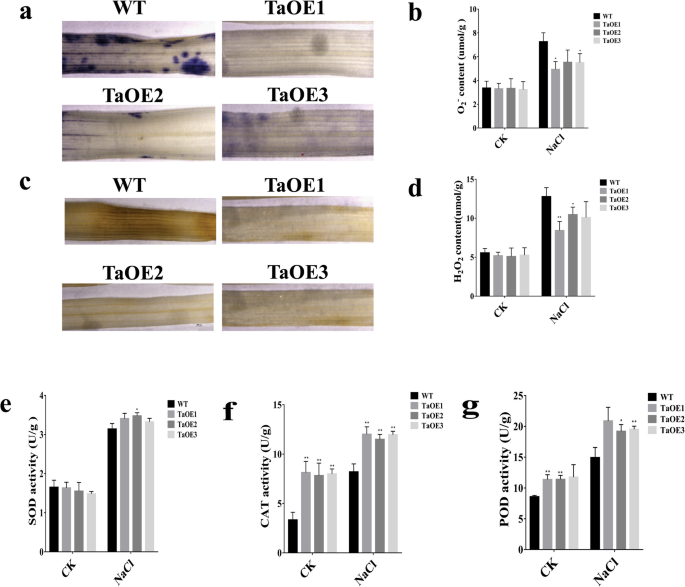
已有研究表明,植物对氧化胁迫的耐受性与植物对非生物胁迫的生理反应有关[gydF4y2Ba35gydF4y2Ba,gydF4y2Ba37gydF4y2Ba,gydF4y2Ba38gydF4y2Ba].因此,我们考察了的功能gydF4y2BaTaPRX-2AgydF4y2Ba降低盐胁迫下转基因系ROS水平的作用。作为ROS水平的主要指标,我们测定了O的积累gydF4y2Ba2gydF4y2Ba−gydF4y2Ba和HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba用硝基蓝四唑(NBT)和3-二氨基联苯胺(DAB)染色比较TaOE和WT系。在盐处理下,我们发现OgydF4y2Ba2gydF4y2Ba−gydF4y2Ba(被NBT染成蓝色)和HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba(DAB染成棕色)在转基因株系中显著低于WT株系(图。gydF4y2Ba6gydF4y2Ba模拟)。此外,转基因植株的超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)抗氧化酶活性均高于WT植株(图5)。gydF4y2Ba6gydF4y2Baeg)。gydF4y2Ba
TaPRX-2AgydF4y2Ba通过提高抗氧化酶活性来增强ros清除能力。gydF4y2Ba一个gydF4y2BaO的组织定位gydF4y2Ba2gydF4y2Ba−gydF4y2Ba积累,(gydF4y2BabgydF4y2Ba阿)gydF4y2Ba2gydF4y2Ba−gydF4y2Ba内容,(gydF4y2Bac)gydF4y2BaH组织定位gydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba一代(gydF4y2BadgydF4y2Ba) HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba内容,(gydF4y2Bae)gydF4y2BaSOD活性(gydF4y2BafgydF4y2Ba) CAT活动,及(gydF4y2BaggydF4y2Ba) POD活性gydF4y2BaTaPRX-2AgydF4y2Ba-过表达和WT植物。数据以三次重复计算的平均值±标准差表示。每列上面的*和**表示与WT植株的显著差异(*gydF4y2BaPgydF4y2Ba< 0.05;**gydF4y2BaPgydF4y2Ba< 0.01)gydF4y2Ba
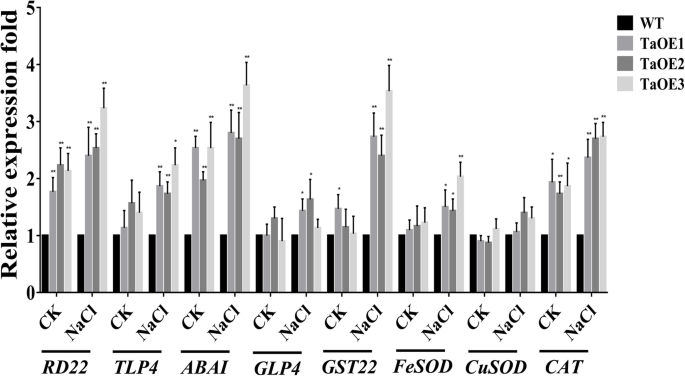
以确定胁迫反应基因是否与增强盐耐受性有关gydF4y2BaTaPRX-2AgydF4y2Ba,我们利用qRT-PCR方法测定了TaOE植物中各种胁迫相关基因的表达模式(图。gydF4y2Ba7gydF4y2Ba).这些与压力相关的基因(编码脱水反应蛋白,gydF4y2BaRD22gydF4y2Ba;thaumatin-like蛋白质,gydF4y2BaTLP4gydF4y2Ba;ABA-inducing蛋白质,gydF4y2BaABAIgydF4y2Ba;germin-like蛋白质,gydF4y2BaGLP4gydF4y2Ba;谷胱甘肽S-transferase,gydF4y2BaGST22gydF4y2Ba;以及编码ros清除酶的基因gydF4y2BaFeSODgydF4y2Ba,gydF4y2BaCuSODgydF4y2Ba,gydF4y2Ba猫gydF4y2Ba)被报道参与了对各种非生物胁迫的反应。我们的研究结果表明,这些胁迫相关基因在盐胁迫下的TaOE品系中表达高于WT品系gydF4y2BaCuSODgydF4y2BaWT与转基因株系间无显著差异。我们还发现一些与压力相关的基因的表达,包括gydF4y2BaRD22gydF4y2Ba,gydF4y2BaABAIgydF4y2Ba,gydF4y2Ba猫gydF4y2Ba,在非胁迫条件下,WT植株比转基因植株低gydF4y2Ba.gydF4y2Ba综合来看,这些结果表明gydF4y2BaTaPRX-2AgydF4y2Ba过表达可能通过提高胁迫响应基因的转录水平来提高小麦的耐盐性。gydF4y2Ba
讨论gydF4y2Ba
TaPRX-2A在gydF4y2Bat . aestivumgydF4y2Ba
本研究的目的是确定小麦PRX基因的作用gydF4y2BaTaPRX-2AgydF4y2Ba在植物对盐胁迫的反应中,鉴于与这种形式的非生物胁迫相关的作物产量严重下降[gydF4y2Ba39gydF4y2Ba].基于NJ系统发育树的分类和HMM扫描,建立了trescs2a02g57390.1。cds1属于VI PRXs亚家族,可在gydF4y2Ba美国moellendorffiigydF4y2Ba但不是在gydF4y2Bap .金属盘gydF4y2Ba,这表明VI PRXs亚家族出现在类似蕨类的祖先中。亚科VI PRXs在两个调查的优生子中只包含一个成员gydF4y2Ba答:芥gydF4y2Ba而且gydF4y2Ba诉酿酒用葡萄gydF4y2Ba,而VI PRXs亚科包含所研究的单子鼠的各种成员(附加文件gydF4y2Ba5gydF4y2Ba:图S2),表明VI亚族在单株-双株分离后经历了单株特异性复制事件。gydF4y2Ba
在分析12种植物的外显子-内含子结构的基础上,我们提出了一个包含两轮外显子融合事件的进化模型来推断起源gydF4y2BaTaPRXgydF4y2Ba2 (TraesCS2A02G573900.1.cds1)(图。gydF4y2Ba2gydF4y2Ba).在这些外显子融合事件中,我们重点研究了第二轮外显子融合事件中的一个,即三外显子结构在发生前转变为一外显子结构gydF4y2BaTriticum-AegilopsgydF4y2Basplit(形成gydF4y2BaTaPRXgydF4y2Ba2一个祖先)。这种单外显子结构出现的可能机制可能是“逆转录”(由于逆转录转位的结果,新复制的残序缺乏内含子),这在基因起源中有报道gydF4y2Ba精卫gydF4y2Ba在gydF4y2Ba果蝇gydF4y2Ba物种(gydF4y2Ba40gydF4y2Ba]和ATP合酶PGAM3 [gydF4y2Ba41gydF4y2Ba].例如,PGAM1包含三个内含子,而PGAM3一个也没有。在植物中,鉴定出69个逆转录子和1235个初级逆转录基因gydF4y2Ba答:芥gydF4y2Ba而且gydF4y2Bao .漂白亚麻纤维卷gydF4y2Ba分别为(gydF4y2Ba42gydF4y2Ba,gydF4y2Ba43gydF4y2Ba].通过PAML4.9检测进化模型中13个prx的正向选择,发现2 ~ 6个正向选择位点。在24个逆转录基因中有7个基因对被发现gydF4y2Ba选用gydF4y2Ba被鉴定为正选择的物种[gydF4y2Ba44gydF4y2Ba].gydF4y2Ba
TaPRX-2AgydF4y2Ba增强了小麦抗氧化能力和耐盐性gydF4y2Ba
在高等植物中,III类PRXs包含一个庞大的基因家族,据报道,该家族的成员参与植物对非生物胁迫的反应[gydF4y2Ba16gydF4y2Ba].例如,III类PRX基因gydF4y2BaOsPRX38gydF4y2Ba在gydF4y2Bao .漂白亚麻纤维卷gydF4y2Ba据报道,改进gydF4y2Ba拟南芥gydF4y2Ba通过激活抗氧化系统(SOD、PRX和GST)和清除HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba[gydF4y2Ba45gydF4y2Ba].在烟草中,III类PRX基因的过表达已被证明gydF4y2BaAtPrx64gydF4y2Ba在gydF4y2Ba答:芥gydF4y2Ba通过增加根系生长和清除Al和ROS积累,提高植物对铝(Al)的耐受性[gydF4y2Ba46gydF4y2Ba].在gydF4y2Ba答:芥,gydF4y2Ba过度的gydF4y2BaAtPRX3gydF4y2Ba被证明可以缓解脱水和增加耐盐性。然而,抑制gydF4y2BaAtPRX3gydF4y2Ba表达降低了对脱水和盐的耐受性[gydF4y2Ba47gydF4y2Ba].此外,III类PRX基因gydF4y2BaCrPrx1gydF4y2Ba而且gydF4y2BaCrPrxgydF4y2Ba在gydF4y2BaCatharanthus roseus也叫gydF4y2Ba在盐胁迫条件下,有研究表明gydF4y2Ba烟草gydF4y2Ba[gydF4y2Ba48gydF4y2Ba].与这些报告的结果一致,我们的结果也证明了小麦耐盐性的正向调节因子gydF4y2BaTaPRX-2A。gydF4y2Ba
在伴随植物非生物胁迫的生理问题中,ROS(特别是OgydF4y2Ba2gydF4y2Ba−gydF4y2Ba和HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba)和高浓度的活性氧会破坏细胞膜的通透性和完整性,以及细胞分隔[gydF4y2Ba49gydF4y2Ba,gydF4y2Ba50gydF4y2Ba,gydF4y2Ba51gydF4y2Ba].植物中的III类PRXs可以催化HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba通过转移来自不同供体的电子来减少过氧化循环[gydF4y2Ba13gydF4y2Ba,gydF4y2Ba16gydF4y2Ba].已有研究表明,III类PRXs可以通过调节植物的ROS平衡来提高植物的抗逆性。例如,gydF4y2BaOsPRX38gydF4y2Ba提高了gydF4y2Ba拟南芥gydF4y2Ba通过激活抗氧化系统和清除HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba[gydF4y2Ba45gydF4y2Ba]gydF4y2Ba.gydF4y2BaAtPrx64gydF4y2Ba通过清除ROS积累提高植物对铝的耐受性[gydF4y2Ba46gydF4y2Ba].为了通过清除自由基来维持ROS的平衡,植物进化出了一套复杂的抗氧化系统来保护细胞免受伤害[gydF4y2Ba49gydF4y2Ba,gydF4y2Ba51gydF4y2Ba].值得注意的是,据报道,SOD、CAT和PRX的表达有助于增强耐盐性[gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10gydF4y2Ba].在研究中,我们发现gydF4y2BaTaPRX-2AgydF4y2Ba过表达通过CAT和PRX提高抗氧化活性,从而降低ROS水平。此外,抗氧化基因(gydF4y2BaFeSODgydF4y2Ba,gydF4y2BaCuSODgydF4y2Ba,gydF4y2Ba猫gydF4y2Ba)在gydF4y2BaTaPRX-2AgydF4y2Ba-过表达的转基因植株与在WT植株中观察到的相比,表明gydF4y2BaTaPRX-2AgydF4y2Ba调节这些基因的表达,从而影响耐盐性。未来的研究将探索其中的机制gydF4y2BaTaPRX-2AgydF4y2Ba调节其他抗氧化剂编码基因。gydF4y2Ba
有趣的是,我们发现gydF4y2BaTaPRX-2AgydF4y2Ba以NLSs定位于细胞核。一些报告显示,PRX基因如gydF4y2BaTaPRXsgydF4y2Ba,gydF4y2BaAtGPX8gydF4y2Ba和GPX在哺乳动物和gydF4y2BaLjGpx1gydF4y2Ba位于细胞核中[gydF4y2Ba52gydF4y2Ba,gydF4y2Ba53gydF4y2Ba,gydF4y2Ba54gydF4y2Ba,gydF4y2Ba55gydF4y2Ba,gydF4y2Ba56gydF4y2Ba].据报道,一个勉强的PRX具有假定的核定位信号,位于核[gydF4y2Ba57gydF4y2Ba].先前的研究表明,ROS可通过激活内切酶和破坏重要的生物大分子(如核酸)引起DNA损伤[gydF4y2Ba5gydF4y2Ba,gydF4y2Ba58gydF4y2Ba,gydF4y2Ba59gydF4y2Ba].在gydF4y2Ba拟南芥,AtGPX8gydF4y2Ba定位于细胞核,可通过维持细胞氧化还原稳态,保护核DNA免受ROS损伤[gydF4y2Ba53gydF4y2Ba].基于上述证据,我们提出了可能的监管机制:一种解释是gydF4y2BaTaPRX-2AgydF4y2Ba在细胞核中抑制ROS介导的基因组DNA损伤,其他酶负责清除细胞器内或邻近的ROS。我们的第二个解释是gydF4y2BaTaPRX-2AgydF4y2Ba与其他ROS清除酶共表达,在暴露于盐度胁迫期间,其转录上调导致细胞核外调节ROS水平的酶的上调(图。gydF4y2Ba7gydF4y2Ba).gydF4y2Ba
TaPRX-2A的gydF4y2Ba通过aba依赖性途径对耐盐性的影响gydF4y2Ba
在植物中,ABA信号通路调节各种非生物胁迫响应[gydF4y2Ba60gydF4y2Ba,gydF4y2Ba61gydF4y2Ba].例如,脱氢蛋白和类索马丁蛋白(gydF4y2Ba张力腿平台gydF4y2Ba)对非生物胁迫的耐受性至关重要的基因,可能在胁迫期间被ABA诱导[gydF4y2Ba62gydF4y2Ba,gydF4y2Ba63gydF4y2Ba].在gydF4y2Ba拟南芥gydF4y2Ba据报道,ABA介导脱水反应基因的转录上调gydF4y2BaRD22gydF4y2Ba[gydF4y2Ba61gydF4y2Ba].类似于gydF4y2BaTaPRX-2AgydF4y2Ba据报道,一些III类PRX基因通过ABA信号通路介导对非生物胁迫的耐受性[gydF4y2Ba64gydF4y2Ba].例如,的表达式gydF4y2BaAtPRX3gydF4y2Ba在gydF4y2Ba答:芥gydF4y2Ba是由盐度胁迫和外源ABA处理共同诱导的[gydF4y2Ba47gydF4y2Ba].7个III类PRXs基因gydF4y2Ba甘蒙柽柳hispidagydF4y2Ba是由ABA信号通路控制的[gydF4y2Ba65gydF4y2Ba].在我们的研究中,表达gydF4y2BaTaPRX-2AgydF4y2Ba在NaCl和外源ABA处理下均显著上调。gydF4y2Ba3.gydF4y2Ba).此外,我们观察到gydF4y2BaTaPRX-2AgydF4y2Ba在转基因小麦中导致胁迫相关基因的转录上调gydF4y2BaRD22gydF4y2Ba,gydF4y2BaTLP4gydF4y2Ba,gydF4y2BaABAIgydF4y2Ba,gydF4y2BaGLP4gydF4y2Ba,gydF4y2BaGST2gydF4y2Ba2在盐度胁迫下(图。gydF4y2Ba7gydF4y2Ba).我们的研究表明gydF4y2BaTaPRX-2AgydF4y2Ba通过激活下游胁迫相关基因和ABA信号通路,增强小麦的耐盐性。有必要进一步研究其调控机制gydF4y2BaTaPRX-2AgydF4y2Ba调节与压力相关的基因。gydF4y2Ba
结论gydF4y2Ba
在这项研究中,我们确定并表征了PRX基因的作用gydF4y2BaTaPRX-2AgydF4y2Ba对小麦盐胁迫的响应。系统发育分析显示,在此过程中发生了一些外显子融合事件和正向选择gydF4y2BaTaPRX-2AgydF4y2Ba进化。过度的gydF4y2BaTaPRX-2AgydF4y2Ba通过激活ABA途径和抗氧化酶增强转基因小麦的耐盐性,从而降低ROS积累和提高渗透代谢产物水平。这项工作及其发现在培育耐盐小麦品种方面具有很强的未来应用价值,考虑到未来气候变化的影响所带来的预期作物损失,这一点尤其重要。gydF4y2Ba
方法gydF4y2Ba
分离和克隆gydF4y2BaTaPRX-2AgydF4y2Ba及其转换gydF4y2Ba
以收获小麦品种“苏麦3号”叶片为材料,用TRIzol试剂(Transgen)提取总RNA。合成cDNA进行扩增gydF4y2BaTaPRX-2A。gydF4y2Ba完整的gydF4y2Ba-gydF4y2Ba长cDNA序列gydF4y2BaTaPRX-2AgydF4y2Ba(基因库。AJ878510.1)来自NCBI (gydF4y2Bahttps://www.ncbi.nlm.nih.gov/gydF4y2Ba),连接到PC186载体上,利用粒子枪介导的基因转化为“KN199”[gydF4y2Ba66gydF4y2Ba].gydF4y2Ba
植物材料和非生物处理gydF4y2Ba
面包小麦(gydF4y2Bat . aestivumgydF4y2Ba品种“KN199”和“苏麦3号”)幼苗来源于我实验室(山东农业大学农学院作物生物学国家重点实验室)。的gydF4y2BaTaPRX-2AgydF4y2Ba-过表达转基因小麦品系和WT“KN199”在20°C - 25°C条件下生长,光周期16/8 h。当植株生长到一叶一颗心期时,用200 mM NaCl处理转基因植株和“KN199”。盐处理时,对照苗和转基因苗在200 mM NaCl溶液中培养10 d。gydF4y2Ba
小麦ⅲ类PRXs的鉴定与分类,gydF4y2BaAe。tauschiigydF4y2Ba,以及其他植物gydF4y2Ba
12种植物的基因组和蛋白质组(gydF4y2Ba美国moellendorffiigydF4y2Ba,gydF4y2Baz梅斯gydF4y2Ba,gydF4y2Bab . distachyongydF4y2Ba,gydF4y2Bat . aestivum Ae。tauschiigydF4y2Ba,gydF4y2Ba小麦、小麦、小麦、小麦、小麦、小麦、小麦gydF4y2Ba,gydF4y2Ba答:芥gydF4y2Ba,gydF4y2Bap .金属盘gydF4y2Ba而且gydF4y2Bac . reinhardtiigydF4y2Ba)从综合植物42 (gydF4y2Bahttp://plants.ensembl.org/gydF4y2Ba)和分析。为了识别PRXs,我们使用本地服务器Hmmer 3.1 (pfam配置文件PF00141.23,过氧化物酶)批量扫描了12种植物的所有蛋白质组。嗯,插件可以域)。然后是pfam 32.0网站(gydF4y2Bahttp://pfam.xfam.org/gydF4y2Ba), E值为0.01。保留和分析典型的PRX区域覆盖> 50%对齐的PRX。那些覆盖小于50%的PRX结构域排列的被认为是非典型PRX,并被排除在进一步的分析之外。使用ClustalW v2.0对PRX域中截断序列进行PRX比对[gydF4y2Ba67gydF4y2Ba].我们使用MEGA-CC 7.0软件在本地服务器上构建了NJ系统发育树[gydF4y2Ba68gydF4y2Ba].利用HMMER 3.1对PRX亚族进行分类,基于玉米PRX比对生成模型[gydF4y2Ba12gydF4y2Ba].gydF4y2Ba
的RNA-seq数据gydF4y2Bap .金属盘gydF4y2Ba(SRR11434644, SRR11434645,和SRR11434646),gydF4y2Ba答:芥gydF4y2Ba(SRR11308184, SRR11308187和SRR11308188),gydF4y2Ba诉酿酒用葡萄gydF4y2Ba(SRR11249050, SRR11249059,和SRR11249060),gydF4y2Bab . distachyongydF4y2Ba(SRR10380965, SRR10380966, SRR10380967和SRR10380968),gydF4y2BaAe。tauschiigydF4y2Ba(SRR9657462和SRR9657463),以及gydF4y2Bat . dicoccoidesgydF4y2Ba(SRR9657450和SRR9657451)从NCBI SRA转录组数据库(gydF4y2Bahttps://www.ncbi.nlm.nih.gov/sra/gydF4y2Ba).的RNA-seq数据gydF4y2Bat . aestivumgydF4y2Ba(ERR1201797, ERR1201798, ERR1201799)从EBI ArrayExpress (gydF4y2Bahttps://www.ebi.ac.uk/arrayexpress/gydF4y2Ba).利用Hisat2(2.2.0版本,gydF4y2Bahttps://daehwankimlab.github.io/hisat2/download/#version-hisat2-220gydF4y2Ba).转换(sam to bam)和排序使用Samtools(版本1.10,gydF4y2Bahttps://github.com/samtools/samtools/releases/gydF4y2Ba).这些文本是使用Stringtie(版本2.1.1,gydF4y2Bahttps://ccb.jhu.edu/software/stringtie/index.shtmlgydF4y2Ba).gydF4y2Ba
prx的结构域和内含子-外显子结构图gydF4y2Ba
我们使用Perl和R脚本为本研究中包含的12种植物生成PRXs内含子-外显子结构和域图,基于来自synbl plants 42 (gydF4y2Bahttp://plants.ensembl.org/gydF4y2Ba).prx的域信息是从Pfam 32.0 (gydF4y2Bahttp://pfam.xfam.org/gydF4y2Ba).gydF4y2Ba
选择压力分析gydF4y2Ba
截断的氨基酸PRX结构域序列gydF4y2BaTaPRX-2AgydF4y2Ba其余12个同源prx用Clustal X2进行比对。根据Pfam 32的信息,用我们的Perl脚本生成相应的PRX域截断cDNA。密码子对齐由web服务器PAL2NAL生成[gydF4y2Ba69gydF4y2Ba].Paml 4.9 (codeml) [gydF4y2Ba70gydF4y2Ba]及图形界面PAMLX [gydF4y2Ba71gydF4y2Ba]用于检测选择压力。生成了位点特异性模型M0(单比)、M1a(中性)、M2a(选择)、M7 (beta)和M8 (beta & ω)。利用CODEML计算各模型的对数似然(lnL)值。采用2 Δ lnL = 2(lnL1−ln0)根据χ2与df的分布进行模型比较。通过CODEML(第一个结果文件)和MEGAX(使用ML方法和基于JTT矩阵的模型)推断祖先序列[gydF4y2Ba72gydF4y2Ba].gydF4y2Ba
的表达模式gydF4y2BaTaPRX-2AgydF4y2Ba在不同的非生物胁迫处理中gydF4y2Ba
在20% (w/v) PEG 6000处理和200 mM NaCl处理后,分别于0、6、12、24、48和72 h收获小麦三叶期幼苗叶片组织。小麦叶片组织在10 mM h后0、2、6、12、24、48和72 h收割gydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba治疗。在2 mM SA、100 μM MeJA、100 μM IAA和100 mM ABA处理后0、1、3、6、12、24和48 h收获小麦叶片组织。收集的所有样本用TRIzol试剂(Invitrogen)提取总RNA。使用Roche LightCycler®480系统(Roche, Germany)进行第一链cDNA合成和qRT-PCR。小麦基因gydF4y2Ba18 srrnagydF4y2Ba作为内源性对照。相对mRNA表达量用2gydF4y2Ba-ΔΔCTgydF4y2Ba方法。所有的qRT-PCR引物在附加文件中总结gydF4y2Ba11gydF4y2Ba:表S5。gydF4y2Ba
TaPRX-2A蛋白的亚细胞定位gydF4y2Ba
根据ORF的gydF4y2BaTaPRX-2AgydF4y2Ba我们克隆了这个没有停止密码子的基因,并将其构建成一个pBINgydF4y2Ba35个年代gydF4y2Ba-gydF4y2BaeGFPgydF4y2Ba载体使用CaMV 35S启动子。随后,pBINgydF4y2Ba35个年代gydF4y2Ba-gydF4y2BaTaPRX-2AgydF4y2Ba-gydF4y2BaeGFPgydF4y2Ba和pBINgydF4y2Ba35个年代gydF4y2Ba-gydF4y2BaeGFPgydF4y2Ba(对照)被转化为gydF4y2Ba农杆菌属gydF4y2BaEHA105。的gydF4y2Ba农杆菌属gydF4y2BaEHA105重悬于悬浮液(10 mM MgClgydF4y2Ba2gydF4y2Ba, 10 mM 4- morpholineethone -磺酸水合物pH值5.6,200 mM乙酰丁香酮)。的gydF4y2Ba农杆菌属gydF4y2Ba将悬浮液调整到光密度600值0.6,注射到烟叶中培养3天。用共聚焦显微镜(蔡司LSM880元共聚焦显微镜)观察注射烟草叶片的表皮细胞。此外,我们还对pBIN进行了转换gydF4y2Ba35个年代gydF4y2Ba-gydF4y2BaTaPRX-2AgydF4y2Ba-gydF4y2BaeGFPgydF4y2Ba和pBINgydF4y2Ba35个年代gydF4y2Ba-gydF4y2BaeGFPgydF4y2Ba载体通过基因枪介导转化进入洋葱表皮细胞[gydF4y2Ba73gydF4y2Ba].将转化后的表皮细胞在28°C暗处培养8-12 h,用共聚焦显微镜观察。的NLS序列gydF4y2BaTaPRX-2AgydF4y2Ba使用web服务器cNLS (gydF4y2Bahttp://nls-mapper.iab.keio.ac.jp/cgi-bin/NLS_Mapper_form.cgigydF4y2Ba)[gydF4y2Ba74gydF4y2Ba].gydF4y2Ba
生理生化参数测定gydF4y2Ba
我们收集了……的叶子gydF4y2BaTaPRX-2AgydF4y2Ba-过表达和“KN199”植株在盐处理后10 d。我们用公式计算叶片RWC: RWC = (FW−DW)/(TW−DW) × 100%,其中RWC为相对含水量,FW为鲜重,TW为肥厚鲜重,DW为干重[gydF4y2Ba75gydF4y2Ba].采用硫代巴比妥酸法测定丙二醛含量[gydF4y2Ba76gydF4y2Ba].采用茚三酮反应法测定脯氨酸含量[gydF4y2Ba77gydF4y2Ba].可溶性总糖测定采用蒽酮法[gydF4y2Ba78gydF4y2Ba].我们用NBT和DAB染色来可视化OgydF4y2Ba2gydF4y2Ba−gydF4y2Ba和HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba水平,如以前所述[gydF4y2Ba79gydF4y2Ba,gydF4y2Ba80gydF4y2Ba].采用上述方法检测SOD、CAT和PRX活性[gydF4y2Ba81gydF4y2Ba,gydF4y2Ba82gydF4y2Ba,gydF4y2Ba83gydF4y2Ba].gydF4y2Ba
数据和材料的可用性gydF4y2Ba
研究植物的基因组和蛋白质组刊载于《植物学杂志》(gydF4y2Bahttp://plants.ensembl.org/gydF4y2Ba).被调查植物的加入数为gydF4y2Bat . aestivumgydF4y2Ba(IWGSC),gydF4y2BaAe。tauschiigydF4y2Ba(Aet_v4.0),gydF4y2Ba答:芥gydF4y2Ba(TAIR10),gydF4y2Bab . distachyongydF4y2Ba(v3.0),gydF4y2Bac . reinhardtiigydF4y2Ba(v5.5),gydF4y2Bao .漂白亚麻纤维卷gydF4y2Ba(irgsp - 1.0),gydF4y2Bap .金属盘gydF4y2Ba(Phypa_V3),gydF4y2Ba美国moellendorffiigydF4y2Ba(v1.0),gydF4y2Bat . dicoccoidesgydF4y2Ba(WEWSeq_v.1.0),gydF4y2Bat . urartugydF4y2Ba(ASM34745v1),gydF4y2Ba诉酿酒用葡萄gydF4y2Ba(12 x)gydF4y2Baz梅斯gydF4y2Ba(B73_RefGen_v4)。TgydF4y2BaaPRX-2AgydF4y2Ba可在NCBI下载,登录编号为AJ878510.1 (gydF4y2Bahttps://www.ncbi.nlm.nih.gov/gydF4y2Ba).使用NCBI SRA和EBI ArrayExpress的RNA-seq数据的登录号见方法部分。所研究植物prx的鉴定和外显子-内含子结构在补充文献中有介绍。在当前研究中使用和/或分析的数据集可根据合理要求从通讯作者处获得。gydF4y2Ba
缩写gydF4y2Ba
- WT:gydF4y2Ba
-
野生型gydF4y2Ba
- 插件可以:gydF4y2Ba
-
氧化物酶gydF4y2Ba
- SOD:gydF4y2Ba
-
超氧化物歧化酶gydF4y2Ba
- 圆荚体:gydF4y2Ba
-
过氧化物酶gydF4y2Ba
- 猫:gydF4y2Ba
-
过氧化氢酶gydF4y2Ba
- ROS:gydF4y2Ba
-
活性氧gydF4y2Ba
- GPX:gydF4y2Ba
-
谷胱甘肽过氧化物酶gydF4y2Ba
- APX型:gydF4y2Ba
-
抗坏血酸盐过氧化物酶gydF4y2Ba
- 山:gydF4y2Ba
-
水杨酸gydF4y2Ba
- 惩罚:gydF4y2Ba
-
Methyljasmonic酸gydF4y2Ba
- 国际宇航科学院:gydF4y2Ba
-
Indole-3-acetic酸gydF4y2Ba
- 阿坝:gydF4y2Ba
-
脱落酸gydF4y2Ba
- RWC:gydF4y2Ba
-
相对含水量gydF4y2Ba
- 电视台:gydF4y2Ba
-
氮蓝四唑gydF4y2Ba
- 轻拍:gydF4y2Ba
-
3-DiaminobenzidinegydF4y2Ba
- 绿色荧光蛋白:gydF4y2Ba
-
绿色荧光蛋白gydF4y2Ba
- 存在:gydF4y2Ba
-
定量实时聚合酶链反应gydF4y2Ba
- PEG6000:gydF4y2Ba
-
聚乙二醇6000gydF4y2Ba
参考文献gydF4y2Ba
冷、盐和干旱胁迫研究综述。生物化学。2005;444:139-58。gydF4y2Ba
脱水和低温的分子响应:两种胁迫信号通路的差异和交叉信号。植物生物学,2000;3:217-23。gydF4y2Ba
camo S, Baldrich P, Messeguer J, Lalanne E, Coca M, San SB.一种钙依赖性蛋白激酶的过表达通过防止膜脂过氧化使水稻具有耐盐性和耐旱性。植物杂志。2014;165:688 - 704。gydF4y2Ba
Abdel Latef AA, Kordrostam M, Zakir A, Zaki H, Saleh OM。积极压力与HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba提高两个小麦品种对盐胁迫的耐受性,促进植株生长。植物。2019;8(9):303。gydF4y2Ba
麦考德JM。自由基和氧化应激的进化。中华医学杂志2000;108:652-9。gydF4y2Ba
Roxas VP, Lodhi SA, Garrett DK, Mahan JR, Allen RD.过度表达谷胱甘肽s -转移酶/谷胱甘肽过氧化物酶的转基因烟草幼苗的耐胁迫性。植物细胞物理,2000;41:1229-34。gydF4y2Ba
翟长忠,赵亮,尹立军,陈明,王启勇,李丽丽,马永忠。两个小麦谷胱甘肽过氧化物酶基因的产物位于叶绿体中,它们对盐和HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba公差在gydF4y2Ba拟南芥gydF4y2Ba.《公共科学图书馆•综合》。2013;8:e73989。gydF4y2Ba
氧化应激、抗氧化剂与应激耐受性。植物学报2002;7:405-10。gydF4y2Ba
Abdel Latef AA, Mostofa MG, Rahman MM, Abdel Farid IB, Tran LSP。酵母和胡萝卜根提取物通过改变胁迫植物的生理生化特性,提高了海水盐胁迫下玉米的生产性能。植物生长学报,2019b; 38:966-79。gydF4y2Ba
Abdel Latef AA, Abu Alhmad MF, Kordrostami M, ab - baker AE, Zakir A.接种gydF4y2BaAzospirillum lipoferumgydF4y2Ba或gydF4y2Ba固氮菌chroococcumgydF4y2Ba在生理盐水条件下通过提高玉米生理活性来促进玉米生长。植物生长规律2020。https://doi.org/gydF4y2Bahttps://doi.org/10.1007/s00344-020-10065-9gydF4y2Ba.gydF4y2Ba
吴志强,陈文华,陈文华,陈文华。过氧化还原蛋白的结构、作用机制及调控。生物化学学报2003;28:32-40。gydF4y2Ba
王颖,王强,赵颖,韩刚,朱松。玉米III类过氧化物酶基因家族的系统分析揭示了一个与非生物胁迫反应相关的保守亚家族。基因。2015;566:95 - 108。gydF4y2Ba
平贺S,佐佐木K,伊藤H,大桥Y,松井H。III类植物过氧化物酶大家族。植物细胞物理学报2001;42:462-8。gydF4y2Ba
Welinder公斤。植物、真菌和细菌过氧化物酶超家族。《结构生物学》1992;2:388-93。gydF4y2Ba
甲状腺过氧化物酶的分子进化。Biochimie。1999;81:557 - 62。gydF4y2Ba
Cosio C, Dunand C.单个III类过氧化物酶基因的特异性功能。J Exp Bot 2009; 60:391-408。gydF4y2Ba
重冈S,石川T,田井M,宫川Y,武田T,谷田Y,吉村k。抗坏血酸过氧化物酶同工酶的调控与功能。J Exp Bot 2002; 53:1305-19。gydF4y2Ba
酵母菌细胞色素c过氧化物酶:通过蛋白质工程的机制研究。生物化学生物物理学报。2002;1597:193-220。gydF4y2Ba
马丁内斯AT, Speranza M, Ruiz-Duenas FJ, Ferreira P, Camarero S, Guillen F, Martinez MJ, Gutierrez A, del Río JC。木质纤维素的生物降解:木质素真菌攻击的微生物、化学和酶方面。Int Microbiol。2005;8:195 - 204。gydF4y2Ba
Almagro L, Gómez LV, Belchi-Navarro S, Bru R, Ros Barceló A, Pedreno MA。植物防御反应中的第III类过氧化物酶。J Exp Bot 2009; 60:377-90。gydF4y2Ba
Csiszár J, Gallé Á, Horváth E, Dancsó P, Gombos M, Váry Z, Tari .渗透胁迫下耐旱性不同基因型小麦根尖段过氧化物酶活性及非生物胁迫相关过氧化物酶表达的差异。植物生理与生物化学,2012;52:119-29。gydF4y2Ba
Passardi F, Longet D, Penel C, Dunand C.水稻III类过氧化物酶多基因家族及其在陆生植物中的进化植物化学,2004;65:1879 - 93。gydF4y2Ba
Welinder KG, Justesen AF, Kjaersgard IV, Jensen RB, Rasmussen SK, Jespersen HM, Duroux L.的ⅲ类过氧化物酶的结构多样性和转录gydF4y2Ba拟南芥gydF4y2Ba.中华生物化学杂志2002;269:6063-81。gydF4y2Ba
任丽丽,刘玉军,刘海军,钱婷婷,齐丽伟,王晓荣,曾庆勇。亚细胞再定位和正向选择在复制基因的保留中起着关键作用gydF4y2Ba杨树gydF4y2BaIII类过氧化物酶家族。植物细胞。2014;26:2404-19。gydF4y2Ba
植物III类过氧化物酶和抗坏血酸代谢。Phytochem牧师2004;3:195 - 205。gydF4y2Ba
埃雷罗J, Fernández-Pérez F, Yebra T, Novo-Uzal E, Pomar F, Pedreño MÁ, Cuello J, Guéra A,埃斯特班-卡拉斯科A,萨帕塔JM。碱性过氧化物酶72的生物信息学和功能特征gydF4y2Ba拟南芥gydF4y2Ba参与木质素的生物合成。足底。2013;237:1599 - 612。gydF4y2Ba
常玉华,张海生,古普瑞,王旭,朱婷,栾珊。转录谱分析揭示了损伤、病原体、非生物胁迫和激素反应之间的新相互作用gydF4y2Ba拟南芥gydF4y2Ba.植物杂志。2002;129:661 - 77。gydF4y2Ba
查索N,纳瑞斯C, Métraux JP。角质层缺陷导致对一种主要植物病原体的完全免疫。植物j . 2007; 49:972 - 80。gydF4y2Ba
梅WQ,秦艳梅,宋WQ,李娟,朱yx。棉花gydF4y2BaGhPOX1gydF4y2Ba编码植物III类过氧化物酶可能负责高水平的活性氧产生,这与棉纤维伸长有关。中华基因学报2009;36:141-50。gydF4y2Ba
Simonetti E, Veronico P, Melillo MT, Delibes Á, Andrés MF, López-Braña I.小麦抗性和易感品系根中ⅲ类过氧化物酶基因表达分析gydF4y2Ba异皮线虫属avenaegydF4y2Ba.植物与微生物的相互作用。2009;22:1081-92。gydF4y2Ba
氧化胁迫对水稻细胞质抗坏血酸过氧化物酶mRNA的诱导作用过氧化氢在氧化应激信号传导中的作用。植物细胞物理学报1999;40:417-422。gydF4y2Ba
苗勇,吕东,王萍,王晓春,陈杰,苗超,宋春安gydF4y2Ba拟南芥gydF4y2Ba谷胱甘肽过氧化物酶在脱落酸和干旱胁迫反应中既是氧化还原传感器,又是清道夫。植物细胞。2006;18:2749 - 66。gydF4y2Ba
周燕,胡丽芙,叶顺生,蒋丽伟,刘思齐。谷胱甘肽过氧化物酶(GPX)基因家族的全基因组鉴定及其对非生物胁迫的响应gydF4y2Ba黄瓜gydF4y2Ba.3.生物技术。2018;8:159。gydF4y2Ba
seenji M, Lendvai Á, Miskolczi P, Kocsy G, Gallé Á, szenzcs A, Hoffmann B. Sa’rva’ri E, Schweizer P, stein N, Dudits D, Gyorgyey J.长期干旱适应过程中根系功能的差异:两种基因型小麦活性基因集的比较。植物医学杂志。2010;12:871 - 82。gydF4y2Ba
董伟,王春春,徐峰,全泰泰,彭克强,肖莱特,夏转基因。小麦氧植二烯酸还原酶基因gydF4y2BaTaOPR1gydF4y2Ba通过增强脱落酸信号和活性氧的清除来增强耐盐性。植物杂志。2013;161:1217-28。gydF4y2Ba
张敏,吕德伟,葛萍,卞玉伟,陈光旭,朱光荣,李晓华,闫玉梅。面包小麦幼苗叶片抗旱性和防御机制的磷蛋白组学分析(gydF4y2Ba小麦gydF4y2Bal .)。j .蛋白质组学。2014;109:290 - 308。gydF4y2Ba
胡丽霞,李海燕,庞浩昌,付建明。两种基因型多年生黑麦草抗氧化基因、蛋白质和酶对盐胁迫的响应gydF4y2Ba多年生黑麦草gydF4y2Ba)不同的耐盐性。植物生理学报,2012;169:146-56。gydF4y2Ba
米特勒P,范德陶韦拉S,铃木N,米勒G,托格内蒂VB,范德波尔K, Gollery M,舒拉耶夫V,布勒塞吉夫FV。ROS信号:新浪潮?植物科学进展2011;16:300-9。gydF4y2Ba
尤杰,陈振林。ROS在作物非生物胁迫响应中的调控。植物科学进展2015;6:1092。gydF4y2Ba
龙,兰利。自然选择与精卫基因嵌合加工功能基因的起源gydF4y2Ba果蝇gydF4y2Ba.科学。1993;260:91-5。gydF4y2Ba
龙my, Deutsch M,王伟,Betrán E, Brunet FG,张建明。新基因的起源:来自实验和计算分析的证据。遗传。2003;118:171 - 82。gydF4y2Ba
张燕,吴燕,刘燕,韩斌。植物中69个逆转录子的计算鉴定gydF4y2Ba拟南芥gydF4y2Ba.植物杂志。2005;138:935-48。gydF4y2Ba
王W,郑元,李风扇CZ, J, JJ, Cai ZQ、张GJ,刘DY,张詹,稳索SR, Lu ZK黄G,长的我,王J .嵌合基因起源的高速率后移于植物基因组中。植物细胞。2006;18:1791 - 802。gydF4y2Ba
周永利,张cj。嵌合逆转录基因的进化模式gydF4y2Ba选用gydF4y2Ba物种。Sci众议员2019;9:17733。gydF4y2Ba
Maria K, Yogeshwar VD, Neelam G, Madhu T, Iffat ZA, Mehar HA, Debasis C。gydF4y2Ba栽培稻gydF4y2Ba第III类过氧化物酶(gydF4y2BaOsprx38gydF4y2Ba)超表达gydF4y2Ba拟南芥gydF4y2Ba减少因异塑木质素化而造成的砷积累。《危险物质杂志》2019;362:383-93。gydF4y2Ba
吴云云,杨志林,徐恩海英,陈琳,李克泽。过氧化物酶基因过表达(gydF4y2BaAtPrx64gydF4y2Ba)gydF4y2Ba拟南芥gydF4y2Ba在烟草中提高植物对铝胁迫的耐受性。植物分子生物学杂志2017;95:157-68。gydF4y2Ba
Llorente F, Lopez-Cobollo RM, Catala R, Martinez-Zapater JM, Salinas J.一种新的冷诱导基因gydF4y2Ba拟南芥,RCI3gydF4y2Ba编码过氧化物酶,该酶是抗压能力的组成部分。植物j . 2002; 32:13-24。gydF4y2Ba
Kumar S, Jaggi M, Sinha AK。空泡和外体细胞异位过表达gydF4y2BaCatharanthus roseus也叫gydF4y2Ba过氧化物酶使转基因烟草对盐和脱水胁迫具有不同的耐受性。原生质。2012;249:423-32。gydF4y2Ba
Dat J, Vandenabeele S, Vranová E, Van MM, Inzé D, Van BF。活性氧在植物胁迫反应中的双重作用。细胞分子生命科学2000;57:79 - 95。gydF4y2Ba
巴克斯特A,米特勒R,铃木NN。ROS在植物胁迫信号传递中起着重要作用。J Exp Bot 2013; 65:1229-40。gydF4y2Ba
作物植物抗非生物胁迫中的活性氧种类和抗氧化机制。植物生理与生物化学。2010;48:909-30。gydF4y2Ba
颜健,苏培生,李伟,肖国良,赵颖,马旭,王红伟,聂华娥,孔立龙。小麦和小麦III类过氧化物酶基因家族的全基因组和进化分析gydF4y2Ba山羊草属tauschiigydF4y2Ba揭示了一些成员参与了压力反应。BMC基因组学。2019;20:666。gydF4y2Ba
Ahmed G, Tomoya O, Takanori M, Kazuya Y, Masahiro T, Shigeru s的参与gydF4y2Ba拟南芥gydF4y2Ba谷胱甘肽过氧化物酶8在抑制细胞核和细胞质中的氧化损伤。植物细胞物理学报2012;53:1596-606。gydF4y2Ba
大鼠大脑皮层发育中的超氧化物歧化酶、谷胱甘肽过氧化物酶和过氧化氢酶亚细胞定位。机械老化发展1989;48:15-31。gydF4y2Ba
罗杰斯LK,古普塔S,韦尔蒂SE,汉森TN,史密斯简历。雄性和雌性fisher -344大鼠肝脏中谷胱甘肽还原酶、过氧化物酶和转移酶活性的测定。Toxicol Sci。2002;69:279 - 85。gydF4y2Ba
Matamoros MA, Saiz A, Peñuelas M, Bustos-Sanmamed P, Mulet JM, Barja MV, Rouhier N, Moore M, James EK, Dietz KJ, Becana M.谷胱甘肽过氧化物酶在豆科植物根瘤中的作用。J Exp Bot 2015; 66:2979-90。gydF4y2Ba
Stacy RA, Nordeng TW, Culianez-Macia FA, Aalen RB。与休眠相关的过氧化物还蛋白抗氧化剂PER1定位于大麦胚核和糊粉层细胞。J。1999;19:1-8。gydF4y2Ba
Hagar H, Ueda N, Shah SV。活性氧代谢物在lc - pk1细胞化学缺氧损伤中DNA损伤和细胞死亡中的作用中国生物医学工程杂志1996;gydF4y2Ba
过氧化物酶在生理反应中产生羟自由基的新功能。生物化学杂志1999;260:726-35。gydF4y2Ba
秦努沙米五,龚铮,朱家杰。脱落酸介导的植物发育和胁迫反应的表观遗传过程。植物生物学杂志,2008;50:1187-95。gydF4y2Ba
王晓燕,王晓燕。干旱和寒冷胁迫下植物基因表达的调控网络。植物生物学杂志2003;6:410-7。gydF4y2Ba
徐普杰,朴明昌。myb96介导的脱落酸信号通过促进水杨酸的生物合成诱导病原菌的耐药反应gydF4y2Ba拟南芥gydF4y2Ba.新植醇。2016;186:471 - 83。gydF4y2Ba
Jung YC, Lee HJ, Yum SS, Soh WY, Cho DY, Auh CK, Lee TK, Soh HC, Kim YS, Lee SC.胡萝卜中可诱导干旱但不依赖aba的类thaumatin蛋白(gydF4y2Ba胡萝卜胡萝卜L。gydF4y2Ba).植物细胞学报2005;24:366-73。gydF4y2Ba
Roberts E, Kolattukudy PE。亚化相关的高阴离子过氧化物酶的分子克隆、核苷酸序列和脱落酸诱导。分子生物学杂志1989;217:223-32。gydF4y2Ba
高常青,王永春,刘广光,王超,蒋军,杨沛平。大豆过氧化物酶(POD) 10个基因的克隆gydF4y2Ba甘蒙柽柳HispidagydF4y2Ba以及它们对非生物胁迫的反应。植物生物学杂志2010;28:77。gydF4y2Ba
姚强,丛琳,常建林,李凯旭,杨国祥,何光勇。利用粒子轰击技术实现小麦商品品种低拷贝数基因转移和稳定表达。J Exp Bot。2006;57:37 - 46。gydF4y2Ba
Larkin MA, Blackshields G, Brown NP, Chenna R, McGettigan PA, McWilliam H, Valentin F, Wallace IM, Wilm A, Lopez R. Clustal W和Clustal X 2.0版本。生物信息学。2007;23:2947-8。gydF4y2Ba
Kumar S, Stecher G, Tamura K. MEGA7:用于更大数据集的分子进化遗传学分析7.0版本。摩尔。杂志。另一个星球。2016;33:1870-4。gydF4y2Ba
Suyama M, Torrents D, Bork P. PAL2NAL:蛋白质序列比对到相应密码子比对的鲁棒转换。核酸学报,2006;34:609-12。gydF4y2Ba
杨震。PAML 4:最大似然系统发育分析程序包。分子生物学学报2007;24:1586-91。gydF4y2Ba
徐斌,张志华。pamlX: PAML的图形用户界面。Mol Biol Evol. 2013; 30:2723-4。gydF4y2Ba
Kumar S, Stecher G, Li M, Knyaz C, Tamura K. MEGA X:跨计算平台的分子进化遗传学分析。Mol Biol Evol 2018; 35:1547-9。gydF4y2Ba
Das P, Ito T, Wellmer F, Vernoux T, Dedieu A, Traas J, Meyerowitz EM.花干细胞终止涉及花被直接调节无花性。发展。2009;136:1605-11。gydF4y2Ba
Kosugi S, Hasebe M, Tomita M和Yanagawa H.通过复合基序预测酵母细胞周期依赖的核质穿梭蛋白的系统鉴定。中国生物科学进展2009;106:10171-6。gydF4y2Ba
周思明,孙晓东,尹树生,孔晓铮,周松,徐勇,王伟。小麦F-box基因TaFBA1的作用(gydF4y2Ba小麦gydF4y2BaL.)的耐旱性。植物杂志。物化学。2014;84:213-23。gydF4y2Ba
李文华,李文华。离体叶绿体的光过氧化作用:I.脂肪酸过氧化的动力学和化学计量学。生物化学。1968;125:189-98。gydF4y2Ba
贝茨LS,沃尔德伦PR,蒂尔ID。水胁迫研究中游离脯氨酸的快速测定。土壤植物。1973;39:205-7。gydF4y2Ba
斯皮罗RG。糖蛋白中糖的分析。方法Enzymol。1966;8:3-26。gydF4y2Ba
盖·C,柯林斯J,盖比基JM。过氧化氢法,二甲酚橙配合物。肛交。物化学。1999;273:149-55。gydF4y2Ba
田F,龚J,张军,张M,王G,李,王w .增强的类囊体膜蛋白的稳定性和抗氧化能力有助于tasg1干旱胁迫抗性的小麦住环保旅馆突变。J. Exp. Bot. 2013; 64:1509-20。gydF4y2Ba
Dhindsa RA, plumm -Dhindsa P, Thorpe TA。叶片衰老:与叶片渗透性和脂质过氧化增加,超氧化物歧化酶和过氧化氢酶水平降低有关。J. Exp. Bot 1981; 126:93-101。gydF4y2Ba
Aebi H.过氧化氢酶体外研究。方法Enzymol。1984;105:121-6。gydF4y2Ba
Chance B, Maehly A.过氧化氢酶和过氧化物酶的测定。方法Enzymol。1955;2:764 - 75。gydF4y2Ba
确认gydF4y2Ba
感谢周淑梅教授(山东农业大学,中国)对生理数据测量的帮助。gydF4y2Ba
资金gydF4y2Ba
国家自然科学基金项目(3315203911、31471488)、转基因专项项目(2016ZX08002003-002、2016ZX08009-003)、国家重点研发计划项目(2016YFD0100602)资助。资助机构在设计研究、收集、分析和解释数据以及撰写手稿方面没有任何作用。gydF4y2Ba
作者信息gydF4y2Ba
从属关系gydF4y2Ba
贡献gydF4y2Ba
PSS、HWW和LRK对实验进行构思和设计;PSS完成了大部分的实验;JY进行了识别和进化分析gydF4y2BaTaPRX-2AgydF4y2Ba,并对手稿进行修改;LW、JXZ和WL进行亚细胞定位和植株转化;AFL提供了植物材料;PSS撰写并修改了手稿。所有作者已阅读并认可最终稿。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
伦理批准和同意参与gydF4y2Ba
本研究所用小麦品种“KN199”和“苏麦3号”来自山东泰安山东农业大学农学院作物生物学国家重点实验室。它们是公开的,用于非商业目的。gydF4y2Ba
同意出版gydF4y2Ba
不适用。gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者声明他们没有竞争利益。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba
施普林格自然对出版的地图和机构附属的管辖权要求保持中立。gydF4y2Ba
补充信息gydF4y2Ba
附加文件1:表S1。gydF4y2Ba
12种植物中III类过氧化物酶基因家族的数量。gydF4y2Ba
附加文件2:表S2。gydF4y2Ba
植物基因组中III类过氧化物酶的亚科分类。gydF4y2Ba
附加文件3:表S3。gydF4y2Ba
植物基因组中非典型III类过氧化物酶列表。gydF4y2Ba
附加文件4:图S1。gydF4y2Ba
III类过氧化物酶系统发生树。(a)第III类过氧化物酶第VI亚族;亚科(b)。gydF4y2Ba
附加文件5:图S2。gydF4y2Ba
中III类过氧化物酶的结构域和外显子-内含子结构图gydF4y2Ba白花蒿、黄花蒿、白花蒿、白花蒿、白花蒿、白花蒿、白花蒿。黄花菜、白花菜、黄花菜、黄花菜、黄花菜、黄花菜gydF4y2Ba而且gydF4y2Ba美国moellendorffiigydF4y2Ba.填充框:红色代表PRX域;白框代表其他外显子区域;黑箱代表未翻译区域(utr);线代表PRX内含子;数字0、1和2表示外显子相。长内含子被“//”缩短。gydF4y2Ba
补充文件6:表S4。gydF4y2Ba
来自7种植物的RNA-seq数据显示了dna水平的证据。gydF4y2Ba
附加文件7:图S3。gydF4y2Ba
积极选择的地点和推测的祖先序列。(a)利用PAML的M2a模型。(b)采用PAML的M8模型。(c)使用MEGAX。在13个prx和11个推测的祖先序列比对中,推测的积极选择位点被红框圈出。gydF4y2Ba
附加文件8:图S4。gydF4y2Ba
的本地化gydF4y2BaTaPRX-2AgydF4y2Ba主要在细胞核中。(a)矢量结构图gydF4y2BapBIN35S: eGFPgydF4y2Ba而且gydF4y2BapBIN35S: TaPRX-2A: eGFPgydF4y2Ba.(bgydF4y2Ba1gydF4y2Ba- dgydF4y2Ba2gydF4y2Ba的亚细胞定位gydF4y2BapBIN35S: TaPRX-2A: eGFPgydF4y2Ba融合蛋白和gydF4y2BapBIN35S: eGFPgydF4y2Ba烟草表皮细胞中的蛋白质。(bgydF4y2Ba3.gydF4y2Ba- dgydF4y2Ba4gydF4y2Ba的亚细胞定位gydF4y2BapBIN35S: TaPRX-2A: eGFPgydF4y2Ba融合蛋白和gydF4y2BapBIN35S: eGFPgydF4y2Ba洋葱表皮细胞中的蛋白质(bgydF4y2Ba1gydF4y2Ba- bgydF4y2Ba4gydF4y2Ba)绿色荧光图像;(cgydF4y2Ba1gydF4y2Ba- cgydF4y2Ba4gydF4y2Ba)明亮的绿色荧光合并图像;(dgydF4y2Ba1gydF4y2Ba- dgydF4y2Ba4gydF4y2Ba)明亮的野外图像。酒吧、20μm。gydF4y2Ba
附加文件9:图S5。gydF4y2Ba
核定位信号的预测gydF4y2BaTaPRX-2AgydF4y2Ba.gydF4y2Ba
附加文件10:图S6。gydF4y2Ba
表达谱及过氧化物酶活性测定。(a)表达分析gydF4y2BaTaPRX-2AgydF4y2Ba在转基因系和WT中使用gydF4y2BaTaPRX-2AgydF4y2Ba基因。(b)测定过氧化物酶活性gydF4y2BaTaPRX-2AgydF4y2Ba转基因系和WT基因gydF4y2Ba18 srrnagydF4y2Ba作为内源性对照。基因相对表达量由循环阈值(Ct)值计算(公式2)gydF4y2Ba-ΔΔCTgydF4y2Ba.数据为三次技术重复计算的平均值±标准差。每列上方的星号*和**表示与WT植株相比有显著差异(*gydF4y2BaPgydF4y2Ba< 0.05;**gydF4y2BaPgydF4y2Ba< 0.01)。gydF4y2Ba
附加文件11:表S5。gydF4y2Ba
用于分析的引物。gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循创作共用署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),该协议允许在任何媒体或格式中使用、分享、改编、分发和复制,只要您给予原作者和来源适当的署名,提供创作共用许可协议的链接,并说明是否有更改。本文中的图片或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果材料不包含在文章的创作共用许可中,并且您的预期用途不被法律法规允许或超出了允许的用途,您将需要直接从版权所有者那里获得许可。欲查看此许可证的副本,请访问gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.创作共用公共领域奉献放弃书(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)适用于本文提供的数据,除非在数据的信用额度中另有说明。gydF4y2Ba
关于这篇文章gydF4y2Ba
引用这篇文章gydF4y2Ba
苏鹏,颜俊杰,李伟,李伟。gydF4y2Baet al。gydF4y2Ba小麦III类过氧化物酶基因家族成员,gydF4y2BaTaPRX-2A,gydF4y2Ba增强了对盐胁迫的耐受性。gydF4y2BaBMC植物杂志gydF4y2Ba20.gydF4y2Ba392(2020)。https://doi.org/10.1186/s12870-020-02602-1gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12870-020-02602-1gydF4y2Ba
关键字gydF4y2Ba
- 小麦gydF4y2Ba
- 盐度的压力gydF4y2Ba
- 氧化物酶gydF4y2Ba
- TaPRX-2AgydF4y2Ba