摘要
背景
类黄酮的生物合成受到植物激素的强烈影响。例如,茉莉酸甲酯(MeJA)能促进梨类黄酮的积累。然而,meja诱导梨类黄酮生物合成的分子机制在很大程度上尚不清楚。因此,通过分析MeJA处理梨愈伤组织的转录组,阐明MeJA介导的黄酮生物合成的调控机制。
结果
外源MeJA显著提高了梨愈伤组织中类黄酮的积累,特别是花青素的积累。加权基因共表达网络分析确定了与meja诱导的类黄酮生物合成相关的差异表达基因。MeJA处理上调了黄酮生物合成途径结构基因的表达(PcCHS,PcCHI,PcF3H,PcDFR,PcANS,PcANR2a,PcLAR1).MYB家族成员是调控meja诱导的黄酮生物合成的主要转录因子,但bHLH、AP2-EREBP、NAC、WRKY和TIFY家族也参与其中。除了已知的梨花青素生物合成的正调控因子PcMYB10外,还发现了一些新的可能调控黄酮醇和原花青素生物合成的MYB候选基因。酵母双杂交和双分子荧光互补试验表明,PcMYB10和PcMYC2可以直接相互作用,并与JAZ阻遏子(PcJAZ1和PcJAZ2)结合。
结论
PcMYB10-PcMYC2分子复合物可能在转录水平上参与了茉莉酸介导的类黄酮生物合成的调控。本研究的数据可能阐明meja诱导梨愈伤组织黄酮积累相关的转录调控网络,为今后的研究提供坚实的基础。
背景
类黄酮是一类广泛分布于植物体内的次生代谢产物。它们被分为几个主要的亚群,如花青素、原花青素、黄酮醇、黄酮和异黄酮[1].这些代谢物在植物发育和防御中起着重要的生物学作用。花青素是一种水溶性色素,主要参与花和水果的着色。因此,花青素对吸引传粉者很重要,它们也影响种子的传播[2].此外,花青素是天然的抗氧化剂[3.].原花青素是浓缩单宁,主要集中在种子中,但它们也会影响水果的味道[4].黄酮醇、黄酮、黄酮和异黄酮有助于保护植物免受紫外线辐射和病原体的伤害[5].此外,类黄酮是植物适应生物和非生物胁迫所必需的[6].
类黄酮生物合成途径是苯丙类途径的一个分支[7,并且需要几种酶。例如,编码PAL(苯丙氨酸解氨酶)、CHS(查尔酮合成酶)、CHI(查尔酮异构酶)和F3H(黄酮3-羟化酶)的基因是早期生物合成基因(EBGs),在途径的早期步骤中产生共同的前体[8].后期生物合成基因(lbg)有助于后期合成特定的类黄酮产物,如花青素、原花青素和黄酮醇。lbg包括编码DFR(二氢黄酮醇4-还原酶)、ANS(花青素合成酶)和UFGT (udp -葡萄糖:黄酮3-葡萄糖基转移酶)的基因,它们专门参与花青素的生物合成[9].相比之下,LAR(白花青素还原酶)和ANR(花青素还原酶)是介导原花青素生物合成的关键酶[10].此外,黄酮醇合成酶(FLS)专门用于黄酮醇生物合成[11].类黄酮生物合成途径的结构基因受MYB - bHLH - wdr (MBW)复合体的转录控制,该复合体由一个MYB转录因子、一个碱性螺旋-环-螺旋(bHLH)和一个WD-repeat蛋白组成[12].
类黄酮的生物合成受多种因素的影响,包括光[13)、温度(14,水分亏缺[15],以及营养缺乏[16].此外,植物激素是植物类黄酮化合物生物合成的重要调节因子之一。植物激素的作用,如茉莉酸[17,18,脱落酸[19,20.)、生长素(21),乙烯(22),细胞分裂素(23]和赤霉素[24对黄酮类化合物积累的影响已被广泛研究。
茉莉酸酯是由十八烷/十六烷途径合成的氧脂素(含氧脂肪酸)[25].茉莉酸可以被代谢成几种衍生物,包括茉莉酸甲酯(MeJA)、茉莉酰异亮氨酸(JA- ile)、茉莉酰-1-氨基环丙烷-1-羧酸(JA- acc)、茉莉的糖基衍生物(如JA- o - glc)和顺式茉莉酮。然而,在这些衍生物中,只有MeJA和JA-Ile得到了很好的表征[26].多项研究表明,施用MeJA可诱导不同果实类黄酮的生物合成,如苹果(马吕斯有明显)[27)、葡萄(28,蓝莓29)和草莓(草莓属×ananassa)[30.].在梨中,采后施用MeJA可诱导UV-B/Vis照射下果皮中花青素的积累[31].除了花青素,Ni等[22]报道了MeJA增加了梨果实中其他类黄酮衍生物的积累,包括黄酮和异黄酮。
茉莉酸诱导花青素积累的分子机制已在拟南芥(拟南芥)和苹果[17,32,33].茉莉酸茨姆结构域蛋白(jjas)是SCF的底物COI1复杂并负调控茉莉酸信号通路[34,35].JAZ蛋白可直接与MYB和bHLH相互作用,破坏MBW复合体的形成[32,36].茉莉酸信号被感知后,JAZ蛋白被COI1募集到SCFCOI1复合体用于泛素化,随后被26S蛋白酶体途径降解[32].这触发MYB和bHLH转录因子的释放和MBW复合体的形成,激活类黄酮生物合成途径结构基因的表达[18,33].在拟南芥和苹果中,MeJA上调了MYB和bHLH转录因子基因的表达水平,表明这些转录因子受茉莉酸信号通路的调控。然而,meja诱导梨类黄酮生物合成的分子机制尚不清楚。因此,本研究对MeJA处理的梨愈伤组织进行了全面的转录组分析,以确定MeJA处理和未处理梨愈伤组织之间的差异表达基因(DEGs)。构建共表达网络,检测meja诱导的类黄酮生物合成相关转录本。本研究生成了一个候选基因库,需要对其进行更详细的分析,以阐明meja诱导梨类黄酮生物合成的分子机制。具体来说,我们对梨愈伤组织进行了研究,因为它们不受季节的限制,而且它们的基因效应可以在一个同质系统中容易观察到,这可以大大加速梨基因功能的研究。
结果
meja诱导梨愈伤组织中类黄酮的积累
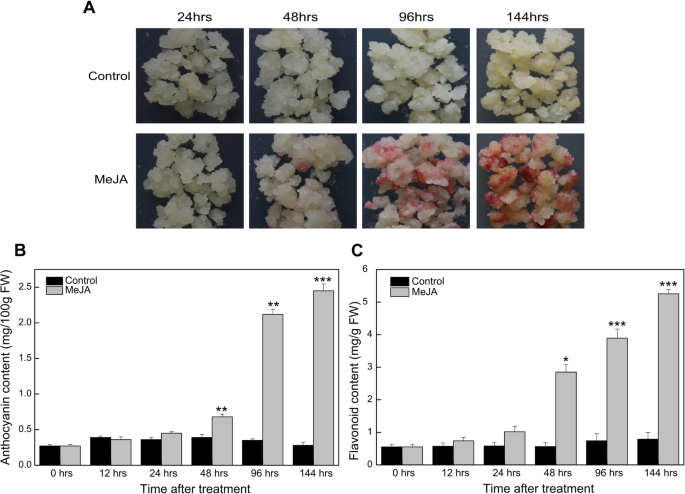
为了研究MeJA对梨愈伤组织黄酮生物合成的影响,将愈伤组织转移到含有50 μmol/L MeJA的Murashige和Skoog (MS)培养基中,而对照组转移到含有1%甲醇的MS培养基中。meja处理的梨愈伤组织和对照组在处理48小时后观察到明显的表型差异(图1)。1a).此外,在meja处理的梨愈伤组织中检测到红色。meja处理的梨愈伤组织中花青素和类黄酮含量在48 h后大幅增加,并在整个处理过程中持续增加(图1)。1b和c)。
RNA测序概述
从MeJA处理后0、12和48 h的梨愈伤组织和相应对照样本中提取总RNA,进行RNA测序(RNA-seq)分析。每个库的原始阅读数从4439万到6210万不等。经过质量过滤,每个库产生了4343万到6077万的清洁阅读。此外,所有文库的Q20和Q30值分别为≥96.48%和≥90.9%,证实了用于进一步分析基因表达的RNA和测序数据的高质量。总参考基因组映射率从70到72.67%不等,其中63.9到65.79%的reads是唯一映射的4:表S1)。
差异表达基因分析
为了确定meja处理和对照梨愈伤组织之间的基因表达差异,基因表达水平基于千碱基每百万片段(FPKM)值归一化(附加文件)5:表S2)。所有唯一映射的reads被用来计算基因FPKM值。根据以下标准对deg进行识别和筛选:调整p-value < 0.005 and log2(fold-change)值> 1。meja处理后12 h,梨愈伤组织中4228和3410基因的表达量相对于对照分别上调和下调。此外,meja处理后48 h梨愈伤组织中2583和1659个基因表达水平与对照相比分别上调和下调1:图S1)。
GO注释和KEGG通路分析
基于基因本体论(GO)数据库对所有unigenes进行功能注释。预测的基因被分为三个主要类别(生物过程、分子功能和细胞成分)。(附加文件2:图S2)。此外,通过富集的京都基因与基因组百科(Kyoto Encyclopedia of Genes and Genomes, KEGG)通路来阐明MeJA处理激活的生物通路。功能分析表明,meja处理后的梨愈伤组织中,黄酮生物合成(mdm0094)途径在处理后12和48 h显著增强。与对照相比,meja处理的梨愈伤组织中除了类黄酮的生物合成外,植物激素信号转导(mdm04075)、次生代谢产物的生物合成(mdm01110)以及苯丙氨酸、酪氨酸和色氨酸的生物合成(mdm00400)也显著增强(图2)。2).
茉莉酸信号转导途径
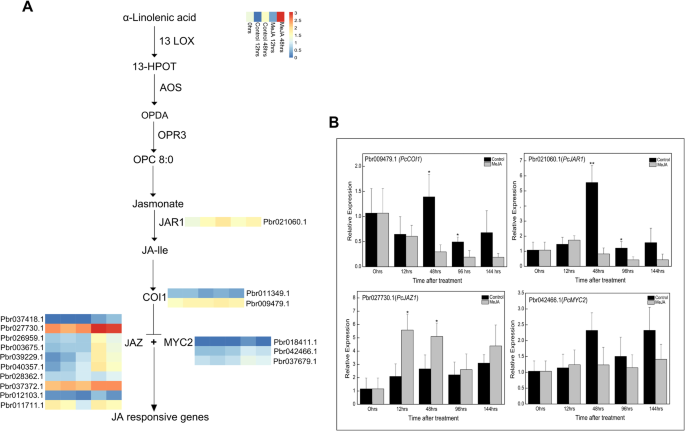
在注释与茉莉酸信号转导通路相关的DEGs后,发现了几个茉莉酸信号因子(图。3.a).例如,Pbr021060.1被区别表达并注释为PcJAR1.的PcJARmeja处理的梨愈伤组织转录水平低于对照组。两个PcCOI1基因Pbr011349.1和Pbr009479.1表达差异,表达水平在MeJA处理后上调。另有10个属于TIFY家族的JAZ基因表达水平上调。MeJA处理后48 h梨愈伤组织中JAZ差异表达基因的转录丰度低于MeJA处理后12 h。此外,Pbr018411.1、Pbr042466.1和Pbr037679.1,它们被注释为PcMYC2,在对照组愈伤组织中表达高于meja处理的愈伤组织。用实时定量pcr (qRT -PCR)分析基因的相对表达,验证测序结果。所选茉莉酸信号因子基因的表达水平与RNA-seq数据一致(图1)。3.b)。
除茉莉酸外,还发现有几种DEGs参与与其他植物激素相关的信号转导途径,包括细胞分裂素、乙烯、生长素、脱落酸和油菜素内酯6:表S3)。
与类黄酮生物合成相关的WGCNA模块的鉴定
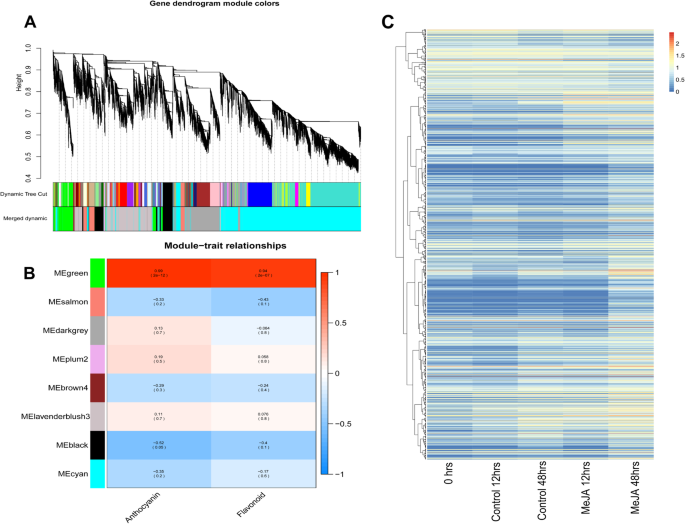
通过加权基因共表达网络分析(WGCNA)构建基因共表达网络,识别与meja诱导的类黄酮生物合成相关的DEGs。树状图的各个分支代表相互关联的基因簇(即模块)。分层聚类识别出8个共表达的WGCNA模块(图。4a).分析各模块与性状表型(花青素和类黄酮含量)相关的共表达。最大的(3139个)和最小的(77个)模块分别是“lavenderblush”和“plum”。对模块-性状关系的分析表明,“绿色”模块与梨愈伤组织花青素高度正相关。r= 0.99,p= 2 × 10−12)和类黄酮(r= 0.94,p= 2 × 10−7(图)内容。4b).“绿色”模块由1334个基因组成,整体表达模式如图所示。4c.选择该模块进行进一步分析,因为它是与梨愈伤组织中类黄酮生物合成最呈正相关的模块。
类黄酮生物合成途径
通过对黄酮类生物合成途径相关DEGs的鉴定,确定了几个结构基因。例如,PcCHS(Pbr020913.1和Pbr020914.1),PcCHI(Pbr038148.1和Pbr032289.1),以及PcF3H(Pbr034840.1)被鉴定为EBGs。此外,Pbr020145.1和Pbr005931.1被注释为PcDFR.Pbr001543.1 (PcANS)基因被鉴定为专门参与花青素的生物合成,而Pbr013248.1 (PcLAR1)及Pbr032454.1 (PcANR2a)影响原花青素的生物合成。我们绘制了所选类黄酮生物合成途径的结构基因,并确定了它们的表达模式(图。5a). EBGs和lbg与梨愈伤组织中花青素和类黄酮的积累呈正相关,meja处理梨愈伤组织中表达水平显著上调,尤其是处理后48 h。进一步用qRT-PCR分析所选结构基因的相对表达量,以验证测序数据。结果显示PcDFR在处理后48小时,meja处理的梨愈伤组织的表达约为对照组的2倍。的PcANSMeJA处理后,其表达水平约为对照组的7倍(图1)。5b)。
meja诱导的类黄酮生物合成的转录调控
通过WGCNA识别出可能参与meja诱导的类黄酮积累的转录因子家族1).MYB家族成员是调控类黄酮生物合成的主要转录因子基因,其次是bHLH和AP2-EREBP基因。此外,NAC和WRKY家族基因也存在差异表达。此外,TIFY和锌指蛋白(C2H2, C3H和C2C2-Dof)转录因子家族也被鉴定与茉莉酸信号转导通路有关。在WGCNA后面的“绿色”模块中共包含108个差异表达的转录因子基因。“绿色”模块中差异表达的转录因子基因的转录谱在附加文件中给出3.:图S3。这些基因中的大多数在MeJA处理后高度表达。除MYB转录因子外,bHLH基因Pbr006544.1、Pbr017127.1、Pbr017379.1和Pbr030521.1在meja处理的愈伤组织中表达量较对照显著上调。此外,Pbr029330.1、Pbr023747.1和Pbr008278.1是MeJA处理后WRKY转录因子基因的高表达基因。
MYB家族在meja诱导梨愈伤组织黄酮合成的转录调控中的作用
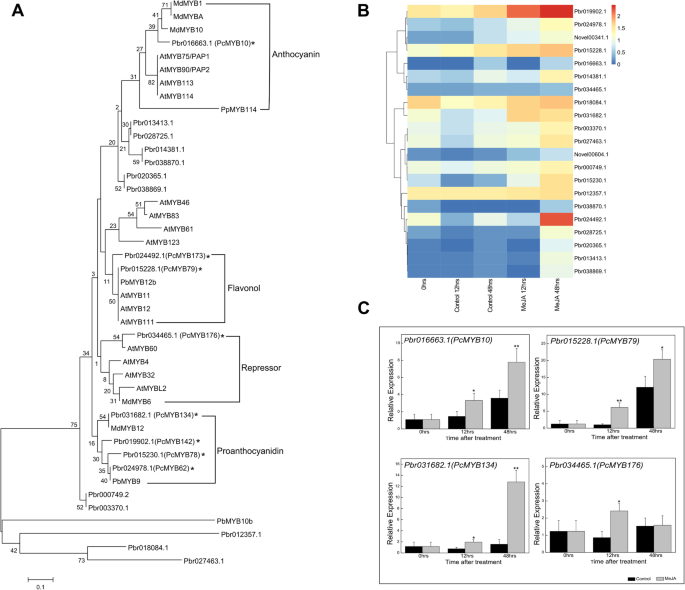
我们鉴定了21个“绿色”模块基因,编码meja诱导梨愈伤组织黄酮类化合物生物合成的候选MYB转录因子。基于已知的梨类黄酮调控MYB转录因子构建了系统发生树。Pyrusspp),苹果m .释放有)和拟南芥(Fig。6a).例如,Pbr016663.1 (MYB10)被鉴定为已知的梨花青素调控MYB转录因子。此外,还发现了几个新的候选MYB转录因子。Pbr015228.1 (PcMYB79)和Pbr024492.1 (PcMYB173)均与梨中黄酮醇调控因子PbMYB12b和拟南芥中黄酮醇调控因子MYB转录因子AtMYB12、AtMYB111和AtMYB11的系统发育相关。此外,4个候选MYB转录因子[Pbr031682.1 (PcMYB134)、Pbr019902.1 (PcMYB142)、Pbr015230.1 (PcMYB78)和Pbr024978.1 (PcMYB62)]被鉴定为原花青素生物合成的潜在调控因子。相比之下,Pbr034465.1 (PcMYB176)与苹果和拟南芥类黄酮生物合成抑制子组合在一起,被认为是一种潜在的抑制子。
候选MYB转录因子基因的转录谱显示,这些基因中的大多数在meja处理的梨愈伤组织中表达高于对照组,表达水平与花青素和类黄酮生物合成呈正相关(图1)。6b). qRT-PCR所选MYB转录因子基因的相对表达量与基于测序数据的FPKM值一致(图1)。6c)。
PcMYB10和PcMYC2与JAZ阻遏子相互作用
用酵母双杂交(Y2H)法分析了PcMYB10和PcMYC2与所选JAZ蛋白的物理相互作用。结果表明,PcMYB10和PpMYC2可以相互作用,并与PcJAZ1和PcJAZ2相互作用。7a).这些相互作用在双分子荧光互补(BiFC)试验中得到验证,在阴性对照中检测不到荧光(图。7b).然而,与Y2H结果一致的是,当PcMYB10-2YN与PcMYC2-2YC、PcJAZ1-2YC和PcJAZ2-2YC共表达时,细胞核中观察到强烈的绿色荧光蛋白信号。此外,在PcMYC2-2YN、PcJAZ1-2YC和PcJAZ2-2YC共浸润的样品中检测到荧光。这些结果表明,PcMYB10和PcMYC2可以相互作用,并与PcJAZ1和PcJAZ2相互作用。
讨论
MeJA诱导梨愈伤组织黄酮类化合物的生物合成
在植物中,茉莉酸是必要的信号分子[37促进次生代谢物的生物合成,特别是类黄酮[38].类黄酮是水果质量和经济价值的重要决定因素,因为它们对颜色、香气、涩味和抗氧化性能有影响[39].因此,在过去的几十年里,人们进行了大量的研究,以制定通过茉莉酸处理提高水果类黄酮含量的策略[22,27,30.,31].在本研究中,外源MeJA的应用激活了梨愈伤组织茉莉酸信号通路。与未处理的对照相比,meja处理梨愈伤组织中许多DEGs的表达水平上调1:图S1)。此外,几个重要的茉莉酸信号因子(JAR1, COI1, JAZ和MYC2)被注释为茉莉酸信号转导途径的一部分(图。3.).
以梨愈伤组织为研究对象,研究MeJA对梨愈伤组织中黄酮类化合物生物合成的影响,因为MeJA可以连续均匀地生产,有效地利用可利用空间。我们观察到MeJA显著促进了梨愈伤组织中类黄酮的生物合成,特别是花青素的合成。1).同样,先前的研究也得出结论,MeJA促进苹果愈伤组织中花青素和原花青素的积累[18,20.,33].此外,据报道,高效的体外系统可以在商业规模上生产高质量的花青素[40].
在本研究中,MeJA治疗上调EBGs的表达,如PcCHS,PcCHI,PcF3H,它们参与类黄酮生物合成途径的早期阶段。此外,与花青素和原花青素生物合成相关的lbg在meja处理的梨愈伤组织中比在对照组中表达更高(图1)。5).DFR和ANS都被认为是花青素生物合成的关键酶[9].与我们的结果一致,Shan等人。[17]报道茉莉酸强烈上调AtDFR从而调节花青素的积累。此外,其他类黄酮生物合成基因的表达水平,包括AtPAL,青岛,AtCHI,AtF3H,AtF3'H,虽然表达水平仍然相对较低,但茉莉酸酯也反应增加。孙等人[20.]表明,外源MeJA的施用增加了红肉苹果愈伤组织中花青素的积累,因为其相关的上调MdCHS,MdF3H,MdUFGT表达式.除了花青素生物合成相关基因外,参与原花青素生物合成的关键基因的表达(PcANR2a而且PcLAR1)也被MeJA上调(图。5).此外,KEGG分析显示,meja处理的梨愈伤组织中,类黄酮生物合成途径较未处理的梨愈伤组织明显增强(图1)。2).
基于RNA测序数据的meja介导的梨愈伤组织黄酮类化合物合成的转录调控
转录因子调控类黄酮生物合成途径结构基因的表达。例如,MYB、bHLH和WDR蛋白形成MBW复合体,调节许多植物物种的类黄酮生物合成[12].先前的研究表明,MYB转录因子是类黄酮生物合成过程中控制特定基因表达模式的调控网络中的关键元素[1].在梨中,PpMYB10最初被确定为R2R3-MYB转录因子,可积极调节花青素的生物合成[41].此外,PbMYB10b和PbMYB9被认为是梨花青素和原花青素生物合成的正调控因子[42].早前的研究发现,PpMYB114和PpbHLH3可共同调控梨果实花青素的生物合成[43],而PbMYB12b被功能注释为梨中的黄酮醇调节剂[44].然而,参与茉莉酸介导的类黄酮生物合成的MYB转录因子在梨中尚未被特异性表征。然而,据报道,在苹果中,MdMYB9和MdMYB11与MdbHLH3和MdTTG1相互作用,形成MBW复合体,调节茉莉酸介导的花青素和原花青素的积累[33].最近,MdMYB24L该基因在苹果愈伤组织中过表达,其功能特征是一个编码茉莉酸响应型MYB转录因子的基因,该转录因子参与meja诱导的苹果花青素积累。其他研究证明茉莉酸诱导拟南芥花青素积累是由MYB转录因子(包括PAP1 (MYB75)、PAP2 (MYB90)和GL3)介导的,这些转录因子上调了花青素生物合成基因的表达[17,32].
RNA测序是明确次生代谢物生物合成途径中必要基因的转录调控的有效工具[45].在WGCNA的基础上,我们鉴定了21个MYB转录因子候选基因,它们的表达水平与meja诱导的梨愈伤组织黄酮类化合物生物合成显著正相关。这些基因包括Pbr016663.1 (PcMYB10),它编码一种已知的MYB转录因子,该转录因子正向调节梨花青素的生物合成。有趣的是,我们发现了一些新的MYB候选基因,它们可能是梨原花青素和黄酮醇生物合成的潜在调节因子(图1)。6).
基于我们的转录组数据,编码bHLH、AP2-EREBP、NAC、WRKY和TIFY家族其他候选转录因子的基因也被发现表达差异3.:图S3)。已经报道了几种bHLH转录因子调控植物中茉莉酸响应花青素积累。此前的一项研究证明,属于bHLH家族的MYC2调节拟南芥中多种茉莉酸盐反应,包括花青素生物合成、伤口反应、根系生长抑制和氧化应激适应[17].此外,MYC3和MYC4是MYC2的同源物,在茉莉酸信号通路中与MYC2共同发挥作用[46].此外,GL3、EGL3和TT8 bHLH转录因子也是拟南芥茉莉酸响应花青素积累的正调控因子[32].在苹果中,MdMYC2被鉴定为茉莉酸诱导的花青素生物合成的正向调节因子[47].然而,bHLH转录因子参与梨茉莉酸介导的类黄酮生物合成尚未见报道。在目前的研究中,我们确定了几个候选bHLH转录因子,包括PcMYC2,它们可能参与茉莉酸诱导的梨愈伤组织中黄酮的生物合成(图1)。3.和额外的文件3.:图S3)。
meja诱导梨愈伤组织黄酮类化合物生物合成的分子机制
茉莉酸诱导的拟南芥花青素生物合成的分子机制已被彻底表征[17,32,35,48].JAZ蛋白被认为抑制茉莉酸信号通路。JAZ抑制子直接与MBW复合体的MYB转录因子(PAP1、PAP2和GL1)和bHLH转录因子(GL3、EGL3和TT8)相互作用,抑制转录,进而抑制拟南芥花青素的生物合成。在茉莉酸信号诱导JAZ蛋白降解后,MBW复合物被激活,诱导下游结构基因的表达,并介导茉莉酸诱导的花青素生物合成[32].此外,Shan等人。[17]揭示了F-box蛋白COI1对转录因子基因的表达至关重要,包括编码PAP1、PAP2和GL3的转录因子基因。在苹果中,一项早期的研究得出结论,MdJAZ2抑制MdbHLH3的招募到MdMYB9而且MdMYB1启动子。茉莉酸信号被感知后,MdbHLH3被释放,形成MBW复合物,参与激活下游与类黄酮生物合成相关的基因[33].然而,茉莉酸介导的梨类黄酮生物合成的分子机制尚不清楚。
在本研究中,我们观察到PcMYB10和PcMYC2可以直接相互作用,并与JAZ蛋白(PcJAZ1和PcJAZ2)相互作用(图2)。7).相反,我们的转录组数据表明,10个JAZ基因在meja处理的愈伤组织中比在对照愈伤组织中表达更高(图1)。3.).虽然JAZ基因的转录可能上调,但由于翻译后调控活动的存在,可能与高译蛋白水平不一致[49].在之前的一项关于苹果的研究中,MdJAZ8和MdJAZ11与mdmyb24样蛋白形成复合物,从而削弱MYB-MYC2复合物的转录活性,在茉莉酸盐的作用下,MdJAZ8和MdJAZ11被降解,释放MdMYC2和MdMYB24L,从而促进ja介导的花青素积累[18].因此,本研究结果表明,PcMYB10-PcMYC2分子复合物可能参与了茉莉酸介导的梨类黄酮生物合成的转录调控。然而,这需要在未来的研究中进行实验验证。
结论
在本研究中,外源MeJA的应用激活了茉莉酸信号通路。此外,MeJA通过上调梨愈伤组织结构基因(PcCHS,PcCHI,PcF3H,PcDFR,PcANS,PcLAR1)在类黄酮生物合成途径中。MYB家族显著参与黄酮生物合成的转录调控,bHLH、AP2-EREBP、NAC、WRKY和TIFY家族成员也参与其中。蛋白质相互作用分析表明,PcMYB10-PcMYC2分子复合物可能影响茉莉酸介导的梨愈伤组织黄酮合成的转录调控。我们的综合转录组分析揭示了一组候选转录因子,这些转录因子可能与未来与meja介导的梨类黄酮生物合成的转录调控相关的功能研究有关。
方法
植物材料及处理
梨愈伤组织是由幼梨“克拉普的最爱”(Clapp ' s Favorite)的果肉诱导而成。Pyrus普通的)在我们的体外实验室根据已发表的协议[50].梨果样品是中国山东省烟台市农业科学院李元军教授提供的。简单地说,梨愈伤组织在添加蔗糖(30 g/L)、6-苄基氨基嘌呤(0.5 mg/L)和2,4-二氯苯氧乙酸(1.0 mg/L)的MS固体培养基上生长。愈伤组织每3周继代培养一次。转入含MeJA的MS培养基,MeJA在甲醇中稀释至50 μmol/L。对照愈伤组织转移到含1%甲醇的MS培养基上。处理后的愈伤组织和对照的愈伤组织在24°C连续白光(2000 lx)下培养。分别于处理后0、12、24、48、96和144 h收集愈伤组织标本。在每个时间点,从三个愈伤组织板上收集样本(3个重复)。实验按照完全随机设计进行。 The collected calli samples were immediately frozen in liquid nitrogen and stored at − 80 °C until analyzed.
总黄酮含量的测定
利用科明生物植物类黄酮提取试剂盒(苏州克明生物技术有限公司,苏州,中国)分析黄酮类化合物。具体来说,黄酮类化合物用60%乙醇提取,然后在碱性亚硝酸盐溶液中与铝离子络合。用DU800分光光度计(Beckman Coulter, Brea, CA, USA)测量样品提取物的吸光度(530 nm),然后用以下公式计算黄酮含量:
花青素总含量的测定
如前所述,从梨愈伤组织中提取花青素[14].简单地说,0.2 g冷冻梨愈伤组织用1ml甲醇:醋酸(99:1体积)处理,在黑暗中4℃过夜。用DU800分光光度计测量吸光度(530,620,650 nm)。总花青素含量计算公式如下:
RNA提取和qRT-PCR分析
采用十六烷基三甲基溴化铵法从采集的样品中提取总RNA [51].qRT-PCR分析如前所述[52].关于qRT-PCR引物的详细信息列在附加文件中7:表S4。
RNA-seq分析
MeJA处理后0、12和48 h取样的梨愈伤组织以及相应的对照样品(1%甲醇)用于RNA-seq分析,按照Bai等人的描述完成。[50].文库准备好,然后用HiSeq X系统(Illumina, San Diego, CA, USA)测序,由Novogene (Beijing, China)完成。干净的读取被映射到Pyrus bretschneideri基因组序列(http://gigadb.org/dataset/100083),使用HISAT2的默认参数。
差异表达基因的GO和KEGG富集分析
利用goseq R包完成对DEGs的GO富集分析,并对基因长度偏差进行校正。GO条件与一个修正p-值小于0.05被认为显著富集。利用KOBAS软件对DEGs中显著富集的KEGG通路进行识别(http://www.genome.jp/kegg/)[53].
共表达模块的构建与可视化
根据已发表的方法,使用R包执行WGCNA [54].梨类黄酮调控MYB转录因子序列Pyrusspp),苹果m .释放有)和拟南芥均从NCBI数据库下载。蛋白质资料在附加文件中提供8:表S5。利用MEGA 6.0程序的邻居连接方法(500个自举重复)生成系统进化树。
酵母2台混合动力分析
酵母双杂交检测使用Matchmaker™黄金酵母双杂交系统试剂盒(TaKaRa,大连,中国)进行。将猎物蛋白和诱饵蛋白的全长编码序列分别克隆到pGADT7 (AD)和pGBKT7 (BD)载体上。首先,将全长的PcMYB10-BD和PcMYC2-BD质粒插入到含有空AD载体的Y2HGold细胞中,然后确认PcMYB10-BD和PcMYC2-BD缺乏自我激活。将重组基因- ad和基因- bd质粒与Y2HGold感受质细胞共转化,铺于琼脂固化SD/−Leu/−色氨酸培养基上。为了评估潜在的物理相互作用,共转化菌落选择在缺乏腺嘌呤、组氨酸、亮氨酸和色氨酸的SD培养基上,添加X-α-gal。
双分子荧光互补法
如前所述进行BiFC分析[52].简单来讲,PcMYB10,PcMYC2,PcJAZ1,PcJAZ2将无终止码子的编码序列扩增,克隆到p2YN和p2YC载体上。将得到的重组质粒插入根癌土壤杆菌培养GV3101细胞株烟草benthamiana叶子。浸润48小时后,用共聚焦激光扫描显微镜(日本尼康)在转化后的叶片中检测到荧光。
系统发育分析
利用MEGA 6.0程序的邻居连接方法生成系统进化树。这棵树包括来自分支节点旁边1000个复制的引导值和一条表示演化距离为0.1%的条形。梨类黄酮调控MYB转录因子的登录数(英文)Pyrusspp),苹果m .释放有)和被纳入系统发育分析的拟南芥在附加文件中列出8:表S5。
统计分析
实验按照完全随机设计进行。显著差异(*p< 0.05, * *p< 0.01, ***p两种独立治疗之间的差异均< 0.001)t以及。所有数据均采用SPSS软件(版本25)(SPSS Inc., Chicago, IL, USA)进行分析。
数据和材料的可用性
本研究的相关数据包含在本文和补充文件中。
缩写
- 惩罚:
-
甲基jasmonate
- 度:
-
差异表达基因
- CHS:
-
查耳酮合酶
- 气:
-
查耳酮异构酶
- F3H:
-
黄烷酮3-hydroxylase
- DFR:
-
Dihydroflavonol 4-reductase
- 答:
-
花青素合成酶
- EBG:
-
早期的生物合成的基因
- LBG:
-
晚期生物合成的基因
- WGCNA:
-
加权基因共表达网络分析
参考文献
- 1.
strackr, Werber M, Weisshaar B.拟南芥.植物学报,2001;4(5):447-56。
- 2.
植物色素的遗传与生物化学。植物生物学杂志2006;57:761-80。
- 3.
香野M,高柳木T,原田K,牧野K,石川F.紫甘薯花青素抗氧化活性研究,Ipomoera甘薯品种Ayamurasaki。生物技术与生物化学。2005;69(5):979-88。
- 4.
Pourcel L, Routaboul J-M, Kerhoas L, Caboche M, Lepiniec L, Debeaujon I.透明TESTA10编码一种漆酶样酶,参与拟南芥种皮类黄酮的氧化聚合。植物细胞。2005;17(11):2966 - 80。
- 5.
Havsteen黑洞。黄酮类化合物的生物化学和医学意义。杂志。2002;96(2 - 3):67 - 202。
- 6.
班尼特注册护士,沃斯格罗夫注册护士。植物防御机制中的次生代谢物。新植醇。1994;127(4):617 - 33所示。
- 7.
黄酮类化合物的生物合成及胁迫的影响。植物学报,2002;5(3):218-23。
- 8.
黄酮类化合物:生物化学通路的调节和进化的彩色模型。植物科学进展2005;10(5):236-42。
- 9.
Honda C, Kotoda N,和田M,近藤S,小林S, Soejima J,张Z, Tsuda T, Moriguchi T花青素生物合成基因在苹果皮染红过程中协调表达。植物生理与生物化学。2002;40(11):955-62。
- 10.
Almeida JRM, D 'Amico E, Preuss A, Carbone F, CHRd V, Deiml B, Mourgues F, Perrotta G, Fischer TC, Bovy AG, Martens S, Rosati c草莓果实发育过程中类黄酮和原花青素生物合成主要酶和基因的表征(草莓属×ananassa).生物化学。2007;465(1):61-71。
- 11.
黄酮和黄酮合成酶。植物化学。2005;66(20):2399 - 407。
- 12.
Meissner RC, Jin H, Cominelli E, Denekamp M, Fuertes A, Greco R, Kranz HD, Penfield S, Petroni K, Urzainqui A, Martin C, Paz-Ares J, Smeekens S, Tonelli C, Weisshaar B, Baumann E, Klimyuk V, Marillonnet S, Patel K, Speulman E, Tissier AF, Bouchez D, Jones JJD, Pereira A, Wisman E, Bevan M在拟南芥转录因子基因家族中的功能搜索:评估反向遗传学识别Rl2R3 MYB基因插入突变的潜力。植物细胞。1999;11(10):1827 - 40。
- 13.
陶锐,白松,倪娟,杨强,赵颖,滕颖。蓝光信号转导通路参与了枣苏红花青素的积累。足底。2018;248(1):37-48。
- 14.
Bai S, Saito T, Honda C, Hatsuyama Y, Ito A, Moriguchi T。苹果B-box蛋白MdCOL11参与了UV-B和温度诱导的花青素生物合成。足底。2014;240(5):1051 - 62。
- 15.
中林R, Yonekura-Sakakibara K, Urano K, Suzuki M, Yamada Y, Nishizawa T, Matsuda F, Kojima M, Sakakibara H, Shinozaki K, Michael AJ, Tohge T, Yamazaki M.过量积累抗氧化黄酮类物质增强拟南芥抗氧化和耐旱性植物j . 2014; 77(3): 367 - 79。
- 16.
姜春,高旭,廖琳,Harberd NP,付旭。拟南芥中磷素饥饿根系构型和花青素积累响应受赤外光- della信号通路的调控。植物杂志。2007;145(4):1460 - 70。
- 17.
单霞,张颖,彭伟,王智,谢东。茉莉酸诱导拟南芥花青素积累的分子机制。中国科学(d辑:自然科学版)2009;
- 18.
王艳,刘伟,姜红,毛铮,王宁,蒋珊,徐宏,杨刚,张铮,陈旭。R2R3-MYB转录因子MdMYB24-like参与茉莉酸甲酯诱导的苹果花青素生物合成。植物物理与生物化学,2019;133:273-82。
- 19.
Ban T, Shiozaki S, Ogata T, Horiuchi S.脱落酸和遮荫处理对京穗葡萄果实果皮中花青素和白藜芦醇含量的影响。Acta Hortic。2000;514:83 - 90。
- 20.
孙杰,王妍,陈鑫,龚鑫,王楠,马琳,邱莹,王妍,冯珊。茉莉酸甲酯和脱落酸对红肉苹果愈伤组织花青素合成的影响(马吕斯sieversiif。niedzwetzkyana).植物细胞学报2017;130:227-37。
- 21.
姬兴华,张锐,王宁,杨丽,陈兴生。转录组分析显示生长素抑制红肉苹果愈伤组织花青素的生物合成(马吕斯sieversiif。niedzwetzkyana).植物科学学报,2015;29(2):369 - 371。
- 22.
倪J,赵Y,道R,阴L, L, Strid,钱,李J,李Y,沈J,邓Y,白美国乙烯介导的分支jasmonate-induced类黄酮生物合成途径通过抑制花青素生物合成在红色中国梨果实。植物生物技术学报,2020;18:1223-40。
- 23.
Das PK, Shin DH, Choi S-B, Yoo S-D, Choi G, Park Y-I。细胞分裂素促进拟南芥中糖诱导的花青素生物合成。摩尔细胞。2012;34(1):93 - 101。
- 24.
Loreti E, Povero G, Novi G, Solfanelli C, Alpi A, Perata P. Gibberellins,茉莉酸和脱落酸调节蔗糖诱导的拟南芥花青素生物合成基因的表达。新植醇。2008;179(4):1004 - 16。
- 25.
茉莉酸和水杨酸作为防御基因表达的全局信号。植物学报,1998;1(1):404-11。
- 26.
Virginia B, Alessandra D. Jasmonate信号网络拟南芥:关键的调节节点和新的生理场景。新植醇。2007;177(2):301 - 18。
- 27.
茉莉酸甲酯促进富士苹果花青素积累,改善酚类物质和色素的产生。中国科学(d辑:自然科学版)2002;27(3):369 - 369。
- 28.
Flores G, Blanch GP, del Castillo MLR。采后用(-)和(+)-茉莉酸甲酯处理能刺激葡萄花青素的积累。食品科学与技术,2015;62(1):807-12。
- 29.
黄霞,李娟,尚宏。茉莉酸甲酯对蓝莓冷藏过程中花青素含量及抗氧化活性的影响。食品农业科学,2015;95(2):337-43。
- 30.
Pérez AG,桑兹C, Olías R, Olías JM。茉莉酸甲酯对草莓离体成熟的影响。农业食品化学。1997;45(10):3733-7。
- 31.
钱梅,于波,李旭,孙燕,张东,滕燕。红沙梨花青素生物合成基因的分离与表达分析,Pyrus pyrifoliaNakai简历。满天红对茉莉酸甲酯处理和UV-B/VIS条件的响应。植物分子生物学杂志,2014;32(2):428-37。
- 32.
齐涛,宋松,任青,吴东,黄红,陈艳,范敏,彭伟,任春,谢东。茉莉酸- zimi结构域蛋白与WD-repeat/bHLH/MYB复合体相互作用,调控茉莉酸介导的花青素积累和毛状体启动拟南芥.植物细胞。2011;23(5):1795 - 814。
- 33.
安晓华,田勇,陈克强,刘秀杰,刘东东,谢晓波,程春光,丛培华,郝玉杰。MdMYB9和MdMYB11参与调控ja诱导的苹果花青素和原花青素的生物合成。植物细胞物理学报2015;56(4):650-62。
- 34.
程铮,孙亮,齐涛,张斌,彭伟,刘燕,谢东。拟南芥bHLH转录因子MYC3与茉莉酸zimi结构域蛋白相互作用介导茉莉酸应答。摩尔。2011;4(2):279 - 88。
- 35.
Thines B, Katsir L, Melotto M, Niu Y, Mandaokar A, Liu G, Nomura K, He SY, Howe GA, Browse J. JAZ抑制蛋白是SCFCOI1复合物在茉莉酸信号传递过程中的靶标。自然.2007, 448(7154): 661 - 5。
- 36.
宋松,齐涛,黄红,任强,吴东,常超,彭伟,刘宇,彭杰,谢东。茉莉酸- zim结构域蛋白与R2R3-MYB转录因子MYB21和MYB24互作影响拟南芥茉莉酸调控的雄蕊发育。植物细胞。2011;23(3):1000 - 13所示。
- 37.
王晓燕,王晓燕。茉莉酸信号通路的研究。植物细胞。2002;14(增刊)。S153-S164:https://doi.org/10.1105/tpc.000679.
- 38.
豪。茉莉酸作为伤口反应的信号。植物生长学报2004;23(3):223-37。
- 39.
黄酮类化合物的生物合成、生物功能和生物技术应用。植物科学,2012;3(222)https://doi.org/10.3389/fpls.2012.00222.
- 40.
黄菊愈伤组织中花青素的产生Crataegus sinaica木香。中华医学杂志2009;1(1):30-4。
- 41.
冯松,王勇,杨松,徐勇,陈旭。梨花青素生物合成受R2R3-MYB转录因子PyMYB10调控。足底.2010年,232(1):245 - 55。
- 42.
翟锐,王铮,张松,宋亮,王铮,李鹏,马芳,徐磊。两个MYB转录因子调控梨果实黄酮生物合成(Pyrus bretschneideriRehd)。中国科学(d辑:自然科学版)2015;
- 43.
姚刚,明明,Allan AC,顾超,李亮,吴旭,王瑞,常勇,齐凯,张松,吴俊。梨基因MYB 114与其他转录因子相互作用,协同调控果花色素苷生物合成。植物j . 2017; 92(3): 437 - 51。
- 44.
翟锐,赵颖,吴敏,杨军,李旭,刘宏,吴涛,梁峰,杨超,王智,马芳,徐磊。MYB转录因子PbMYB12b正向调控梨果实黄酮醇生物合成。BMC Plant Biol 2019;9:85。
- 45.
Kalra S, Puniya BL, Kulshreshtha D, Kumar S, Kaur J, Ramachandran S, Singh K. De novo转录组测序揭示了植物的重要分子网络和代谢途径,Cholorophytum borivilianum.PLoS ONE。2013; 8 (12): e83336。
- 46.
Fernandez-Calvo P, Chini A, Fernandez-Barbero G, Chico J-M, Gimenez-Ibanez S, Geerinck J, Eeckhout D, Schweizer F, Godoy M, Franco-Zorrilla JM, Pauwels L, Witters E, Puga MI, Paz-Ares J, Goossens A, raymond P, Jaeger GD, Solano R.拟南芥bHLH转录因子MYC3和MYC4是JAZ抑制子的靶点,并与MYC2共同激活茉莉酸反应。植物细胞。2011;23(2):701 - 15所示。
- 47.
安建平,李红红,宋丽琴,苏玲,刘旭,游青祥,王旭峰,郝艳杰。苹果bHLH转录因子MdMYC2的分子克隆及功能表征。植物生理生物化学,2016;108:24-31。
- 48.
Melotto M、Mecey C、Niu Y、Chung HS、Katsir L、Yao J、Zeng W、Thines B、Staswick P、Browse J、Howe JA、He SY。拟南芥JAZ蛋白Jas基序中两个带正电的氨基酸在介导COI1 F-box蛋白的冠氨酸和茉莉基异亮氨酸依赖性相互作用中的关键作用。植物j . 2008; 55(6): 979 - 88。
- 49.
谢D-X, Feys BF, James S, Nieto-Rostro M, Turner JG。COI1:拟南芥茉莉调节防御和生育所需的基因。科学.1998, 280(5366): 1091 - 4。
- 50.
白松,陶瑞,唐勇,尹亮,马艳,倪娟,闫欣,杨强,吴铮,曾勇,滕颖。B-box蛋白BBX16通过激活红梨MYB10正向调节光诱导花青素积累。植物生物技术学报2019;17:1985-97。
- 51.
张丹,于斌,白娟,钱梅,舒琼,苏娟,滕勇。高温对UV-B/可见光照射诱导的云红里号采后花青素积累的影响。1 '(Pyrus pyrifoliaNakai)梨。Sci Hortic。2012;134:53-9。
- 52.
倪娟,白松,赵颖,钱梅,陶锐,尹亮,高亮,滕宇。乙烯响应因子Pp4ERF24和Pp12ERF96通过与MYB114的相互作用调控“枣苏红”果实中蓝光诱导的花青素生物合成。植物分子生物学2019;99(1-2):67-78。
- 53.
毛曦,陶晨,Olyarchuk JG,魏磊。KEGG Orthology (KO)作为对照词汇的自动化基因组注释和通路识别。生物信息学。2005;21(19):3787 - 93。
- 54.
白松,孙颖,钱梅,杨芳,倪娟,陶锐,李亮,舒琼,张东,滕宇。套袋处理红沙梨果皮的转录组分析揭示了花青素积累的光响应通路功能。Sci众议员2017;7(1):63。
确认
不适用。
资金
本研究得到国家自然科学基金项目(no . 31901986, JN, 31772272)和中国农业科学研究专项基金(CARS-28, YT)的资助。资助机构没有参与研究的设计、数据收集、数据解释或撰写手稿。
作者信息
从属关系
贡献
YT构思了这项研究。ATP进行了实验。ATP, SB, JN和JS分析了转录组数据。ATP、YT、JN、SB撰写了手稿。所有作者阅读并批准了最终稿件。
相应的作者
道德声明
伦理批准和同意参与
不适用。
同意出版
不适用。
相互竞争的利益
作者声明他们没有竞争利益。然而,YT和SB是《BMC Plant Biology》编委会成员。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构附属的管辖权要求保持中立。
补充信息
附加文件1:图S1。
火山图分析了meja处理的梨愈伤组织与对照(1%甲醇)在不同时间点的差异表达基因。
附加文件2:图S2
.meja处理梨愈伤组织12和48 h后差异表达上调unigenes的基因本体分类。x轴和y轴分别表示富集的GO项和差异表达的基因数量。
附加文件3:图S3。
加权基因共表达网络的ME“绿色”模块中差异表达的转录因子基因表达模式的热图。从蓝色到红色的色阶表示FPKM值的增加。
附加文件4:表S1。
测序数据的详细统计。
附加文件5:表S2。
基因表达量化。
附加文件6:表S3。
参与植物激素信号转导途径的差异表达基因。
补充文件7:表S4。
qRT-PCR分析用引物。
附加文件8:表S5。
梨类黄酮调控MYB转录因子的登录数(Pyrusspp),苹果马吕斯有明显)和拟南芥(拟南芥)被纳入系统发育分析。
权利和权限
开放获取本文遵循创作共用署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),该协议允许在任何媒体或格式中使用、分享、改编、分发和复制,只要您给予原作者和来源适当的署名,提供创作共用许可协议的链接,并说明是否有更改。本文中的图片或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果材料不包含在文章的创作共用许可中,并且您的预期用途不被法律法规允许或超出了允许的用途,您将需要直接从版权所有者那里获得许可。欲查看此许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献放弃书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信用额度中另有说明。
关于这篇文章
引用这篇文章
Premathilake, A.T,倪婧,沈婧,沈婧。et al。转录组分析为茉莉酸甲酯诱导梨愈伤组织黄酮合成的转录调控提供了新的思路。BMC植物杂志20.388(2020)。https://doi.org/10.1186/s12870-020-02606-x
收到了:
接受:
发表:
关键字
- 甲基jasmonate
- 类黄酮
- 转录组
- WGCNA
- PcMYB10
- PcMYC2