摘要
背景
花生是世界上重要的豆科作物。随着异体四倍体基因组的发表,进一步研究花生基因的功能对作物改良非常重要。CRISPR/Cas9系统是基因功能研究和作物改良的有力工具,但尚未在花生上广泛应用。花生植株通过与根瘤菌的共生关系形成根瘤来固定氮。在模型豆科植物中,植物对根瘤菌的反应是由Nod因子受体(NFRs)启动的。然而,关于功能的信息nfr在花生方面仍然有限。在本研究中,我们将CRISPR/Cas9工具应用于花生毛状根转化系统中,探索其功能非功能性需求基因。
结果
我们首先发现了AhNFR1基因和两个AhNFR5栽培花生的基因(Tifrunner).基因表达分析表明AhNFR1和两个AhNFR5在结瘤过程中,结瘤(Nod+)系E5较非结瘤(Nod-)系E4表达量高,提示其在花生结瘤过程中的作用。为了进一步探索它们在花生结瘤中的作用,我们应用CRISPR技术创建了花生结瘤突变体AhNFR1而且AhNFR5基因利用毛状根转化系统。这些基因在转基因毛状根中的测序结果表明AhNFR1而且AhNFR5结果表明,该系统对花生同种异体四倍体的靶向突变具有一定的效果。两个编辑的变种人AhNFR5基因显示Nod-表型,而在两个选择的突变体中进行编辑AhNFR1基因接种根瘤菌后仍可形成根瘤。
结论
本研究表明,CRISPR-Cas9可用于花生毛状根转化系统的功能基因组研究,特别是对花生根系基因功能的研究。通过使用CRISPR-Cas9靶向花生AhNFR在毛状根转化系统中,我们验证了基因的功能AhNFR5花生结节形成的基因。
背景
种植花生(落花生hypogaeaL.)是一种豆科作物,具有很大的经济价值,主要用于石油和粮食生产。栽培花生是一个具有A和B两个亚基因组的异源四倍体(AABB基因组,2n =4 x = 40)。这两个亚基因组可能来自两个二倍体祖先物种答:duranensis而且答:ipaensis[1].两个花生祖先种和两个栽培栽培品种的基因组(Tifrunner和Shitouqi)已完全测序,并公开提供[1,2,3.].这些参考基因组极大地促进了花生分子和遗传研究。为了表征花生基因组中基因的功能,工程基因过表达和RNA干扰(RNAi)已被广泛应用[4,5,6].然而,基因过表达会对机体产生副作用,RNAi敲除并不能消除剩余蛋白质的功能,从而限制了其基因功能表征的能力。在花生遗传研究中,有必要更新基因功能分析库。
CRISPR/Cas9(聚类规则间隔短回文重复序列/CRISPR相关蛋白9)系统已经成功地在许多植物系统中演示了精确的基因编辑[7].CRISPR/ cas介导的基因敲除、置换和插入为基因功能研究、植物生物学和精确植物育种提供了简单有效的方法[8,9].CRISPR/Cas9在植物中的应用使植物育种家能够控制目标基因,为作物的快速改良提供了巨大的资源[8,9].人们相信,CRISPR/Cas具有增强全球粮食安全和可持续农业的潜力。然而,目前对CRISPR/Cas9在花生中的应用还知之甚少。
花生和其他豆科植物的固氮根瘤共生关系使它们在无或无氮肥输入的土壤中生长良好,并产生富含蛋白质的种子。大多数豆科植物,包括模式豆科植物,都是通过“根毛”感染建立根瘤共生关系。植物根系分泌物如类黄酮可特异性诱导结瘤基因的转录(点头,Nol,挪亚)[10,11],它们参与了根瘤菌结瘤因子(Nod因子,NFs)的合成。NFs被宿主根表皮细胞的膜溶素motif (LysM)受体样激酶(LYK/LYR)识别,随后刺激植物根内的信号转导,通过感染线(IT)的形成和结节原基的形成促进根瘤菌的感染[12,13].花生形成结节,主要产生nfBradyrhizobium菌株,但NF突变Bradyrhizobium有报道在花生中诱发结节。14,15].根瘤菌侵入花生的方式被称为“裂隙侵入”[16,17],这与“根毛”感染途径不同。根瘤菌通过相邻腋窝毛细胞之间的中片进入根内,并在细胞间侵入皮层。受根瘤菌感染的大基底细胞反复分裂形成固定结节。
亲和性根瘤菌对NF的识别是根瘤共生的关键步骤。两个NF受体(非功能性需求)基因或它们的同源物在一些根毛感染的豆科植物中被鉴定和表征[18,19,20.,21,22,23,24].这些非功能性需求基因命名NFR1而且NFR5在l .对虾,均编码lysm型丝氨酸/苏氨酸受体激酶[19].豆科植物对根瘤菌感染的反应是由NFRs启动的,共生受体激酶(SYMRK)放大了nf感知的信号[14]从而激活下游的共生信号通路,启动结节的形态发生[14,25,26].
在花生中,发现了两种推测的NFRs (AhNFR1和AhNFP) [27],它们分别是LjNFR1和LjNFR5的正交向量。预测的AhNFP蛋白与大豆GmNFR5α和GmNFR5β具有相似的分子特征[27].在大豆中,过表达GmNFR5α,GmNFR5β而且GmNFR1α在Nod-突变体中可以恢复Nod+表型[22,28的过度表达GmNFR1α同时增加了单株结瘤数。由这两个基因编码的NFR蛋白Lotus对虾形成异聚物受体复合物,启动下游信号传递[29].我们以往的报告[26,30.]表明花生NFR5正交图可能在识别点头因素方面起作用。然而,Karmakar等人。15]认为花生与NFR1而且NFR5可能不是建立共生关系的关键基因,因为脂壳寡糖(LCO)结合受体基因(LYR3)和胞外多糖受体基因(EPR3)比古典的要高得多nfr(NFR1而且NFR5在花生)。本研究对花生进行毛状根介导的CRISPR基因敲除AhNFR1而且AhNFR5基因特征及其在结瘤共生中的功能。研究结果不仅证实了CRISPR/Cas9结合毛状根转化系统是一种快速表征根系基因功能的方法,而且提高了我们对根系基因功能的认识非功能性需求花生结瘤的基因功能
结果
检索和比较基因序列AhNFR1s而且AhNFR5s
利用编码DNA序列(CDS)GmNFR1(DQ219806)和GmNFR5(NM_001354196)作为查询AhNFR1基因(两个在一个亚基因组命名AhNFR1A1而且AhNFR1A2,两个在B亚基因组上命名AhNFR1B1而且AhNFR1B2)和两个AhNFR5基因(AhNFR5A亚基因组和AhNFR5B在B亚基因组上)是从花生基地的花生基因组中鉴定出来的(表1).这两个AhNFR5四种基因均无内含子AhNFR1基因有多个内含子(表1).在四个AhNFR1基因,长度AhNFR1A1序列比其他三个都长AhNFR1由于其内含子和外显子的数量增加而增加。DNA序列之间的同源性AhNFR5A而且AhNFR5B是98%;之间的同源性AhNFR1A1而且AhNFR1B1是96%;之间的同源性AhNFR1A2而且AhNFR1B2为99%(附加文件1:图S1)。
6个花生NFR蛋白序列的功能结构与其他豆科植物中报道的同源结构相似[31,32].它们有三个胞外LysM结构域,LysM1-LysM2和LysM2-LysM3之间的间隙结构域中典型的CXC(半胱氨酸-任意氨基酸-半胱氨酸)基序[27(图。1).
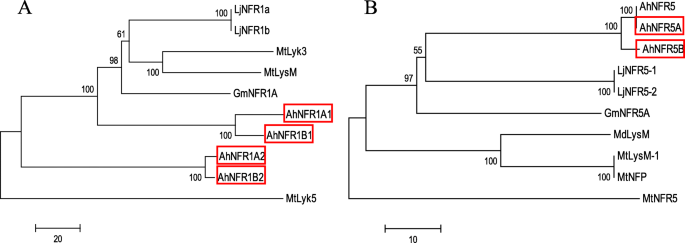
基于蛋白质序列的系统发育分析。2)表明AhNFR5A和AhNFR5B与LjNFR5-1/2和GmNFR5A密切相关;四个AhNFR1蛋白是LjNFR1和GmNFR1A的同源蛋白。
栽培花生和其他豆科植物NFRs的无根近邻系统发育树。NFR1。b NFR5。红色的方框突出显示了我们在PeanutBase中识别的NFRs orthologics。其他蛋白id为:AhNFR5 (ANS10208.1), GmNFR1A (ABB30246.1), GmNFR5A (NP_001341125.1), LjNFR1a (CAE02591.1), LjNFR1b (CAE02592.1), LjNFR5-1 (CAE02597.1), LjNFR5-2 (CAE02598.1), MdLysM (AEN71536.1), MtLyk3 (AAQ73159.1), MtLyk5 (CAN88846.1), MtLysM (CAN88845.1), MtLysM-1 (CAO02950.1), MtNFP (ABF50224.1), MtNFR5 (AET03984.1)
研究的表达模式AhNFR1s而且AhNFR5s在rhizobial感染
为了研究这些基因在接种根瘤菌后Nod- E4和Nod+ E5中的时间基因表达模式,采用实时定量pcr (q-PCR)方法。6个基因在接种根瘤菌后Nod- E4和Nod+ E5的根中有不同的表达模式(图1)。3.).在六种假定的花生中AhNFR基因的表达水平有四种AhNFR1基因在根瘤菌接种Nod- E4后未被诱导,但在Nod+ E5中被诱导。这两个AhNFR1A1而且AhNFR1B1在Nod+ E5中均有诱导作用,但在接种后16 h (HAI)才对AhNFR1A1在16岁和24岁时AhNFR1B1(无花果。3.a和b)。然而,AhNFR1A2而且AhNFR1B2在所有检测时间点,包括感染早期和晚期,Nod+ E5均显著诱导。结果表明,在四AhNFR1的基因,AhNFR1A2而且AhNFR1B2与根瘤菌相比,可能在根瘤菌感染和根瘤器官发生中起主要作用AhNFR1A1而且AhNFR1B1,因为Nod- E4和Nod+ E5的表达水平差异更显著(图5)。3.的表达式AhNFR5A而且AhNFR5B在72和144 HAI时,这两个基因只在Nod- E4中被诱导,但在整个感染阶段,这两个基因都在Nod+ E5中被诱导。两者表达水平均显著升高AhNFR5结果表明,Nod+ E5基因与根瘤菌侵染和根瘤菌器官发生有关。3.e和f)。
此外,信用违约掉期AhNFR1A2,AhNFR1B2,AhNFR5A而且AhNFR5B的Nod- E4和Nod+ E5进行了检查(数据未显示)。序列比较表明,Nod- E4和Nod+ E5的4个基因均相同,且与花生基地中获得的DNA序列相同。结果表明四种都没有AhNFRNod- E4系基因发生突变。
因此,两个AhNFR1基因(AhNFR1A2而且AhNFR1B2)和两个AhNFR5基因(AhNFR5A而且AhNFR5B)选取这些基因,利用CRISPR/Cas9系统研究花生结节形成是否需要这些基因。
sgRNA: Cas9表达载体的靶位点选择与构建
两种名为NFR1AB1和NFR1AB2的单导rna (sgRNAs)被设计成针对这两种rnaAhNFR1A2而且AhNFR1B2基因,但在不同的位置。因此,将携带两种sgRNAs (NFR1AB1和NFR1AB2)的p201G/Cas9:NFR1AB1 + NFR1AB2载体插入到p201G/Cas9质粒中,靶向两种sgRNAsAhNFR1A2而且AhNFR1B2基因敲除(表2).为AhNFR5设计了3个sgRNAs基因(Table2).其中,一个sgRNA (NFR5B)被设计为靶点AhNFR5B基因和其他两个sgRNAs (NFR5AB1和NFR5AB2)都是针对这两种sgRNAs设计的AhNFR5A而且AhNFR5B基因在两个不同的位置。因此,p201G/Cas9:NFR5AB1 + NFR5AB2载体靶向两者AhNFR5A而且AhNFR5B基因和p201G/Cas9: NFR5B载体靶向AhNFR5B基因分别构建(表2额外的文件1:图S2)。
转基因毛状根的特征研究
AhNFR1基因
为了验证外源T-DNA插入转基因毛状根,仅对p201G/Cas9:NFR1AB1 + NFR1AB2载体转化的绿色荧光蛋白(GFP)阳性毛状根进行了测序验证。12个独立AhNFR1显示GFP阳性的转基因事件称为H1 ~ H12。目的:评价靶向DNA编辑的效果AhNFR1对覆盖两个靶位点(NFR1AB1和NFR1AB2)的基因组区和扩增子进行了评估,并从12根毛状根中进一步克隆和测序。
12份样本中有7份(H3、H4、H6、H8、H9、H11和H12)的扩增子只有一个PCR条带,大小与野生型(WT)相同(约600 bp)。其余5个样本(H1, H2, H5, H7, H10)有两个PCR条带,条带大小在300和600 bp左右(附文件)1:图S3)。根据我们最初的设计,预期的PCR主产物大小为569 bp,设计的裂解长度约为300 bp。因此,这一结果表明,精确的切割事件可能发生在我们设计的基因组区域AhNFR1基因。为了进一步验证PCR大小的变化是否来源于CRISPR/ cas9引起的基因组截断,我们随机从每个转基因PCR产物的每个条带中选取20个阳性克隆AhNFR1花生毛状根样品用于Sanger测序。
样本H1、H2、H5、H7和H10的测序结果表明,所有100个小序列(每个样本20个克隆)都是截断版本AhNFR1从NFR1AB1 DNA位点到NFR1AB2 DNA位点的基因组序列(图5)。4).裂解DNA长度多为−342和−341 bp(表3)3.).因此,CRISPR/Cas9基因组编辑系统成功地在花生基因组中选定的基因组区域上产生长DNA片段缺失。
PCR产物长569 bp的12个样本,随机选取240个阳性克隆(每个样本PCR产物20个克隆)进行Sanger测序分析。结果显示毛状根H11和H12的靶基因未发生修饰(数据未显示)。然而,在其他10个样本上观察到NFR1AB1目标基因组位点上的各种类型的核苷酸插入和删除突变,其中大多数是在NFR1AB2目标基因组位点上的- 1bp缺失(图1)。5)(额外的文件1:表S1)。除H9样本外,其余9个样本中,部分无性系的NFR1AB1和NFR1AB2基因组位点仍保持未编辑状态,与野生型DNA序列相同。结果表明,在基因组敲除转基因AhNFR1在每个转基因事件中都观察到镶嵌现象,这可能会影响后续的表型分析[33].转基因的表型AhNFR1接种根瘤菌后,除H4和H6外,基因组编辑正转化的毛状根均发生根瘤。因此,我们认为修改AhNFR1A2而且AhNFR1B2本研究中发现的基因不影响结节的形成。
AhNFR5基因
验证外源性T-DNA在AhNFR5p201G/Cas9:NFR5AB1 + NFR5AB2载体转化的转基因毛状根AhNFR5A而且AhNFR5B基因),筛选出10个GFP阳性的独立转基因事件,命名为F1到F10。以评估DNA编辑发生在靶向AhNFR5A而且AhNFR5B评估了这10个事件的基因组区域,覆盖两个靶位点(NFR5AB1和NFR5AB2)的扩增子,并进一步克隆和测序。
除样品F6外,9个转基因毛状根的PCR产物只有一个PCR带1:图S4)。我们还选择每个条带PCR产物的20个克隆进行测序。毛状根F6的PCR产物有两个条带,测序结果显示,不仅长序列(736 bp)缺失,靶点NFR5AB1位点也出现了1 bp的缺失(图5)。6)(额外的文件1:表S2)。在10个毛状根中,未检测到基因的改变AhNFR5样本F7和F10的基因序列。在其他8个样品中,在NFR5AB1或NFR5AB2靶位点上,样品F1、F3、F6和F9的所有克隆序列都被编辑,而在两个靶位点上的其他样品部分克隆未被编辑。8个转基因植株出现了镶嵌现象AhNFR5事件。
序列在AhNFR5毛状根导致样本F1、F3、F6和F9的Nod-表型(表5)4).测序和表型结果表明,当AhNFR5A而且AhNFR5B一个转基因的所有克隆的基因序列AhNFR5事件均被编辑,无法形成结节。因此,我们得出结论AhNFR5A而且AhNFR5B基因是花生小结形成的关键基因。
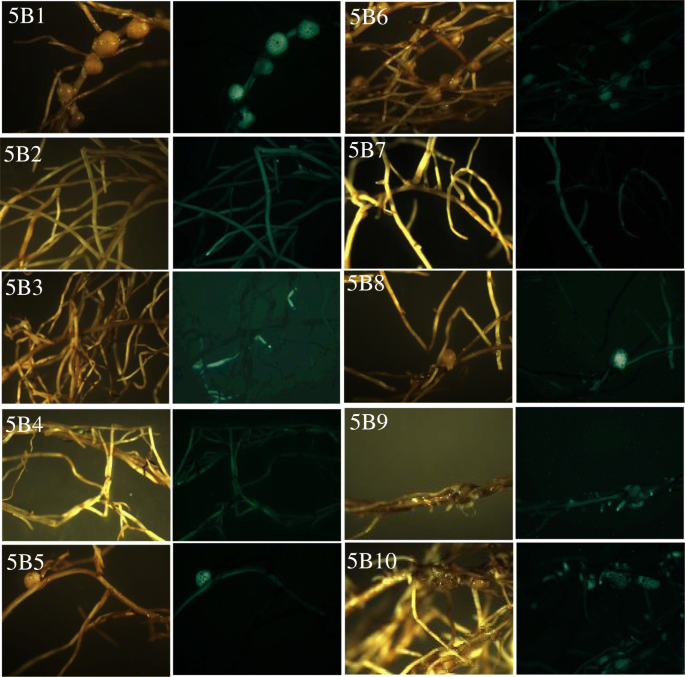
验证外源性T-DNA在AhNFR5B用p201G/Cas9:NFR5B载体转化的转基因毛状根(仅靶向AhNFR5B基因),从10个独立的转基因事件中提取dna。的PCR产物AhNFR5B在10个转基因毛状根中只有一个PCR条带1:图S5)。如表所示5的10个独立转基因事件AhNFR5B样品(5B1 ~ 5B10)分析。测序结果显示,10个发状根的A亚基因组未检测到修饰,说明与NFR5B-sgRNA不存在错配核苷酸。样品5B1、5B5、5B6、5B8和5B10未检测到序列编辑。然而,在其余5个样本5B2, 5B3, 5B4, 5B7和5B9中检测到各种类型的核苷酸插入和删除突变。转基因的表型结果AhNFR5B多毛的根(图。7)显示样品5B2、5B3、5B4、5B7和5B9没有结瘤,但其他未编辑的毛状根有结瘤。五种无根瘤毛状根中,AhNFR5B样本5B2, 5B3和5B9的所有克隆的基因序列都被编辑了,但是AhNFR5B样本5B4和5B7所有克隆的基因序列进行了部分编辑。结合AhNFR5用p201G/Cas9: NFR5AB1 + NFR5AB2载体进行转基因毛状根的转化,结果表明AhNFR5B一个转基因事件的所有克隆的基因序列都被编辑,可以导致非结节化表型。然而,如果AhNFR5B从一个转基因事件克隆的基因序列被部分编辑,表型仍然不确定。
讨论
CRISPR系统
花生是一种重要的经济作物。随着花生基因组研究和全基因组基因鉴定研究的进展,花生群落迫切需要一种高效、低成本的CRISPR/Cas9系统进行基因功能研究。为建立花生根系相关研究的CRISPR体系,在大豆中具有较高编辑效率的p201G/Cas9载体[34],入选本研究。为了检验对花生同种异体四倍体基因组进行有效CRISPR/Cas9基因组编辑的资格,两个sgRNAs (NFR1AB1和NFR1AB2)AhNFR1A2而且AhNFR1B2两个sgrna (NFR5AB1和NFR5AB2)用于AhNFR5A而且AhNFR5B在花生A亚基因组和B亚基因组的同源拷贝之间的相同基因组区域设计,研究了该基因组编辑系统在花生同种四倍体中的效率。两个目标基因的不同类型的编辑结果表明,p201G/Cas9 CRISPR载体具有很高的编辑效率,因为长时间的基因组片段删除需要较高的Cas9- sgrna复合物活性,以确保两个设计的切割位点被有效识别并同时切割[35,36].
单个特定的sgRNA (NFR5B)被设计用于AhNFR5B基因。测序结果显示AhNFR5B50%的gfp阳性转基因基因被编辑AhNFR5B多毛的根源。然而,AhNFR5A而且AhNFR5B80%的转基因基因被编辑AhNFR5两种sgRNAs (NFR5AB1和NFR5AB2)同时靶向毛状根AhNFR5A而且AhNFR5B基因。这一结果表明,一个sgRNA在CRISPR载体中的编辑效率低于两个sgRNA。换句话说,一个CRISPR载体中包含两个或多个sgRNAs可以提高基因编辑效率。
综上所述,本研究为利用CRISPR/Cas9系统对花生异体四倍体进行高效基因组编辑提供了一个成功的实例,可广泛应用于花生其他功能基因组学研究或作物改良中产生突变。
一个。rhizogenes介导的毛状根产生已成为花生基因功能研究和根生物学研究的有力工具[5,6,37].这是一种高效的由转基因根和野生型芽组成复合植株的技术。在本研究中,我们构建了毛状根的CRISPR/Cas9系统,以探讨毛状根结节形成过程中的基因功能。然而,毛状根转化系统在CRISPR/Cas9技术研究基因功能方面可能存在局限性。特别是在每个转基因事件中观察到镶嵌现象,这可能会影响后续的表型分析。马赛克突变是CRISPR/Cas9编辑系统的主要挑战[38].先前的研究[33]推断嵌合体可能在选择的后期被消除。但毛状根转化系统不能产生后代。由于可能存在的嵌合性,CRISPR-Cas9实验中的毛状根转化子会产生Nod-、Nod+或Nod−/Nod+扇区。因此,在目前的研究中,从敲除事件中观察到明确的Nod-表型(图。7)为我们在敲除实验中提供了一定的信心。利用稳定的胚胎发生转化系统可进一步完善该基因编辑系统。
的功能AhNFR结节形成过程中的基因
在模式豆科植物常见的共生信号通路中,第一步是LYK对NFs的识别。这种激酶有两种形式,NFR1(或LYK3)m . truncatula)和NFR5(或NFP inm . truncatula)[20.,24,39].在以往的研究中[27,发现花生NFR1具有不完整的LysM受体激酶结构域。此外,Nod- E4和Nod+ E5的转录组显示NFR1在任何基因型中都不是差异表达基因[26].在这项研究中,四个假定AhNFR1基因(AhNFR1A1,AhNFR1B1,AhNFR1A2而且AhNFR1B2)在花生基因组中被发现。DNA序列的高度同源性AhNFR1A1而且AhNFR1B1之间,AhNFR1A2而且AhNFR1B2表明这些基因可能有类似的功能。然而,序列长度AhNFR1A1比其他域要长,在花生基础中注释了两个额外的域(STKc_IRAK和PKc_like超族)。一个不同的AhNFR1A1在NCBI数据库中注释了基因结构(基因符号:LOC112702229),序列长度较短。为了使基因模型与豆科植物信息系统保持一致,我们在本研究中使用了花生基地的基因信息。
在被确认的四人中AhNFR1的基因,AhNFR1A2而且AhNFR1B2可能与根瘤菌侵染后Nod+ E5诱导而Nod- E4不诱导有关。然而,所有10个淘汰赛的AhNFR1A2而且AhNFR1B2除了两行外,基因产生结节,这表明AhNFR1A2而且AhNFR1B2可能不是形成结节的绝对必需基因。最有可能的是,其他NFR1辩喻补充了被试的功能NFR1拷贝花生结瘤。AhNFR1基因相对分化,拷贝较多。使用大豆NFR1作为一个基因序列查询,我们摧毁了花生基因组,并确定了四个副本,具有非常严格的同源性标准。然而,当我们放宽标准,更多NFR1类似基因可以在花生基因组中被识别出来。例如,当E值设置为e−10,35岁NFR1基因可以被识别。来确定的NFR1基因在花生小结形成中的作用是一项艰巨的任务。因此,在这项研究中我们选择AhNFR1A2而且AhNFR1B2基因敲除实验。需要进一步的研究来验证不同拷贝的功能NFR1花生结瘤基因。相比于CRISPR/Cas9, RNAi实验可能是一种更有效地下调毛状根中所有相似性的方法。
NFR5的LysM结构域至少部分决定了NF识别的特异性[26,40].据报道,NFR5与NFR1作为异质二聚体耦合在NF识别信号转导中[29].一个NFR5直接同源(AhNFP)被Ibanez等人在花生基因组中发现,具有完整的LysM受体激酶结构域。[27].在这项研究中,有两个AhNFR5基因被鉴定具有相同的细胞外结构域。两个人的DNA序列AhNFR5Nod- E4和Nod+ E5之间的结瘤表型相同,说明重组姐妹自交系之间的结瘤表型不同[26], E4和E5,不是由突变引起的AhNFR5基因。然而,由于AhNFR5基因在Nod- E4中被诱导,最有可能的是负责E4和E5之间不同结节表型的基因位于下游AhNFR5基因。Araip。NL2P7,一NFR5二倍体花生的同源体(落花生ipaensis),被鉴定为差异表达基因(DEG) [26],在Nod+基因型中表达上调,响应根瘤菌接种,表明其在结瘤过程中被诱导表达。在这里,两个AhNFR5与Nod-基因型(E4)相比,Nod+基因型(E5)的基因表达量较高AhNFR5A而且AhNFR5B在转基因毛状根中突变,未形成根瘤。因此,我们认为AhNFR5基因,要么AhNFR5A,或AhNFR5B,或者两者都是花生结节形成所必需的。既然证实了,那就只能用线条了AhNFR5B突变至少没有形成结节AhNFR5B是花生结节形成的必要条件。是否AhNFR5A对于结节形成需要进一步探索。同样,在大豆中,这两种突变体中的任何一种NFR5基因显示Nod-表型[22].
结论
以花生为研究对象,建立了与毛状根转化系统耦合的CRISPR/Cas9基因序列,研究了花生根瘤形成过程中的基因功能。编辑突变体的结瘤表型AhNFR1基因(AhNFR1A2而且AhNFR1B2本研究鉴定的突变体)在接种根瘤菌后仍能形成根瘤菌结节AhNFR5基因(AhNFR5A而且AhNFR5B在本研究中鉴定的)显示Nod表型。然而,对这两个基因检测到的镶嵌编辑模式可能会阻碍对它们功能的解释。这些结果表明,CRIPR/Cas9系统可用于花生异体四倍体毛状根的基因初步筛选。未来需要一个稳定的胚胎转化CRISPR系统来进一步确认基因的功能。
方法
植物材料
美国农业部-农业研究所(Tifton, GA)的郭宝珠博士提供的花生品种“Tifrunner”和一对花生姊妹重组自交系(RILs),一个非结瘤(Nod-)的‘e4’和一个结瘤(Nod+)的‘E5’[26,30.]被用于这项研究。本研究中使用的所有植物的生长条件是在佛罗里达大学的生长室中,16小时-日27°C/8小时-夜25°C循环生长。
为了进行基因表达分析,每个基因型的种子约200个在0.1%的HgCl中杀菌2然后用消毒过的ddH清洗三次2每次五分钟。种子萌发和花生根瘤菌接种采用Peng等人描述的方法。[26].简单地说,将灭菌后的种子在蒸馏水中浸泡2天,然后转移到萌发箱中。4天后,将发芽的种子转移到带发芽纸的保鲜袋中,其中包含40ml不含N. A的25%霍格兰溶液Bradyrhizobium spp.从结瘤效率高的花生结节中分离出一株名为Lb8的菌株[41]用于接种制备。一毫升Lb8 (A600= 0.05 ~ 0.1),根长6 ~ 7cm时施悬浮液。对于每个基因型,总共有100株植物接种Lb8。在接种(HAI)后0、2、4、6、8、16、24、48、72、96和144 h,从处理过的植株上剪下主根中间2 ~ 3 cm,立即放入液氮中进行RNA提取。发芽后6天,花生主根中间2-3厘米处是根瘤菌感染活跃的部位,侧根即将在此出现[16,17].
识别和表征AhNFR基因
识别的基因组DNA序列AhNFR1而且AhNFR5在花生基因组中,BLAST搜索使用的CDSGmNFR1(DQ219806)和GmNFR5(NM_001354196)基因作为对PeanutBase (https://peanutbase.org/)在E-value = 0。通过SWISS-MODEL同源建模程序对AhNFR蛋白进行区域搜索[42].系统发育分析使用MEGA 5软件[43].基于BLAST基因模型的CDS,我们设计了引物(附加文件1表S3),从Nod- E4和Nod+ E5两个基因型中扩增得到其cDNA序列。
在上述接种后的每个时间点,分别从E4和E5的三个生物重复中制备RNA样本。根据制造商的协议(Zymo Research, USA),使用Direct-zol RNA Miniprep Kit分离总RNA。第一链cDNA合成使用高容量RNA-to-cDNA Kit (Applied Biosystems, USA)进行。由于同源拷贝的DNA序列高度相似,我们从同源拷贝之间的发散序列区域精心设计q-PCR引物,以扩增同源基因特异性拷贝。引物(附加文件1:表S4)通过对一系列稀释的cDNA样本(E4在0 HAI处)进行q-PCR估计扩增效率(E)。将模板起始量与各稀释剂放大过程中得到的Ct值的对数绘制成标准曲线。E值由标准曲线的斜率计算,公式如下:E = 101 /坡.q-PCR只使用E值在90-105%范围内的引物。q-PCR使用Power SYBR Green PCR Master Mix试剂盒(Applied Biosystems, USA)和CFX96 Real-Time PCR检测系统(Bio-Rad, USA)对每个样本进行3个生物重复和3个技术重复。将不同处理的结果标准化AhUbiquitin2 (44],是花生q-PCR的内部对照。相对基因表达用2−ΔΔCt方法(45].熔化曲线记录在循环40后,加热从55°C到95°C。采用单因素方差分析(ANOVA)对不同时间点间或两个品种间的基因表达量进行统计分析。小于0.05的概率值被认为是显著的,在图中用星号或字母表示这种显著性。3..
sgRNA: Cas9表达载体的设计与构建
p201G/Cas9质粒(#59178)和ppu - grna穿梭质粒(#47024)从Addgene (http://www.addgene.org/).ppac - grna中的sgRNA盒通过MtU6启动子进行诱导。p201G/Cas9中的Cas9和GFP分别由增强花菜花叶病毒(CaMV) 35S启动子驱动。用绿色荧光蛋白作为可见标记快速筛选转基因事件。
构建载体中的sgRNAs使用基于web的工具CRISPR-P (http://cbi.hzau.edu.cn/crispr/)[46],它突出显示了所有潜在的CRISPR sgRNA序列(19 bp或20 bp),紧接着是5 ' -NGG (PAM)在AhNFRcd。对于我们选择的每个目标位点,DNA寡核苷酸从Invitrogen公司(Carlsbad, USA)合成。通过重叠PCR将DNA寡核苷酸插入mtU6启动子和sgRNA支架之间。将重叠PCR产物连接到p201G/Cas9质粒载体上,用酶切酶切ApaI而且SpeI[34].构建物(p201G/Cas9: sgRNAs)首次转化为大肠杆菌全球.PCR(附加文件1:表S5)用质粒试剂盒(NEB, England)纯化构建物的阳性克隆。在克隆位点对构建物进行Sanger测序后,选择成功构建的质粒并用于转化农杆菌属rhizogenes应变K599。
花生毛根转化
毛状根变换系统的使用答:rhizogenes菌株K599之前有过描述[47].简单地说,在本研究中,携带CRISPR/Cas9质粒的K599在添加50 μg/ml卡那霉素(Sigma, USA)的酵母甘露醇平板上生长2天。在萌发后7天的花生幼苗(DAG)的下胚轴处注射K599。每一个GFP阳性的毛状根都是一个独立的转基因事件,因为注射k599诱导毛状根后,每一个毛状根都是独立发育的。注射后,将花生幼苗转移到装满蛭石的花盆中,在生长室中生长(16小时-日27°C/8小时-夜25°C循环)。
GFP检测,基因组DNA提取和突变分析
转化4周后,将转化的花生植株挖出来,在立体显微镜下观察(Olympus, Japan)。将GFP阳性毛状根的植物幼苗移栽到蛭石中进行恢复,然后接种根瘤菌菌株Lb8 [26].接种根瘤菌1个月后,观察到结瘤表型。如前所述,采用CTAB法提取GFP阳性毛状根的DNA [48].对GFP阳性毛状根的靶基因区进行扩增1:图S2和表S6),克隆到pClone007简单载体(青岛,南京,中国)。每个靶区扩增子选择20个阳性克隆进行Sanger测序。使用DNAman软件(Lynnon Biosoft, USA)对序列进行分析和比对。
数据和材料的可用性
本研究中生成或分析的数据包含在本文和补充信息文件中。本研究产生的测序数据存入NCBI SRA数据库(BioProject: PRJNA655791, SRA登录号:SRR12405032-SRR12405036)。其他资料如有合理要求,请联系通讯作者wangjp@ufl.edu.
缩写
- cd:
-
编码DNA序列
- 绿色荧光蛋白:
-
绿色荧光蛋白
- CRISPR / Cas9:
-
聚簇规则间隔短回文重复序列/ crispr相关蛋白9
- 海:
-
小时后接种
- 像是:
-
LysM受体激酶
- LysM:
-
细胞溶解酶的主题
- 尼克-弗瑞:
-
点头的因素
- NFP:
-
NF知觉
- 非功能性需求:
-
NF受体
- q-PCR:
-
定量真正time-PCR
- RNAi:
-
RNA干扰
- sgRNAs:
-
单导rna
参考文献
Bertioli DJ, Cannon SB, Froenicke L,等。的基因组序列落花生duranensis而且落花生ipaensis即栽培花生的二倍体祖先。Nat麝猫。2016;48(4):438 - 46。
Bertioli DJ, Jenkins J, Clevenger J,等。花生片段异体四倍体基因组序列落花生hypogaea.Nat麝猫。2019;51:877 - 84。
庄伟,陈浩,杨敏,等。栽培花生的基因组为研究豆科植物核型、多倍体进化和作物驯化提供了依据。Nat麝猫。2019;51:865 - 76。
唐刚,徐鹏,马伟,王芳,刘铮,万胜,单磊AtLEC1花生种子含油量增加及脂肪酸组成改变(落花生hypogaeal .)。植物科学,2018;9:26。https://doi.org/10.3389/fpls.2018.00260.
Das DR, Horvath B, Kundu A, Kalo P, DasGupta M.裂缝入口豆科植物CYCLOPS的功能保护落花生hypogaea.植物科学。2019;281:232-41。
茶室DasGupta。沉默假定的细胞分裂素受体组氨酸激酶1抑制根结节的起始和分化落花生hypogaea.植物学报。2018;31(2):187-99。
尹凯,高超,邱建林。植物基因组编辑研究进展与展望。Nat植物。2017;3:17107。
陈凯,王颖,张锐,张宏,高晨。CRISPR/Cas基因组编辑与农业植物精准育种。植物生物学2019;70:667-97。
Jaganathan D, Ramasamy K, Sellamuthu G, Jayabalan S, Venkataraman G.作物改良的CRISPR:更新综述。植物科学进展2018;https://doi.org/10.3389/fpls.2018.00985.
Munoz V, Ibanez F, Tordable M, Megias M, Fabra a .活性氧产生和nod因子在裂口侵入感染豆科植物花生与慢生根瘤菌早期共生作用中的作用。应用微生物学杂志,2015;118(1):182-92。
王晓燕,王晓燕。植物-细菌固氮共生的起点:根系的细胞间侵入。科学通报2017;68(8):1905-18。
奥尔德罗伊德GE,默里JD,普尔PS,唐尼JA。豆科植物-根瘤菌共生的参与规律。2011; 45:19 19 - 44。
王杰,苏安生,陈晓燕。豆科植物-根瘤菌共生的分子和细胞机制。前沿植物学报2018;9:1839 doi: 10.3389/fpls.2018.01839。
Sharma V, Bhattacharyya S, Kumar R, Kumar A, Ibanez F, Wang J, Guo B, Sudini HK, Gopalakrishnan S, DasGupta M, Varshney RK, Pandey MK.根瘤共生的分子基础Bradyrhizobium而“可进入”的豆科花生(落花生hypogaeal .)。植物。2020;9(2):276。
Karmakar K, Kundu A, Rizvi AZ, Dubois E, Severac D, Czernic P, Cartieaux F, Dasgupta M.“裂缝进入”豆科植物共生过程中的转录组学分析落花生hypogaea突出了它与“感染线”适应豆科植物的对比。植物学报2019;32(3):271-85。
Boogerd FC, Rossum DV。花生瘤Bradyrhizobium:裂纹进入的简单感染过程。FEMS微生物学,1997;21:5-27。
马库杰,王磊,刘芳,刘丽,Kelley K,彭卓,王杰。栽培花生根毛对根瘤菌侵染的影响(落花生hypogaeal .)。植物学报2018;9(8):1646-59。
Tsikou D, Ramirez EE, Psarrakou IS, Wong JE, Jensen DB, Isono E, Radutoiu S, Papadopoulou KK。一个Lotus对虾E3连接酶与结瘤因子受体5相互作用,正向调节结瘤。BMC Plant Biol. 2018;18:217。
Madsen EB, Madsen LH, Radutoiu S, Olbryt M, Rakwalska M, Szczyglowski K, Sato S, Kaneko T, Tabata S, Sandal N, Stougaard J. LysM型受体激酶基因参与豆科植物对根瘤菌信号的感知。大自然。2003;425:637-40。
Radutoiu S, Madsen LH, Madsen EB, Felle HH, Umehara Y, Gronlund M, Sato S, Nakamura Y, Tabata S, Sandal N, Stougaard J.共生菌的植物识别需要两个LysM受体样的酶。大自然。2003;425:585 - 92。
Indrasumunar, Gresshoff总理。重复节点因子受体5 (NFR5)基因在大豆中发生了突变。植物信号与行为学报2010;5(5):535 - 36。
Indrasumunar A, Kereszt A, Searle I, Miyagi M, Li D, Nguyen CDT, Men A, Carroll BJ, Gresshoff PM。(2010).异源四倍体大豆(Glycine max L. Merr.)隐性失活非结瘤突变体中重复结瘤因子受体5 (NFR5)基因的失活植物细胞学报,2010;51(2):201-14。
Indrasumunar A, Searle I, Lin MH, Kereszt A, Men A, Carroll BJ, Gresshoff PM。结瘤因子受体激酶1a控制大豆结瘤器官数量大豆l .稳定)。植物j . 2011; 65:39-50。
Limpens E, Franken C, Smit P, Willemse J, Bisseling T, Geurts R.调节根瘤菌nod因子诱导感染的LysM结构域受体激酶。科学。2003;302:630-3。
Oldroyd霍利尔。说,朋友,然后进入:促进植物中有益共生联系的信号系统。微生物学报。2013;11:252-63。
彭志,刘芳,王玲,周浩,Paudel D, Tan L, Maku J, Gallo M, Wang J。花生基因调控的转录组谱分析(落花生hypogaeal .)有节。Sci . 2017;7:40066 doi: 10.1038/srep40066。
Ibanez F, Angelini J, Figueredo MS, Munoz V, Tonelli ML, Fabra a落花生hypogaea(花生)点头因子感知蛋白。植物学报2015;128:709-18。
Lee WK, Jeong N, Indrasumunar A, Gresshoff PM, Jeong SC. Glycine max非结瘤位点rj:一个包含赖氨酸基序受体样激酶中一个SNP的重组原区(GmNFR1a).应用理论,2011;122:875-84。
Madsen EB, Antolin-Llovera M, Grossmann C, Ye J, Vieweg S, Broghammer A, Krusell L, Radutoiu S, Jensen ON, Stougaard J, Parniske MLotus对虾Nod因子受体1和受体介导的信号传导与Nod因子受体5的合作。植物j . 2011; 65:404-17。
彭志,谭亮,Lopez Y, Maku J,刘峰,周辉,曾永春,杨旭,谢永峰,宋杰,王磊,Tillman BL, Gallo M,王杰。花生非结瘤重组自交系的形态和遗传特性。作物科学。2018;58:540-50。
Geurts R, Fedorova E, Bisseling T. Nod因子信号基因在根瘤菌侵染早期的作用植物生物学杂志2005;8:346-52。
Nod因子感知蛋白在生物相互作用中起着重要作用。植物学报,2013;18(10):566-74。
李超,李文涛,张斌。棉花高效CRISPR/Cas9定向诱变系统(陆地棉l .)。Sci众议员2017;7:43902。
雅各布斯TB,拉斐特公关,施密茨RJ,帕罗特WA。利用CRISPR/Cas9基因对大豆基因组进行靶向修饰。生物科技BMC》。2015;3。
周宏,刘斌,Weeks DP, Spalding MH,杨斌。CRISPR/Cas9诱导水稻大染色体缺失和可遗传小基因改变。核酸学报,2014;42(17):10903-14。
Lowder LG, Zhang D, Baltes NJ, Paul JW, Tang X,郑X, Voytas DF, Hsieh TF, Zhang Y,祁勇。植物基因组编辑和转录调控的CRISPR/ cas9工具箱。植物杂志。2015;169:971 - 85。
Sinharoy S, Saha S, Chaudhury SR, DasGupta M.转化毛根落花生hypogea:一种研究Aeschynomeneae族非感染螺纹豆科植物根结节共生的工具。植物与微生物的相互作用。2009;22:132-42。
梅赫拉瓦,谢拉兹,纳扎里,巴南。CRISPR/ cas9介导的基因组编辑中的嵌合性。Dev杂志。2019;445(2):156 - 62。
Smit P, Limpens E, Geurts R, Fedorova E, Dolgikh E, Gough C, Bisseling T. Medicago LYK3,根瘤菌结瘤因子信号通路的入口受体。植物杂志。2007;145:183 - 91。
Radutoiu S, Madsen LH, Madsen EB, Jurkiewicz A, Fukai E, Quistgaard EMH, Albrektsen AS, James EK, Thirup S, Stougaard J. LysM结构域介导脂质寡糖的识别非功能性需求基因扩展了共生宿主的范围。EMBO j . 2007; 26:3923-35。
pauldel D,刘芳,王丽,Crook M, Maya S, Peng Z, Kelley K, Ane JM, Wang jBradyrhizobium从花生根瘤中分离的菌株Lb8利用裂隙侵入感染。Microbiol前面。2020;11:93。
李晓燕,李晓燕,李晓燕。基于网络的蛋白质结构同源性建模环境。生物信息学。2006;22(2):195 - 201。
Tamura K, Peterson D, Peterson N, Stecher G, Nei M, Kumar S. MEGA5:利用最大似然、进化距离和最大简约方法进行分子进化遗传学分析。中华生物学报2011;28:2731-9。
罗敏,党鹏,鲍usher MG, Holbrook CC, Lee RD, Lynch RE,郭伯仲。叶斑病抗性应答相关转录本的鉴定Cercosporidium personatum花生(落花生hypogaea).植物病理学。2005;95:381-7。
Livak KJ, Schmittgen TD。相关基因表达数据的实时定量PCR分析和2——ΔΔCT方法。方法。2001;25:402-8。
刘红,丁颖,周颖,金伟,谢坤,陈磊。植物基因组编辑的CRISPR- p 2.0:一种改进的CRISPR/Cas9工具。摩尔。2017;10(3):530 - 2。
Kereszt A, Li D, Indrasumunar A, Nguyen CD, Nontachasiyapoom S, Kinkema M, Gresshoff PM。根际农杆菌介导的大豆根生物学研究。Nat Protoc。2007;2:948-52。
罗杰斯SO,本迪奇AJ。正确的做法:Gelvin SB,编辑。植物组织DNA的提取:植物分子生物学手册,施普林格;1989.p . 73 - 83。
确认
我们感谢位于蒂夫顿的USDA-ARS的郭宝珠博士为实验提供种子。
资金
这项研究由佛罗里达花生生产者协会、佛罗里达大学IFAS早期职业科学家奖和美国农业部国家食品和农业研究所孵化项目1011664资助。资助机构没有参与研究的设计和收集、数据的分析和解释,也没有参与撰写手稿。
作者信息
从属关系
贡献
JW构思了这项研究。实验由JW和HS设计。HS、ZL和ZP进行了实验。HS对数据进行了分析,并撰写了初稿。JW、ZL、ZP对原稿进行了修改。所有作者阅读并批准了最终稿件。
相应的作者
道德声明
伦理批准和同意参与
不适用。
同意出版
不适用。
相互竞争的利益
作者声明他们没有竞争利益。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构附属的管辖权要求保持中立。
补充信息
附加文件1图S1
.DNA序列同源性AhNFR基因在花生。无花果S2。.基因序列、靶位点和检测产物区域示意图AhNFR转基因毛状根中的基因。(一)AhNFR1A2而且AhNFR1B2基因,(B)AhNFR5A而且AhNFR5B基因。NFR1AB1、NFR1AB2、NFR5AB1、NFR5AB2和NFR5B是gRNAs。AhNFR1-EX-h、AhNFR5-EX-h、AhNFR5B-EX-h代表覆盖靶位点的扩增子,用于检测编辑后的基因序列。图S3。聚合酶链反应的产物AhNFR1转基因毛状根中的基因。M: 1 kb +标记;H1-H12:转基因AhNFR1样品;P1-P3:毛状根,P201G空向量;WT: Tifrunner花生;−:消极的控制。图S4。聚合酶链反应的产物AhNFR5转基因毛状根中的基因。M: DL2000标记;F1-F10:转基因AhNFR5样品;P1-P3:毛状根,P201G空向量;WT: Tifrunner花生;−:消极的控制。图S5。聚合酶链反应的产物AhNFR5B转基因毛状根中的基因。M: 1 kb +标记;5 b1-5b10:转基因AhNFR5B样品;P1-P3:毛状根,P201G空向量;WT: Tifrunner花生;−:消极的控制。表S1。不同CRISPR/ cas9引起的突变的百分比AhNFR1A2和AhNFR1B2转基因的DNA序列位点AhNFR1多毛的根源。表S2。不同CRISPR/ cas9引起的突变的百分比AhNFR5A和AhNFR5B转基因的DNA序列位点AhNFR5多毛的根源。表S3。的引物AhNFR基因。表S4。q-PCR引物AhNFR基因。表S5。构建和检测CRISPR/Cas9的引物:AhNFR向量。表S6。扩增转基因目标基因的引物AhNFR多毛的根源。
额外的文件2。
原始凝胶图像见图S3、图S4和图S5。
权利和权限
开放获取本文遵循创作共用署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),该协议允许在任何媒体或格式中使用、分享、改编、分发和复制,只要您给予原作者和来源适当的署名,提供创作共用许可协议的链接,并说明是否有更改。本文中的图片或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果材料不包含在文章的创作共用许可中,并且您的预期用途不被法律法规允许或超出了允许的用途,您将需要直接从版权所有者那里获得许可。欲查看此许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献放弃书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信用额度中另有说明。
关于这篇文章
引用这篇文章
舒、H、罗、Z、彭、Z。et al。应用CRISPR/Cas9技术探讨毛状根的功能AhNFR1而且AhNFR5花生结瘤的基因。BMC植物杂志20.417(2020)。https://doi.org/10.1186/s12870-020-02614-x
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12870-020-02614-x
关键字
- CRISPR / Cas9
- 突变体
- 点头因子受体(非功能性需求)基因
- 有节
- 花生
- 共生