抽象的
背景
通过影响基因表达和染色质结构,组蛋白改性基因(HMS)在植物生长和发育中发挥潜在作用。但是,有限的信息有关于葡萄中的HMS基因(葡萄l .)。
结果
在这里,我们描述了葡萄树中HMS基因家族的详细基因组鉴定。我们在葡萄中鉴定了117个HMS基因,并将这些基因分类为11个基于与拟南芥和系统发育关系的11个亚壳。我们在染色体位置和外显子分布方面描述了基因。此外,我们调查了葡萄和拟南芥之间的进化历史,基因本体(GO)分析和同期关系。根据结果,21%的HMS基因是重复(串联和分段)事件的结果,所有重复的基因都具有负选择模式。GO分析预测细胞质,细胞核和细胞内细胞细胞中HMS蛋白的存在。根据种子发育表达分析,许多HMS葡萄葡萄葡萄葡萄种类在种子和无籽品种中差异表达,表明其在种子发育中的作用。此外,我们检查了HMS基因对不同时间点的粉末状霉菌感染的响应。结果表明,一些基因在抗病调控机制中的参与。此外,在不同时间点的不同植物激素(脱离酸,茉莉酸,水杨酸和乙烯)上分析HMS基因的表达谱。 All of the genes showed differential expression against one or more hormones.
结论
VvHMs基因可能在葡萄树中具有潜在的作用,包括种子发育,抗病性和激素信号通路。我们的研究提供了葡萄树中的首先详细的基因组鉴定和HMS基因的表达分析。
背景
有几种后术后修饰系统和过程,包括甲基化,乙酰化,磷酸化,泛素化和稳定性,其可以影响基因表达[1].组蛋白修饰和DNA甲基化是非常重要的,因为它们通过改变DNA可用性和染色质结构来调节基因表达模式。这些机制是植物生命周期中正常发育和抗病所必需的[2].乙酰化,脱乙酰化,甲基化和去甲基化是常见的组蛋白修饰(HMS)方法。这些HMS过程主要由四种不同的组蛋白修饰基因家族控制,其包括组蛋白甲基转移酶(HMT),组蛋白甲基酶(HDMS),组蛋白乙酰酶(帽)和组蛋白脱乙酰酶(HDACs)[3.,4].
这些HMS基因家族HMTS,HDMS,帽子和HDAC分别含有2,2,4和3个亚壳。因此,每个亚家族具有特定的结构域或结构,从而在植物生长和发育中起着不同的作用。设定结构域组(SDG)和蛋白质精氨酸甲基转移酶(PRMT)是丙的亚壳,分别含有设定结构域和PRMA结构域。HDM具有HDMA(SWIRN和C末端结构域)和JMJ(含JMJC域的蛋白质)亚家族。在拟南芥, SDG蛋白根据序列与集合域的相似性分为7类。这些分类是I), zesta增强子,II) ASH1同源物,III) Trx同源物及相关蛋白,IV)具有SET和PHD结构域的蛋白,V), Su (var)同源物,VI)具有中断SET结构域的蛋白(S-ET),以及VII)核酮糖- 1,5 -二磷酸羧化酶/加氧酶(Rubisco)甲基转移酶(RBCMT)。每个类的成员都有特定的结构和函数[5,6,7].根据序列表征和硅的数据分析,帽子分为四个亚属:(1)HAC具有P300 / CREB(CAMP响应元素结合蛋白) - 耦合蛋白(CBP)家族),(2)HAG含有一般控制不可抑制的5相关N-末端乙酰转移酶(GNAT)家族,(3)HAF含有塔塔结合蛋白相关因子(TAF2(4) HAM型有MOZ、Ybf2/Sas3、Sas2和Tip60 (MYST)家族。此外,hdac还分为HDA (RPD3 (Reduced钾依赖)/HDA1、SRT (Silent information regulator 2, SIR2)和HDT (HD2)家族[8,9].
甲基化是一种重要的基因调控机制,可以影响不同的过程并具有植物生长和发育的潜在作用。组蛋白赖氨酸甲基化修饰主要由不同的组蛋白甲基转移酶(HMT)组催化。主要是,SDG基因在组蛋白赖氨酸甲基化修饰中起作用。卷发叶(CLF)和MEDEA(MEA)是SDG的第一个认可成员[10,11].HMTS在植物生命周期中发挥多种作用,如细胞周期调节,花器官发展,开花过渡,转录激活和沉默,休眠调节,真菌病原体抗性,以及对不同(生物和非生物)应激期间的对激素信号传导途径基因的影响和对激素信号通路基因的影响12,13].例如,AtASHH2甲基化的H3K4被认为是基因表达的正调控因子。一些SDG基因在异染色质形成和基因沉默中发挥潜在作用[14].ATSDG5据报道,它与胚胎流产和胚乳发育有关。AtSDG2影响配子体和孢子体发育[11].PRMT蛋白在植物中在植物中发挥不同的作用,例如ATPRMT4A和4B在拟南芥中共同影响开花时间。在拟南芥中,PRMT5中的突变导致深绿色,卷曲叶子具有发育不良的生长[15].
hat和HDACs在植物生长和不同胁迫应答的基因表达调控中发挥着重要作用。例如,AtHAM1和AtHAM2在男性和女性配子形成中具有作用[16].沉默的AtHD2A表达导致种子发育失败[17].此外,AtHDA7和AtHD2B在胚胎发育和种子休眠中具有作用[18,19].过度的OsglHAT1通过增加细胞数量和灌浆速率来增加粒重和植株生物量[20.].的功能分析AtHDA15和AtHDA19表明它们参与了光形态建成[21,22].在其他的研究中,AtHDA19参与了叶和根的发育。这些结果表明,HDA基因在植物中起着不同的作用。AtHDA5和AtHDA9可以调节花期。此外,一些基因如OSHAC701.,OsHAG703,AtHD2C,OsHDT701已经报道了温度、盐和脱落酸(ABA)胁迫反应[23,24,25,26].AtHDA19通过影响JA,SA和乙烯信号通路基因的表达,参与植物防御真菌和细菌疾病。最后,帽子和HDACS通过与转录因子和各种染色质改造因子相互作用来发挥潜在作用的转录调节方法[3.].
在许多植物物种中鉴定了不同的HMS基因家族,包括答:芥,栽培稻,茄属植物lycopersicum,Malus Domestica.,素类,草莓属vesca,玉米,芸苔属植物拉伯.然而,所有四个HMS基因家族都仅描述在其中A. Thilana,S.Lycopersicum,M.Moversa,c . sinensis[18,27,28,29,30.,31,32].此外,大多数功能研究仅在模型植物中进行。拟南芥和米饭。有关HMS基因数量和葡萄树中的功能的信息很少。HMS基因在不同植物中的潜在作用在不同植物的不同阶段的生长和涉及防御机制中,证明了葡萄树中综合生物信息学的需求和HMS基因的表达分析。据我们所知,这是葡萄葡萄酒中所有四个HMS基因家族的第一次全面的生物信息分析。在这项研究中,我们在葡萄树中进行了HMS基因的鉴定,然后基于用拟南芥的系统发育分析分成不同的家族。此外,对其外显子内,进化,同时性和基因本体论(GO)分析进行。我们还分析了HMS基因对粉末状霉菌感染和不同激素治疗的响应,以及种子和无籽品种种子发育的不同阶段的表达分析。该研究将增加关于葡萄HMS基因的谅解,并为基因的功能表征提供帮助。
方法
葡萄树中HMS基因的鉴定
为了获得完整的葡萄中HMs基因列表,我们从pam数据库(http://pfam.xfam.org/search#tabview=tab1)[30.].这些HMM配置文件用于查询三个公共数据库:葡萄基因组数据库(http://www.genoscope.cns.fr)、国家生物技术信息中心(http://www.ncbi.nlm.nih.gov/),以及Grapevine Genome CRIBI生物科技网站(http://genomes.cribi.unipd.it/)通过HMMER软件查找葡萄中的HMS蛋白的完整列表[33].此外,由于HDT族在pam数据库中没有HMM剖面,所以我们使用Basic Local Alignment Search Tool (BLAST)进行HDT族的识别[30.].在此之前,我们将被注释为HDT的拟南芥和苹果蛋白作为BlastP的查询。最初鉴定了148个HMs基因。所有非冗余假定的HMs基因用SMART (http://smart.embl-heidelberg.de.),剔除结构域不完整或DUF(未知功能域)的基因。这样,答案是117VvHMs选择基因进行最终考虑。
HMs基因的系统发育及外显子-内含子分布分析
利用拟南芥和葡萄的HMs蛋白序列进行系统发育分析。使用MEGA 6.0软件构建系统发育树,参数为:序列比对采用“W”法,邻接法(NJ), p-distance,完全删除,1000 bootstrap值[34].为不同的亚属生成不同的系统发育树。系统发育树的生成VvHMS相同的基因组,我们遵循之前的趋势。系统发育树仅在三个研究较好的亚科成员之间构建。从葡萄基因组数据库下载葡萄的全基因组序列和编码序列(http://www.genoscope.cns.fr)及在线基因结构显示服务器2.071 (http://gsds.cbi.pku.edu.cn/index.php)用于外显子-内含子分析。
葡萄与拟南芥基因的Synteny分析
同一染色体上200 kb以内的两个或两个以上的基因被指定为连续重复[35].从植物基因组复制数据库(http://chibba.agtec.uga.edu/duplication/)[36].Circos 0.63版本(http://circos.ca/)的默认参数用于生成图表。
估计重复基因的KA / KS比率和分析
网上软件(http://services.cbu.uib.no/tools/kaks),计算重复基因的非同义替代率(Ka)和同义替代率(Ks)。Ka/Ks比值用于选择压力的估计。Ka/Ks值表示三种不同的选择压力情况,即中性(等于1)、正性(大于1)和负性(小于1)[37].GO富集分析使用缺省参数MetGenMAP进行[38].
植物材料
本研究选用了5个葡萄品种,包括2个有籽品种(‘大穗’和‘麝香大穗’)、2个无籽品种(‘火焰无籽’和‘深红色无籽’)和1个抗白粉病的中国野生品种‘上24’(诉quinquangularis).所有品种均在保定河北农业大学(北纬38°51′,东经115°29′)葡萄园内自然环境条件下进行保存。年平均气温13.4℃(冬季- 4.3℃以下,夏季26.4℃以上),年平均日照时数2511小时,年平均降水量498.9 mm。以‘商-24’的幼叶为接种源erysiphe necator.(Schw.),在接种后12、24和48 h收获。对照叶片接种无菌水。在激素溶液的制备中,先将ABA、茉莉酸甲酯(MeJA)、水杨酸(SA)溶于95%乙醇,然后用水稀释,乙烯直接溶于水。激素处理分别为叶面喷施300 μM ABA、0.5 g/L乙烯、50 μM MeJA或100 μM SA,处理后1、6和12 h采集样品。对照叶喷洒无菌水。此外,在开花后20、30、40和50天分别从无核和有籽品种中分离种子进行种子发育研究。所有叶片和种子样品立即被液氮冷冻,并保存在−80°C以备将来使用。本工作中使用和收集的所有植物材料均符合中国的指导方针和法规。
转录组分析VvHMs种子发育过程中的基因和无籽葡萄产后
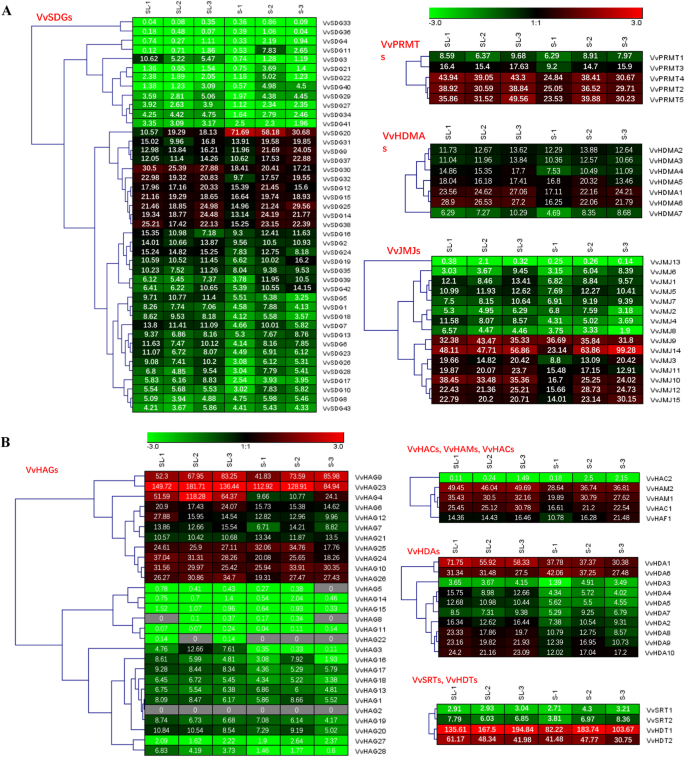
表达概况VvHMs使用我们之前发表的转录组数据(BioProject Accession, PRJNA338255)分析了种子发育过程中来自有籽和无籽后代的基因[39].采用有种子母本“红地球”和无核父本“百年无核”的杂交后代群体。共获得65个子代,其中无核子代31个,有籽子代34个。从群体中随机选择9个无核子代和9个有种子子代进行rna测序。每千碱基外显子模型的读数每百万映射读数(RPKM)VvHMs用Mev 4.8.1转换成热图[40].根据所有分析样本中基因的RPKM均值,对每个VvHM基因的RPKM值进行归一化。对处理后的数据进行log2变换,生成Mev 4.8.1的热图。红色和绿色分别表示高、低表达水平。
定量RT-PCR检测RNA提取及表达分析
根据制造商的指导,通过使用EZNA植物RNA试剂盒(R6827-01,Omega Biotek,Norcross,Ga,USA)从样品中提取总RNA。纳米滴分光光度计(Thermo Fisher Scientific,Yokohama,Japan)用于测量RNA的OD值,对每个RNA样品进行琼脂糖凝胶电泳,以检查其质量。Prime Script RTASE(Trans Gen Biotech,北京,中国)用于去除GDNA,然后进行逆转录。通过GDNA橡皮擦除去基因组DNA(含有DNase)。还进行了QPCR反应粗RNA,以进入GDNA污染程度。在将该cDNA稀释后用蒸馏水稀释,终浓度为100ng /μl。葡萄肌动蛋白GenBank登录号为NC_012010EF1 -α基因(GenBank登录号NC_012012)作为内参基因。所有引物都是使用Primer 5软件设计的,可以在附加文件中找到1:表S1。使用三种生物重复和三种技术复制。对于每次反应,使用100ng cDNA并一式一式三份进行,反应体积为20μL的0.8μL的0.8μL的每次底漆(1.0μm),1.0μlcDNA,10μl2x快速超级Evagreen®QPCRMasterMix(美国光大Inc.,苏州,中国)和7.4μl无菌蒸馏水。扩增参数为30℃,30秒为95℃,为40℃,5s和60℃,30秒。在95℃下初始孵育15s,然后恒定增加熔融曲线分析,然后从60至95℃升高。使用IQ5软件和Genorm软件分析相对表达水平。
统计分析
使用SPSS统计信息22.0软件进行分析数据。使用HOC分析的TUKEK分析的ANOVA来检查数据的总体意义。Sigma Plot 12用于绘制图形。
结果
HMs基因的全基因组鉴定与注释
葡萄基因组中共有117个HMs基因,其中48个hmt, 22个HMs, 33个HATs, 14个hdac基因。根据以往的研究[30.,31,32],所有基因按保守域划分为11个亚家族。hmt有43个SDG基因和5个PRMT基因;HDMs包含15个JMJ基因和7个HDMA基因;hat有28个HAG, 2个HAM, 2个HAC和1个HAF基因;hdac分别有10、2、2个HDA、SRT和HDT基因。这些基因是根据它们的家族及其在染色体上的位置命名的。SDG亚家族、PRMT亚家族、JMJ亚家族、HDMA亚家族、HAG亚家族和HDA亚家族的预测蛋白长度分别为184 ~ 2199、337 ~ 651、131 ~ 1905、492 ~ 984、157 ~ 667和349 ~ 698个氨基酸。基因登录号、基因ID、染色体位置、编码序列长度、蛋白质序列长度等详细信息见表1.
系统发育和外显子内分析
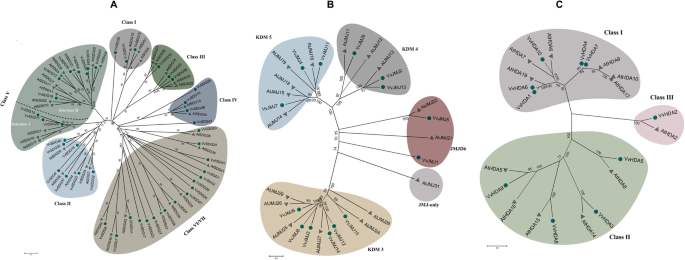
为了阐明HMs基因的系统发育历史,并将其划分为不同的亚家族,我们在拟南芥和葡萄HMs蛋白序列之间构建了系统发育树(图1)。1).此外,为了深入研究它们之间的系统发育关系,还出现了不生根的树VvHMS进行同一组的基因,并进行内部外显子分析(图。2).系统发育树的生成VvHMS相同的基因组,我们遵循之前的趋势。系统发育树仅在三个研究较好的亚科成员之间构建。
VvHMTs
所有43个SDG基因基于拟南芥和葡萄之间构建的系统发育树分为七种类(图。1a). V类又细分为I类和II类。I类在基因数量上更为保守,如葡萄和拟南芥包含相同的基因;3个基因。此外,不同的类包含不同数量的外显子,但同一类的外显子数量几乎相同,例如i类。然而,PRMTs的5个成员所包含的外显子数量都不同,表明PRMTs类保守性较低。在拟南芥和葡萄中发现了相同数量的hmt基因。这些结果表明,与其他家族相比,HMTs家族更为保守。
VVHDMS.
系统发育树是在葡萄和拟南芥的JMJ蛋白之间构建的。根据图。1b、JMJ葡萄藤和拟南芥蛋白分别聚为4个和5个不同的分支。Class I (JMJ- domain only),只有一个来自拟南芥的成员。II类(KDM3)、III类(KDM4)和V类(JMJD6)的蛋白质数量分别为6、3和2。而IV类(KDM5)则分别含有拟南芥和葡萄的5个和3个蛋白。这些结果表明,II类、III类和V类在蛋白质数量上更为保守。此外,在同一类中,外显子-内含子的分布和大小也不相同。然而,所有复制的基因对都具有相似的外显子-内含子结构(VvJMJ2/VvJMJ13,VvJMJ4/VvJMJ11,VvJMJ12/VvJMJ14),有多个外显子和内含子,但外显子的大小和分布不同。葡萄和拟南芥分别含有7个和4个HDMAs蛋白。
VvHATs和VvHDACs
在HATs家族中,HAG亚群的基因含量最高(28)。在HATs组中,葡萄和拟南芥的基因数量与其他组相比差异较大,说明HATs组在进化过程中经历了更多的变化。连续重复的基因对(VvHAG3/VvHAG4和VvHAG7/VvHAG8)显示保守的外显子-内含子分布。此外,HAG蛋白具有较高的bootstrap值,表明它们之间具有较高的相似性。根据系统发育分析(图。1c)的基因VvHDA进一步分为三个课程。有趣的是,III类仅包含2名成员,每个葡萄和拟南芥都是一个成员。
HMs基因本体论分析
我们在生物学、细胞和分子水平上对葡萄基因进行了硅氧化石墨烯分析(附加文件2:图。S1)。生物学过程预测表明HMS基因在基因表达,细胞组分,花卉发育,对生物和非生物刺激,蛋白质改性过程和转录过程的反应的调节中的累积。大多数HMS蛋白被发现在细胞质,细胞核和细胞内细胞内。HMS基因可能在分子水平的结合(染色质,DNA和蛋白)转录和转移酶调节活动中作用。
HMs基因在葡萄中的染色体分布及扩展模式
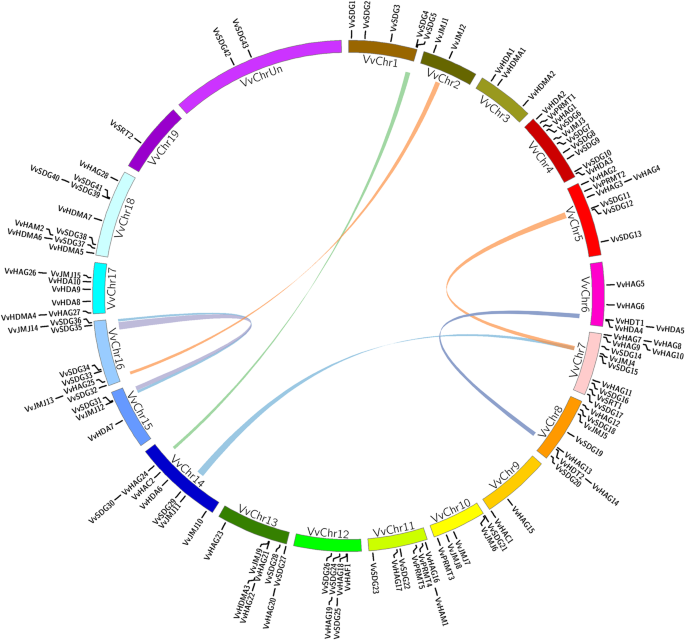
117个HMs基因均不均匀分布在20条染色体上。3.).第7号染色体包含的基因数量最多(11),而第19号染色体包含的基因数量最少,只有一个。43的VvSDG基因在14条染色体上随机分布,因为染色体2,3,6,9,17和19没有基因。四种染色体1,4,16和18含有相同数量的基因;五。这四种染色体含有近50%的基因。对于所有其他基因家族,注意到不均匀分布的相同趋势(图。3.).根据材料和方法中描述的标准计算串联复制。
只有三个串联重复事件(VvHAG3/VvHAG4,VvHAG7/VvHAG8,VvSDG39/VvSDG40在三种染色体上的六个基因中观察到)。两双复制对属于HAG系列,这表明在进化过程中,这个家庭在保守中不太保守。我们还计算了HMS葡萄基基因中的节段性重复。共有15个基因以八双的形式接受细分重复;VvSDG4/VvSDG30,VvSDG11/VvSDG35,VvSDG29/VvSDG15,VvSDG31/VvSDG15,VvJMJ2/VvJMJ13,VvJMJ11/VvJMJ4,VvJMJ12/VvJMJ14,VvHDT1/VvHDT2.有趣的是,VvSDG15与两个基因配对,VvSDG29和VvSDG31.这些结果表明,串联和片段重复(21%)事件在HMs基因的扩增中都发挥了作用。这些结果可以为进化历史和功能分析提供线索。Ka和Ks之间的比值有助于描述进化过程[41].此外,所有重复基因的Ka / ks比例小于1,表明所有基因都有净化选择压力(附加文件3.:表S2)。
葡萄与拟南芥的进化关系
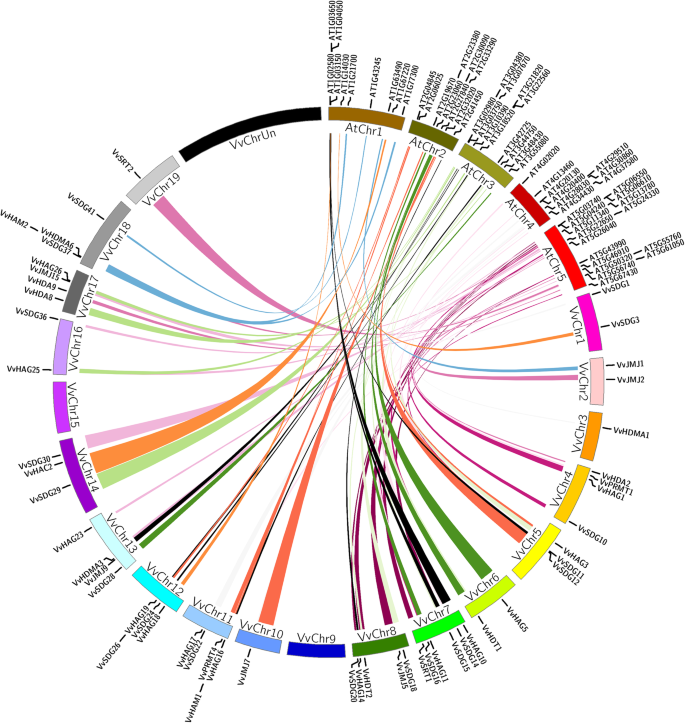
HMs基因在拟南芥和水稻等模式植物中的作用已经得到了很好的研究。因此,为了深入了解HMs基因在葡萄中的起源和潜在功能,探索其进化历史,我们对葡萄和拟南芥进行了共时分析。
如图1所示。4结果表明,拟南芥与葡萄的HMs基因共鉴定出69对同源基因,分别由24对、3对、7对、3对、18对、2对、1对、3对、2对和6对SDGs、prmt、JMJs、HDMAs、HAGs、HAMs、HACs、hda、SRTs和HDTs组成4:表S3)。然而,HAFS基因没有同步块。有24个SDG基因嵌段具有21个拟南芥和19个葡萄属基因。此外,有四对SDG,两对PRMT,一对JMJ,四对HAG,以及两对HDT,其中单个葡萄基因与拟南芥的多种基因配对。还有五个HMS拟南芥(3个SDG和2 HDT)基因,其与两种葡萄基基因形成对。所有对都包含来自同一亚家族的成员,这表明它们在物种之前具有共同的起源。
种子发育过程中HMS基因的转录组分分析
为了了解HMs葡萄基因在种子发育中的潜在作用,我们对HMs葡萄基因进行了转录组分析(图1)。5和附加文件5:表S4)。从种子和无籽产后的种子发育的三个不同阶段进行样品。大多数HMS基因在种子形成的连续阶段在种子和无籽产后的连续阶段高度表达。然而,大多数HDA家族成员表达得相对较低。例如,有一些例外,VvJMJ14与无籽相比,在种子发育的后期显示了上调。相比之下,VvSDG30,VvHDA1,vvhag23.在无核品种种子发育的各个阶段均有高表达,表明它们可能在胚珠败育中发挥作用。因此,我们推测HMs基因在种子发育和胚珠败育中具有潜在的作用。我们观察到一些由重复事件产生的葡萄藤HMs基因对在基因对中表现出相似的表达模式。例如,JMJ家族的大部分重复基因对在外显子-内含子分布和表达模式方面是保守的。然而,也有一些例外,VvSDG4/VvSDG30和VvSDG15-VvSDG29/VvSDG31(局部),即VvSDG4和VvSDG30种子发展逐步阶段具有显着不同的表达。进一步关于重复基因,与SDG亚家族相比,JMJ亚家族更加保守。
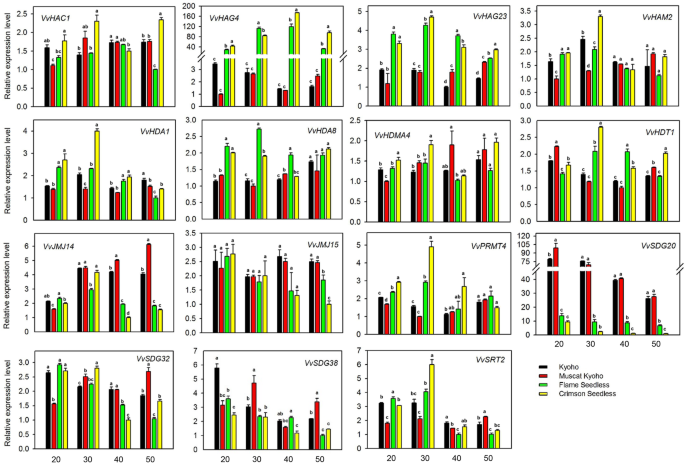
不同葡萄品种HMs基因在种子发育不同阶段的表达模式
为了验证转录组数据的可靠性,并探索vvhs基因的表达模式是否在不同葡萄品种中广泛存在,本研究选择了15个HMs基因,分析了不同种子葡萄品种(‘巨穗葡萄’和‘麝香葡萄’)和无籽葡萄品种(‘火焰无籽葡萄’和‘深红色无籽葡萄’)种子发育连续阶段的表达模式。根据种子发育转录组数据的结果选择基因(图1)。5).这些基因由所有亚家族的代表组成,包括不同的(VvHAC1, VvHAG23,VVHAM2,VVHDA1,VVHDA8,VVHDT1,VVJMJ14,VVJMJ15,VVSDG20,VVSDG32,VvSDG38)和无处不在(vvhag4,vvhdma4,vvprmt4,VvSRT2)在种子和无籽品种的种子发育的不同阶段表示基因。如图1所示。6,VvJMJ14 VvJMJ15,和VvSDG38,在种子发育后期显著高表达。VvSDG20在种子发育的各个阶段均显著高于无核品种。有籽品种与无籽品种间的变异率较高VvSDG20与其他差异表达基因相比。基于这些结果,我们推测这些基因可能在种子发育中起作用。与这些结果相反,一些基因在无核品种种子形成的某些阶段显著高表达,例如,vvhag23.,VvHDA8,和VvPRMT4.此外,VvHAG4在种子发育的各个阶段,无核品种的表达模式与有种子品种有显著差异。这些结果表明,这些基因可能在胚珠流产中起作用。总体上,qRT-PCR结果与转录组结果一致。
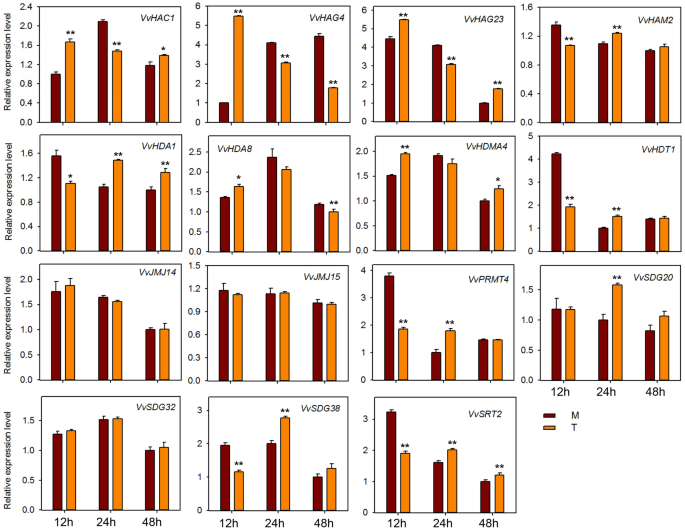
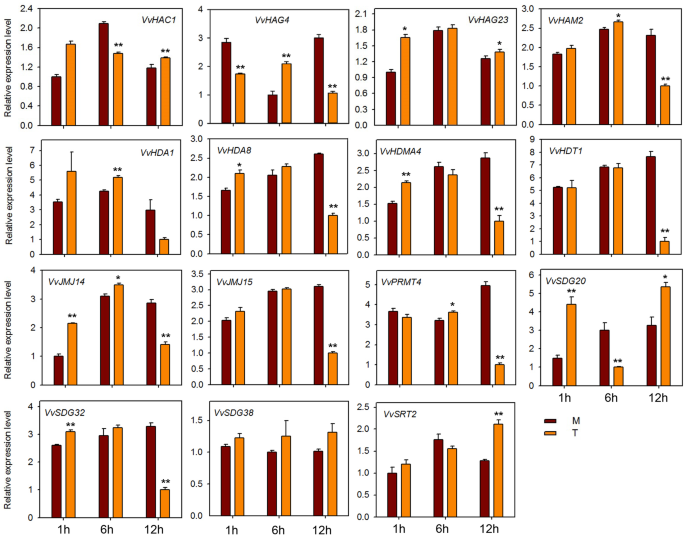
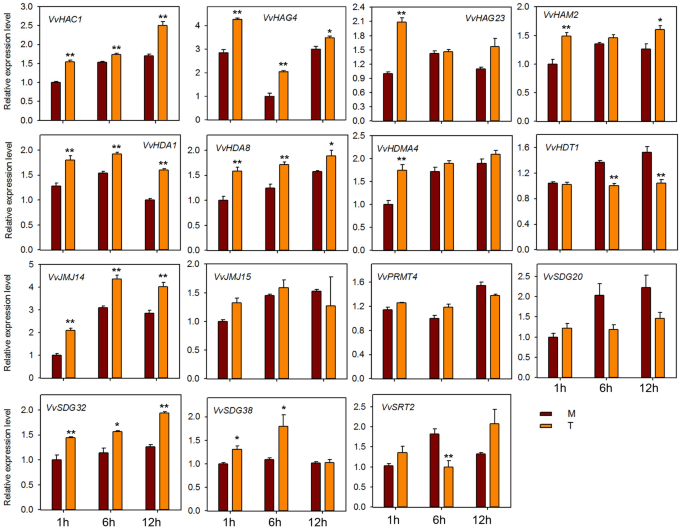
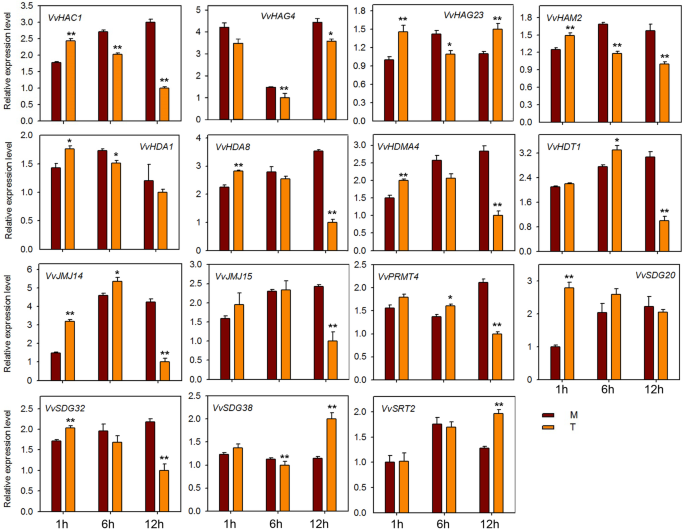
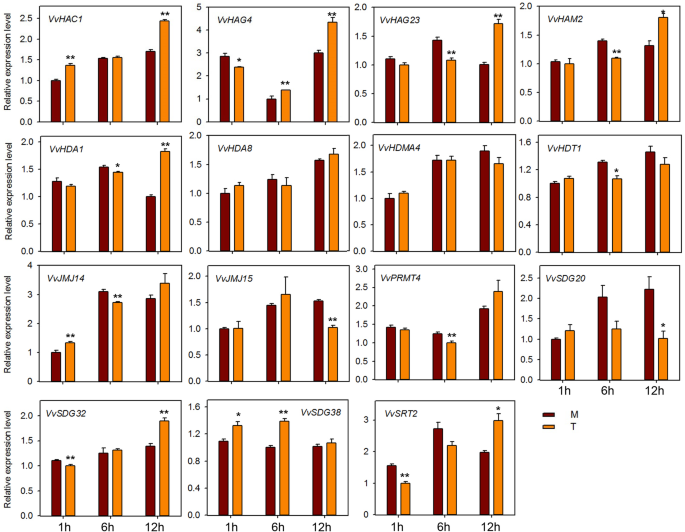
HMS基因的表达分析响应E.necator接种和激素处理
为了探讨HMS基因对粉末状霉菌感染的潜在作用,在感染“Shang-24”后,我们对15个HMS基因的QRT-PCR分析进行了QRT-PCR分析(相同的种子研究)erysiphe necator..在12 hpi时,三种基因的表达(VVHAC1.,VvHAG4,和vvhag23.)显着上调,但随后在24 HPI下调(图。7).但是,表达了VvHAM2, VvHDA1,VvPRMT4,VvHDT1,VvSDG38,VvSRT2在12 hpi下调,并在24 hpi上调。此外,一些基因(VvJMJ14,VvJMJ15,VvSDG32)在治疗和对照植物之间表达表达没有显着差异。这些结果表明一些HMS基因对粉末状霉菌响应,并且可能在抗性机制中作用。我们还检查了15个HMS葡萄基基因的响应到ABA,乙烯,JA和SA应用。在用ABA处理的植物中,大多数基因在12hPI下调(图。8).但VVHAC1.,vvhag23.,SDG20.,VvSRT2基因在12 hpi显著上调。VvHAG4,VvJMJ14,VvSDG20在all-time点显示出显着的差异表达。然而,VvSDG38该基因在所有时间点上在对照和处理植株中均表现出相同的表达,表明除了这一点外,其他所有基因在葡萄中都与ABA调控有关。对于经过JA处理的植物,VvHAC1, VvHAG4,VvHDA1,VvHDA8,VvJM14,VvSDG32在所有时间点上显示显著的上调。然而,vvhag23.和VvHDMA4仅在1 hpi显著上调。此外,VvHDT1在JA处理后的6、12 hpi显著下调(图。9).在SA处理的工厂中,VVHAC1.,vvhag23.,VvHAM2,VvHDA1,VvHDA8,VvHDMA4,VvJMJ14,VvSDG20,VvSDG32基因在1 hpi显著上调,12 hpi时大部分基因下调(图5)。10).此外,7个基因(VVHAC1.,VvHAG4,vvhag23.,VvHAM2,VvHDA1,VvSDG32,VvSRT2)在12 hpi时,乙烯处理植株的表达量显著高于对照(图1)。11).此外,表达vvhag23.,VvHAM2,VvHDA1在all-time potocts中彼此相似。在1 hpi的表达相同,在6 hpi为6 hpi,随后在12 hpi上调节。然而,VvJMJ15和VvSDG2012 hpi显著下调。这些结果表明,大部分HMs基因参与了葡萄的防御机制大肠necator接种和参与激素途径。
讨论
HMs基因家族已经在模式植物中得到了很好的研究,它影响植物生长发育的许多过程,包括根生长、花诱导、花器官发生、胚胎发育以及植物对生物和非生物胁迫的反应[42,43,44].近年来,HMs基因已在柑橘、苹果和草莓等水果作物中被发现。这些研究报告了这些基因在花诱导、果实发育、对蓝霉感染、寒冷和热应激的反应等方面的假定功能[30.,31,32].然而,有关HMs基因数量和功能在葡萄藤中的信息是有限的。在本研究中,我们详细描述了HMs基因的生物信息学和表达分析大肠necator接种和不同的激素治疗。我们确认117VvHMs基因基于拟南芥和保守结构域的系统发育关系,将它们分成11个亚属植物。所有基因根据其家庭命名,并在染色体上的位置命名[30.,31].此前,在葡萄藤aqua等人[45,46]在HAT、HDAC和SDG亚家族中分别报道了7、13和33个基因。但是,与以前的研究相比,我们发现了更多的基因,基因数量的差异是由于基因搜索网站的进步和不同的搜索方法。vvhm家族中,VvSDG家族较为保守,VvHAG家族较为保守。外显子-内含子分析也支持我们的结果。2).此外,SDG系列也在不同物种中的基因数中保存,即葡萄,拟南芥,柑橘和番茄分别具有43,41,40和43个SDG基因[31].根据预测的蛋白长度,HDA亚家族成员相对于其他亚家族更为保守(表1)1).此外,我们的发现与之前在其他作物上的发现是一致的[30.,31,32].
基因复制在基因家族的扩张中起着至关重要的作用[47].据研究,片段重复和串联重复都对葡萄基因家族的扩展有重要贡献[48].我们观察到先前基因分布的趋势,即基因在染色体上的高度变异分布。7号染色体上的基因数量最多。这表明大多数复制事件发生在这条染色体上。在7号染色体上发现了两种类型的重复对(串联的和片段的),表明这条染色体在HMs基因家族的扩展中发挥了潜在的作用。此外,更多的重复事件可能是染色体上基因聚集的原因,但我们没有证据支持这一假设[49].根据结果,21%的HMS基因是重复事件的结果。与串联复制(3对)事件相比,我们观察了更多的分段复制(8对)事件。在重复事件的情况下,我们观察到之前的趋势,因为在植物中进化过程中发生了比串联复制更常见的分段重复发生了[47].进一步,配对VvSDG15有两个基因(VvSDG29和VvSDG31),表明它可能在植物生长发育中起着多种作用。此外,VvHAG基因家族中发生的串联重复事件较多,进一步证实了我们的基因数量和外显子-内含子分析结果表明HAG基因家族保守性较弱。一般来说,重复的基因对在外显子-内含子分布和表达模式上具有保守性。然而,也有一些区别,VvSDG4/VvSDG30和VvSDG15-VvSDG29/VvSDG31(局部),即VvSDG15在种子发育的各个阶段均有表达,在有籽和无籽后代中均有表达VvSDG29有籽子代和无籽子代的种子含量均较低。5).JMJ亚家族的重复基因对在外显子-内含子分布和表达模式上较为保守。Ka和Ks之间的比值有助于描述进化过程[42].结果表明,所有重复基因都具有负选择模式。此前,在苹果、柑橘和草莓等其他水果作物中也报道过类似的HMs基因结果[30.,31,32].
Synteny分析是一个非常重要的生物信息学工具,Synteny块可以提供关于基因进化和功能的线索[50.].在葡萄和拟南芥HMs基因之间发现了68个synteny blocks (Segmental duplication pairs)。在葡萄和拟南芥之间存在更多的片段复制对,表明它们可能在物种形成前有一些共同的起源。然而,仅根据同系关系很难解释进化史。基于葡萄同源基因在其他作物中的潜在作用,我们可以预测HMs基因在葡萄中的功能。
此前已经报道了一些在葡萄种子发育中起作用的转录因子和基因家族,如MADS-box、B3、GASA基因家族[33,34,41].在拟南芥中,HMs基因特别是SDG家族在植物营养和生殖生长中的潜在作用已经得到了广泛的研究。基因表达分析可为基因功能研究提供线索。基于HMs基因在其他作物中的作用,我们对不同种子发育阶段的HMs葡萄基因进行了表达谱分析erysiphe necator.,并在施用多种植物激素之后。例如,获得的结果是如此获得VvSDG20在种子和无籽品种种子中表达了不同的表达。根据以前的研究,VvSDG12,VvSDG14,VvSDG16,VvSDG25,VvSDG37(之前被称为SDG6934、SDG66905、SDG66903、SDG66932、SDG66911)在葡萄花和果实中高表达[45].在我们的研究中,这些基因在种子和无籽品种中表现出普遍存在的表达。因此,我们推测这些基因可能在生殖过程中具有一致作用。植物激素,如ABA,乙烯,JA和SA,在调节对生物和非生物胁迫的植物反应中涉及的发育过程和信号网络中起重要作用。在我们的研究中,VvPRMT4上调了erysiphe necator.在SA治疗之后。进一步,表达VvSDG32也受JA和SA的影响。此前,SDG基因参与柑橘胚胎发育、果实发育以及对生物和非生物刺激的响应[30.),草莓32]和番茄[51.已被报道。如果是HDMs基因(VvJMJ14,VvJMJ15,VvHDMA4)注意到类似的结果。因此,我们推测,HMTS和HDMS基因可能在种子发育和抗病抵抗通过影响激素信号通路具有潜在的作用。一般来说,我们的研究为基于生物信息和表达分析提供了关于基因功能的一些线索。需要进行未来的研究以获得有关基因功能的确切信息。
VVHAC1.外源ABA、JA、SA和乙烯在处理植株和对照植株上表达差异。李等人[52.报道了……的卷入athac1(同源VVHAC1.)在乙烯信号通路中。此外,突变体的athac1在根部发育早期阶段显示出对高浓度葡萄糖的抗性。VvHAM2外源施加JA和SA时表达上调,外源施加乙烯时表达显著下调。在拟南芥中,Ham1 / 2.据报道,他们参与男性和女性配子[16].这些结果表明,HATs基因通过调控基因表达在植物发育过程中发挥重要作用。HDACs基因也在基因表达和染色质结构的调控中发挥潜在的作用[46].例如,AtHDA19通过调节多种激素信号通路和网络,在植物防御中发挥重要作用WRKY38和WRKY62.在我们的研究中,VvHDA1(同源AtHDA19)在抗疾病和激素应用方面表现出显著的表达变化,表明它参与了多个生物学过程。此外,VvSRT2对白粉病的侵袭和乙烯的施用有显著的下调作用。拟南芥和水稻的SRT基因功能也得到了类似的结果[53.,54.].最后,我们的研究提供了关于HMS基因在葡萄树中的功能的墨水。
结论
在这项研究中,我们确定了117个HMs基因在葡萄。我们将这些基因分为4个亚组,随后又将这些亚组划分为11个亚家族。此外,我们还从染色体位置、外显子-内含子分布和进化历史等方面分析了这些基因。从进化历史来看,节段复制和串联复制都在扩张中起了作用HMs葡萄树的基因。根据结果,VvHMs基因可能在种子发育、抗病和多种激素信号通路中发挥作用。我们的研究对表征VvHMs基因。
可用性数据和材料
支持本文结论的数据集包含在文章及其附加文件中。
缩写
- 阿坝:
-
脱盐酸
- 爆炸:
-
基本的局部对齐搜索工具
- 海关与边境保护局:
-
(cAMP响应元件结合蛋白)结合蛋白
- CLF:
-
卷曲的叶子
- DAF):
-
几天后开花
- 乙:
-
乙烯
- 蚊:
-
一般控制不可抑制的5相关n端乙酰转移酶
- 走:
-
基因本体论
- 帽子:
-
组蛋白乙酰基转移酶
- hdac:
-
组蛋白脱乙酰酶
- HDMS:
-
组蛋白甲基化酶
- 号:
-
组蛋白修饰
- hmt:
-
组蛋白甲基转移酶
- 嗯:
-
隐藏的马尔可夫模型
- JMJ:
-
JmjC domain-containing蛋白质
- 卡:
-
非同义替换率
- ks:
-
同义替代率
- 意味着:
-
美狄亚
- 惩罚:
-
茉莉酸甲酯
- NJ:
-
Neighbor-joining
- PRMTs:
-
蛋白质精氨酸甲基转移酶
- RPD3:
-
减少钾的依赖
- SA:
-
水杨酸
- 西班牙:
-
设置域组
- SIR2:
-
无声信息调节器2
- TAF2250:
-
tata结合相关蛋白因子
参考
- 1.
关键词:组蛋白修饰,植物,非生物胁迫,非生物胁迫中国生物医学工程学报。2013;55(10):892-901。
- 2.
链接DNA甲基化和组蛋白修饰:模式和范例。李建平。2009;10(5):295-304。
- 3.
刘X,阳S,yu cw,陈联师,吴酸组蛋白乙酰化和植物发育。酶。2016; 40:173-99。
- 4.
关键词:组蛋白,甲基化,高等植物,甲基化植物生物学杂志。2010;61:395-420。
- 5.
Dong G,MA D-P,Li J.组蛋白甲基转移酶SDG8调节枝条拟南芥.生物化学与生物物理学报,2008;
- 6。
Cazzonelli CI、Cuttriss AJ、Cossetto SB、Pye W、Crisp P、Whelan J、Finnegan EJ、Turnbull C、Pogson BJ。类胡萝卜素组成和芽分枝的调控拟南芥通过染色质修饰组蛋白甲基转移酶SDG8。植物细胞。2009;21(1):39-53。
- 7。
Cazzonelli CI, Nisar N, Roberts AC, Murray KD, Borevitz JO, Pogson BJ。一种染色质修饰酶,SDG8,参与形态学,基因表达和表观遗传反应的机械刺激。植物科学与技术,2014;
- 8。
Pandey R, Muller A, Napoli CA, Selinger DA, Pikaard CS, Richards EJ, Bender J, Mount DW, Jorgensen RA。组蛋白乙酰转移酶和组蛋白去乙酰化酶家族分析拟南芥表明多细胞真核生物染色质修饰的功能多样化。中国生物医学工程学报,2002;30(23):5036-55。
- 9。
h3 -赖氨酸79的甲基化是由一个新的无SET结构域的h3 -赖氨酸79酶家族介导的。咕咕叫医学杂志。2002;12(12):1052 - 8。
- 10.
关键词:同源异型基因,polycomb-group,基因表达,细胞因子拟南芥.大自然。1997;386(6620):44-51。
- 11.
Grossniklaus U, Vielle-Calzada JP, Hoeppner MA, Gagliano WB。母体对胚胎发生的控制美狄亚,一个Polycomb组基因in.拟南芥.科学。1998年; 280(5362):446-50。
- 12.
应激的转录“记忆”:应激反应基因的瞬时染色质和记忆(表观遗传)标记。植物j . 2015; 83(1): 149 - 59。
- 13.
索尔斯坦森T,格里尼PE,阿伦RB。植物发育中的SET结构域蛋白。BBA Gene Regul Mech. 2011;1809(8): 407-20。
- 14.
赵卓,于颖,D迈耶,吴超,沈卫华。通过表达预防早熟开花开花轨迹C需要组蛋白H3 K36甲基化。细胞生物学杂志。2005;7(12):1256-60。
- 15.
关键词:拟南芥,精氨酸甲基转移酶AtPRMT5, II型蛋白,多效性发育缺陷植物杂志。2007;144(4):1913 - 23所示。
- 16。
Latrasse D ., Benhamed M., Henry Y ., Domenichini S ., Kim W ., Zhou D . x ., Delarue M.。MYST组蛋白乙酰转移酶在拟南芥配子体发育中起重要作用。中国生物医学工程学报,2008;
- 17。
关键词:组蛋白去乙酰化酶,HD2,功能分析拟南芥.工厂J. 2000; 22(1):19-27。
- 18。
Cigliano RA, Sanseverino W, Cremona G, Ercolano MR, Conicella C, coniglio FM。番茄组蛋白修饰基因的全基因组分析:了解其发育作用。BMC基因组学。2013;14:57。
- 19。
Yano R, Takebayashi Y, Nambara E, Kamiya Y, Seo M.结合关联映射和转录组学鉴定HD2B组蛋白脱乙酰酶作为与种子休眠相关的遗传因素拟南芥.工厂J. 2013; 74(5):815-28。
- 20.
Song XJ, Kuroha T, Ayano M, Furuta T, Nagai K, Komeda N, Segami S, Miura K, Ogawa D, Kamura T,等。一种罕见的组蛋白H4乙酰转移酶等位基因可以提高水稻的粒重、产量和植株生物量。P美国国家科学研究院。2015, 112(1): 76 - 81。
- 21.
刘XC、陈CY王KC,罗M, Tai R,元LY,赵ML,杨SG,田G,崔YH, et al。光敏色素交互作用因子3与组蛋白去乙酰化酶HDA15在黄化过程中抑制叶绿素生物合成和光合作用拟南芥幼苗。植物细胞。2013;25(4):1258 - 73。
- 22.
张国强,周国栋,周国栋。Arabidopsis GCN5,HD1,和TAF1 / HAF2.相互作用以调节光响应基因表达所需的组蛋白乙酰化。植物细胞。2006; 18(11):2893-903。
- 23.
Liu X, Luo M, Zhang W, Zhao JH, Zhang JX, Wu KQ, Tian LN, Duan J. rice的组蛋白乙酰转移酶(栽培稻L.):系统发育分析,亚细胞定位和表达。BMC植物BIOL。2012; 12:17。
- 24.
Long Ja,Ohno C,史密斯Zr,Meyerowitz em。裸照调节顶端胚胎命运拟南芥.科学。2006;312(5779):1520 - 3。
- 25.
To TK, Nakaminami K, Kim JM, Morosawa T, Ishida J, Tanaka M, Yokoyama S, Shinozaki K, Seki M。拟南芥HDA6要求有耐冻性。生物化学与生物物理学报,2011;
- 26.
周德明,周德明,周德明。拟南芥组蛋白乙酰转移酶AtGCN5通过基因调控花分生组织的活性WUSCHEL /无性生殖的途径。生物化学杂志。2003;278(30):28246-51。
- 27.
Pontvianne F,Blevins T,Pikaard CS。拟南芥组蛋白赖氨酸甲基转移酶。ADV BOT RES。2010; 53:1-22。
- 28.
卢振海,黄小龙,欧阳亚东,姚建林。全基因组鉴定,系统发育和共表达分析奥塞梯人水稻基因家族。《公共科学图书馆•综合》。2013;8(6):15。
- 29.
钱祥祥,奚云龙,程宝平,朱绍伟。玉米DNA甲基转移酶基因家族的全基因组鉴定与表达谱分析。Plant Cell Rep. 2014;33(10): 1661-72。
- 30.
徐茹,徐H,刘y,王X,徐q,邓x。甜橙的基因组鉴定(素类)组蛋白改性基因家族及其在水果发育过程中的表达分析及水果蓝模感染过程。前植物SCI。2015; 6:607。
- 31.
关键词:组蛋白修饰,苹果,花诱导,基因家族植物生物学学报。2018;18(1):173。
- 32.
GU T,HAN Y,Huang R,Mcavoy RJ,Li Y.鉴定和表征组蛋白赖氨酸甲基化改性剂草莓属vesca.SCI REP UK。2016; 6(1):23581。
- 33.
Ahmad B,张某,姚J,Rahman Mu,Hanif M,Zhu Y,王X.葡萄牙B3-域转录因子家庭的基因组组织(葡萄L.)和种子发育过程中的表达。国际分子物理学报,2019;
- 34.
艾哈迈德B,姚杰,张S,李X,张X,yadav v,王X.葡萄葡萄原种子发育不同阶段的GASA基因的基因组特征和表达分析(葡萄l)预测它们参与种子发育。中国生物医学工程学报,2014;
- 35.
Holub EB。军备竞赛是古代历史拟南芥野花。李文杰。2001;2(7):516-27。
- 36.
李士泰,唐海斌,王兴耀,阿派德森。PGDD:植物基因和基因组复制数据库。核酸研究2013;41(D1): D1152-8。
- 37.
Siltberg J, Liberles DA。一个简单的协变分析核苷酸取代率的方法。中国生物医学工程学报。2002;15(4):588-94。
- 38.
Joung JG,Corbett Am,Fellman Sm,Tieman DM,Klee Hj,Giovannoni JJ,Fei ZJ。植物metgenmap:植物系统生物学的一体化分析系统。植物理性。2009; 151(4):1758-68。
- 39.
关键词:葡萄,种子发育,转录组,转录组分析BMC基因组学。2016;17(1):898。
- 40.
RNA-Seq分析在MeV中的应用。生物信息学。2011;27(22):3209 - 10。
- 41.
王磊,尹晓军,程春霞,王辉,郭瑞荣,徐学珍,赵军,郑勇,王小平。一个参与有籽和无籽葡萄胚珠发育的MADS-box基因超家族的进化与表达分析基因组学。2015;290(3):825-46
- 42.
摩根CC,Loughran NB,Walsh Ta,Harrison AJ,O'Connell MJ。正面选择邻近功能基本的哺乳动物生殖蛋白的疾病牵种地区。BMC EVOL BIOL。2010; 10:17。
- 43.
Nelissen H, Boccardi TM, Himanen K, Van Lijsebettens M.;植物科学学报,2007;
- 44.
关键词:干细胞,染色质重塑,干细胞,维持拟南芥.摩尔。2009;2(4):600 - 9。
- 45.
【关键词】葡萄;SET DOMAIN GROUP;全基因组分析;Plant Cell rep 2011;30(6): 1087-97。
- 46.
组蛋白乙酰转移酶和去乙酰化酶家族分析葡萄.植物生理学杂志。2010;48(2):194-9。
- 47.
关键词:基因重复,基因序列,基因重复,遗传进化拟南芥.植物生物学杂志2004;4:10。
- 48.
Jaillon O, auury J, Noel B, Policriti A, Clepet C, Casagrande A, Choisne N, Aubourg S, Vitulo N, Jubin C。大自然。2007;449(7161):463 - 7。
- 49.
夏F,Sun T,Yang S,Wang X,Chao J,Li X,Hu J,Cui M,Liu G,Wang D等。洞察B3转录因子超家族和表达剖析B3在烟草上滴下后腋芽的基因(烟草l .)。基因。2019;10(2):164。
- 50.
Lyons E, Pedersen B, Kane J, Alam M, Ming R, Tang HB, Wang XY, Bowers J, Paterson A, Lisch D, et al. .拟南芥与木瓜、杨树、葡萄等外类群的同生区发现与比较。植物杂志。2008;148(4):1772 - 81。
- 51.
钟双林,费志军,陈永良,郑勇,黄明英,Vrebalov J, McQuinn R, Gapper N,刘斌,向俊,等。番茄果实发育的单碱基拆分甲基化组揭示了与成熟相关的表观基因组修饰。生物科技Nat》。2013;31(2):154 - 9。
- 52.
关键词:拟南芥,组蛋白乙酰转移酶,分子生物学HAC乙烯信号通路中的家庭基因。植物细胞生理。2014; 55(2):426-35。
- 53.
黄L,太阳问,周秦F,李C,赵Y, d .下调静音信息调节器2相关组蛋白去乙酰化酶基因OsSRT1,诱导水稻DNA碎裂和细胞死亡。植物杂志。2007;144(3):1508 - 19所示。
- 54.
关键词:拟南芥,去乙酰化酶,基础防御,抑制PAD4,EDS5.和SID2表达。植物细胞生理。2010; 51(8):1291-9。
确认
作者感谢所有编辑和审稿人对这份手稿的评论。
资金
这项工作得到了河北农业大学的划线基金,李王(YJ201806),河北教育委员会科学研究计划(QN2020232)和中国河北的自然科学基金(C2018204055)。这些融资机构在设计本研究,收集,分析和解释或写作稿件的设计中没有作用。
作者信息
从属关系
贡献
LW设计的研究;GD监督实验;LW和CL完成了大部分实验;BA、RS和SZ提供了技术支持;LW和XS对数据进行分析;BA和LW与所有作者共同撰写了这篇文章。所有作者阅读并批准最终稿件。
相应的作者
道德声明
伦理批准并同意参与
不适用。
同意出版物
不适用。
相互竞争的利益
提交人声明他们没有竞争利益。
额外的信息
出版商的注意
《自然》杂志对已出版的地图和附属机构的管辖权主张保持中立。
补充信息
附加文件1:表S1。
引物序列用于qRT-PCR扩增。
附加文件2:图S1。
基因本体论分析VvHMs.
附加文件3:表S2。
葡萄基因组中HM基因的Synteny块。
附加文件4:表S3。
葡萄与拟南芥HM基因的Synteny块。
附加文件5:表S4。
转录组分析中鉴定的DEGs的详细信息。
权利和权限
开放获取本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.“创作共用公共领域”豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信用额度中另有说明。
关于这篇文章
引用这篇文章
王磊,Ahmad, B., Liang, C.。等等。葡萄中组蛋白修饰基因的生物信息学和表达分析预测了它们参与种子发育、白粉病抗性和激素信号转导。BMC植物杂志20.412(2020)。https://doi.org/10.1186/s12870-020-02618-7
收到了:
接受:
发表:
关键词
- VvHMs
- VvSDG
- 种子发展
- 激素
- 进化的历史