抽象的
背景
藜藜麦Willd。藜麦(quinoa)是苋科的一种伪谷类作物,是一种很有前途的作物,营养含量高,对应激环境(如受高盐影响的土壤)具有很高的耐受性。碱性亮氨酸拉链(bZIP)转录因子仅在真核生物中存在,与许多生物过程有关。到目前为止,藜麦和其他3种苋科作物(Spinacia oleracea那Beta寻常魅力, 和Amaranthus hepochondriacus.)已经完全测序。然而,有关的bZIPs在这些苋菜科的物种是有限的,全基因组分析bZIP结构这个家族缺乏藜麦。
结果
我们确认94bZIPs在奎奴亚藜中(命名为CqbZIP1-CQBZIP94).一切CqbZIPs在系统发育上被分成12个不同的亚科。比例CqbZIPs在每个亚家族中是不同的,同一亚群的成员都具有保守的外显子-内含子结构和蛋白质基序。此外,32个重复cqbzip.研究基因对,重复CqbZIPs主要经历了净化选择压力,这表明重复的功能CqbZIPs可能没有太大的分歧。此外,我们确定了bZIP结构藜麦和41,32和16种氨基克科特物种的成员和41,32和16个直字基因对S. Oleracea.那刺檗, 和A.次沉晶杆菌,分别。其中,大多数是一个单一的副本出现在S. Oleracea.那刺檗, 和A.次沉晶杆菌和两种副本存在于同种异体一体化奎奴亚藜中。功能分歧bZIP结构同源基因可能是有限的。此外,11中选择CqbZIPs有特定的空间表达式模式,共有6个CqbZIPs响应于盐胁迫而上调。在选定中间CqbZIPs,4个重复基因对共有类似的表达模式,表明这些重复的基因可能在随后的进化期间保留一些基本功能。
结论
本研究提供了系统发育分类,基因序和基因结构,膨胀模式和表达剖面的第一种系统分析bZIP结构奎奴亚藜的家庭。我们的结果将为CQ的功能和进化分析奠定重要基础bZIPs,并为进一步研究组织特异性及其在藜麦抗盐胁迫中的功能提供了有前景的候选基因。
背景
藜麦(藜藜麦Willd。)是一种嗜睡症,源于南美安第斯仙安第安马省地区[1]它是一种异源四倍体(2n = 四倍 = 奎奴亚藜属苋科植物,也包括其他重要的经济作物,如Spinacia oleracea(菠菜,2n = 2x = 12),Beta寻常魅力(甜菜,2n = 2x = 18) ,及Amaranthus hepochondriacus.(苋菜红,2n = 2x = 32) [2].藜麦生产的谷物比其他主要谷物更有营养[3.那4.]并表现出对不良气候和土壤条件的高耐受性,如干旱,土壤盐度和霜,这使其成为农艺膨胀到边缘土地的有利候选者,并鉴定促进胁迫耐受性的候选基因[1那5.那6.那7.].2013年宣布国际藜亚的年度,联合国承认了这一新兴作物的潜力[6.那7.]为了在世界范围内扩大奎奴亚藜的生产并加速奎奴亚藜的改良,越来越多的研究人员致力于奎奴亚藜的研究,并起草了藜麦最近报道了基因组序列[7.这为加速世界粮食作物的遗传改良和提高全球粮食安全提供了基础。
转录因子(TFS)在几乎所有植物生物过程中起重要作用。它们是许多信号网络的关键调节因子,响应于植物生长和发展以及通过结合对应基因的启动子和/或增强子区域来激活或抑制下游靶基因的转录[8.那9.那10.]在几个只存在于真核生物中的TF家族中,碱性亮氨酸拉链(bZIP)家族是最大和最多样化的家族之一[10.那11.那12.].bZIP TFs包含一个高度保守的bZIP域,该域由两个结构特征组成,一个高度保守的基本区域和一个不太保守的亮氨酸拉链。基本区由16个氨基酸残基组成,具有不变的N-× 7-R/K基序,专门负责DNA结合和细胞核定位。亮氨酸拉链包括亮氨酸或其他大型疏水氨基酸的七核苷酸重复序列,用于特定的识别和二聚[10.那11.那12.那13.那14.].
在植物中,有大量证据表明bZIP TFs在胚胎发生等生物过程的各个方面发挥着关键作用[15.],种子成熟[16.那17.[花和血管发展[18.那19.].另一方面,bZIP蛋白也参与调控信号和对非生物/生物刺激的反应,包括高盐度、干旱、渗透、冷胁迫和病原体防御[10.那11.那12.那20.].因此,bZIP结构转录因子是重要的植物抵御各种环境压力,如盐渍化土壤。土壤盐渍化是一个日益严重的问题,在农业生产造成全球巨大的经济损失。由于藜可在苛刻的土壤条件下生长,并表现出高耐盐[6.那21.那22.[庄稼可以用作其他作物的耐盐基因的有价值的捐赠者[6.].
Bzip TF家族的成员在许多真核基因组中全面地识别或预测了[10.那20.那23.那24.那25.那26.].然而,据我们所知,没有bZIP结构到目前为止已经在奎奴亚藜中鉴定并孤立基因。通过藜麦基因组测序完成,基因组概述bZIP结构迫切需要奎奴亚藜科植物。在本研究中,假设bZIPs在奎奴亚藜中鉴定出来。我们对系统发育,基因结构,蛋白质基序,基因组定位,膨胀模式和表达谱进行了相对详细的研究,以评估分子演化和生物学功能bZIP结构奎奴亚藜的家庭。
结果
推定基因的基因组鉴定和特征bZIPs
总共94bZIP结构基因被证实和藜(附加文件中标识1),我们将这些基因命名为CqbZIPs, 从CqbZIP1来CQBZIP9494个CQBZIP的一级和二级蛋白质结构由其蛋白质序列推断(附加文件1).蛋白质结构在所有鉴定的CQbzips中高度多样化,蛋白质的氨基酸数由92(CQBZIP31)至821(CQBZIP86)变化,预测分子量范围为10.8kDa(CQbzip31)至91.6kDa(CQbzip86)。等电点从4.38(CQBZIP81)到10.37(CQBZIP42)。此外,我们确定了54,48和49bZIP结构基因甘蓝,普通甘蓝, 和A.次沉晶杆菌,表示为sobzips.那BvbZIPs, 和AhbZIPs,分别(附加文件2).
系统发育分析
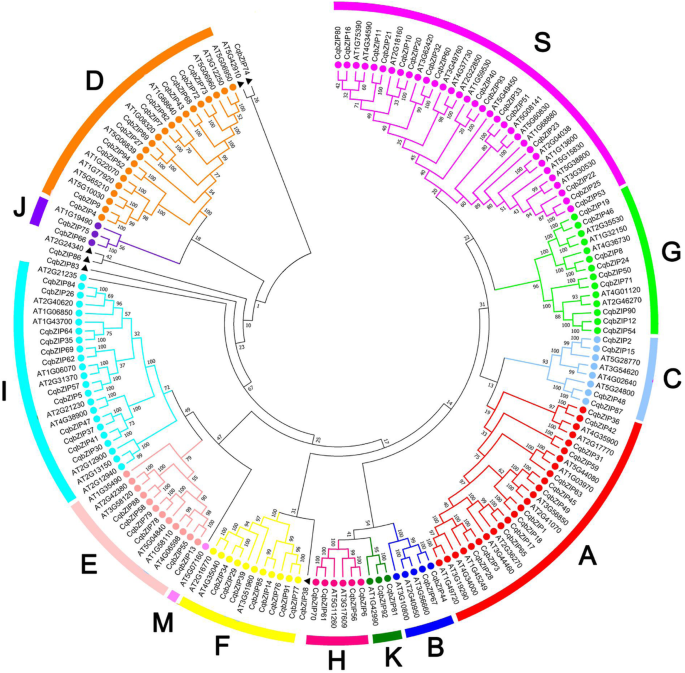
确定进化关系bZIPs在藜麦中,用来自拟南芥的94个Cqbzip蛋白和已知的Bzips构建系统发育树(图。1和2a、 附加文件3.).
根据以前的分类系统[14.),cqbzip.家系分为12个亚科(亚科A至K和S),每个亚科的成员比例不同(附加文件)4.一个)。亚家族S(17%)具有最多的基因,其次是亚家族A(14%),亚家族D(13%)和亚家族I(13%)。亚家族B(2%),亚家族J(2%)和亚家族K(2%)含有最小成员。此外,这bZIPs在菠菜中,甜菜和苋菜被系统发育分类(附加文件)5.),每个植物中发现每个亚家族中的类似成分分布(附加文件4.B-D)。
基因结构和蛋白质基序CqbZIPs
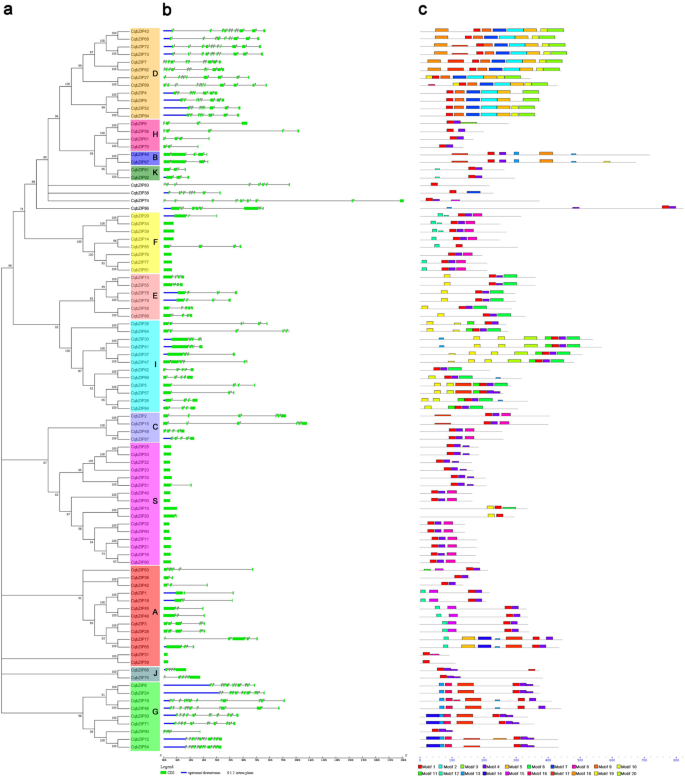
对基因结构和内含子相进行了研究cqbzip.家庭(图。2b)。结果表明大多数CqbZIPs(72 of 94CqbZIPs)含有内含子,内含子数量从1个到11个不等。亚家族A、B、C、E、F、H、I、J、K、S含有0-5个内含子,而亚家族D、G含有7-11个内含子,但不含CQBZIP90..一般来说,大多数cqbzip.同一亚组中的基因显示出类似的外显子结构,并且通过相对位置和相形成的内含子模式在每个系统发育亚组内高度保守。
总共,在CqbZIP蛋白质中鉴定出20个保守的基序,包括bZIP结构域,它们的多水平一致氨基酸基序序列在附加文件中列出6..对应的系统发育树的图案分布cqbzip.基因家族如图所示。2c.所有的cqbzip都有Motif 1,代表bZIP域的基本区域和铰链,Motif 4和9对应于bZIP家族中亮氨酸拉链区域的可变Motif。例如,motif 9只出现在D亚族中,而motif 4几乎出现在其他亚族中。此外,还发现了一些亚家族特有的基序。例如,Motif 16仅存在于G亚家族中,Motif 15仅存在于A亚家族中,Motif 11和20仅存在于I亚家族中,Motif 2、7和9仅存在于D亚家族中。
基因组位置和基因复制CqbZIPs
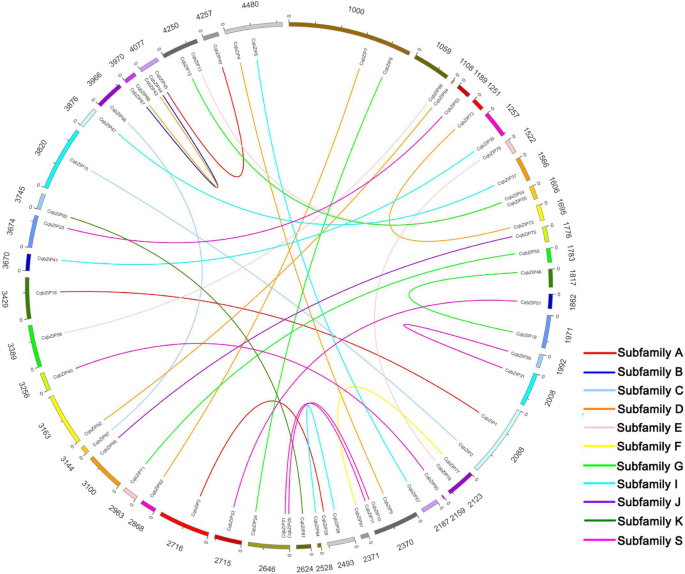
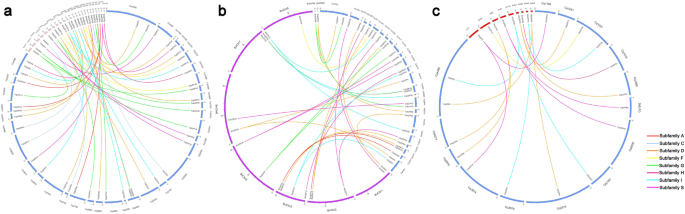
94的基因组位置CqbZIPs显示在其他文件中7.。此外,为了说明CqbZIPs,基因复制事件在本研究探讨。如图1所示。3.32岁的复制cqbzip.重复事件主要集中在S、D、A、G和I亚群。此外,计算了所有32个重复样本的Ka/Ks比值cqbzip.基因对小于11).的同源关系bZIPs分析藜麦和3种其他苋菜植物之间,分别鉴定41,32和16个直晶基因对,分别在藜麦和菠菜,甜菜和苋菜之间鉴定出来(图。4.,附加文件8.).其中,17sobzips., 13BvbZIPs,及7AhbZIPs有2bZIP结构奎奴亚藜的直觉。在原始基因对中,大多数分布在亚家族D,S和I中。除此之外,所有KA / KS比例cqbzip72/Bvbzip13.和CQBZIP73./Bvbzip13.少于1人。
表达式模式CqbZIPs
以前的研究报告说,有些bZIP结构基因,如BZIP17.[27.那28.],bZIP49[14.],BZIP28[29.],BZIP60[28.那30.],ABF1-4[14.那31.那32.],GBF1[33.],矫正性大动脉转位[34.那35.那36.],Abi5.[37.], 和HY5[38.]在植物对盐胁迫和其他非生物胁迫的反应中发挥作用。在本研究中,我们调查了11个选定的基因的表达模式CqbZIPs(无花果。5.),表现出较高的同源性bZIPs在拟南芥中(图。1,附加文件9.)结果表明,这些基因具有组织特异性表达谱(图。5.一个)。CqbZIP3主要表达于叶,而CqbZIP17在幼茎中表现出较高的转录本丰度。其他基因,如cqbzip92那CQBZIP44那cqbzip81那cqbzip72, 和cqbzip61主要在根中表达。此外,11CqbZIPs对盐处理下的幼苗根系进行了研究(图。5.b).结果表明,11CqbZIPs被诱导或抑制。如图所示。5.B,6 11CqbZIPs(CqbZIP3那CqbZIP8那CqbZIP24那CQBZIP67.那CQBZIP44, 和CQBZIP73.)对盐胁迫响应肯定,而其他基因如CqbZIP17那cqbzip72那cqbzip92, 和cqbzip61在盐胁迫后表达水平下降。此外,4个重复的表达式配置文件cqbzip.基因对进行了比较(附加文件10.).其中,3对基因(CQBZIP44/CQBZIP67.那CqbZIP8/CqbZIP24, 和cqbzip81/cqbzip92)共享相似的表达模式(附加文件10.A-C和E-G),虽然这不是如此cqbzip72/CQBZIP73..复制的基因对在盐胁迫下表现出反表达模式(附加文件)10.H),这可能是由基因调控的变异引起的。
讨论
奎奴亚藜基因组是两个不同的多倍体亲本物种基因组融合的结果土荆芥(c . pallidicaule和C. Suecicum.),每一个贡献约一半的基因组大小[7.].在这项研究中,一套完整的94bZIP结构在藜麦中鉴定基因,基因的大小与拟南芥(78)相似[14.]和大米(89)[23.,但明显低于大豆(160)[39.]最近的全部基因组重复(WGD)事件由于古代多百倍而发生,这表明除了大约430万年前发生的基因组融合事件,没有其他谱系最近的WGD参与奎奴亚藜基因组进化[40].此外,基因的编码蛋白CqbZIPs表现出物理和化学性质的显着差异(附加文件1)bZIPs其他植物的基因[23.那24.那25.].
这bZIP结构成员也被鉴定在其他3种苋科物种和数量bZIPs异源四倍体中的藜麦几乎是多倍体中的一倍S. Oleracea.(54),刺檗(48),A.次沉晶杆菌(49)(附加文件2).其中,12bZIP结构亚科是通过系统发生分析(图聚类。1和2a、 附加文件2那3,和5.)),在4次苋科植物中发现了每种亚家族的类似成分分布(附加文件4.).亚家族含有最多的基因,而亚家族B,J和K具有最少bZIPs.然而,并非每株植物都存在所有亚组。与拟南芥中的成员相比,没有亚家族bZIPs存在于4种苋科植物中,无J亚科bZIPs存在于A.次沉晶杆菌,表明植物的进化不仅涉及基因保留,而且还伴随着基因丢失和突变[41].
内外图案携带基因家族的演变的印记[42那43那44那45].在本研究中,内含子的数量CqbZIPs从0变化到11(图2b,附加文件3.).大多数CqbZIPs(72 of 94CqbZIPs)包含内含子,仅占总数的22cqbzip.基因是无元的。外显子和内含子拼接的不同状态可能是有意义的cqbzip.基因进化。此外,结果表明,基因的外显子/内含子结构CqbZIPs各亚群内高度保守,聚在一起的基因在外显子序列中的内含子区域分布普遍相似。此外,D亚家族和G亚家族包含的内含子明显多于其他亚家族,S亚家族(16个成员中有14个)和F亚家族(8个成员中有6个)的大部分都不存在内含子。CqbZIPs表现出相似的基因结构多样性bZIP结构S在其他物种中,例如木薯[20.]和六个豆类[26.].
在本研究中,我们还根据保守motif的序列相似性对20个不同的保守motif进行了识别和分类(图2)。2c).结果表明,所有的cqbzip都包含典型的bZIP域(Motif 1),每个亚族都有一些共同的Motif,但也有一些亚族包含特殊的Motif。bZIP结构域是bZIP家族的核心,优先与下游靶基因的启动子结合CIS.-元素(如ABREs)。不同的母题组成可能有助于CqbZIP成员的功能多样性[25.].总体而言,各系统发育类群的基因结构和基序分布高度保守,支持其密切的进化关系和亚科分类。
人们已经认识到,基因复制在进化新颖性和复杂性的起源中起着重要作用[46那47].在这项研究中,研究了基因重复事件以阐明扩大机制bZIP结构奎奴亚藜的基因家族(图。3.桌子1).我们确定了32重复cqbzip.基因对(图3.),以及嘉/ Ks的比率对所有的复制cqbzip.基因对小于11),表明这一点CqbZIPs主要经验丰富的净化选择压力,有限的功能分歧[41那48那49].同时,成绩单水平的一些重复CqbZIPs不同组织和根在盐胁迫后也有相似之处(附加文件10.),这可能与它们高度相似的蛋白质结构有关CIS.-regulatory元素,结果表明,这些重复基因可能后续演进过程中保留了一些基本功能[50那51那52].
在苋菜科家庭,属土荆芥和Spinacia.属藜科β属于贝叶科,属苋菜属苋科[2].在这项研究中,41,32和16CqbZIPs分别与菠菜、甜菜和苋菜同源(图。4.,附加文件8.),取进化树(附加文件11.)考虑到奎奴亚藜和菠菜bZIPs与甜菜和苋菜在系统发育上是否密切相关bZIPs,这符合预期[2].除此之外,在bZIP结构同源基因中,大多数是一个拷贝存在于多倍体菠菜、甜菜和苋菜中,两个拷贝存在于异源四倍体藜麦中(图。4.,附加文件8.).嘉/ Ks的比来计算建议内的功能有限发散bZIP结构本研究鉴定的同源基因。
对于多基因家族,基因表达分析常常为功能预测提供有用的线索。结果表明,11个样本中大部分被选中CqbZIPs具有特定的空间表达模式(图。5.A),表明它们在藜麦中发挥不同的发育和生理功能的重要作用。此外,藜麦作为植物耐盐性的一个模型也被研究bZIP结构已被证明在各种植物物种中鉴定的基因在盐应激反应中发挥关键作用[53那54那55那56].在目前的研究中,11人中有6人CqbZIPs那CqbZIP3(直观到ABF1-4),CqbZIP8(直观到GBF1),CqbZIP24(直观到GBF1),CQBZIP67.(直观到BZIP17.那bZIP49, 和BZIP28),CQBZIP44(直观到BZIP17.那bZIP49, 和BZIP28),CQBZIP73.(直观到矫正性大动脉转位)响应于盐应激而正面调节(图。5.b) 我们的结果为筛选候选基因提供了证据,以进一步鉴定它们在植物抗盐胁迫中的功能参与CqbZIPs对盐胁迫产生负面影响,表明它们可能是对其他强调或参与其他生物过程的反应。
结论
在本报告中,共94岁bZIPs在藜中分离得到。综合研究CqbZIPs所提供的基因家族的一些重要的功能,如系统发生的分类,扩展图案,和表达谱。本研究的结果可以扩大上的分子进化和功能我们的理解bZIP结构奎奴亚藜的家庭,并提供了进一步调查的好机会bZIP结构植物科。
方法
的的bZIP转录因子基因鉴定
藜麦(藜藜麦V1.0)和苋菜(Amaranthus hepochondriacus.从Phytozome v12 (https://phytozome.jgi.doe.gov/pz/portal.html).菠菜(登录号:PRJNA325593)和甜菜(登录号:PRJNA268352)基因组数据库从美国国家生物技术信息中心(NCBI) (http://www.ncbi.nlm.nih.gov.).Arabidopsis Bzip序列[14.]取自拟南芥信息资源(TAIR) (http://www.arabidopsis.org),并使用带有默认参数的BLASTP程序对藜麦、菠菜、甜菜和苋菜基因组数据库进行搜索[57]之后,bZIP域由保守域数据库(CDD)程序确认(https://www.ncbi.nlm.nih.gov/cdd)和简单模块化架构研究工具(SMART) (http://smart.embl-heidelberg.de).最后,收集了自信的基因并分配为bZIP结构基因如下分析。利用ProtParam (http://web.expasy.org/protparam/)及SOPMA (https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=/npsa/npsa_sopma.html.) 工具。
系统发育分类和结构分析
本研究中识别的所有bZIP序列使用ClustalX version 2.1进行比对[58].然后,利用MEGA7 (Molecular Evolutionary Genetics Analysis)构建邻居连接系统发育树[59].Bootstrap分析进行1000次重复,以评估每个节点的统计支持度。利用在线Multiple Em for Motif Elicitation (MEME)程序扫描藜麦中bZIP蛋白的保守基序(http://meme-suite.org/tools/meme.),参数是基于先前的研究上设置[41].为了说明藜麦的外显子-内含子结构bZIPs,基因结构显示服务器(GSDS)工具(http://gsds.cbi.pku.edu.cn/)通过将预测的编码序列与其对应的基因组序列进行比较来使用。
染色体定位和基因复制
藜麦和苋菜的特定染色体位置bZIPs从植物血统数据库下载,以及染色体位置信息bZIPs在NCBI中搜索菠菜和甜菜。通过BLASTP和系统发育分析搜索重复的基因对[49],并配以马戏团节目[60]用DnaSP v5.0软件估算进化率、Ka(非同义替代率)和Ks(同义替代率)[61,计算Ka/Ks比值来评估每个重复基因对的选择压力。
植物材料、RNA提取和定量实时PCR
白藜种子(YMSBLM-2)由山西省农业科学院玉米研究所提供。在受控条件下在生长室中培养灭菌的种子(24℃/ 22°C夜晚,16小时光/ 8小时)。从4-5叶阶段幼苗收集RNA样品。收获根,茎,叶子,并收获300mM NaCl(盐胁迫)的根,1小时和3小时。之后,使用RNeasy植物迷你试剂盒(QIAGEN)提取总RNA,使用Superscript TM III逆转录酶试剂盒(Invitrogen)进行cDNA的制备。设计了基因特异性引物(附加文件12.),然后进行商业合成(华大基因,北京,中国)。采用2× Quantitative SYBR Green PCR mix (QIAGEN)和ABI ViiA 7 real-time PCR系统(Applied Biosystems, USA)进行实时定量PCR (qRT-PCR),严格按照制造商说明进行。qRT-PCR机设置40个循环,退火温度为60℃。相对基因转录水平测定为2−⊿⊿CT.[62],和归一化对延伸因子1α(EF1α.)基因转录水平。每个实验使用独立的RNA样本重复三次bZIPs在奎奴亚藜中,使用Cluster 3.0软件进行聚类[63].
数据和材料的可用性
拟南芥bZIP蛋白序列来源于拟南芥信息源(TAIR)数据库(http://www.arabidopsis.org)藜属植物的基因组序列(藜藜麦V1.0)和苋菜(Amaranthus hepochondriacus.下载自Phytozome v12 (https://phytozome.jgi.doe.gov/pz/portal.html).菠菜(登录号:PRJNA325593)和甜菜(登录号:PRJNA268352)的基因组序列从国家生物技术信息中心(NCBI)下载http://www.ncbi.nlm.nih.gov.).目前研究中使用的所有数据都包含在本发布的文章中及其附加文件中,或者可以从相应的作者提供合理的请求。
缩写
- bZIP:
-
基本亮氨酸拉链
- TF:
-
转录因子
- NCBI:
-
国家生物技术信息中心
- TAIR:
-
拟南芥信息资源
- 客户尽职调查:
-
保守域数据库
- 聪明的:
-
简单的模块化建筑研究工具
- 兆:
-
分子进化遗传学分析
- MEME:
-
多重Em用于基序诱导
- GSDS:
-
基因结构显示服务器
- Ka / Ks:
-
非同义替换率/同义替换率
- EF1α.:
-
伸长因子1α基因
- qRT PCR:
-
定量实时PCR
参考
- 1。
Morales A,Zurita-Silva A,Maldonado J,Silva H.智利藜诺的转录反应(藜藜麦在水分亏缺条件下发现aba独立的表达模式。植物学报2017;8:216。
- 2。
Yasui Y, Hirakawa H, Oikawa T, Toyoshima M, Matsuzaki C, Ueno M, Mizuno N, Nagatoshi Y, Imamura T, Miyago M藜藜麦,一种具有良好环境适应性和卓越营养特性的异源四倍体作物。DNA Res.2016;23(6):535-46。
- 3.
苏黎塔席尔瓦A、富恩特斯F、萨莫拉P、雅各布森S、施文伯R.育种奎奴亚藜(藜藜麦Willd。):潜在和观点。mol繁殖。2014; 34(1):13-30。
- 4.
Graf BL,Rojas Silva P,Rojo LE,Delatore Herrera J,Baldeón ME,Raskin I.奎奴亚藜的健康价值和功能性食品开发创新(藜藜麦Willd)。食品科学与食品安全。2015;14(4):431-45。
- 5.
雅各布森S,蒙特罗斯C,科库埃拉LJ,布拉沃LA,Christiansen的JL,在藜穆希卡A.抗冻性机制(藜藜麦《欧洲农业杂志》,2007;26(4):471-5。
- 6.
Schmöckel SM,Lightfoot DJ,Razali R,Tester M,Jarvis DE.鉴定与大鼠耐盐性相关的假定跨膜蛋白藜藜麦通过整合生理数据、RNAseq和SNP分析。植物学报2017;8:1023。
- 7.
Jarvis de,Ho Ys,Lightfoot DJ,SchmöckelSM,Li B,Borm Tj,Ohyanagi H,Mineta K,Michell Ct,Saber N.的基因组藜藜麦.大自然。2017;542(7641):307。
- 8.
刘杰,陈楠,陈菲,蔡斌,达尔桑托S,托尼利GB,佩佐蒂M,郑志明。葡萄bZIP转录因子基因家族的全基因组分析和表达谱(葡萄).BMC基因组学,2014;15(1):281。
- 9.
王志强,王志强,王志强,等。转录因子在植物防御和胁迫反应中的作用。植物学报。2002;5(5):430-6。
- 10。
Baloglu MC,Eldem V,Hajyzadeh M,Unver T.黄瓜bZIP转录因子的全基因组分析。公共科学图书馆一号。2014;9(4):e96014。
- 11.
魏坤,陈杰,王烨,陈寅,陈楠,林烨,潘楠,钟X,谢丁.玉米bZIP编码基因的全基因组分析.DNA研究.2012;19(6):463-76。
- 12.
李德,傅F,张H,宋F。番茄bZIP转录因子家族的全基因组系统特征(Solanum lycopersicum.l .)。BMC基因组学。2015;16(1):771。
- 13。
Jakoby M,Weisshaar B,Dröge-Laser W,Vicente-Carbajosa J,Tiedemann J,Kroj T,拟南芥的Bzip转录因子。趋势植物SCI。2002; 7(3):106-11。
- 14.
Dröge-Laser W,Snoek BL,Snel B,Weiste C. Arabidopsis Bzip转录因子家庭 - 更新。CurrOp植物BIOL。2018; 45:36-49。
- 15.
关益,任h,谢H,MA Z,陈F.综合征涉及胡萝卜的Bzip型转录因子(卡罗塔狗l .)体细胞胚胎发生。植物j . 2009; 60(2): 207 - 17所示。
- 16.
基于异源二聚体化和蛋白质复合物形成的拟南芥种子成熟基因表达调控的关键作用。植物细胞。2009;21(6):1747 - 61。
- 17.
Zinsmeister J, Lalanne D, Terrasson E, Chatelain E, Vandecasteele C, Vu BL, Dubois-Laurent C, Geoffriau E, Le Signor C, Dalmais M. ABI5是豆类植物种子成熟和寿命的调节因子。植物细胞。2016;28(11):2735 - 54。
- 18.
throw C, Schiermeyer A, Krawczyk S, Butterbrodt T, Nickolov K, Gatz C. Tobacco bZIP transcription factor TGA2.2 and related factor TGA2.1在植物防御反应和植物发育中起着重要的作用。植物j . 2005; 44(1): 100 - 13所示。
- 19.
拟南芥AtbZIP9蛋白融合到VP16转录激活域改变了叶片和维管的发育。植物科学。2007;172(6):1148 - 56。
- 20.
胡w,杨h,yan y,wei y,tie w,ding z,zuo j,peng m,li k。基因组 - 在木薯中非生物胁迫与非生物胁迫相关的基因组宽的表征和分析。Sci Rep-UK。2016; 6:22783。
- 21.
Rozema J,Cornelisse D,Zhang Y,Li H,Brunning B,Katschnig D,Broekman R,JI B,Van Bodegom P.比较甜菜品种的耐盐性和嗜睡祖先:驯化和育种计划的后果。AOB植物。2015; 7:PLU083。
- 22.
Adolf VI,Jacobsen S,Shabala S.藜麦的耐盐机制(藜藜麦遗嘱。环境实验机器人。2013;92:43–54.
- 23.
Nijhawan A, Jain M, Tyagi AK, Khurana JP。水稻碱性亮氨酸拉链转录因子家族的基因组调查及基因表达分析。植物杂志。2008;146(2):333 - 50。
- 24.
VanithaĴ,Ramachandran的S.全基因组的膨胀和在高等植物的碱性亮氨酸拉链转录因子的表达发散对高粱的重视。J Intent Plant Biol。2011; 53(3):4。
- 25.
Liu X,Chu Z.bZIP转录因子及其表达谱在多种非生物胁迫下的全基因组进化特征和分析二穗短柄草.BMC基因组学。2015; 16(1):227。
- 26.
王梓,程克,万力,严力,江H,刘S,雷Y,廖B.六种豆类基因组中碱性亮氨酸拉链(bZIP)转录因子基因家族的全基因组分析。BMC基因组学。2015;16(1):1053。
- 27
Liu JX,Srivastava R,Howell SH.在拟南芥中,胁迫诱导的激活型AtbZIP17的表达提供了抗盐胁迫的保护。植物细胞环境。2008;31(12):1735–43.
- 28
bZIP17和bZIP60以一种不依赖于uprin的方式调控BiP3和其他盐胁迫响应基因的表达拟南芥蒂利亚纳.J Cell Biochem。2015; 116(8):1638-45。
- 29
在拟南芥中,bZIP28和NF-Y转录因子被内质网胁迫激活并组装成一个转录复合物调控胁迫响应基因。植物细胞,2010,22(3):782 - 96。
- 30.
拟南芥bZIP60是一种蛋白质水解激活的转录因子,参与内质网应激反应。植物细胞。2008;20(11):3107 - 21所示。
- 31。
金SY。ABF家族bZIP类转录因子在应激反应中的作用。杂志杆菌。2006;126(4):519 - 27所示。
- 32。
奥雷利亚纳S,亚涅斯男,埃斯皮诺萨A,瓦多戈我,冈萨雷斯E,鲁伊斯 - 拉拉S,卡萨雷托JA。转录因子SlAREB1赋予干旱,盐胁迫耐受性和调节生物和非生物胁迫相关基因番茄。植物细胞环境。2010; 33(12):2191-208。
- 33。
孙勇,徐伟,贾勇,王敏,夏光tagbf1.基因参与蓝光反应和耐盐性。植物杂志2015;84(6):1219-30。
- 34。
在拟南芥中,一般解毒和应激反应是由氧化脂质通过TGA转录因子介导的。植物细胞。2008;20(3):768 - 85。
- 35。
Sham A、Al Azzawi A、Al Ameri S、Al Mahmoud B、Awwad F、Al Rawashdeh A、Iratni R、AbuQamar S.转录组分析揭示了通常由Botrytis cinerea感染,寒冷,干旱和拟南芥氧化胁迫。Plos一个。2014; 9(11):e113718。
- 36。
Sham A,Moustafa K,Al-Ameri S,Al-Azzawi A,Iratni R,AbuQamar S.利用比较微阵列鉴定拟南芥候选基因对生物和非生物胁迫的反应.公共科学图书馆一号.2015;10(5):e0125666。
- 37。
Skubacz A,Daszkowska-Golec A,Szarejko一中的作用和ABI5(ABA不敏感5)在植物发育,非生物胁迫反应,激素串扰的调节。前植物SCI。2016; 7:1884。
- 38.
Gangappa Sn,Botto JF。HY5在植物生长发育中的多方特性作用。莫尔植物。2016; 9(10):1353-65。
- 39.
关键词:亮氨酸拉链转录因子家族,进化,表达分析,基因工程,基因工程abstract:BMC基因组学。2018;19:159。
- 40.
邹C,陈A,肖L,Muller HM,Ache P,Haberer G,Zhang M,Jia W,Deng P,Huang R.藜麦的高质量基因组组装为基于盐囊的耐盐性和特殊营养价值的分子基础提供了见解。Cell Res.2017;27:1327。
- 41.
李F,风扇K,MA F,Yue E,Bibi N,Wang M,Shen H,Hasan MM,王X.基因组鉴定与非特异性脂质转移蛋白基因家族的基因组鉴定及比较膨胀分析Gossypium.Sci Rep-UK。2016; 6:38948。
- 42.
Long M,Rosenberg C,Gilbert W.内含子相位相关和基因内含子/外显子结构的演变。P Natl Acad SCI。1995年; 92(26):12495-9。
- 43.
Rogozin IB,Sverdlov Av,Babenko VN,Koonin EV。真核基因外显子性结构的演变分析。简短生物形式。2005; 6(2):118-34。
- 44.
Del Campo EM,Casano LM,Ballino E.内含子-外显子分布的进化含义以及基因的性质和序列rpl10a.真核生物中的基因。分子系统发育进化。2013;66(3):857-67。
- 45.
林奇M.内含演变为群体的遗传过程。P Natl Acad SCI。2002; 99(9):6118-23。
- 46.
Flagel LE,文德尔JF。基因复制和植物进化的新颖性。新植物。2009; 183(3):557-64。
- 47.
Moore Rc,Purugganan MD。植物重复基因的进化动态。CurrOp植物BIOL。2005; 8(2):122-8。
- 48.
范克,王敏,缪Y,倪敏,比比N,袁S,李菲,王X.基因工程中NAC转录因子的分子进化和扩增分析Zea Mays..Plos一个。2014; 9(11):E111837。
- 49.
Liu W, Li W, He Q ., Daud MK ., Chen J ., Zhu S.全基因组钙依赖蛋白激酶的研究和表达分析Gossypium raimondii..《公共科学图书馆•综合》。2014;9 (6):e98189。
- 50。
亚当斯kl。多倍体和杂交植物中重复基因表达的演变。j hered。2007; 98(2):136-41。
- 51。
李福,郭X,刘杰,周福,刘伟,吴杰,张H,曹H,苏H,温R。大鼠NAC转录因子的全基因组鉴定,鉴定和表达分析藜藜麦.基因。2019; 10(7):500。
- 52。
风扇K,沉H,Bibi N,李F,元S,王M,王X.植物睡室成员的分子演化和物种膨胀。J Intent Plant Biol。2015; 57(8):673-87。
- 53。
关键词:番茄,bZIP转录因子,sareb,水分亏缺,盐胁迫足底。2010;231(6):1459 - 73。
- 54。
刘C,毛,欧S,王W,刘L,吴y,楚思,王X. osbzip71,Bzip转录因子,赋予水稻的盐度和耐旱耐旱耐旱性。植物mol biol。2014; 84(1-2):19-36。
- 55。
王燕,高超,梁燕,王超,杨超,刘国栋bZIP结构基因毛柽柳调节烟草植物对盐胁迫的生理反应。植物生理学报。2010;167(3):222-30。
- 56。
王聪,陆庚,郝烨,郭浩,郭浩,郭勇,赵杰,程浩。ABP9是一种玉米bZIP转录因子,可提高转基因棉花的耐盐性和耐旱性。Planta.2017;246(3):453-69。
- 57。
阿尔特舒尔·SF,马登·TL,谢弗·AA,张J,张Z,米勒W,利普曼DJ.间隙BLAST和PSI-BLAST:新一代蛋白质数据库搜索程序.核酸研究1997;25(17):3389-402。
- 58。
拉金MA,Blackshields G,布朗NP,Chenna R,McGettigan PA,McWilliam H,瓦伦丁女,华莱士IM,维尔姆斯A,洛佩兹R. Clustal W比和为Clustal X版本2.0。生物信息学。2007; 23(21):2947-8。
- 59。
Kumar S,Stecher G,Tamura K.MEGA7:更大数据集的分子进化遗传学分析7.0版.摩尔生物进化.2016;33(7):1870-4。
- 60。
MI Krzywinski,Schein JE,Birol I,Connors J,Gascoyne R,Horsman D,Jones SJ,Marra MA.Circos:比较基因组学的信息美学.基因组研究,2009;19(9):1639-45。
- 61。
Librado P,Rozas J.DNASP V5:一种用于综合分析DNA多态性数据的软件。生物信息学。2009; 25(11):1451-2。
- 62.
Livak KJ,Schmittgen TD。使用实时定量PCR和2分析相对基因表达数据−⊿⊿CT.方法。方法。2001; 25(4):402-8。
- 63.
De Hoon MJ, Imoto S, Nolan J, Miyano S.开源集群软件。生物信息学。2004;20(9):1453 - 4。
致谢
我们感谢凯凡博士(福建农业和中国林业大学)以获得优秀的技术援助。
资金
这项研究是由来自山西大同大学(2017年-B-18)的博士后科研基金,重点研究和农业科技大同科技,山西(2018042)和山西省计划的开发项目,重点基础研究发展计划资助项目(201603D221004-5)。供资机构必须在研究和收集,分析和解释数据的设计没有任何作用,并以书面稿件。
作者信息
从属关系
贡献
FL和RW构思和设计了研究。FL和RW提供了新的试剂或分析工具。FL、JL、XG和HZ分析了数据。FL、JL和LY进行了实验。FL、XG、HZ和RW为撰写手稿做出了贡献。所有作者都阅读并批准了手稿。
通讯作者
伦理宣言
道德认可和参与同意
不适用。
同意出版
不适用。
竞争利益
两位作者宣称没有相互竞争的经济利益。
额外的信息
出版商的注意事项
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
补充信息
附加文件1。
本研究中确定的BZIP的结构分析。
附加文件2。
这bZIPs在菠菜,甜菜和苋菜中发现。
附加文件3。
分类和基因结构bZIPs在藜麦。
附加文件4。
成员在每个项目中所占的百分比bZIP结构亚家族在奎奴亚藜,菠菜,甜菜和苋菜。
附加文件5。
菠菜、甜菜、苋菜和拟南芥中bzip基因的系统发育关系。
附加文件6。
根据MEME程序的预测,CqbZIP蛋白中保守基序的多级共有序列及其标志。
附加文件7。
基因组位置bZIPs在藜麦。
附加文件8。
Ka/Ks分析法在直系同源性研究中的应用bZIP结构藜麦和菠菜,甜菜和苋菜之间的基因对。
补充文件9。
来自BLASTP的cqbzip和atbzip的同源性信息。
附加文件10。
一些重复的表达模式cqbzip.盐胁迫下不同器官和根的基因。
附加文件11。
奎奴亚藜,菠菜,甘蔗和苋菜植物发育关系。
额外的文件12。
本研究中用于qRT-PCR的PCR引物。
权限
开放访问本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条中提供的数据,除非数据信用额度中另有规定。
关于这篇文章
引用这篇文章
李芳,刘军,郭旭东。等等。基因组调查,表征和BZIP转录因子的表达分析藜藜麦.BMC植物杂志20.405(2020)。https://doi.org/10.1186/s12870-020-02620-0-
已收到:
公认:
出版:
关键词
- 藜麦(藜藜麦)
- Bzip转录因子家庭
- 系统发育分类
- 进化分析
- 基因表达模式