摘要
背景
本研究描述了一种了解艾滋病如何适应极端盐水条件并鉴定具有更大抗性的人群的有希望的方法。图像和颜色分析能够获得许多图像参数并区分植物中的不同方面,这使得它们与遗传分析结合研究植物耐受性。据我们所知,通过非破坏性方法监测嗜睡植物的出版物,用于鉴定属于不同母体盐度环境的植物之间的差异。目的是评估图像分析作为非破坏性方法和主成分分析(PCA)的能力,以识别两个的多个响应美国欧洲种群,并确定哪个种群受不同盐度处理的影响最大,作为选择的初步模型。
结果
图像分析有利于检测两种表型变异性美国欧洲通过形态学和颜色参数、分形维数(FD)、投影面积(A)、茎高(H)、分枝数(B)、茎直径(S)和颜色变化(ΔE)对各居群进行了分析。S与脯氨酸含量和ΔE呈显著正相关,与叶绿素含量呈显著负相关。这些结果表明,脯氨酸和ΔE与植物多肉性密切相关,而叶绿素则随着多肉性的增加而降低。FD与过氧化氢(HP)呈负相关,说明在盐胁迫下,植物体内HP含量增加,导致植物复杂性降低,叶片生长减少。主成分分析结果表明,应力越大,差异越明显。在400 mM处,析因评分之间的距离较短。遗传变异分析为这些群体间的差异提供了证据。
结论
该方法有利于评价盐胁迫下盐生植物的发育情况。FD、S、ΔE是厂房建筑的相关指标。主成分分析表明,人为盐渍植物对盐胁迫的耐受性更强。此外,随机扩增多态性DNA分析为确定两个种群间的遗传变异模式提供了一种快速的方法,并为两个种群间的遗传差异提供了证据。
背景
盐度如今是一个重要的环境问题令人不安的植物生长。它已被[17土壤盐分对农业生产有负面影响,特别是污染自然资源,影响生态系统的平衡。与此同时,Nelson和Mareida [41.]报告说,由于高含盐量,超过1000万公顷的灌溉土地被排除在生产之外。因此,盐生植物在盐胁迫下具有较好的生长机制,有利于盐渍化土壤的生物修复,具有较好的盐适应能力。盐生植物的研究,如蓬子欧洲公司可以帮助我们了解这类植物如何适应盐碱地的极端条件,并选择那些最适应的。Salicornia属于藜科是最耐盐的基因型之一,能够在高盐排水条件下生长。有研究报道,在100 ~ 400 mM NaCl下,它的生长和净光合速率受到了刺激而不是抑制[6,20.,33].但是,在高端盐度条件下,Salicornia体验其生理学,细胞形态和生物化学的修饰。盐胁迫的生物学效应是非常不同的,并且可以包括形态学变化,例如高度,投影区域,芽增厚,植物分支和叶子复杂性的变化。由于影响营养损失,生物质和水分平衡的降低的光合作用,它们还可包括植物颜色改性40].在该属的少数可用的形态特征欧洲公司,大多数在物种中非常有变化,可能归因于不同环境条件下的高水平的可塑性或生物适应[38].Piernik进行的一项实地实验[43.],用游标卡尺测定茎高和人工鉴定茎数,揭示了不同土壤盐碱度下种群间的形态差异。Hairmansis等人[21[开发了一种表型图像分析作为监测盐度应力下水稻特征的非破坏性技术。得出结论,图像分析具有从图像获得几个参数的能力,并在盐压力的不同方面之间区分,使其成为生理研究的合适工具。还表示,与遗传分析相结合的图像分析是解释影响植物盐度耐受性的主要过程的有用方法。在这种情况下,最近的研究一直在寻找简单,准确和非破坏性的方法来评估非生物压力源如何影响植物的生长[7,19,30.,32].关于工厂架构,分形维数已被证明是一个良好的指标,用于分析由于盐度的植物叶子变化。一些研究通过计算分形维数来分析植物的不规则性[18].因此,该参数在植物树叶结构的研究中具有相关性,因为它可以描述植物在非生物压力源下物理适应的方式,以及用作植物生物量的预测因子[11,25].通过图像分析技术进行植物颜色研究已被用于其他研究的不同目的。karcher和richardson [26]通过图像分析来量化草坪草的颜色,以便在草坪之间进行比较。Ma et al. [34利用图像预处理技术对叶片图像进行颜色分析,识别大豆叶片缺氮和过量氮含量。然而,据我们所知,还没有发表过使用颜色分析作为评价植物盐胁迫的指标的研究。
当植物暴露于高盐度时,它们会引起降低的气孔导度作为一种战略机制,以减少盐离子的净吸收并保护植物中的水,从而导致芽的培养基增稠[10].较低的气孔电导机制导致在同一时间同时产生反应性氧物质(ROS)2固定作用减弱,导致光合作用减弱,这反映在叶绿素含量降低导致植物色素的变化。的能力Salicornia处理盐胁迫可能与清除活性氧如O2H2O2哦[37,48.].到目前为止,大多数研究通过破坏性和缓慢的筛选技术测试了植物盐适应,以测量不同的形态特征。因此,这些常规技术不适合于在盐胁迫期间植物生长中的原位动力反应测量。但是,实时采样可以在现场条件下进行。表型图像分析中的最新进展已经强调植物盐度随时间的非破坏性评价,这允许在不影响整个工厂的情况下测量和形态测量的植物生物质测量。21,24].目前尚无利用非破坏性方法监测盐生植物的研究成果,特别是对不同母盐环境下的植物进行鉴别的研究。因此,在本研究中,我们旨在评估非破坏性方法的能力,如图像和颜色分析,分形维数作为定量衡量植物在盐度下的发育和复杂性,以及主成分分析(PCA)识别两个响应的多重能力美国欧洲来自不同盐度点的种群。本文的目的也是确定哪些是受不同盐度处理影响最大的,作为从每个样品中选择的初步模型,因为假设非破坏性方法能够有效地确定是否美国欧洲来自不同地点(自然地点和人为地点)的种群对盐度的适应能力不同。
方法
植物材料、生长条件和盐处理
土壤样本美国欧洲种子是在波兰的天然盐碱地和工业盐碱地两个地点采集的。第一个地点是Ciechocinek (C)(52°53′n, 18°47′e)疗养胜地的天然盐水。这个地方的天然盐度与泽克斯坦盐层的盐泉有关[44.].第二个地点位于Inowrocław-Mątwy (I)镇(52°48′n, 18°15′e)的一家汽水厂附近,该地点的盐度与汽水生产的废物有关[45.,47.].第一个地点的特点是土壤含盐量高加利福尼亚州100ds /m (~ 1000mm NaCl) [47.,50.],这种类型的土壤盐化描述为氯化物(Cl−:所以42−与主要阳离子> 2.5):Na > >钙>镁> K和阴离子:Cl > >4 > HCO3.[44.].第二个部位的特点是盐度较低加利福尼亚州55ds / m(〜550 mm NaCl)[47.,50.].土壤盐度的类型也是氯化物,阳离子占优势:Ca> Na>> Mg> K和阴离子:Cl >>4 > HCO3.[44.].C点和I点之间的距离约为50公里,两者似乎彼此相当孤立。美国欧洲种子于2018年10月收集,并使用稀释水(30%)的漂白剂消毒。然后种子在培养皿(Ø 7厘米)的生长室中,用一张滤纸和5毫升蒸馏水发芽。种子发芽后,分别种植在高5.3厘米、直径5.5厘米的花盆中,并以1:1的比例在蛭石和沙子的无菌基质中,每花盆有一个实验单位,每盐处理12棵幼苗。种植前,每组12个花盆放置在单独的不排水的托盘上,用0、200、400、800和1000 mM NaCl溶液(12个花盆用基材加500 ml溶液)使其充分饱和[46.].植物在生长室中生长,白天/夜(25/20°C)光子通量密度为1000mmol m˗2年代˗1,相对湿度50-60%,光周期16/8 h(光/暗)。通过将蒸馏水倒在托盘中灌溉幼苗达21天。然后每2天用等量的霍格兰溶液浇灌30天,以确保盐度和营养供应的均匀性。共培养120株(12株× 5个处理× 2个群体),因此,采用完全随机设计和析因设计25共120个样本(12个植物× 5个处理× 2个群体),12个响应变量。在发育2个月后,对12个样品的形态和颜色参数进行估计,同时每3个重复测定脯氨酸、过氧化氢、叶绿素和类胡萝卜素的含量(随机选择)。该植物材料的代用标本已保存在尼古拉·哥白尼大学的一个公开的植物标本室Toruń(标本室索引代码TRN),沉积编号不详。(hab博士。Agnieszka Piernik教授承担了植物物种的正式鉴定工作,并获得了Bydgoszcz环境保护区域主任WPN.6205.159.2014提供的种子研究许可。逗留一番,WPN.6205.69.2015。逗留一番,WPN.6205.44.2016.KLD)。
形态学和颜色分析
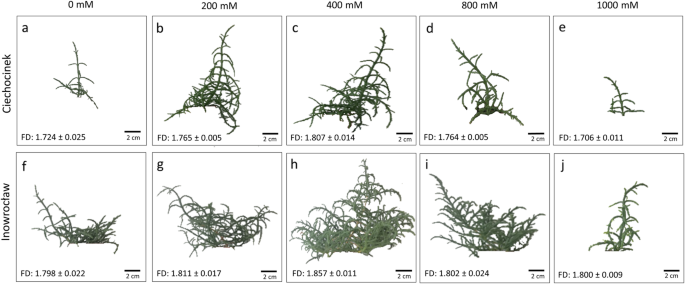
这些植物的大小和形状通过索尼数码相机(13mp, f/2.0, 1/3″,1.12 μm,焦距3.79 mm,自动对焦)获得的图像进行了表征。2个月后,样品从锅(整个植物)被放置在一个摄影灯箱PULUZ(中国HITSAN PU5060)配备两个30 W、5500 K集成LED灯可以软化和反射光线,消除眩光,而箱壁材料作为照明扩散产生均匀的样品。相机放置在距离样品50厘米的位置,并使用相同的光线和距离条件来捕捉植物的地上部分。对C和I种群,每次处理12次,捕获图像。图像在RGB中获取,存储在。TIFF格式为4160 × 3120像素。将图像转换为灰度图像,然后通过人工分割(阈值从135到240)将单个植物裁剪后的灰度图像转换为二值图像。最后,从二值图像中得到植物的形状和大小。图像分析的所有步骤均在ImageJ v. 1.47软件(美国国立卫生研究院,Bethesda, MD)中进行。投影面积(A)是通过边界内的像素数计算出来的,而拍摄直径(S)是通过拍摄中间段两个极端之间的水平距离来确定的。 The number of branches (B) was obtained through the total count of branches per individual, and shoot height (H) corresponds to the distance from the base to the apical part. Furthermore, fractal dimension (FD) was used to evaluate the structural shape of growth, and has been used to analyse the complexity of biological samples in many studies [12,13].在本研究中,通过ImageJ中的分形框计数插件评估FD,其中更高的FD值对应于复杂图像。值在1和2之间,值接近1,表示低不规则性,而近2的值表示更不规则或分形的植物结构,这意味着植物倾向于更有效地填充双维空间。
根据Cárdenas-Pérez等的方法对植物盐处理过程中的颜色变化进行了分析。14].以前的研究得出结论,CIELAB空间适用于对生物样品颜色的分析[35].完整的植物图像(无根)被用来评估每个植物的颜色变化。将植物芽图像上的像素值转换为CIELab坐标a*(绿色到红色)、b*(蓝色到黄色)和L*(光度)。使用转换插件将RGB转换为CIELab (Illuminant D65)。用公式计算总色差(ΔE)1:
where ΔL = L*-L0*;Δ= * -0*,ΔB= B * -B0*;初始颜色参数对应于不加盐处理(0 mM)的对照植物的颜色值。
对于不同处理和群体之间的颜色比较,ΔE参数被认为是一个有用的描述参数,以评价每个植株的颜色的完全差异。一个附加的图形文件显示了此处进行的图像分析的图表[参见附加文件]1].
生物化学分析
亚伯拉罕等人测定了植物中脯氨酸含量(P) [1].在冰上粉碎新鲜干材料(500mg)并在砂浆中均化,用3%硫磺酸水溶液(5μl/ mg新鲜植物材料)。将匀浆在4℃下以18,000×g离心,10分钟,收集上清液。将反应混合物由100μl3%硫磺酸甲酸,200μl冰醋酸,200μl酸性茚三酮试剂和100μl上清液组成。如Bates等人所述制备酸性茚三酮试剂。[8].基于脯氨酸的标准曲线在0至40μg/ mL的浓度范围内测定P.标准曲线方程为Y = 0.0467x - 0.0734,R2= 0.963。磷以每克鲜重脯氨酸的mg表达。
过氧化氢(HP)水平的测定方法由Velikova等人描述[51.].茎组织(500 mg)用5 ml 0.1%的三氯乙酸(w:v)在冰浴中均质。匀浆离心(12,000 × g, 4°C, 15分钟),上清液0.5 ml加入0.5 ml磷酸钾缓冲液(10 mM, pH 7.0)和2 ml 1 M KI。在390nm处读取吸光度,HP含量在0 - 40mm的标准曲线上给出。标准曲线方程为y = 0.0188x + 0.046, R2= 0.987。HP浓度以nM / g鲜重表示。
在黑暗中使用80%丙酮从新鲜植物茎(100mg)中从新鲜植物茎(100mg)中萃取叶绿素(CH A和CH B)和类胡萝卜素,然后以10,000rpm,10分钟离心。上清液定量分光光度法。在646,663和470nm和方程中测定吸光度2,3.,4根据Lichtenthaler和Welburn用于计算[31当80%的丙酮用作溶解剂时。总叶绿素含量计算为叶绿素A和B含量的总和。
DNA提取和RAPD分析
一种互补的遗传分析被开发作为鉴定遗传变异模式的初步尝试的一部分美国欧洲种群,每个种群共30个个体,在实地“原位”取样。采用随机扩增多态性DNA (RAPD)指纹图谱方法,是目前研究遗传变异模式最快、最简单的方法。根据之前的研究报道,我们随机选择了三种引物进行分析:K01 (5 ' -CATTCGAGCC-3 '), M02 (5 ' -ACAACGCCTC-3 ')和OPB11 (5 ' -GTAGACCCGT-3 ') (Operon Technologies Inc.) [28,36].
用CTAB法从100 mg冰冻组织中提取DNA,提取缓冲液1 ml (CTAB-buffer 20 mg/ml, TRIS-HCL 0.1 M pH 8, NaCl 1.4 M, EDTA 20 mM pH 8和0.5% β-巯基乙醇)。随机扩增多态性DNA分析进行25μL总量包含2.5μL的缓冲区(1.5毫米MgCl2的最终浓度),0.5μL的核苷酸每个核苷酸(0.2毫米),0.5μL底漆(0.1μM)和0.625μL Taq DNA聚合酶(0.65 U) (Eurx、分子生物学产品)和30 ng的DNA。利用自动热循环仪,将RAPD-PCR分为94℃变性1 min, 34℃退火1 min, 72℃延伸1 min,共35个循环。RAPD片段经1.5%琼脂糖电泳分离,紫外可见。通常出现在每个种群中的条带被定义为单形条带。相反,在植物个体中出现或消失的条带则被认为是多态条带。
统计和多变量分析
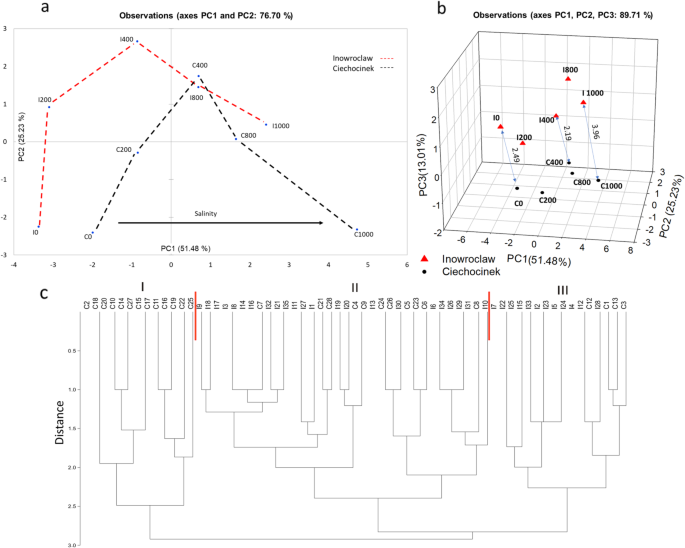
为了确定植物中盐处理效果的投影,使用XLSTAT软件版本2019.4.1进行了主要成分分析(PCA)[52.].采用12个变量(投影面积A、分枝数B、茎粗S、株高、脯氨酸P、过氧化氢HP、叶绿素A Cha、叶绿素B Chb、总叶绿素TC、类胡萝卜素Carot、分形维数FD和总色差ΔE),用从每个处理和种群的重复中得到的平均值排列在一个矩阵中。采用Holm-Sidak方法,使用SigmaPlot软件11.0版本对所有结果进行了双向方差分析,比较了群体内处理和群体内处理[49.].变量之间的关系采用Pearson分析,同时采用显著性检验(Kaisere Meyere Olkin),以确定哪些变量之间具有显著相关性(α=0.05)。然后,根据Kaiser准则,利用三个主成分因子绘制了三维图,该准则表示单元以下的因子是无关的。每个样本PCA的阶乘评分被用来计算在相同处理P下两个点(人群)之间的距离(D)1x = (1y1, z1)和P.2x = (2y2, z2)在三维空间的主成分分析(方程5).
x2y2和z.2是PCA中的三个主要因素评分对应于I和C.中的评估治疗。距离用于评估和确定盐处理群体之间的差异最大。
对于RAPD分析,过去4.0软件用于对Jaccard的系数作为具有算术平均(UPGMA)的相似性测量和未加权对组方法进行分层附聚类分析,用于树木结构的算术平均值[22].
结果
分形维数是衡量不同盐度下植物生物量的指标
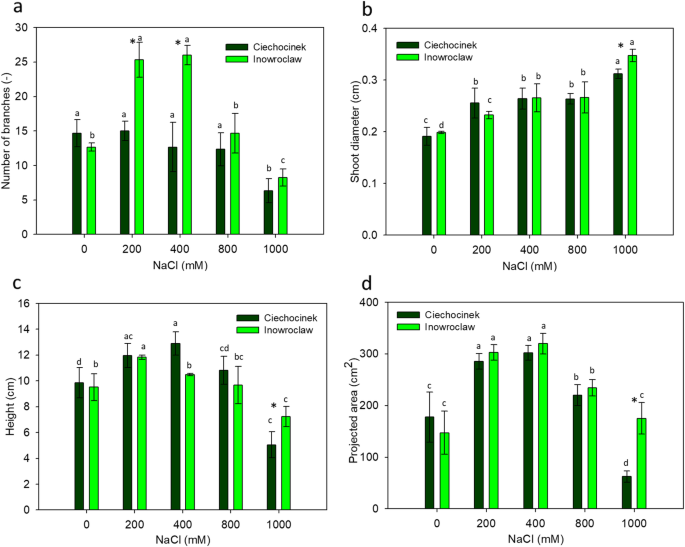
本研究显示了形态学特征美国欧洲在中等盐度(200和400 mM NaCl)下Ciechocinek和200、400和800 mM NaCl下Inowrocław表现出正效应,而在极端盐度(0和1000 mM)下则表现出生物量的下降。总体而言,I种群的生物量产量高于C种群(图2)。1).分形维数(FD)可定量表征植物构型的自相似特性,C和i的自相似度最大,为400 mM。两个种群的FD值在0 ~ 400 mM处理之间存在显著差异,C和I分别增加了4.81和3.28%。此外,在两个种群之间发现了显著的差异。
盐度处理中的形态测定分析
每个种群在叶片扩张方面表现出不同的行为,这与两个种群在200和400 mM处理范围内枝条数量的显著差异有关(图4)。2一种)。另一方面,投影区域和高度在两个人口中显示了200至400毫米的NACL之间的最高值,如图所示2c和d。在NaCl为1000 mM时,两个群体在茎粗、高度和投影面积上存在显著差异(图2)2B,C和D)。
增长评估的颜色分析
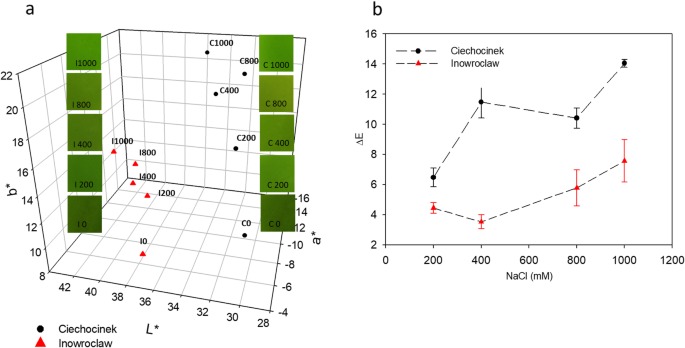
在测定期间观察到颜色变化,有趣的是,在0 mm和1000mm的植物之间观察到显着差异(图。3.).关于L *值,0至1000mm NaCl的处理在I中的含量增加10.91%,C的含量增加了10.91%。A *和B *值分别显示出降低和增加的证据,在不同的盐处理之间。这反映在从处理0至1000mm处理的A *和B *值的变化中,其逐渐降低66.77%,B *升高60.58%,并且a *减少98.19%和b *增加97.36C的%(图。3.一种)。ΔE值(图。3.b)表示0 mM和盐处理下样品之间的差异。如预期,在200 - 1000 mM范围内,ΔE在盐梯度I和C下分别增加了70.11%和117%。从这个意义上说,C种群比I种群显示出更高的ΔE增长率。
形态学,颜色和生物化学分析之间的关系
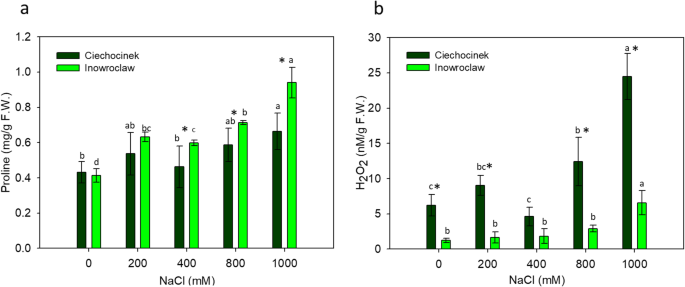
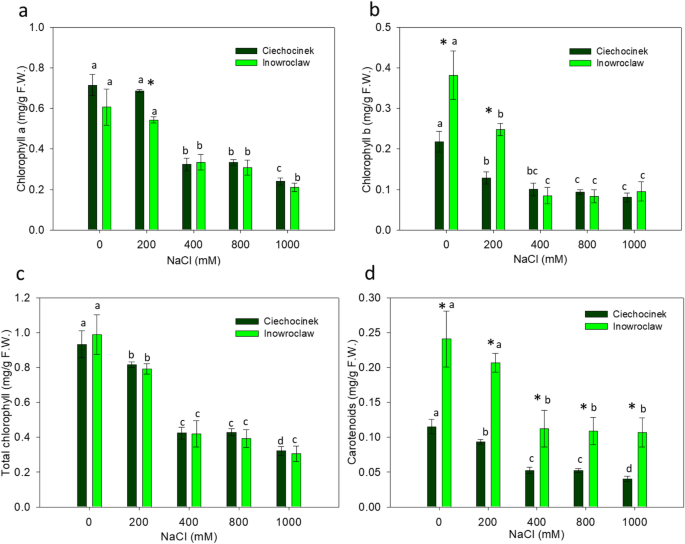
p显示盐度梯度的增加(图。4一种)。结果表明,与盐胁迫下的C人群相比,P群体中P显着高,主要是400,800和1000 mm。同时,HP增加仅在800和1000mM NaCl的群体中显着,仅适用于群体I的1000mM NaCl(图。4在NaCl胁迫下,两个群体的叶绿素a (Ch a)、b (Ch b)和类胡萝卜素(Carot)含量均显著降低(图2)。5).在0和200mm的CH A中,两种群体的叶绿素含量明显不同,在0和200mm处,在高盐度下没有显着差异(图。5叶绿素含量在两个种群间无显著差异,但类胡萝卜素含量有显著差异(图2)。5c和d)。
主成分分析(PCA)对两者的分离进行评价美国欧洲人口
使用PCA对每个人群中的所有变量进行评估(图。6一种)。数字6A显示PC1和PC2图,精确描述样品的可变性(76.70%)。该曲线表明,对于盐水应力以及它们在PC1的负象限上,它们在PC1的正象限上通过PC1的正象限而言是最耐盐性的植物是最耐受的植物。结果也在3D图上分组(图。6b)根据其相似性通过三个主要因子分数(PC1,PC2和PC3),它描述了样品的可变性(89.71%),其中C植物更容易受到盐胁迫的影响。来自每个样品的PCA的阶乘分数用于计算P1 =(×1,Y1,Z1)和P2 =(×2,Y2,Z2)的相同处理的两个点之间的距离在PCA的3D空间中(图。6b)仅适用于极端和中度治疗(0,400和1000mm)。在三维直角坐标轴(x = PC1, y = PC2, z = PC3)上进行C0与I0 (2.49), C400与I400 (2.19), C1000与I1000(3.96)的对比,结果表明应力越大,分离越大。此外,在最佳点(400mm)观察到较短的距离。
随机扩增多态性DNA(RAPD)
50的RAPD分析 美国欧洲利用K01、M02、OPB11引物扩增出15条多态性条带。分析结果表明,M02和OPB11引物的多态性条带数最高(6条),K01引物的多态性条带数最低(3条)。最后,RAPD分析显示了研究群体之间的关系,用非加权对组方法与算术平均数(UPGMA)树状图表示(图)6c). II组和III组样品中存在非典型条带,而I组只对应c组(28个样品中有13个)。
讨论
较高的FD值对应植物复杂而不规则的生长模式,因此对应广泛的主要分枝指数,以及最优生长空间的优化[5,15],这导致适应的机制,以支持图中所示的应力1.FD结果与Karamchedu的结果一致[25]的研究发现,植物光合效率的最佳分形维数接近1.85,而Bayirli等[9研究FD在加拿大紫荆(Cercis canadensis L.)、刺槐(Robinia pseudoacacia L.)、树胶(Amelanchier arborea)弗纳尔德结果表明,基于表面密度函数的FD可作为植物分类研究的新途径。这些测量给出了植物生长和分形结构的总体定量程度。分形分析是描述和预测多尺度生态格局的有效工具。因此,我们的结果证实,分形分析作为植物进展的衡量是一个有用的非破坏性工具,用于数值和简单估计分枝植物的生物量和复杂性模式[5它能够识别两个群体之间不同的发展模式。
因此,FD可以有效地衡量两个种群之间的消极和积极的发展效应美国欧洲在不同盐度下。I种群的FD值最高,特别是在最高盐度处理时,FD值相差5.5%,而两个种群在400 mM处FD值最大(~ 1.850)。根据形态学评价的图像分析结果,美国欧洲群体似乎具有相似的行为来应对盐度。然而,它们之间的差异在每种盐处理中非常可见,例如在I群体中出现较高的分支,枝条,枝条和投影区域,特别是在最高盐度处理(1000mm)。此外,I群体具有所测试的所有形态参数的最高值,其中投影区域显示约173%的最高差异。因此,作为非破坏性方法的图像分析能够识别在研究中的两个人群之间的差异。
这项工作的新颖之处在于,它证明了用图像分析可以比用视觉方法获得更精确、准确和更快的结果。例如,可以观察到拍摄直径在两个种群随盐度(一个细节可能会很难获得使用一个简单的视图),这意味着这个值也可以被用作一个被估计的参数的盐度在植物生长的环境。I的茎粗比C高11.2%。2b).本研究的形态测量结果与Piernik报道的结果一致[43.,他在实地试验中证明了这种植物的生长状况较差美国欧洲在较低的盐度(〜20mm NaCl),比家庭区(〜200毫米NaCl)。实验增长最优美国欧洲被描述为300 mm NaCl [39],在38 dS/m (~ 380 mM NaCl)条件下[44.],这也反映了这项研究的结果。此外,Szymanska等。[50.]报告了调查种群间的原位差异。形态测量参数通过游标卡尺手工检测,差异与环境条件和特定的微生物群有关。我们的结果证明,在控制条件下,即使考虑到不同的盐度水平,差异仍然是相同的。我们的假设是,来自高盐度母本的种子的遗传结构不利于过度生长,尽管必须进行进一步的遗传分析来证实这一假设。El-Keblawy等[16]评估母体盐度环境如何影响耐盐性AnaBasis Setifera.沙漠盐土植物。他们发现,在高盐碱地采集的种子比在非盐碱地采集的种子萌发和耐盐性显著降低,他们将这归因于从盐碱地采集的种子活力较低。与以前的研究比较[43.,50.,而非破坏性方法则以更有效和准确的方式提供了差异的证据。
作为互补的非破坏性方法的颜色分析可用于证实盐度影响光合色素含量欧洲公司。由于缺乏叶绿素,L *参数的变化可以与植物中的暗绿色变为亮绿色的变化相关联。根据有关颜色变化的某些研究[23], b*从+b*黄色方向;提及时谨提及b*蓝色方向,因此较高的b*值与叶绿体中高水平的叶黄素和叶绿素缺失有关。相反,a*值为负表示样本在绿色区域,a*值为正表示样本在红色区域。所有这些变化都是由于盐度影响光合色素,植物的深绿色减少,而淡绿色增加的结果。与C相比,I种群的ΔE较低,在最高盐度处理下,两种群间的差异为85.46%。这些结果与叶绿素和类胡萝卜素分析有关,这些分析显示随着盐度梯度的降低。
结果表明,盐度对C族色素的生物合成影响较大。Witzel(2018)认为ΔE值在5以上说明色差是人眼可以感知的,这是彩色图像分析作为一种无损方法定量评价表型变化的重要特征。因此,我们的假设,非破坏性方法(FD,图像和颜色分析)能够识别不同处理的种群之间的差异得到了证实。
关于脯氨酸的研究结果,我们已经知道脯氨酸是一种渗透调节剂、酶变性保护剂和大分子组装稳定剂,可以从环境中保留额外的水分。这是通过肉质增加使水势降低而观察到的[4,29,这可以通过图像分析的物理观察到。我们的结果与Akcin和Yalcin的研究结果一致[4, Aghaleh等人[3.和Aghaleh等人[2] 为了美国欧洲.两种群体之间HP含量的激烈差异可用于证实哪个更耐盐。据Kong-Ngern等人说。[27],耐盐品种的过氧化氢含量比盐敏感品种低,本研究表明C比I更敏感。
两种群体的叶绿素含量在低盐度下显着差异,而在高盐度下没有显着差异,其通过颜色分析得到了我们的研究结果。从这个意义上讲,重要的是要注意,CH B型是调整叶绿体的适应性特征,而高CH B含量产生由叶绿体吸收的波长范围的增加,这归因于植物时适应模式受到一些非生物压力源的[42.].在本研究中,在0-和200 mm处理下,I群体的chb含量显著高于C群体。
在PCA中,可以观察到,在不同的盐处理下,两个种群都有相似的趋势,在400mm处都表现出良好的适应能力(见表)1).然而,I种群似乎能更好地应对盐度,因为在1000mm以下它的行为类似于在800mm以下的C,而在800mm, I在400mm以下的行为类似于C。这表明种群I在高盐度下受影响较小。然而,根据Szymańska等人[50.较高的活性美国欧洲来自盐碱地的内生微生物(C)增加了根系的生物量,较高的微生物种群密度影响了植物上部形态的差异,如较短的枝条长度和一级侧枝的数量。
研究参数之间的相关性结果非常有趣,有些以前没有报道过,特别是脯氨酸与茎粗之间的正相关(0.840)(表1).此外,FD和HP之间的负相关也是一个有趣的发现,这一结果表明,当植物在盐胁迫下,HP增加,这反映在植物复杂性或叶结构的降低。此外,植株的S(枝条直径越大,植株肉质越好)与叶绿素含量(Cha、Chb和TC)呈高度负相关,即叶绿素含量越高,肉质越低。高盐度下的植物由于气孔导度较低,易于储存更多水分,从而导致茎粗增加,同时光合色素受到光抑制而减少。S与ΔE呈高度正相关。生化分析结果与形态分析,特别是FD和颜色分析结果一致,表明这些描述符是评价植物在盐胁迫下生长的有效方法。这些描述符也可以在现场或实验室中作为一种非破坏性、经济和可靠的测试来证实工作的假设。
结果在图6a允许可视化种群耐盐性,以及两个种群如何在二维空间中移动,其优点是考虑了PCA中的所有估计参数。这部分证实了我们的假设,即相同的不同种群美国欧洲不同物种对盐度的适应可能不同。此外,析因评分有助于证明在最高盐度下I和C参数之间的最高分离,这表明C在该盐度下有更多的修改。
RAPD分析结果显示,引物K01、OPB11和M02的多态性条带数最高,分别为3、4和5条。同时,同一引物在C群体中有2条、4条和4条多态性条带。这提供了种群间遗传差异的证据,可能是对盐度不同反应的原因。然而,由于RAPD目前被认为是一种首选的指纹技术,因此必须进行更深入的分子分析,如扩增片段长度多态性指纹图谱或基于下一代测序的方法,以获得适当的遗传变异和不同基因表达的分析。
结论
这项工作表明,图像分析在评估盐度 - 生长响应方面是有效的美国欧洲是一种无损、简单、经济的方法。此外,FD可以很好地指示植物叶片的整体发育,并能识别种群间和盐处理间生物量生产的差异。这种非破坏性方法是定量描述植物结构复杂性的有效方法。颜色分析也是确定两个种群间差异的有效方法。此外,通过图像分析分析茎直径本身就可以很好地指示肉质和盐度,这两者都是很难用肉眼检测到的。
生物化学分析证明,非破坏性方法提供了足够量的准确结果而不损坏植物,如Pearson相关性所证实的,这突出了非破坏性和常规参数之间的关系。PCA提供了证据表明,人为盐水栖息地的植物更耐盐胁迫。RAPD提供了一种快速方法,用于确定与图像分析很好地相关的两个群体之间的遗传变异模式。根据我们整体的分析,很明显,我们的应用方法能够证明这两者美国欧洲人群确实具有不同的盐适应机制,以及在中等盐水下的阳性生长效应。这些结果可用于未来选择抗性植物。
用非破坏性方法获得的现有结果是在盐抵抗植物的研究中进行了新颖,这意味着研究人员可以应用于未来与植物盐度开发反应有关的未来实验的这些直接的,低成本,准确和快速的方法。
可用性数据和材料
在当前研究期间使用和/或分析的数据集可从合理的请求上从相应的作者获得。
缩写
- 答:
-
投影面积
- B:
-
分支数量
- C:
-
Ciechocinek
- 胡萝卜:
-
类胡萝卜素
- CH A:
-
叶绿素A.
- Ch b:
-
叶绿素B.
- DNA-RAPD:
-
随机扩增多态性DNA
- FD:
-
分形维数
- H:
-
拍摄高度
- 惠普:
-
过氧化氢
- 一世:
-
Inowrocł啊
- 病人:
-
脯氨酸
- 主成分分析:
-
主成分分析
- ROS:
-
活性氧
- TC:
-
总叶绿素
- 史:
-
拍摄直径
- ΔE:
-
颜色变化
参考文献
- 1.
徐志强,李志强,李志强,等。植物中脯氨酸含量的测定方法。出自:Walker JM,编辑。分子生物学方法:施普林格;2010.317 - 31页。
- 2.
盐胁迫对番茄幼苗生长、色素、蛋白质和脂质过氧化的影响蓬子persica和美国欧洲.BIOL植物。2009; 53(2):243-8。
- 3.
Aghaleh M,Niknam V,ebrahimzadeh h,以及Razavi K.两种体外培养的Salicornia物种中的抗氧化酶,响应盐度的增加。Biol Plant 2014;58(2):391-394。
- 4.
盐胁迫对海蓬子叶绿素、类胡萝卜素和脯氨酸含量的影响。Suaeda prostrata pall。无性系种群。prostrata(苋科)。Braz J Bot. 2016; 39:101-6。
- 5。
Alados CL, Escos J, Emlen JM, Freeman DC。分支复杂性的分形分析。植物学报,1999;160(增刊):S147-55。
- 6.
植物耐盐性的一些重要生理选择标准。植物生态学报。2004;19:361 - 76。
- 7.
植物叶片分类与识别技术综述。电脑。2019;八4。
- 8.
Bates LS,Walderd RP,Hinde ID。快速测定水分胁迫研究的自由序。植物土壤。1973年; 39:205-8。
- 9.
刘志刚,刘志刚,刘志刚,等。植物叶片分形维数的分形研究。植物学报。acta botanica yunnanica(云南植物研究). 2014;43(3):275-83。
- 10.
Benjamin JJ, Miras-Moreno B, Araniti F, Salehi H, Bernardo L, Parida A, Lucini L.蛋白质组学揭示了盐生植物对盐度的不同响应碱蓬maritima(l)杜莫和海蓬子。植物。2020;9:227。
- 11.
基于细胞分辨率的植物形态发生三维力学模型的计算框架。11:e1003950。
- 12.
Camacho-DíazBH,Aparicio AJ,Chanona-PérezJJ,Calderón-DomínguezG,艾拉米拉 - BeltránL,Hernández-Sánchezh,Gutiérrez-LópezGF。固体培养基中Rhizopus Oligosporus的生长前面的形态学特征。J Food Eng。2010; 101(3):309-17。
- 13.
Cárdenas-Pérez S, Chanona-Pérez JJ, Méndez-Méndez JV, Calderón-Domínguez G, López-Santiago R, Arzate-Vázquez I.苹果组织和分离细胞的纳米压痕研究,图像和分形分析。创新食品科学新兴技术。2016;34:234-42。
- 14。
Cárdenas-PérezS,Chanona-PérezJ,Méndez-MéndezJV,Calderón-DomínguezG,López-SantiagoG,Perea-Flores MJ,Arzate-Vázquez,I.通过计算机评估苹果(金色美味)的成熟阶段视觉系统。Biosyst Eng。2017; 159:46-58。
- 15.
Corbit JD, Garbary DJ。分形维数作为植物发育复杂性的定量度量。中国生物医学工程学报。1995;262(1363):1-6。
- 16。
El-Keblawy A,Gairola S,Bhatt A.母体盐度环境影响萌发期间的耐盐性AnaBasis Setifera.:一个伴随的沙漠哈菲特。J干旱的土地。2016; 8(2):254-63。
- 17.
联合国的粮食和农业组织,可提供:http://www.fao.org/soils-portal/soil-management(2019年11月访问)。
- 18.
TIPS:一种基于图像的玉米穗自动表型系统。工厂方法。2017;13(1):1 - 12。
- 19.
Golzarian MR, Frick RA, Rajendran K, Berger B, Roy S, Tester M, Lun DS。从谷物植株高通量图像中准确推断茎生物量。工厂方法。2011;2。
- 20.
(2)咸菜灌溉技术的可行性研究(蓬子bigelovii.Torr)与超盐水排水水。J环境QUAL。2008; 37:S149-56。
- 21.
作者简介:刘志刚,男,博士,主要研究方向为生物医学工程。基于图像表型的水稻耐盐特性无损筛选。大米。2014;16。
- 22.
哈默Ø,哈珀·DAT,瑞安警局。过去:用于教育和数据分析的古生物统计软件包。Palaeontol电子。2001;4(1):1 - 9。
- 23.
itle ra,kabelka ea。南瓜和南瓜中实验室色空间值和类胡萝卜素含量的相关性(Cucurbita SPP。)。Hortic SCI。2009; 44(3):633-7。
- 24.
Jansen M, Pinto F, Nagel KA, Dusschoten D, Fiorani F, Rascher U, Schneider HU, Walter A, Schurr U.非侵入性表型方法能够准确表征芽和根的生长和性能。出自:Tuberosa R, Graner A, Frison E, editors。植物遗传资源基因组学。Dordecht:荷兰施普林格;2014.p . 173 - 206。
- 25.
利用植物图像的分形维数比作为植物生物量的异速生长预测因子。美国俄勒冈州波特兰市耶稣会高中。国际地质遥感会议(IGARSS)。2016.
- 26。
Karcher DE, Richardson MD,草坪科学。作物科学。2003;43:943-51。
- 27。
Kong-Ngern K,Bunnag S,Theerakulpisut P.脯氨酸,过氧化氢,膜稳定性和抗氧化酶活性作为水稻耐盐耐药性的潜在指标(奥雅萨苜蓿l .)。中国生物医学工程学报。2012;8(2):54-65。
- 28。
Krügerm,Hellwig FH,Oberprieler C.天然耐盐植物的天然和肺结泡内陆群中的遗传多样性:ASTER三元石L.(Compositae)和Sal-Icornia Ramosissima Woods(Chenopodiaceae)的随机扩增多态性DNA分析。Mol Ecol。2002; 11:1647-55。
- 29.
张海峰,张海峰,张海峰,等。NaCl胁迫对真红树林氮磷代谢的影响工业parviflora水培栽培植物科学。2004;161:921-8。
- 30.
张丽娟,张丽娟,张丽娟,等。基于图像分析的植物根系发育的非破坏性、高通量表型研究。工厂方法。2014;10(1):1 - 16。
- 31.
不同溶剂中叶提取物总胡萝卜素和叶绿素a、b的测定。生物化学学报1983;603:591-3。
- 32.
Lien Mr,Barker Rj,Ye Z,Westphall Mh,Gao R,Singh A,Gilroy S,Townsend PA。用于自动成像的低成本和开源平台。植物方法。2019; 15(1):1-14。
- 33.
吕胜,蒋鹏,陈旭,范鹏,王旭,李艳艳。钠的多重区隔作用与耐盐性蓬子欧洲公司.植物理性生物化学。2012; 51:47-52。
- 34.
马丽,方军,陈勇,龚胜。大豆叶片缺氮和过量氮图像的颜色分析。《2010电子产品电子服务与电子娱乐国际会议论文集》,河南,vol. 11541023;2010.1 - 3页。7 - 11月。
- 35.
门多萨,阿奎莱拉。图像分析在成熟香蕉分类中的应用。食品科学。2004;69(9):471-7。
- 36.
D, Luković J, Dan M, Zorić L, Obreht D, Veselić S, Anačkov G, Petanidou tSalicornia人口:解剖表征和RAPD指纹识别。拱形Biol sci。2011; 63:4。
- 37.
非靶向代谢组学和活性氧清除活性揭示了其潜在的抗氧化能力蓬子有腕门作为功能性食品。功能性食品。2015;13:21-31。
- 38。
Moriuchi KS, Friesen ML, Cordeiro MA, Badri M, Vu WT, Main BJ, Aouani M, Nuzhdin S, Strauss S, Von Wettberg EJB。截形苜蓿的盐度适应和亲代环境效应的贡献。《公共科学图书馆•综合》。2016;11(3):-。
- 39。
摩尔科洛A,Panuccio Mr,Piernik A.生态,分布和生态学蓬子欧洲公司L.见:Khan MA, Böer B, Öztürk M, Al Abdessalaam TZ, Clüsener-Godt M, Gul B(编)Sabkha生态系统。第四卷:经济作物盐生植物与生物多样性保护,植被科学任务47荷兰:施普林格;2014.233 - 40页。
- 40.
Negrao S, Schmo SM。评价植物对盐胁迫的生理响应,1-11。安机器人。2017;119:1-11。
- 41.
CGIAR的环境影响:评估,Doc。不。德班:提交中期会议的特别提款权;2001.
- 42.
在:Papageorgiou G, Govindjee C,编辑。叶绿素荧光探测蓝藻中的水和溶质运输,在叶绿素a荧光:光合作用的一个特征。多德雷赫特:施普林格;2004.p . 663 - 78。
- 43.
Piernik A.在内陆盐水栖息地的盐度梯度沿着盐度梯度的三种草地种类的增长:移植实验。Pol J ECOL。2006年:117-25。
- 44.
中欧内陆盐沼植被的生态格局。托伦:中央大学出版社;2012.
- 45.
Piernik A,Kažmierczake,Rutkowski L.盐水草地植被的差异在Mątwy的牛排苏达植物附近。Acta Soc Bot Pol。1996年; 65:349-56。
- 46.
陈志强,王志强,王志强,等。耐盐内生细菌的研究进展蓬子欧洲公司对饲用甜菜生长的影响Beta寻常魅力在盐胁迫下。土壤学报,2017;63:1404-18
- 47.
王志强,王志强,王志强,等。盐碱工业对盐渍化土壤盐生植物生长的影响。土壤学报。2015;61:98-112。
- 48.
黄志强,王志强,王志强,等。盐生植物SbSLSP基因的克隆及表达分析蓬子有腕门通过维持膜的稳定性、K(+)/Na(+)比和抗氧化机制,赋予耐盐和耐旱能力。植物学报。2016;7:737。
- 49.
SigmaPlot Version 11 n.d..美国加州圣何塞Systat软件公司www.systatsoftware.com.
- 50。
Szymańskas,piernik a,baum c,złochm,hrynkiewicz K.与烟道相关的微生物的代谢谱蓬子欧洲公司在不同盐度的土壤中。Ecoscience。2014;21(2):114 - 22所示。
- 51。
Velikova V,Yordanov I,Edreva A.氧化应激和一些酸性雨处理豆植物中的抗氧化体系。外源多胺的保护作用。植物SCI。2000; 151:59-66。
- 52.
XLSTAT和Addinsoft是Addinsoft的注册商标。https://www.xlstat.com.
致谢
这项研究得到了波兰托伦尼古拉·哥奈尼克州的尼古拉·哥奈尼克州的研究资金。此外,康西特提供的一些财务支持(239899,268660)和IPN(20195198,20200506)项目,墨西哥的秘书园Posgrado。
资金
不适用。
作者信息
从属关系
贡献
SCP和AP采集土壤样品并开发栽培过程。AL、MD和ASJ参与了随机扩增多态性DNA分析实验。SCP执行了所有测试。SCP和AP生成了统计分析和树状图。SCP和JCP发展了分形和颜色分析。SCP准备了手稿。所有作者阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准和同意参与
这项研究是在波兰地区Dyrektor Ochrony Środowiska w Bydgoszczy的许可下进行的。WPN.6205.159.2014。逗留一番,WPN.6205.69.2015。逗留一番,WPN.6205.44.2016。KLD,对应于Ciechocinek土壤样品根据国家指南的许可。在Inowrocław土壤样品的情况下,不需要许可,因为这是一个苏打工厂地区。
同意出版物
不适用。
相互竞争的利益
作者声明他们没有竞争利益。
额外的信息
出版商的注意
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
补充信息
额外的文件1。
形态学和颜色分析的图像处理图欧洲公司。
权利和权限
开放获取本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信贷额度中另有说明。
关于这篇文章
引用这篇文章
Cárdenas-Pérez,S.,Piernik,A.,Ludwiczak,A。等等。图像和分形分析作为评估两者间盐度增长响应的工具蓬子欧洲公司人群。BMC植物BIOL.20.467(2020)。https://doi.org/10.1186/s12870-020-02633-8
收到了:
接受:
发表:
关键词
- 哈菲特
- 分形架构
- 色彩分析
- 形态测量学
- 基因分析