摘要
背景
众所周知,植物的非光合质体参与了一系列的代谢和生物合成反应,即使它们由于体积小和缺乏颜色而难以研究。根质体的形态是异质的,而且质体的大小、密度和亚细胞分布也因细胞类型和发育阶段而异,因此其功能特征一直不清楚。虽然根质体蛋白质组可能揭示特定的功能特征,拟南芥到目前为止,还没有关于根质体蛋白质组的研究。
结果
在本研究中,我们通过2D-PAGE将富含塑体和线粒体富集的拟南芥根蛋白质级分,并使用LC-MS / MS鉴定了84个体积靶向和77个线粒体靶向蛋白质。最普遍的根塑性蛋白类别代表氨基酸生物合成,碳水化合物代谢和脂质生物合成途径,而没有检测参与淀粉和蔗糖代谢的酶。线粒体靶向蛋白主要分为能量类别。
结论
这是第一个研究提出凝胶为基础的地图拟南芥根质体和线粒体蛋白质组。我们的研究结果表明,拟南芥根质体具有广泛的生物合成能力,但它们在碳水化合物的长期储存中并不起主要作用。蛋白质组学图谱为进一步研究比较蛋白质组学变化提供了工具,例如对环境信号的响应,并强调了根质体在氮和硫代谢以及氨基酸和脂肪酸生物合成中的作用。这一研究结果为整合根质体/线粒体蛋白质组和代谢功能迈出了第一步拟南芥根。
B.背景
质体是植物细胞的细胞器,在能量代谢、生物合成反应等代谢活动中起着多种作用。所有的质体类型都被双层膜包裹,它们包含若干个半自治的环状基因组,编码约100个蛋白质,这些蛋白质参与光合作用、转录和翻译。然而,绝大多数质体定位蛋白是由核基因组编码的。这些蛋白质在胞质核糖体上被翻译,并利用n端转运肽中隐藏的信息转运到质体中[1那2].转运肽选择性地与特定质体上的不同转位子组件相互作用,从而区分不同类型和/或年龄的质体[1那3.].细胞类型及周围组织与环境因素共同决定质体的发展方向[4.].
质体根据结构、(色素)组成和功能特性分为不同的组。最典型的质体类型是叶绿体,它在绿色组织中含量丰富。叶绿体是光合作用的场所,包含一个复杂的称为类囊体的内部膜系统,其中包含参与光合电子转移反应的大型色素-蛋白质复合物。花和果实含有着色体,其中含有丰富的黄色和橙色类胡萝卜素,而根(和其他非光合组织)含有白质,又可分为储存脂质的弹力体、含有结晶蛋白体的蛋白质体和储存淀粉的淀粉体[5.].叶绿体能够捕获光能,并将其转化为化学形式的ATP和还原性NADPH,而非光合质体依赖于外源糖磷酸盐和ATP的输入到质体。
非光合质体参与一系列的代谢和生物合成反应,如淀粉的生物合成[6.),类胡萝卜素(7.]和脂质[8.]以及氮的同化[9.].尽管某种塑性型的蛋白质组可能反映并揭示特定的功能特征,但是在非光合体积的蛋白质蛋白质中存在有限的数据。到目前为止,马铃薯块茎淀粉组织蛋白质蛋白质[10],小麦胚乳淀粉片淀粉样品[11那12],来自甜椒和甜橙果实的染色体[13那14],来自烟草细胞培养的未分化质体[15],水稻原生质体[16],和Medicago Truncatula.根叶绿体(17那18]目前还没有关于植物根质体蛋白质组的资料拟南芥.
在本研究中,我们采用了与大多数非光合质体蛋白质组研究相同的策略:富集根质体,用2d -凝胶电泳分离蛋白质,然后用凝胶内消解,用LC-MS/MS鉴定蛋白质点。10、11、17)。鉴定的蛋白质揭示了一个复杂的调节和代谢网络拟南芥根体积和线粒体,并使朝向根塑性/线粒体蛋白质组和根代谢功能的综合阶段。
结果
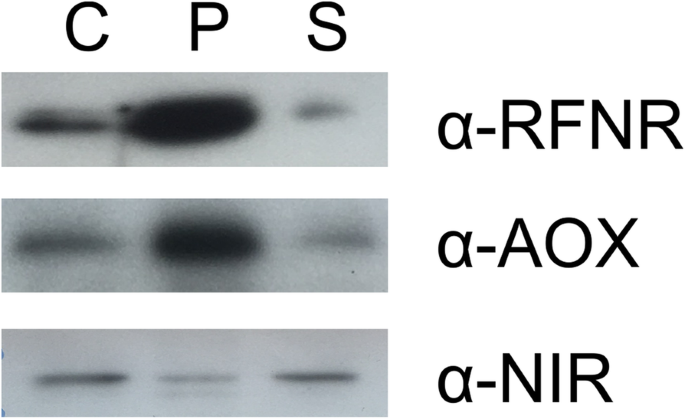
由于根质体尺寸小(根质体直径为1.8 ~ 3.0 μm,而叶绿体直径为5 ~ 10 μm)和缺乏颜色,一直以来研究根质体都很困难,因此它们的特征仍然很差[19].然而,研究表明,根质体的形态是非常不均一的,质体的形状(通常被描述为变形虫)、大小、密度和亚细胞分布取决于细胞类型和发育阶段[19].此外,根质体富含基质,基质中充满小管,可以连接不同的质体[20].由于线粒体(0.1-0.5 μm × 1-2 μm)的大小与根质体相同,因此,富含根质体的样品中也含有线粒体,但受到胞质蛋白的轻微污染就不足为奇了。1; 附加文件1:图S1)。这些污染物也经常在使用相同方法的其他研究中检测到[10那11那17].为进一步研究拟南芥根的白质和线粒体蛋白质组。
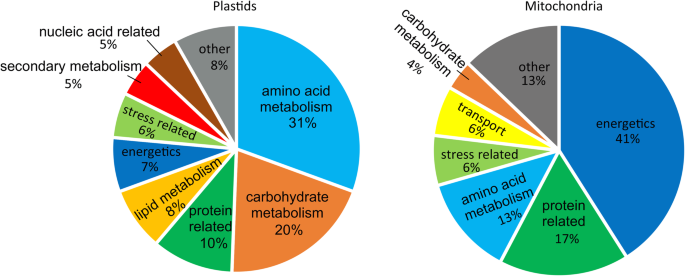
用pH范围从3到11的等电聚焦法分离细胞器根蛋白,然后用SDS-PAGE和Sypro Ruby染色发现139个不同的蛋白点,这些蛋白点可以在至少3个独立的生物复制物中被识别2:图S2)。我们选择的地点质/ MS分析基于以下标准:(i)三个生物复制的斑点清晰可见,(ii)斑点分离邻近点,和(3)点并不太大,密集,因为这些地方通常包含大量不同的蛋白质。低分子量蛋白斑点被排除在外,因为它们通常不能提供足够的肽段用于蛋白质鉴定。此外,还选择了一些分子量相同但pI不同的点(如Additional file中的1 - 4,6和7-9)2:图S2 A),因为我们想看看这些斑点是否表示不同的同种蛋白质。以高置信度鉴定并表示至少3个肽,预期分子量和等电点(基于序列的预测)鉴定的蛋白质在附加文件中呈现3.:表S1。质体靶向蛋白分为9类,线粒体靶向蛋白分为7类。2)基于UniProt和/或根据最近的文献(例如[12]及其他以文本形式提供的参考资料)。在质体中,最普遍的类别是氨基酸生物合成(31%)和碳水化合物代谢(20%),而在线粒体中,涉及能量学的蛋白质(41%)形成了最大的类别(图。2).然而,需要注意的是,这些类别中不包括的蛋白质可能在这些途径中仍有(未知)的作用,或在根系代谢中有其他重要的作用。
根质体中氨基酸的生物合成途径
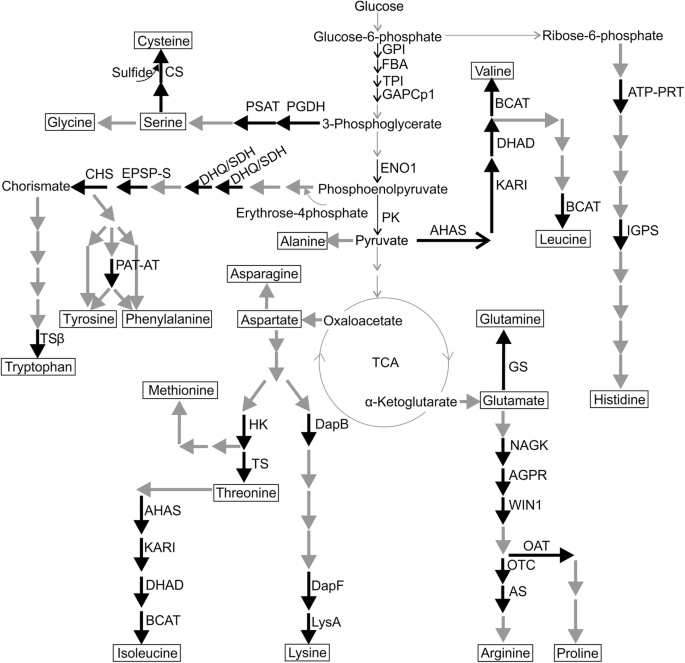
参与氨基酸生物合成的酶在拟南芥根系蛋白中具有很好的表示(图。2那3., 桌子1).首先,鉴定了三种二氨基甲酸(DAP)依赖性途径的三种酶:4-羟基 - 四氢纤维素酸盐还原酶(DAPB,AT2G44040,斑点86)催化来自二氢纤维素素,二氨基纤维素酸酶(DAPF)的四氢纤维素素的形成(DAPF,AT3G53580,斑点86)从LL-2,6-氨基甲基亚甲酸二甲酯形成中间氨基氨基甲基亚甲酯,二氨基胺脱羧酶2(Lysa,AT5G11880,点56),催化L-赖氨酸合成的途径的最后一步 -氨基乙二醇酯[21].此外,HomoSerine激酶(HK,AT2G17265)和苏氨酸合酶1(TS,AT4G29840),参与L-苏氨酸合成的酶[22],在质体富集部分发现。HK(出现在83点和85点)由高丝氨酸和无机磷酸盐形成高丝氨酸磷酸盐,而TS(出现在48点、49点和50点)催化5 '磷酸盐依赖性的l -高丝氨酸磷酸盐转化为l -苏氨酸和无机磷酸盐[23].
植物中氨基酸生物合成途径和糖酵解的简化方案。黑色箭头代表由富集富集的级分中鉴定的酶催化的反应,灰色箭头表示在当前工作中未检测到的酶催化的反应。Ahas,乙酰酸酯合成酶小亚基;1AGPR,可能的N-乙酰基 - γ-戊二酰磷酸还原酶;Ass,Agininosuccinate合成酶;ATP-PRT,ATP磷酸酯基转移酶;1bacat,支链 - 氨基酸氨基转移酶;3Chs,酸毒性合酶;CS,半胱氨酸合成酶;DAPB,4-羟基 - 四氢吡啶酸还原酶; 1DapF, diaminopimelate epimerase; DHAD, dihydroxy-acid dehydratase; DHQ-SDH, bifunctional 3-dehydroquinate dehydratase/shikimate dehydrogenase; EPSP-S, 3-phosphoshikimate 1-carboxyvinyltransferase; FBA, fructose-bisphosphatase aldolase; GAPCp1, plastid localized glyceraldehyde-3-phosphate dehydrogenase; GPI, glucose-6-phosphate isomerase 1; HK, homoserine kinase; IGPS, imidazole glycerol phosphate synthase; KARI, ketol-acid reductoisomerase; LysA, diaminopimelate decarboxylase; NAGK, acetylglutamate kinase; OAT, ornithine aminotransferase; OTC, ornithine carbamoyltransferase; PAT-AT, bifunctional aspartate aminotransferase and glutamate/aspartate-prephenate aminotransferase; PGDH1, D-3-phosphoglycerate dehydrogenase; PSAT, phosphoserine aminotransferase; TCA, tricarboxylic acid cycle; TPI, triose phosphate isomerase; TS, threonine synthase; TSβ, tryptophan synthase beta chain; WIN1, acetylornithine aminotransferase
还鉴定了参与丝氨酸,半胱氨酸和组氨酸生物合成的酶(表1,图。3.).d -3-磷酸甘油酸脱氢酶(d -3-磷酸甘油酸脱氢酶,PGDH1, At4g34200)是l -丝氨酸合成质体磷酸化途径中的第一个酶,在多个位点(18、22-24、30、45-47、54和55)进行了鉴定。它将3-磷酸甘油酸转化为3-磷酸羟基丙酮酸,再通过磷酸丝氨酸转氨酶(PSAT)进一步转化为o -磷酸丝氨酸。本实验均检测到拟南芥基因组编码的两个PSAT亚型,位于第64和66点的PSAT 1 (At4g35630)和位于第66点的PSAT 2 (At2g17630)。另外,在82、83和102点还发现了质体半胱氨酸合成酶(CS, At2g43750),催化o -乙酰丝氨酸和硫化物转化为l -半胱氨酸和乙酸。ATP-磷酸核糖基转移酶(ATP- prt, At1g58080, spot 62)和咪唑甘油磷酸合酶(IGPS, At4g26900, spot 43-46和56)参与l -组氨酸的生物合成。ATP- prt催化ATP和5 ' -磷酸核糖基-1焦磷酸(PRRPP)缩合成N ' -5 '磷酸核糖基-ATP (PRATP),而IGPS参与氨基酮糖PRFAR(磷酸核糖基甲酸-5-氨基咪唑-4-羧基酰胺核糖核苷酸)转化为咪唑甘油磷酸盐[24].
L-精氨酸生物合成途径得到了很好的描述,因为从我们的根质体样本中鉴定出了该途径的五种酶(表1)1,图。3.).第92位点鉴定出催化n -乙酰谷氨酸磷酸化的乙酰谷氨酸激酶(NAGK, At3g57560)。n -乙酰谷氨酸磷酸被n -乙酰谷氨酸磷酸还原酶(AGPR, At2g19940, spot 70和71)转化为n -乙酰谷氨酸半醛。下一步,在62点和63点检测到的乙酰鸟氨酸氨基转移酶(WIN1, At1g80600),从第二个谷氨酸转移一个氨基形成N2- 乙酰甘油。随后,产生的鸟氨酸进一步用鸟氨酸转基氨基氨基甲酶(OTC,AT1G75330,点85)来形成瓜氨酸。在点51和52中检测到的阿尔皮糖琥珀酸合酶(AS,AT4G24830)将L-瓜氨酸转化为Agininosuccin,这是用于合成L-精氨酸的直接衬底[25].
支链氨基酸(BCAAs),即L-异亮氨酸、L-缬氨酸和L-亮氨酸,属于人类和动物不能从头合成的20种氨基酸中的9种。已知BCAAs合成发生在质体内部[26]事实上,在我们富含根质体的样品中鉴定出了催化L-苏氨酸或丙酮酸转化为不同支链氨基酸的后续步骤的所有四种酶(表1)1,图。3.).乙酰乳酸合成酶(Acetolactate synthase,也称acetohydroxyacid synthase, AHAS, spot 58)是BCAA合成途径中第一个催化两个丙酮酸分子缩合成2-乙酰乳酸或丙酮酸与α-酮丁酸缩合成2-乙酰-2-羟基丁酸的酶。在植物中,AHAS作为一种由催化和调节亚基形成的异二聚体[27那28]. 在拟南芥中,已鉴定出两个调控亚基的基因,其中一个(At5g16290)在第58点被检测到。酮类还原异构酶(KARI,At3g58610,存在于第36和37点)异构化,然后还原两个乙酰羟基酸以产生二羟酸。这个反应是L-缬氨酸和L-异亮氨酸生物合成平行途径的第二步[22那29].二羟基酸脱水酶(DHAD,AT3G23940),从两种丙酮酸分子合成L-异戊酸氨酸或合成L-缬氨酸的第三步[30],在斑点30,43和45中鉴定。最后,三种塑体局部同种型中的三种分枝 - 氨基酸氨基转移酶(BCAT AT3G49680)中的一种[31]BCATs催化所有三条BCAA生物合成途径的最后一步,将各自的α-酮酸转化为氨基酸[32].
莽草酸途径是一个多步骤的代谢途径,主要代谢产物磷酸烯醇式丙酮酸(PEP)和红糖-4-P转化为chorismate。Chorismate还用作合成植物生长、发育和防御所需的三种芳香族氨基酸(L-苯丙氨酸、L-酪氨酸和L-色氨酸)以及其他芳香族化合物(如色素和激素)的前体[33].在我们的研究中,我们鉴定了三种酶参与莽草酸途径,双功能3-脱氢喹酸脱氢酶/莽草酸脱氢酶(DHQ/SDH;At3g06350,第30位点),5-烯醇丙酮酸shikimate-3-磷酸(EPSP)合酶(也称为3-磷酸kimate 1-羧基乙烯基转移酶;At2g45300, spot 51, 52)和chorismate synthase (CHS, At1g48850, spot 71, 73)(表11,图。3.). 第一种酶催化3-脱氢喹啉酸形成莽草酸的两个后续反应[34].EPSP合成酶通过一种不寻常的化学反应将烯醇丙酮基从PEP转移到shikimate 3-磷酸盐,这种化学反应涉及PEP的C-O键裂解,而不是像大多数使用PEP的酶那样的P-O键裂解[35那36].这个反应的产物,EPSP,通过络合物合酶1,4-反式消除磷酸和氢进一步转化为络合物。
在植物中,几种不同的酶在经酸后代代谢途径中竞争融合。在这些代谢分支中的一个中,Chorismate被转化为L-色氨酸。该途径的最后两个步骤分别由色氨酸合成酶α亚基和β亚基催化。在点65中检测到色氨酸合酶亚单位β(TSβ,AT5G54810),证实了前面的结果表明除了植物的绿色部位之外,L-色氨酸还在拟南多巴斯根中合成[37那38].此外,导致L-苯丙氨酸和L-酪氨酸合成的后鉴定后鉴定性代谢分支在根塑性样品中表示,作为双官能天冬氨酸氨基转移酶和谷氨酸/天冬氨酸 - 哌膦酸酯酶(PAT-at; AT2G22250)[39)在第64和66个点(表1,图。3.).
碳水化合物新陈代谢和同化途径
20%的质体蛋白代表碳水化合物代谢,包括参与糖酵解的几种酶。葡萄糖-6-磷酸异构酶1(GPI,At4g24620)存在于斑点25和30,是一种催化葡萄糖-6-磷酸和果糖-6-磷酸可逆异构化和相互转化的二聚体酶。果糖双磷酸酶醛缩酶(fba3;在斑点76、83、85、87)中检测到At2g01140,已知参与卡尔文循环中果糖-1,6-二磷酸和sedoheptulose-1,7-二磷酸的缩合反应[40],还催化糖酵解途径中的可逆反应,将果糖1,6-二磷酸分解为二羟丙酮磷酸(DHAP)和甘油醛3-磷酸(G3P)[41]. 磷酸三糖异构酶(TPI,At2g21170,spot 101)将DHAP转化为G3P,再由甘油醛-3-磷酸脱氢酶(GAPDH)进一步转化为1,3-二磷酸甘油酯,同时还原NAD+去NADH。GAPCp1(At1g79530,点71,75,82,85)是拟南芥中GAPDH的两种质体定位糖酵解亚型(除了两种胞质亚型外)之一[42那43].NAD的再生+由NAD依赖性丙酸盐脱氢酶(MDH; AT3G47520,斑点82和83)催化,这负责氧化酸酯和苹果酸的互连[44].在斑点51和52中催化2-磷酸糖(2-PG)转化为PEP的烯醇酶1(ENO1,AT1G74030)。在点47中检测到塑性丙酮酸激酶2(PK,AT5G52920),在斑点47中检测到糖酵解的最后步骤。它催化磷酸基团从PEP转移到腺苷二磷酸(ADP),得到一个丙酮酸分子和一个ATP分子。接下来,由几个至少四个酶的拷贝组成的丙酮酸脱氢酶复合物,进行丙酮酸转化为乙酰基 - COA(丙酮酸脱羧)。在斑点46,47,63和47,47,48和50分别检测二氢烷基 - 赖氨酸残基乙酰转移酶组分4(AT3G25860)和5(AT1G34430),而E1,丙酮酸脱氢酶的β-3亚基β-3亚基(AT2G34590)在点79点检测到(表1). 乙酰辅酶A,反过来,进一步用于各种过程,如脂肪酸生物合成(见下文)。
在非光合质体中(以及在黑暗时期的叶绿体中),氧化戊糖磷酸途径以NADPH的形式产生还原力,用于许多代谢途径,包括氮和硫的同化。NADPH被根型铁氧还蛋白NADP氧化+氧化还原酶(RFNR1,AT4G05390在点77和RFNR2,在点78中的1G30510),其随后减少了根型Ferredoxin蛋白[45].Ferredoxin-nitrite还原酶(近红外光谱;位于位点45、51和52的At2g15620)将铁氧还蛋白氧化为亚硝酸盐还原为氨,然后通过氨基酸的酰胺氮和胺氮进入细胞代谢(例如,通过位点55的谷氨酰胺合成酶At5g35630)。ATP硫酸化酶(ATP-S;At3g22890, 56和57点)依次是硫酸盐同化途径的第一个酶(表)1). 它通过将硫酸盐转移到ATP的腺嘌呤一磷酸部分来催化无机硫酸盐的活化,形成高能化合物5′-磷酸腺苷硫酸盐(APS)[46]. APS随后被还原成亚硫酸盐(通过APS还原酶)和硫化物(通过亚硫酸盐还原酶),这也需要还原当量的铁氧还蛋白。此后,硫化物被并入半胱氨酸,半胱氨酸是蛋氨酸的前体,也是诱导非生物胁迫反应所需的谷胱甘肽和植物螯合素的主要成分[47].
脂质代谢
甘油和脂肪酸的生物合成发生在质体(和内质网)中。丙酮酸脱氢酶酶复合体(见上文)生成乙酰辅酶a,然后在乙酰辅酶a羧化酶的催化下生成丙二酰辅酶a [48那49]. 在拟南芥中,质体乙酰辅酶a羧化酶是一种多酶复合物,由生物素羧化酶、生物素羧基载体蛋白和羧基转移酶的α亚基和β亚基组成[50]. 事实上,其中三种蛋白质(生物素羧化酶,At5g35360,斑点47;生物素羧基载体蛋白,At5g16390,斑点86;羧基转移酶亚基β,AtCg00500,斑点47和59)在我们的根质体样品中被鉴定(表1)1). 然后,另一种叫做脂肪酸合成酶的多酶复合物执行两个碳单元的循环缩合:b-酮酰基-酰基载体蛋白(ACP)合成酶III(KASIII)通过执行丙二酰-ACP和乙酰-ACP的缩合反应开始脂肪酸链的延长[51那52],而KASI和KASII是碳链从C4延伸到C18的缩合酶[53].59、85号点检测到KASI (At5g46290)。缩合反应后,3-酮酰基acp被3-酮酰基acp还原酶(也称3-氧酰基acp还原酶,At1g24360,在97号点检测到)还原,脱水,最后烯酰基acp还原酶(At2g05990,在82号点和83号点检测到)完成饱和脂肪酸的形成[54].这些酶的存在强调了根部塑体对拟南芥脂肪酸生物合成的重要性。
根线粒体:柠檬酸循环和呼吸电子转移的组分
根据线粒体的主要作用,在生产ATP和减少生物合成反应的等同物中,将41%的鉴定的线粒体蛋白分为能量类别(图。2表2;额外的文件4.:表S2)。柠檬酸循环氧化乙酰辅酶a,产生NADH和FADH2,对于ATP的线粒体电子转移和合成需要。在我们的样品中,检测到柠檬酸循环的多个组分。首先,我们确定了丙酮酸脱氢酶复合物的各种组分,其产生乙酰-CoA,包括二氢甲酰基 - 赖氨酸 - 残基乙酰转移酶组分2(AT3G13930,斑点22-25,28,30,79,86,115)和3(AT1G54220,斑点30,45,86)以及EI(丙酮酸脱氢酶E1组分亚单位β-1,AT5G50850,Spots 79-81,86)。在柠檬酸循环的第一种提交步骤中,柠檬酸合酶(CS)在转化乙酰-COA至柠檬酸盐中的作用[55]. 事实上,CS4(At2g44350)蛋白在56–58和65点被鉴定。柠檬酸盐被乌头酸酶(ACO)进一步转化为异柠檬酸盐[56].在拟南芥中,有四个基因编码不同的亚型ACO1-4。有趣的是,本研究中检测到的ACO2 (At4g26970)和ACO3 (At2g05710)亚型分布在多个点,表明ACO亚型存在差异加工和/或其他类型的翻译后修饰(图1)。4.在之前的拟南芥线粒体蛋白质组学研究中发现了相同的ACO亚型,但多个位点中只有ACO3存在[57].异柠檬酸随后被异柠檬酸脱氢酶脱羧成2-羟戊二酸,代表异柠檬酸脱氢酶家族蛋白(At5g14590, spot 65)和调控亚基1 (At4g35260, spot 72)和2 (At2g17130, spot 62和63)。2-羟戊二酸依次脱羧成琥珀酰辅酶a(通过α -酮戊二酸脱氢酶),琥珀酰辅酶a通过琥珀酰辅酶a合成酶(或连接酶)的作用转化成琥珀酸[58.].琥珀酰辅酶a连接酶亚基α -1 (At5g08300)和β (At 2g20420)分别在75-78和85点,62和63点被鉴定。接下来,琥珀酸被琥珀酸脱氢酶复合物氧化成富马酸,琥珀酸脱氢酶复合物参与柠檬酸循环和呼吸电子转移[59.].在斑点17,18和20中检测到5G66760编码琥珀酸脱氢酶的黄酮蛋白亚基,而在点97中AT3G27380编码铁 - 硫磺亚基1.富马酸盐与苹果酸(通过卷曲酶,斑点59-61中可能为2g47510)通过线粒体MDH被氧化成草酸乙酸盐。在点82中,在点83,85和86和MDH2中检测MDH1(AT1G53240)。
呼吸电子转移链由配合物I (NADH辅酶Q还原酶)、配合物II(琥珀酸脱氢酶)、配合物III(细胞色素bc1复合物)和配合物IV(细胞色素c氧化酶)组成。复数I是一个至少有49个亚基的多亚基复数[60.),它以NADH的形式从柠檬酸循环中接受电子。75 kDa蛋白At5g37510(点1、11、13、18、21、45和46)和gamma碳酸酐酶(点92和93的At1g47260)代表复合物I(表2、S1)。如上所述,琥珀酸脱氢酶复合物在柠檬酸循环和电子转移中具有双重功能[61.]. 复合物III依次由抑制素-3(At5g40770,点93,95–97,99)和细胞色素c1 1(At3g27240,点88)表示,而我们在样品中检测不到任何复合物IV亚单位。此外,ATP合酶亚单位存在于多个点:ATP合酶亚单位α(ATMG01190)存在于点30、37、43–50、55、56、58、63、64、79、83、87、89和90,β-3亚单位(At5g08680)存在于点17、43–49、51、54–56、62和63,γ亚单位(At2g33040)存在于点89,O亚单位(AT5G13400)存在于点115和24的可能亚单位 ATP合成酶α和β亚基在许多位点的分布可能表明酶的组装和/或功能可能受到翻译后修饰的调节。
像所有其他细胞器一样的线粒体与其他细胞隔间相互作用。通过在隔室之间的各种基板,中间体和最终产物以及通过各种信号传导途径运输相互作用。在多个斑点(95-97,99,100)中检测到的孔隙或电压依赖性阴离子选择性通道(AT5G15090,AT5G67500,AT3G01280),使得离子和小分子交换,例如,NADH和ATP穿过线粒体外膜,从而严格连接线粒体反应对细胞代谢。
讨论
根质体中氨基酸的生物合成:构建块和调控元件
参与氨基酸生物合成的酶的存在似乎是非绿色质体的共同特征[12那13那17]. 在所有高等植物中,L-赖氨酸是由L-天冬氨酸通过DAP依赖的途径合成的,该途径在藻类、细菌和细胞壁含有纤维素的真菌中也起作用[62.].类似地,L-天冬氨酸也用作合成L-苏氨酸的基材。已经显示已经在几十年前的情况下,完整的照明叶绿体能够合成来自外源的所有天冬氨酸衍生的氨基酸[14C]天冬氨酸,表明它们含有L-赖氨酸和L-苏氨酸合成所需的所有酶[63.那64.]. 这可能是生物合成途径也存在于非绿色质体中,因为除了拟南芥根质体外,一些相关的酶也在非绿色质体中被发现Medicago Truncatula.根叶绿体(17]小麦胚乳发育过程中的淀粉体[12].
l -组氨酸是通过叶绿体中发生的一系列酶促反应合成的[65.那66.].由于该途径极度消耗能量(41 ATP/1 His) [67.],叶绿体的区段化表明光合作用可能为这个过程提供能量[68.]. 然而,在非绿色质体中也检测到参与组氨酸生物合成的酶[12那17].事实上,l -组氨酸参与调节其他氨基酸的生物合成、金属离子的螯合和运输以及植物的繁殖和生长[69.那70那71.].此外,L-组氨酸生物合成与许多其他代谢途径有关,包括嘌呤,嘧啶和叶片的合成[68.].值得注意的是,在我们的分析中也检测到了腺苷酸琥珀酸合成酶(At3g57610)(表1).它催化一磷酸腺苷(AMP)从头合成的第一步[72.]作为嘌呤核苷酸是核酸的结构组分以及各种维生素,辅酶和激素的前体[73.那74.那75.那76.那77.].实际上,已经表明,体积局部化的DE Novo合成途径是植物中的主要嘌呤合成途径[73.].
l -丝氨酸是一种重要的氨基酸,是多种代谢途径中的中间体,是其他氨基酸(如l -甘氨酸、l -半胱氨酸)形成的前体,参与磷脂和嘌呤的合成[78.那79.].在植物中,l -丝氨酸的生物合成通过三个途径进行。d -3磷酸甘油酸脱氢酶(PGDH1),在多个点上检测,最近被认为在非光合组织中特别重要,与叶片中依赖光呼吸的乙醇酸途径功能相比[80那81.那82.].
作为参与BCAAs生物合成的酶是可商购和潜在的新除草剂的靶标,生物合成途径是广泛研究的对象[26那29].同样,莽草酸途径在动物体内的缺失使其成为有价值的营养分子来源和新抗生素和除草剂的潜在靶点,成为有趣的研究对象。因此,在富含根质体的样品中发现了一些参与BCAA生物合成和shikimate途径的酶,这一事实特别有趣。最近的研究也表明,二羟酸脱氢酶(DHAD)在营养组织和生殖组织中广泛表达,其活性对三种BCAAs在根中的准确积累至关重要[30]. DHAD酶水平降低的植株表现出短根表型和对盐胁迫的敏感性[30].需要注意的是,支链氨基酸转氨酶BCAT(和其他参与亮氨酸生物合成的酶)也通过蛋氨酸链延伸途径用于硫代葡萄糖苷的合成[83.那84.]强调了根塑体对植物次生代谢和防御反应的重要性。还在发育过程的调节和应力响应调节中起重要作用[85.那86.]. 重要的是,L-精氨酸不仅是这两种化合物的前体[87.],但它也是蛋白质合成的必需氨基酸,具有高氮碳比。因此,l -精氨酸经常作为氮素的贮藏物,特别是在地下贮藏器官和根系中[88.那89.那90.]. 这些特性使参与L-精氨酸生物合成的酶成为当前研究的焦点,旨在解决根源性胁迫反应。
质量糖甘露出态酶对初生代谢,应激反应和发育过程的影响
糖酵解是生物体中主要的主要代谢途径,其中己糖被氧化为生物合成反应提供能量、还原力和前体[91.].在植物中,有两种糖浆途径在细胞溶质和体层中平行操作,它们通过塑性包络中存在的选择性转运蛋白相互作用[92.].除了它们在初级代谢中的作用,一些质体酶亚型似乎参与调节发育过程和诱导应激反应。例如,葡萄糖-6-磷酸异构酶的质体异构体被认为是花的起始过程中淀粉合成所必需的[93.以及在低氧条件下的生存[94.],而Triose磷酸异构酶基因的表达通过发育刺激调节[95.].反过来,FBA对于糖代谢和信号传导都是至关重要的[96.]. 除了研究了fba3(At2g01140)在糖酵解中的功能外,该酶在诱导生物和非生物胁迫反应以及生长发育过程中也具有重要作用[96.].实际上,表明FBA的mRNA水平响应水杨酸,脱落和赤霉素酸性增加[96.那97.那98.,干旱,盐,以及寒冷胁迫[97.那99.那One hundred.].有趣的是,FBA 3定位于拟南芥叶绿体和非绿色质体的质体球泡中[96.].最近,有报道称FBA是赖氨酸甲基化的靶点[101]和半胱氨酸谷胱甘肽化[102],这可能会影响酶的构象、活性或稳定性。
淀粉片与拟南芥根塑料
在马铃薯块茎淀粉质体部分也鉴定出了一些根质体蛋白,如磷酸丝氨酸转氨酶、精氨酸琥珀酸合成酶、苏氨酸合成酶、苹果酸脱氢酶、果糖-二磷酸醛缩酶和PPiase [10/或小麦耳朵或种子[11那12].然而,在小麦和马铃薯块茎淀粉片上检测到淀粉和蔗糖代谢的丰富蛋白质[10那11]在拟南芥根质体蛋白中没有很好的代表性,这表明根质体在拟南芥中并没有长期储存碳水化合物的主要作用。另外,由于淀粉体脆弱,难以分离,因此不能排除在分离过程中淀粉体损坏并从我们的根质体中逃逸的可能性。值得注意的是,在高度纯化的淀粉体组分中,鉴定出了一些线粒体蛋白(如线粒体孔蛋白)[10那11那12],这可以表示某些蛋白质的真正的双重位置,或淀粉体和线粒体的共纯化。
除了一些质体蛋白(表1),还检测到一系列线粒体蛋白质,主要代表柠檬酸循环和电子转移链组分(表2)。同意以前的研究[57],其中许多蛋白以多个点的形式出现,表明线粒体蛋白是多个翻译后修饰的靶点。事实上,最近有研究表明细胞器蛋白质经常被磷酸化修饰[103那104],Lys乙酰化[105]和甲基化[106那107].然而,这些修饰的功能后果仍然是未知的。我们还可靠地鉴定了一些蛋白,这些蛋白可能存在于多个隔间中,或者尚未被注释为质体或线粒体蛋白。例如,与花椒素相关的凝集素是参与防御信号通路的碳水化合物结合蛋白[108]. 除了膜结合的异构体外,植物在细胞质、细胞核、叶绿体以及液泡和质外体中都含有可溶性凝集素[109那110那111那112].无论是jacalin相关的凝集素在几个斑点中都检测到(见附加文件3.;表S1)表示真正积聚在线粒体或根塑状中的蛋白质仍有待阐明的。
结论
在该研究中,我们已经确定了84个根体积靶向和77个线粒体靶向蛋白,并表明拟南芥根系具有较宽的生物合成能力,代表氨基酸和脂肪酸的合成以及碳,氮和硫同化。该工作强调了根体积对次生代谢和根部发起的应激反应的重要性,并且表明拟南芥根系在碳水化合物的长期储存中没有主要作用。目前我们不知道存在于我们的根体积分数中的塑体是否代表一种均匀的体积型,或多种不同类型的白膜,其可能具有专门的功能特征。此外,细胞或组织类型的影响和作用阶段对根塑性的结构和功能性质仍然是未来研究的有趣话题。
方法
植物材料
拟南芥生态型哥伦比亚-0种子,从诺丁汉拟南芥库存中心(NASC)购买;英国),表面灭菌,并在50%的正方形板(½x Murashige和Skoog)的最上面镀上维生素(Duchefa) mM MES缓冲液pH 5.7,0.8%植物琼脂(Duchefa)。植株在16/8以下的垂直板上生长 h光/暗光周期120 μmol/m− 2.年代− 1.在23℃下四周。
根塑性隔离
SDS-PAGE和Western blotting
如文献[113]经过以下修改。500 4周龄植株的镁根在1.5℃的预冷砂浆中磨碎 ml均质缓冲液(50 mM Tris-HCl,pH值 7.5, 330 mM山梨醇,1 毫米乙二胺四乙酸,1 mM MgCl2,0,1%BSA,PierceTM蛋白酶抑制剂,1片/10 毫升)。匀浆通过一层预先浸泡的米拉布过滤并离心(4000 x g,3 最小值,4 摄氏度)。收集上清液作为细胞溶质部分,将富含质体的颗粒轻轻地重新悬浮在50%的溶液中 μl均化缓冲液,用小刷子,用1.8宽尖端移液 ml 10%Percoll,然后离心(4000 x g 5 最小值,4 摄氏度)。收集质体部分,并用500%丙酮洗涤两次 μl均质缓冲液。最后的弹丸在50分钟内重新悬浮 μl缓冲液(5 毫米,10 mM Hepes氢氧化钠,5 毫米氯化镁2)在冰上呆了5天 最小。
用细胞室标记酶的免疫检测验证了根质体制剂的纯度。粗根匀浆、根质体和细胞质蛋白被溶解(Laemmli, 1970),蛋白质在12%丙烯酰胺凝胶中分离。将凝胶用1 mA/cm的印迹缓冲液(48mm Tris-HCl, 39mm甘氨酸,1.3 mM SDS, 20%甲醇)电泳到PVDF膜(Immobilion-P, Merck Millipore)上2用Hoefer Te77x半色吸墨特为1小时。使用TTB(20mM Tris-HCl,pH 7.5,150mM NaCl和0.05%Tween 20)的5%非脂肪干乳(BiORAD)封闭印迹,并用蛋白质特异性抗体免疫标签。根型FNR抗体(RFNR;来自T. Hase的礼物,[45],稀释1:1000)作为根质体标记物,同时选择氧化酶1/2 (AOX1/2, Agrisera, AS04054,稀释1:50 50)和硝酸还原酶(NR;使用Agrisera, AS08 310-100,稀释:1:500)的抗体分别评估线粒体和细胞质污染。使用辣根过氧化物酶偶联抗兔二抗(GE Healthcare)与ECL Western Blotting检测试剂(GE Healthcare)检测x射线胶片上的蛋白质(Fujifilm SuperRX)。使用Geliance 1000成像仪和GeneSnap成像软件(PerkinElmer)对印迹进行成像。
2D凝胶电泳和凝胶染色
新鲜制备约150 μg蛋白的根质体样品,用复水缓冲液(8 M尿素、2 M硫脲、4% CHAPS、100 mM二硫苏糖醇和0.5% 3 - 11nl IPG缓冲液),用铝箔覆盖,以最大速度旋转2 h。蛋白质等电聚焦单元与NL(非线性)18厘米IPG条(Bio-Rad)用于pH范围为3-11。IPG条带在340 μl复水缓冲液中复水过夜。蛋白质样品被杯子直接装入条带上,杯子靠近条带的阳极端。采用Ettan IPGphor 3等电聚焦系统进行一维分离。蛋白质在150 V和300 V下集中3小时,然后在6小时内电压提高到1000 V,在2小时内电压提高到10000 V,然后在10000 V下保持3小时[114].在电胶壳后,用130mM二硫醇(DTT)降低条带中的蛋白质,并在平衡缓冲液中用135mM碘乙酰胺(IAA)烷基化(375mM Tris-HCl pH8.8,6M尿素,20-30%甘油,2%SDS)。在14%线性SDS凝胶上进行二维电泳。
电泳后,根据制造商的说明,用Sypro Ruby蛋白质染色剂染色凝胶,如下所示。在40%甲醇中进行凝胶固定,10%三氯乙酸3小时,然后用三个水在水中进行10分钟。随后,用330ml的Sypro Ruby蛋白染色凝胶,并在黑暗中留过夜,以持续轻柔的搅拌。染色后,将凝胶漂洗在10%乙醇,7%乙酸中45分钟,然后在水中洗涤。使用300nm uV过敏器可视化染色蛋白质,并使用Cy3过滤器(PerkinElmer)与凝胶1000成像器成像。此后,相同的凝胶是染色的,以便能够切割蛋白质斑点。MS兼容的银染色根据[115].在20%乙醇和水中漂洗15分钟后,通过200mL 1.2mM Na孵育溶解凝胶2S.2O.3.·5小时2O代表90。随后,将凝胶用水洗涤两次20秒,并进行银染色。12 mM AgNO染色3.在平台摇床上放置30分钟,然后用水冲洗20秒。之后,在217mm K的条件下开发凝胶2一氧化碳3.,0,6 mm na2S.2O.3.,0.07%福尔马林,在摇床上轻轻摇动2-5分钟 直到斑点清晰可见。摇动凝胶2分钟后停止显影 停止溶液(2.5%醋酸,400 mM-三氯化氢)。
质谱分析,数据库检索和功能分类
从2D凝胶中选择的蛋白质点手动切除,并用0.2–0.3的凝胶内消化 μg胰蛋白酶(Promega V5111),37 18°C H消化后,用乙腈(ACN)和50%ACN/5%HCOOH溶液从凝胶片中提取胰蛋白酶肽。将总提取物汇集在一起,在真空离心机中干燥,并在室温下储存− 20 摄氏度。在质谱分析之前,我们将肽溶于10 0.1%六氯环己烷(μl)涡流,37℃孵育 °C持续15分钟 将至少5μl肽注射到在配备有纳米电喷雾电离源的Q Exactive质谱仪(Thermo Fisher Scientific,不来梅,德国)耦合的纳米流HPLC系统(Easy-nLC1000,Thermo Fisher Scientific)上执行的LC-MS/MS分析中。首先将肽装载在捕集柱(100)上 μm内径× 2. cm),然后在分析柱(75 μm内径× 15 厘米)。两个塔的包装材料都是ReproSil Pur 5 微米200 ÅC18-AQ(Dr.Maisch HPLC GmbH,Ammerbuch Entringen,德国)。流动相为水加0.1%甲酸(溶剂A)或乙腈/水(80:20(v/v))加0.1%甲酸(溶剂B)。A 10 最小梯度从8%到43%B用于洗脱肽。MS数据由Thermo Xcalibur 4.0软件(Thermo Fisher Scientific)自动获取。一种与信息相关的采集方法,由质量范围为300–1750的Orbitrap MS survey扫描组成 m/z,然后HCD裂解10个最强烈的肽离子。
使用Proteome Discoverer 2.2软件(Thermo Fisher Scientific)与运行吉祥物2.5.1软件(Matrix Science)的内部服务器连接,搜索数据文件以进行蛋白质鉴定。在SwissProt数据库(version 2017_03)中搜索数据。数据库搜索设置包括一个分类过滤器'拟南芥意大利“其中胰蛋白酶为固定修饰,甲酰氨基为固定修饰,蛋氨酸氧化为可变修饰。允许有两个缺劈。显著性阈值P< 0.05。使用MapMan软件(http://mapman.gabipd.org/mapman-download)使用UniProt数据库的注释手动验证结果。
数据和材料的可用性
支持本文结论的数据集包含在本文及其附加文件中。
缩写
- 华:
-
乌头酸酶
- 机场核心计划:
-
3-ketoacyl-acyl载体蛋白
- 啊哈:
-
乙酰乳酸合酶
- 接入点:
-
腺苷5 ' -phosphosulfate
- BCAAs:
-
支链氨基酸
- BCAT:
-
支链氨基酸转氨酶
- CS:
-
柠檬酸盐合成酶
- 衣冠楚楚的:
-
二氨基丙酸
- DHAP:
-
二羟基丙酮磷酸盐
- 第1部分:
-
enolase 1.
- EPSP:
-
5-enolpyruvylshikimate-3-phosphate
- 功能性:
-
果糖双磷酸酶醛缩酶
- GAPDH:
-
甘油醛-3-磷酸脱氢酶
- G3P:
-
甘油醛3 -磷酸
- 香港:
-
高丝氨酸激酶
- 卡斯:
-
机场核心计划合酶
- MDH公司:
-
NAD-dependent苹果酸脱氢酶
- 政治公众人物:
-
膦基嘌呤酸酯
- PSAT:
-
磷素氨基转移酶
- RFNR:
-
根型ferredoxin-NADP+氧化还原酶
- TPI:
-
磷酸丙糖异构酶
- TS:
-
苏氨酸合成酶1
参考
- 1.
李H,滕ys。过境肽设计和塑植进口调控。趋势植物SCI。2013; 18:360-6。
- 2.
Sjuts I,Soll J,BölterB.将可溶性蛋白质进入叶绿体和潜在的调节机制。前植物SCI。2017; 8:1-15。
- 3.
关键词:信号肽,差异年龄依赖,进口调控公共科学图书馆杂志。2012;10:e1001416。
- 4.
何新豪斯,Emes MJ。质体中的非光合代谢。植物生理学杂志。2000;51:111-40。
- 5.
Lopez-Juez E,派克卡。质体被释放:它们的发育和它们在植物发育中的整合。中国生物医学工程杂志。2005;49:557-77。
- 6。
盖根伯格P,斯蒂特M,费尼AR。生长马铃薯块茎中蔗糖转化为淀粉的代谢控制分析和调控。植物细胞环境。2004;27:655–73.
- 7。
尼萨尔,李玲,卢森,钦NC,鲍普森。植物类胡萝卜素的代谢。摩尔。2015;8:68 - 82。
- 8。
罗斯特霍恩S。植物碳通量与脂肪酸合成。《脂质研究进展》,2002年;41:182–96.
- 9。
Esposito S、Massaro G、Vona V、Di Martino RV、Carfagna S。大麦根系谷氨酸合成:质体葡萄糖-6-磷酸脱氢酶的作用。足底。2003;216:639–47.
- 10.
Stensballe A, Hald S, Bauw G, Blennow A, Welinder KG。马铃薯块茎淀粉质体蛋白质组。2月j . 2008; 275:1723-41。
- 11
Andon NL,Haliingworth S,Koller A,Greenland AJ,Yatess JR III,Haynes Pa等。用串联质谱法使用蛋白质鉴定小麦淀粉组织蛋白质组学特征。蛋白质组学。2002; 2:1156-68。
- 12
Balmer Y,Vensel WH,Frances MD,Buchanan BB,Hurkamn WJ。从开发小麦胚乳中分离的淀粉片蛋白质呈现出广泛代谢能力的证据。J Exp Bot。2006; 57:1597-02。
- 13
Siddique MA, Grossmann J, Gruissem W, Baginsky S.蛋白质组分析甜椒l .)色素母细胞。植物细胞生理学。2006;47:1663-73。
- 14
曾燕,潘铮,丁勇,朱安,曹辉,徐强,等。甜橙果实着色质体的蛋白质组学分析[柑橘sinensis.(L.)奥斯贝克]。J实验机器人。2011;62:5297–309.
- 15
Baginsky S,Siddique A,Gruissem W.烟草亮黄-2(BY-2)细胞培养物的蛋白质组分析作为未分化的异养型体积的模型。J蛋白质组。2004; 3:1128-37。
- 16。
关键词:水稻,叶绿体,蛋白质组学,蛋白质组学蛋白质组学。2005;4:1072-84。
- 17。
作者简介:Daher Z, re - bet G, Valot B, Robert F, Balliau T, Potin S等。蛋白质组学分析Medicago Truncatula.根塑性。蛋白质组学。2010; 10:2123-37。
- 18。
Daher Z,Recorbet G,Solymosi K,Wienkoop S,Mounier A,Morandi D等。丛枝菌根质体蛋白质组和结构的变化显示出营养缺乏的特征。生理植物。2017;159:13–29.
- 19。
高等植物的质体小管具有组织特异性和发育调控性。细胞科学杂志。2000;113:81–9.
- 20.
Köhler RH, Cao J, Zipfel WR, Webb WW, Hanson MR.通过高等植物质体之间的连接交换蛋白质分子。科学。1997;276:2039-42。
- 21.
Hudson Ao,Bess C,Macedo P,Chatterjee SP,Singh BK,Gilvarg C等人。植物中赖氨酸的生物合成:已知细菌途径变体的证据。Biochim Biophys Acta - Gen Subj。2005; 172:27-36。
- 22.
阿泽维多拉,兰西安M,利亚PJ。天冬氨酸代谢途径是植物体内一条重要的代谢途径。氨基酸。2006;30:143–62.
- 23.
Laber B, Maurer W, Hanke C, Gräfe S, Ehlert S, Messerschmidt A等。描述的重组拟南芥苏氨酸合酶。欧洲生物化学杂志。1999;263:212–21.
- 24.
Rees JD, Ingle RA, Smith JAC。组氨酸生物合成途径中9个基因对控制游离组氨酸浓度的相对贡献拟南芥.植物科学学报;2009;
- 25.
Haines RJ,Pendleton LC,Eichler DC。精氨琥珀酸合成酶:在精氨酸代谢的中心。国际生物化学分子生物学杂志。2011;2:8–23.
- 26.
Singh BK.缬氨酸、亮氨酸和异亮氨酸的生物合成。作者:Singh BK,编辑。植物氨基酸:生物化学和生物技术。纽约:马塞尔·德克尔;1999年。227–47.
- 27.
好时惠普、施瓦茨、盖尔JP、艾贝尔LM。乙酰乳酸合成酶小亚基的克隆及功能表达烟草plumbaginifolia.植物学报,1999;
- 28
Lee YT, Duggleby RG。监管的相互作用拟南芥acetohydroxyacid合成酶。2月。2002;512:180-4。
- 29
Binder S、Knill T、Schuster J。高等植物的支链氨基酸代谢。生理植物。2007;129:68–78.
- 30.
张C,庞Q,姜L,王S,yan x,陈S等。二羟基酸脱水酶对于配子体发育至关重要,破坏导致拟南芥中盐度应激的敏感性增加。J Exp Bot。2015; 66:879-88。
- 31.
Niehaus TD, Nguyen TND, Gidda SK, ElBadawi-Sidhu M, Lambrecht JA, McCarty DR等。拟南芥和玉米的RidA蛋白先发制人的反应性烯胺/亚胺损害的支链氨基酸合成质体。植物细胞。2014;26:3010-22。
- 32.
Diebold R、Schuster J、Da K、Binder S。拟南芥支链氨基酸转氨酶基因家族编码质体和线粒体蛋白质1.植物生理学。2002;129:540–50.
- 33.
植物芳香族氨基酸的生物合成。植物生物学杂志,2012;63(1):73-105。
- 34.
关键词:莽草酸,芳香族氨基酸,生物合成途径拟南芥.拟南芥的书。《植物生物学》2010;8:e0132。
- 35
Walsh CT、Benson TE、Kim DH、Lees WJ。磷酸烯醇式丙酮酸及其乙烯基醚产品在生物合成中的多功能性。化学生物学。1996;3:83–91.
- 36
Schonbrunn E,Eschenburg S,Shuttleworth WA,Schloss JV,Amrhein N,Evans JNS等。除草剂草甘膦与其靶酶5-烯醇丙酮酸莽草酸3-磷酸合酶的原子细节相互作用。国家科学院学报。2001;98:1376–80.
- 37
普鲁伊特·KD,最后一名RL。双色氨酸合成酶基因的表达模式拟南芥.植物理性。1993; 102:1019-26。
- 38
Iven T, König S, Singh S, Braus-Stromeyer SA, Bischoff M, Tietze LF等。拟南芥根中色氨酸次生代谢产物的转录激活和生成有助于抵御维管真菌病原长孢黄萎病。摩尔。2012;5:1389 - 402。
- 39
谷氨酸/天冬氨酸-前phenate转氨酶(glutamate/aspartate-prephenate aminotransferase)基因的鉴定。2月。2010;584:4357-60。
- 40.
FECHNER A,GROCK W,MARTIN WF,Schnarrenberger C.叶绿体类I和II类醛糖酶是钙氏循环中的果糖-1,6-二磷酸和Sedoheptulose-1,7-二磷酸盐切割的双官能。费用。1999; 447:200-2。
- 41.
Alqurashi M, Gehring C, Marondedze C拟南芥蛋白质组研究表明cAMP在生物和非生物胁迫反应和能量代谢变化中起重要作用。国际分子科学杂志。2016;17:1-11。
- 42.
Munoz-Bertomeu J,Cascales-Minana B,Mulet JM,Baroja-Fernandez E,Pozueta-Romero J,Kuhn JM等。质量性甘油醛-3-磷酸脱氢酶缺乏导致改变的根部发育,并影响拟南芥中的糖和氨基酸平衡。植物理性。2009; 151:541-58。
- 43.
Anoman Ad,Muñoz-bertomeu J,Rosa-Téllezs,Flores-Tornero M,Serrano R,Bueso E等人。质量糖甘油甘油醛-3-磷酸脱氢酶是拟南芥中异养细胞的碳和氮代谢中的重要决定因素。植物理性。2015; 169:1619-37。
- 44.
Selinski J,Scheibe R。缺乏苹果酸瓣膜能力导致转基因植株的氮同化和生长得到改善A.拟南芥植物。植物信号处理研究进展。2014;
- 45.
Hanke GT,Okutani S,Satomi Y,Takao T,Suzuki A,Hase T.FNR的拟南芥中的多种Iso-蛋白:对叶绿体功能和氮同化的不同贡献的证据。植物细胞环境。2005; 28:1146-57。
- 46.
Hatzfeld Y,Lee S,Lee M,Leustek T,Saito K.从拟南芥中编码第四ATP硫磺化酶同种型的基因的功能表征。基因。2000; 248:51-8。
- 47.
Anjum Na,Hasanuzzaman M,Hossain Ma,Thangavel P,Roychoudhury A,Gill SS等。植物中金属/金属螯合贸易的杰克 - 概述。前植物SCI。2015; 6:1-17。
- 48.
小麦乙酰辅酶a羧化酶。植物生物学。1993;22:547-52。
- 49.
关键词:乙酰辅酶,羧化酶,乙酰辅酶大肠杆菌.J Biol Chem。1974年; 249:6633-45。
- 50.
哈伍德杰。植物脂肪酸生物合成研究进展。生物物理学报1996;1301 - 56。
- 51.
jackowski rco。改变与8-酮酰基 - 酰基碰撞蛋白合酶I1(Fabf)突变体相关的酰基脉冲蛋白的分子形式。J细菌。1987年; 169:1469-73。
- 52.
Clough Rc,Matthis L,Barnums R,Jaworski JG。菠菜3-酮酰基 - 酰基载体蛋白合成酶III的纯化与表征。J Biol Chem。1992年; 267:20992-8。
- 53.
Shimakata T,Stumpf PK。s的脂肪酸合成酶pinacia oleracea树叶。植物生理学。1984;29:249–65.
- 54.
Mou Z。脂肪酸合成酶的缺乏导致细胞过早死亡和植物形态的剧烈改变。植物细胞。2000;12:405–18.
- 55.
费尼·阿尔,卡拉里·F,甜心·LJ。呼吸代谢:糖酵解、TCA循环和线粒体电子传递。植物生物学。2004;7:254–61.
- 56.
Moeder W, Del Pozo O, Navarre DA, Martin GB, Klessig DF。在拟南芥中,乌头酶在调节抗氧化应激和细胞死亡中发挥作用烟草benthamiana.植物学报。2007;63:273-87。
- 57.
Millar AH, Sweetlove LJ, Giegé P, Leaver CJ。拟南芥线粒体蛋白质组分析。植物杂志。2001;127:1711-27。
- 58.
Johnson JD、Mehus JG、Tews K、Milavetz BI、Lambeth DO。多细胞真核生物中ATP-和GTP-特异性琥珀酰辅酶A合成酶表达的遗传证据。生物化学杂志。1998;273:27580–6.
- 59
Oyedotun KS,Lemire BD.的第四纪构造酿酒酵母琥珀酸脱氢酶:同源建模,辅助因子对接,分子动力学模拟研究。生物化学杂志。2004;279:9424-31。
- 60
Klodmann J,Sunderhaus S,Nimtz M,Jansch L,Braun HP。线粒体复合体的内部结构拟南芥.植物细胞。2010; 22:797-810。
- 61
eubel h,jansch l,braun hp。新洞察植物线粒体呼吸链。超复杂和复合II的独特组成。植物物理。2003; 133:274-86。
- 62
沃特林M,弗兰卡德V,雅各布斯M。这个拟南芥编码二氢纤维素素合酶的DHDPS基因,赖氨酸生物合成的关键酶以细胞特异性方式表达。植物mol biol。1999; 39:695-708。
- 63.
米尔斯WR, Lea PJ, Miflin BJ。分离叶绿体中天门冬氨酸家族氨基酸的光合形成。植物杂志。1980;65:1166 - 72。
- 64.
壁画RM,Mazelis M.赖氨酸生物合成的酶学在高等植物中完全定位的酶学。菠菜叶片叶绿体中调节酶二氢嘧啶的完全定位。费用。1980; 116:189-92。
- 65.
El Malki F,Frankard V,Jacobs M。鸡组氨酸磷酸转氨酶基因的克隆与表达尼古利亚娜塔巴拉拉.植物学报。1998;37:13 - 22。
- 66.
ingle ra。组成型高表达组氨酸生物合成途径有助于高沉积厂的耐镍耐受性。植物细胞。2005; 17:2089-106。
- 67.
等。关键词:聚类;聚类;组氨酸生物合成途径与基因:结构、调控与进化。Microbiol启60:44 1996;69年。
- 68.
Stepansky A,Leustek T。组氨酸在植物中的生物合成。氨基酸。2006;30:127–42.
- 69.
Salt de,Rc,贝克AJM,Rasking I,皮克林IJ。金属超读数器中的锌配体菥caerulescens如使用X射线吸收光谱法测定。环境科技。1999年; 33:713-7。
- 70。
Liao MT、Hedley MJ、Woolley DJ、Brooks RR、Nichols MA。菊苣对铜的吸收和转运(菊苣L. cv草原Puna)和番茄(Lycopersicon esculentum磨坊。在NFT系统中生长的植物。二。烟碱和组氨酸在木质部汁液铜转运中的作用。种植土壤。2000;223:245–54.
- 71.
Kerkeb L,KrämerU.自由组氨酸在镍硅荷载荷兰香雪球lesbiacum和芸苔属植物juncea.植物杂志。2003;131:716-24。
- 72.
Prade L、Cowan Jacob SW、Chemla P、Potter S、Ward E、Fonne Pfister R。小麦和小麦腺苷酸琥珀酸合成酶的结构拟南芥. 分子生物学杂志。2000;296:569–77.
- 73.
Senecoff JF,McKinney EC,Meagher RB。De Novo嘌呤合成Arabidopis芥.植物理性。1996年; 112:905-17。
- 74.
Herz S,Eberhardt S,Bacher A.植物中核黄素的生物合成。riba基因拟南芥双功能GTP环水解酶II/3,4-二羟基-2-丁酮4-磷酸合酶。植物化学。2000;53:723-31。
- 75.
汉森,格雷戈里。植物中叶酸的合成和周转。植物生物学。2002;5:24 - 9。
- 76.
史密斯PMC,Atkins Ca.嘌呤生物合成。在细胞分裂中,氮素同化甚至更大。植物理性。2002; 128:793-2。
- 77.
黄志明,李建平,李建平,等。植物中嘧啶和嘌呤的生物合成与降解。植物学报,2006,26(5):657 - 664。植物生物学杂志,2006;
- 78.
李建平,张建平,张建平,等。拟南芥丝氨酸生物合成中可溶性磷酸化丝氨酸转氨酶的分子生物学特性研究。生物技术通报。植物j . 1998; 16:443-52。
- 79.
爱尔兰rj,hiltz da。甘氨酸和丝氨酸合成在非光合组织中。在:Wallsgrove RM,编辑器。氨基酸及其在高等植物中的衍生物。剑桥:剑桥大学出版社;1995. p。111-8。
- 80。
Cascales-Minana B, Munoz-Bertomeu J, Flores-Tornero M, Anoman AD, Pertusa J, Alaiz M,等。丝氨酸生物合成的磷酸化途径对于拟南芥的雄配子体和胚胎发育以及根系生长都是必不可少的。植物细胞。2013;25:2084 - 101。
- 81。
Toujani W,Munoz-Bertomeu J,Flores-Tornero M,Rosa-Tellez S,Anoman Ad,Alseekh S等人。拟南芥血浆3-磷酸糖脱氢酶家族的功能表征。植物理性。2013; 163:1164-78。
- 82
关键词:丝氨酸,植物,生物合成,代谢,功能植物生态学报,2014;
- 83
张国良,张国良,张国良。拟南芥编码含有Leu Biosynthesis和葡糖苷形成的Met链伸长途径的细菌型异二聚酯异丙酸盐异构酶。植物mol biol。2009; 71:227-39。
- 84
Sonderby IE,Geu Flores F,Halkier BA。硫甙的生物合成-基因发现和超越。植物科学趋势。2010;15:283–90.
- 85
Alcázar R, Marco F, Cuevas JC, Patron M, Ferrando A, Carrasco P,等。多胺参与植物对非生物胁迫的响应。Biotechnol。2006;28:1867 - 76。
- 86
Domingos P, Prado AM, Wong A, Gehring C, Feijo JA。一氧化氮:植物中的多任务信号气体。摩尔。2015;8:506-20。
- 87
陈建平,陈建平,陈建平,等。植物精氨酸代谢的研究进展。植物营养与肥料学报。植物科学与技术,2015;
- 88.
Nordin A,NäsholmT.氮气储存形式九种北部北部石碑。oecologia。1997年; 110:487-92。
- 89.
Bausenwein U, Millard P, Thornton B, Raven JA。土壤中氮的季节性储存和再流动Rumex acetosa.功能生态。2001;15:370-7。
- 90.
杨树氮素营养的研究进展。植物医学杂志。2010;12:275 - 91。
- 91.
Plaxton Wc。植物糖酵解的组织和调节。Annu Rev植物植物植物Mol Biol。1996年; 47:185-214。
- 92。
韦伯APM,施瓦克,弗卢格UI。质体包膜的溶质转运子。植物生物学年鉴。2005;56:133–64.
- 93。
Yu T-S,Lue W-L,王S-M,陈J.拟南芥血浆异构酶异构酶的突变影响叶淀粉合成和花香。植物理性。2000; 123:319-26。
- 94。
Dolferus R,Ellis M,DeBruxelles G,Trevaskis B,Hoeren F,Dennis ES等.拟南芥缺氧过程中基因作用的策略。安·博特。1997;79:21–31.
- 95.
陈米,谢恩jj。在拟南芥中从异养的异常过渡到拟南芥中的自养生长,需要三糖磷酸异构酶的体层同种型。植物细胞。2010; 22:77-90。
- 96.
卢伟,唐晓,霍勇,徐荣,祁松,黄杰,等。拟南芥中果糖1,6-二磷酸醛缩酶基因的鉴定和特性揭示了一个对非生物胁迫有不同反应的基因家族。基因。2012;503:65 - 74。
- 97.
风扇W,张Z,张Y.高盐度和干旱调节果糖-1,6-双磷酸醛糖酶基因的克隆与分子表征马齿苋. 植物细胞代表2009;28:975–84.
- 98.
关键词:赤霉素,果糖-二磷酸醛缩酶,水稻abstract:中国生物医学工程学报,2004;
- 99.
Purev M,Kim Mk,Samdan N,Yang D-C。分离新颖的果糖-1.6双磷酸醛糖酶基因轮叶党参并分析了该基因对非生物胁迫的响应。杂志。2008;42:179-6。
- 100。
关键词:糖酵解酶,酶活性,基因表达Cicer Arietinum.暴露于缺水压力。应用生物化学生物技术。2014;173:2241–53.
- 101
Mininno M,BrugièreS,Pautre V,Gilgen A,Ma S,Ferro M等。叶片果糖的表征1,6-双磷酸醛糖酶作为植物中赖氨酸 - 甲基化蛋白的表征。J Biol Chem。2012; 287:21034-44。
- 102
Mohapatra S,Mittra B。蛋白质谷胱甘肽化对小麦的保护作用(小麦var。Sonalika)针对镰刀菌诱导氧化胁迫。植物理性生物化学。2016; 109:319-25。
- 103
Bykova NV,Rampitsch C.通过可逆氧化调节蛋白质功能:通过蛋白质组学显示植物中的氧化还原过程。蛋白质组学。2013; 13:579-96。
- 104
Rochaix j d。类囊体蛋白激酶的氧化还原调控与光合基因表达。抗氧化氧化还原信号。2013;18:2184-201。
- 105
芬克迈尔一世,拉萨M,米盖特L,豪登AJM,甜心LJ。在拟南芥中,具有不同功能和亚细胞定位的蛋白质是赖氨酸乙酰化的。植物生理学。2011;155:1779–90.
- 106
克拉克SG。表面和深层的蛋白质甲基化:在组蛋白盒之外思考。生物科学,2013;38:243-52。
- 107.
陈建平,陈建平,陈建平,等。揭示拟南芥叶绿体中蛋白赖氨酸和精氨酸甲基化网络。《公共科学图书馆•综合》。2014;9:e95512。
- 108.
Esch L,Schaffrath U.更新Jacalin样章程及其在植物防御中的作用。int j mol sci。2017; 18:1592。
- 109.
珀曼斯WJ,豪斯B,云顿爵士EJM。半乳糖结合和甘露糖结合花椒素相关凝集素位于不同的胼胝体下隔室。2月。2000;477:186 - 92。
- 110.
云顿集团EJM, lannon, Peumans WJ。植物凝集素。机器人研究2008;48:107-209。
- 111.
关键词:酰氨基酸释放酶,氧化蛋白水解酶,胞质抗氧化足底。2012;236:427-36。
- 112。
徐敏,Lü F,彭刚,牛洁,王刚。一种凝集素的亚细胞定位羽藻属催眠样(苔藓科,绿藻科)及其在细胞外细胞聚集期间的表达。植物植物。2012; 51:340-6。
- 113。
Bowsher CG、Hucklesby DP、Emes MJ。甘蓝根质体亚硝酸盐还原及糖代谢的研究Pisum一l .足底。1989;177:359 - 66。
- 114。
Lehtimäkin,koskela mm,Dahlstrom km,pakula e,lintala m,scholz m等。Ferredoxin-NADP的后期修饰+拟南芥叶绿体中的氧化还原酶。植物杂志。2014;166:1764 - 76。
- 115.
O'Connell Kl,Stults JT。基质辅助激光解吸/电离质谱法在原位酶消化中鉴定小鼠肝蛋白对二维电泳凝胶的鉴定。电泳。1997年; 18:349-59。
确认
不适用。
基金
这项研究由芬兰科学院资助(307335和321616)。质谱分析是在图尔库蛋白质组学设施,图尔库大学和博博阿卡德米大学。该设施由芬兰生物中心提供支持。
作者信息
从属关系
贡献
PM, MG和EMA构思了这个项目并设计了研究。PM和AR对实验进行监督;MG, IF和AR进行了实验。所有作者都参与了实验设计和数据分析;PM和MG写了这篇文章,所有作者都有贡献。PM同意作为作者负责联系并确保沟通。所有作者均已阅读并批准稿件。
作者的信息
不适用
相应的作者
道德宣言
伦理批准和同意参与
不适用。
同意出版物
不适用。
相互竞争的利益
提交人声明他们没有竞争利益。
额外的信息
出版商的注意
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
补充信息
附加文件1:图S1。
根蛋白样本分析。原蛋白印迹如图。1. 20 用SDS-PAGE法分离μg粗根蛋白提取物(C)、代表根质体(P)的小球和代表胞浆(S)的上清液,转移到PVDF膜上,用根型FNR(RFNR)免疫标记;根质体标记),交替氧化酶(AOX1/2;线粒体标记物)和硝酸还原酶(NR;细胞溶质标记物)抗体。kDa表示分子量标记。箭头表示预测的蛋白质大小。
附加文件2:图S2。
富含质体和线粒体的根蛋白样品的2d -凝胶。通过等电聚焦(pH 3-11)和SDS-PAGE(14%)分离150 μg蛋白。A. SYPRO Ruby染色2D-gel(见图。4.图S2 B)。红色的圆圈代表质谱分析的蛋白质点。B.三个生物复制的2d凝胶。对于生物复制1和2,采用Sypro Ruby染色,对于生物复制3,采用银染色。
附加文件3:表S1。
通过LC-MS/MS在富含根质体的部分中鉴定蛋白质。使用蛋白质组发现器2.2软件进行蛋白质鉴定,如方法中所述。
附加文件4:表S2。
质谱分析鉴定的带注释的根线粒体蛋白质。
权利和权限
开放存取本文是根据知识共享署名4.0国际许可证授权的,该许可证允许以任何媒体或格式使用、共享、改编、分发和复制,只要您给予原作者和来源适当的信任,提供到知识共享许可证的链接,并指出是否进行了更改。本文中的图像或其他第三方材料包含在文章的知识共享许可证中,除非在材料的信用额度中另有说明。如果材料未包含在文章的知识共享许可证中,并且您的预期用途不受法律法规的允许或超出允许的用途,您将需要直接获得版权持有人的许可。要查看此许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/. 知识共享公共领域放弃(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信用额度中另有说明。
关于这篇文章
引用这篇文章
格拉布斯图诺维奇,M,罗卡,A,法鲁克,I。等。蛋白质组凝胶图谱拟南芥根质体和线粒体。BMC植物生物学20.413(2020)。https://doi.org/10.1186/s12870-020-02635-6
收到了:
公认:
发表:
关键词
- 二维凝胶电泳
- 拟南芥
- 质谱
- 线粒体
- 蛋白质组学
- 根
- 根质体