摘要
背景
干燥宽容卷柏物种进化是为了在极端环境条件下生存。确定脱水耐性(DT)获得机制的研究只集中在少数方面卷柏物种。由于DT在形态上的巨大多样性和对干燥反应的广泛范围,对其分子基础的认识卷柏物种仍然是有限的。
结果
在这里,我们提出了一个干旱耐受性物种的参考转录组美国sellowii和干燥敏感的物种美国denticulata.该分析还包括充分研究的转录组数据美国lepidophylla(耐干燥),以确定DT机制是独立于形态适应。我们使用比较方法来区分DT响应和普通的失水响应卷柏物种。预测的蛋白质组显示出很强的同源性,但大多数干燥反应基因在物种之间是不同的。尽管存在这些差异,但功能分析显示,不同形态的耐受性物种使用相似的机制在干燥环境下生存。DT的重要功能包括诱导抗氧化系统、氨基酸和次生代谢,而物种特异性反应包括细胞壁修饰和碳水化合物代谢。
结论
在这项工作中产生的参考转录组为研究提供了宝贵的资源卷柏与DT相关的生物学和植物进化。我们的结果提供了收敛演化的证据美国sellowii而且美国lepidophylla因为不同的基因集被选择来获得DT
背景
的起源卷柏据估计,属大约存在于3.83亿年前[1].这组植物代表了维管植物最古老的系系之一。1),包括超过700个品种[2,7,8。的卷柏属的生境广泛多样,主要在潮湿的环境中,但也有一些物种适应极端干旱的条件[1,3.。后一种植物中有些进化出了耐干燥性(DT),这是一种特殊的性状,使它们能够在干燥状态下耐受很长时间。对干燥的耐受性,被认为是从几乎完全失去原质水中恢复的能力,在繁殖结构(如种子和花粉)中广泛存在,但在气管植物的营养组织中并不常见[9].大量的卷柏物种栖息于极端干燥的生境,其中至少有15个成员被列为耐旱品种[10,11,12。DT在这些物种中的作用机制包括积累山梨醇和木糖醇等多元醇,通过稳定蛋白质结构起到渗透保护剂的作用,激活类黄酮和谷胱甘肽代谢以防止氧化应激[13],脯氨酸积累增加,抗氧化酶激增[11].宽容卷柏由于它们在干燥过程中保留叶绿素和类囊体膜,因此被分类为同叶绿素的物种[14].茎卷曲和叶片折叠等形态机制也有助于这些物种的DT,因为它们限制了光的收集,以及由于光合作用装置的保留而导致的活性氧(ROS)的形成[15,16,17。耐受性物种的最新基因组测序卷柏lepidophylla[18和美国tamariscina[19也揭示了对干燥的分子基础的新见解。的美国lepidophylla基因组(109 Mb)具有与适应极端失水相关的串联基因复制,特别是早期光诱导蛋白(ELIPs)和晚期胚胎发生丰富蛋白(LEA)中的基因家族扩张[18,20.。ELIPs的功能是通过与光合色素结合来防止氧化损伤。比较所有现有的耐干燥测序基因组的分析表明,ELIP基因的扩增独立地发生了趋同进化[21],支持DT收敛进化的假设。此外,在美国tamariscina基因组(301 Mb)也发现了具有能量储存和膜修复功能的油苷基因的显著扩增[19].此外,与它的敏感亲戚相比,该物种还表现出改进的ROS产生和清除机制美国moellendorffii.这些发现表明,即使来自同一属的物种也可能进化出共同的和特定的策略来获得DT。
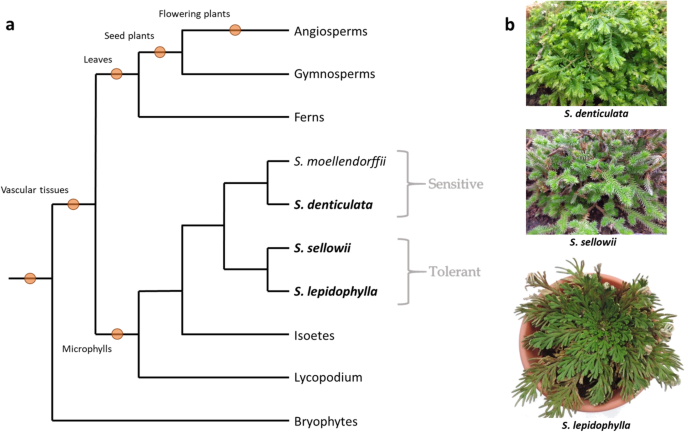
卷柏具有丰富的生态位、生长形式和形态[22。在形态学上,属内有两个主要类群,其中最大的类群为异生种(四个等级的小叶;两个背排和两个腹排)大多在潮湿的热带森林中发现。另一组为同叶植物种(排列不分明,呈螺旋状排列的小叶植物),常见于墨西哥和美国西部的干旱地区[4,23。关于DT的研究多在卷柏迄今为止,已在异生植物中进行了研究。自卷柏被分类为耐干燥的物种可以表现出广泛不同的形态,因此确定这两种形态类型是否具有共同的和/或特定的机制来调节它们的DT能力是非常重要的。
在这里,我们报告了在不同时间点的同源植物物种的干燥过程的RNA-Seq对比分析美国sellowii以及异生植物美国denticulata。的研究美国sellowii由于其在治疗皮肤利什曼病方面的潜在用途,先前侧重于药理应用[24这是中美洲和南美洲的一个主要健康问题。美国sellowii1987年Gaff首次报道了耐干燥性[25],但其对DT的分子机制尚未得到表征。美国denticulata也是一种值得关注的物种,其中已鉴定出几种具有潜在药理特性的双类黄酮[26].
以前使用比较方法分析DT性状的研究包括生理[27,28],代谢的[13,29],基因表达[30.,31],和基因组分析[32,33].本研究比较了两种形态高度不同的耐受物种在脱水和复水过程中的转录反应(美国sellowii而且美国lepidophylla)与敏感物种的反应(美国denticulata).我们的研究结果表明,密切相关的物种可能通过基于不同基因/蛋白质的适应进化出DT,从而实现非常相似的耐受机制。
结果
DT的表征卷柏sellowii
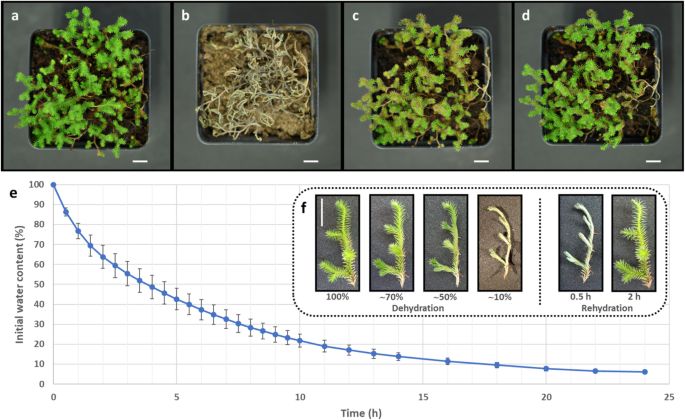
识别与DT获取相关的共享或特定功能卷柏我们比较了两种植物的RNA-Seq数据,以区分对水分流失的共享和保守响应与对干燥的响应卷柏具有相似形态但DT特性不同的物种与具有不同形态的耐受性物种。植物的形态和系统发育位置卷柏选择用于分析的物种如图所示。1.枝状图是先前的系统发育研究的代表,这些研究表明了它们之间的关系是一致的美国sellowii,美国lepidophylla而且美国denticulata使用不同的分子标记[1,3.,4,5,6].虽然美国sellowii此前有报道称其耐干燥,我们决定用我们的样品来确认这一评价。因此美国sellowii在温室条件下对植物进行脱水和复水循环,以确定其DT能力。代表性标本的表型美国sellowii如图所示。2.个别的罐子通过一个月的停水来脱水。大部分水分流失发生在前12天,在此期间组织达到干燥状态(图1)。2b).在此期间,温室的平均相对湿度为40.35±7.15%,是确定DT [34].经过长时间处于干燥状态的组织再水化美国sellowii呈浅棕色色素沉着(图。2c),但复水1周后恢复到与停水前观察到的颜色相似(图。2d).测试是否分离美国sellowii小枝(称为外植体)在脱水后也能耐受并保持活力,这些组织也经历了脱水-再脱水的反复循环。的美国sellowii与敏感品种的外植体相比,外植体在反复干燥后无明显损伤美国denticulata显然失去了生存能力(附加文件1:图S1a)。
以便更仔细地检查DT响应美国sellowii外植体在与温室试验相似的条件下脱水(相对湿度46.96±4.19%)。干燥速率美国sellowii外植体是由初始含水量损失的百分比来确定的。2e).在实验条件下发现美国sellowii在开始脱水处理90分钟后,外植体失去了30%的初始含水量,4小时后失去了50%,7.5小时后失去了70%,17小时后失去了90%(图2)。2e).叶柄向内折叠美国sellowii外植体,被认为是保护组织免受氧化损伤在干燥过程中,明显低于50%的含水量(图。2f).补液期间美国sellowii外植体迅速恢复,复水后2小时小叶完全开放(图。2f).离体外植体试验也用于美国lepidophylla而且美国denticulata.耐受性品种的干燥速率也有相似的结果美国lepidophylla虽然水分流失期间的形态变化主要是茎卷曲,而不是叶面折叠。另一个区别是美国lepidophylla相比之下美国sellowii外植体充分水化的形态在复水化2小时后没有完全恢复1:图S1b)。干燥敏感美国denticulata表现出更快的水分流失(处理9小时后达到其初始含水量的10%),但没有观察到叶柄折叠或茎卷曲(附加文件)1:图S1c)。此外,美国denticulata当水被截留时,外植体失去膨胀性,在复水化过程中有明显的组织氧化。
参考转录组组合的开发美国sellowii,美国lepidophylla而且美国denticulata
为了获得DT过程中基因表达模式变化的全局概述,我们从完全脱水、部分脱水(初始含水量的70%和50%)和完全脱水(初始含水量的10%)的外植体中提取RNA美国sellowii,美国lepidophylla而且美国denticulata(根据各自的干燥曲线采集样品;无花果。2和附加文件1:图S1)。外植体的美国sellowii而且美国lepidophylla进一步干燥至初始含水量低于10%,再水化2和6小时,以分析恢复期间的转录反应。RNA-Seq分析美国denticulata仅在脱水过程中进行,因为在复水后可重复观察到组织损伤和RNA完整性的丧失(附加文件2:图S2)。
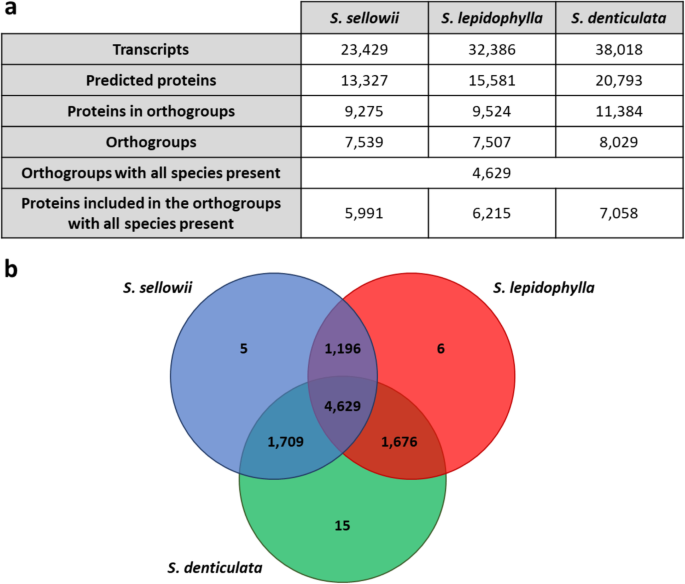
测序使用NextSeq Illumina平台,双端(2 × 75 bp)读取格式。对原始测序reads进行过滤,去除低质量和适配器序列,以获得每个物种的总输出超过100,000,000个reads(表2)1).三篇文章的阅读卷柏物种用三位一体分开组合[35]和soapeno - trans [36]算法。装配质量的评价包括N50长度、基因预测、完整性和reads映射到装配的比例等指标的组合1).三一从头组装被选中,因为它们在每个指标中表现出更好的性能。
对标通用单拷贝矫形仪(BUSCO)分析[37结果表明,该基因中95%、93%和98%的真核标记均具有较高的覆盖率美国sellowii,美国lepidophylla而且美国denticulata组件,分别(表1).然而,大多数的BUSCO标记(单拷贝正交)在组装中被检测到重复(高达70%)美国sellowii;表格2).为了减少冗余并为每个物种定义一个参考转录组,每个contig只保留最长的亚型(用于后续分析称为转录本)。减少冗余后的总contigs的41.6,50.5和61.2%美国sellowii,美国lepidophylla而且美国denticulata,分别保留。程序集基本上已经完成,超过92%的原始读取与它们各自的程序集对齐(表2).尽管这种策略导致了较低的质量指标,如N50长度,但由于单个拷贝标记的完整数量在每个物种中增加到> 75%,因此获得了显著的冗余水平提高(表2).
转录组使用BLASTX对SwissProt和RefSeq(植物)数据库和几种物种的蛋白质模型进行注释,包括拟南芥.每个转录组的注释率分别为55.72、55.43和52.29%美国sellowii,美国lepidophylla而且美国denticulata,分别。每个物种中至少有42%的转录本与之前测序的蛋白质模型具有显著的相似性美国moellendorffii[38。在脱水(DH)和补液(RH)过程中美国sellowii而且美国lepidophylla分别有4,001和5,098个转录本差异表达,其中2,908个和3,455个转录本至少部分注释。在美国denticulata我们观察到5,738个差异表达的转录本,其中4,033个可以注释。此外,响应转录本的大小分布显示序列长度和注释(附加文件3.:图S3)。
蛋白质组的卷柏物种
利用TransDecoder从参考转录组(最长异构体)中预测蛋白质序列。推测蛋白质组卷柏物种表现出不同的大小,其中确定具有编码潜力的转录本数分别为13,327、15,581和20,793美国sellowii,美国lepidophylla而且美国denticulata,分别见图。3.a).使用OrthoFinder聚类[39]]为预测的蛋白质组定义了总共9236个正交组,显示出所有蛋白质组之间的高度相似性卷柏物种。大约一半的蛋白质家族在所有三个物种中都具有同源性,其余的大部分是在每对物种的组合中共享的,只有少数通过分析被分类为物种特异性蛋白质家族(共26个正构组)(图1)。3.b).虽然敏感种与各耐受种之间共享的正交群数量大于耐受种之间共享的正交群数量,但由互惠最佳命中(RBH)分析确定的序列一致性百分比在耐受种之间最高(约71%)美国sellowii而且美国lepidophylla相比之下65-66%的人美国denticulata(附加文件4:图S4)。
共享和对比的转录谱卷柏物种
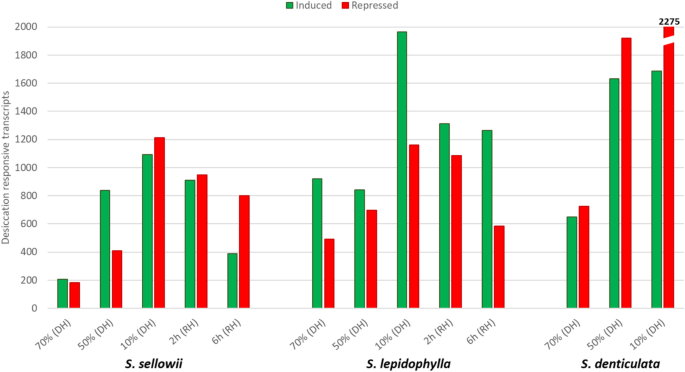
目的:研究细胞对脱水的转录反应卷柏,在DH和RH的几个点采集组织样本。在每种条件下,通过相对于水合样品的表达定量检测脱水反应转录本。在DH过程中,耐受性和敏感性物种都表现出类似的模式,即与水分流失相关的响应转录本数量增加(图1)。4).在极端DH(10%含水量)条件下,反应转录本的数量最多,分别为1091、1964和1686个诱导转录本,而抑制转录本的数量分别为1214、1160和2275个美国sellowii,美国lepidophylla而且美国denticulata分别。耐受物种在RH期间也进行了分析,结果显示在RH后(6小时)较长时间内,当组织有时间恢复初始状态时,应答转录本减少(图1)。4).RH后6 h,诱导转录本数量分别为389和1263,而抑制转录本数量分别为799和583美国sellowii而且美国lepidophylla,分别。美国lepidophylla在DT过程的各个条件下,诱导转录物的水平高于抑制转录物的水平(诱导转录物的水平是抑制转录物的1.20 ~ 2.16倍)。美国sellowii在含水量为70%和50%时,最初表现出类似的模式(诱导比抑制多1.13 - 2.05倍),但在极端DH(含水量为10%)和RH时,抑制转录本的比例更高(抑制比诱导多1.04 - 2.05倍)。敏感种的表达变化主要与抑制转录本相关(抑制转录本是诱导转录本的1.12 ~ 1.34倍)。
宽容卷柏不同物种对干旱反应的基因表达模式存在显著差异
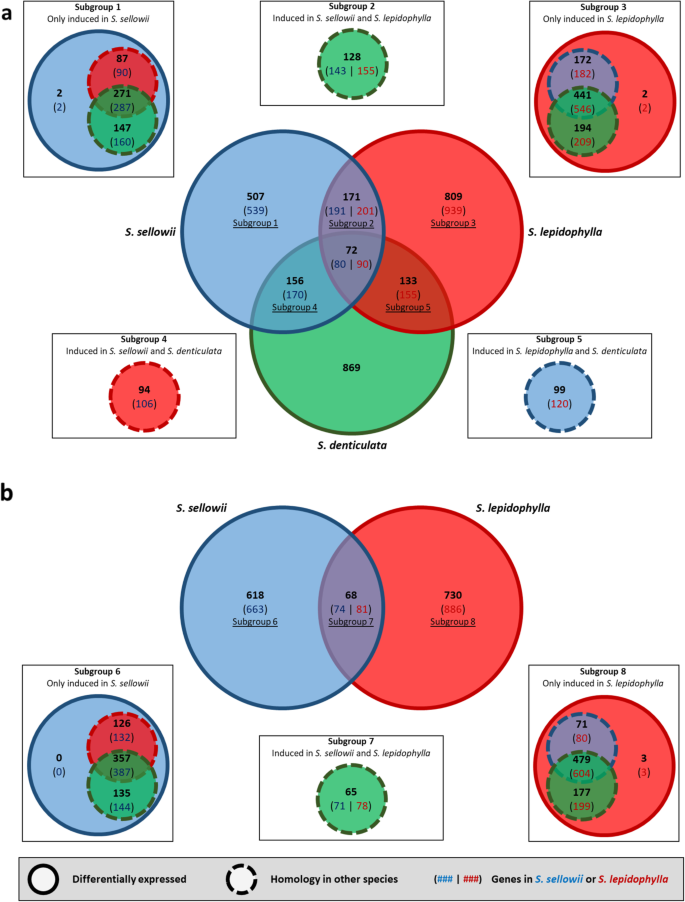
为了更好地比较耐受种和敏感种之间的DH过程,我们将在含水率为70、50和10%时诱导的所有脱水响应转录本一起进行分析。利用正交组比较不同物种间的干燥反应,我们发现DH激活的基因存在差异。尽管事实是卷柏它们之间的蛋白质组表现出非常高的同源性。3.),对DH的常见反应仅占总诱导正交群数的7.94、6.07和5.85%美国sellowii,美国lepidophylla而且美国denticulata共有72个正交组代表共同的DH反应(图。5a).如预期的那样,具有DT能力的物种比耐受和敏感物种共享更大的公共正交群;耐受性种间对DH的共有响应分别为26.82和20.5%美国sellowii而且美国lepidophylla,分别。差异诱导的正交群(图1和3亚群)的详细分析。5a)揭示这些基因由539和939个基因组成,与其他物种中至少一个同源基因(4个物种特异性基因除外),但只对DH有反应美国sellowii而且美国lepidophylla分别(无花果。5一个)。
同样,对耐药品种的RH时间点(浇水后2 h和6 h)的正交类群进行了分析,结果显示,耐药品种的共享响应分别为9.91和8.52%美国sellowii而且美国lepidophylla,分别见图。5b).被确定为RH特异性诱导的基因数量(图中的亚组6和亚组8)。5B)为663美国sellowii还有886美国lepidophylla.所有的反应基因美国sellowii在其他物种中是否有同源性只有3种被发现是物种特异性的美国lepidophylla.这些差异表明在进化过程中卷柏选择不同基因集的差异表达,以获得DT。
正交类群可能由每个物种的不同数量的同源序列组成,这使得特定正交类群内同源物之间的差异表达的数据验证复杂化。因此,我们选择在耐受种中诱导差异的单拷贝正交群(每个物种一个同源体)进行实时荧光定量PCR (qRT-PCR)验证。根据注释结果和之前的关于DT中假设作用的报道选择基因。选择的正序组为OG5138、OG4174和OG2082,以及一个注释为泛素蛋白连接酶的基因(OG3782),该基因在不同物种的DH和RH处理中表达无差异,作为内参基因。评估在极端脱水(10%含水量)和早期补液(2小时)时的表达水平。转录组数据显示,耐受物种在DH和RH过程中OG5138正位基团上调;qRT-PCR证实了这种表达模式5:图S5)。OG5138与an正交拟南芥PLATZ转录因子(AT1G21000),被报道为控制种子耐脱水能力的调节网络的一部分拟南芥[40].OG2082包含LEA蛋白(AT2G44060),仅在美国lepidophylla(附加文件5:图S5)。OG4174基因被注释为果胶甲基酯酶抑制剂(AT5G09760),推测其在细胞壁修饰中起作用。qRT-PCR结果显示,在果胶的DH和RH过程中,OG4174基因都表达上调美国sellowii但只在DH期间美国lepidophylla(附加文件5:图S5)。qRT-PCR结果与RNA-Seq数据的表达水平基本一致。
常见的和具体的机制涉及DT的获取卷柏
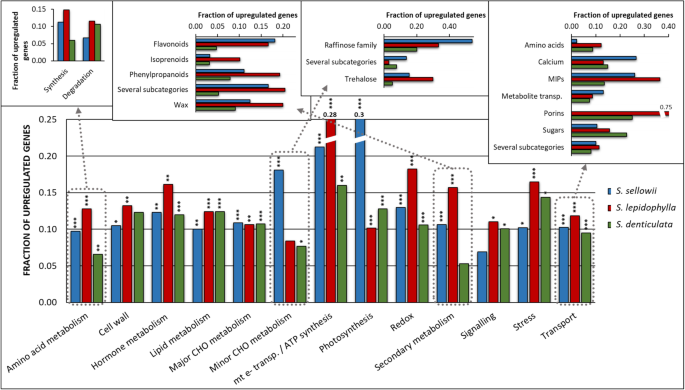
确定所涉及的假定机制卷柏每个物种的DT、DH和RH诱导的转录本根据MapMan术语分配函数。为了比较种与种之间的差异,每一类的诱导基因被表示为该一类的诱导基因相对于其在参考转录组中存在的比例。在DH阶段,敏感植株中种类丰富美国denticulata被用来作为一个参考,以确定哪些类别可以参与确定公差。耐受性物种共有的、敏感物种有显著差异的最相关诱导类别是:氨基酸、次生代谢、氧化还原和转运(图1)。6).耐受性品种的氨基酸类中,涉及合成的基因有19个和36个,涉及降解的基因有5个和8个美国sellowii而且美国lepidophylla分别。相比之下,敏感物种美国denticulata显示了10个氨基酸合成基因和11个降解基因9:表S1)。抗氧化化合物,如谷胱甘肽,抗坏血酸盐,过氧还蛋白和硫氧还蛋白的差异上调基因的比例,在耐受物种中是敏感物种的1.31到2.28倍6:图S6g)。尽管抗氧化酶的诱导已在耐受性物种中报道过,但只有美国lepidophylla在这一类中表现出明显的富集,如歧化酶和过氧化氢酶富集2.7倍于美国denticulata(附加文件6:图S6g)。次生代谢类在耐受性物种中显著丰富,包括与合成几种已知与水胁迫反应有关的化合物有关的基因,如类黄酮、苯丙素和蜡(图1)。6;额外的文件7:图S7e)。苯丙素亚类包括木质素生物合成,诱导基因的比例分别为1.68和2.53倍美国sellowii而且美国lepidophylla分别,比在美国denticulata.转运相关的功能在耐受性物种之间有很大的差异,一些重要的亚类别是钙转运美国sellowii和porin美国lepidophylla在整个干燥过程中(图。6;额外的文件7:图S7c)。两种耐受性物种主要在主要内在蛋白(MIPs)的表达模式上重合,分别为26%和36%美国sellowii而且美国lepidophylla分别(无花果。6).在美国denticulata, MIP基因的表达也被诱导,但只有14%左右。在脱水过程中MIPs显著富集美国lepidophylla主要是PIP型,其次是TIP型(9和5转录本),结果相似,但在美国sellowii(3和2份成绩单;额外的文件10:表S2)。除了氮代谢和一些MIPs基因在RH期间保持激活外,在RH期间显著富集的类别与在两个耐受性物种中测定的DH相似美国lepidophylla(附加文件7:图S7)。
功能分析表明,细胞壁类别明显丰富的物种特异性方式美国lepidophylla因为它包括44个基因在DH和39个在RH的表达,而美国sellowii在DH和RH阶段分别只显示21和11个基因11表S3)。属于这一类的过程表明在干燥过程中细胞壁的重塑,包括参与细胞壁修饰(如XTH,膨胀蛋白)和降解的基因,细胞壁特异性蛋白(如AGPs)和细胞壁前体(附加文件)6:图S6a;额外的文件7:图S7a)。另外,果胶酯酶在耐受性中诱导数量较高卷柏物种与敏感物种的比较(附加文件6:图S6a)。这些结果表明,正如之前报道的那样,细胞壁修饰在植物的耐旱性中起着重要的作用卷柏物种(41].小量碳水化合物代谢在DH过程中表现出明显的差异美国sellowii显示了7个被分类为棉子糖家族基因的差异诱导转录本。6;额外的文件9:表S1)一种未检测到的低聚糖卷柏物种。此外,海藻糖代谢基因(特别是TPP)只在耐受物种脱水过程中被诱导9:表S1)。
美国sellowii在DH过程中,与光合作用相关的词汇显著增加(图5)。6).通过对这一功能的详细分析,发现主要在卡尔文循环和光反应亚类(分别为19/1和82/5诱导过抑制)中诱导基因数量多于抑制基因美国lepidophylla在每个亚类中诱导基因数量略高于抑制基因数量(14/6和26/25),检测到诱导和抑制基因数量相似美国denticulata(15/14和44/448:图S8a)。光合作用相关基因的诱导美国sellowii在RH期光合活性的快速恢复可能有一定的作用。这一结论得到了光合速率测量结果的支持美国sellowii相比之下美国lepidophylla(附加文件8:图S8b)。PSII的最大量子效率也显示了较高的回收率美国sellowii在早期RH时间(0.33和1 h),即使没有积极的光合作用值登记(附加文件8:图S8c)。
elps是干燥过程中保护光合机制的关键成分。转录组数据美国lepidophylla显示5个ELIP基因在所有DH处理(含水量为70%、50%和10%)中均显著诱导,而美国sellowii4个ELIP基因在50%的条件下诱导,而在10%的含水量条件下仍能维持。在两种耐受性物种中,ELIP基因在RH早期(2小时)高度表达,在RH后6小时关闭。在敏感种中也诱导了ELIP基因美国denticulata但只有50%的含水量。
讨论
脱水研究卷柏属是维管植物中最早分化的属之一,近年来因其系统发育位置而得到重视。通过对这一基础气管植物谱系中形态差异很大的耐旱物种的鉴定,我们揭示了形态与DT机制之间的关系。因此,本研究的RNA-Seq对比分析包括了具有不同形态的耐受性物种,以确定其相关机制卷柏或独立于或依赖于形态适应的DT。
虽然美国lepidophylla而且美国tamariscina已经对DT进行了广泛的研究,但关于其他耐受性的信息却很少卷柏具有不同形态的物种,例如美国sellowii在本研究中,其DT能力在植物和外植体水平得到了证实。由于使用完整的植物可能存在发现差异表达模式的缺点,这是由于发育调控或干燥过程中的长距离信号传递[42],我们设计了一个基于外植体的系统来研究DH和RH处理的转录效应。外植体方法被证明是一种简单和可复制的技术,它允许相对快速的分析复制卷柏样本。
的莲座状形态美国lepidophylla干燥时产生一个紧凑的球体,具有非常精确的阀杆填料。与这种机械能力相关的一些因素是细胞密度(轴侧和轴侧之间的不对称)和内外茎之间的化学成分差异,这些因素改变了它们的失水能力[16,43].因为在美国lepidophylla外植体暴露于脱水条件下,外茎比内茎干得更快,在同一植物的分支之间产生不同的水分状态,使用外植体是一种更简单和更均匀的方法来分析分子和生理反应卷柏特定含水量的物种。
为了为后续比较分析的转录组数据提供充分、准确的参考,对不同的组装算法进行了测试。全新转录组分析软件如Trinity和SOAPdenovo-Trans被归类为最精确的汇编程序[44虽然这两条管道产生的contigs数量相似,但相关的质量指标(N50长度、预测基因数量和映射读的比例)表明Trinity对所有人都有更好的性能卷柏物种。RSEM-EVAL评分,一种评估装配精度的补充分析[45,也对三一组合进行了更高的评价。基于BUSCO基因集作为装配完整性指标的分析[37),也表明三位一体的组装已经基本完成。由于Trinity算法生成由单个基因产生的rna的交替拼接异构体,为了消除物种间进一步比较分析的冗余,每个组件都被过滤为每个组件最长的异构体。BUSCO分析表明,使用每个转录本最长的亚型减少了冗余,而没有显著的普遍基因覆盖损失。
预测的蛋白质组进行OrthoFinder分析,以确定正交组或蛋白质家族卷柏物种。分析结果表明,共有蛋白家族数量显著(50%的正交类群是所有物种共有的),只有少数被分类为种特异性的(< 0.01%的总正交类群)。一个意想不到的发现是更多的正序基团被共享美国denticulata而耐受性物种比耐受性物种之间更强,这可能是因为美国denticulataBUSCO结果显示其转录组最完整,而耐受性种的蛋白质序列具有较强的平均序列一致性。后者的观察结果与先前的系统发育分析结果一致美国sellowii而且美国lepidophylla物种之间的系统发育关系更为密切[3.,4,5,6].虽然它们之间有明显的形态学差异美国lepidophylla而且美国sellowii,历史生物地理学研究表明,它们在二叠纪晚期拥有共同的祖先,并在早期适应干旱地区[1].
美国lepidophylla在DH和RH处理的每种条件下,诱导转录本的数量高于抑制转录本的数量(多1.2-2.16倍),而干燥敏感的美国denticulata在DH过程中,抑制转录本多于诱导转录本(1.12-1.35倍)。另一种耐受性物种,美国sellowii,呈现出类似的模式美国lepidophylla但仅在DH初期(70%和50%,诱导比抑制多1.13倍和2.05倍),但在极端DH(10%)和RH倍时,大部分转录本被抑制(1.04 ~ 2.05倍的抑制比诱导)。美国lepidophylla而且美国sellowii从适应干旱环境的共同祖先进化而来[1],如果祖先有能力在干燥环境中生存下来,那么可以预期它们有一些共同的DT机制。然而,转录组分析表明这两个卷柏物种进化出不同的策略来获取DT。比较分析各物种的反应正群发现,在DH过程中,耐受性和敏感性物种均仅诱导了72个蛋白家族,不足各物种总反应的8%。耐受性物种共享较多的诱导正交群体,分别约占总DH和RH反应群体的25%和10%。这些发现并不支持大多数DT反应在这些耐受性物种中是共同的或保守的,而是在耐受性物种的脱水过程中,不同基因组的激活或抑制发生。例如,LEA蛋白在水分亏缺期间积累到很高的水平,并在种子和营养DT中发挥重要的保护作用[17,46],但相同的LEA基因在两种耐受性中表达不相似卷柏物种。同源性分析表明,原类群OG2082每个种均含有一个LEA蛋白拷贝基因,但该基因是由植物中DH和RH诱导产生的美国lepidophylla但不是在美国sellowii或美国denticulata.这一观察结果表明,这三种基因都存在卷柏物种可能进化出了对干燥的特定表达反应。这些发现提示在DT的获得过程中可能发生趋同进化卷柏物种。
同源性分析表明,大多数在耐受种诱导的正交群在敏感种中也存在。以前的假设认为DT是从敏感植物物种中也存在的基因成分进化而来的[9,47,48,49],表明DT的产生是由于调节网络的重新连接,而不是新基因的获得。耐受和敏感之间的差异调节的证据卷柏PLATZ1转录因子是种子DT的主要调控因子之一,其本构表达已被证明可以提高植物营养组织的耐旱性拟南芥[40].尽管已知PLATZ1与其他转录因子协同调节种子中DT的获取[40],这是第一个关于在营养组织DT过程中PLATZ1上调的报道。PLATZ1的诱导和调控作用需要在其他耐旱物种和孢子等生殖结构中得到证实,以阐明DT在不同植物组织中的进化关系。
本研究的比较分析集中在DH和RH分别响应,以获得这些物种脱水过程的全球概览。尽管对干燥的共同反应比例很小,但DH和RH期间的功能分析表明美国sellowii而且美国lepidophylla采用类似的机制来实现DT。与敏感物种相比,耐受物种的富集类别包括氨基酸和次生代谢、氧化还原和转运。氨基酸代谢被激活作为对干燥的反应,而两者美国sellowii而且美国lepidophylla诱导合成相关基因多于降解相关基因,而敏感种则相反。新陈代谢研究美国lepidophylla检测到在干燥状态下富氮氨基酸的积累,可能是作为再水化阶段的氮库或作为产生保护性化合物如谷胱甘肽的前体[50].事实上,氮代谢只在相对湿度期间才显著富集美国lepidophylla.除抗坏血酸外,谷胱甘肽、过氧还蛋白和硫氧还蛋白(化合物被分类为抗氧化防御系统的重要成分)也被诱导在耐受物种中。抗氧化防御的酶成分,特别是歧化酶和过氧化氢酶高度富集美国lepidophylla.当组织失去水分时,这些酶活性会增加卷柏物种如美国tamariscina[51].值得注意的是,在RH期,氧化还原代谢仍然非常活跃美国lepidophylla.次级代谢的亚类主要富集在类黄酮和苯丙类途径中,它们也被认为是抗氧化系统的关键成分。已经报道了几种类型的类黄酮和苯丙素卷柏[7在干旱的状态下,它们的储量更丰富美国lepidophylla相比之下美国moellendorffii[13].具体来说,苯丙类包括与木质素合成相关的基因的显著富集,木质素是一种公认的在卷曲和机械反应中起作用的聚合物美国lepidophylla茎(16,43].
转运亚类“MIPs”在耐受种中高度富集美国denticulata.这些蛋白质形成膜通道,促进水和小溶质的跨膜运输,在水的关系中起着重要作用。EST分析发现,在脱水过程中,TIP基因的含量排在第7位美国lepidophylla[52]],强调了MIPs在DT中的重要性。我们的转录组数据显示卷柏种诱导主要是PIP和TIP亚科,特别是在美国lepidophylla在RH期MIPs仍然活跃。敏感物种的基因组美国moellendorffii编码19个mip,包括NIP、TIP、PIP、SIP、XIP和HIP亚族[53。转录组组合只对PIP、TIP、NIP和SIP亚科进行了分类,因此需要更详细的分析来确定本研究所分析物种中MIPs的类型和数量。
某些功能在单一物种中显著富集。例如,超微结构研究美国lepidophylla证明了细胞壁在干燥状态下高度折叠[54],这是在干燥过程中保持结构完整性的基本要求。最近,另一种耐受性物种的结构特征(美国involvens)确定,干燥也会引起细胞壁成分的显著改变[12。我们的转录组数据证实了重组美国lepidophylla细胞壁对干燥的反应。DH过程中的亚类主要以细胞壁修饰和前体合成为代表,前者包括木糖葡聚糖内转糖苷酶/水解酶(XTH)和与细胞壁松动和重组相关的扩展蛋白[41].此外,在失水过程中阿拉伯半乳蛋白(AGPs)的表达有助于增加细胞壁的灵活性[55].在DH过程中,大量直接参与细胞壁组成的基因被诱导,包括纤维素和半纤维素的合成,以及果胶酯酶。RH过程中富集最多的是前体合成、修饰和细胞壁蛋白。特别是,在RH过程中agp仍然被诱导。一个重要的区别在DH和RH阶段美国lepidophylla是RH期间细胞壁降解亚类基因数量的增加。尽管细胞壁修饰对干燥生存是必要的,但这一类细胞在干燥中没有显著富集美国sellowii.但在DH过程中,耐受种诱导的果胶酯酶比例高于敏感种。果胶酯酶活性可修饰细胞壁结构[41]和qRT-PCR分析证实了果胶甲基酯酶抑制剂在两种耐受性物种中的上调,表明该机制也存在于美国sellowii.虽然在细胞壁修饰类中观察到的富集基因数量较低美国sellowii,与美国lepidophylla如前体的诱导和半纤维素的合成观察。然而,美国sellowii显示出对比鲜明的模式美国lepidophylla在降解亚类中,DH时期比RH时期表达差异的基因更多。综上所述,这些结果强烈表明,细胞壁重组在耐受性物种的脱水过程中起着重要作用。
为了应对脱水,所有耐旱植物都会抑制光合活性[56]和下调光合作用相关基因已在几个同质叶绿素耐受物种中报道[57,58,59].功能分析显示在美国sellowii因为在DH过程中,大量与卡尔文循环和光反应相关的基因被诱导,而美国lepidophylla而且美国denticulata在这些过程中表现出相似数量的诱导和抑制基因。PSII的净光合作用测量值和最大量子效率表明,PSII的活性恢复较快美国sellowiiRH期间的外植体可能与水分流失期间光合作用相关基因的诱导有关。与光合作用相关的转录本和/或蛋白质的积累将在短时间内提供生态优势美国sellowii代谢活跃,允许在补液期间快速恢复。此外,光合作用的快速激活表现为卷柏表明在水分流失和干燥状态下的光合机制得到了有效的保护。形态变化、抗氧化活性的增加和具有保护作用的蛋白质(特别是ELIPs)的诱导结合起来,可以防止光氧化损伤。在耐旱植物和敏感植物中均观察到诱导ELIP基因响应水分胁迫的现象[21].这三个卷柏不同品种在DH过程中均表现出较高的ELIPs表达。然而,敏感物种美国denticulata在脱水的中间阶段(含水量50%)诱导了这些基因,而耐受种在极端的DH(含水量10%)下保持了ELIP的表达。这些结果表明在耐干燥和敏感干燥之间有重要的区别卷柏耐受性物种在低含水量下表达ELIPs可以在干燥状态下对光氧化损伤提供保护,而这在敏感物种中是缺乏的。此外,ELIP基因在RH早期(2小时)继续上调,但在RH后期关闭。这与其他耐干燥物种的报告一致,当植物在RH期间恢复正常含水量时,显示出类似的ELIPs表达减少模式[21].
脱水过程中糖的积累是耐旱植物的主要特征之一,不同物种的碳水化合物代谢差异很大[60。高水平的海藻糖在水合和脱水组织已报告在几个物种卷柏属,包括敏感种[13,61,62,63。先前的研究表明,海藻糖合成的第一酶(TPS)是在美国lepidophylla[64],而我们的转录组数据表明,合成的第二种酶TPP是在耐受物种脱水过程中诱导的。尽管海藻糖基因的异源表达提高了作物对非生物胁迫的耐受性[65],在DT中的具体角色还没有明确定义。棉子糖家族寡糖(RFOs)也与DT在一些物种的种子和营养组织中的获取有关,但两者都没有美国lepidophylla也不美国tamariscina可检测到的RFOs水平(特别是棉子糖和水苏糖)[50,62。相比之下,美国sellowii在脱水过程中,与棉子糖家族代谢相关的转录组高度富集。这些结果支持假设美国sellowii与其他物种相比,它采用不同的策略来利用碳水化合物代谢以应对干旱。碳水化合物的薄层色谱分析结果表明,碳水化合物的分布格局变化较大美国sellowii而且美国lepidophylla(数据未显示),但是需要更详细的分析来确定碳水化合物代谢与DT的关系美国sellowii.
宽容的物种美国sellowii而且美国lepidophylla密切相关的[3.,4,5,6预测的蛋白质组之间具有高度的同源性。然而,转录组数据显示,尽管几乎所有的干燥反应转录本在其他物种中都有同源物,但它们主要只在一个物种中诱导。在响应DH和RH时,两者都是耐受的卷柏物种共有几种被认为是在干燥环境下生存所必需的机制。这些结果表明,在中国,DT能力是趋同进化的美国sellowii而且美国lepidophylla这可能是由于在这些物种适应其特定的自然栖息地期间,协调DT的调节网络的特定重组。系统发育分析表明,这些物种所属的进化支的共同祖先适应了干旱地区[1],但没有足够的证据来确定这个祖先是否也是一种耐旱生物。
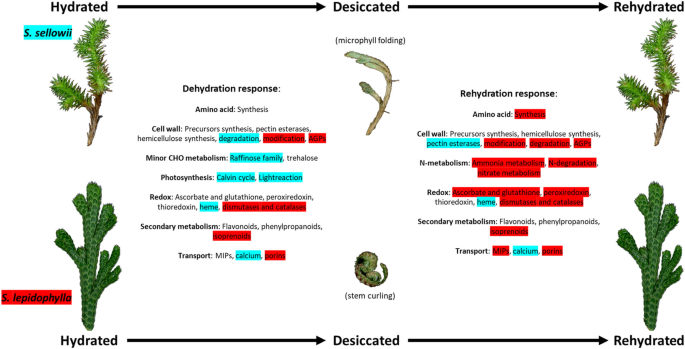
耐受性比较分析卷柏形态和生长形态非常不同的品种在一些主要的对水分流失的反应中表现出收敛性,如参与次级代谢(类黄酮和苯丙氨酸)、抗氧化系统(抗坏血酸盐、谷胱甘肽、过氧还蛋白和硫氧还蛋白)、MIPs和氨基酸合成的大量上调基因(图)。7).特异性反应在每个物种DT的获取过程中也起着重要作用,可能是根据它们特定的栖息地和适应而进化的。一个例子是DH过程中光合作用相关基因的诱导美国sellowii导致在RH期间光合作用更快地重新激活,与代谢活动的缩短周期一致,或更明显的细胞壁修饰反应美国lepidophylla.为了证实这些假设,需要更详细的特征描述,以确定与敏感物种相比,耐受性物种在干燥过程中特定基因集的特定模式和表达水平。
结论
的卷柏属为研究基底维管分支中营养DT的获得机制提供了一个有用的模型。本研究证实了DT的性质美国sellowii以及分析外植体样本的设备。准确和完整的参考转录组足以分析DT的分子方面和生物学卷柏被开发。虽然预测的蛋白质组共享大量的蛋白质家族,但DT下的大多数差异表达基因之间美国sellowii而且美国lepidophylla尽管它们在系统发育上有相似之处。宽容卷柏具有不同形态的物种对DH和RH的反应既有共同的,也有特殊的,如图所示。7功能分析表明在一些与DT相关的主要类别中有趋同进化。对比分析美国denticulata允许我们区分DT响应和一般干旱响应卷柏物种表明,耐受性和敏感性物种之间的一些主要差异包括在失水期间的氨基酸和次生代谢方面。在耐受物种中,共有的和物种特异性的抗氧化反应都有很高的代表性。此外,我们的研究结果表明,在脱水过程中,耐受性物种在光合作用相关基因和碳水化合物代谢方面存在差异美国sellowii和细胞壁重塑和n代谢(特别是RH期间)S.lepidophylla.
方法
植物材料和干燥处理
美国sellowii植物采集于墨西哥瓦哈卡州的圣何塞德尔奇拉尔(17°42′56.2″N, 96°56′28.4″W)。美国lepidophylla采集于墨西哥莫雷洛斯的特拉科特佩克(18°49′19.6″N, 98°45′10.3″W)(附加文件12).在分析之前,两种植物都保持在干燥状态。以上标本由来自墨西哥国立大学伊兹塔卡拉高等研究学院(FES)的Daniel Tejero-Díez教授进行形态学鉴定并保存在墨西哥国立大学植物标本室(UNAM)。美国denticulata隶属于UNAM生物研究所植物园的样本由Aída Telléz Velasco提供。在进行干燥试验之前,耐受性物种在温室/生长室条件下再水化和适应至少5天。在温室条件下,干燥实验在含有Sunshine®:Tezontle(2:1)的310毫升罐子中进行。水被停了一个月,罐子每2天称重一次,直到达到恒定的重量。记录RH(%)和温度的平均值,直到达到恒定的重量。为了评估DT,植物浇水并保持在水化条件下至少1周。干燥速率的建立使用外植体从良好的灌溉个体,去除不活的组织和蒸馏水洗涤两次;美国lepidophylla外植体从其圆形排列的第3行和第4行采集。外植体在24°C的生长室内漂浮在水面上30分钟,然后用吸干法去除多余水分,将外植体置于培养皿中称量(W我).然后将样品立即置于生长室(24°C)内的封闭塑料盒(40 × 21.5 × 13 cm)中,其中含有饱和盐溶液(MgCl2),以降低系统湿度。每隔一定时间取下样品称重(Wx),为期24小时。在干燥期之后,复水的样品被浸入去离子水中特定时间。含水率(WC)的计算公式为:WC = (Wx- Wd) / (W我- Wd) × 100,其中Wd为80°C孵育15 h后获得的干重。
RNA提取,文库构建和测序
在脱水过程中的特定时间点(通过干燥曲线确定含水量的70%、50%和10%)和复水过程中的特定时间点(耐受种)获得充分水合的组织外植体。使用PureLink™植物RNA试剂(Invitrogen)提取RNA,用DNase I (Roche)处理,然后使用TRIzol™试剂(Invitrogen)进一步纯化。使用安捷伦2100生物分析仪(Agilent Technologies)评估RNA样本的完整性。使用TruSeq RNA文库准备试剂盒v2 (Illumina)收集来自两个独立副本的RNA用于文库制备。cDNA文库在NextSeq平台(Illumina)上采用2 × 75对端模式进行测序。文库和测序在基因组服务实验室进行(UGA-LANGEBIO, Cinvestav,墨西哥)。
转录组从头组装和注释
使用Trimmomatic (v0.35)对原始数据进行预处理[66]删除适配器序列并过滤低质量的读取。使用Trinity (v2.1.1)获得De novo转录组组合[35]和SOAPdenovo-Trans (v1.04) [36]和默认参数。所产生的组件的质量评估包括:rnaQUAST (v1.4.0) [67], BUSCO (v2.0);真核生物亚群)[37]和引爆(v1.11) [45].利用BLASTX (bitscore≥90)对植物RefSeq (NCBI)和UniProt/SwissProt数据库以及以下物种的蛋白质模型进行功能注释:答:芥,美国moellendorffii,Physcomitrella金属盘,Amborella trichopoda(运用植物)。所有的转录组版本(不同的软件和参考集)和注释可根据作者的要求提供。
反应性转录本的鉴定和功能富集分析
参考转录组用于量化不同水化状态下的表达。使用Bowtie2对裁剪后的读进行对齐[68]和RSEM [69]]用于转录物丰度估计。表达水平用edgeR量化[70].为了计算每个物种的分散参数,根据Martinez和Reyes-Valdés开发的算法,将一组跨文库特异性较低的转录本分类为管家基因[71].logFC≥1或≤−1且FDR < 0.01的转录本被认为是显著的。使用MapMan术语在SuperViewer在线服务器(http://bar.utoronto.ca/),连同成绩单一并递交答:芥注释(72].对参考组合和对脱水或补液反应的差异表达转录本进行MapMan分类。分类中有应对脱水或补液用的p-value < 0.05 (SuperViewer分析)被归为显著富集的类别。每一类都表示为诱导类(绝对值)与参考转录组集合中相同类的总数之比
蛋白质组预测和聚类
用TransDecoder (https://transdecoder.github.io/, v2.0.1),以最少100个氨基酸的长度进行过滤。预测的正交群卷柏根据OrthoFinder算法(v2.1.2)对蛋白质进行聚类[39使用默认设置。维恩图工具jvenn [73]被用来比较物种之间的正交类群。
实时定量PCR分析
选择在耐受种中产生差异诱导的单拷贝正交组进行验证。qRT-PCR反应分别对水合外植体(对照条件)、极度脱水(含水量10%)和早期复水(2 h)进行。qRT-PCR在磁感应循环器(生物分子系统)中进行,使用种特异性或通用PCR引物(信息在附加文件中提供)5)和试剂SensiFast TM SYBR No-ROX试剂盒(Bioline)。PCR循环条件为:95°C 2 min, 95°C 5 s, 65°C 10 s, 72°C 20 s,循环40次。使用公式2计算相对于参考基因(泛素蛋白连接酶)的表达水平(−ΔCT).与对照条件相比,每个物种的变化值加倍。
光合参数
用CIRAS-3便携式光合作用系统(PP Systems, USA)进行气体交换测量。外植体的净光合速率以250cc / min的试管流速测定−1、有限公司2浓度为390 μmol mol−1相对湿度为70%,光强为1000 μmol m−2年代−1.数据采用干质量归一化方法进行物种间比较。Fv/Fm用Pocket PEA叶绿素荧光计(Hansatech Instruments, UK)在15分钟暗适应外植体中测定。
数据和材料的可用性
本研究中生成的原始数据已保存在NCBI序列读取存档(SRA)存储库中,访问编号为SRR11554869至SRR11554884。Trinity de novo转录组组装体存放在DDBJ/EMBL/GenBank转录组霰弹枪组装体(TSA)中,分别位于GIMF00000000、GIMG00000000和GIMH00000000的目录下。
缩写
- agp:
-
阿拉伯半乳聚糖蛋白质
- 车身:
-
对标通用单拷贝矫形仪
- DH:
-
脱水
- DT:
-
脱水耐性
- ELIPs:
-
早期光诱导蛋白
- 李:
-
晚期胚胎发生丰富
- MIPs:
-
主要固有蛋白质
- RFOs:
-
棉子糖家族低聚糖
- RH:
-
补液
- ROS:
-
活性氧种类
- 泛太平洋伙伴关系:
-
Trehalose-6-phosphate磷酸酶
- TPS:
-
海藻糖磷酸合酶
- XTH:
-
Xyloglucan endotransglucosylases /水解酶
参考文献
- 1.
古石松属(Selaginella)的历史生物地理:泛大陆对干旱生境的早期适应。支序分类学》2016。https://doi.org/10.1111/cla.12184.
- 2.
银行农协。松柏和4亿年的分离。植物学报2009;60:223-38。
- 3.
Arrigo N, Therrien J, Anderson CL, Windham MD, Haufler CH, Barker MS.了解卷柏树(Selaginella subg)系统发育关系和生态多样性的全证据方法。Tetragonostachys。J学报。2013;100:1672-82。
- 4.
卷柏科的系统发育:形态学终究有价值!Am J Bot. 2016; 103:2136-59。https://doi.org/10.3732/ajb.1600156.
- 5.
基于rbcL序列的卷柏科植物系统发育关系。Am J Bot. 2002; 89:506-17。
- 6.
周旭明,Rothfels CJ,张磊,何志荣,乐Péchon T,何红,等。基于质体和核位点的卷柏属(卷柏科:卷柏科)系统发育研究。支序分类学。2015;32:360 - 89。
- 7.
翁建奎,Noel JP。卷柏属植物的化学多样性:陆生植物平行和趋同代谢进化的参考系统。植物科学,2013;4:119。https://doi.org/10.3389/fpls.2013.00119.
- 8.
Baniaga AE, Arrigo N, Barker MS.卷柏树核基因组小,基因组大小进化速率低。Genome Biol Evol 2016; 8:1516-25。https://doi.org/10.1093/gbe/evw091.
- 9.
王晓燕,王晓燕,王晓燕,等。陆生植物营养性干旱性的进化。植物生态学报2000;151:85-100。https://doi.org/10.1023/A:1026550808557.
- 10.
Proctor MCF, Pence VC。营养组织:苔藓植物、维管再生植物和营养繁殖体。正确的做法:布莱克·M,普里查德·HW,编辑。植物的干燥和存活:干燥而不死亡。沃灵福德:CABI;2002.207 - 37页。https://doi.org/10.1079/9780851995342.0207.
- 11.
Pandey V, Ranjan S, Deeba F, Pandey AK, Singh R, Shirke PA,等。干燥诱导的再生植物松柏生理生化变化。植物生理学报,2010;37(3):369 - 369。
- 12.
林志强,刘志强,刘志强,等。植物的耐旱性:三种卷柏属植物细胞壁半纤维素多糖的结构特征。碳水化合物聚合物,2019;208:180-90。https://doi.org/10.1016/j.carbpol.2018.12.051.
- 13.
Yobi A, Wone BWM, Xu W, Alexander DC, Guo L, Ryals JA,等。比较干燥敏感和耐干燥松柏属植物之间的代谢谱,揭示了对复活性状的深刻认识。植物学报(英文版)2012;
- 14.
杨建军,张建军,张建军,等。耐旱植物光合作用:能量代谢与抗氧化应激防御。植物科学学报,2012;32(2):447 - 447。https://doi.org/10.1016/j.plantsci.2011.01.018.
- 15.
Lebkuecher JG, Eickmeier WG。再生植物鳞翅柏茎卷曲减少光抑制。环境科学。1991;88:597 - 604。https://doi.org/10.1007/BF00317725.
- 16.
拉夫桑贾尼A, Brulé V,西TL,帕西尼D.再生植物卷柏的水响应卷曲。科学通报2015;5:8064。https://doi.org/10.1038/srep08064.
- 17.
《复活植物:生理学与分子生物学》。柏林海德堡:施普林格;2011.p . 339 - 64。https://doi.org/10.1007/978-3-642-19106-0_16.
- 18.
范布伦R,魏秋明,欧思,Pardo J, Bryant D,蒋宁,等。耐干燥松卷的极端单倍型变异。2018;9:13。https://doi.org/10.1038/s41467-017-02546-5.
- 19.
徐铮,辛涛,Bartels D,李勇,顾伟,姚辉,等。对古老的管生植物松柏(Selaginella tamariscina)的基因组分析揭示了与脱水耐性获得相关的进化特征。植物学报,2018;11:983-94。https://doi.org/10.1016/J.MOLP.2018.05.003.
- 20.
Silva Artur MA, Costa M-CD, Farrant JM, Hilhorst HWM。基因组水平对环境的反应:植物的耐旱性。新兴顶级生命科学2019;3:153-63。
- 21.
VanBuren R, Pardo J, Man Wai C, Evans S, Bartels D. elps的大量串联增殖支持陆生植物耐干性的趋同进化。植物物理学报2019;179:1040-9。https://doi.org/10.1104/pp.18.01420.
- 22.
周旭明,张丽波。基于分子(叶绿体和核)、宏观形态和孢子特征的卷柏属(卷柏科)分类。分类单元。2015;64:1117-40。https://doi.org/10.12705/646.2.
- 23.
mikel JT, Smith AR.墨西哥的蕨类植物。第一部分(描述和地图)。纽约:纽约植物园出版社;2004.https://www.nybgshop.org/the-pteridophytes-of-mexico-part-i-descriptions-maps-mem-881?___SID=U.已于2019年7月15日访问。
- 24.
de DP Q, Carollo CA, MCT K, Rizk YS, de VCP A, de PE M,等。Selaginella sellowii极性提取物的体内抗利氏菌活性及化学性质。奥斯瓦尔多·克鲁兹医学研究所2016;111:147-54。https://doi.org/10.1590/0074-02760150307.
- 25.
斜桁DF。南美洲的耐旱植物。环境科学。1987;74:133-6。
- 26.
López-Sáez JA, Pérez-Alonso MJ, Negueruela AV.西班牙卷柏的双黄酮。Zeitschrift für Naturforsch C. 1994; 49:67 - 70。https://doi.org/10.1515/znc-1994-3-417.
- 27.
温德威利根C, Pammenter NW, Mundree S, Farrant J.复活草(Eragrostis nindensis)与相关干燥敏感种(E curvula)的生理比较。植物生长规律2001;35:121-9。https://doi.org/10.1023/A:1014425619913.
- 28.
Dinakar C, Bartels D.不同耐旱性的Linderniaceae近缘种的光响应、氧化应激管理和核酸稳定性。足底。2012;236:541-55。
- 29.
Oliver MJ, Guo L, Alexander DC, Ryals JA, Wone BWM, Cushman JC。姐妹组对比使用非靶向的整体代谢组学分析描述了在干燥耐受性基础上的生化调节Sporobolus stapfianus.植物细胞,2011;23:1231-48。https://doi.org/10.1105/tpc.110.082800.
- 30.
van den Dries N, Facchinelli F, Giarola V, Phillips JR, Bartels D. Linderniaceae中耐干燥性不同的相关植物中LEA-like 11-24基因表达和调控的比较分析。植物学报,2011;190:75-88。https://doi.org/10.1111/j.1469-8137.2010.03595.x.
- 31.
Juszczak I, Bartels D.三种干旱耐受性不同的Linderniaceae近缘种的LEA基因表达、RNA稳定性和色素积累。植物学报,2017;
- 32.
VanBuren R, Wai CM, Pardo J, Giarola V, Ambrosini S, Song X,等。耐旱性是通过基因复制和网络重组进化而来的。《植物细胞》2018;30:2943-58。tpc.00517.2018。https://doi.org/10.1105/tpc.18.00517.
- 33.
Pardo J, Wai CM, Chay H, Madden CF, Hilhorst HWM, Farrant JM,等。草类干旱和耐旱性的相互交织特征。bioRxiv。2019:662379。https://doi.org/10.1101/662379.
- 34.
Xiao L, Yobi A, Koster KL, He Y, Oliver MJ。耐干燥Physcomitrella金属盘:脱水速率和内源性脱落酸(ABA)的参与。植物细胞环境学报,2018;https://doi.org/10.1111/pce.13096.
- 35.
Grabherr MG, Haas BJ, Yassour M, Levin JZ, Thompson DA, Amit I,等。没有参考基因组的RNA-Seq数据的全长转录组组装。生物工程学报2011;29:644-52。https://doi.org/10.1038/nbt.1883.
- 36.
谢勇,吴刚,唐杰,罗荣,Patterson J,刘姝,等。SOAPdenovo-trans:带有短RNA-Seq读的转录组从头组装。生物信息学。2014;30:1660-6。https://doi.org/10.1093/bioinformatics/btu077.
- 37.
Simão FA, Waterhouse RM, Ioannidis P, Kriventseva EV, Zdobnov EM. BUSCO:用单拷贝矫形仪评估基因组组装和注释完整性。生物信息学。2015;31:3210-2。https://doi.org/10.1093/bioinformatics/btv351.
- 38.
Banks JA, Nishiyama T, Hasebe M, Bowman JL, Gribskov M, de Pamphilis C,等。卷柏树基因组鉴定了与维管植物进化相关的基因变化。科学。2011;332:960-3。https://doi.org/10.1126/science.1203810.
- 39.
Emms DM, Kelly S. OrthoFinder:解决全基因组比较中的基本偏差,极大地提高了正交群推断的准确性。基因组生物学2015;16:157。https://doi.org/10.1186/s13059-015-0721-2.
- 40.
González-Morales SI, Chávez-Montes RA, Hayano-Kanashiro C, Alejo-Jacuinde G, Rico-Cambron TY, de Folter S,等。调控网络分析揭示了种子耐干性的新调控因子拟南芥.中国生物医学工程学报,2016;https://doi.org/10.1073/pnas.1610985113.
- 41.
陈平,聂荣荣,贾洛拉,巴特尔斯等。再生植物细胞壁在脱水和复水过程中的动态响应。植物科学进展2020;10:1698。https://doi.org/10.3389/fpls.2019.01698.
- 42.
Mitra J,徐刚,王斌,李明娟,邓霞。利用再生植物渤亚水分测定系统了解其耐干性。植物科学,2013;4:446。https://doi.org/10.3389/fpls.2013.00446.
- 43.
Brulé V, Rafsanjani A, Asgari M, Western TL, Pasini D.三维功能梯度直接诱导再生植物松卷的茎卷曲。J R Soc接口。2019;16:20190454。
- 44.
Honaas LA, Wafula EK, Wickett NJ, Der JP ZY, Edger PP,等。选择优良的De Novo转录组组合:利用最佳植物基因组的经验教训。PLoS One. 2016;11:e0146062。https://doi.org/10.1371/journal.pone.0146062.
- 45.
Li B, Fillmore N, Bai Y, Collins M, Thomson JA, Stewart R,等。从RNA-Seq数据中评价新生转录组组装。基因组生物学。2014;15:553。https://doi.org/10.1186/s13059-014-0553-5.
- 46.
巴塔利亚M,奥尔维拉-卡里略Y,加西亚鲁比奥A,坎波斯F,科瓦鲁比亚斯AA。神秘的LEA蛋白和其他亲水蛋白。植物物理学报2008;148:6-24。https://doi.org/10.1104/pp.108.120725.
- 47.
杨建平,王晓燕,王晓燕,等。干旱和耐旱系统的分子遗传学研究。正确的做法:布莱克·M,普里查德·HW,编辑。植物的干燥和存活:干燥而不死亡。沃灵福德:CABI;2002.319 - 41页。https://doi.org/10.1079/9780851995342.0319.
- 48.
被子植物的耐干燥性:转录组学和基因组测序的提示。植物科学进展2017;22:705-17。https://doi.org/10.1016/j.tplants.2017.05.007.
- 49.
法兰特JM,摩尔JP。规划耐干性:从植物到种子再到再生植物。植物生物学杂志,2011;14:340-5。
- 50.
Yobi A, Wone BWM, Xu W, Alexander DC, Guo L, Ryals JA,等。水化状态下松柏的代谢组学分析为其耐旱性的机制基础提供了新的认识。植物学报,2013;6:369-85。
- 51.
王旭,陈松,张宏,石磊,曹峰,郭磊,等。生理和蛋白质组学分析揭示了蕨类植物柽柳卷柏(Selaginella tamariscina)的耐脱水机制。蛋白质组学杂志2010;9:6561-77。
- 52.
Iturriaga G, Cushman MAF, Cushman JC。一份来自复活植物松柏的EST目录揭示了非生物胁迫适应基因。植物科学,2006;170:1173-84。https://doi.org/10.1016/j.plantsci.2006.02.004.
- 53.
陆生植物Selaginella moellendorffii主要固有蛋白的注释及蛋白家族的进化。植物科学,2012;3:33。https://doi.org/10.3389/fpls.2012.00033.
- 54.
汤姆森WW,普拉特KA。黄豆干叶肉细胞秩序的保持卷柏lepidophylla)胡克和格里夫。春天)。安·博特1997;79:439-47。https://doi.org/10.1006/anbo.1996.0375.
- 55.
Neeragunda Shivaraj Y, Barbara P, Gugi B, Vicré-Gibouin M, Driouich A, Ramasandra Govind S,等。复活植物对干燥的结构、生理、细胞和分子响应的展望。Scientifica。2018;2018:9464592。
- 56.
张强,张丽娟。耐干燥再生植物光合作用的保护作用。植物生理学报2018;227:84-92。https://doi.org/10.1016/J.JPLPH.2018.05.002.
- 57.
Rodriguez MCS, Edsgärd D, Hussain SS, Alquezar D, Rasmussen M, Gilbert T,等。耐干燥的复活植物山楂的转录组。植物学报,2010;32(3):347 - 347。https://doi.org/10.1111/j.1365-313X.2010.04243.x.
- 58.
Gechev TS, Benina M, Obata T, Tohge T, Sujeeth N, Minkov I,等。复活冰川遗迹雪莲耐干性的分子机制。细胞分子生命科学,2013;70:689-709。https://doi.org/10.1007/s00018-012-1155-6.
- 59.
马超,王宏,Macnish AJ, Estrada-Melo AC,林杰,常勇,等。转录组学分析显示,复活植物木香的脱水耐受性与多种蛋白激酶和转录因子有关。Hortic Res. 2015;2:15034。https://doi.org/10.1038/hortres.2015.34.
- 60.
张强,宋旭,巴特利斯。耐干燥植物碳水化合物代谢中的酶和代谢产物。蛋白质组。2016;4。https://doi.org/10.3390/PROTEOMES4040040.
- 61.
新的耐旱植物,包括一种草,在墨西哥中部高地,积累海藻糖。science J Bot. 2000;48:153。
- 62.
刘明生,钱春涛,林铁鹏。柽柳卷柏干旱耐受性的组成成分和诱导基因表达。植物细胞物理学报2008;49:653-63。https://doi.org/10.1093/pcp/pcn040.
- 63.
De Moraes MG, De Oliveira AAQ, Santos MG。巴西东南海岸岩石露头上生长的蕨类植物和石松中的糖。生物工程学报。2014;30:442 - 441。
- 64.
Zentella R, mascorl - gallardo JO, Van Dijck P, Folch-Mallol J, Bonini B, Van Vaeck C,等。松柏藻海藻糖-6-磷酸合酶在酵母tps1突变体中补充生长和耐胁迫缺陷。植物物理学报1999;119:1473-82。
- 65.
López-Arredondo D, González-Morales SI, Bello-Bello E, Alejo-Jacuinde G, Herrera L.工程粮食作物在恶劣环境中生长。F1000Research。2015; 4:651。https://doi.org/10.12688/f1000research.6538.1.
- 66.
Bolger AM, Lohse M, Usadel B. Trimmomatic:一种用于Illumina序列数据的灵活微调器。生物信息学。2014;30:2114-20。https://doi.org/10.1093/bioinformatics/btu170.
- 67.
布希马诺娃E,安提波夫D,拉皮德斯A,苏沃洛夫五世,普吉贝尔斯基AD。rnaQUAST:用于新生转录组组装的质量评估工具。生物信息学。2016;32:2210-2。https://doi.org/10.1093/bioinformatics/btw218.
- 68.
Langmead B, Salzberg SL.快速间隙读取对准领结2。Nat方法。2012;9:357-9。https://doi.org/10.1038/nmeth.1923.
- 69.
杜威中国出版社。RSEM:从有或没有参考基因组的RNA-Seq数据中精确的转录物定量。生物信息学。2011;12:323。https://doi.org/10.1186/1471-2105-12-323.
- 70.
罗宾逊医学博士,麦卡锡DJ,史密斯GK。edgeR:用于数字基因表达数据的差异表达分析的生物导体包。生物信息学。2010;26:139-40。https://doi.org/10.1093/bioinformatics/btp616.
- 71.
Martínez O, Reyes-Valdés MH.通过信息论定义转录组中的多样性、专业化和基因特异性。中国科学(d辑:自然科学版)2008;https://doi.org/10.1073/pnas.0803479105.
- 72.
唐卓。基于浏览器的拟南芥基因组功能分类superviewer。中华生物医学杂志2003;2003:271 - 2。
- 73.
Bardou P, Mariette J, Escudié F, Djemiel C, Klopp C. jvenn:交互式维恩图查看器。生物信息学,2014;15:293。https://doi.org/10.1186/1471-2105-15-293.
确认
我们感谢Klaus Mehltreter博士帮助我们获得植物材料和技术建议。我们也感谢Edgar博士Balcázar-López和m.sc Aída Telléz Velasco为我们提供植物材料。致丹尼尔博士Tejero-Díez为标本的形态鉴定和凭证沉积。感谢Octavio博士Martínez和Luis Fernando博士García-Ortega对弥散参数计算的支持。G.A.-J。感谢墨西哥CONACyT学院提供硕士学位。
资金
这项工作得到了来自CONACytT基础科学项目(拨款00126261)、德克萨斯州州长大学研究计划(05-2018)的部分资助,以及来自霍华德休斯医学研究所(拨款55005946)对l.h.e的高级学者资助。
作者信息
从属关系
贡献
G.A.-J。和L.H.-E。设计研究。G.A.-J。和A.O.-A进行了实验研究。G.A.-J。和S.I.G.-M。进行生物信息学分析。G.A.-J。,S.I.G.-M., J.S. and L.H.-E. analyzed the data. G.A.-J., J.S. and L.H.-E. wrote the paper. All authors read and approved the manuscript.
相应的作者
道德声明
伦理批准和同意参与
抽样地点美国sellowii而且美国lepidophylla没有被列为自然保护区,也没有被列入墨西哥官方规范(NOM-059-SEMARNAT-2010)的濒危物种。具体地说,美国lepidophylla经土地所有人事先同意(瓜达拉哈拉大学CUCEI的Edgar博士Balcázar-López)收集。
发表同意书
不适用。
相互竞争的利益
作者声明他们没有竞争利益。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构附属的管辖权要求保持中立。
补充信息
附加文件1:图S1。
外植体的耐旱能力和干燥速率美国lepidophylla而且美国denticulata.
附加文件2:图S2。
形态和RNA完整性美国lepidophylla而且美国denticulata在干燥过程中。
附加文件3:图S3。
干燥反应转录本的大小分布及其注释。
附加文件4:图S4。
蛋白质序列一致性的比较卷柏物种。
附加文件5:图S5。
实时定量PCR验证。
附加文件6:图S6。
脱水过程中诱导基因的亚类。
附加文件7:图S7。
复水诱导基因的功能分析及亚类。
附加文件8:图S8。
耐受性植物在复水过程中的光合作用代谢。
附加文件9:表S1。
MapMan分析的子类别列表。
附加文件10:表S2。
主要内在蛋白(MIPs)的亚族响应干燥卷柏.
附加文件11:表S3。
DH和RH诱导的细胞壁亚分类。
附加文件12。
形态鉴定、生境描述及坐标。
权利与权限
开放获取本文遵循创作共用署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),该协议允许在任何媒体或格式中使用、分享、改编、分发和复制,只要您给予原作者和来源适当的署名,提供创作共用许可协议的链接,并说明是否有更改。本文中的图片或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果材料不包含在文章的创作共用许可中,并且您的预期用途不被法律法规允许或超出了允许的用途,您将需要直接从版权所有者那里获得许可。欲查看此许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献放弃书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信用额度中另有说明。
关于本文
引用本文
乔治亚州的Alejo-Jacuinde, González-Morales,南卡罗来纳州的Oropeza-Aburto。et al。比较转录组分析表明,干旱耐受性的趋同进化卷柏物种。植物生物学20.468(2020)。https://doi.org/10.1186/s12870-020-02638-3
收到了:
接受:
发表:
关键字
- 卷柏
- 脱水耐性
- 趋同进化