- 研究文章gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
的鉴定、表征和功能分析gydF4y2Ba无性生殖的gydF4y2Ba与万寿菊花器官和种子发育相关的亚家族基因(gydF4y2Ba万寿菊gydF4y2Ba)gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba20.gydF4y2Ba文章编号:gydF4y2Ba439gydF4y2Ba(gydF4y2Ba2020gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
无性生殖的gydF4y2Ba(gydF4y2BaAG)gydF4y2Ba)亚家族基因调控花器官的萌发和发育、果实和种子的发育。目前,对其功能的研究还不够gydF4y2BaAG)gydF4y2Ba菊科亚家族基因。金盏花(gydF4y2Ba万寿菊gydF4y2Ba)属于菊科植物,其独特的花序结构使其成为了解植物花器官发育的重要研究对象。gydF4y2Ba
结果gydF4y2Ba
四个gydF4y2BaAG)gydF4y2Ba分离出万寿菊亚家族基因,系统发育将其归类为C类(gydF4y2BaTeAG1gydF4y2Ba而且gydF4y2BaTeAG2gydF4y2Ba)及D类(gydF4y2BaTeAGL11-1gydF4y2Ba而且gydF4y2BaTeAGL11-2gydF4y2Ba)基因。表达谱分析表明,这4个基因在万寿菊生殖器官中均有高表达。亚细胞定位分析表明,这四种蛋白均位于细胞核内。蛋白质-蛋白质相互作用分析表明,C类蛋白质的相互作用方式比D类蛋白质更广泛。异位表达的功能分析gydF4y2Ba拟南芥gydF4y2Ba透露,gydF4y2BaTeAG1gydF4y2Ba显示了一个指定雄蕊标识和心皮标识的C函数gydF4y2BaTeAGL11-1gydF4y2Ba表现出调节种子和花瓣发育的D功能。此外,两者都过表达gydF4y2BaTeAG1gydF4y2Ba而且gydF4y2BaTeAGL11-1gydF4y2Ba导致卷曲莲座叶和早开花在gydF4y2Ba拟南芥gydF4y2Ba.gydF4y2Ba
结论gydF4y2Ba
本研究为研究分子机制提供了新的思路gydF4y2BaAG)gydF4y2Ba菊科植物亚家族基因的研究及花性状改良的技术支持。gydF4y2Ba
背景gydF4y2Ba
花是植物的生殖器官,被认为是植物进化过程中重要的形态创新。MADS-box转录因子是花器官识别的关键因素[gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba,果实和种子发育[gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4gydF4y2Ba,以及叶和根的发育[gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba].在遗传研究的基础上,引入了一个著名的ABCDE模型来解释花器官决定的遗传调控。在该模型中,A类和E类基因决定萼片;A类、B类和E类基因指定花瓣;B、C、E类基因调控雄蕊命运;C类和E类基因控制心皮的形成;D类和E类基因指导胚珠的发育[gydF4y2Ba7gydF4y2Ba,gydF4y2Ba8gydF4y2Ba].的gydF4y2Ba无性生殖的gydF4y2Ba(gydF4y2BaAG)gydF4y2Ba)属MADS-box C/D类亚家族基因参与花器官、花分生组织和果实发育的调控。以前的报告表明gydF4y2BaAG)gydF4y2Ba亚家族基因最有可能起源于开花植物中具有多重全基因组复制事件(WGDs)的几个副系,导致可能的亚功能化[gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10gydF4y2Ba,gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba].第一批wgd可能会产生gydF4y2BaAG)gydF4y2Ba(C类)血统和gydF4y2BaAGAMOUS-LIKE11gydF4y2Ba(gydF4y2BaAGL11gydF4y2Ba, D类)血统[gydF4y2Ba10gydF4y2Ba,gydF4y2Ba11gydF4y2Ba].的gydF4y2BaAG)gydF4y2Ba然后在核心枝上经历第二次WGDs,产生两个子枝gydF4y2BaeuAGgydF4y2Ba而且gydF4y2Ba满(中国)gydF4y2Ba[gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10gydF4y2Ba].gydF4y2Ba
的基因gydF4y2BaAG)gydF4y2Ba决定花分生组织发育和生殖器官(雄蕊和心皮)身份的谱系[gydF4y2Ba13gydF4y2Ba]首次在拟南芥中发现(gydF4y2Ba拟南芥gydF4y2Ba,gydF4y2BaAG)gydF4y2Ba) [gydF4y2Ba13gydF4y2Ba和安蒂莱茵(gydF4y2Ba金鱼草majusgydF4y2Ba,gydF4y2Ba请耐心gydF4y2Ba) [gydF4y2Ba10gydF4y2Ba].在拟南芥中,C类基因阻止A类基因在内螺纹花器官中发挥作用,这显然是通过减少gydF4y2BaAG)gydF4y2Ba在拟南芥中表达,导致生殖器官如花瓣状雄蕊和萼片或花瓣状心皮的同源性突变[gydF4y2Ba14gydF4y2Ba,gydF4y2Ba15gydF4y2Ba,gydF4y2Ba16gydF4y2Ba].的功能gydF4y2BaAG)gydF4y2Ba谱系基因先前已在其他杜鹃花属植物中被鉴定过,包括菊花(gydF4y2Ba菊花gydF4y2Ba) [gydF4y2Ba17gydF4y2Ba),佩妮(gydF4y2Ba佩妮矮牵牛gydF4y2Ba) [gydF4y2Ba18gydF4y2Ba),杨树(gydF4y2Ba杨树trichocarpagydF4y2Ba) [gydF4y2Ba2gydF4y2Ba],以及水稻等单子叶植物(gydF4y2Ba栽培稻gydF4y2Ba) [gydF4y2Ba19gydF4y2Ba].gydF4y2Ba
然后,gydF4y2Ba花卉绑定PROTEIN7gydF4y2Ba(gydF4y2BaFBP7gydF4y2Ba),gydF4y2Ba花卉绑定PROTEIN11gydF4y2Ba(gydF4y2BaFBP11gydF4y2Ba)调控胚珠鉴定为D类基因,这两个基因属于矮牵牛属gydF4y2BaAGL11gydF4y2Ba血统(gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba21gydF4y2Ba].拟南芥中有三个D类基因,命名为gydF4y2BaSEEDSTICKgydF4y2Ba(gydF4y2BaSTKgydF4y2Ba;原名gydF4y2BaAGL11gydF4y2Ba),gydF4y2BaSHATTERPROOT1gydF4y2Ba(gydF4y2BaSHP1gydF4y2Ba),gydF4y2BaSHATTERPROOT2gydF4y2Ba(gydF4y2BaSHP2gydF4y2Ba),它们在调节胚珠发育的功能上冗余重叠[gydF4y2Ba22gydF4y2Ba,gydF4y2Ba23gydF4y2Ba,gydF4y2Ba24gydF4y2Ba].单基因和三基因突变体的表型证实了这一点。在三倍突变体中,珠被转化为腕皮结构,雌配子体发育在大孢子发生后中断。然而,在gydF4y2BastkgydF4y2Ba单株突变体,只有胚珠珠柄比野生型大,成熟种子不脱离角果[gydF4y2Ba24gydF4y2Ba,gydF4y2Ba25gydF4y2Ba,gydF4y2Ba26gydF4y2Ba,gydF4y2Ba27gydF4y2Ba].此外,栽培葡萄(gydF4y2Ba葡萄)gydF4y2Ba[gydF4y2Ba28gydF4y2Ba和杨柳[gydF4y2Ba2gydF4y2Ba),这表明gydF4y2BaSTK / AGL11gydF4y2Ba具有调节胚珠发育的保守功能。gydF4y2Ba
菊科植物是开花植物中最大的植物科之一,具有独特的头状花序,由数百个射线小花和圆盘小花组成。头状花序,外层为无雄蕊的不育射线小花,内部为四轮生器官完整的圆盘小花。在一个花序中存在多种小花形态特征,如育性、对称性和器官融合等。因此,Asteraceae为研究上述现象的遗传调控提供了无可比拟的机会。先前的研究表明生长素和基因gydF4y2BaLFYgydF4y2Ba而且gydF4y2Ba不明飞行物gydF4y2Ba都参与了头花的图案形成,那呢gydF4y2Ba赛克gydF4y2Ba类基因调节花的对称性[gydF4y2Ba29gydF4y2Ba,gydF4y2Ba30.gydF4y2Ba,gydF4y2Ba31gydF4y2Ba].MADS-box家族基因在花分生组织和花器官发育的调控中发挥着重要作用,其在菊科植物头状花序形成中的调控作用一直是研究热点。迄今为止,B类基因的功能已在许多菊科物种中得到报道[gydF4y2Ba32gydF4y2Ba,gydF4y2Ba33gydF4y2Ba,gydF4y2Ba34gydF4y2Ba],但有关的报道很少gydF4y2Ba无性生殖的gydF4y2Ba菊科植物亚家族基因。到目前为止,gydF4y2BaAG)gydF4y2Ba非洲菊属(gydF4y2Ba大丁草混合gydF4y2Ba) [gydF4y2Ba35gydF4y2Ba,菊花gydF4y2Ba36gydF4y2Ba)和向日葵(gydF4y2Ba向日葵gydF4y2Ba) [gydF4y2Ba37gydF4y2Ba的研究结果表明gydF4y2BaAG)gydF4y2Ba在确定雄蕊和心皮的同一性方面,菊科植物的功能是保守的。不像gydF4y2BaAG)gydF4y2Ba谱系基因的功能gydF4y2BaAGL11gydF4y2Ba菊科的谱系基因尚未见报道。gydF4y2Ba
金盏花(gydF4y2Ba万寿菊gydF4y2Ba)是一种受欢迎的观赏植物。万寿菊属菊科植物,具有典型的头花,由两种形态不同的小花组成,边缘为射线(不育)小花,中心为圆盘(可育)小花。万寿菊从播种到开花的生长期为2-3个月。在菊科植物的进化史中,万寿菊经历了一个漫长的进化过程,它位于一个衍生的calendleae分支中[gydF4y2Ba38gydF4y2Ba].这些特性使万寿菊成为研究花器官发育的重要植物。在这里,两个gydF4y2BaAG)gydF4y2Ba血统基因(gydF4y2BaTeAG1gydF4y2Ba而且gydF4y2BaTeAG2gydF4y2Ba)和两个gydF4y2BaAGL11gydF4y2Ba血统基因(gydF4y2BaTeAGL11-1gydF4y2Ba而且gydF4y2BaTeAGL11-2gydF4y2Ba)的克隆,研究其表达模式,并确定其亚细胞定位。采用酵母双杂交试验和异位转化技术对小花器官形成和种子发育的基因功能进行了预测。gydF4y2Ba
结果gydF4y2Ba
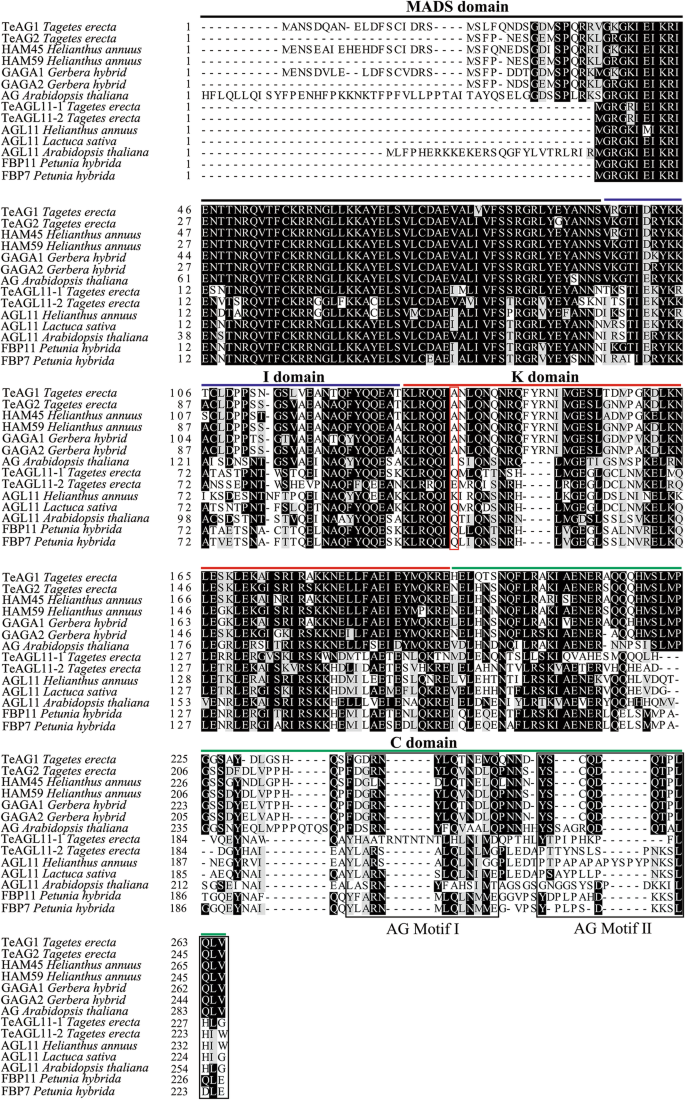
万寿菊的分离与分子表征gydF4y2Ba无性生殖的gydF4y2Ba亚基因gydF4y2Ba
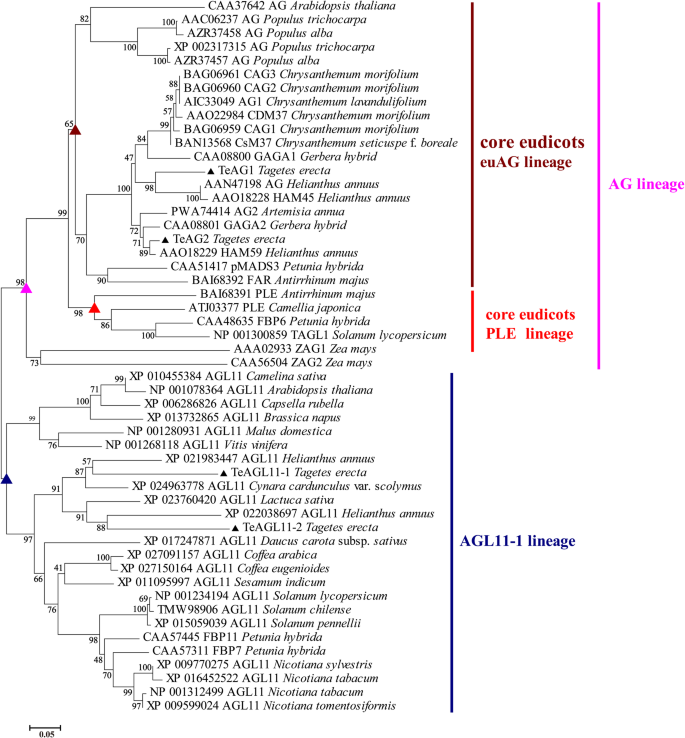
研究…的功能gydF4y2BaAG)gydF4y2Ba万寿菊亚家族基因gydF4y2Ba,gydF4y2Ba我们放大gydF4y2BaTeAG1gydF4y2Ba(991个基点),gydF4y2BaTeAG2gydF4y2Ba(837个基点),gydF4y2BaTeAGL11-1gydF4y2Ba(735个基点)gydF4y2BaTeAGL11-2gydF4y2Ba(831个基点)。其序列包括开放阅读片段、部分5 '非翻译区和部分3 '非翻译区。与模型植物和菊科植物的其他典型C/D蛋白的多重比对表明,这4个蛋白是典型的MADS-box蛋白,包含mads -结构域、I-结构域、k -结构域,氨基酸残基保守,C端有AG基序I和AG基序II(图1)。gydF4y2Ba1gydF4y2Ba).采用邻居连接(NJ)方法进行的系统发育分析显示,这些蛋白被分为AG和AGL11谱系的两个主要分支,分别对应于MADS-box C类和D类基因(图1)。gydF4y2Ba2gydF4y2Ba).第一批WGDs发生在金盏花的进化过程中。2个C类蛋白TeAG1和TeAG2聚在核心euidicot euAG谱系中,2个D类蛋白TeAGL11-1和TeAGL11-2聚在AGL11谱系中。gydF4y2Ba2gydF4y2Ba).TeAG1和TeAG2蛋白分别被认为是向日葵中HAM45和HAM59蛋白的同源蛋白,这两种蛋白都有超过85%的氨基酸同一性(表SgydF4y2Ba2gydF4y2Ba).TeAGL11-1和TeAGL11-2蛋白与其同源物向日葵具有高度的相似性gydF4y2Ba年代gydF4y2BaHaAGL11-1和HaAGL11-2蛋白的氨基酸同源性分别为70.76和65.38%(表SgydF4y2Ba3.gydF4y2Ba).gydF4y2Ba
的表达模式gydF4y2BaTeAGgydF4y2Ba而且gydF4y2BaTeAGL11gydF4y2Ba基因gydF4y2Ba
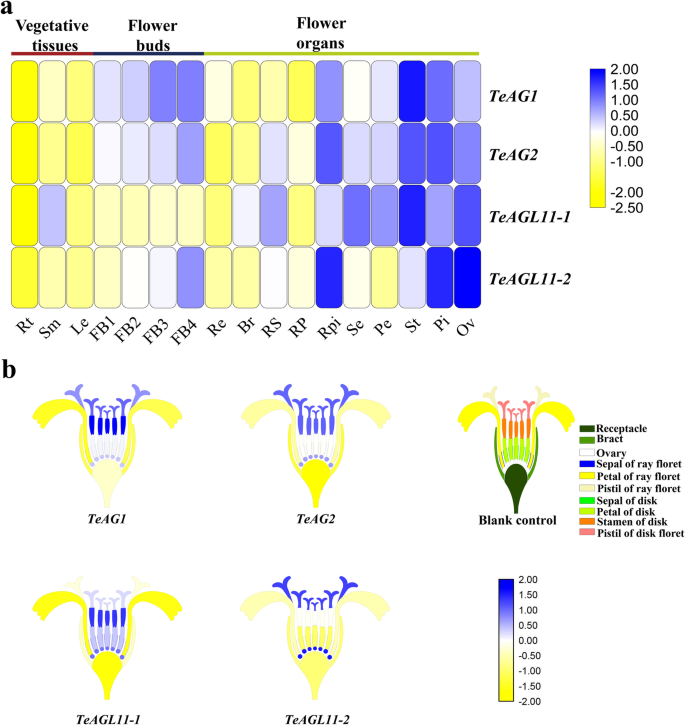
本文采用qRT-PCR方法研究了这4个基因在万寿菊中的表达模式。为了确定基因转录本是否具有阶段依赖性,我们初步检测了其在花芽(FB1-FB4)四个阶段的表达水平。qRT-PCR分析显示gydF4y2BaTeAG1gydF4y2Ba,gydF4y2BaTeAG2,gydF4y2Ba而且gydF4y2BaTeAGL11-2gydF4y2Ba在花芽发育过程中有增加的趋势gydF4y2BaTeAGL11-1gydF4y2Ba花芽发育的四个阶段均无明显变化(图1)。gydF4y2Ba3.gydF4y2Ba无花果。SgydF4y2Ba1gydF4y2Ba,表gydF4y2Ba6gydF4y2Ba).gydF4y2Ba
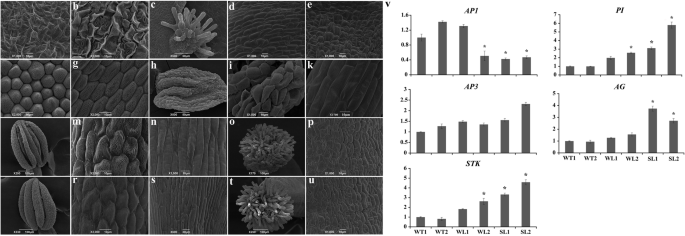
表达水平的gydF4y2BaTeAGgydF4y2Ba而且gydF4y2BaTeAGL11gydF4y2Ba万寿菊不同组织和器官的基因。(gydF4y2Ba一个gydF4y2Ba的相对表达热图gydF4y2BaTeAG1、TeAG2 TeAGL11-1gydF4y2Ba而且gydF4y2BaTeAGL11-2gydF4y2BaqRT-PCR检测不同组织和器官的基因。Rt:根;Sm:茎;勒:叶子;FB1-FB4:花蕾直径分别为0- 1mm、2- 3mm、4 - 5mm、6- 7mm;再保险:插座;Br:苞片;RS:射线小花的萼片;RP:射线小花花瓣;RPi:射线小花的雌蕊; Se: sepal of disk floret; Pe: petal of disk floret; St: stamen of disk floret; Pi: pistil of disk floret; Ov: ovary. (bgydF4y2Ba)的热图gydF4y2BaTeAG1、TeAG2 TeAGL11-1gydF4y2Ba而且gydF4y2BaTeAGL11-2gydF4y2Ba基于qRT-PCR的相对表达分析万寿菊花序基因。毛坯控制:头状体结构模型gydF4y2Bat . erectagydF4y2Ba不同的颜色代表不同的花器官gydF4y2Ba
我们进一步分析了这4个基因在植物营养组织和花器官开花期的表达水平(图5)。gydF4y2Ba3.gydF4y2Baa, b,图SgydF4y2Ba1gydF4y2Ba,表gydF4y2Ba6gydF4y2Ba).结果表明,这些基因在花器官中高度表达。的gydF4y2BaTeAG1gydF4y2Ba而且gydF4y2BaTeAG2gydF4y2Ba在生殖器官(雄蕊、雌蕊和子房)中表达多于在萼片和花瓣中表达。有趣的是,文字水平gydF4y2BaTeAG1gydF4y2Ba雄蕊含量显著高于雌蕊和子房含量gydF4y2BaTeAG2gydF4y2Ba雄蕊和雌蕊高于子房。两者的表达模式gydF4y2BaAGL11gydF4y2Ba花器官的基因各不相同。gydF4y2BaTeAGL11-1gydF4y2Ba该基因在花盘小花中广泛表达,包括萼片、花瓣、雄蕊和雌蕊,而该基因只在射线花的萼片和雌蕊以及子房中被检测到。值得注意的是,高表达水平gydF4y2BaTeAGL11-1gydF4y2Ba在雄蕊中检测到。相比之下,gydF4y2BaTeAGL11-2gydF4y2Ba在雌蕊和子房中表达高于雄蕊、萼片和花瓣。gydF4y2Ba
TeAG和TeAGL11蛋白的亚细胞定位gydF4y2Ba
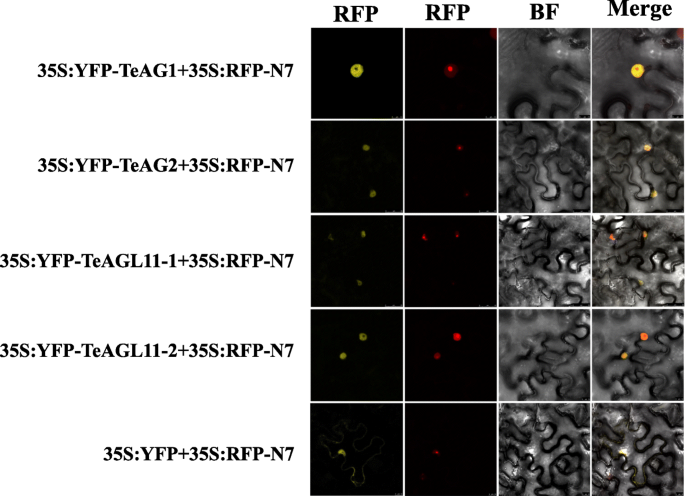
为了深入了解这四个基因的亚细胞定位,四个融合载体gydF4y2Ba35 s: YFP-TeAG1gydF4y2Ba,gydF4y2Ba35 s: YFP-TeAG2gydF4y2Ba,gydF4y2Ba35 s: YFP-TeAGL11-1gydF4y2Ba,gydF4y2Ba35 s: YFP-TeAGL11-2gydF4y2Ba短暂地和gydF4y2Ba35 s:招标书gydF4y2Ba-N7载体进入烟叶gydF4y2Ba,gydF4y2Ba分别。这四种融合载体的荧光信号主要在核仁外的细胞核内观察到(图。gydF4y2Ba4gydF4y2Ba).gydF4y2Ba
TeAG和TeAGL11的蛋白相互作用gydF4y2Ba
为了证实这4种蛋白之间的相互作用,进行了酵母双杂交实验。评估BD结构的自我激活。结果表明没有观察到自激活(图SgydF4y2Ba2gydF4y2Baa) TeAG1和TeAG2蛋白在序列上具有高度的相似性,但与其他AGAMOUS亚家族蛋白的相互作用方式不同。如表所示gydF4y2Ba1gydF4y2Ba和无花果。gydF4y2Ba2gydF4y2Bab, TeAG2与TeAG1、TeAGL11-1、TeAGL11-2形成异二聚体,与自身形成同二聚体。而TeAG1只与TeAG2和TeAGL11-1相互作用,没有形成同型二聚体。TeAGL11-1和TeAGL11-2与其他AGAMOUS亚家族蛋白的相互作用能力有限。AGL11-1和AGL11-2之间的相互作用均未形成同型二聚体和异型二聚体。TeAGL11-1和TeAGL11-2与TeAG2单向相互作用。此外,TeAGL11-1与TeAG1具有强相互作用,而TeAGL11-2与TeAG1无相互作用能力。gydF4y2Ba
过度表达的戏剧性效果gydF4y2BaTeAG1gydF4y2Ba拟南芥的萼片和花瓣的一致性gydF4y2Ba
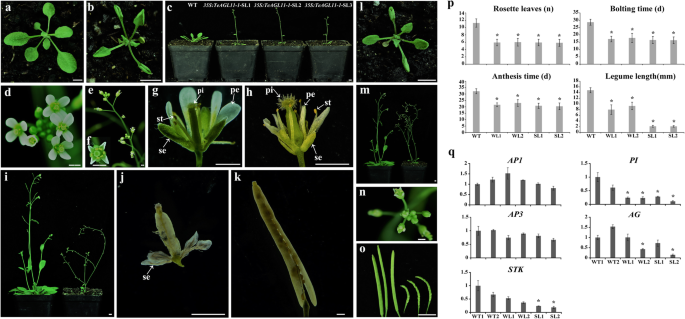
进一步研究的功能gydF4y2BaTeAG1gydF4y2Ba而且gydF4y2BaTeAG2gydF4y2Ba在拟南芥中使用异位表达进行功能分析。十八岁gydF4y2Ba35 s: TeAG1gydF4y2Ba转基因株系和二十三株gydF4y2Ba35 s: TeAG2gydF4y2Ba获得转基因株系。转录水平的gydF4y2BaTeAG1gydF4y2Ba而且gydF4y2BaTeAG2gydF4y2Ba以花的cDNA为模板,进行半定量RT-PCR分析(图SgydF4y2Ba3.gydF4y2Baa、b)。gydF4y2Ba35个年代gydF4y2Ba:gydF4y2BaTeAG2gydF4y2Ba转基因株系与野生株系相比,形态变化不明显。然而,五gydF4y2Ba35个年代gydF4y2Ba:gydF4y2BaTeAG1gydF4y2Ba转基因系表现出严重的表型(命名为gydF4y2BaSl-TeAG1)gydF4y2Ba, 7个表现为弱表型(命名为gydF4y2BaWl-TeAG1)gydF4y2Ba6个没有明显的表型变化。与野生型相比,gydF4y2BaSl-TeAG1gydF4y2Ba而且gydF4y2BaWl-TeAG1gydF4y2Ba转基因株系开花早,莲座叶卷曲,植株大小小。gydF4y2Ba5gydF4y2Baa, b, c, h, l,表gydF4y2Ba2gydF4y2Ba).此外,只有在gydF4y2BaSl-TeAG1gydF4y2Ba在转基因系中,正常的萼片和花瓣的形成被破坏。gydF4y2Ba5gydF4y2Bad, e, f, g,表gydF4y2Ba2gydF4y2Ba).在萼片上缘发现萼片向雌蕊样结构的同源转变。观察到类似的花瓣向雄蕊样结构的转变。gydF4y2Ba5gydF4y2Bae、g、表gydF4y2Ba2gydF4y2Ba).萼片、花瓣和雄蕊保留在角果的基部。gydF4y2Ba5gydF4y2Baj, k)。野生型株系的角果更凹凸、更小,结实率低于正常角果(图1)。gydF4y2Ba5gydF4y2Ba、表gydF4y2Ba2gydF4y2Ba,年代gydF4y2Ba4gydF4y2Ba).gydF4y2Ba
组构表达的转基因拟南芥植株形态异常gydF4y2BaTeAG1gydF4y2Ba基因gydF4y2Ba.gydF4y2Ba一个gydF4y2Ba-gydF4y2BakgydF4y2Ba的形态特征gydF4y2BaSl-TeAG1gydF4y2Ba行和野生型行。(gydF4y2Ba一个gydF4y2Ba)野生型幼苗;(gydF4y2BabgydF4y2Ba)莲座叶严重卷曲的转基因幼苗;(gydF4y2BacgydF4y2Ba)野生型(左)和早开花转基因植物(右);(gydF4y2BadgydF4y2Ba,gydF4y2BafgydF4y2Ba)野生型的正常花;(gydF4y2BaegydF4y2Ba,gydF4y2BaggydF4y2Ba)转基因植物的突变花;(gydF4y2BahgydF4y2Ba)野生型(右)和矮化转基因植株(左);(gydF4y2BajgydF4y2Ba,gydF4y2BakgydF4y2Ba转基因株系的角果较野生株系短,呈黄绿色,萼片、花瓣和雄蕊保留。gydF4y2Ba我gydF4y2Ba).se:萼片;体育:花瓣;圣:雄蕊;Pi:雌蕊,ca-se:腕皮萼片;st-pe: stamen-like花瓣;WT1:野生型线路1;WT2:野生型线路2;WL1:gydF4y2BaWl-TeAG1gydF4y2Ba1号线;WL2:gydF4y2BaWl-TeAG1gydF4y2Ba2号线;SL1:gydF4y2BaSl-TeAG1gydF4y2Ba1号线;SL2:gydF4y2BaSl-TeAGL1gydF4y2Ba第2行。A-c, bar = 5毫米,d-k, bar = 1毫米。(gydF4y2BalgydF4y2Ba)对照植株与转基因植株的主要形态性状统计,*差异显著gydF4y2BaPgydF4y2Ba< 0.05gydF4y2Ba
四轮状的花器官gydF4y2BaSl-TeAG1gydF4y2Ba用扫描电镜(i, j, k, l。gydF4y2Ba6gydF4y2Ba).与野生型的萼片结构比较(图5)。gydF4y2Ba6gydF4y2Baa, b),在转基因株系中,心皮萼片顶部出现了一簇乳头状细胞(图)。gydF4y2Ba6gydF4y2Bac),正常萼片中有气孔的粗糙细胞(图。gydF4y2Ba6gydF4y2Baa)被心皮萼片正面光滑的矩形表皮细胞所取代(图。gydF4y2Ba6gydF4y2Bad).此外,下表皮细胞由正常的有气孔的粗糙型细胞转化而来(图5)。gydF4y2Ba6gydF4y2Bab)为不规则的光滑凸结构(图。gydF4y2Ba6gydF4y2Bae),与花柱的表皮细胞结构相似(图1)。gydF4y2Ba6gydF4y2Bap).转基因植株的第二轮花器官转化为花药样结构的雄蕊状花瓣(图1)。gydF4y2Ba6gydF4y2Bah)由鳞状细胞组成。gydF4y2Ba6gydF4y2Bai).此外,雄蕊状花瓣下部的表皮细胞由粗糙的纺锤形结构转变(图1)。gydF4y2Ba6gydF4y2Bag)变为光滑的丝状结构(图。gydF4y2Ba6gydF4y2Bak, n)。转基因株系的雄蕊和心皮未见明显变化(图。gydF4y2Ba6gydF4y2Bal-u)。一般来说,过表达gydF4y2BaTeAG1gydF4y2Ba在拟南芥中导致了花器官如心皮萼片和雄蕊状花瓣的同源突变。gydF4y2Ba
花器官的扫描电镜图与花器官发育与种子形成之间相关基因的表达水平gydF4y2BaTeAG1gydF4y2Ba转基因拟南芥和野生型系。(gydF4y2Ba一个gydF4y2Ba-gydF4y2BaugydF4y2Ba)中间花器官的扫描电子显微图gydF4y2BaSl-TeAG1gydF4y2Ba转基因拟南芥及野生型株系;(gydF4y2Ba一个gydF4y2Ba,gydF4y2BabgydF4y2Ba)向轴的(gydF4y2Ba一个gydF4y2Ba)和背面(gydF4y2BabgydF4y2Ba野生型萼片的表皮细胞;(gydF4y2BacgydF4y2Ba)转基因植物心皮萼片顶部的乳头状细胞;(gydF4y2BadgydF4y2Ba,gydF4y2BaegydF4y2Ba)向轴的(gydF4y2BadgydF4y2Ba)和背面(gydF4y2BaegydF4y2Ba)转基因植物心皮萼片表皮细胞;(gydF4y2BafgydF4y2Ba,gydF4y2BaggydF4y2Ba)上(gydF4y2BafgydF4y2Ba)及底部部分(gydF4y2BaggydF4y2Ba)野生型的花瓣;(gydF4y2BahgydF4y2Ba)转基因株系中花瓣转化为花药样结构;(gydF4y2Ba我gydF4y2Ba,gydF4y2BakgydF4y2Ba)顶端的表皮细胞(gydF4y2Ba我gydF4y2Ba)和底部(gydF4y2BakgydF4y2Ba花药样结构的一部分;(gydF4y2BalgydF4y2Ba)野生型株系的花药结构;(gydF4y2Ba米gydF4y2Ba,gydF4y2BangydF4y2Ba花药的表皮细胞(gydF4y2Ba米gydF4y2Ba)及灯丝(gydF4y2BangydF4y2Ba)在野生型系中;(gydF4y2BaogydF4y2Ba)野生型株系柱头的乳头细胞;(gydF4y2BapgydF4y2Ba野生型株系花柱的表皮细胞;(gydF4y2Ba问gydF4y2Ba)转基因植株的花药结构;(gydF4y2BargydF4y2Ba,gydF4y2Ba年代gydF4y2Ba花药的表皮细胞(gydF4y2BargydF4y2Ba)及灯丝(gydF4y2Ba年代gydF4y2Ba)在转基因植物;(gydF4y2BatgydF4y2Ba转基因植株柱头乳头细胞;(gydF4y2BaugydF4y2Ba)转基因植物花柱表皮细胞。(gydF4y2BavgydF4y2Ba)通过qRT- PCR分析对照和转基因拟南芥花中花器官发育和种子形成相关基因的表达量。WT1:野生型线路1;WT2:野生型线路2;WL1:gydF4y2BaWl-TeAG1gydF4y2Ba1号线;WL2:gydF4y2BaWl-TeAG1gydF4y2Ba2号线;SL1:gydF4y2BaSl-TeAG1gydF4y2Ba1号线;SL2:gydF4y2BaSl-TeAGL1gydF4y2Ba第2行。*转基因植物中内源基因表达量比野生型植物高2倍或低1/2gydF4y2Ba
由于表型异位表达gydF4y2BaTeAG1gydF4y2Ba从视觉上关注萼片和花瓣的特性,gydF4y2BaAP1gydF4y2Ba,gydF4y2BaAP3gydF4y2Ba,gydF4y2BaπgydF4y2Ba,gydF4y2BaAG)gydF4y2Ba而且gydF4y2BaSTKgydF4y2Ba选择拟南芥中的基因进行检测gydF4y2BatgydF4y2Ba他们的转录水平是否发生了变化,这是基于ABCDE模型的。结果(图。gydF4y2Ba6gydF4y2Bav,表gydF4y2Ba7gydF4y2Ba的转录水平gydF4y2BaπgydF4y2Ba,gydF4y2BaAG)gydF4y2Ba而且gydF4y2BaSTKgydF4y2Ba是否在转基因系中显著上调gydF4y2BaSl-TeAG1gydF4y2Ba,而gydF4y2BaAP1gydF4y2Ba表达明显下调,表明gydF4y2BaTeAG1gydF4y2Ba(C类基因)可能抑制的表达水平gydF4y2BaAP1gydF4y2Ba(A类基因)。两组转录水平无显著差异gydF4y2BaAP3gydF4y2Ba(B类基因)gydF4y2BaSl-TeAG1gydF4y2Ba行(无花果。gydF4y2Ba6gydF4y2Bav,表gydF4y2Ba7gydF4y2Ba).与在gydF4y2BaSl-AG1gydF4y2Ba线性变化趋势相似,表达量变化平缓gydF4y2BaAP1gydF4y2Ba,gydF4y2BaπgydF4y2Ba,gydF4y2BaAP3gydF4y2Ba,gydF4y2BaAG)gydF4y2Ba而且gydF4y2BaSTKgydF4y2Ba被发现在gydF4y2BaWl-AG1gydF4y2Ba行(无花果。gydF4y2Ba6gydF4y2Bav,表gydF4y2Ba7gydF4y2Ba).gydF4y2Ba
异位表达的影响gydF4y2Ba的TeAGL11-1gydF4y2Ba对花瓣和种子发育的影响gydF4y2Ba
为了研究的功能gydF4y2BaTeAGL11-1gydF4y2Ba而且gydF4y2BaTeAGL11-2gydF4y2Ba,gydF4y2BaegydF4y2Ba两个基因也在拟南芥中异位表达。我们获得了21gydF4y2Ba35 s: TeAGL11-1gydF4y2Ba7个严重表型系的转基因株系(gydF4y2BaSl-TeAGL11-1)gydF4y2Ba,十个弱表型系(gydF4y2BaWl-TeAGL11-1)gydF4y2Ba4个株系无表型变化。我们获得了46个gydF4y2Ba35 s: TeAGL11-2gydF4y2Ba转基因株系与野生型株系相比,表型无明显变化。转录水平的gydF4y2BaTeAGL11-1gydF4y2Ba而且gydF4y2BaTeAGL11-2gydF4y2Ba以花cDNA为模板,进行半定量RT-PCR分析(图SgydF4y2Ba3.gydF4y2Bac, d).过表达gydF4y2BaTeAGL11-1gydF4y2Ba拟南芥的结果是莲座丛叶向上和向内卷曲,花瓣卷曲明显,开花早,植株大小小。gydF4y2Ba7gydF4y2Baa, b, c, d, e, f, g, h, i, l, m, n, p,表gydF4y2Ba2gydF4y2Ba).在gydF4y2BaSl-TeAGL11-1gydF4y2Ba与野生型株系相比,花萼几乎是无籽的,而且花萼比野生型株系的花萼小。gydF4y2Ba7gydF4y2Baj k p,表gydF4y2Ba2gydF4y2Ba,年代gydF4y2Ba5gydF4y2Ba).然而,在gydF4y2BaWl-TeAGL11-1gydF4y2Ba线,只有凹凸不平和小的角果(图。gydF4y2Ba7gydF4y2Baj, k, o, p表gydF4y2Ba2gydF4y2Ba).gydF4y2Ba
转基因拟南芥植株的异常形态gydF4y2Ba35 s: TeAGL11-1gydF4y2Ba以及与花器官发育和种子形成相关的基因表达水平。(gydF4y2Ba一个gydF4y2Ba)野生型幼苗。(gydF4y2BabgydF4y2Ba,gydF4y2BacgydF4y2Ba,gydF4y2BaegydF4y2Ba,gydF4y2BafgydF4y2Ba,gydF4y2BahgydF4y2Ba,gydF4y2Ba我gydF4y2Ba,gydF4y2BajgydF4y2Ba)表型的gydF4y2BaSl-TeAGL11-1gydF4y2Ba行。(gydF4y2BabgydF4y2Ba)具有严重卷曲莲座叶的转基因幼苗。(gydF4y2BacgydF4y2Ba野生型和gydF4y2Ba35 s: TeAGL11-1gydF4y2Ba提早开花的转基因植物。(gydF4y2BadgydF4y2Ba,gydF4y2BaggydF4y2Ba)野生型花。(gydF4y2BaegydF4y2Ba,gydF4y2BafgydF4y2Ba,gydF4y2BahgydF4y2Ba)转基因花卉。(gydF4y2Ba我gydF4y2Ba)野生型(左)和转基因植物(右),植株较小。(gydF4y2BajgydF4y2Ba,gydF4y2BakgydF4y2Ba)剑果几乎无籽,短,萼片无脓肿(gydF4y2BajgydF4y2Ba),与野生型(gydF4y2BakgydF4y2Ba).(gydF4y2BalgydF4y2Ba-gydF4y2BaogydF4y2Ba)表型的gydF4y2BaWl-TeAGL11-1gydF4y2Ba行。(gydF4y2BalgydF4y2Ba)具有严重卷曲莲座叶的转基因幼苗。(gydF4y2Ba米gydF4y2Ba)野生型(左)和转基因植物(右),植株较小。(gydF4y2BangydF4y2Ba)转基因花卉。(gydF4y2BaogydF4y2Ba较小的角果(右)。se:萼片;体育:花瓣;圣:雄蕊;Pi:雌蕊,a-c, i, l, m.o, bar = 5 mm;D-h j k n bar = 1mm。(gydF4y2BapgydF4y2Ba)对照植株与转基因植株的主要形态性状统计,*差异显著gydF4y2BaPgydF4y2Ba< 0.05。(gydF4y2Ba问gydF4y2Ba)通过qRT- PCR分析对照和转基因拟南芥花中花器官发育和种子形成相关基因的表达量。WT1:野生型线路1;WT2:野生型线路2;WL1:gydF4y2BaWl-TeAGL11-1gydF4y2Ba1号线;WL2:gydF4y2BaWl-TeAGL11-1gydF4y2Ba2号线;SL1:gydF4y2BaSl-TeAGL11-1gydF4y2Ba1号线;SL2:gydF4y2BaSl-TeAGL11-1gydF4y2Ba第2行。*转基因植物中内源基因表达量比野生型植物高2倍或低1/2gydF4y2Ba
探讨表型是否受内源基因表达的影响gydF4y2BaAP1gydF4y2Ba,gydF4y2BaπgydF4y2Ba,gydF4y2BaAP3gydF4y2Ba,gydF4y2BaAG)gydF4y2Ba而且gydF4y2BaSTKgydF4y2Ba对2个严重表型系、2个弱表型系和2个野生型系的花器官和胚珠发育进行了qRT-PCR分析。如图所示。gydF4y2Ba7gydF4y2Baq和表SgydF4y2Ba8gydF4y2Ba的转录水平gydF4y2BaAP1gydF4y2Ba而且gydF4y2BaAP3gydF4y2Ba6个样品间无显著差异。的表达水平gydF4y2BaπgydF4y2Ba两者都明显下调了gydF4y2BaSl-TeAGL11-1gydF4y2Ba而且gydF4y2BaWl-TeAGl11-1gydF4y2Ba线条,却表达了层次gydF4y2BaSTKgydF4y2Ba是低gydF4y2BaSl-TeAGL11-1gydF4y2Ba行比gydF4y2BaWl-TeAGl11-1gydF4y2Ba线,表明无籽表现型gydF4y2BaSl-TeAGL11-1gydF4y2Ba线路可能与下调有关gydF4y2BaSTKgydF4y2Ba.gydF4y2Ba
早熟卷曲叶相关内源基因表达谱分析gydF4y2Ba
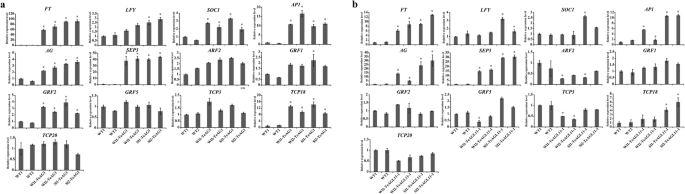
我们还检测了与开花时间相关的内源基因表达量(gydF4y2BaAP1gydF4y2Ba,gydF4y2Ba英国《金融时报》gydF4y2Ba,gydF4y2BaLFYgydF4y2Ba,gydF4y2BaSOC1gydF4y2Ba,gydF4y2BaAG)gydF4y2Ba而且gydF4y2BaSEP3gydF4y2Ba)和卷曲的叶子(gydF4y2BaGRF1gydF4y2Ba,gydF4y2BaGRF2gydF4y2Ba,gydF4y2BaGRF5gydF4y2Ba,gydF4y2BaTCP3gydF4y2Ba,gydF4y2BaTCP18gydF4y2Ba,gydF4y2BaTCP20gydF4y2Ba, ARF2),当转基因和野生型幼苗10 d龄时。如图所示。gydF4y2Ba8gydF4y2Ba的表达水平gydF4y2BaAP1gydF4y2Ba,gydF4y2Ba英国《金融时报》gydF4y2Ba,gydF4y2BaSOC1gydF4y2Ba,gydF4y2BaAG)gydF4y2Ba而且gydF4y2BaSEP3gydF4y2Ba显著高于gydF4y2Ba35 s: TeAG1gydF4y2Ba转基因苗比野生型苗更明显。然而,表达水平的gydF4y2BaLFYgydF4y2Ba显著增加了gydF4y2BaSl-AG1gydF4y2Ba线条,并略有增加gydF4y2BaWl-AG1gydF4y2Ba行(无花果。gydF4y2Ba8gydF4y2Ba年代,表gydF4y2Ba9gydF4y2Ba).植物叶片发育相关基因的转录本分析gydF4y2Ba35个年代gydF4y2Ba:gydF4y2BaTeAG1gydF4y2Ba转基因苗表明gydF4y2BaARF2gydF4y2Ba,gydF4y2BaGRF1gydF4y2Ba,gydF4y2BaGRF5gydF4y2Ba,gydF4y2BaTCP20gydF4y2Ba而且gydF4y2BaTCP3gydF4y2Ba6个样本间无显著差异(图。gydF4y2Ba8gydF4y2Ba年代,表gydF4y2Ba9gydF4y2Ba的表达水平gydF4y2BaGRF2gydF4y2Ba而且gydF4y2BaTCP18gydF4y2Ba的表达明显高于野生型,说明gydF4y2BaGRF2gydF4y2Ba而且gydF4y2BaTCP18gydF4y2Ba可能是叶子卷曲的原因。gydF4y2Ba
野生型10日龄苗木内源开花和叶片发育相关基因的qRT-PCR分析gydF4y2Ba35 s: TeAG1gydF4y2Ba而且gydF4y2Ba35 s: TeAGL11-1gydF4y2Ba拟南芥的转基因系。(gydF4y2Ba一个gydF4y2Ba)植物内源开花和叶片发育相关基因的qRT-PCR分析gydF4y2Ba35 s: TeAG1gydF4y2Ba转基因线。(gydF4y2BabgydF4y2Ba)植物内源开花和叶片发育相关基因的qRT-PCR分析gydF4y2Ba35 s: TeAGL11-1gydF4y2Ba转基因线。*转基因植物中内源基因表达量比野生型植物高2倍或低1/2gydF4y2Ba
在gydF4y2BaWl-TeAGL11-1gydF4y2Ba线和gydF4y2BaSl-TeAGL11-1gydF4y2Ba行,gydF4y2BaAP1gydF4y2Ba,gydF4y2BaAG)gydF4y2Ba,gydF4y2Ba英国《金融时报》gydF4y2Ba而且gydF4y2BaSEP3gydF4y2Ba被强烈的差异。的表达水平gydF4y2BaSOC1gydF4y2Ba增加在gydF4y2BaSl-TeAGL11-1gydF4y2Ba的表达水平无显著差异gydF4y2BaSOC1gydF4y2Ba观察之间的gydF4y2BaWl-TeAGL11-1gydF4y2Ba线和野生型线(图。gydF4y2Ba8gydF4y2Bab,表gydF4y2Ba10gydF4y2Ba).结果表明,gydF4y2BaAP1gydF4y2Ba,gydF4y2BaAG)gydF4y2Ba,gydF4y2Ba英国《金融时报》gydF4y2Ba而且gydF4y2BaSEP3gydF4y2Ba可能有助于早开花gydF4y2Ba35 s: TeAG11-1gydF4y2Ba转基因线。叶片发育相关基因的表达水平表现出复杂的表达模式gydF4y2Ba35 s: TeAGL11-1gydF4y2Ba转基因线。的转录水平gydF4y2BaTCP18gydF4y2Ba在gydF4y2BaSl-TeAGL11-1gydF4y2Ba系上调,且明显高于野生型gydF4y2BaWl-AG11-1gydF4y2Ba行(无花果。gydF4y2Ba8gydF4y2Bab)。gydF4y2BaARF2gydF4y2Ba而且gydF4y2BaTCP3gydF4y2Ba被抑制的gydF4y2BaSl-TeAGL11-1gydF4y2Ba行,gydF4y2BaTCP3gydF4y2Ba显著降低了gydF4y2BaWl-TeAGL11-1gydF4y2Ba行。表达水平的gydF4y2BaGRF1gydF4y2Ba,gydF4y2BaGRF2gydF4y2Ba,gydF4y2BaGRF5gydF4y2Ba而且gydF4y2BaTCP20gydF4y2Ba与野生型相比,无明显变化(图5)。gydF4y2Ba8gydF4y2Bab,表gydF4y2Ba10gydF4y2Ba).gydF4y2Ba
讨论gydF4y2Ba
万寿菊的进化保护与多样性gydF4y2Ba无性生殖的gydF4y2Ba例如基因gydF4y2Ba
在开花植物中,大量的MADS-box基因是植物生长发育的重要调控因子。的gydF4y2BaAG)gydF4y2BaMADS-box亚家族基因参与调控许多物种的花分生组织和果实的发育,并确定生殖器官的特性。之前的研究表明gydF4y2BaAG)gydF4y2Ba亚家族基因起源于开花植物的几个副系,其中大部分可能源于开花植物在长期进化过程中的多次全基因组复制事件[gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10gydF4y2Ba,gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba].gydF4y2BaAG)gydF4y2Ba而且gydF4y2BaAGL11gydF4y2Ba血统可能起源于最初的wgd [gydF4y2Ba10gydF4y2Ba,gydF4y2Ba11gydF4y2Ba].的gydF4y2BaAG)gydF4y2Ba这个谱系在低eudicots中经历了第二次wgd,从而产生了两个子分支,即gydF4y2BaeuAGgydF4y2Ba而且gydF4y2Ba请耐心gydF4y2Ba[gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10gydF4y2Ba].最近,重复事件gydF4y2Ba请耐心gydF4y2Ba拟南芥中观察到的谱系[gydF4y2Ba23gydF4y2Ba和番茄[gydF4y2Ba39gydF4y2Ba使它们的功能不同于gydF4y2BaeuAGgydF4y2Ba.在万寿菊中,TeAG1、TeAG2、TeAGL11-1和TeAGL11-2被归类为AG亚家族蛋白。这四种蛋白在c端区域含有高度保守的AG motif I和AG motif II(图。gydF4y2Ba1gydF4y2Ba) [gydF4y2Ba10gydF4y2Ba,gydF4y2Ba40gydF4y2Ba].根据我们的系统发育分析,TeAG1和TeAG2属于euAG谱系,TeAGL11-1和TeAGL11-2属于AGL11谱系,而在金盏花的转录组数据中没有发现PLE谱系蛋白(图5)。gydF4y2Ba2gydF4y2Ba).Dreni和Kater的建议认为,PLE谱系蛋白可能在Asteraceae家族中丢失,这可能与Asteraceae中干燥、不开裂的种子有关[gydF4y2Ba9gydF4y2Ba].gydF4y2Ba
万寿菊的特异性表达gydF4y2Ba无性生殖的gydF4y2Ba类基因存在于花器官和胚珠的内两轮中gydF4y2Ba
在金盏花中,我们发现四种表达gydF4y2BaAG)gydF4y2Ba亚家族基因具有高度的组织特异性。的表达模式gydF4y2BaTeAG1gydF4y2Ba而且gydF4y2BaTeAG2gydF4y2Ba(C类基因)与非洲菊属(Gerbera)的研究结果一致[gydF4y2Ba35gydF4y2Ba].这两个基因在生殖器官和胚珠中优先表达。gydF4y2Ba3.gydF4y2Baa, b,图SgydF4y2Ba1gydF4y2BaA, b),表明gydF4y2BaTeAG1gydF4y2Ba而且gydF4y2BaTeAG2gydF4y2Ba可能在调节生殖器官发育和确定卵巢身份方面发挥重要作用。此外,gydF4y2BaTeAG1gydF4y2Ba而且gydF4y2BaTeAG2gydF4y2Ba在萼片和花瓣中有轻微的表达,说明gydF4y2BaTeAG1gydF4y2Ba可能与调节四轮花器官的发育有关。不像gydF4y2BaTeAG2gydF4y2Ba,gydF4y2BaTeAG1gydF4y2Ba在雌蕊和子房中高表达,表明其功能分化。类似于gydF4y2BaTeAG1gydF4y2Ba而且gydF4y2BaTeAG2gydF4y2Ba表达模式,gydF4y2BaTeAGL11-1gydF4y2Ba而且gydF4y2BaTeAGL11-2gydF4y2Ba(D类基因)在雌蕊和子房中高度表达(图5)。gydF4y2Ba3.gydF4y2Baa、b SgydF4y2Ba1gydF4y2Baa-d),提示万寿菊C类和D类基因都可能参与调节进化过程中的雌蕊和子房发育。的表达模式gydF4y2BaTeAGL11-1gydF4y2Ba而且gydF4y2BaTeAGL11-2gydF4y2Ba显然彼此不同。gydF4y2BaTeAGL11-1gydF4y2Ba在花盘花器官包括雄蕊、萼片和子房中均有高表达,而gydF4y2BaTeAGL11-2gydF4y2Ba在雌蕊和胚珠中高度表达。gydF4y2Ba3.gydF4y2Baa、b SgydF4y2Ba1gydF4y2Bac, d).结合上述发现,以及TeAGL11-1和TeAGL11-2蛋白之间氨基酸序列一致性较低的事实,我们推测这两个基因可能在调控花发育方面具有不同的功能。的表达模式gydF4y2BaTeAGL11-1gydF4y2Ba而且gydF4y2BaTeAGL11-2gydF4y2Ba不同于gydF4y2BaFBP7gydF4y2Ba,gydF4y2BaFBP11,gydF4y2Ba或gydF4y2BaSTKgydF4y2Ba它们的表达仅限于种子和胚珠[gydF4y2Ba41gydF4y2Ba,gydF4y2Ba42gydF4y2Ba].由此可见,D类基因在万寿菊中的特异性表达提示其具有一定的功能gydF4y2BaTeAGL11-1gydF4y2Ba或gydF4y2BaTeAGL11-2gydF4y2Ba除了调节种子的发育。gydF4y2Ba
保守的作用gydF4y2BaTeAG1gydF4y2Ba在说明雄蕊和心皮特性时gydF4y2Ba
与以往对其他植物的研究相比,该植物的花器官和种子发育的表型变化相似gydF4y2Ba35 s: TeAG1gydF4y2Ba转基因线。的异位表达gydF4y2BaTeAG1gydF4y2Ba在拟南芥中,会导致萼片向雌蕊结构和花瓣向雄蕊样结构的同源性转化。gydF4y2Ba5gydF4y2Bae, g,gydF4y2Ba6gydF4y2Bae, f, h, l表gydF4y2Ba2gydF4y2Ba),这与菊花C类基因异位表达结果一致[gydF4y2Ba43gydF4y2Ba和康乃馨(gydF4y2Ba石竹类植物caryphyllusgydF4y2Ba) [gydF4y2Ba44gydF4y2Ba].例如,异位表达gydF4y2BaCDM37gydF4y2Ba(C类基因)使菊花的花瓣转变为花药样结构,萼片转变为雌蕊样组织[gydF4y2Ba43gydF4y2Ba].基于ABCDE模型,功能C类同源基因异位表达会抑制A类同源基因在第一和第二轮的表达,导致萼片和花瓣分别向心皮和雄蕊转化。内源基因表达谱分析gydF4y2BaAP1gydF4y2Ba,gydF4y2BaAP3gydF4y2Ba,gydF4y2BaπgydF4y2Ba,gydF4y2BaAG)gydF4y2Ba而且gydF4y2BaSTKgydF4y2Ba透露,gydF4y2BaTeAG1gydF4y2Ba产生抑制A类基因的活性(图。gydF4y2Ba6gydF4y2Bav).根据的具体表达gydF4y2BaTeAG1gydF4y2Ba转基因植物的显著表型改变,我们推测gydF4y2BaTeAG1gydF4y2Ba可能调节雄蕊和心皮的发育。gydF4y2Ba
的函数gydF4y2BaTeAGL11-1gydF4y2Ba在种子和花瓣的发育中gydF4y2Ba
引起的表型变化gydF4y2BaTeAGL11-1gydF4y2BaD类基因在拟南芥中的过表达提示其可能具有保守性和发散性功能。几乎无籽的表现型gydF4y2Ba35 s: TeAGL11-1gydF4y2Ba与其他植物中D类基因表达被抑制的株系相似,表明转基因拟南芥中D类基因的功能受到了部分抑制。在拟南芥中,三重gydF4y2Bastk / shp1 / shp2gydF4y2Ba取消了胚珠和种子的发育[gydF4y2Ba24gydF4y2Ba].在佩妮亚中,同时下调gydF4y2BaFBP7gydF4y2Ba而且gydF4y2BaBP11gydF4y2Ba形成无籽表型[gydF4y2Ba18gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba41gydF4y2Ba].除了模式植物外,在其他物种中也观察到D类基因下调导致的类似表型[gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba].内源性基因表达下调gydF4y2BaSTKgydF4y2Ba也支持这种表型变化(图。gydF4y2Ba7gydF4y2BaQ),提示异位表达gydF4y2BaTeAGL11-1gydF4y2Ba在拟南芥中导致共抑制表型。MADS-box基因的其他异位表达系存在共抑制现象。例如,过度gydF4y2BaHAM45asgydF4y2Ba而且gydF4y2BaHAM59gydF4y2Ba向日葵(C类)基因在烟草中下调了内源C类基因的表达水平,进而导致雄蕊向花瓣转化[gydF4y2Ba45gydF4y2Ba].此外,卷曲的花瓣在gydF4y2Ba35 s: TeAGL11-1gydF4y2Ba但这种表型与拟南芥和番茄中D类基因过表达导致的表型不同,后者的萼片转化为具有胚珠的心皮器官[gydF4y2Ba42gydF4y2Ba或肉质器官[gydF4y2Ba3.gydF4y2Ba].一方面,表型的不同可能归因于功能之间的差异gydF4y2BaTeAGL11-1gydF4y2Ba而且gydF4y2BaSTKgydF4y2Ba(拟南芥)或gydF4y2BaSl-AGL11gydF4y2Ba(番茄,gydF4y2Ba茄属植物lycopersicumgydF4y2Ba).另一方面,万金菊和拟南芥基因调控网络的不同可能导致它们异源转化表型的差异。的减少gydF4y2BaπgydF4y2Ba转录水平可能解释花瓣卷曲(图。gydF4y2Ba7gydF4y2Ba问)。gydF4y2Ba
功能的保存和多样性gydF4y2BaTeAG1gydF4y2Ba而且gydF4y2BaTeAGL11-1gydF4y2Ba基因gydF4y2Ba
在转基因植物中观察到早开花表型gydF4y2Ba35 s: TeAG1gydF4y2Ba而且gydF4y2Ba35 s: TeAGL11-1gydF4y2Ba构造(无花果。gydF4y2Ba5gydF4y2Bac、l,gydF4y2Ba7gydF4y2Bac、p、表gydF4y2Ba2gydF4y2Ba),这与转基因拟南芥的表型一致gydF4y2BaAG)gydF4y2Ba或gydF4y2BaSTKgydF4y2Ba[gydF4y2Ba42gydF4y2Ba,gydF4y2Ba46gydF4y2Ba].此外,过度gydF4y2BaTeAG1gydF4y2Ba而且gydF4y2BaTeAGL11-1gydF4y2Ba在拟南芥中,莲座叶卷曲(Figs。gydF4y2Ba5gydF4y2Bab,gydF4y2Ba7gydF4y2Bab l表gydF4y2Ba2gydF4y2Ba).在异位表达C或D类基因的转基因植物中也观察到类似的表型[gydF4y2Ba47gydF4y2Ba,gydF4y2Ba48gydF4y2Ba].值得注意的是,在拟南芥中,异位表达gydF4y2BaTeAG1gydF4y2Ba而且gydF4y2BaTeAGL11-1gydF4y2Ba结果表明:果实角果短,结实率低,成熟角果底部萼片保留。这一结果与《蕙兰》(Cymbidium)上的研究结果一致[gydF4y2Ba49gydF4y2Ba].内源基因表达分析gydF4y2BaSTKgydF4y2Ba提示短穗轴和低结实率可能与产量增加有关gydF4y2BaSTKgydF4y2Ba表达水平gydF4y2Ba35 s: TeAG1gydF4y2Ba而结实率低的短角果则可能与结实率下降有关gydF4y2BaSTKgydF4y2Ba转录水平gydF4y2BaTeAGL11-1gydF4y2Ba转基因线。总的来说,这些结果支持了我们的预测,即C和D类基因异位表达可能在调节拟南芥花发育方面具有相似的功能[gydF4y2Ba50gydF4y2Ba].另外,之间的发散函数gydF4y2BaTeAG1gydF4y2Ba而且gydF4y2BaTeAGL11-1gydF4y2Ba也观察到。与表型变化比较gydF4y2Ba35个年代gydF4y2Ba:gydF4y2BaTeAG1gydF4y2Ba转基因植物的过表达gydF4y2BaTeAGL11-1gydF4y2Ba导致花瓣向内卷曲,但不能诱导花器官的同源改变。gydF4y2Ba7gydF4y2Bae, f, h, ngydF4y2Ba2gydF4y2Ba).gydF4y2Ba
既往研究表明,MADS-box基因过表达导致的早花卷曲叶通常可能与上游或下游基因的表达变化有关[gydF4y2Ba51gydF4y2Ba,gydF4y2Ba52gydF4y2Ba,gydF4y2Ba53gydF4y2Ba,gydF4y2Ba54gydF4y2Ba].在本研究中,研究了调节花期和卷曲叶的内源基因的转录水平gydF4y2Ba35 s: TeAG1gydF4y2Ba,gydF4y2Ba35 s: TeAGL11-1gydF4y2Ba对品系和野生型植物进行了分析。结果表明gydF4y2BaAP1gydF4y2Ba,gydF4y2Ba英国《金融时报》gydF4y2Ba,gydF4y2BaAG)gydF4y2Ba而且gydF4y2BaSEP3gydF4y2Ba被上调gydF4y2Ba35 s: TeAG1gydF4y2Ba而且gydF4y2Ba35 s: TeAGL11-1gydF4y2Ba行。以往有关大豆的报告(gydF4y2Ba大豆gydF4y2Ba)表明,花期早与转录水平上调有关gydF4y2BaAP1gydF4y2Ba,gydF4y2Ba英国《金融时报》gydF4y2Ba,gydF4y2BaSEP3gydF4y2Ba[gydF4y2Ba55gydF4y2Ba]gydF4y2Ba.gydF4y2Ba总的来说,增加的表达水平gydF4y2BaAP1gydF4y2Ba,gydF4y2Ba英国《金融时报》gydF4y2Ba,gydF4y2BaAG)gydF4y2Ba而且gydF4y2BaSEP3gydF4y2Ba可能促进转基因植物花的形成和早开花(图。gydF4y2Ba8gydF4y2Baa, b).基因表达和表型变化分析表明,叶片卷曲在gydF4y2Ba35 s: TeAG1gydF4y2Ba转基因系可能与转录本的变化有关gydF4y2BaGRF2gydF4y2Ba而且gydF4y2BaTCP18gydF4y2Ba(无花果。gydF4y2Ba8gydF4y2BaA),这与结果一致gydF4y2BaTCPgydF4y2Ba[gydF4y2Ba56gydF4y2Ba),gydF4y2Ba平gydF4y2Ba[gydF4y2Ba57gydF4y2Ba可以调节叶子的发育。此外,下调了gydF4y2BaARF2gydF4y2Ba而且gydF4y2BaTCP3gydF4y2Ba和老年病gydF4y2BaTCP18gydF4y2Ba可能会导致叶子卷曲gydF4y2Ba35 s: TeAGL11-1gydF4y2Ba行(无花果。gydF4y2Ba8gydF4y2Bab).的表达式gydF4y2BaLFYgydF4y2Ba表达水平较高的转基因株系中gydF4y2BaTeAG1gydF4y2Ba的表达水平gydF4y2BaLFYgydF4y2Ba可能和转基因表达有关。gydF4y2Ba
结论gydF4y2Ba
这项研究表明gydF4y2BaTeAG1gydF4y2Ba而且gydF4y2BaTeAGL11-1gydF4y2Ba调节花器官,种子和营养组织的发育gydF4y2BaTeAG2gydF4y2Ba而且gydF4y2BaTeAGL11-2gydF4y2Ba它们可能失去调控花器官和胚珠发育的能力,或者需要与其他MADS-box基因结合来调控花的发育和胚珠的形成。本研究拓展了对菊科植物雄蕊、雌蕊和胚珠发育的认识,为后续园艺性状的创造提供了技术支持。然而,还需要进一步的原位杂交分析和同源转化表型实验来探索这4个基因的准确表达区域和潜在的功能机制。gydF4y2Ba
方法gydF4y2Ba
植物材料和生长条件gydF4y2Ba
万寿菊自交系M525B连续自交10代得到,M525B是由He [s]分离的两型(雄性不育/雄性可育)系M525AB [s]分离的雄性可育型植株。gydF4y2Ba58gydF4y2Ba在我们的实验室里。M525B-1在头状花序周围有一轮生射线小花。它们于2016年秋季在中国湖北省武汉市的华中农业大学的自然条件下种植。北纬30°28 ' 36.5 ",长,东经114°21 ' 59.4 ")。gydF4y2Ba
的种子gydF4y2Ba拟南芥gydF4y2Ba用于功能分析的添加哥伦比亚(Col-0)植物首先杀菌,在含有Skoog (MS)和1/2× Murashige的琼脂上4℃培养2天。10 d后移栽到生长箱中,光照16 h /暗8 h,昼夜温度22/20°C,相对湿度60%,长日条件下进行遗传转化。gydF4y2Ba
总RNA的提取、分离及生物信息学分析gydF4y2BaAG)gydF4y2Ba而且gydF4y2BaAGL11gydF4y2Ba基因从万寿菊gydF4y2Ba
根据Ai等人的描述,收集万金菊的各种营养组织、四个发育阶段的花芽和花组织,并在液氮中快速冷冻。[gydF4y2Ba33gydF4y2Ba].花蕾大小有四种:FB1:直径0 ~ 1mm,形成射线小花原基和最外层盘小花原基;FB2:直径2 ~ 3mm,射线小花的萼片、花瓣和最外层的圆盘小花发育;FB3:直径4-5 mm,花盘小花最外侧雄蕊发育;FB4:直径6 ~ 7mm,射线小花的雌蕊和最外面的圆盘小花发育。根据制造商的协议,使用PLANTpure试剂盒(Aidlab,北京,中国)分离每个样本的总RNA。RNA的质量和数量由Nano-Drop 2000分光光度计检测(Thermo Fisher Scientific, Wilmington, DE)。使用PrimeScriptTM RT试剂盒和gDNA Eraser (Takara, Dalian, China)合成第一链cDNA。基于转录组序列(登录号SRP066084) [gydF4y2Ba33gydF4y2Ba),四gydF4y2BaAG)gydF4y2Ba选择亚家族基因并命名gydF4y2BaTeAG1gydF4y2Ba(comp38613_c0 comp38613_c1),gydF4y2BaTeAG2gydF4y2Ba(comp68705_c0),gydF4y2BaTeAGL11-1gydF4y2Ba(comp199520_c0),gydF4y2BaAGL11-2gydF4y2Ba(comp50841_c0)。的全长gydF4y2BaTeAG1gydF4y2Ba,gydF4y2BaTeAG2gydF4y2Ba,gydF4y2BaTeAGL11-1gydF4y2Ba,gydF4y2BaTeAGL11-2gydF4y2Ba是用特定引物克隆的吗gydF4y2BaTeAG1gydF4y2Ba-gydF4y2Ba完整的gydF4y2Ba- f / R,gydF4y2BaTeAG2gydF4y2Ba-gydF4y2Ba完整的gydF4y2Ba- f / R, TgydF4y2BaeAGL11-1gydF4y2Ba-gydF4y2Ba完整的gydF4y2Ba- f / RgydF4y2BaTeAGL11-2gydF4y2Ba-gydF4y2Ba完整的gydF4y2Ba-F/R(补充表S .gydF4y2Ba1gydF4y2Ba).PCR扩增产物经纯化后克隆成gydF4y2BapMD18-TgydF4y2Bavector (Takara,大连,中国)。阳性克隆(3-5个重复)在上海生工公司测序确认。gydF4y2Ba
采用DNAMAN (v.6.0)软件(gydF4y2Bahttps://www.lynnon.comgydF4y2Ba).分析了C/D类基因的系统发育关系gydF4y2BaAG)gydF4y2Ba而且gydF4y2BaAGL11gydF4y2Ba从国家生物技术信息中心(NCBI) (gydF4y2Bahttp://www.ncbi.nlm.nih.govgydF4y2Ba).首先使用MEGA (v. 6.0)中实现的MUSCLE中的默认设置对全长氨基酸序列进行对齐,然后根据Zahn等人提供的参考对齐进行手动调整。[gydF4y2Ba59gydF4y2Ba].采用MEGA (v. 6.0)软件,在1000次自举重复下,采用邻居连接(neighbor-joining, NJ)方法构建系统发生树。gydF4y2Ba
实时荧光定量PCR表达分析gydF4y2Ba
采用实时荧光定量PCR (qRT-PCR)方法,分析了C/D类基因在金盏花不同组织(根、嫩茎、鲜叶)、花组织(射线小花、盘小花的萼片、花瓣、雌蕊、盘小花的雄蕊、花托、苞片、子房)和不同大小花蕾中的表达水平。基因特异性引物(补充表SgydF4y2Ba1gydF4y2Ba)在非保守的c端区域用Primer Premier 5.0进行设计。进行QRT-PCR实验,如先前研究所述[gydF4y2Ba33gydF4y2Ba].每个样本重复3次这4个基因的表达量。在这些实验中,参考基因gydF4y2BaβgydF4y2Ba-gydF4y2Ba肌动蛋白gydF4y2Ba进行归一化,用2gydF4y2Ba-ΔΔCtgydF4y2Ba方法。使用TBtools软件对数据进行分析,并采用行尺度进行归一化处理。gydF4y2Ba
万寿菊AG和AGL11蛋白的亚细胞定位gydF4y2Ba
的编码序列gydF4y2BaTeAG1gydF4y2Ba,gydF4y2BaTeAG2gydF4y2Ba,gydF4y2BaTeAGL11-1gydF4y2Ba,gydF4y2BaTeAGL11-2gydF4y2Ba对去除了终止密码子的基因进行了扩增,并引入到一个pYellow载体中gydF4y2Ba35 s CaMVgydF4y2Ba启动子生成融合载体gydF4y2Ba35 s: YFP-TeAG1gydF4y2Ba,gydF4y2Ba35 s: YFP-TeAG2gydF4y2Ba,gydF4y2Ba35 s: YFP-TeAGL11-1gydF4y2Ba,gydF4y2Ba35 s: YFP-TeAGL11-2。gydF4y2Ba引物列于补充表SgydF4y2Ba1gydF4y2Ba.转染后,在细胞质和细胞核中均可观察到YFP信号gydF4y2Ba35 s: YFPgydF4y2Ba向量。的gydF4y2Ba35 s: YFPgydF4y2Ba空载体作为阴性对照gydF4y2Ba35 s:招标书gydF4y2Ba使用包含N7核瞄准信号的-N7矢量作为核控制。将对照载体和重组载体转化为农杆菌菌株gydF4y2BaGV3101gydF4y2Ba,分别。然后,重组载体和细胞核的控制gydF4y2Ba35 s:招标书gydF4y2Ba- n7或pylow -gydF4y2BaYFPgydF4y2Ba空核控制gydF4y2Ba35 s:招标书gydF4y2Ba-N7在瘤facien菌株gydF4y2BaGV3101gydF4y2Ba同时注入烟草(gydF4y2Ba烟草benthamianagydF4y2Ba)分别的叶子,[gydF4y2Ba60gydF4y2Ba].在25°C孵育48 h后,用共聚焦显微镜(Leica, TCS SP2, Wetzlar, Germany)检测烟草叶片中的YFP荧光信号和RED荧光信号。gydF4y2Ba
酵母2台混合动力分析gydF4y2Ba
的互补gydF4y2BaTeAG1gydF4y2Ba,gydF4y2BaTeAG2gydF4y2Ba,gydF4y2BaTeAGL11-1gydF4y2Ba,gydF4y2BaTeAGL11-2gydF4y2Ba使用带有特定限制位点的引物进行扩增(表SgydF4y2Ba1gydF4y2Ba).PCR片段分别与质粒pGBKT7和pGADT7 (Clontech, Palo Alto, CA, USA)重组。将PGADT7和PGBKT7重组载体共转化为菌株gydF4y2BaAH109gydF4y2Ba通过LiAc/DNA/PEG方法,遵循Frozen-EZ酵母转化II试剂盒协议(Zymo Research Corp, Irvine, CA, USA)。在缺乏亮氨酸(Leu)和色氨酸(Trp)的培养基上选择转化菌。通过与空AD质粒共转化检测BD克隆的自激活性和毒性。同时转移空AD和空BD载体或pGBKT7-53和pGADT7-T载体到gydF4y2BaAH109gydF4y2Ba设为阴性对照或阳性对照。阳性酵母细胞用AD-F−/R和BD-F−/R进行PCR检测(补充表SgydF4y2Ba1gydF4y2Ba).阳性酵母细胞在不含亮氨酸、色氨酸、组氨酸(His)和腺嘌呤(Ade)的x -a-gal培养基上进行斑点试验。在30°C孵育3-5天后观察结果。在本研究中,如果有方向相互作用导致酵母在选择板上生长,则对相互作用能力的阳性信号进行评分。gydF4y2Ba
拟南芥载体构建与异位表达gydF4y2Ba
的编码区gydF4y2BaTeAG1gydF4y2Ba,gydF4y2BaTeAG2gydF4y2Ba,gydF4y2BaTeAGL11-1gydF4y2Ba而且gydF4y2BaTeAGL11-2gydF4y2Ba使用带有限制性位点的特异性引物进行扩增(补充表SgydF4y2Ba1gydF4y2Ba),然后被克隆成gydF4y2Bap2300gydF4y2Ba在矢量的控制下gydF4y2BaCaMV 35 sgydF4y2Ba启动子。对得到的融合向量进行命名gydF4y2Ba35 s: TeAG1gydF4y2Ba,gydF4y2Ba35 s: TeAG2gydF4y2Ba,gydF4y2Ba35 s: TeAGL11-1,gydF4y2Ba而且gydF4y2Ba35 s: TeAGL11-2。gydF4y2Ba这些融合向量被引入gydF4y2Ba大肠杆菌DH5a,gydF4y2Ba并通过PCR进行检测。然后将这些融合向量转化为gydF4y2Ba根癌土壤杆菌gydF4y2Ba应变gydF4y2BaGV3101gydF4y2Ba.利用花浸法将这些合成结构转化为野生型拟南芥生态型哥伦比亚植物[gydF4y2Ba61gydF4y2Ba].在含50 μg ml的培养基上选择转化菌gydF4y2Ba−1gydF4y2Ba卡那霉素,gydF4y2Ba并利用引物进行PCR和半定量RT-PCR (semi-RT-PCR)分析gydF4y2Ba35个年代gydF4y2Ba- f,gydF4y2Ba35 s-teag1gydF4y2Ba- r,gydF4y2Ba35 s-teag2gydF4y2Ba- r,gydF4y2Ba35 s-teagl11-1gydF4y2Ba- r,gydF4y2Ba35 s-teagl11-2gydF4y2Ba- r, qRT -gydF4y2BaTeAG1gydF4y2Ba- f / R, qRT -gydF4y2BaTeAG2gydF4y2Ba- f / R, RT -gydF4y2BaTeAG11-1gydF4y2Ba- f / R, RT -gydF4y2BaTeAGL11gydF4y2Ba2 - f / RgydF4y2BaAtEF1αgydF4y2Ba-F/R(补充表SgydF4y2Ba1gydF4y2Ba).分析T1和T2转基因株系的表型变化。gydF4y2Ba
扫描电子显微镜gydF4y2Ba
盛开的鲜花gydF4y2Ba35 s: TeAG1gydF4y2Ba采集野生型植物,在2.5% (v/v)戊二醛4℃下固定过夜。然后用乙醇系列(30-100%)每15分钟脱水一次。乙醇替换为乙酸异戊酯/乙醇(1/1)和乙酸异戊酯每10分钟。干燥后的样品采用临界点干燥(CPD 020;鲍尔泽联盟,gydF4y2Bahttp://www.bal-tecgydF4y2Ba.(NanotechSEMPrep II sputtercoater, NanotechLtd.)。, Prestwick, UK),并用双面胶带固定在标本存根上。使用LEO 435VP扫描电子显微镜(LEO electron Microscopy Ltd.,gydF4y2Bahttp://www.smt.zeiss.com/gydF4y2Ba).gydF4y2Ba
转基因植物内源基因表达分析gydF4y2Ba
为了进一步分析植物花器官和种子表型变化的机理gydF4y2Ba35 s: TeAG1gydF4y2Ba而且gydF4y2Ba35 s: TeAGL11-1gydF4y2Ba转基因植物的表达水平gydF4y2BaAP1gydF4y2Ba,gydF4y2BaAP3gydF4y2Ba,gydF4y2BaπgydF4y2Ba,gydF4y2BaAG)gydF4y2Ba而且gydF4y2BaAGL11gydF4y2Ba采用qRT-PCR法检测拟南芥的基因。盛开花朵的总RNAgydF4y2Ba35 s: TeAG1gydF4y2Ba,gydF4y2Ba35 s: TeAGL11-1gydF4y2Ba使用PLANTpure (Aidlab, Beijing, China)分离转基因植物和野生型植物,然后使用PrimeScript™RT试剂Kit和gDNA Eraser (Takara, Dalian, China)进行反转录。拟南芥gydF4y2BaEF1gydF4y2Baα(gydF4y2BaAtEF1αgydF4y2BaAT5G60390)作为管家基因。此外,一些与开花时间相关的内源性基因的转录水平(gydF4y2Ba英国《金融时报》gydF4y2Ba,gydF4y2BaSOC1gydF4y2Ba,gydF4y2BaLFYgydF4y2Ba,gydF4y2BaAP1gydF4y2Ba,gydF4y2BaSEP3gydF4y2Ba,gydF4y2BaAG)gydF4y2Ba) [gydF4y2Ba54gydF4y2Ba]和叶片发育(gydF4y2BaGRF1gydF4y2Ba,gydF4y2BaGRF2gydF4y2Ba,gydF4y2BaGRF5gydF4y2Ba,gydF4y2BaTCP3gydF4y2Ba,gydF4y2BaTCP18gydF4y2Ba,gydF4y2BaTCP20gydF4y2Ba,gydF4y2BaARF2gydF4y2Ba)进行分析[gydF4y2Ba62gydF4y2Ba],在转基因和野生型幼苗10 d龄时进行。所有10日龄幼苗在光照条件下同时采集。引物列于补充表SgydF4y2Ba1gydF4y2Ba.gydF4y2Ba
数据和材料的可用性gydF4y2Ba
将agamouss样蛋白的序列信息上传到NCBI (TeAG1: MT452648, TeAG2: MT452649, TeAGL11-1: MT394168, TeAGL11-2, MT394169)。gydF4y2Ba
缩写gydF4y2Ba
- AP1:gydF4y2Ba
-
APETALA1gydF4y2Ba
- AP3:gydF4y2Ba
-
APETALA1gydF4y2Ba
- SEP3:gydF4y2Ba
-
SEPALLATA3gydF4y2Ba
- PI:gydF4y2Ba
-
PISTILLATAgydF4y2Ba
- TCP:gydF4y2Ba
-
teosin分枝1、摆线思想、增殖因子gydF4y2Ba
- 平:gydF4y2Ba
-
生长调节因子gydF4y2Ba
- ARF2:gydF4y2Ba
-
生长素反应调节剂gydF4y2Ba
- 英国《金融时报》:gydF4y2Ba
-
开花轨迹TgydF4y2Ba
- SOC1:gydF4y2Ba
-
过表达抑制因子co 1gydF4y2Ba
- LFY:gydF4y2Ba
-
多叶的gydF4y2Ba
- AG:gydF4y2Ba
-
无性生殖的gydF4y2Ba
- wgd:gydF4y2Ba
-
全基因组复制事件gydF4y2Ba
- AGAL11:gydF4y2Ba
-
AGAMOUS-LIKE11gydF4y2Ba
- 比如:gydF4y2Ba
-
满gydF4y2Ba
- FBP7:gydF4y2Ba
-
花结合蛋白7gydF4y2Ba
- FBP11:gydF4y2Ba
-
花结合蛋白11gydF4y2Ba
- STK:gydF4y2Ba
-
SEEDSTICKgydF4y2Ba
- SHP1:gydF4y2Ba
-
SHATTERPROOT1gydF4y2Ba
- SHP2:gydF4y2Ba
-
SHATTERPROOT1gydF4y2Ba
- YFP:gydF4y2Ba
-
黄色荧光蛋白gydF4y2Ba
- 招标书:gydF4y2Ba
-
红色荧光蛋白gydF4y2Ba
- 低浓缩铀:gydF4y2Ba
-
亮氨酸gydF4y2Ba
- Trp:gydF4y2Ba
-
色氨酸gydF4y2Ba
- 他:gydF4y2Ba
-
组氨酸gydF4y2Ba
- 正面:gydF4y2Ba
-
腺嘌呤gydF4y2Ba
- RT-qPCR:gydF4y2Ba
-
定量实时聚合酶链反应gydF4y2Ba
- Semi-PCR:gydF4y2Ba
-
semi-quantitative-PCRgydF4y2Ba
参考文献gydF4y2Ba
Theißen G, Melzer R, Rümpler F. mads区域转录因子与花发育的花四元模型:连接植物的发育和进化。发展。2016;143 (18):3259 - 71 . .gydF4y2Ba
Lu H, Klocko AL, Brunner AM, Ma C, Magnuson AC, Howe GT, An X, Strauss SH.抑制AGAMOUS和SEEDSTICK的RNA干扰改变了杨树花器官的特性,损害了花器官的决定性、胚珠的分化和种毛的发育。新植醇。2019;222(2):923 - 37。gydF4y2Ba
黄斌,Routaboul J-M,刘明,邓伟,Maza E, Mila I, Hu G, Zouine M, Frasse P, Vrebalov JT。D类MADS-box基因Sl-AGL11过表达影响番茄果实肉质组织分化和结构。中国生物医学工程学报2017;68(17):4869-84。gydF4y2Ba
张娟,王颖,Naeem M,朱敏,李娟,余旭,胡铮,陈刚。AGAMOUS MADS-box蛋白SlMBP3调控番茄胎盘液化速度和种子形成。J Exp Bot 2018;70(3): 909-24。gydF4y2Ba
Rosin FM, Hart JK, Van Onckelen H, Hannapel DJ。马铃薯营养性MADS box基因的抑制激活了腋窝分生组织的发育。植物杂志。2003;131(4):1613 - 22所示。gydF4y2Ba
Alvarezbuylla ER、Garciaponce B、Sanchez MDLP、Espinosasoto C、Garciagomez ML、Pineyronelson A、Garayarroyo A. MADS盒子基因在地下成为主流:植物根系发育机制。新植醇。2019;223(3):1143 - 58。gydF4y2Ba
Theißen G.花器官身份的发展:来自MADS房子的故事。植物学报,2001;4(1):75-85。gydF4y2Ba
植物生物学:花的四重奏。大自然。2001;409(6819):469。gydF4y2Ba
Dreni L, Kater MM. MADS重新加载:AGAMOUS亚家族基因的进化。新植醇。2014;201(3):717 - 32。gydF4y2Ba
Kramer EM, Jaramillo MA, Di Stilio .被子植物中MADS box基因AGAMOUS亚家族多样化过程中的基因复制和功能进化模式。遗传学。2004;166(2):1011 - 23所示。gydF4y2Ba
Zahn LM, Leebens-Mack JH, Arrington JM, Hu Y, Landherr LL, DePamphilis CW, Becker A, Theissen G, Ma H. MADS-box基因AGAMOUS亚家族的保守和发散:独立亚和新功能化事件的证据。另一个星球Dev。2006;8(1):30 - 45。gydF4y2Ba
姜叶植物AGAMOUS蛋白K结构域的阳性选择提示了其雄蕊形态演化的机制。EvoDevo。2015; 6(1): 7。gydF4y2Ba
《轮生的战争:控制花发育的基因相互作用》。大自然。1991;353(6339):31。gydF4y2Ba
Bowman JL, Smyth DR, Meyerowitz EM.拟南芥花发育的调控基因。植物细胞。1989;1(1):37-52。gydF4y2Ba
Yanofsky MF, Ma H, Bowman JL, Drews GN, Feldmann KA, Meyerowitz EM.拟南芥同源基因agamous编码的蛋白质类似转录因子。大自然。1990;346(6279):35。gydF4y2Ba
王晓燕,王晓燕,王晓燕,等。拟南芥同源基因AGAMOUS的负性调控。细胞。1991;65(6):991 - 1002。gydF4y2Ba
Aida R, Komano M, Saito M, Nakase K, Murai K.菊花agamous基因抑制对菊花形状的影响。生物科技植物》。2008;25(1):55-9。gydF4y2Ba
矮牵牛属植物ABC中C和D的重新定义。植物细胞,2012;24(6):2305 - 17所示。gydF4y2Ba
山口田,李迪,美瑶A,广千贺H,安G,平野H- y。水稻c类MADS box基因OSMADS3和OSMADS58的功能多样性植物细胞。2006;18(1):15-28。gydF4y2Ba
Angenent GC, Franken J, Busscher M, van Dijken A, van Went JL, Dons H, van Tunen AJ。一类新的MADS盒型基因参与矮牵牛胚珠的发育。植物细胞。1995;7(10):1569 - 82。gydF4y2Ba
科伦坡L,弗兰肯J, Koetje E, van Went J, Dons H, Angenent GC, van Tunen AJ。矮牵牛MADS box基因FBP11决定胚珠的鉴定。植物细胞。1995;(11):1859 - 68。gydF4y2Ba
Ma H, Yanofsky MF, Meyerowitz EM. AGL1-AGL6,一个与花同源和转录因子基因相似的拟南芥基因家族。基因Dev。1991;5(3):484 - 95。gydF4y2Ba
利耶格伦SJ,迪塔GS,伊舍德Y,萨维奇B,鲍曼JL,亚诺夫斯基MF。抗碎MADS-box基因控制着拟南芥种子的传播。大自然。2000;404(6779):766。gydF4y2Ba
Pinyopich A, Ditta GS, Savidge B, Liljegren SJ, Baumann E, Wisman E, Yanofsky MF。测定心皮和胚珠发育过程中MADS-box基因的冗余度。大自然。2003;424(6944):85。gydF4y2Ba
Brambilla V, Battaglia R, Colombo M, Masiero S, Bencivenga S, Kater MM, Colombo L. BELL1和MADS箱型因子的遗传和分子相互作用支持拟南芥胚珠发育。植物细胞。2007;19(8):2544 - 56。gydF4y2Ba
Brambilla V . Colombo L. bel1 stk shp1 shp2突变体雌配子体发育的形态学分析。植物生物系统——植物生物学各方面的国际杂志。2008;142(3):643-9。gydF4y2Ba
Mizzotti C, Mendes MA, Caporali E, Schnittger A, Kater MM, Battaglia R, Colombo L. MADS box基因SEEDSTICK和拟南芥Bsister在受精和种子发育中起母体作用。植物j . 2012; 70(3): 409 - 20。gydF4y2Ba
d类MADS-box AGL11基因的抑制导致肉质果实无核。植物细胞学报2016;35(1):239-54。gydF4y2Ba
张丽娟,张丽娟。菊科植物花序发育的分子调控。Adv Bot Res. 2014; 72:297-333。gydF4y2Ba
陈娟,沈晨,郭勇,饶刚。菊科植物头状花序的模式:花对称性CYC2-Like基因的复制与差异表达。植物科学学报2018;9:551。gydF4y2Ba
张丽华,张丽华,张丽华,等。植物生长素在菊科植物头状花序形态形成中的作用。植物杂志。2019;179(2):391 - 401。gydF4y2Ba
葛藤SK,丁亮,赵坤,赵伟,陈松,蒋娟,陈峰。拟南芥菊CDM19异位表达揭示了其在心皮发育中的新功能。中国生物技术学报,2020;45(2):10-8。gydF4y2Ba
艾燕,张超,孙燕,王伟,何燕,包明。植物花器官鉴定相关MADS-Box B类基因的鉴定与功能分析gydF4y2Ba万寿菊gydF4y2Ba.《公共科学图书馆•综合》。2017;12 (1):e0169777。gydF4y2Ba
Broholm SK, Pollanen E, Ruokolainen S, Tahtiharju S, Kotilainen M, Albert VA, Elomaa P, Teeri TH。非洲菊B类MADS-box转录因子的功能表征。中国生物医学工程学报2010;61(1):75-85。gydF4y2Ba
Yu D, Kotilainen M, Pöllänen E, Mehto M, Elomaa P, Helariutta Y, Albert VA, Teeri TH。菊科非洲菊(Gerbera hybrida, Asteraceae)器官鉴定基因及其花发育的修饰模式。植物j . 1999; 17(1): 51 - 62。gydF4y2Ba
Shchennikova AV, Shulga OA, Sizeneva ES, Perkovskaya NI, Skryabin KG。菊花同种异型MADS -box基因CDM37功能活性的多样性。生物化学学报。2011;436(1):29-31。gydF4y2Ba
Shulga O, Mitiouchkina T, Shchennikova A, Skryabin K, Dolgov s异位表达向日葵MADS-box基因HAM59修饰菊花第25届国际桉树专题讨论会观赏植物:跨越国界1087;2015.105 - 11页。gydF4y2Ba
Mandel JR, Dikow RB, Siniscalchi CM, Thapa R, Watson LE, Funk VA。完全解析的主干系统发育揭示了整个菊科的历史中无数的分散和爆发性的多样化。中国生物医学工程学报2019;39(4):369 - 369。gydF4y2Ba
果实发育主题的变化:番茄(TAGL1)和其他物种中MADS-box基因的PLE谱系。足底。2017;246(2):313 - 21所示。gydF4y2Ba
Yun P-Y, Kim S-Y, Ochiai T, Fukuda T, Ito T, Kanno A, Kameya T. AVAG2是一种装饰性芦笋的d类基因。有性植物通报2004;17(3):107-16。gydF4y2Ba
科伦坡L,弗兰肯J,范德克罗尔AR, Wittich PE, Dons H, Angenent GC。矮牵牛胚珠特异性MADS box基因的下调导致了母体控制的种子发育缺陷。植物细胞。1997;9(5):703 - 15所示。gydF4y2Ba
Favaro R、Pinyopich A、Battaglia R、Kooiker M、Borghi L、Ditta G、Yanofsky MF、Kater MM、Colombo L. MADS-box蛋白复合物控制拟南芥心皮和胚珠的发育。植物细胞。2003;(11):2603 - 11。gydF4y2Ba
Shchennikova AV, Shul’ga OA, Sizeneva ES, Perkovskaya NI, Skryabin KG。菊花同种异体MADS-box基因CDM37功能活性的多样性。生物化学学报。2011;436(1):29-31。gydF4y2Ba
王强,丹宁,张旭,林松,鲍明,付旭。石竹双花性状相关c类基因的鉴定、性状表征及功能分析。植物。2020;9(1):87。gydF4y2Ba
Sizeneva ES, Shulga OA, Shchennikova AV, Skryabin KG。向日葵两个MADS-Box基因HAM45和HAM59的功能多样性中国生物工程学报2013;451(1):221-4。gydF4y2Ba
水上春,马华。AGAMOUS在拟南芥花分生组织鉴定中的应用。植物细胞。1997;9(3):393 - 408。gydF4y2Ba
徐红峰,谢惠平,陈明凯,张莹莹,杨春华。兰(Oncidium Gower Ramsey)和百合(Lilium longiflorum)两种单子叶植物的C/D类MADS box基因对拟南芥花的转变和形成具有不同的影响。植物细胞学报2010;51(6):1029-45。gydF4y2Ba
吴伟,陈峰,景东,刘铮,马琳。乌枫玉兰agamouss样基因的分离与鉴定。植物分子生物学杂志,2012;30(3):690-8。gydF4y2Ba
苏胜,邵晓,朱春,徐军,唐勇,罗东,黄旭。一个agamus样因子与兰科大花蕙兰两个驯化品种的起源有关。园艺杂志2018;5(1):48。gydF4y2Ba
曾天宇,陈海燕,杨春华。在拟南芥中,百合和藤本花的心皮特异性MADS box基因异位表达引起了相似的萼片和花瓣的同源性转化。植物杂志。2002;130(4):1827 - 36。gydF4y2Ba
Goodrich J, Puangsomlee P, Martin M, Long D, Meyerowitz EM, Coupland g。大自然。1997;386(6620):44。gydF4y2Ba
Lopez-Vernaza M, Yang S, Müller R, Thorpe F, De Leau E, Goodrich J. SEPALLATA3、FT和FLC基因作为多comb组基因CURLY LEAF靶标的拮抗作用。《公共科学图书馆•综合》。2012;7 (2):e30715。gydF4y2Ba
费尔南德斯德,王c - t,郑昱,Adamczyk BJ, Singhal R, Hall PK, Perry SE。mads结构域因子AGAMOUS-LIKE15和AGAMOUS-LIKE18以及短营养期和AGAMOUS-LIKE24是在营养期阻断花基因表达所必需的。植物杂志。2014;165(4):1591 - 603。gydF4y2Ba
Pajoro A, Madrigal P, Muiño JM, Matus JT, Jin J, Mecchia MA, Debernardi JM, Palatnik JF, Balazadeh S, Arif M.花发育过程中mads转录因子对染色质可达性和基因调控的动态。基因组医学杂志。2014;15 (3):R41。gydF4y2Ba
曾旭,刘辉,杜辉,王松,杨伟,迟勇,王杰,黄峰,于东。大豆MADS-box基因GmAGL1通过光周期通路促进开花。BMC基因组学。2018;19(1):51。gydF4y2Ba
Koyama T, Mitsuda N, Seki M, Shinozaki K, Ohme-Takagi M. TCP转录因子调控拟南芥叶片分化过程中不对称LEAVES1和miR164的活性,以及生长素反应。植物细胞。2010;22(11):3574 - 88。gydF4y2Ba
刘东,宋勇,陈铮,于东。miR396异位表达抑制拟南芥GRF靶基因表达并改变叶片生长。杂志。2009;136(2):223 - 36。gydF4y2Ba
何颖,宁刚,孙颖,胡颖,赵旭,包明。万寿菊(Tagetes erecta L.)自发花器官同源转化雄性不育型的细胞学和制图分析。摩尔品种。2010;(1):26日19-29。gydF4y2Ba
Zahn LM, Kong H, Leebens-Mack JH, Kim S, Soltis PS, Landherr LL, Soltis DE, Depamphilis CW, Ma H. MADS-box基因SEPALLATA亚家族的进化:在被子植物历史中具有多重复制的前被子植物起源。遗传学。2005;169(4):2209 - 23所示。gydF4y2Ba
张建勇,乔云云,吕东,高志华,曲顺生,张铮。湖北海棠NPR1诱导转基因烟草中致病相关蛋白基因的表达。植物医学杂志。2012;14:46-56。gydF4y2Ba
花浸法:农杆菌介导的拟南芥转化的一种简化方法。植物j . 1998; 16(6): 735 - 43。gydF4y2Ba
张松,陆松,易松,韩浩,刘亮,张娟,鲍明,刘刚,基部eudicot树sepallta类基因功能的保守与分化,gydF4y2Ba梧桐树gydF4y2Ba.足底。2017;245(2):439 - 57。gydF4y2Ba
致谢gydF4y2Ba
感谢我们实验室所有过去和现在的同事的建设性讨论和技术支持。gydF4y2Ba
资金gydF4y2Ba
本研究得到国家自然科学基金项目(31672181)和中央高校基本科研业务费专项资金项目(2662019PY072)的资助。资助者不参与研究设计、数据收集和分析、决定发表或准备手稿。gydF4y2Ba
作者信息gydF4y2Ba
从属关系gydF4y2Ba
贡献gydF4y2Ba
构思并设计了实验:YHH, CLZ。完成实验:CLZ。分析数据:CLZ, YQW。贡献的试剂/材料/分析工具:CLZ, LDW, WJW, WQQ, HL, ZC。代写论文:CLZ, YHH, ZC, WQQ, MZB。所有作者阅读并批准了最终稿件。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
伦理批准和同意参与gydF4y2Ba
不适用。gydF4y2Ba
同意出版gydF4y2Ba
不适用。gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者声明他们之间没有利益冲突。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba
施普林格自然对出版的地图和机构附属的管辖权要求保持中立。gydF4y2Ba
补充信息gydF4y2Ba
附加文件1:表S1。gydF4y2Ba
引物序列。gydF4y2Ba
附加文件2:表S2。gydF4y2Ba
C类蛋白质的氨基酸序列比对。gydF4y2Ba
附加文件3:表S3。gydF4y2Ba
D类蛋白质的氨基酸序列比对。gydF4y2Ba
附加文件4:图S1。gydF4y2Ba
表达水平的gydF4y2BaTeAG1、TeAG2 TeAGL11-1gydF4y2Ba而且gydF4y2BaTeAGL11-2gydF4y2Ba在不同的组织和器官中。Rt:根;Sm:茎;勒:叶;FB1-FB4:花蕾直径分别为0- 1mm、2- 3mm、4 - 5mm、6- 7mm;再保险:插座;Br:苞片;RS:射线小花的萼片;RP:射线小花花瓣;RPi:射线小花的雌蕊; Se: sepal of disk floret; Pe: petal of disk floret; St: stamen of disk floret; Pi: pistil of disk floret; Ov: ovary.
附加文件5:图S2。gydF4y2Ba
酵母双杂交测定金盏花TeAG和TeAGL11蛋白的相互作用(a)评估AD和BD结构的自激活和自动作用。(b)从10gydF4y2Ba−1gydF4y2Ba到10gydF4y2Ba−4gydF4y2Ba分别在含有X-α-gal的SD -Leu/ - Trp/ - His/ - Ade平板上进行标记。gydF4y2Ba
附加文件6:图S3。gydF4y2Ba
的表达gydF4y2BaTeAG1、TeAG2 TeAGL11-1gydF4y2Ba而且gydF4y2BaTeAGL11-2gydF4y2Ba半定量RT-PCR检测T1转基因株系幼苗。(a - 1)gydF4y2Ba35 s: TeAG1gydF4y2Ba转基因线。(b - 1)gydF4y2Ba35 s: TeAG2gydF4y2Ba转基因线。(颈- 1)gydF4y2Ba35 s: TeAG11-1gydF4y2Ba转基因线。(d 1)gydF4y2Ba35 s: TeAG11-2gydF4y2Ba转基因线。WT:野生型线;SL:表现性强系;WL:弱表型系;李:转基因线。(a-2, b-2, c-2, d-2),构成基因为拟南芥护巢基因gydF4y2BaAtEF1α。多克斯(654 kb)gydF4y2Ba
补充文件7:表S4。gydF4y2Ba
对照组与对照组结实率的统计gydF4y2BaSl-TeAG1gydF4y2Ba转基因线。gydF4y2Ba
附加文件8:表S5。gydF4y2Ba
对照组与对照组结实率的统计gydF4y2BaSl-TeAGL11-1gydF4y2Ba转基因线。gydF4y2Ba
附加文件9:表S6。gydF4y2Ba
C原始数据gydF4y2BaTgydF4y2Ba在qRT-PCR中的表达水平gydF4y2BaTeAG1gydF4y2Ba,gydF4y2BaTeAG2gydF4y2Ba,gydF4y2BaTeAGL11-1gydF4y2Ba,gydF4y2BaTeAGL11-2gydF4y2Ba在万寿菊的不同组织和器官中。gydF4y2Ba
附加文件10:表S7。gydF4y2Ba
C原始数据gydF4y2BaTgydF4y2Ba在qRT-PCR中的表达水平gydF4y2BaAP1gydF4y2Ba,gydF4y2BaAP3gydF4y2Ba,gydF4y2BaπgydF4y2Ba,gydF4y2BaAG)gydF4y2Ba,gydF4y2BaSTKgydF4y2Ba在花gydF4y2Ba35 s: TeAG1gydF4y2Ba转基因系和野生型拟南芥。gydF4y2Ba
附加文件11:表S8。gydF4y2Ba
C原始数据gydF4y2BaTgydF4y2Ba在qRT-PCR中的表达水平gydF4y2BaAP1gydF4y2Ba,gydF4y2BaAP3gydF4y2Ba,gydF4y2BaπgydF4y2Ba,gydF4y2BaAG)gydF4y2Ba,gydF4y2BaSTKgydF4y2Ba在花gydF4y2Ba35 s: TeAGL11-1gydF4y2Ba转基因系和野生型拟南芥。gydF4y2Ba
附加文件12:表S9。gydF4y2Ba
C原始数据gydF4y2BaTgydF4y2Ba在qRT-PCR中的表达水平gydF4y2BaAP1gydF4y2Ba,gydF4y2BaAP3gydF4y2Ba,gydF4y2BaπgydF4y2Ba,gydF4y2BaAG)gydF4y2Ba,gydF4y2BaSTKgydF4y2Ba幼苗的gydF4y2Ba35 s: TeAG1gydF4y2Ba转基因系和野生型拟南芥。gydF4y2Ba
附加文件13:表S10。gydF4y2Ba
C原始数据gydF4y2BaTgydF4y2Ba在qRT-PCR中的表达水平gydF4y2BaAP1gydF4y2Ba,gydF4y2BaAP3gydF4y2Ba,gydF4y2BaπgydF4y2Ba,gydF4y2BaAG)gydF4y2Ba,gydF4y2BaSTKgydF4y2Ba幼苗的gydF4y2Ba35 s: TeAGL11-1gydF4y2Ba转基因系和野生型拟南芥。gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循创作共用署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),该协议允许在任何媒体或格式中使用、分享、改编、分发和复制,只要您给予原作者和来源适当的署名,提供创作共用许可协议的链接,并说明是否有更改。本文中的图片或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果材料不包含在文章的创作共用许可中,并且您的预期用途不被法律法规允许或超出了允许的用途,您将需要直接从版权所有者那里获得许可。欲查看此许可证的副本,请访问gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.创作共用公共领域奉献放弃书(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)适用于本文提供的数据,除非在数据的信用额度中另有说明。gydF4y2Ba
关于这篇文章gydF4y2Ba
引用这篇文章gydF4y2Ba
张聪,魏磊,王伟。gydF4y2Baet al。gydF4y2Ba的鉴定、表征和功能分析gydF4y2Ba无性生殖的gydF4y2Ba与万寿菊花器官和种子发育相关的亚家族基因(gydF4y2Ba万寿菊gydF4y2Ba).gydF4y2BaBMC植物杂志gydF4y2Ba20.gydF4y2Ba439(2020)。https://doi.org/10.1186/s12870-020-02644-5gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12870-020-02644-5gydF4y2Ba
关键字gydF4y2Ba
- 金盏花gydF4y2Ba
- 植物的器官gydF4y2Ba
- MADS-box基因gydF4y2Ba
- 无性生殖的gydF4y2Ba亚基因gydF4y2Ba
- 功能分析gydF4y2Ba