摘要
背景
高亲和力硝酸盐转运体2 (NRT2)基因与许多植物在氮(N)饥饿胁迫下的硝酸盐吸收和再动员有关,但该基因家族对各种胁迫的响应通常发生在油菜生产中(芸苔属植物显著l .)。
结果
此报告详细说明鉴定17NRT2并利用RNA-seq分析和qRT-PCR分析评估其表达谱。在这项研究中BnNRT2。1名会员,bnnrt2.2a.和bnnrt2.4a.特异性表达于根组织,而bnnrt2.7a.和bnnrt2.7b.主要表达在地上部分,包括as主要表达NRT2在种子中发现的基因。这种拍摄模式NRT表达,以及拟南芥的同源性NRT在种子中表达,强烈表明两者都BnNRT2。7基因在种子硝酸盐积累中发挥作用。另一个油菜籽NRT那BnNRT2.5年代,表达中间体表达,在芽和根组织中检测到转录物。功能BnNRT2s基因通过在表达测试对于适应性反应暴露于一系列环境胁迫,包括N,磷(P)或钾(K)缺乏症,水涝和干旱的进一步概述。在这些测试中,最NRT2基因成员在N饥饿条件下表达上调,在其他胁迫条件下表达受限。与这一总体趋势相反,转录bnnrt2.1a.在淹水和缺钾胁迫下,BnNRT2.5年代在淹水的根系中表达上调。此外,mRNA水平BnNRT2.7年代在淹水胁迫和缺磷、缺钾条件下均有增强。这些结果表明,这三个BnNRT2基因可能会在不同的压力反应途径中参与串扰。
结论
这里展示的结果概述了一组不同的NRT2基因存在于基因油菜籽共同开展油菜整个开发特定功能的同时,还应对不只是缺氮,也给其他几个应力。的具体定位BnNRT2协调油菜硝酸盐吸收和转运以响应多种胁迫响应途径的线索,可以显著扩大油菜抗环境胁迫的遗传资源。
背景
氮(N)是一种重要的植物常量营养素,其可得性往往有限,这导致全世界数百万公吨氮肥被以高昂的成本用于农业领域[1那2].此外,过量施用氮肥会污染水和空气,使环境恶化,也会导致全球变暖。因此,通过提高作物氮素利用效率(NUE)来减少对氮肥的需求是作物育种家和植物科学家有价值的研究目标[3.].
对大多数植物来说,吸收、同化和转运过程是成功地从土壤中获取和利用氮的重要早期步骤。氮同化需要硝酸盐(NO)的还原3.-)至铵,然后将铵掺入氨基酸中,这取决于无机N来源的获取和运输和多种植物器官之间的氨基酸和蛋白质的转移[4.].因为没有3.-是土壤中最丰富的无机氮[1),没有3.-因此,吸收和易位,在NUE发挥重要角色。
土壤中N的组成受湿度、温度、风、土壤类型和pH等多种因素的影响,导致土壤环境中硝酸盐浓度存在较大差异[3.那5.].为了应对没有的异质性3.-在土壤中,植物进化出了两种NO3.-分别由NRT1和NRT2介导的低亲和转运系统(low-affinity transport system, LATS)和高亲和转运系统(high-affinity transport system, HATS) [6.].总体而言,NRT2活动提供者NRT1活动随着N可用性的减少。在一组可比结果中,表达式非洲爪蟾蜍卵母细胞已导致km.value estimates of 5.9 mM for the拟南芥背阔肌桥AtNRT1.2大麦HATS运输器为30 μMHvNRT2.1[7.那8.].这种近200倍的硝酸盐亲和力差异表明HATSNRT2可能是在努力提高NUE的主要目标,特别是在低N可用条件下。
七个高亲和力硝酸盐转运体(nrt2.1.-nrt2.7.)已被确定在拟南芥蒂利亚纳(l) [6.那9.].迄今为止,AtNRT2.1那AtNRT2.2和AtNRT2.4已经涉及根部没有3.-吸收(10那11].有趣的是,Atnrt2.1在没有占据主要作用3.-吸收,而ATNRT2.2能够补偿丢失的损失3.AtNRT2.1失能时的摄取[12].AtNRT2.4在NO中起作用3.-吸收,但也有助于装载没有3.-在茎部韧皮部导管中[11].另一种高亲和力硝酸盐转运蛋白拟南芥,atnrt2.5.,在限氮条件下,成熟植株的茎和根均上调,支持硝酸盐的有效吸收,并在硝酸盐转移过程中向韧皮部输送硝酸盐[13].ATNRT2.7.据报道据报道,在真空膜上定位,它在种子硝酸盐积聚中起着细节作用[14].既不nrt2.3.也不nrt2.6在NO3.-吸收或易位。同源的类似活动拟南芥NRT2作物物种的基因已经部分得到证实,尽管努力有限。与大米有关的研究发现了五个NRT2基因,包括osnrt2.3a.据发现,这是在N个限制条件下拍摄硝酸盐易位的关键作用[15].
油菜籽(芸苔属植物显著L.)是一种全球性重要作物油是用于生产植物油,生物燃料和工业产品的广泛栽培,如润滑剂和表面活性剂[16那17].作为异源四倍体芸苔属植物显著(基因组A.N一种NCNCN)为基因组加倍在之间的杂交产物芸苔属植物oleracea基因组(l) (CO.CO.),Brassica Rapa.(基因组(l)R.一种R.) ~ 7500年前[18].这表明芸苔属植物显著基因组可能含有多个同源物的个人NRT2成员拟南芥[18].油菜籽需要大量的n,因此对土壤n可用性的变化非常敏感[19].减少氮肥的输入保持油菜籽的产率,因此,会很可能继承权提高油菜籽的NUE一会儿。此外,油菜籽是各种环境压力,如大量营养素不足,水涝和干旱胁迫敏感,这些会导致营养物imbanlance,影响氮代谢或其他代谢途径,最终抑制油菜籽的生长和产量[20.那21.那22.那23.那24.那25.].有必要了解自适应模式NRT2家族基因响应于这些常见于油菜籽中的应力。因此,本研究的目的是(i)识别所有nrt2家庭成员芸苔属植物显著基因组,(ii)分析基因组和转录组特征BnNRT2s家族成员,包括外显子-内含子结构、保守基序、系统发育、基因复制、组织特异性表达及其在各种胁迫下的响应情况,以及(iii)确定参与NO的核心基因成员3.-Ñ限制条件或其他环境胁迫下的吸收和运输。总体来说,这份报告揭示的特征NRT2同时也为油菜田提高氮肥利用率和减少氮肥施用提供了候选基因资源。
结果
油菜全基因组鉴定与生物信息学分析NRT2家族的基因
为了确定NRT2油菜中的基因成员,使用ATNRT2S的氨基酸序列来进行芸苔病毒数据库(BRAD)的BOARCH搜索,其返回鉴定为17个基因NRT2如表所示1.这些BnNRT2基因根据其顶部标记拟南芥火柴BnNRT2.1年代(7个基因),BnNRT2.2年代(2)基因,BNNRT2.3 S.(2)基因,BnNRT2.4年代(2)基因,BnNRT2.5年代(2基因)和BnNRT2.7年代(2)的基因。没有同系物atnrt2.6在菜籽基因组中鉴定出来。根据布拉德物理地图,所识别的BnNRT2基因成员映射到9条染色体上(chrA02, chrA06, chrA08, chrA09, chrA10;chrC02, chrC03, chrC08, chrC09),带BnNRT2基因在A和C基因组中的分布几乎相同(图S1).例如,bnnrt2.5a.和bnnrt2.5b.分别映射到chrC03和chrA08,而bnnrt2.7a.和bnnrt2.7b.分别被映射到chrC02和chrA02(图:S1).这提供了不可否认的证据了解更多nrt2油菜的基因成员比油菜的基因成员多拟南芥,这是由于基因组乘法中的杂交B.oleracea(基因组C.O.CO.),b·拉伯(基因组A.R.一种R.).油菜基因重复分析确实发现,14对已鉴定的BnNRT2重复对中,10对来自全基因组重复,4对来自转座重复(表S)1).
BnNRT2蛋白长度从353个(BnNRT2.1b和BnNRT2.1c)氨基酸残基到506个(BnNRT2.2b)氨基酸残基1).BNNRT2S之间的百分比(表S2)从26.9%(BNNRT2.1b和bnnrt2.7a)的范围为98.8%(bnnrt2.5a和bnnrt2.5b)。对于BNNRT2.7b计算的最小PI值为7.54,这意味着所有BNNRT2S都是碱性蛋白质。亚细胞定位预测表明,除了BNNRT2.4a之外,大多数BNNRT2s定位在血浆膜上,其预测为具有信号肽的细胞质蛋白,BNNRT2.4b预测为线粒体蛋白,BNNRT2.7 S都是如BNNRT2.7 S的被预测为真空蛋白(表1).在预测的亚细胞定位中,这种繁文表明,BNNRT2,如ATNRT2S,执行不同的运输功能。跨膜螺旋预测的结果也支持这一结论,单独的BNNRT2S覆盖8到10个跨膜螺旋(图S2).
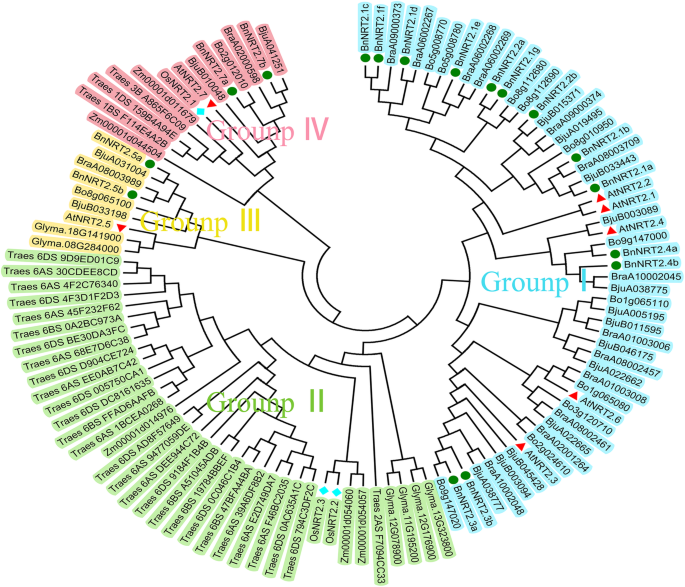
为了了解油菜籽和其他物种中NRT2蛋白质之间的系统发育关系,构建了NRT2家族的大型系统发育树。如图1所示。1,树被分为四组,命名为组I-IV。在四组中,BnNRT2.1 s、BnNRT2.2 s、BnNRT2.3 s和BnNRT2.4 s分布在I组,BnNRT2.5 s和BnNRT2.7 s分布在III组和IV组,进一步说明BnNRT2.5 s和BnNRT2.7 s之间发生了功能分化。通过比较分析发现,油菜籽NRT2蛋白与其同源基因的排列紧密A. Thaliana,但不是来自nrt2so .、马唐具有NRT2蛋白质成员的单子叶植物,主要分为II族。
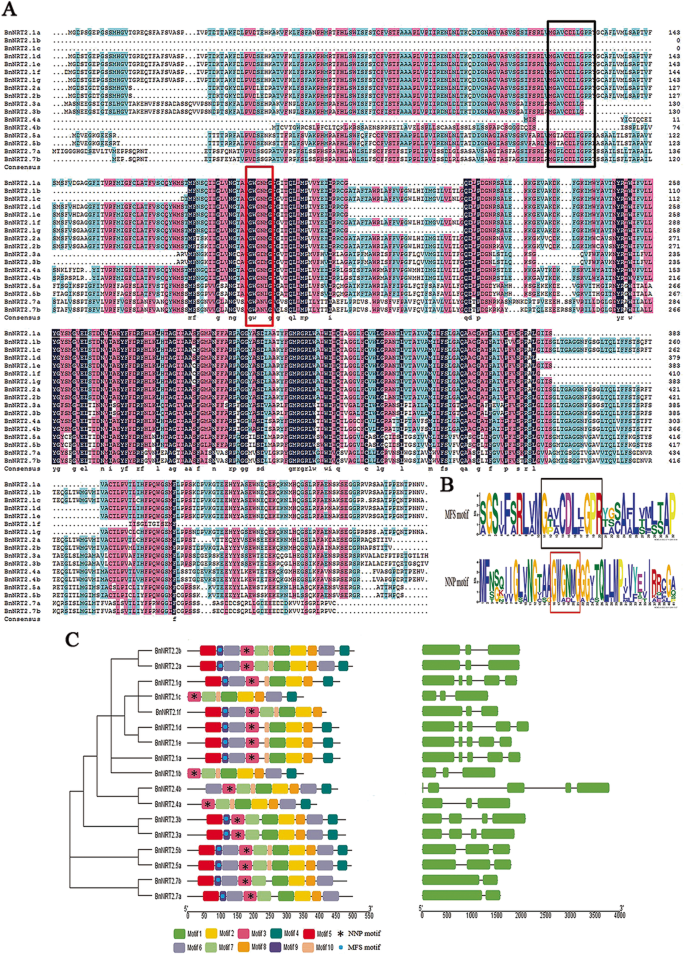
BnNRT2氨基酸序列的多重序列比对结果,作为DNAMAN表现,表明NRT2蛋白质可能硝酸盐或亚硝酸盐波特家族(NNP)成员的主要推动者总科(MFS),与MFS (G-x-x-x-D-x-x-G-x-R)和NNP (G-W / L-G-N-M / g)签名BnNRT2序列(图中确定。2a). Weblogo输出结果显示,几乎所有BnNRT2蛋白成员都有一个高度保守的NNP motif (G-W-G/ a - n /D-M/L/V-G)。而在BnNRT2.1b、BnNRT2.1c、BnNRT2.4a和BnNRT2.4b中未发现MFS motif (G-A/T/P-V/L/ a - c - d -L/I/F-G-P-R)。2a, b).在最大motif数设置为10的MEME网络应用程序中进一步分析BnNRT2氨基酸序列,发现所有识别到的BnNRT2成员都含有标记为“motif 1-motif 2-motif 8”的保守结构域(图1)。2C)。
基因结构分析BnNRT2s表明BnNRT2.2年代那BNNRT2.3 S.那BnNRT2.5年代和BnNRT2.7年代具有相同数量的内含子和外显子(图2C)。相比之下,BnNRT2.4a和BnNRT2.4b缺乏第一两个外显子(图2c),这可能表明功能性分歧。更重要的是,基因结构BnNRT2.1会员可分为两种类型:1)有四种内含子和五个外显子(bnnrt2.1a.那bnnrt2.1d.那bnnrt2.1e.和BnNRT2.1 g);2)两个内含子和三个外显子(bnnrt2.1b.那bnnrt2.1c和bnnrt2.1f.)(图。2C)。
促进区的推定式CIS作用调控元素(CRES)分析BnNRT2家族的基因
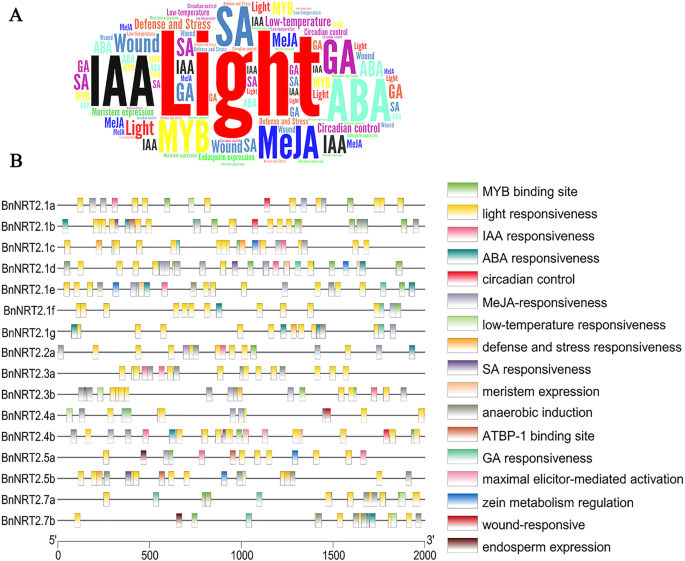
转录表达在很大程度上是通过转录因子(TFs)与顺式作用调控元件(CREs)的结合来调控的。了解潜在的监管BnNRT2,对起始密码子上游2000bp区域进行了CREs分析BnNRT2.如图所示。3.a,在所有分析的CREs中最丰富BnNRT2启动子区域是光响应元件,其次是若干激素相关元件和MYB结合位点。具体来说,就是油菜籽的CREsNRT2基因可分为四类,分别是MYB结合位点、非生物胁迫响应元件、激素相关元件、生长发育调控元件(图1)。3.b)。
MYB蛋白是多功能转录因子,参与许多植物过程[26.].均发现MYB结合位点BnNRT2推动者区域,除了上游的地区BnNRT2.1 g那bnnrt2.3a.和bnnrt2.5b.(无花果。3.b)。在所有的启动子地区都发现了光响应性元素BnNRT2基因家族成员,而低温应答元件中的启动子区中也发现BnNRT2.1a, BnNRT2.3b, BnNRT2.4a, BnNRT2.5b和BnNRT2.7年代(无花果。3.b).更广泛的非生物胁迫响应元件,包括光响应、低温响应、防御和胁迫响应、厌氧诱导和创伤响应,在整个系统中都有广泛的代表BnNRT2启动子区域(图3.b)。此外,激素相关的元素被很好中表示BnNRT2在油菜启动子区域中广泛发现了ABA、MeJA、SA、GA和IAA响应元件NRT2基因(图。3.b)相比之下,生长发育调控因子在Bn中分布更为稀疏NRT2启动子区域。所鉴定的生长发育CREs包括发生在启动子区域的昼夜节律控制相关因子bnnrt2.1a,bnnrt2.1b.和bnnrt2.4b.,在促进区域中发生的分生表达相关元素bnnrt2.1b,bnnrt2.1d和bnnrt2.1e.,胚乳表达的相关元件只发生在启动子区域bnnrt2.5a.和bnnrt2.7b.(无花果。3.b)。
油菜籽的组织特异性表达NRT2家族的基因
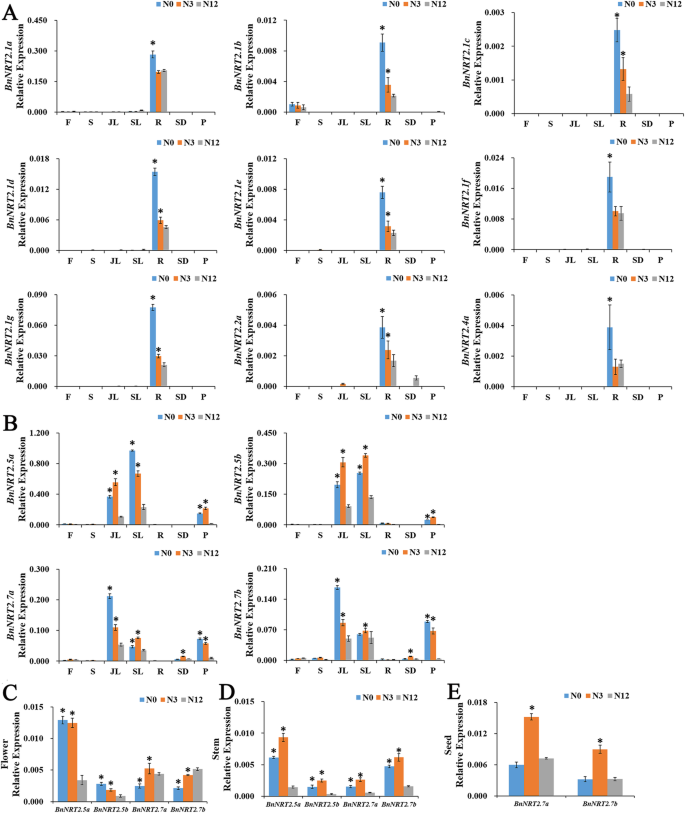
探索的组织特异性的表达谱BnNRT2从油菜全生命周期的各个组织中收集RNA-seq和qRT-PCR样本。其中,对雌蕊、雄蕊、胚珠、茎、叶、根、角果、果皮样品进行rna测序,对成虫花、茎、幼叶、老叶、根、种子、果皮样品进行qRT-PCR检测。对早期表达也进行了检测bnnrt2.5a., 和bnnrt2.5a.对油菜籽苗期根系和叶片样品进行qRT-PCR检测。
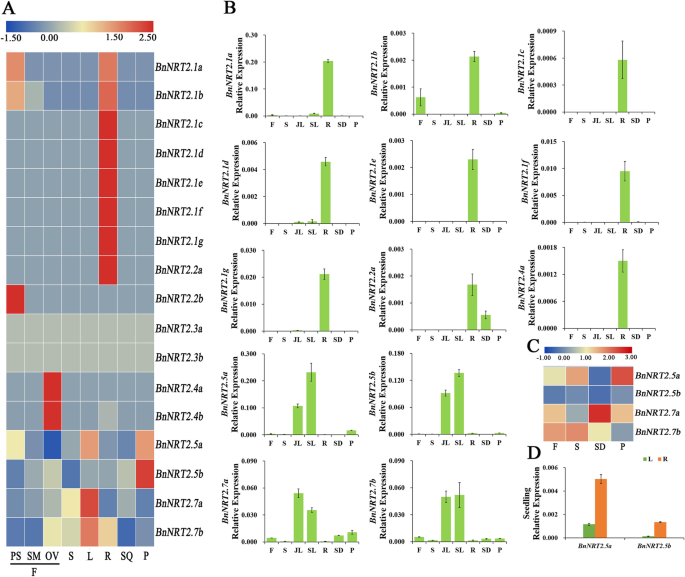
结合RNA-seq和qRT-PCR分析结果表明,在成年植物中,bnnrt2.1a-g那bnnrt2.2a.和bnnrt2.4a.主要表现在词根,withbnnrt2.1a.成为最丰富的根BnNRT2, 和bnnrt2.1b.在根和花中都有丰富的转录本,特别是雌蕊(图。4.a)进一步观察BnNRT2在qRT-PCR检测中表达(图。4.B,C)在很大程度上证实了RNA-SEQ分析的结果(图。4.a)。值得注意的是,所有的人BnNRT2.1基因主要在根中表达。同时,在芽中表达BnNRT2年代,BnNRT2.5和BnNRT2.7家庭成员主要在叶组织中表达(图。4.B),尽管在花、茎和果皮以及种子中也可以明显地检测到它们BnNRT2。7个家庭成员(图。4.C)。进一步的QRT-PCR测定BnNTR2.5用水疏苗饲养进行的组织特异性表达谱系也恢复了两者的可检测到的表达bnnrt2.5a.和bnnrt2.5b.虽然幼苗的这些基因比成年植物在成年植物中的根部比在枝叶中表达较高(图。4.d)。
的组织特异性表达谱BnNRT2通过RNA-seq和qRT-PCR检测确定家族基因。一种热相对表达的映射从RNA-SEQ分析BnNRT2在八个不同的组织中的表达。PS:Pistil,SM:STAMEN,OV:Ovule,S:Step,L:Leaf,R:Root,SQ:Silique,P:Pericarp。B.-D.组织特异性表达概述BnNRT2在QRT-PCR测定中测定的基因。B.表达式BnNRT2不同成年植物中的不同组织在不同的生长阶段。从补充有180kg / hm的N的场图中收集成人植物的每个组织2详细地,在营养生长阶段(即越冬阶段),在开花阶段收集花(F)和茎,尿素在营养生长阶段(即冬季)和茎(即茎)。然后在繁殖生长阶段收集种子(SD)和PericaRP(P)。C的表达BnNRT2.5年代在幼苗组织中(21日龄油菜籽苗)。油菜籽幼苗在正常N处理(9.5 mM N)的水培培养中培养,L:叶片,R:根。D.的表情BnNRT2.5年代和BnNRT2.7年代在花(F),茎(S),种子(SD)和Pericarp(P)中,但在热图中进一步描绘了QRT-PCR测定
BnNRT2家族基因在现场为N剥夺回应
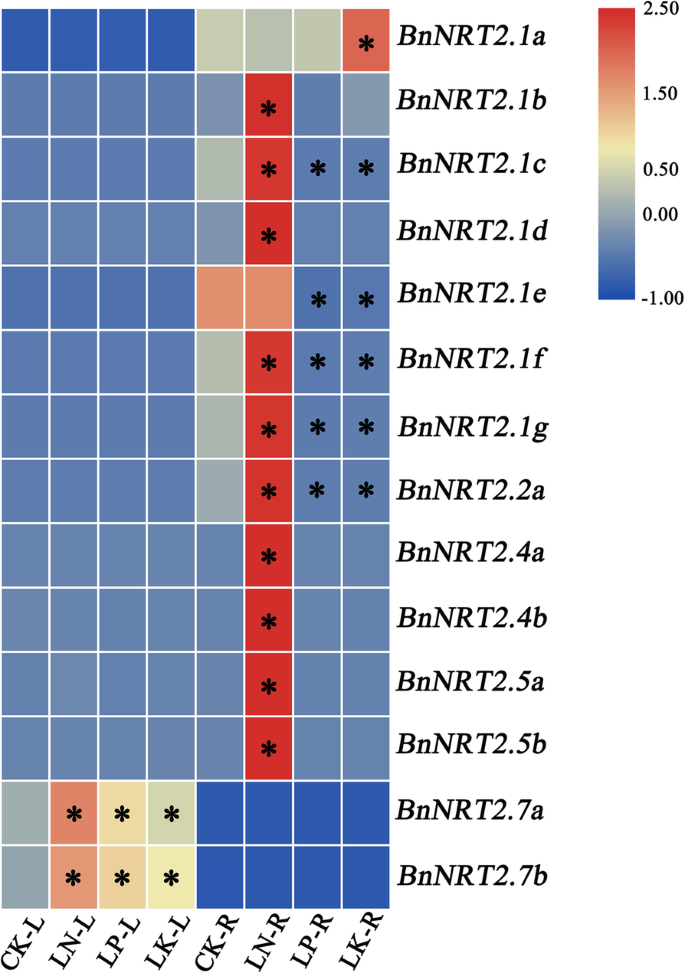
研究…的可能作用NRT2s在油菜对N剥夺反应中的表达BnNRT2在田间小区中测定了油菜不同组织的家族基因,这些基因在尿素施用处理中产生了显著的氮效应(图S3.A, B).结果显示显著上调BnNRT2.1年代那bnnrt2.2a.和bnnrt2.4a.根(无花果。5.A),和的表达BnNRT2.5年代和BnNRT2.7年代显著上调油菜叶片、茎和果皮对N剥夺的响应(图。5.此外,……的丰富BnNRT2。油菜花中5个转录本也显著增加(图5)。5.c)BnNRT2.7s到N的剥夺与观察到的其他反应相反BnNRT2而在中氮或高氮供给区生长的植株中表达量达到峰值,而在低氮供给区生长的植株中表达量达到峰值。5.c, d, e)。
的反应BnNRT2表达谱的改变的N供应的qRT-PCR测定法来确定。一种根特异性反应BnNRT2基因(BnNRT2.1年代,bnnrt2.2a.和bnnrt2.4a.).B.芽特异性反应BnNRT2基因(BnNRT2.5 s andBnNRT2.7年代)。C的反应BnNRT2.5 s andBnNRT2.7年代的花。D.的反应BnNRT2.5 s andBnNRT2.7在阀杆。E.的反应BnNRT2.7年代在种子中。对于这些测定,油菜籽在提供180,45或0 kg / hm提供的场图中培养2N.油菜籽,油菜籽2在每个采样时间,以n提供地块为对照地块。星号表示对照地块与45 kg/hm或0 kg/hm地块之间的表达差异显著2尿素(P.< 0.05)
表达概况BnNRT2家族基因响应水培宏量营养素缺乏症
在本研究中,表达BnNRT2在水培中对营养不平衡的反应进行了基因分析。为此,采用水培法对油菜幼苗进行N、磷(P)和钾(K)缺乏处理,以检测油菜幼苗表达的响应BnNRT2这三种MACRORRIERS中任一项的基因缺乏。如图1所示。6.,最BnNRT2.1年代(有例外的bnnrt2.1a.和bnnrt2.1e.),bnnrt2.2a.均显著上调经受缺氮根,但是通过P或K缺乏显着地下调。有趣的是,bnnrt2.1a.似乎在k缺乏症的根源中特别上调bnnrt2.1e.对缺磷、缺钾的响应显著下调,而对缺氮的响应不显著下调(Fig。6.).而且,BnNRT2.4和BnNRT2.5氮素缺乏对根系中成员的表达有明显的影响。6.).与此相反,以根特异性应答,叶表达式BnNRT2.7年代被测的每一种宏量营养素缺乏症显著上调(图。6.),提示这些基因可能参与了N、P、K稳态信号通路的串扰。
的反应BnNRT2干旱或涝渍胁迫的基因表达
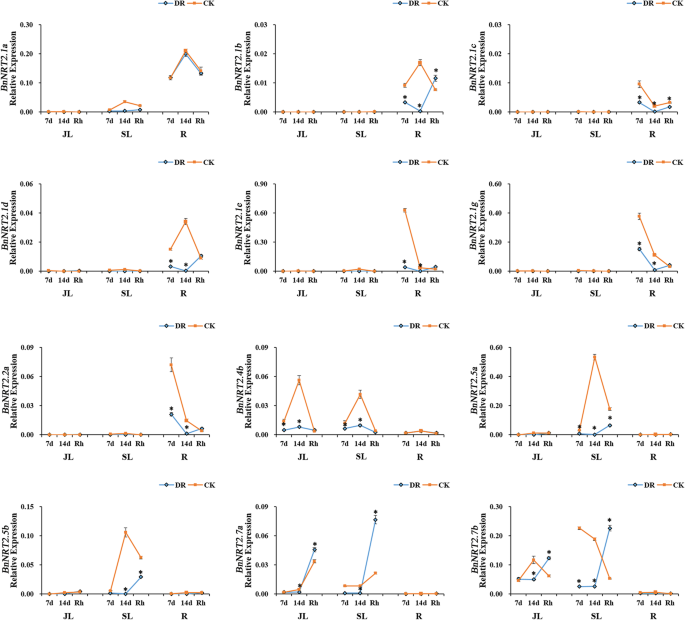
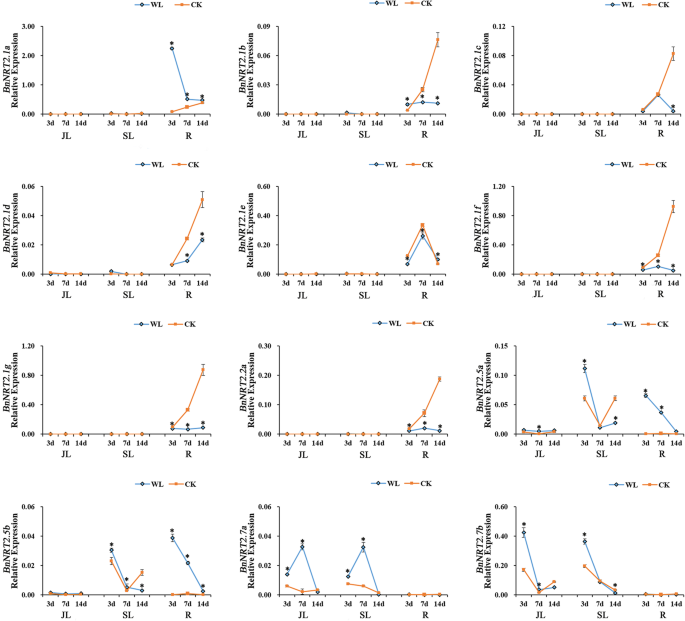
干旱和涝渍对农业生产产生了极大的影响,对油菜植物的严重影响往往发生营养生长。在本研究中,在盆栽培养物中模拟干旱和涝脂胁迫,以研究表达模式BnNRT2s基因在应对这些压力。在干旱胁迫条件下,转录丰所有的BnNRT2基因,除了bnnrt2.1a.,在14天的干旱胁迫过程中相对于对照罐的表达量显著下降,然后在复水后恢复到对照水平(图。7.).表达式bnnrt2.1a.在干旱处理的盆保持在在对照盆中观察到的水平(图7.).在另一个极端,在涝渍压力条件下,bnnrt2.1a.和BnNRT2.5成员S在根中显著上调,而bnnrt2.7a.在叶片中表达显著上调(图。8.).同时,词根表达bnnrt2.1e.在淹水的罐子中仍然是高的,相对于在对照罐子中的表达没有变化,而,转录丰度bnnrt2.1f.那BnNRT2.1 g和bnnrt2.2a.在响应涝渍应激的根中显着下调(图。8.).
qRT-PCR分析表达谱BnNRT2家族基因响应淹水胁迫。For this assay, rapeseed seedlings at the five leaf growth stage were subjected to waterlogging stress for 14 days. Tissues for qRT-PCR assays were harvested on the 3rd, 7th and 14th days of waterlogging stress. The blue line connects observations in the waterlogging stress treatment (WL), and the orange line connects observations in the control treatment (CK). Asterisks mark significant differences in expression between control and waterlogging stress treatments (P < 0.05). JL: junior leaf, SL: senior leaf, R: root
讨论
NRT2蛋白在细菌、动物和植物中很常见。虽然NRT2从许多物种的基因家族成员已经详细描述的,硝酸盐转运油菜,特别是对各种胁迫响应信息仍然有限。在这项研究中,17推定NRT2从油菜籽的基因组中确定了基因,这意味着个体拟南芥NRT2油菜基因(7个基因)可能有多个同源基因。确实,在这项研究中观察到了这一点,但其预期的结果是总共有7个BnNRT2.1基因和两个BnNRT2.2根据在各自最接近的匹配基因鉴定拟南芥是高度相似的一对NRT2基因,AtNRT2.1和AtNRT2.2(无花果。1和表格1).范围BnNRT2.1油菜籽中的基因表明,这个复杂的基因家族可能是油菜籽进化史上异源多倍体或复制事件的产物[18],我们的结果确实发现,最基因复制NRT2基因家族是全基因组复制的结果(表S1).此外,本文报道的大量营养素缺乏试验结果清楚地表明,重复BnNRT2.1基因导致了这个家庭的成员中变化的常量营养素应激条件反应扮演的特定角色的分歧。保守结构域分析表明,推定鉴定NRT2蛋白的所有17怀有签名序列(G-W-G / A-N / d-M / L / V-G)NNP蛋白质家族(图2),也在其他NRT2转运体中发现,如在大肠杆菌和nrt2 in.来。cylindrosporum[9.那27.].
顺式作用的调控元件分析BnNRT2启动子区域的显示光响应元件(图极大丰富。3.),这意味着BnNRT2基因表达与光合作用密切相关,可能每天都受到调控。先前的研究与拟南芥阐明了上调的AtNRT2.1在白天和下调夜间,可以通过蔗糖抑制[28.那29.].将我们的研究结果与过去的报告结合起来,支持了这样的结论:作为光和蔗糖调节NO的介质3.-油菜籽采运NRTs是协调碳氮代谢系统的关键成员。此外,复制BnNRT2.1对N、P、K缺乏性处理的反应的基因和变异表明NRT基因参与调节多种营养响应途径。
几个以前的研究表明,有限的外部没有3.-耗材可以通过成熟的根尖分生组织活性的调节,其中,在油菜籽,将细胞在分生组织区域被比在伸长区填充更密集地促进侧根伸长[30.].在拟南芥那AtNRT2.1和AtNRT2.2,两个主要在根中表达的硝酸盐转运基因,在促进侧根伸长中起关键作用[31.那32.].最近的研究也表明了倒闭csnrt2.1.在低NO处理下,根系长度和侧根数显著减少3.-状况 [33.].在本研究中,BnNRT2.1年代缺氮应力(图中在根中表达,并且最表达上调。5.和6.).加,侧根长度和根尖响应也增加到N缺乏(图:S3.C,d)。因此,我们得出结论,BnNRT2.1家庭成员可能涉及在N有限条件下对侧根伸长的调节。
最近,exo70a3.被确定为的下游靶标PIN4.,一种生长素流出载体,在适应性干旱反应中导致产生更深的根系体系结构(RSA) [34.].类似地,缺氮诱导的更深层次的RSA可能被调节exo70a3.,nrt2.1.可能涉及蟾蜍素途径相关RSA调制的基因,这是由CRES分析中的事实支持的,在启动子序列中发现IAA响应元件BnNRT2.1年代(无花果。3.).
在拟南芥中,奥塞尔[35.的表达概况NRT2家庭成员,AtNRT2.1那AtNRT2.4那ATNRT2.5和atnrt2.6在根中优先表达,ATNRT2.7.在空中零件中具体表达,AtNRT2.3表达中间在前两个轮廓之间,和AtNRT2.2在根或枝上不能察觉的。同样,在本文观察到的菜籽表达谱中,BnNRT2.1年代和BnNRT2.4年代主要以根本表达,而BnNRT2.7年代仅在叶、种子、花、茎等地上部分检测到。4.b, c).另一方面,与Orsel的观察结果相反[35.],bnnrt2.2a.转录本主要在根中检测到BnNRT2.3在根或芽中检测到转录物。我们确实观察到这一点BnNRT2.5年代就像BnNRT2.7年代并主要表达在成人植物的芽中(图。4.b, c).然而,在水培培养的幼苗中,BnNRT2.5年代主要在根中表达(图。4.d)。这可能是水培系统的人工制品,也可能表明,BnNRT2.5年代在根中表达的变化作为植物的成熟。最后,BnNRT2.7年代是唯一的BnNRT2在种子中检测到(图。4.b),与肖邦的[14)发现ATNRT2.7.对种子中硝酸盐的积累起特殊的作用。
迄今为止,一些nrt2.1.- 溶栓的症状基因,其特征在于包括更高的植物物种,包括拟南芥蒂利亚纳[10那36.],甘氨酸最大[37.],小麦[38.],栽培稻[39.],Zea Mays.[40那41.),黄瓜33.]和大白菜[42.],其中许多已被证明是参与根NO的主要hats型基因3.-下氮限制摄取。按照此前的报道,的mRNA水平BnNRT2.1年代在本研究中观察到的根系中,随着氮供应的减少而上调(图。5.).更重要的是,最近的研究已经确定了这种基因BnaA06g04560D(bnnrt2.1d.)通过涉及两个的基因组和转录组分析实验,作为NUE中的关键因素芸苔属植物显著NUE的基因型对比[43.].此外,BnNRT2.5表达谱在幼苗和成体植株之间存在差异,但表达量随着外源氮供应的减少而增加(fig。5.和6.).巧合的是,之前的研究nrt2.1.那nrt2.2.那nrt2.4和nrt2.5.突变体已经表明了这一点ATNRT2.5,它在表皮表达和幼苗中的侧根和成熟植物的次静脉的皮层,与这些其他相结合NRT2S调节硝酸盐的有效摄取,以及在N-饥饿条件下硝酸盐重组期间将硝酸盐加载到Phloem中[13].BnNRT2.5年代在油菜籽中可能起到类似的作用ATNRT2.5在拟南芥,这可能是未来调查的有价值的主题。
氮肥的吸收直接影响作物产量,因此,维持适当的氮肥供应是作物产量管理的重要组成部分。然而,许多压力,如渍水、干旱和营养不足,可能会降低作物产量。如预期的那样,本研究发现淹水、干旱、缺磷、缺钾抑制了油菜籽的表达NRT2基因成员(无花果。6.那7.和8.).具体来说,bnnrt2.1a.在淹水胁迫和缺钾条件下上调,BnNRT2.7在淹水胁迫和缺磷、缺钾条件下,基因表达上调。6.和8.),BnNRT2.5成员在涝渍压力下的根部上调(图。8.).这与之前对一些Pi、Fe转运体的研究结果一致[44.那45.[这还通过不同的营养应力调节,并且良好地记录了当植物对不同营养应力的反应时,在离子信号中存在串扰[45.那46.那47.].增强的表达BnNRT2sp或k缺乏的基因可能是因为n吸收或新陈代谢会受到这些缺陷的影响,我们推测了这些NRT2基因可以感知外部P或K水平的状态。然而,需要进一步调查不同营养素稳态的协同调节机制。另外,增强的表达BnNRT2s可能有助于有效的NO3.-涝渍压力下油菜籽的摄取与运输。因此,可以推断这一点是合理的bnnrt2.1a.那BnNRT2.5年代和BnNRT2.7年代可能在调节氮的吸收和运输的油菜植株经历多重压力发挥重要作用。
结论
总之,17NRT2在油菜基因组中鉴定出九染色体上分布的基因。BnNRT2基因在油菜生长发育过程中发挥重要作用,其时空表达模式尤其在低氮条件下。值得注意的是,表示数BnNRT2对各种压力的反应增加,表明这些NRT2基因通过规定的规定有助于应力适应3.-摄取和运输。总之,这项研究包括了油菜籽的全基因组分析NRT2该研究为了解这些基因的可能功能提供了有价值的信息,对培育在逆境环境下高产的油菜籽具有重要意义。
方法
的识别NRT2基因在油菜
16例以前报告的NRT2蛋白序列,其中包括7A.thaliana,3从栽培稻(L.),3来自甘氨酸最大(L.)和3Zea Mays.(l) [39.那48.那49.,对其基因数据库进行BLAST搜索A.thalianas那甘蓝型那G.max那O.Sativa.那Z.Mays.那T.Aestivum.那B.rape那B.oleracea和B.juncea.然后,对16个起始蛋白序列进行比对,在HMMER (v3.1)中构建HMM profile,使用该HMM profile对BLAST命中进行域搜索,e值阈值为0.001。在BLAST搜索中返回的含有HMMER搜索中定义的NRT2域的菜籽蛋白最终被标记为菜籽NRT2蛋白。本研究查询的基因数据库包括拟南芥信息资源(TAIR) (https://www.arabidopsis.org/)A. Thaliana.基因和基因产物;Genoscope(http://www.genosope.cns.fr/brassicanapus/)甘蓝型[18];所述芸苔属数据库(布拉德)(http://brassicadb.org/brad/)B.rape那B.oleracea和B.juncea[50.那51.那52.];URGI (https://wheat- urgi.versailles.inra.fr/)T.Aestivum.[53.];玉米遗传学和基因组学数据库(MEIZEGDB)(https://maizegdb.org/)Z.Mays.;和Phytozome v12.1 (https:///phytozome.jgi.doe.gov/pz/portal.html.)对于其他物种[54.].这NRT2本研究的油菜籽基因命名如下:BN.+基因同源物名称A. Thaliana.(如nrt2.1.) +小写字母,以区分油菜籽中个体的同源性A.thaliana NRT2基因。例如,bnnrt2.5a.和bnnrt2.5b.两种不同的油菜籽是否同源ATNRT2.5从拟南芥.
生物信息学分析NRT2基因在油菜
油菜籽的基因组位置NRT2基因使用Genoscope(的核苷酸序列中的BLASTn检索确定http://www.genoscope.cns.fr/blat-server/cgi-bin/colza/webBlat).使用MapInspect v.2010绘制所得坐标在基因组定位图中绘制http://www.softsea.com/review/mapinspect. html)。对油菜籽间的基因复制模式进行了鉴定NRT2基因使用Dupgen_Finder(https://github.com/qiao-xin/DupGen_finder) 在B. Napus.[55.].在线扩展软件Proparam分析了氨基酸和理论PI的数量(https://web.expasy.org/cgi-bin/protparam/protparam)[56.].TargetP 1.1版(http://www.cbs.dtu.dk/services/TargetP/)[57.],狼Psort(http://www.genscript.com/wolf-psorthtml的)58.]和ProtComp诉9.0(http://linux1.softberry.com/)预测油菜NRT2蛋白的亚细胞定位。通过TMHMM 2.0 web应用程序预测NRT2蛋白的跨膜螺旋(http://www.cbs.dtu.dk/services/tmmm/).
所有NRT2蛋白序列A.thalianas那甘蓝型那G.max那O.Sativa.那Z.Mays.那T.Aestivum.那B.rape那B.oleracea和B.juncea在,然后将其在1000经受ClustalW多重序列比,然后将其用于使用邻接法在MEGA 6.06构建系统发生树,与所述自举值集的FASTA文件被编译,和其它参数设置为默认值[59.].
通过导入每个cDNA序列(CDS)和基因组序列的外显子而获得 - 内含子结构信息NRT2基因家族成员进入基因结构显示服务器(gsds2.0) (http://gsds.cbi.pku.edu.cn/)[60].将已翻译的油菜籽NRT2蛋白序列,采用分析工具MEME套件的MEME v5.1.0算法进行Motif Elicitation (http://meme-suite.org/tools/meme)[61].
油菜籽启动子序列NRT2通过从Brassica数据库(BRAD)的每个基因从起始密码子(ATG)上游的2000bp区域下游来分析基因(http://brassicadb.org/brad/),然后将这些启动子区域提交plantCARE进行检测(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)[62].然后使用TBtools v0.6为图形视图准备假定的顺式作用的调控元件。
植物材料及处理
中国种植油菜品种中顺11(B. Napus.简历。ZS11)由中国农业科学院石油作物研究所培养,是本研究中应用的植物材料来源。组织特异性表达分析BnNRT2s通过RNA-SEQ分析在八个组织中进行,然后通过在提供为180kg / hm的N场中饲养油菜籽植物来证实2分别在营养生长期(即越冬期)采集幼叶、老叶和根,在开花期采集花和茎,在生殖生长期采集种子和果皮。三个独立的生物学重复被纳入组织特异性分析。
调查…可能的反应BnNRT2sto nutrient deficiency, 7-day-old seedlings were exposed to low nitrogen (LN), low phosphorus (LP), and low potassium (LK) conditions for 14 days, in which time nutrient deficiency symptoms became evident. In more detail, nutrient deficiency conditions were simulated in hydroponics cultures with the base solution being 1/2 strength modified Hoagland nutrient solution, containing 2.5 mM Ca (NO3.)2, 2.5 mM KNO3.,1毫米NH4.不3.,0.25 mm k2所以4.,0.5毫米kh2宝4., 1 mM MgSO4.,0.08 mm EDTA-FE,0.02 mm H.3.博4.,4.5μmmncl2, 0.3 μM ZnSO4., 0.16 μM CuSO4., 和0.16 μM (NH4.)6.莫7.O.24..控制溶液包含9.5 mM N, 0.5 mM P和3.5 mM K。营养缺乏的治疗方案一样的控制解决方案,除了LN包含0.475毫米N (N)控制的5%,LP包含10μM P(2%控制P),和路包含10μM K (K)控制的0.29%。植物生长在一个24°C / 20°C日夜温度政权14小时/ 10 h光明/黑暗光周期。每个处理有四个独立的生物重复。分别取营养(N、P、K)缺乏的油菜叶片和根系进行RNA提取和qRT-PCR分析。
此外,BnNRT2在湖北省黄冈市进行了田间试验研究。在试验地块种植ZS11基因型油菜,并进行常规管理。氮素以尿素(46% N)的形式以0、45和180 kg/hm的速率向小区提供2.每次治疗都有三种独立的生物重复。在不同N比率下的七种组织以不同的氮酸盐率进行采样,详细地,在营养生长阶段(即越冬阶段),花和茎在开花阶段收集初级叶,高级叶和根部然后在繁殖生长阶段收集种子和果皮。
此外,根据以前的研究,也在盆栽中测试了干旱和涝渍胁迫[63].在干旱胁迫观测中,称重罐的含水量保持在25 - 35%之间,对照罐的含水量保持在65 - 75%之间。在复水前,对5个叶片生长期的油菜籽幼苗进行干旱胁迫14 d。分别在干旱处理7 d、14 d和复水处理7 d后取油菜籽幼叶、老叶和根。五个叶片生长期的油菜幼苗也遭受了14 d的涝渍胁迫。同时,涝渍胁迫是通过保持水面高于土壤表面1 ~ 2 cm来进行的,控制盆与干旱胁迫观测使用的相同。分别在淹水胁迫第3、7和14 d采集组织(幼叶、老叶和根)进行qRT-PCR检测。本盆栽试验每个处理有3个独立的生物重复。
RNA-SEQ分析和定量实时RT-PCR(QRT-PCR)
用于菜籽的组织特异性分析NRT2RNA-seq技术的家族基因,RNA-seq数据生成的细节已在前面详细描述[64那65],并将从油菜不同生长阶段收集的不同组织的RNA-seq公开数据集保存在公共存储库中(SRA accession:prjna474576,65],并将其应用于本研究,利用每千碱基外显子每百万片段图谱(FPKM)计算基因表达水平,得到基因表达谱的热图(log2)BNANRT2.数据归一化(https://cran.r-project.org/web/packages/pheatmap//).
为验证该组织特异性表达和进一步分析油菜籽的差异表达谱NRT2下各种应力家族基因,每个收获的样品的总RNA使用HiPure植物RNA Mini试剂盒根据制造商说明书(洋红色,广州,中国)萃取。然后,样品用无RNA酶的DNA酶I(Invitrogen公司,格兰德岛,NY,USA)被列为cDNA合成使用PrimeScript™RT试剂盒和gDNA的橡皮擦(完美实时)(TAKARA,日本东京)模板前治疗.cDNA合成后,油菜籽的相对表达NRT2使用Sybr®PremixexTaq™II套件(TLI RNASEH Plus)(Takara,Tokyo,Japan)和CFX96™实时PCR检测系统(Bio-Rad,USA),通过QRT-PCR检测基因家族成员。PCR程序如下:95℃持续1分钟,其次为40℃,95℃,60℃,15s,72℃,30℃。PCR反应体积的总量为20μL,其中包括2μL稀释的cDNA,10μLSYBR预混物EXQII(TLI RNASEH PLU)(2×),0.6μL引物和6.8μLRNAFREE水(Takara,Tokyo,Japan)。这CQ.候选基因的值相对于CQ.参考基因的价值act-7,使用2计算相对表达——ΔCq方法。油菜籽专用引物NRT2基因(表3.)和内参基因act-7采用Primer-NCBI (https://www.ncbi.nlm.nih.gov/tools/primerblast/index.cgi?LINK_LOC=BlastHome),通过熔体曲线分析确定,反应程序如下:95°C 10 s, 65°C至95°C 5 s(+ 0.5°C /循环)。
统计分析
所有装置与在本研究中的数据的标准误差在Microsoft Excel 2010中的所有计算使用方差分析进行本研究中的控制和应力处理之间的比较在SPSS统计25(ANOVA)方法P.值<0.05认为统计学意义。
数据和材料的可用性
从TAIR收集拟南芥,小麦和玉米NRT2蛋白序列(http://www.arabidopsis.org.),URGI(https://wheat- urgi.versailles.inra.fr/)和meizeGDB (https://maizegdb.org/)数据库。水稻和大豆蛋白NRT2序列从Phytozome V12.1收集(https:///phytozome.jgi.doe.gov/pz/portal.html.).NRT2蛋白序列B.rape那B.oleracea和B.juncea从布拉德(http://brassicadb.org/brad/).的基因组和蛋白质序列甘蓝型下载至Genoscope (http://www.genosope.cns.fr/brassicanapus/).本研究中使用的RNA测序数据沉积在NCBI SRA数据库中(SRA Rescivels:Prjna474576)。本研究期间生成或分析的所有数据都包含在本公布的文章及其补充信息文件中。通过联系相应作者,可根据要求提供这些材料。
缩写
- n:
-
氮
- 自虐:
-
氮气使用效率
- 不3.-:
-
硝酸
- 拉特:
-
低亲和力运输系统
- 帽子:
-
交通系统的高亲和性
- NRT1:
-
硝酸盐转运体1
- NRT2:
-
硝酸盐转运蛋白2
- NNP:
-
硝酸盐和亚硝酸盐波特家族
- MFS:
-
主要代理总科
- 的CRE:
-
CIS作用监管要素
- TFS:
-
转录因子
- P:
-
磷
- 凯西:
-
钾
- FPKM:
-
每个外显子的碱基片段每百万片段映射
参考文献
- 1.
在理解硝酸盐调控基因表达的分子机制方面出现了一个新的步骤。[J] .机器人。2014;65(19):5589-600。
- 2.
好ag,shrawat ak,muench dg。可以少得多?是否降低了与维持作物生产兼容的环境中的营养输入?趋势植物SCI。2004; 9(12):597-605。
- 3。
利用遗传变异和数量遗传学的综合方法提高作物氮素利用率的挑战。中国生物医学工程学报。2007;58(9):2369-87。
- 4.
硝酸盐还原与信号传导。在:Lea PJ, Morot-Gaudry JF,编辑。植物氮。柏林:斯普林格出版社;2001.37-59页。
- 5。
Jackson LE, Stivers LJ。商品生产条件下生菜根系分布对作物氮素吸收的影响。中国农业科学。1993;9(3):273-93。
- 6.
王洋洋,徐pk,蔡永福。硝酸盐的摄取、分配和信号转导。植物学报,2012;17(8):458-67。
- 7.
佟勇,周俊杰,李泽,米勒AJ。大麦双组分高亲和硝酸盐吸收系统。植物j . 2005; 41(3): 442 - 50。
- 8.
黄尼克,刘姬,罗哈,Tsay Yf。拟南芥硝酸盐转运蛋白的克隆和功能表征编码低亲和力摄取的组分组分。植物细胞。1999; 11(8):1381-92。
- 9.
Forde BG。植物中的硝酸盐转运蛋白:结构,功能和调节。Biochim Biophys Acta。2000; 1465(1-2):219-35。
- 10.
Filleur S,Dorbe Mf,Cerezo M,Orsel M,Granier F,Gojon A等人。拟南芥T-DNA突变体受影响Nrt2基因在硝酸盐摄取方面受损。2月。2001;489(2 - 3):220 - 4。
- 11.
木场T,博览会-Bourrellier AB,Lafouge楼Lezhneva L,布泰-Mercey S,Orsel M等人。拟南芥硝酸盐转运NRT2.4起着根和氮饥饿植物的芽的双重作用。植物细胞。2012; 24(1):245-58。
- 12.
Li W, Wang Y, Okamoto M, Crawford NM, Siddiqi MY, Glass广告。解剖的AtNRT2.1:AtNRT2.2可诱导的高亲和力硝酸盐转运基因簇。植物理疗。143(1): 425 - 2007; 33。
- 13。
引用本文:李志强,李志强,李志强,等。拟南芥硝酸盐转运体NRT2.5在缺氮植物中参与硝酸盐的获取和转运。植物j . 2014; 80(2): 230 - 41。
- 14。
肖邦F, Orsel M, Dorbe MF, Chardon F, Truong HN, Miller AJ等。拟南芥ATNRT2.7硝酸盐转运体控制种子中的硝酸盐含量。植物细胞。2007;19(5):1590 - 602。
- 15.
唐智,范晓荣,李强,冯慧敏,Miller AJ,沈庆荣,等。稻米星状硝酸盐转运体的敲除改变长距离转运但不影响根内流。植物杂志。2012;160(4):2052 - 63。
- 16。
Allender CJ, King GJ。多倍体物种的起源芸苔属植物显著L用叶绿体和核分子标记检测。BMC Plant Biol. 2010;10:54。
- 17.
王志强,王志强,王志强,等。加拿大大草原上用于生物柴油原料的替代油料作物。植物学报,2011;91(5):889-96。
- 18.
Chalhoub B,Denoeud F,Liu S,Parkin Ia,Tang H,Wang X等人。植物遗传学。早期的全多利多倍进化在新石器时代芸苔属植物显著油籽基因组。科学(纽约,纽约)。2014; 345(6199):950-3。
- 19.
拉特克GW,克里森O,氮源和速度上的生产力和冬油菜的品质Diepenbrock W.影响(芸苔属植物显著在不同的作物轮作中生长。中国农业科学(英文版);2005;94(2-3):103-13。
- 20。
邹军,卢建文,李永生,李晓坤。长江流域油菜对钾肥、钾肥利用效率和土壤钾临界水平的区域响应评价中国农业科学。2011;6:911-20。
- 21。
王勇,刘涛,李晓坤,任涛,丛瑞,卢建伟。营养缺乏限制了冬季直接播种油菜的群体发育、产量形成和养分吸收。中国科学:地球科学,2015;
- 22。
4 . Ploschuk RA, Miralles DJ, Colmer TD, Ploschuk EL, Striker GG.冬作物早期和后期涝渍对叶片生理、生长和产量的影响。植物科学学报2018;9:1863。
- 23。
古厘米,张SJ,韩PP,胡XJ,谢LH,Li Ys等。土壤中土壤酶活性,对油菜进行洪水的影响及对氮素和磷吸收的影响。前植物SCI。2019; 10:368。
- 24。
张XK,Lu Gy,Long Wh,Zou XL,Li F,Nishio T.芸苔作物中干旱和耐盐性研究的最新进展。品种sci。2014; 64(1):60-73。
- 25。
王健,焦健,周明杰,金志勇,于永军,梁明森。工业油菜的生理和转录反应(芸苔属植物显著)幼苗受干旱和盐胁迫。中华医学杂志。2019;20(22):5604。
- 26。
Jin H,Martin C.植物内的多功能和多样性MYB- ene家庭。植物mol biol。1999; 41(5):577-85。
- 27。
Jargeat P, Rekangalt D, Verner MC, Gay G, Debaud JC, Marmeisse R,等。共生担子菌硝酸盐同化基因簇中硝酸盐转运体和亚硝酸盐还原酶基因的特征和表达分析Hebeloma cylindrosporum.咕咕叫麝猫。2003;43(3):199 - 205。
- 28。
Lejay L,Tillard P,Lepetit M,Olive F,Filleur S,Daniel-Vedele F等人。分子和功能调节两个没有3.-拟南芥植物的N-和c -状态吸收系统。植物j . 1999; 18(5): 509 - 19所示。
- 29.
Vidal EA, Gutiérrez RA。拟南芥氮素营养和代谢产物反应的系统观点。植物学报。2008;11(5):521-9。
- 30。
秦丽,Walk TC,韩鹏,陈丽丽,张松,李永生,等。通过三维定量和蛋白质组分析揭示根系对缺氮的适应。植物杂志。2019;179(1):329 - 47岁。
- 31。
张H,Forde BG。通过硝酸盐可用性调节拟南芥根系发展。J Exp Bot。2000; 51(342):51-9。
- 32。
Remans T,Nacry p,Pervent m,girin t,tillard p,lepetit m等。硝酸盐转运蛋白NRT2.1在根系中综合形态和生理反应在拟南芥中氮限制的核心作用。植物理性。2006; 140(3):909-21。
- 33。
李义,李杰克,闫益,刘··张,张文,高lh,田yq。knockcsnrt2.1.作为黄瓜硝酸盐转运体,在外源硝酸盐浓度较低时,可减少硝酸盐的吸收、根长和侧根数。前面。植物科学。2018;9:722。
- 34.
小仓T,Goeschl C,Filiault d,MIREA男,斯洛伐克语R,Wolhrab B,等人。在拟南芥的根系统深度由EXOCYST70A3经由生长素运输的动态调制成形。细胞。2019; 178(2):400-12 E416。
- 35.
ORSEL M,KRAPP A,Daniel-Vedele F.拟南芥NRT2硝酸盐转运蛋白家族分析。结构和基因表达。植物理性。2002; 129(2):886-96。
- 36.
Orsel M,Chopin F,Leleu O,Smith Sj,Krapp A,Daniel-Vedele F等。拟南芥双组分高亲和力硝酸盐摄取系统的表征。生理学和蛋白质 - 蛋白质相互作用。植物理性。2006; 142(3):1304-17。
- 37。
amasinghe BH, de Bruxelles GL, Braddon M, Onyeocha I, Forde BG, Udvardi MK.大豆根中GmNRT2表达和硝酸盐转运活性的调控(甘氨酸最大).Planta。1998; 206(1):44-52。
- 38。
赵XQ,李YJ,刘JZ,李斌,刘QY,佟YP等。从小麦的根的高亲和力硝酸盐转运TaNRT2.3的分离及表达分析。ACTA博特仙。2004; 46(3):347-54。
- 39。
蔡超,王继勇,朱永刚,沈其荣,李波,童彦平,等。水稻根高亲和硝酸盐转运系统的基因结构与表达。acta botanica yunnanica(云南植物研究). 2008;50(4):443-51。
- 40.
Plett D,Toubia J,Garnett T,测试仪M,Kaiser Bn,Baumann U. Dichotomy在NRT双子叶植物和禾本科植物的基因家族。《公共科学图书馆•综合》。2010;5 (12):e15289。
- 41.
等。硝酸盐诱导在高氮利用率和低氮利用率玉米自交系中引发不同的转录变化。acta botanica yunnanica(云南植物研究). 2014;56(11):1080-94。
- 42。
刘tk,戴伟,孙帆,杨晓东,熊阿斯,侯小龙。非结球大白菜硝酸盐转运基因BraNRT2.1的克隆与鉴定。植物生理学报。2014;36(4):815-23。
- 43。
李强,丁刚,杨宁,白普杰,叶旭,蔡辉,等。比较基因组和转录组分析揭示了氮素利用效率的关键因素芸苔属植物显著L.植物细胞ENVIRON。2020; 43(3):712-31。
- 44。
李y,王x,张h,王sl,ye xs,shi l等。磷酸盐的分子鉴定为磷酸盐家庭1(PHT1)基因及其表达谱对磷缺乏和其他非生物胁迫的响应芸苔属植物显著.Plos一个。2019; 14(7):E0220374。
- 45。
王耶,Garvin DF,Kochian LV。番茄根中磷,钾和铁缺乏的调节和转运基因的快速诱导。交叉谈话和根际介导信号的证据。植物理性。2002; 130(3):1361-70。
- 46。
秦立,郭yx,陈丽,梁瑞克,顾m,xu gh等。功能表征14PHT1.酵母家族基因及其在大豆营养饥饿反应中的表达。《公共科学图书馆•综合》。2012;7 (10):e47726。
- 47。
Maillard A,Etienne P,Diquélous,排他J,Billard V,Yvin JC等。营养缺陷改变植物组织的离子组成:重点在钼和其他营养素之间的串扰芸苔属植物显著.J Exp Bot. 2016;67(19): 5631-41。
- 48。
冯维根斯特,李春华,李春华,等。植物中氨、硝态氮和肽转运体的进化分类。BMC Evol Biol. 2014;14:11。
- 49。
冈本M, Vidmar JJ, Glass AD。的监管NRT1和NRT2拟南芥基因家族对硝酸盐供应的响应。植物生理学报。2003;44(3):304-17。
- 50.
王新伟,王洪志,王健,孙福峰,吴军,刘少英,等。中多倍体作物品种的基因组Brassica Rapa..Nat麝猫。2011;43(10):1035 - 9。
- 51.
杨建辉,刘大勇,王新伟,季春梅,程飞,刘bn,等。作者更正:异源多倍体的基因组序列芸苔属植物juncea差异同源基因表达对选择影响的分析。Nat麝猫。2018;(11):1616。
- 52.
刘少英,刘玉明,杨晓华,童志邦,Edwards D, Parkin IA,等。这芸苔属植物oleracea基因组揭示多倍体基因组的不对称进化。Nat Commun。2014;5:3930。
- 53.
Alaux M,Rogers J,Letellier T,Flores R,Alfama F,Pommier C,等。将国际小麦基因组测序联盟联盟面包小麦参考基因组序列与小麦遗传和现象数据相连。基因组Biol。2018; 19(1):111。
- 54。
等。植物群落:绿色植物基因组学的比较平台。核酸Res. 2012;40(数据库版):D1178-86。
- 55。
乔X,李Qh,尹H,齐kj,李夫,王立,等。植物植物重复多倍体化分交循环的基因复制与演化。基因组Biol。2019; 20(1):38。
- 56。
Wilkins Mr,Gasteiger E,Bairoch A,Sanchez JC,Williams KL,Appel Rd等人。扩展服务器中的蛋白质识别和分析工具。方法Mol Biol。1999; 112:531-52。
- 57。
Emanuelsson O,Brunak S,Von Heijne G,Nielsen H.使用TargetP,SignalP和相关工具在电池中定位蛋白质。NAT PROTOC。2007; 2(4):953-71。
- 58.
Horton P, Park KJ, Obayashi T, Fujita N, Harada H, Adams-Collier CJ,等。WoLF PSORT:蛋白质定位预测器。核酸Res. 2007;35(Web服务器版):W585-7。
- 59.
大厅BG。建立从MEGA分子数据的系统发育树。分子生物学EVOL。2013; 30(5):1229至1235年。
- 60。
胡斌,金军,郭爱华,张华,罗军,高国刚。gss2.0:一种改进的基因特征可视化服务器。生物信息学(英国牛津大学)。2015; 31(8): 1296 - 7。
- 61.
贝利TL,博登男,Buske FA,弗里斯男,格兰特CE,克莱门L,等人。MEME SUITE:对motif发现和搜索工具。核酸RES。2009; 37(Web服务器问题):W202-8。
- 62.
王志强,王志强,王志强,等。植物顺式调控元件数据库,启动子序列硅分析工具的门户网站。核酸学报2002;30(1):325-7。
- 63.
夏丽娟,杨立强,孙乃丽,李娟,方永军,王艳萍。生理和抗氧化酶基因表达分析表明,体细胞杂种后代对干旱胁迫的耐受性有所提高芸苔属植物显著和Sinapis阿尔巴在营养生长阶段。ACTA植物生理学。2016; 38(4):88。
- 64.
Sun FM,粉丝GY,胡Q,周YM,Guan M,Tong CB等。高质量的基因组芸苔属植物显著品种'ZS11'揭示了半冬季Morphotype的血阶历史。工厂J. 2017; 92(3):452-68。
- 65.
李勇,董春霞,胡敏,白志涛,佟春宝,左锐,等。通过比较转录组分析鉴定花特异性启动子芸苔属植物显著.int j mol sci。2019; 20(23):5949。
致谢
我们非常感谢中国农业科学院武汉油料作物研究所华为教授小组提供的用于分析的油菜RNA-seq数据。
资金
国家重点研发计划项目(no . 2016YFD0100202-5)资助,进行研究设计和大部分实验。国家现代农业产业技术体系项目(CARS-22-G-05)资助了我们的生物信息学和数据分析研究。中国农业科学院农业科技创新项目(CAAS-ASTIP-2013-OCRI)资助我们进行田间试验材料的培育。
作者信息
隶属关系
贡献
TJF进行实验,分析数据,撰写手稿。WTC和CLY进行了生物信息学分析。HPP和LYS水培预实验。GCM和HXJ进行了盆栽试验。XLH和SXJ预制现场试验。QL和LX设计和监督研究,解释数据和修改手稿。所有作者均已阅读并批准本稿件。
相应的作者
伦理宣言
伦理批准和同意参与
不适用。
同意出版物
不适用。
相互竞争的利益
两位作者宣称他们没有相互竞争的利益。
额外的信息
出版商的注意
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
补充信息
附加文件1:图S1。
物理图谱的NRT2油菜基因组中的家族基因(芸苔属植物显著l .)
附加文件2:图S2。
预测油菜NRT2家族蛋白的跨膜区(芸苔属植物显著l .)。
附加文件3:图S3。
不同施氮处理下油菜植株的表型和生理变化(A) 180 kg/hm、45 kg/hm和0 kg/hm三种施氮处理下油菜植株的表型和生物量2N. (B) 180 kg/hm、45 kg/hm和0 kg/hm三种施氮处理下的油菜生物量2N. (C)不同施氮处理(CK: 9.5 mM N, LN: 0.475 mM N)水培油菜根系的表型。(D)不同施氮处理(CK: 9.5 mM N, LN: 0.475 mM N)水培油菜侧根长度和根尖。
附加文件4:表S1。
复制油菜籽NRT2本研究中确定的基因对。
附加文件5:表S2。
BNNRT2蛋白成员之间的特性比较。
附加文件6:表S3。
油菜籽的特异性引物NRT2用于qRT-PCR检测的基因。
权利和权限
开放获取本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信贷额度中另有说明。
关于这篇文章
引用这篇文章
童杰,沃克。t.c.,韩。P。et al。高亲和性硝酸盐转运体2的全基因组鉴定与分析(NRT2)油菜籽的家庭基因(芸苔属植物显著以及他们对各种压力的反应。BMC植物生物学20,464(2020)。https://doi.org/10.1186/s12870-020-02648-1
已收到:
公认:
发表:
关键字
- 高亲和性硝酸盐转运体
- NRT2
- 油菜籽
- 各种压力