- 研究文章gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
WRKY转录因子TaWRKY42-B通过促进茉莉酸的生物合成来促进叶片衰老gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba20.gydF4y2Ba,文章号:gydF4y2Ba444gydF4y2Ba(gydF4y2Ba2020gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
叶片衰老包括许多合作事件,将环境信号与年龄依赖的发育线索整合在一起,协调多方面的恶化和营养物质的源-汇分配。在作物中,叶片衰老一直被认为是影响产量和品质的重要发育阶段,而在小麦中,参与叶片衰老调控的候选基因的功能表征迄今为止还很有限。gydF4y2Ba
结果gydF4y2Ba
在本研究中,我们分析了小麦叶片衰老过程中97个WRKY转录因子(TFs)的表达谱,并分离出一个潜在的叶片衰老调控因子TaWRKY42-B,以进行进一步的功能研究。通过表型和生理分析gydF4y2BaTaWRKY42-BgydF4y2Ba-overexpressinggydF4y2Ba拟南芥gydF4y2Ba植物和gydF4y2BaTaWRKY42-BgydF4y2Ba我们证实了TaWRKY42-B在启动发育和暗诱导叶片衰老中的积极作用。此外,我们的研究结果表明,TaWRKY42-B主要通过与JA生物合成基因相互作用来促进叶片衰老,gydF4y2BaAtLOX3gydF4y2Ba,及其正交正交向量,gydF4y2BaTaLOX3gydF4y2Ba,从而促进了JA含量的积累。在本研究中,我们还证实了TaWRKY42-B与AtWRKY53在叶片年龄依赖性衰老的启动过程中具有功能保守性。gydF4y2Ba
结论gydF4y2Ba
我们的研究结果揭示了一个新的叶片衰老正调控因子TaWRKY42-B,它通过激活JA生物合成来介导JA相关的叶片衰老,有可能成为小麦分子育种的靶基因。gydF4y2Ba
背景gydF4y2Ba
叶片衰老是一个高度整合的发育阶段,协调了生理和分子水平上的多维变化[gydF4y2Ba1gydF4y2Ba].在叶片衰老过程中,细胞内的细胞器和大分子被分解和退化,这主要有助于营养物质的源库分配[gydF4y2Ba2gydF4y2Ba].营养物质从衰老器官向营养组织的再分配对植物的适应性至关重要,对作物的生产力和品质至关重要[gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4gydF4y2Ba].一般来说,叶片衰老的开始与年龄有关,并由发育线索触发[gydF4y2Ba5gydF4y2Ba].此外,叶片衰老受到表观遗传修饰、生物钟、自噬、叶绿素代谢和转录调控的严格控制[gydF4y2Ba6gydF4y2Ba,gydF4y2Ba7gydF4y2Ba,gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10gydF4y2Ba,gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba,gydF4y2Ba14gydF4y2Ba,gydF4y2Ba15gydF4y2Ba,gydF4y2Ba16gydF4y2Ba,gydF4y2Ba17gydF4y2Ba].同时,当植物遭遇非生物和生物胁迫时,衰老的启动也会加快[gydF4y2Ba5gydF4y2Ba,gydF4y2Ba18gydF4y2Ba].gydF4y2Ba
植物激素在叶片衰老过程中起着积极和消极的作用。在叶片衰老相关激素中,乙烯、脱落酸(ABA)、茉莉酸(JA)、水杨酸(SA)、油菜素内酯(BRs)和独脚金内酯(SLs)促进叶片衰老,而细胞分裂素(CKs)、赤霉素(GA)和生长素(AUXs)则延缓叶片衰老[gydF4y2Ba19gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba21gydF4y2Ba,gydF4y2Ba22gydF4y2Ba,gydF4y2Ba23gydF4y2Ba,gydF4y2Ba24gydF4y2Ba,gydF4y2Ba25gydF4y2Ba,gydF4y2Ba26gydF4y2Ba,gydF4y2Ba27gydF4y2Ba,gydF4y2Ba28gydF4y2Ba].gydF4y2Ba
JA是一种脂质来源的植物激素,在植物的生物胁迫防御、非生物胁迫耐受和发育调控中起重要作用[gydF4y2Ba29gydF4y2Ba,gydF4y2Ba30.gydF4y2Ba].JA在促进叶片衰老方面的作用是通过燕麦中叶绿素的严重降解首次发现的。gydF4y2Ba燕麦属漂白亚麻纤维卷gydF4y2BaL. cv " Victory ")于1980年施用茉莉酸甲酯(MeJA)后的叶片[gydF4y2Ba31gydF4y2Ba].同时,JA对野生型的外源应用gydF4y2Ba拟南芥gydF4y2Ba能提高衰老相关基因的转录,比如gydF4y2BaSAG12gydF4y2Ba而且gydF4y2BaSEN4gydF4y2Ba,但不是gydF4y2Bacoi1-1gydF4y2Ba.此外,许多JA生物合成基因的表达和JA含量在衰老叶片中增强[gydF4y2Ba32gydF4y2Ba].生成JA的脂氧合酶,gydF4y2BaAtLOX2gydF4y2Ba,在ja诱导的叶片衰老过程中受到TCP4的调控gydF4y2BamiRNA319gydF4y2Ba[gydF4y2Ba33gydF4y2Ba,gydF4y2Ba34gydF4y2Ba].最近,对JA信号通路关键成分的研究表明gydF4y2Ba拟南芥gydF4y2BaMYC2, MYC3和MYC4通过直接结合的启动子促进叶片衰老gydF4y2BaSAG29gydF4y2Ba;这种相互作用由III d族bHLHs拮抗调节[gydF4y2Ba21gydF4y2Ba].然而,叶片衰老的过程中gydF4y2Bacoi1-1gydF4y2Ba一些与ja相关的突变体与野生型(WT)相似,这表明对ja诱导叶片衰老的复杂机制的解剖是极其重要的[gydF4y2Ba32gydF4y2Ba,gydF4y2Ba35gydF4y2Ba].gydF4y2Ba
除了激素反应基因,许多衰老相关基因,如gydF4y2Ba衰老相关基因gydF4y2Ba(gydF4y2Ba凹陷gydF4y2Ba),已被证明对叶片衰老的时间至关重要[gydF4y2Ba36gydF4y2Ba].其中衰老相关转录因子,包括NACs、WRKYs、bzip、MYCs、myb等,将各种衰老信号整合到细胞核中,从而进行转录调控[gydF4y2Ba15gydF4y2Ba,gydF4y2Ba16gydF4y2Ba,gydF4y2Ba37gydF4y2Ba].WRKY是植物中最大的TF家族之一,以具有WRKYGQK核心基序和锌指基序的保守WRKY结构域命名。根据结构特征和系统发育分析,WRKYs被进一步分为7个亚群(I、IIa + IIb、IIc、IId + IIe和III),目前已有报道WRKYs参与多种应激防御反应和发育调控。此外,参与叶片衰老调控的wrky已被广泛认可[gydF4y2Ba38gydF4y2Ba,gydF4y2Ba39gydF4y2Ba].在这些与衰老相关的wrky中,AtWRKY53因其在促进叶片衰老启动中的关键作用而被广泛研究[gydF4y2Ba40gydF4y2Ba,gydF4y2Ba41gydF4y2Ba,gydF4y2Ba42gydF4y2Ba].AtWRKY6在GA和光相关的衰老过程中发挥作用[gydF4y2Ba43gydF4y2Ba,gydF4y2Ba44gydF4y2Ba,gydF4y2Ba45gydF4y2Ba].AtWRKY57协调JA和Aux信号调控叶片衰老[gydF4y2Ba46gydF4y2Ba].AtWRKY54和AtWRKY70是两个功能冗余的wrky,在叶片衰老中起负调控作用[gydF4y2Ba47gydF4y2Ba].AtWRKY45和AtWRKY75分别通过GA和SA信号通路触发叶片衰老的启动[gydF4y2Ba22gydF4y2Ba,gydF4y2Ba26gydF4y2Ba].总的来说,WRKYs能够整合多种信号促进和延缓叶片衰老的发生gydF4y2Ba拟南芥gydF4y2Ba.然而,WRKYs如何调节作物叶片衰老仍是未知的。gydF4y2Ba
面包小麦(gydF4y2Ba小麦gydF4y2BaL.)是种植最广泛的作物之一,是世界上30%以上人口的主食资源,提供约20%的人类消耗的卡路里[gydF4y2Ba48gydF4y2Ba].面包小麦(AABBDD)的异源六倍体基因组源于两次多倍体事件。第一次二倍体祖细胞间的杂交gydF4y2Ba小麦属植物urartugydF4y2Ba(2n = 2x = 14,基因组AA)和片段Sitopsis(基因组BB的供体,可能与gydF4y2Ba山羊草属speltoidesgydF4y2Ba, 2n = 2x = 14,基因组SS)导致同种异体四倍体祖先的形成gydF4y2Ba小麦属植物turgidumgydF4y2Ba(2n = 4x = 28;基因组AABB)。第二次杂化gydF4y2Ba小麦属植物turgidumgydF4y2Ba而且gydF4y2Ba山羊草属tauschiigydF4y2Ba(2n = 2x = 14,基因组DD)最终促成了面包小麦的起源[gydF4y2Ba49gydF4y2Ba,gydF4y2Ba50gydF4y2Ba].由于面包小麦的异源六倍体特性,其基因组的测序和功能基因的描述一直落后于其他作物。幸运的是,新一代测序技术和全基因组霰弹枪测序建立的数据库为小麦基因组研究提供了新的途径[gydF4y2Ba51gydF4y2Ba,gydF4y2Ba52gydF4y2Ba,gydF4y2Ba53gydF4y2Ba,gydF4y2Ba54gydF4y2Ba].然而,调控小麦叶片衰老的候选基因仍然不明确,需要探索以提高小麦产量和籽粒品质。gydF4y2Ba
本研究通过rna测序(RNA-seq)实验筛选小麦叶片衰老的候选基因。因此,我们选择了WRKY型TF TaWRKY42-B进行进一步的功能研究。有趣的是,尽管表达水平gydF4y2BaTaWRKY42-BgydF4y2Ba,与叶片衰老进程、叶片沉默等呈负相关gydF4y2BaTaWRKY42-BgydF4y2Ba显著延缓了小麦叶片的衰老过程gydF4y2BaTaWRKY42-BgydF4y2Ba在gydF4y2Ba拟南芥gydF4y2Ba说明TaWRKY42-B对叶片衰老具有正向调节作用。随后,我们通过生理和分子分析证实了TaWRKY42-B调控的叶片衰老与JA信号通路有关。我们进一步证明TaWRKY42-B可以通过与JA生物合成基因相互作用促进JA的生物合成gydF4y2BaAtLOX3gydF4y2Ba和它的正交正交向量(gydF4y2BaTaLOX3gydF4y2Ba,gydF4y2BaTraesCS4B02G295200gydF4y2Ba),改变的转录gydF4y2BaAtLOX3gydF4y2Ba而且gydF4y2BaTaLOX3gydF4y2Ba.此外,TaWRKY42-B-gydF4y2BaTaLOX3gydF4y2Ba模块在叶片衰老开始后持续受到抑制,这可能是叶片衰老有组织进展的原因之一。通过互补实验,我们还发现TaWRKY42-B与AtWRKY53在叶龄依赖性衰老调控中具有部分保守的功能。简而言之,我们的研究结果揭示了一个新的衰老相关TF TaWRKY42-B的功能作用,它是小麦叶片衰老的一个阳性和ja相关的调节因子。我们的数据也表明TaWRKY42-B有可能成为小麦分子育种的靶基因。gydF4y2Ba
结果gydF4y2Ba
TaWRKY42-BgydF4y2Ba在叶片衰老过程中是否下调gydF4y2Ba
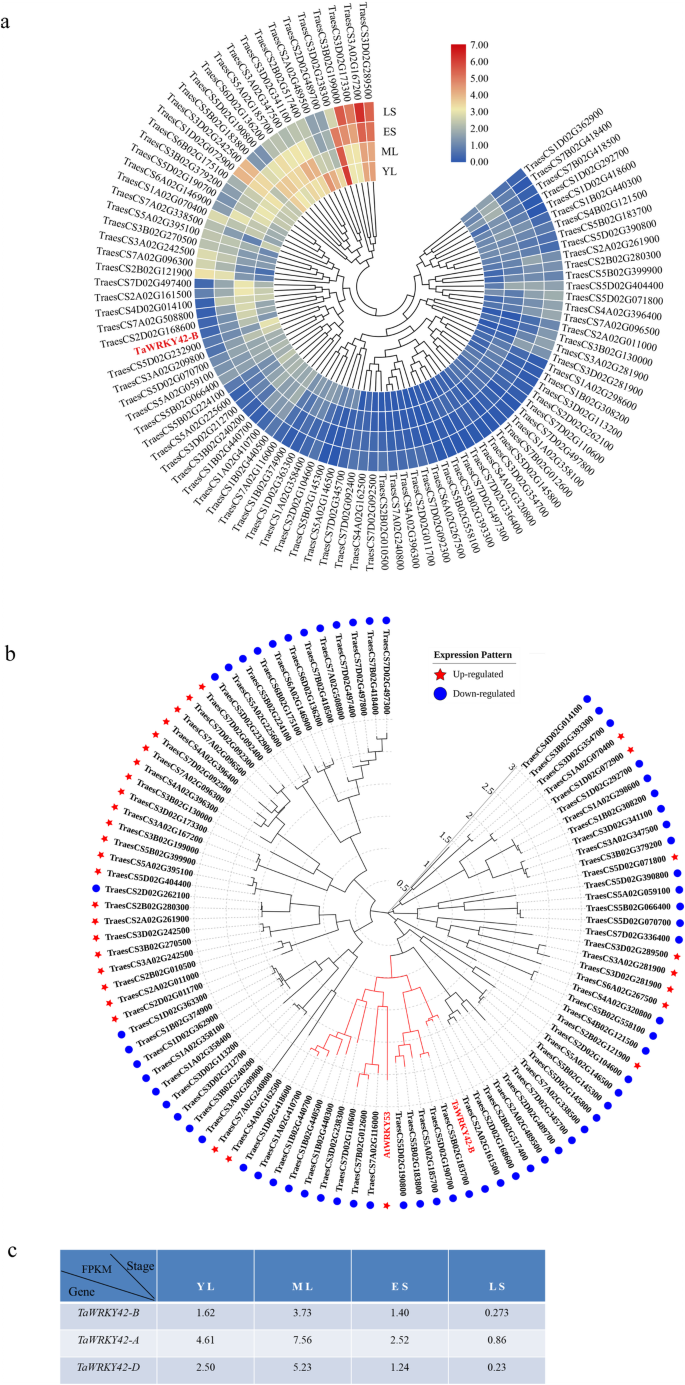
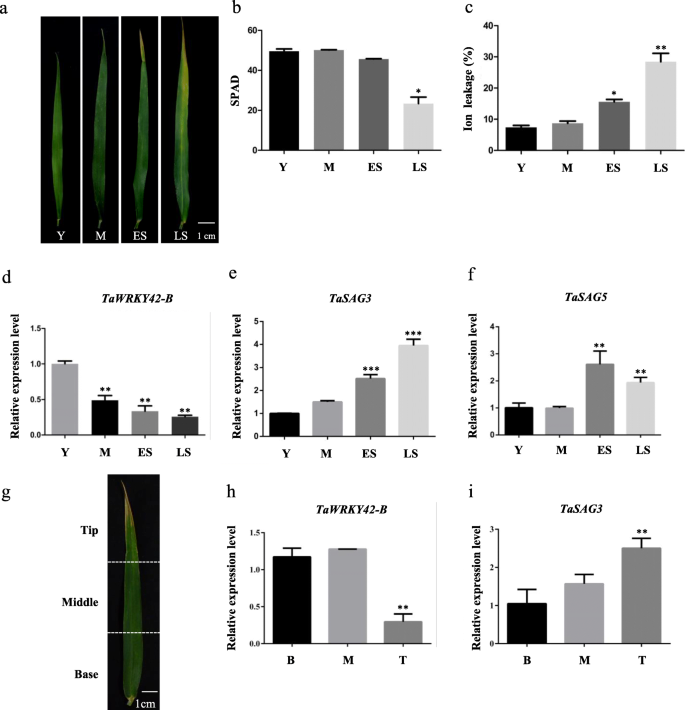
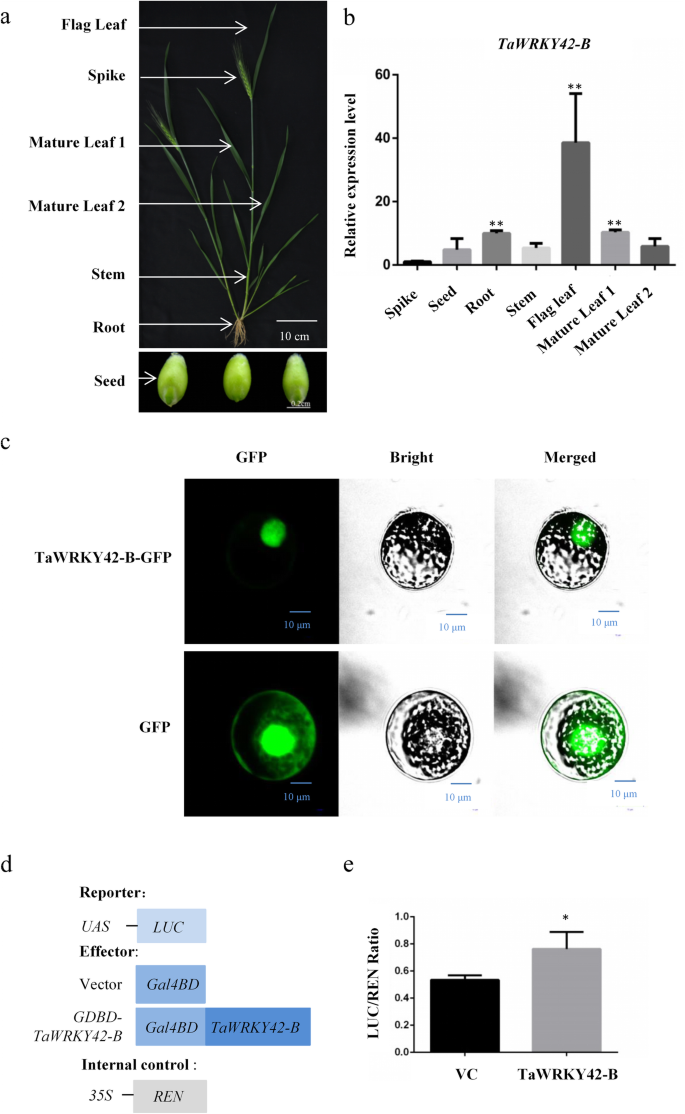
目的:研究植物叶片衰老调控的候选基因gydF4y2Bat . aestivumgydF4y2Ba(cv Chinese Spring),我们在旗叶的四个发育阶段(YL,幼叶;ML,成熟叶片;ES,早衰老叶;LS,叶片晚衰老)。每个样品采用3个生物重复。在衰老阶段,我们发现有32个基因上调gydF4y2BaWRKYsgydF4y2Ba65个下调了gydF4y2BaWRKYsgydF4y2Ba与幼叶期相比(|log2(折叠变化)|≥1;gydF4y2BaPgydF4y2Ba< 0.05)(图gydF4y2Ba1gydF4y2Baa - b)。与衰老相关gydF4y2BaTaWRKYsgydF4y2Ba在这项研究中,gydF4y2BaTaWRKY42-BgydF4y2Ba(TraesCS2B02G187500), III组成员gydF4y2BaWRKYsgydF4y2Ba(附加文件gydF4y2Ba1gydF4y2Ba:图S1a),在ML期表达量最高,随着叶片衰老过程表达量逐渐降低(图S1a)。gydF4y2Ba1gydF4y2Bac).验证的表达模式gydF4y2BaTaWRKY42-BgydF4y2Ba的时空转录谱分析gydF4y2BaTaWRKY42-BgydF4y2Ba在小麦。首先,转录之间的负相关gydF4y2BaTaWRKY42-BgydF4y2Ba通过定量实时荧光定量pcr (qRT-PCR)分析,确定了小麦旗叶的衰老过程。gydF4y2Ba2gydF4y2Bad).叶片衰老相关参数,包括叶绿素含量和离子泄漏率(图;gydF4y2Ba2gydF4y2BaB, c),以及两个转录水平gydF4y2Ba凹陷gydF4y2Ba,gydF4y2BaTaSAG3gydF4y2Ba而且gydF4y2BaTaSAG5gydF4y2Ba(无花果。gydF4y2Ba2gydF4y2Bae, f),研究了在不同的衰老阶段收获旗叶的适当性(图。gydF4y2Ba2gydF4y2Baa).衰老一般从叶尖开始,逐渐向叶底发展[gydF4y2Ba55gydF4y2Ba(图。gydF4y2Ba2gydF4y2Bag).始终较少的抄本gydF4y2BaTaWRKY42-BgydF4y2Ba叶尖含量高于叶中含量和叶基部含量(图;gydF4y2Ba2gydF4y2BaH),与之相反gydF4y2BaTaSAG3gydF4y2Ba(无花果。gydF4y2Ba2gydF4y2Bai).接下来,的转录水平gydF4y2BaTaWRKY42-BgydF4y2Ba对穗、种子、根、茎、旗叶、成熟叶等不同组织进行分析(图2)。gydF4y2Ba3.gydF4y2Ba一个)。gydF4y2BaTaWRKY42-BgydF4y2Ba在小麦中表现出普遍存在的表达模式,而最丰富的转录本gydF4y2BaTaWRKY42-BgydF4y2Ba在旗叶中检测到。gydF4y2Ba3.gydF4y2Bab).以上数据表明gydF4y2BaTaWRKY42-BgydF4y2Ba是gydF4y2Ba衰老下调基因gydF4y2Ba(gydF4y2Ba西班牙gydF4y2Ba),主要在叶片中发挥作用。gydF4y2Ba
表达式分析gydF4y2BaTaWRKYgydF4y2BaS在不同的衰老阶段。gydF4y2Ba一个gydF4y2Ba热图描绘gydF4y2BaTaWRKYsgydF4y2Ba在四个发育叶阶段中。蓝色表示的表达级别gydF4y2BaTaWRKYsgydF4y2Ba的转录水平相对于YL下降,而红色表示gydF4y2BaTaWRKYsgydF4y2Ba相对于YL. (YL,幼叶;ML,成熟叶片;ES,早衰老叶,叶面积< 25%发黄;LS,晚衰老叶,> 50%叶面积发黄)。gydF4y2BabgydF4y2Ba衰老相关TaWRKYs的系统发育分析。gydF4y2BacgydF4y2Ba的转录水平(FPKM值)gydF4y2BaTaWRKY42-BgydF4y2Ba,gydF4y2BaTaWRKY42-AgydF4y2Ba而且gydF4y2BaTaWRKY42-DgydF4y2Ba通过叶片衰老过程进行监测。(点和星号表示下调和上调基因)gydF4y2Ba
的时空表达模式gydF4y2BaTaWRKY42-BgydF4y2Ba在小麦。gydF4y2Ba一个gydF4y2Ba表达模式gydF4y2BaTaWRKY42-BgydF4y2Ba在小麦旗叶发育的4个不同阶段(Y、M、ES和LS)均有检测。叶绿素含量(gydF4y2BabgydF4y2Ba)和离子泄漏率(gydF4y2BacgydF4y2Ba)所示的(gydF4y2Ba一个gydF4y2Ba).gydF4y2BadgydF4y2Ba-gydF4y2BafgydF4y2Ba衰老相关基因的转录水平gydF4y2BaTaWRKY42-B, TaSAG3gydF4y2Ba而且gydF4y2BaTaSAG5gydF4y2Ba在叶片中,如图(gydF4y2Ba一个gydF4y2Ba).gydF4y2BaggydF4y2Ba-gydF4y2Ba我gydF4y2Ba表达水平gydF4y2BaTaWRKY42-BgydF4y2Ba而且gydF4y2BaTaSAG3gydF4y2Ba衰老小麦旗叶的顶端、中部和基部。(误差条表示标准差(SD)。星号表示显著差异。学生的gydF4y2Bat -gydF4y2Ba测试中,*gydF4y2BaPgydF4y2Ba< 0.05, **gydF4y2BaPgydF4y2Ba< 0.01, ***gydF4y2BaPgydF4y2Ba< 0.001)gydF4y2Ba
组织和亚细胞表达模式gydF4y2BaTaWRKY42-BgydF4y2Ba在小麦。gydF4y2Ba一个gydF4y2Ba-gydF4y2BabgydF4y2Ba组织表达谱gydF4y2BaTaWRKY42-BgydF4y2Ba不同组织(旗叶、穗叶、第1成熟叶、第1成熟叶;第2成熟叶从顶部起,成熟叶2;6月龄小麦茎、根和种子的qRT-PCR分析。gydF4y2BacgydF4y2BaTaWRKY42-B-GFP融合蛋白在小麦原生质体中的亚细胞定位对照实验采用简单的GFP蛋白。Bars = 10 μm。所有实验至少重复三次。gydF4y2BadgydF4y2Ba转录活性实验结构图。gydF4y2BaegydF4y2Ba矢量瞬时表达后相对LUC报告活性的测量,如图所示(gydF4y2BadgydF4y2Ba).(误差条表示SD。星号表示显著差异。学生的gydF4y2BatgydF4y2Ba以及,*gydF4y2BaPgydF4y2Ba< 0.05, **gydF4y2BaPgydF4y2Ba< 0.01)gydF4y2Ba
TaWRKY42-B在年龄依赖性和暗诱导的叶片衰老中起积极作用gydF4y2Ba
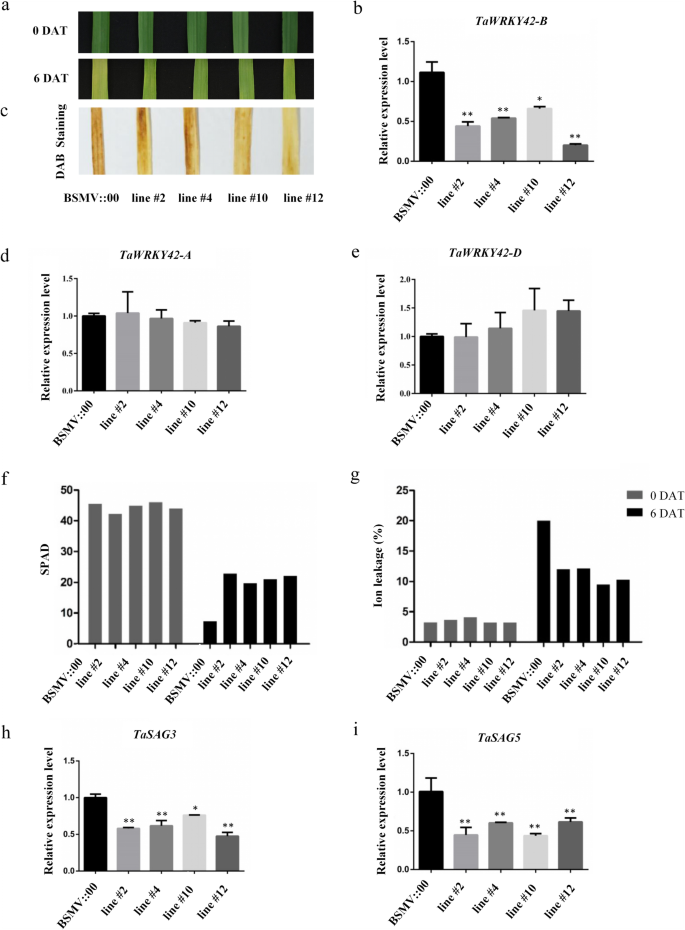
为了进一步研究TaWRKY42-B的功能特征,gydF4y2BaTaWRKY42-BgydF4y2Ba被沉默了gydF4y2Ba大麦条纹花叶病毒gydF4y2Ba(BSMV)-VIGS方法在小麦中采用198 bp的目标序列,从小麦的翻译起始密码子下游679 bp中特异性选择gydF4y2BaTaWRKY42-BgydF4y2Ba编码序列(CDS),而不是在gydF4y2BaTaWRKY42-AgydF4y2Ba而且gydF4y2BaTaWRKY42-DgydF4y2Ba(附加文件gydF4y2Ba1gydF4y2Ba:图S1b, c和附加文件gydF4y2Ba2gydF4y2Ba:图S2a),空载体(pCaBS-γbLIC)作为对照。BSMV::TaWRKY42-B感染了7天大的小麦幼苗gydF4y2Ba198gydF4y2Ba(pCaBS-α, pCaBS-β,和pCaBS-γbTaWRKY42-BgydF4y2Ba198gydF4y2Ba)(附加文件gydF4y2Ba2gydF4y2Ba:图S2b)。再生长25天后,从第8叶顶部开始进行病媒控制(VC)和gydF4y2BaTaWRKY42-BgydF4y2Ba将-沉默的植物分离,在黑暗中培养6天。gydF4y2BaTaWRKY42-B -gydF4y2Ba与VC转基因叶片相比,沉默叶片表现出明显的延迟叶片衰老表型(图2)。gydF4y2Ba4gydF4y2Baa).叶绿素降解,离子泄漏率,和表达一致gydF4y2BaTaSAG3gydF4y2Ba而且gydF4y2BaTaSAG5gydF4y2Ba在gydF4y2BaTaWRKY42-B -gydF4y2Ba与VC相比,沉默叶片明显减少(图2)。gydF4y2Ba4gydF4y2Ba外:我)。过氧化氢(HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba)早就被认为是由于随后的氧化损伤。上面有较少的深棕色斑点gydF4y2BaTaWRKY42-B -gydF4y2Ba对3,3-二氨基联苯胺(DAB)染色后的叶片进行沉默,表明沉默延缓了叶片的衰老过程gydF4y2BaTaWRKY42-BgydF4y2Ba(无花果。gydF4y2Ba4gydF4y2Bac).估计叶片衰老延迟是否由gydF4y2BaTaWRKY42-BgydF4y2Ba的转录水平gydF4y2BaTaWRKY42-AgydF4y2Ba,gydF4y2BaTaWRKY42-BgydF4y2Ba,gydF4y2BaTaWRKY42-DgydF4y2Ba在受感染的小麦植株中进行检测。值得注意的是,深色处理后,离体叶片保持绿色表型明显,转录减少gydF4y2BaTaWRKY42-BgydF4y2Ba(无花果。gydF4y2Ba4gydF4y2BaB)gydF4y2BaTaWRKY42-AgydF4y2Ba而且gydF4y2BaTaWRKY42-DgydF4y2Ba与对照叶(图;gydF4y2Ba4gydF4y2Bad, e).这表明TaWRKY42-B是小麦叶片衰老开始的正向调节因子。gydF4y2Ba
沉默的gydF4y2BaTaWRKY42-BgydF4y2Ba延缓小麦叶片衰老。gydF4y2Ba一个gydF4y2Ba植物离体叶片表型分析gydF4y2BaTaWRKY42-BgydF4y2Ba-让植物和对照在黑暗中沉默6天。(DAT,治疗后的第二天)。gydF4y2BabgydF4y2Ba转录水平gydF4y2BaTaWRKY42-BgydF4y2Ba用树叶gydF4y2BaTaWRKY42-BgydF4y2Ba-静音植物和控制。gydF4y2BacgydF4y2Ba暗处理后离体叶片的DAB染色如图(gydF4y2Ba一个gydF4y2Ba).gydF4y2BadgydF4y2Ba-gydF4y2BaegydF4y2Ba表达水平gydF4y2BaTaWRKY42-BgydF4y2Ba直接同源(gydF4y2BaTaWRKY42-AgydF4y2Ba而且gydF4y2BaTaWRKY42-DgydF4y2Ba的脱落的叶子gydF4y2BaTaWRKY42-BgydF4y2Ba-静音植物和控制。叶绿素含量(gydF4y2BafgydF4y2Ba)和离子泄漏率(gydF4y2BaggydF4y2Ba)所示的分离叶(gydF4y2Ba一个gydF4y2Ba).gydF4y2BahgydF4y2Ba-gydF4y2Ba我gydF4y2Ba衰老相关基因的转录水平gydF4y2BaTaSAG3gydF4y2Ba,gydF4y2BaTaSAG5gydF4y2Ba分离的叶子,如图所示gydF4y2Ba一个gydF4y2Ba)gydF4y2Ba.gydF4y2Ba(误差条表示SD。星号表示显著差异。学生的gydF4y2BatgydF4y2Ba以及,*gydF4y2BaPgydF4y2Ba< 0.05, **gydF4y2BaPgydF4y2Ba< 0.01)gydF4y2Ba
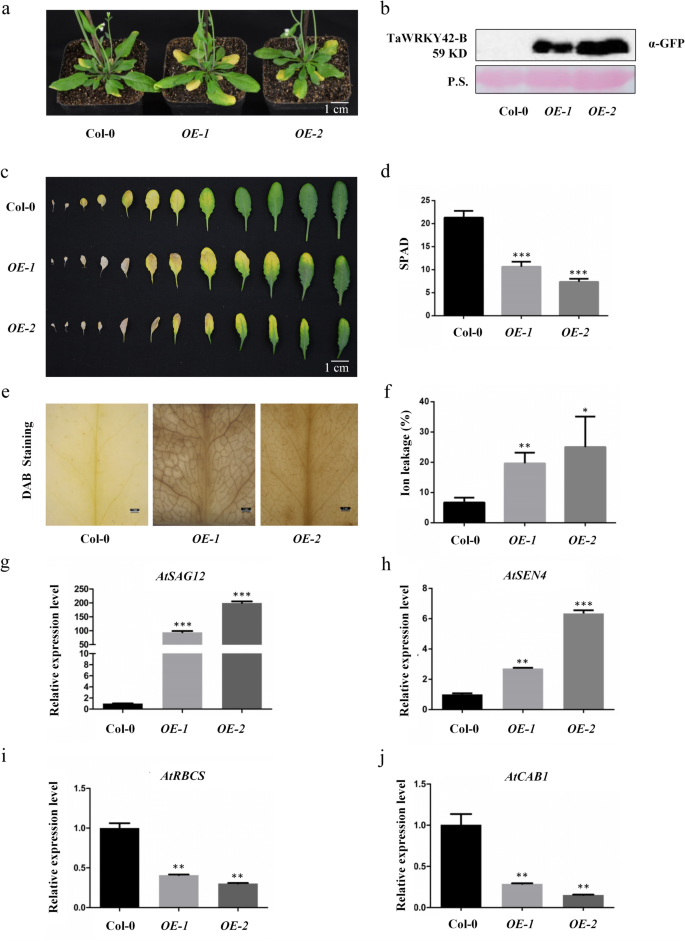
进一步评估的功能作用gydF4y2BaTaWRKY42-BgydF4y2Ba在叶片衰老过程中,gydF4y2BaTaWRKY42-BgydF4y2Ba-overexpressing (OE)gydF4y2Ba拟南芥gydF4y2Ba植物产生了。全长879 bp的CDSgydF4y2BaTaWRKY42-BgydF4y2Ba克隆到pCAMBIA1300中,并与绿色荧光蛋白(GFP)标签融合gydF4y2Ba花椰菜花叶病毒gydF4y2Ba(CaMV) 35S启动子。两个独立纯合的转基因株系(gydF4y2BaOE-1gydF4y2Ba而且gydF4y2BaOE-2gydF4y2Ba)进行进一步表型和生理分析。western blot检测TaWRKY42-B蛋白表达水平升高gydF4y2BaOE-1gydF4y2Ba而且gydF4y2BaOE-2gydF4y2Ba(无花果。gydF4y2Ba5gydF4y2Bab).接下来,我们观察5周大的gydF4y2BaOE-1gydF4y2Ba而且gydF4y2BaOE-2gydF4y2Ba与Col-0相比,植株表现出早熟的叶片衰老表型(图2)。gydF4y2Ba5gydF4y2Baa, c).叶绿素含量gydF4y2BaTaWRKY42-BgydF4y2Ba-gydF4y2BaOEgydF4y2Ba在Col-0中,细胞系减少(图;gydF4y2Ba5gydF4y2BaD)和离子泄漏速率加速过表达gydF4y2BaTaWRKY42-BgydF4y2Ba(无花果。gydF4y2Ba5gydF4y2Baf).更多gydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2BaDAB染色检测gydF4y2BaTaWRKY42-BgydF4y2Ba-gydF4y2BaOEgydF4y2Ba行(无花果。gydF4y2Ba5gydF4y2Bae).与观察到的表型改变一致,二gydF4y2Ba凹陷gydF4y2Ba,gydF4y2BaAtSAG12gydF4y2Ba而且gydF4y2BaAtSEN4gydF4y2Ba的水平上调gydF4y2BaOE-1gydF4y2Ba而且gydF4y2BaOE-2gydF4y2Ba(无花果。gydF4y2Ba5gydF4y2BaG, h),而两个gydF4y2Ba西班牙gydF4y2Ba,gydF4y2BaAtRBCSgydF4y2Ba而且gydF4y2BaAtCAB1gydF4y2Ba,被压制在gydF4y2BaTaWRKY42-BgydF4y2Ba-gydF4y2BaOEgydF4y2Ba(无花果。gydF4y2Ba5gydF4y2Bai, j).调查是否gydF4y2BaTaWRKY42-BgydF4y2Ba与暗诱导叶片衰老有关gydF4y2Ba拟南芥gydF4y2Ba,我们从第8个莲座叶中分离出来gydF4y2BaOE-1gydF4y2Ba,gydF4y2BaOE-2gydF4y2Ba和Col-0,显然无法区分,随后,在黑暗中孵化了另外6天(附加文件gydF4y2Ba5gydF4y2Ba:图S5a)。与衰老相关的表型改变、叶绿素降解和离子泄漏率在gydF4y2BaOE-1gydF4y2Ba而且gydF4y2BaOE-2gydF4y2Ba深色处理后(附加文件gydF4y2Ba5gydF4y2Ba:图S5b, c)。以上数据验证了TaWRKY42-B在最佳生长条件和黑暗条件下均促进叶片衰老。gydF4y2Ba
过度的gydF4y2BaTaWRKY42-BgydF4y2Ba加速叶片衰老gydF4y2Ba拟南芥gydF4y2Ba.gydF4y2Ba一个gydF4y2Ba6周龄Col-0和Col-0表型分析gydF4y2BaTaWRKY42-BgydF4y2Ba-overexpressing植物。gydF4y2BabgydF4y2BaCol-0和TaWRKY42-B蛋白水平gydF4y2BaTaWRKY42gydF4y2Ba-gydF4y2BaBgydF4y2Ba-overexpressing植物。Ponceau S (P.S.)染色表明负载相等。gydF4y2BacgydF4y2Ba将6周龄Col-0和转基因植株的莲座叶分离。叶绿素含量(gydF4y2BadgydF4y2Ba)和离子泄漏率(gydF4y2BafgydF4y2Ba)在(gydF4y2BacgydF4y2Ba).gydF4y2BaegydF4y2Ba4周龄col0和gydF4y2BaTaWRKY42-B -gydF4y2Baoverexpressing植物。gydF4y2BaggydF4y2Ba-gydF4y2BajgydF4y2Ba衰老相关基因表达水平检测gydF4y2BaAtSAG12gydF4y2Ba,gydF4y2BaAtSEN4gydF4y2Ba,gydF4y2BaAtRBCSgydF4y2Ba,gydF4y2BaAtCAB1gydF4y2Ba4周大的col0和gydF4y2BaTaWRKY42-B -gydF4y2BaqRT-PCR过表达植物。(误差条表示SD。星号表示显著差异。学生的gydF4y2BatgydF4y2Ba以及,*gydF4y2BaPgydF4y2Ba< 0.05, **gydF4y2BaPgydF4y2Ba< 0.01, ***gydF4y2BaPgydF4y2Ba< 0.001)gydF4y2Ba
TaWRKY42-B定位于细胞核,具有转录活性gydF4y2Ba
一般来说,wrky参与多种生物过程的转录调控。为了说明TaWRKY42-B是否在转录调节中发挥作用,我们制作了一个gydF4y2Ba35 s: TaWRKY42-B-GFPgydF4y2Ba然后将其转化并瞬时表达为小麦原生质体。TaWRKY42-B-GFP融合的GFP荧光信号主要集中在细胞核中,而GFP单独的信号在质膜、细胞质和细胞核中可见(图)。gydF4y2Ba3.gydF4y2Bac). TaWRKY42-B特异的亚细胞定位表明TaWRKY42-B可能参与了小麦的转录调控。TaWRKY-42-B在酵母中表现出很强的转录活性(附加文件)gydF4y2Ba3.gydF4y2Ba:图S3)。因此,通过双荧光素酶报告系统检测TaWRKY42-B在小麦原生质体中的转录活性。TaWRKY42-B融合到一个Gal4 dna结合域(GDBD),并与TaWRKY42-B共转染gydF4y2Ba萤火虫荧光素酶gydF4y2Ba(gydF4y2Ba卢克gydF4y2Ba)基因,该基因受上游激活序列(UAS)和gydF4y2BaRenilla荧光素酶gydF4y2Ba(gydF4y2Ba任gydF4y2Ba)基因,由CaMV 35S启动子融合驱动作为内部控制(图。gydF4y2Ba3.gydF4y2Bad).加入酶的底物后,GDBD- tawrky42 - b能够促进LUC的酶促反应,但不只是GDBD。gydF4y2Ba3.gydF4y2Bae).这些结果表明TaWRKY42-B是一个核定位的TF。gydF4y2Ba
JA是TaWRKY42-B触发叶片衰老的重要因子gydF4y2Ba
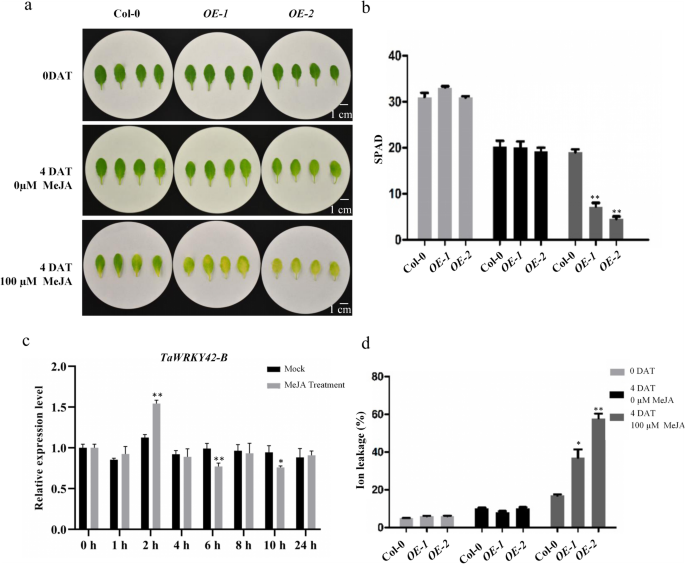
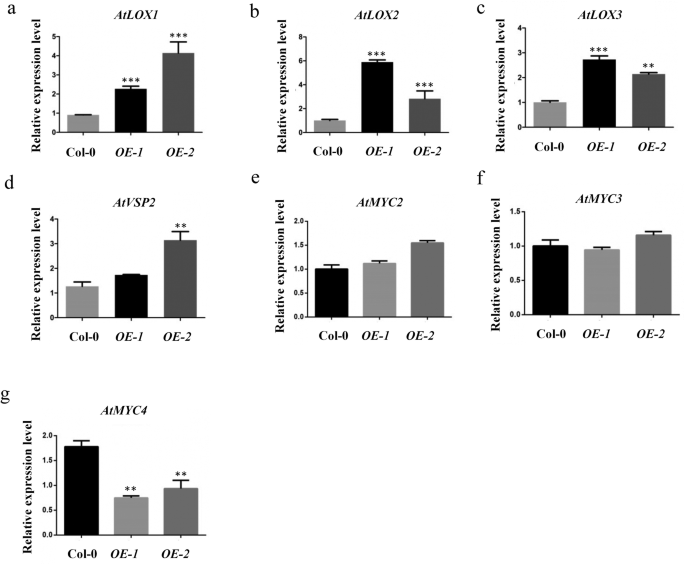
为了揭示tawrky42 - b诱导叶片衰老的机制,我们进行了研究gydF4y2Ba独联体gydF4y2Ba-作用元素分布在gydF4y2BaTaWRKY42-BgydF4y2Ba启动子区域提供线索。值得注意的是,与JA反应性相关的三个cgtca基序存在于gydF4y2BaTaWRKY42-BgydF4y2Ba启动子区域(−980,−1865,−2009 bp)(附加文件gydF4y2Ba4gydF4y2Ba:图S4)。此外,施用200 μM MeJA后,转录水平gydF4y2BaTaWRKY42-BgydF4y2Ba在2小时后达到最大值,然后在4到24小时下降到相对较低的水平(图2)。gydF4y2Ba6gydF4y2Bac).几十年来,JA被公认为与叶片衰老相关的植物激素。因此,我们推测TaWRKY42-B以ja相关的方式调控叶片衰老。从Col-0中收获莲座叶,gydF4y2BaOE-1gydF4y2Ba,gydF4y2BaOE-2gydF4y2Ba100 μM MeJA处理4 d。ja诱导的叶片衰老在Col-0和gydF4y2BaTaWRKY42-BgydF4y2Ba-gydF4y2BaOEgydF4y2Ba植株中叶绿素含量较低,离子渗漏较严重gydF4y2BaOE-1gydF4y2Ba而且gydF4y2BaOE-2gydF4y2Ba(无花果。gydF4y2Ba6gydF4y2Baa, b, d)。为了深入剖析TaWRKY42-B与JA信号通路相互作用的细节,我们检测了一系列JA相关基因的表达水平。JA生物合成基因,包括gydF4y2BaAtLOX1gydF4y2Ba,gydF4y2BaAtLOX2gydF4y2Ba,gydF4y2BaAtLOX3gydF4y2Ba和ja反应基因,gydF4y2BaAtVSP2gydF4y2Ba,被提升到gydF4y2BaOE-1gydF4y2Ba而且gydF4y2BaOE-2gydF4y2Ba与Col-0相比(图;gydF4y2Ba7gydF4y2Ba模拟)。然而,信号成分基因,如gydF4y2BaAtMYC2gydF4y2Ba而且gydF4y2BaAtMYC3,gydF4y2Ba几乎不受过度表达的影响gydF4y2BaTaWRKY42-BgydF4y2Ba(无花果。gydF4y2Ba7gydF4y2Bae-f)。同时,的表达gydF4y2BaAtMYC4gydF4y2Ba略有下降gydF4y2BaTaWRKY42-B-OEgydF4y2Ba植物(图。gydF4y2Ba7gydF4y2Bag).上述结果表明,TaWRKY42-B主要通过改变JA生物合成基因的表达来促进叶片衰老。gydF4y2Ba
TaWRKY42-B正向调控ja诱导的叶片衰老gydF4y2Ba拟南芥gydF4y2Ba.(gydF4y2Ba一个gydF4y2Ba) 4周龄Col-0和Col-0第7和第8叶的衰老相关表型gydF4y2BaTaWRKY42-BgydF4y2Ba-overexpressing (gydF4y2BaTaWRKY42-B -gydF4y2BaOE)在模拟或100 μM MeJA处理前后的植株。叶绿素含量(gydF4y2BabgydF4y2Ba)和离子泄漏率(gydF4y2BadgydF4y2Ba)处理前后离体叶片的变化,详见(gydF4y2Ba一个gydF4y2Ba).(gydF4y2BacgydF4y2Ba)转录gydF4y2BaTaWRKY42-BgydF4y2Ba对MeJA处理后的小麦进行检测。用200 μM MeJA处理7 d小麦幼苗1、2、4、6、8、10和24 h。(误差条表示SD。星号表示显著差异。学生的gydF4y2BatgydF4y2Ba以及,*gydF4y2BaPgydF4y2Ba< 0.05, **gydF4y2BaPgydF4y2Ba< 0.01)gydF4y2Ba
TaWRKY42-B影响ja相关基因的表达gydF4y2Ba拟南芥gydF4y2Ba.gydF4y2Ba一个gydF4y2Ba-gydF4y2BaggydF4y2Ba几种ja相关基因的转录水平,包括gydF4y2BaAtLOX1gydF4y2Ba,gydF4y2BaAtLOX2gydF4y2Ba,gydF4y2BaAtLOX3gydF4y2Ba,gydF4y2BaAtVSP2gydF4y2Ba,gydF4y2BaAtMYC2gydF4y2Ba,gydF4y2BaAtMYC3gydF4y2Ba,gydF4y2BaAtMYC4gydF4y2Ba在4周龄的第7和第8个莲座叶上gydF4y2BaTaWRKY42-B-OEgydF4y2BaqRT-PCR检测Col-0植株。(误差条表示SD。星号表示显著差异。学生的gydF4y2BatgydF4y2Ba以及,*gydF4y2BaPgydF4y2Ba< 0.05, **gydF4y2BaPgydF4y2Ba< 0.01, ***gydF4y2BaPgydF4y2Ba< 0.001)gydF4y2Ba
TaWRKY42-B直接与的启动子区结合gydF4y2Ba液态氧gydF4y2Ba
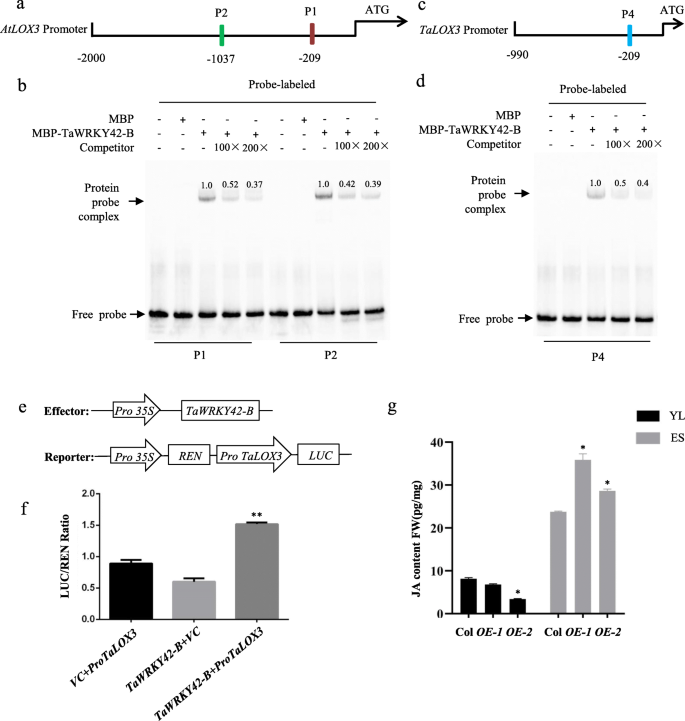
WRKYs长期以来被认为可以调控多种靶基因的转录,这通常是通过WRKYs与W-box启动子区域的相互作用来完成的。我们发现了一个和两个w盒图案gydF4y2BaAtLOX1gydF4y2Ba而且gydF4y2BaAtLOX3gydF4y2Ba分别为启动子(附加文件gydF4y2Ba6gydF4y2Ba:图S6a和图。gydF4y2Ba8gydF4y2Baa).因此,我们研究了TaWRKY42-B是否与中的w -box结合gydF4y2BaAtLOX1gydF4y2Ba而且gydF4y2BaAtLOX3gydF4y2Ba电泳迁移率漂移法测定启动子[gydF4y2Ba56gydF4y2Ba].将TaWRKY42-B的全长CDS亚克隆到pMAL-c2x的框架中,并与麦芽糖结合蛋白(MBP)融合。TaWRKY42-B-MBP融合蛋白的表达和纯化gydF4y2Ba大肠杆菌gydF4y2Ba应变gydF4y2Ba罗塞塔gydF4y2Ba.用TaWRKY42-B-MBP或单独用MBP孵育含有碎片的w盒探针。探针1 (P1)和探针2 (P2)包含gydF4y2BaAtLOX3gydF4y2Ba该启动子与TaWRKY42-B-MBP特异杂交,并与未标记的探针进行竞争。gydF4y2Ba8gydF4y2Bab).探针3 (P3),用于检测TaWRKY42-MBP是否靶向gydF4y2BaAtLOX1gydF4y2Ba,未显示与TaWRKY42-B-MBP的竞争性绑定(附加文件gydF4y2Ba6gydF4y2Ba:图S6b)。这些数据表明gydF4y2BaAtLOX3gydF4y2Ba是TaWRKY42-B的潜在靶基因gydF4y2Ba拟南芥gydF4y2Ba.gydF4y2Ba
TaWRKY42-B直接与的启动子结合gydF4y2BaAtLOX3gydF4y2Ba而且gydF4y2BaTaLOX3gydF4y2Ba,影响转录gydF4y2BaTaLOX3gydF4y2Ba.gydF4y2Ba一个gydF4y2Ba的探测图gydF4y2BaAtLOX3gydF4y2BaEMSA启动子区。gydF4y2BabgydF4y2BaTaWRKY42-B与蛋白启动子区相互作用gydF4y2BaAtLOX3gydF4y2BaEMSA分析。gydF4y2BacgydF4y2Ba的探测图gydF4y2BaTaLOX3gydF4y2BaEMSA启动子区。gydF4y2BadgydF4y2BaTaWRKY42-B与蛋白启动子区相互作用gydF4y2BaTaLOX3gydF4y2BaEMSA分析。TaWRKY42-B-MBP融合蛋白与标记探针混合,以100×或200×未标记探针作为竞争对手。特定探测的存在(+)或不存在(−)。条带上方的数字表示归一化至对照组后TaWRKY42-B-MBP融合蛋白与标记探针的相对结合强度。gydF4y2BaegydF4y2Ba瞬态表达试验结构图。gydF4y2BafgydF4y2BaTaWRKY42-B激活的表达gydF4y2BaTaLOX3gydF4y2Ba在小麦原生质体双荧光素酶报告系统中。gydF4y2BaRenillagydF4y2Ba荧光素酶用于归一化。gydF4y2Ba35 s:绿色荧光蛋白gydF4y2Ba作为阴性对照。gydF4y2BaggydF4y2Ba3周龄和5周龄Col-0和第7和第8莲座叶JA含量的测定gydF4y2BaTaWRKY42-B-OEgydF4y2Ba分别行。(误差条表示SD。星号表示阴性对照与TaWRKY42-B组SPAD和离子渗漏有显著差异。学生的gydF4y2BatgydF4y2Ba以及,*gydF4y2BaPgydF4y2Ba< 0.05, **gydF4y2BaPgydF4y2Ba< 0.01)gydF4y2Ba
尽管TaWRKY42-B与之相互作用gydF4y2BaAtLOX3gydF4y2Ba在此期间,TaWRKY42-B与直系同源物结合的潜力尚不清楚gydF4y2BaAtLOX3gydF4y2Ba在小麦。我们使用gydF4y2BaAtLOX3gydF4y2Ba在小麦基因组数据库(gydF4y2Bahttp://plants.ensembl.org/Triticum_aestivumgydF4y2Ba).独特的基因(gydF4y2BaTraesCS4B02G295200gydF4y2Ba),与的相似度最高gydF4y2BaAtLOX3gydF4y2Ba,被称为gydF4y2BaTaLOX3gydF4y2Ba并被选中进行测试。我们搜索了gydF4y2BaTaLOX3gydF4y2Ba启动子区域,发现只有一个W-box元素存在于起始密码子上游209 bp的片段(图。gydF4y2Ba8gydF4y2Bac).随后,我们测试了TaWRKY42-B与gydF4y2BaTaLOX3gydF4y2BaEMSA。与TaWRKY42-B和gydF4y2BaAtLOX3gydF4y2Ba,探头4 (P4)对gydF4y2BaTaLOX3gydF4y2Ba启动子与TaWRKY42-B强结合(图;gydF4y2Ba8gydF4y2Bad).探索TaWRKY42-B与gydF4y2BaTaLOX3gydF4y2Ba在体内,LUC的酶活性受到了酶的控制gydF4y2BaTaLOX3gydF4y2Ba启动子和共同转化gydF4y2Ba35 s: TaWRKY42-BgydF4y2Ba进入小麦原生质体,被测量(图;gydF4y2Ba8gydF4y2Bae). LUC活性的急剧升高仅在含有两者的原生质体中观察到gydF4y2Ba35 s: TaWRKY42-BgydF4y2Ba而且gydF4y2BaPgydF4y2BaTaLOX3gydF4y2Ba:卢克gydF4y2Ba而对照组则没有。gydF4y2Ba8gydF4y2Baf).此外,我们分析了gydF4y2BaTaLOX3gydF4y2Ba在tawrky42 - b沉默的植物中gydF4y2BaTaLOX3gydF4y2Ba因为沉默而极度抑郁gydF4y2BaTaWRKY42-BgydF4y2Ba(无花果。gydF4y2Ba9gydF4y2Ba一个)。gydF4y2Ba
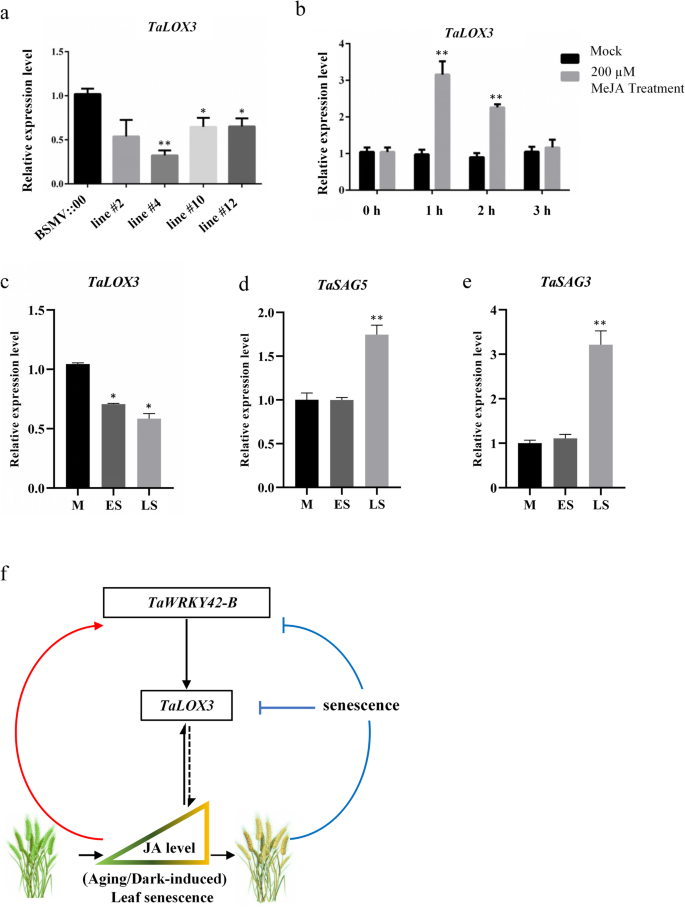
TaLOX3gydF4y2Ba通过TaWRKY42-B、MeJA处理和衰老过程改变其表达。gydF4y2Ba一个gydF4y2Ba表达水平gydF4y2BaTaLOX3gydF4y2Ba在gydF4y2BaTaWRKY42-BgydF4y2Ba沉默的植物。gydF4y2BabgydF4y2Ba转录的gydF4y2BaTaLOX3gydF4y2Ba在MeJA处理后检测到。用200 μM MeJA处理7 d小麦幼苗1、2、3 h。gydF4y2BacgydF4y2Ba-gydF4y2BaegydF4y2Ba衰老相关基因的表达模式gydF4y2BaTaSAG3gydF4y2Ba,gydF4y2BaTaSAG5gydF4y2Ba,gydF4y2BaTaLOX3gydF4y2Ba小麦旗叶发育的不同阶段(M、ES和LS)。gydF4y2BafgydF4y2Ba提出了tawrky42 - b介导的叶片衰老调控网络模型。TaWRKY42-B通过激活一个推测的JA生物合成基因,作为叶片衰老的启动子,gydF4y2BaTaLOX3gydF4y2Ba,这也是由JA信号诱导的。当植物处于幼年期时,高水平的gydF4y2BaTaWRKY42-BgydF4y2Ba可能负责与ja相关的发育调控和生物合成。当小麦植株进入衰老阶段时,叶片衰老抑制了TaWRKY42-B-的表达gydF4y2BaTaLOX3gydF4y2Ba叶片衰老的正常进程模块。的反馈控制gydF4y2BaTaWRKY42-BgydF4y2Ba通过JA信号,叶片衰老有可能成为叶片衰老时间的重要步骤。(误差条表示SD。星号表示显著差异。学生的gydF4y2BatgydF4y2Ba以及,*gydF4y2BaPgydF4y2Ba< 0.05, **gydF4y2BaPgydF4y2Ba< 0.01)gydF4y2Ba
的功能作用gydF4y2BaTaLOX3gydF4y2Ba仍然没有特征。因此,为了初步阐明TaLOX3是否在ja诱导的叶片衰老中发挥作用,我们检查了TaLOX3的转录本gydF4y2BaTaLOX3gydF4y2Ba用200 μM MeJA处理7 d小麦幼苗3 h。通过qRT-PCR检测,我们发现MeJA能够增强蛋白的表达gydF4y2BaTaLOX3gydF4y2Ba(无花果。gydF4y2Ba9gydF4y2Bab).此外,的递减表达式gydF4y2BaTaLOX3gydF4y2BaTaWRKY42-B的表达模式与TaWRKY42-B的表达模式基本一致,与gydF4y2BaTaSAG3gydF4y2Ba而且gydF4y2BaTaSAG5gydF4y2Ba(无花果。gydF4y2Ba9gydF4y2Ba一部)。综上所述,TaLOX3可能参与了ja诱导的小麦叶片衰老过程;然而,要全面了解TaWRKY42-B-的功能作用,还需要更多的证据gydF4y2BaTaLOX3gydF4y2Ba模块在小麦叶片衰老。gydF4y2Ba
TaWRKY42-B促进JA生物合成gydF4y2Ba
为了进一步证实TaWRKY42-B通过JA生物合成促进叶片衰老,我们测定了TaWRKY42-B在幼苗和衰老叶片中的JA水平gydF4y2BaTaWRKY42-BgydF4y2Ba-gydF4y2BaOEgydF4y2Ba和野生型gydF4y2Ba拟南芥gydF4y2BaLC-MS/MS分别测定。与之前的研究一致,JA水平在叶片衰老过程中呈上升趋势。值得注意的是,JA水平在gydF4y2BaTaWRKY42-BgydF4y2Ba-OE在幼期低于野生型,而在衰老期高于野生型(图2)。gydF4y2Ba8gydF4y2Bag).基于此数据,我们推测gydF4y2BaTaWRKY42-BgydF4y2Ba在一定程度上有助于JA在不同发育阶段生物合成的稳态,因此表达水平gydF4y2BaTaWRKY42-BgydF4y2Ba应该严格控制。gydF4y2Ba
TaWRKY42-B与AtWRKY53在叶龄依赖性衰老过程中是保守的gydF4y2Ba
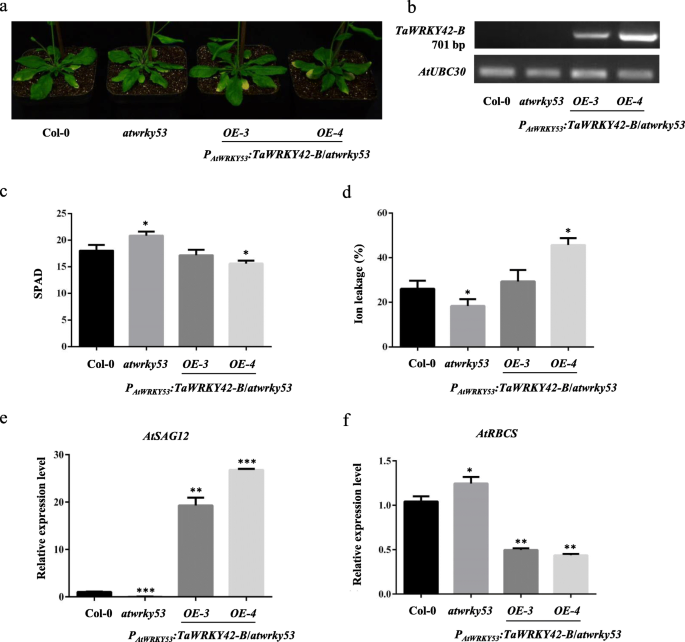
AtWRKY53作为叶片衰老过程的关键调控因子,综合各种环境和内部因素,最终引发叶片衰老。在我们的研究中,系统发育分析和序列比对表明TaWRKY42-B属于III组wrkyys,该组还包括AtWRKY53。为了验证TaWRKY42-B是否与AtWRKY53在功能上保守,我们进行了互补实验gydF4y2BaTaWRKY42-BgydF4y2Ba由1.5 kb驱动gydF4y2BaAtWRKY53gydF4y2Ba促进剂被引入gydF4y2Baatwrky53gydF4y2Ba突变体(无花果。gydF4y2Ba10gydF4y2Bab).中叶片延迟衰老表型gydF4y2Baatwrky53gydF4y2Ba获救的表情gydF4y2BaTaWRKY42-BgydF4y2Ba(无花果。gydF4y2Ba10gydF4y2Baa).叶绿素含量、离子泄漏率和表达水平一致gydF4y2BaAtSAG12gydF4y2Ba而且gydF4y2BaAtRBCSgydF4y2Ba在gydF4y2BaPgydF4y2BaAtWRKY53gydF4y2Ba: TaWRKY42-BgydF4y2Ba/gydF4y2Baatwrky53gydF4y2Ba线被恢复(图;gydF4y2Ba10gydF4y2Ba氟)。这些数据表明,TaWRKY42-B在叶片年龄依赖性衰老调控中的功能作用与AtWRKY53一致。gydF4y2Ba
TaWRKY42-BgydF4y2Ba恢复叶片延迟衰老表型gydF4y2Bawrky53gydF4y2Ba.gydF4y2Ba一个gydF4y2Ba6周龄Col-0的衰老相关表型,gydF4y2Baatwrky53gydF4y2Ba,gydF4y2Bawrky53 / WRK42-B-OEgydF4y2Ba行。gydF4y2BabgydF4y2Ba逆转录PCR (RT-PCR)分析gydF4y2BaTaWRKY42-BgydF4y2Ba在gydF4y2BaPgydF4y2BaAtWRKY53gydF4y2Ba: TaWRKY42-BgydF4y2Ba/gydF4y2Baatwrky53gydF4y2Ba,gydF4y2Baatwrky53gydF4y2Ba和Col-0植物。叶绿素含量(gydF4y2BacgydF4y2Ba)和离子泄漏率(gydF4y2BadgydF4y2Ba)种植不同背景植物,详见(gydF4y2Ba一个gydF4y2Ba).gydF4y2BaegydF4y2Ba-gydF4y2BafgydF4y2Ba转录水平gydF4y2BaAtSAG12gydF4y2Ba而且gydF4y2BaAtRBCSgydF4y2Ba不同的背景植物,显示在(gydF4y2Ba一个gydF4y2Ba).(误差条表示SD。星号表示显著差异。学生的gydF4y2BatgydF4y2Ba以及,*gydF4y2BaPgydF4y2Ba< 0.05, **gydF4y2BaPgydF4y2Ba< 0.01, ***gydF4y2BaPgydF4y2Ba< 0.001)gydF4y2Ba
讨论gydF4y2Ba
衰老不仅是植物发育的最后阶段,而且对植物的生产力和适应性也至关重要,对作物具有特殊的意义[gydF4y2Ba4gydF4y2Ba].随着叶片衰老的进行,氮从衰老的叶片转移到籽粒中,约占作物籽粒中总氮的95% [gydF4y2Ba57gydF4y2Ba,gydF4y2Ba58gydF4y2Ba,gydF4y2Ba59gydF4y2Ba].由生物和非生物胁迫以及异常发育事件引起的叶片衰老时机不当,不利于多种生物过程的发展。因此,叶片衰老一定是一个高度有序的程序,并受到各种衰老相关基因的严格控制。由tf控制的叶片衰老的微妙调节已经研究了几十年,被认为是整合各种衰老相关信号的关键步骤。gydF4y2Ba
wrky是植物中最大的TF家族之一,在植物发育调控和胁迫防御反应中发挥着重要作用[gydF4y2Ba39gydF4y2Ba,gydF4y2Ba60gydF4y2Ba].近年来,一些涉及生物过程的wrky在小麦中得到了研究。TaWRKY51影响乙烯生产,随后促进侧根形成[gydF4y2Ba61gydF4y2Ba].干旱、盐、热、ABA诱导TaWRKY2表达,过量表达TaWRKY2gydF4y2BaTaWRKY2gydF4y2Ba导致转基因小麦对干旱胁迫的耐受性增强,产量增加[gydF4y2Ba62gydF4y2Ba,gydF4y2Ba63gydF4y2Ba].TaWRKY19正向调控植物盐分、干旱和冰冻胁迫响应gydF4y2Ba拟南芥gydF4y2Ba,这部分是由于的表达升高gydF4y2BaDREB2AgydF4y2Ba,gydF4y2BaRD29AgydF4y2Ba,gydF4y2BaRD29BgydF4y2Ba,gydF4y2BaCor6.6gydF4y2BaTaWRKY19 [gydF4y2Ba63gydF4y2Ba].沉默的gydF4y2BaTaWRKY70gydF4y2Ba降低代谢物生物合成基因的转录,从而降低抗性gydF4y2Ba镰刀菌素graminearumgydF4y2Ba在小麦中[gydF4y2Ba64gydF4y2Ba].值得注意的是,WRKYs在不同植物物种中都参与了叶片衰老的调控,但在小麦中与叶片衰老相关的WRKYs在很大程度上是未知的。gydF4y2Ba
在本研究中,我们通过RNA-seq实验筛选了与叶片衰老相关的TaWRKYs。有趣的是,转录水平gydF4y2BaTaWRKY42-BgydF4y2Ba然而,在整个叶片衰老过程中,gydF4y2BaTaWRKY42-BgydF4y2Ba对叶片衰老的启动起了积极作用。TaWRKY42-B的这一特殊特性使我们进一步研究了TaWRKY42-B在叶片衰老调控中的功能作用。类似地,两个gydF4y2Ba拟南芥gydF4y2Ba叶片衰老起始调控因子,gydF4y2BaAtWRKY54gydF4y2Ba而且gydF4y2BaAtWRKY70gydF4y2Ba,主要在叶片衰老过程中积累,但在延缓叶片衰老过程中有部分冗余[gydF4y2Ba47gydF4y2Ba].此外,gydF4y2BaAtJUB1gydF4y2Ba叶片衰老启动延迟,并在转录水平上表现出年龄依赖性升高[gydF4y2Ba65gydF4y2Ba].先前的研究部分说明了叶片衰老的时间是由多种调控因子精心安排的。因此,研究衰老上调和下调的转录因子在叶片衰老调控中的复杂机制具有重要意义。gydF4y2Ba
随后,我们通过TaWRKY42-B的过表达证实了TaWRKY42-B在叶片衰老发生中的积极作用gydF4y2BaTaWRKY42-BgydF4y2Ba在拟南芥。同时,BSMV-VIGS是一种功能表征基因的有力工具,尤其对一些难以稳定转化的作物有帮助。利用BSMV-VIGS,我们发现在小麦植株中叶片衰老的发生显著延迟,表达水平下降gydF4y2BaTaWRKY42-BgydF4y2Ba但不是gydF4y2BaTaWRKY42-AgydF4y2Ba而且gydF4y2BaTaWRKY42-DgydF4y2Ba.值得注意的是,在TgydF4y2BaaWRKY42-BgydF4y2Ba在BSMV-VIGS,成绩单gydF4y2BaTaWRKY42-DgydF4y2Ba而且gydF4y2BaTaWRKY42-AgydF4y2Ba有时出现轻微的变化,这可能是由代偿效应和非特异性沉默引起的。要澄清两者之间的联系gydF4y2BaTaWRKY42-BgydF4y2Ba在本研究中,我们在检测了叶片衰老的表达水平后,进行了与衰老相关的表型分析gydF4y2BaTaWRKY42-BgydF4y2Ba,gydF4y2BaTaWRKY42-AgydF4y2Ba,gydF4y2BaTaWRKY42-DgydF4y2Ba在BSMV-VIGS小麦植株中只有小麦植株转录本减少gydF4y2BaTaWRKY42-BgydF4y2Ba和同等水平的gydF4y2BaTaWRKY42-AgydF4y2Ba而且gydF4y2BaTaWRKY42-DgydF4y2Ba并与对照植物进行对比分析。因此,我们认为本研究中叶片延迟衰老表型的原因是gydF4y2BaTaWRKY42-BgydF4y2Ba在小麦中沉默。综上所述,TaWRKY42-B在单子叶和双子叶植物中促进叶片衰老的潜能表明TaWRKY42-B通过一种保守机制调控植物叶片衰老。gydF4y2Ba
通过序列比对和系统发育分析,我们将TaWRKY42-B确定为III类wrkyys的成员,该wrkyys还包括一些与衰老相关的wrkyys,如AtWRKY53。根据已有的研究,与衰老相关的转录因子调节叶片衰老的启动主要依赖于其转录活性。为了评估TaWRKY42-B是否通过转录调节影响叶片衰老的时间,我们在小麦原生质体和酵母细胞中检测了TaWRKY42-B的转录活性,TaWRKY42-B在两种分析中都表现出很强的转录活性。同样,TaWRKY42-B在小麦叶肉细胞原生质体中的细胞核定位也赋予了TaWRKY42-B调节衰老相关基因转录的潜力。gydF4y2Ba
此外,我们还证实了TaWRKY42-B通过JA信号通路影响叶片衰老过程。叶片衰老加速gydF4y2BaTaWRKY42-BgydF4y2Ba-过表达的植物。此外,我们证实TaWRKY42-B促进了JA在体内的积累。明显,异位表达gydF4y2BaTaWRKY42-BgydF4y2Ba导致幼龄期和衰老期JA水平分别较低和较高。这一结果表明TaWRKY42-B在不同阶段具有多效性。因此,gydF4y2BaTaWRKY42-BgydF4y2Ba应严格限制在正常生长的适当水平。一致地,我们验证了TaWRKY42-B结合的启动子区域gydF4y2BaAtLOX3gydF4y2Ba而且gydF4y2BaTaLOX3gydF4y2BaEMSA提出的建议gydF4y2BaTaLOX3gydF4y2Ba而且gydF4y2BaAtLOX3gydF4y2Ba为TaWRKY42-B的潜在靶基因。此外,通过在小麦原生质体中使用双荧光素酶报告系统,我们证明了双荧光素酶的激活gydF4y2BaTaLOX3gydF4y2BaTaWRKY42-B启动子。此外,gydF4y2BaTaLOX3gydF4y2Ba从成熟叶期到后期衰老叶期,其表达量呈下降趋势,这与基因的表达规律相吻合gydF4y2BaTaWRKY42-BgydF4y2Ba.综上所述,我们推测转录之间的正相关gydF4y2BaAtLOX3gydF4y2Ba,gydF4y2BaTaLOX3gydF4y2Ba, TaWRKY42-B是TaWRKY42-B与相互作用的结果gydF4y2BaAtLOX3gydF4y2Ba而且gydF4y2BaTaLOX3gydF4y2Ba.这种调控可能是由JA的积累促进的,因此引发了叶片衰老的开始,尽管还需要一些令人信服的证据,如ChIP-PCR结果,来进一步验证TaWRKY42-B和TaWRKY42-B之间的物理相互作用gydF4y2Ba液态氧gydF4y2Ba在未来。gydF4y2Ba
JA一直被认为是一种与衰老相关的植物激素[gydF4y2Ba31gydF4y2Ba].虽然JA和JA生物合成基因在衰老叶片中含量升高,但野生型和部分JA相关突变体的衰老过程是相同的,这意味着JA信号通路在叶片衰老中的功能作用仍需考虑[gydF4y2Ba32gydF4y2Ba].gydF4y2Ba
在小麦中,一些与ja相关的基因已被鉴定并进行了功能研究。TaJAZ1与TaABI5直接相互作用,从而抑制种子萌发[gydF4y2Ba66gydF4y2Ba].TaJAZ1对白粉病抗性也有正向调节作用[gydF4y2Ba67gydF4y2Ba].gydF4y2BaTaAOC1gydF4y2Ba是一个JA生物合成基因,负责JA的积累和耐盐性[gydF4y2Ba68gydF4y2Ba].gydF4y2BaTaOPR2gydF4y2Ba在JA的生物合成中起作用,并可挽救雄性不育表型gydF4y2Baopr3gydF4y2Ba在gydF4y2Ba拟南芥gydF4y2Ba[gydF4y2Ba69gydF4y2Ba].然而,对参与ja介导的小麦叶片衰老的调控因子的鉴定落后于许多作物。显着延迟叶片衰老表型gydF4y2BaTaWRKY42-BgydF4y2Ba-沉默的小麦植株和早熟的叶片衰老gydF4y2BaTaWRKY42-BgydF4y2Ba-overexpressinggydF4y2Ba拟南芥gydF4y2Ba表明TaWRKY42-B在叶片衰老的发生中起积极作用。我们的数据还表明,TaWRKY42-B通过JA途径促进叶片衰老。有趣的是,TaWRKY42-B是叶片衰老的启动子,但随着叶片衰老的进行,其表达量呈下降趋势。为了解释TaWRKY42-B的功能作用,我们提出了一个假设,主要是基于TaWRKY42-B对叶片衰老过程中JA生物合成的影响。我们推测gydF4y2BaTaWRKY42-BgydF4y2Ba部分JA生物合成相关基因被严格控制,以保证JA含量适当,保证小麦正常生长。在叶片衰老开始前,TaWRKY42-B在幼年期表现出相对较高的表达水平,用于JA的积累和与JA相关的发育调控,包括叶片衰老开始的准备,并被激活gydF4y2BaTaWRKY42-BgydF4y2Ba表达式。随着叶片衰老的进行,gydF4y2BaTaWRKY42-BgydF4y2Ba而它的目标,比如gydF4y2BaTaLOX3gydF4y2Ba,并与其他与衰老相关的调控因子合作,使叶片衰老有组织地进展。不可否认的是,随着叶片衰老的进展,JA的含量几乎是持续升高的,这表明叶片衰老过程中JA的积累受到其他调控因子的控制。然而,一些关于TaWRKY42-B-底层机制的详细信息gydF4y2BaTaLOX3gydF4y2Ba为了进一步验证我们的假设,还需要进行模块和一些体内实验。gydF4y2Ba
最后,根据我们的遗传数据,我们发现TaWRKY42-B参与叶片衰老调控与AtWRKY53部分保守。AtWRKY53启动子驱动的TaWRKY42-B全长CDS能够挽救延迟的叶片衰老gydF4y2Baatwrky53gydF4y2Ba.此前的实验数据表明,AtWRKY53在叶片衰老过程中受到JA和SA信号的拮抗调控。在我们的研究中,我们发现TaWRKY42-B调节叶片衰老也与JA有关,这进一步表明TaWRKY42-B在年龄依赖性叶片衰老中与AtWRKY53具有功能保守性。gydF4y2Ba
简单地说,我们提出了一个tawrky42 - b促进叶片衰老的模型。gydF4y2Ba9gydF4y2Baf).的转录水平gydF4y2BaTaWRKY42-BgydF4y2Ba受到叶片衰老进程和JA信号的严格控制。在未衰老的叶片中,JA活性增加gydF4y2BaTaWRKY42-BgydF4y2Ba触发转录gydF4y2BaTaLOX3gydF4y2Ba随后,叶片衰老开始,JA生物合成升高。而在衰老阶段,TaWRKY42-B-gydF4y2BaTaLOX3gydF4y2Ba抑制有组织的叶片衰老进程。这种反馈循环可能有助于小麦叶片衰老的适当时机。TaWRKY42-B与AtWRKY53功能保守,同样参与了JA相关的叶片衰老,并改变了一些JA生物合成基因的表达,如gydF4y2BaAtLOX3gydF4y2Ba而且gydF4y2BaTaLOX3gydF4y2Ba.虽然还需要更多的体内证据来全面了解TaWRKY42-B的功能作用,但我们揭示了小麦叶片衰老的转录调控的详细信息。gydF4y2Ba
结论gydF4y2Ba
总的来说,通过生理和分子分析,我们发现了一个新的wrky型叶片衰老启动子TaWRKY42-B,它通过促进JA的生物合成并与JA相互作用来介导叶片衰老的启动gydF4y2BaAtLOX3gydF4y2Ba而且gydF4y2BaTaLOX3gydF4y2Ba.本研究结果为揭示小麦叶片衰老机制提供了新的线索,并为调控小麦叶片衰老提高产量和品质提供了潜在的靶标基因。gydF4y2Ba
方法gydF4y2Ba
植物材料和生长条件gydF4y2Ba
拟南芥gydF4y2Ba‘Col-0’生态型来源于拟南芥生物资源中心(Arabidopsis Biological Resource Center, ABRC;gydF4y2Bahttp://abrc.osu.edugydF4y2Ba),并用于转换。拟南芥突变体gydF4y2Baatwrky53gydF4y2Ba(SALK_034157)由福建农林大学苗颖教授提供,用于互补实验。的gydF4y2Baatwrky53gydF4y2Ba突变体的第二个外显子内有一个T-DNA插入,基因分型为gydF4y2Baatwrky53gydF4y2Ba在本研究中,[gydF4y2Ba41gydF4y2Ba].叶片延迟衰老表型gydF4y2Baatwrky53gydF4y2Ba通过衰老相关参数的测量也得到了作者的证实。所有拟南芥植物都在河北师范大学的生长室中生长。表面消毒后的种子在含1%蔗糖、0.8%琼脂、1 × Murashige和Skoog盐的1/ 2ms培养基中播种,4℃处理48 h。7天大的幼苗转移到22°C的长日条件下(LD:光照16 h /暗8 h)的温室中。在LD条件下,用黑暗和MeJA处理4周龄植株,测定叶绿素含量和离子泄漏量。gydF4y2Ba
面包小麦品种“石滦02-1”在中国广泛种植用于农业生产。本研究中,“石卷02-1”由河北师范大学黄占景教授提供,用于BSMV-VIGS,检测gydF4y2BaTaWRKY42-BgydF4y2Ba表达模式。“石滦02-1”的种子保存在本实验室,也可从河北省农林科学院遗传生理研究所种子库获得。作者对“石滦02-1”的表型性状和农艺性状进行了分析,以确定“石滦02-1”的背景。小麦植株在河北师范大学和河北省农林科学院的温室条件下种植。7天大的幼苗用于渗透。对5周龄的浸润植株进行黑暗处理,检测其表达水平gydF4y2BaTaWRY42-BgydF4y2Ba而且gydF4y2Ba凹陷gydF4y2Ba被检测到。用于检测的表达水平gydF4y2BaTaWRKY42-BgydF4y2Ba在4个发育叶期,小麦旗叶均在4 ~ 6月收获;在拟南芥中,根据叶绿素含量、离子泄漏率和表达水平来描述收集的时间gydF4y2Ba凹陷gydF4y2Ba[gydF4y2Ba22gydF4y2Ba].利用面包小麦品种“科农199”产生小麦原生质体。gydF4y2Ba
质粒构建与植物转化gydF4y2Ba
的过度表达gydF4y2BaTaWRKY42-BgydF4y2Ba的全长879 bp CDSgydF4y2BaTaWRKY42-BgydF4y2Ba从小麦旗叶中扩增,并导入pCAMBIA1300-GFP载体。将上述向量转化为gydF4y2Ba农杆菌属gydF4y2Ba利用花浸转化法将菌株GV3101转化为拟南芥。用GFP抗体western-blot法检测TaWRKY42-B-GFP在转基因系中的融合。gydF4y2Ba
为了测试转录活性和亚细胞定位,gydF4y2BaTaWRKY42-BgydF4y2Ba亚克隆为pSAT-GAL4DB、pGBKT7和PUC19载体。gydF4y2Ba
EMSA全长cDNAgydF4y2BaTaWRKY42-BgydF4y2Ba生成并克隆到pMAL-C2X向量中,并将构建物转化为gydF4y2Ba大肠杆菌gydF4y2Ba应变gydF4y2Ba罗塞塔gydF4y2Ba.gydF4y2Ba
生成gydF4y2BaTaWRKY42-BgydF4y2BaBSMV-VIGS构造,一个198 bp的片段gydF4y2BaTaWRKY42-BgydF4y2Ba构建成pCaBS-γbLIC载体。gydF4y2Ba
原生质体转化和双荧光素酶报告试验gydF4y2Ba
原生质体是从7日龄的“科农199”黄化苗中分离得到的。pGreen0800-LUC与gydF4y2BaTaLOX3gydF4y2Ba推广者和记者。gydF4y2Ba35 s: TaWRKY42-B-GFPgydF4y2Ba被用作效应器和gydF4y2Ba35 s:绿色荧光蛋白gydF4y2Ba作为阴性对照。质粒pGreen0800-LUC和gydF4y2Ba35 s: TaWRKY42-B-GFPgydF4y2Ba或gydF4y2Ba35 s:绿色荧光蛋白gydF4y2Ba,共同转化为小麦原生质体,孵育18 h。萤火虫和gydF4y2BaRenillagydF4y2Ba荧光素酶活性用双荧光素酶测定试剂盒(Promega, E1910)测定。gydF4y2Ba
离子泄漏和叶绿素含量gydF4y2Ba
采用SPAD502 Plus叶绿素仪检测莲座叶的相对叶绿素含量。为了测量膜离子泄漏,每棵植物的第7片叶子都被收获,并在真空下放置在去离子水中1 h。测定了不同背景叶片的电导率。然后,在去离子水中煮沸15 min,测量叶片的电导率,作为总电导率。在减去水的电导率值后,用煮沸前后叶片的电导率来计算离子泄漏率的值。煮沸前后叶片的电导率之比最终确定为离子泄漏率[gydF4y2Ba19gydF4y2Ba].gydF4y2Ba
中存在gydF4y2Ba
总RNA用Trizol试剂(TAKARA, 9109)提取。用1 μL DNase I处理总RNA (500 ng),制备第一链cDNA。用qRT-PCR对合成的cDNA进行定量分析。在ABI7300中,将SYBR绿(TAKARA, RR420A)与ROX参比染料混合,进行实时PCR。每个样品进行3个生物重复分析。本研究中使用的所有引物均列在附加文件中gydF4y2Ba7gydF4y2Ba:表S1。将目标基因的表达水平归一化至内控基因的表达水平,gydF4y2BaTaACTINgydF4y2Ba在小麦中,将表达量归一化到内控的表达量,gydF4y2BaAtUBC30gydF4y2Ba在拟南芥。gydF4y2Ba
RNA-SeqgydF4y2Ba
采用TIANGEN®RNAprep Pure Plant Plus Kit(富含多糖和多酚)从中国春旗叶片孕穗期、抽穗期、开花期和灌浆期分离总RNA。采用3个生物重复。使用NEBNext®Ultra™RNA文库准备试剂盒for Illumina®(NEB, USA)根据说明生成非链测序文库。使用TruSeq PE Cluster Kit v3-cBot-HS (Illumina)根据制造商的建议,通过cBot Cluster Generation System对索引编码的样本进行聚类。然后利用Illumina Novaseq6000平台对文库进行测序,得到末端成对150 bp的reads。每个样本的reads的整体测序质量用Fastp软件评估和控制,使用默认参数[gydF4y2Ba70gydF4y2Ba].其余reads与小麦参考基因组IWGSCv1.0 (gydF4y2Bahttp://www.wheatgenome.org/gydF4y2Ba)使用HISAT2 v2.1 (gydF4y2Bahttps://daehwankimlab.github.io/hisat2/gydF4y2Ba)使用默认参数,并且仅为下面的分析保留唯一映射的读取(附加文件gydF4y2Ba8gydF4y2Ba:表S2)。基因表达定量采用HTseq [gydF4y2Ba71gydF4y2Ba,gydF4y2Ba72gydF4y2Ba].采用R包DESeq2进行两期间的差异表达分析,且仅选取绝对值为log的基因进行差异表达分析gydF4y2Ba2gydF4y2Ba(折叠变化)≥1和gydF4y2BaPgydF4y2Ba值< 0.05为deg。gydF4y2Ba
RNA测序数据已存入NCBI Sequence Read Archive (gydF4y2Bahttps://www.ncbi.nlm.nih.gov/bioproject/PRJNA656068gydF4y2Ba)。PRJNA656068和CNSA (gydF4y2Bahttps://db.cngb.org/search/project/CNP0001003gydF4y2Ba),登记号码为。CNP0001003。gydF4y2Ba
系统发育分析和基因表达gydF4y2Ba
采用最大似然法和WAG+F模型,用MEGA X构建系统发育树[gydF4y2Ba73gydF4y2Ba]并以Newick文件的形式输出,该文件被上传到交互式生命树(gydF4y2Bahttps://itol.embl.de/gydF4y2Ba),这是一个网上树形设计工具,以制作树形。基因表达水平基于RNA-Seq数据中的FPKM值,并以log2(FPKM+ 1)标准化。热图由TBtools构建[gydF4y2Ba74gydF4y2Ba].gydF4y2Ba
暗诱导的叶片衰老gydF4y2Ba
深色诱导叶片衰老,将1月龄小麦叶片和4周龄拟南芥第6、7个莲座丛叶片置于含有10 mL去离子水的培养皿中。在黑暗中放置5 ~ 6天,测定叶绿素含量和离子泄漏量。gydF4y2Ba
对于ja诱导的叶片衰老,用去离子水或100 μM MeJA溶液处理第6和第7叶片,并在22℃的黑暗环境中保存4或5天。测定叶绿素含量和离子泄漏量。gydF4y2Ba
DAB染色gydF4y2Ba
用HCl调去离子水pH为3,加入1% DAB完全溶解,再用KOH调pH为5.7。拟南芥和小麦离体叶片在1% DAB溶液中真空浸泡15 min。接下来,将上述叶片在室温下在黑暗中再孵育4-6小时。样品放置在75%的酒精中直到变色。gydF4y2Ba
BSMVgydF4y2Ba
的目标片段gydF4y2BaTaWRKY42-BgydF4y2Ba通过LIC策略克隆到pCaBS-γbLIC质粒中,将等量携带pCaBS-α、pCaBS-β和pCaBS-γbLIC的细菌混合并渗透到gydF4y2Ban benthamianagydF4y2Ba叶子。溶液中含有10mm MgClgydF4y2Ba2gydF4y2Ba, 10 mM MES, 0.1 M乙酰leugenone (pH = 5.2)。在渗透7天后,收割受感染的局部叶片作为汁液,并在双叶期将汁液机械接种到小麦上。存在载体BSMV::TaWRKY42-BgydF4y2Ba198gydF4y2Ba在gydF4y2Ban benthamianagydF4y2Ba感染5天后可检出,说明感染成功。另外,以BSMV::TaPDS为阳性对照,空(pCaBS-α, pCaBS-β和pCaBS-γbLIC)为阴性对照。gydF4y2Ba
JA量化gydF4y2Ba
三周大和五周大gydF4y2BaTaWRKY42-B-OEgydF4y2Ba和Col-0拟南芥植物进行JA分析的加工和纯化,如前所述[gydF4y2Ba75gydF4y2Ba].脱落的叶子(200毫克)gydF4y2BaTaWRKY42-B-OEgydF4y2Ba将Col-0植物均质浸泡在甲醇中24 h。所有样品离心后,使用Oasis Max固相萃取筒进行纯化。所有样品均采用UPLC系统(Waters)和QTRAP 5500系统(AB SCIEX)测定JA含量。进行3次生物重复gydF4y2Ba2gydF4y2BaHgydF4y2Ba5gydF4y2Ba-JA作为内部参考标准。gydF4y2Ba
EMSAgydF4y2Ba
在EMSA中,与MBP融合的TaWRKY42-B蛋白在gydF4y2Ba大肠杆菌gydF4y2Ba(Rosetta)和直链淀粉树脂纯化(0812S, New England Biolabs, USA)。将最终浓度为0.5 mM的IPTG添加到转化细菌的200 mL培养物中,诱导TaWRKY42-B-MBP融合蛋白的表达;25℃孵育6 h。生物素标记的DNA探针在附加文件中列出gydF4y2Ba7gydF4y2Ba:表S1。未标记的竞争对手探针以100倍和200倍摩尔的过量添加。EMSA使用化学发光核酸检测模块(Thermo Scientific, 89,880)进行。反应总体积为10 μL,含结合缓冲液1 μL,甘油0.5 μL, poly-dIdC 0.5 μL,生物素探针1 μL, 1 M KCl 0.5 μL,纯化融合蛋白400 ng。使用稳定过氧化物溶液检测生物素标记的DNA (Thermo Scientific, 89,880)。gydF4y2Ba
数据和材料的可用性gydF4y2Ba
RNA-seq数据已存入CNSA (gydF4y2Bahttps://db.cngb.org/search/project/CNP0001003gydF4y2Ba),登记号码为CNP0001003和NCBI序列读取存档(gydF4y2Bahttps://www.ncbi.nlm.nih.gov/bioproject/PRJNA656068gydF4y2Ba)。PRJNA656068。本研究的其他实验数据均在本文及其补充资料文件中给出。gydF4y2Ba
缩写gydF4y2Ba
- 阿坝:gydF4y2Ba
-
脱落酸gydF4y2Ba
- 辅助:gydF4y2Ba
-
植物生长激素gydF4y2Ba
- br:gydF4y2Ba
-
BrassinosteroidsgydF4y2Ba
- BSMV:gydF4y2Ba
-
大麦条纹花叶病毒gydF4y2Ba
- 中正:gydF4y2Ba
-
细胞分裂素gydF4y2Ba
- 轻拍:gydF4y2Ba
-
3, 3-diaminobenzidinegydF4y2Ba
- DAT:gydF4y2Ba
-
治疗后一天gydF4y2Ba
- EMSA:gydF4y2Ba
-
电泳迁移率漂移测定gydF4y2Ba
- 遗传算法:gydF4y2Ba
-
赤霉酸gydF4y2Ba
- 是:gydF4y2Ba
-
茉莉酸gydF4y2Ba
- 卢克:gydF4y2Ba
-
萤火虫荧光素酶gydF4y2Ba
- 惩罚:gydF4y2Ba
-
甲基jasmonategydF4y2Ba
- 山:gydF4y2Ba
-
水杨酸gydF4y2Ba
- 减少:gydF4y2Ba
-
Senescence-associated基因gydF4y2Ba
- SLs:gydF4y2Ba
-
StrigolactonesgydF4y2Ba
- 任:gydF4y2Ba
-
RenillagydF4y2Ba荧光素酶gydF4y2Ba
- TF:gydF4y2Ba
-
转录因子gydF4y2Ba
- 中收取:gydF4y2Ba
-
病毒引起的基因沉默gydF4y2Ba
- WT:gydF4y2Ba
-
野生型gydF4y2Ba
参考文献gydF4y2Ba
- 1.gydF4y2Ba
Thomas H, Stoddart JL。叶片衰老。植物科学。1980;31:83-111。gydF4y2Ba
- 2.gydF4y2Ba
LDN。衰老和老化的现象。进:noden LD,编辑。植物的衰老和老化。圣地亚哥:爱思唯尔学术出版社;1988.1-50页。gydF4y2Ba
- 3.gydF4y2Ba
林波,金洪杰,南恒。叶片衰老。植物学报。2007;58:115-36。gydF4y2Ba
- 4.gydF4y2Ba
李志强,李志强,李志强。植物衰老与作物生产力的关系。中国生物医学工程学报,2013;26(6):344 - 344。gydF4y2Ba
- 5.gydF4y2Ba
禹洪辉,金海杰,林波,南桂华。叶片衰老的系统与动力学研究。植物生物学,2019;70:347-76。gydF4y2Ba
- 6.gydF4y2Ba
刘超,程杰,庄勇,叶玲,李忠,王颖,齐明,徐玲,张艳。多梳抑制复合体2对aba诱导的拟南芥衰老的抑制作用。植物学报,2019;39(2):366 - 366。gydF4y2Ba
- 7.gydF4y2Ba
王霞,高洁,高松,宋勇,杨智,快波。拟南芥H3K27me3去甲基化酶REF6通过直接激活衰老调控和功能基因促进叶片衰老。公共科学图书馆,2019;15(4):e1008068。gydF4y2Ba
- 8.gydF4y2Ba
刘鹏,张松,周波,罗霞,周晓峰,蔡波,金永华,牛丽娟,曹旭,等。组蛋白H3K4去甲基化酶JMJ16抑制拟南芥叶片衰老。植物学报,2019;31(2):430-43。gydF4y2Ba
- 9.gydF4y2Ba
金海娟,吴冠华,刘志刚,刘志刚,刘志刚,刘志刚。PRR9对ORE1的昼夜调控对拟南芥叶片衰老的正向调控。中国科学(d辑),2018;29(3):344 - 344。gydF4y2Ba
- 10.gydF4y2Ba
张艳,王颖,魏华,李宁,田伟,崇凯,王磊。拟南芥昼夜节律晚间复合体抑制茉莉酸诱导的叶片衰老。植物学报,2018;11(2):326-37。gydF4y2Ba
- 11.gydF4y2Ba
何玲,吴伟,津塔刚,杨玲,王东,刘瑞,张红,郑铮,黄红,张强,等。在拟南芥中,一种自然发生的外等位基因与叶片衰老和当地气候适应有关。地理学报。2018;9(1):460。gydF4y2Ba
- 12.gydF4y2Ba
贾敏,刘旭,薛辉,吴勇,石磊,王锐,陈勇,徐楠,赵娟,邵娟,等。非典型ATG8-ABS3相互作用控制植物衰老。植物学报。2019;5(2):212-24。gydF4y2Ba
- 13.gydF4y2Ba
施普林格A, Kang C, Rustgi S, von Wettstein D, Reinbothe C, Pollmann S, Reinbothe S.叶片衰老过程中叶绿体程序性破坏涉及13-脂氧合酶(13-LOX)。中国科学(d辑),2016,26(3):344 - 344。gydF4y2Ba
- 14.gydF4y2Ba
李志,吴松,陈娟,王霞,高军,任刚,快斌。NYEs/ sgrs介导的叶绿素降解在拟南芥种子成熟过程中解毒的关键作用。植物学报,2017;29(4):344 - 344。gydF4y2Ba
- 15.gydF4y2Ba
schipper JH。叶片衰老中的转录网络。植物学报。2015;27:77-83。gydF4y2Ba
- 16.gydF4y2Ba
彭富德,杨晓明,杨晓明,等。叶片衰老过程中转录网络的模拟研究。中国科学(d辑),2014;26(4):457 - 457。gydF4y2Ba
- 17.gydF4y2Ba
袁玲,王东,曹玲,余娜,刘凯,郭艳,甘松,陈琳。dml3介导的DNA去甲基化对叶片寿命的调控。植物学报。2020;13(8):1149-61。gydF4y2Ba
- 18.gydF4y2Ba
史瑞华,李志强,李志强。为死而生,为活而死:叶片衰老背后的生存策略。中国生物医学工程学报,2015;29(2):344 - 344。gydF4y2Ba
- 19.gydF4y2Ba
李忠,彭娟,温霞,郭慧。乙烯敏3是一个衰老相关基因,通过直接抑制miR164转录加速拟南芥叶片衰老。植物学报。2013;25(9):3311-28。gydF4y2Ba
- 20.gydF4y2Ba
赵颖,陈震,高洁,邢磊,曹敏,于超,胡勇,尤杰,石辉,朱勇,等。ABA受体PYL9促进抗旱性和叶片衰老。中国科学(d辑:自然科学版),2016;29(3):344 - 344。gydF4y2Ba
- 21.gydF4y2Ba
戚涛,王娟,黄红,刘波,高红,刘勇,宋松,谢东。拟南芥bHLH IIIe亚群与IIId因子拮抗调控茉莉酸诱导叶片衰老的研究。植物细胞学报。2015;27(6):1634-49。gydF4y2Ba
- 22.gydF4y2Ba
郭萍,李忠,黄萍,李波,方松,储健,郭慧。转录因子WRKY75、水杨酸和活性氧组成的三重扩增环加速了叶片衰老。植物学报。2017;29(11):2854-70。gydF4y2Ba
- 23.gydF4y2Ba
孙勇,范晓宇,曹德明,唐伟,何坤,朱建勇,何建新,白美美,朱松,吴娥,等。拟南芥芥中油菜素类固醇激素信号转导与转录网络的整合。生物工程学报。2010;19(5):765-77。gydF4y2Ba
- 24.gydF4y2Ba
直龙果内酯对拟南芥叶片衰老的调控作用。中国生物医学工程学报,2015;29(1):344 - 344。gydF4y2Ba
- 25.gydF4y2Ba
金海杰,刘海红,洪晓红,吴洪红,林波,李ic,辛J,南HG,黄明。细胞分裂素介导的AHK3通过ARR2磷酸化调控拟南芥叶片寿命。中国科学(d辑:自然科学),2006;26(3):344 - 344。gydF4y2Ba
- 26.gydF4y2Ba
陈玲,向松,陈勇,李东,于东。拟南芥WRKY45与DELLA蛋白RGL1相互作用,正向调控衰老引发的叶片衰老。植物学报,2017;10(9):1174-89。gydF4y2Ba
- 27.gydF4y2Ba
金智,Murphy AS, Baek D, Lee SW, Yun DJ, Bressan RA, Narasimhan ML.过表达YUCCA6延缓拟南芥叶片衰老的生长素功能。中国机械工程学报,2011;36(11):369 - 369。gydF4y2Ba
- 28.gydF4y2Ba
张华,周晨。叶片衰老过程中的信号转导。中国生物医学工程学报,2013;32(6):539-45。gydF4y2Ba
- 29.gydF4y2Ba
MYC2和mtb终止茉莉酸信号。植物科学进展,2019;24(8):667-9。gydF4y2Ba
- 30.gydF4y2Ba
黄华,刘波,刘玲,宋松。茉莉素在植物生长发育中的作用。中国生物医学工程学报,2017;29(6):457 - 457。gydF4y2Ba
- 31.gydF4y2Ba
上田杰,加藤。艾草中促衰老物质的分离鉴定。植物学报。1980;66(2):246-9。gydF4y2Ba
- 32.gydF4y2Ba
何艳,傅福海,甘山。茉莉酸在拟南芥叶片衰老过程中的作用。植物科学进展。2002;29(3):344 - 344。gydF4y2Ba
- 33.gydF4y2Ba
Schommer C, Palatnik JF, Aggarwal P, Chetelat A, Cubas P, Farmer EE, Nath U, Weigel D. miR319靶点对茉莉酸盐生物合成和衰老的控制。公共科学图书馆。2008;6(9):e230。gydF4y2Ba
- 34.gydF4y2Ba
Koyama T, Sato F, Ohme-Takagi M. miR319和TCP转录因子在叶片发育中的作用中国生物医学工程学报,2017;29(2):344 - 344。gydF4y2Ba
- 35.gydF4y2Ba
李志刚,李志刚,李志刚,李志刚。脂氧合酶2和茉莉酸盐对拟南芥自然衰老和胁迫诱导衰老的影响。中国生物医学工程学报。2010;29(4):344 - 344。gydF4y2Ba
- 36.gydF4y2Ba
朴俊华,吴珊珊,金玉华,禹洪辉,南恒。不同衰老诱导因子诱导拟南芥叶片衰老过程中相关mrna的差异表达。植物分子生物学,1998;37(3):445-54。gydF4y2Ba
- 37.gydF4y2Ba
王晓燕,王晓燕,王晓燕,等。基于基因网络的小麦衰老调控因子研究。中国生物医学工程学报,2019;18(3):344 - 344。gydF4y2Ba
- 38.gydF4y2Ba
Eulgem T, Rushton PJ, Robatzek S, Somssich IE。植物转录因子WRKY超家族。植物科学进展,2000;5(5):199-206。gydF4y2Ba
- 39.gydF4y2Ba
李志强,李志强,李志强。WRKY转录因子。植物科学进展,2010;15(5):247-58。gydF4y2Ba
- 40.gydF4y2Ba
苗勇,王晓明,王晓明,王晓明。WRKY53转录因子在拟南芥叶片衰老过程中的作用。植物分子生物学杂志,2004;55(6):853-67。gydF4y2Ba
- 41.gydF4y2Ba
杨艳,杨艳。拟南芥WRKY53和ESR/ESP在叶片衰老中的拮抗作用受茉莉酸和水杨酸平衡的调控。植物学报。2007;19(3):819-30。gydF4y2Ba
- 42.gydF4y2Ba
Ay N, Irmler K, Fischer A, Uhlemann R, Reuter G, Humbeck K. WRKY53组蛋白甲基化表观遗传编程控制拟南芥叶片衰老。植物学报,2009;36(2):344 - 344。gydF4y2Ba
- 43.gydF4y2Ba
张艳,刘震,王霞,王娟,范凯,李忠,林伟。DELLA蛋白通过与转录因子WRKY6相互作用负向调控拟南芥暗诱导衰老和叶绿素降解。植物细胞学报,2018;37(7):981-92。gydF4y2Ba
- 44.gydF4y2Ba
Robatzek S, Somssich IE。拟南芥WRKY转录因子家族的一个新成员AtWRKY6与衰老和防御相关的过程有关。植物学报,2001;28(2):123-33。gydF4y2Ba
- 45.gydF4y2Ba
林俊,朴俊华,郑松,黄东,南桂华,洪山。phyA和phyB在拟南芥远红光依赖性叶片衰老中的拮抗作用。中国生物医学工程学报,2018;29(4):344 - 344。gydF4y2Ba
- 46.gydF4y2Ba
姜艳,梁刚,杨松,于东。拟南芥WRKY57在茉莉酸诱导叶片衰老过程中茉莉酸和生长素介导信号的收敛节点。植物学报。2014;26(1):230-45。gydF4y2Ba
- 47.gydF4y2Ba
贝索,李娟,帕尔瓦等。WRKY54和WRKY70在拟南芥叶片衰老中的负调控作用。中国机械工程学报,2012;29(7):457 - 457。gydF4y2Ba
- 48.gydF4y2Ba
罗贝尔,施伦克,柯斯塔-罗伯茨。1980年以来气候变化趋势与全球作物产量。科学。2011;333(6042):616 - 20。gydF4y2Ba
- 49.gydF4y2Ba
Petersen G, Seberg O, Yde M, Berthelsen K.小麦(Triticum aestivum)与Aegilops的系统发育关系及a、B、D基因组起源证据。分子系统进化学报,2006;39(1):70-82。gydF4y2Ba
- 50.gydF4y2Ba
杜晓峰,李志刚,李志刚。基因组可塑性是多倍体小麦驯化成功的关键因素。科学。2007;316(5833):1862 - 6。gydF4y2Ba
- 51.gydF4y2Ba
Brenchley R, Spannagl M, Pfeifer M, Barker GL, D'Amore R, Allen AM, McKenzie N, Kramer M, Kerhornou A, Bolser D,等。面包小麦基因组全基因组霰弹枪测序分析。大自然。2012;491(7426):705 - 10。gydF4y2Ba
- 52.gydF4y2Ba
国际小麦基因组测序C.基于染色体的六倍体面包小麦草稿序列(gydF4y2Ba小麦gydF4y2Ba)基因组。科学。2014;345(6194):1251788。gydF4y2Ba
- 53.gydF4y2Ba
Clavijo BJ, Venturini L, Schudoma C, Accinelli GG, Kaithakottil G, Wright J, Borrill P, Kettleborough G, Heavens D, Chapman H,等。一种改良的异源六倍体小麦基因组的组装和注释鉴定了完整的农艺基因家族,并为染色体易位提供了基因组证据。中国生物工程学报,2017;27(5):885-96。gydF4y2Ba
- 54.gydF4y2Ba
国际小麦基因组测序C,研究者IRp, Appels R, Eversole K, Feuillet C, Keller B, Rogers J, Stein N,研究者Iw-gap, Pozniak CJ,等。利用完全注释的参考基因组改变小麦研究和育种的限制。科学。2018;361 (6403):eaar7191。gydF4y2Ba
- 55.gydF4y2Ba
郭艳,甘山。AtNAP是NAC家族转录因子,在叶片衰老中起重要作用。植物学报,2006;46(4):601-12。gydF4y2Ba
- 56.gydF4y2Ba
张志刚,张志刚,张志刚。产氨基环丙烷-羧酸脱氨酶(ACCD)内生链霉菌GMKU 336抗盐胁迫的分子相互作用gydF4y2Ba栽培稻gydF4y2Bal .简历。KDML105。科学通报2018;8(1):1950。gydF4y2Ba
- 57.gydF4y2Ba
Hirel B, Bertin P, Quillere I, Bourdoncle W, Attagnant C, Dellay C, Gouy A, Cadiou S, Retailliau C, Falque M,等。为了更好地了解玉米氮素利用效率的遗传和生理基础。植物科学进展。2001;25(3):357 - 357。gydF4y2Ba
- 58.gydF4y2Ba
Barneix AJ。来源调控小麦籽粒蛋白质积累的生理生化研究。植物营养学报,2007;26(5):531 - 531。gydF4y2Ba
- 59.gydF4y2Ba
Donnison IS, Gay AP, Thomas H, Edwards KJ, Edwards D, James CL, Thomas AM, Ougham HJ。蛋白酶基因转座子插入突变对玉米氮再流动、籽粒填充和叶片衰老的影响。环境科学学报,2007;43(3):481-94。gydF4y2Ba
- 60.gydF4y2Ba
Viana VE, Busanello C, da Maia LC, Pegoraro C, Costa de Oliveira A.水稻WRKY转录因子的激活:一支对抗压力的军队?植物学报。2018;45(Pt B): 268-75。gydF4y2Ba
- 61.gydF4y2Ba
胡震,王锐,郑敏,刘旭,孟F,吴华,姚勇,辛敏,彭华,倪震,等。TaWRKY51通过负调控小麦(Triticum aestivum L.)乙烯生物合成促进侧根形成。植物学报,2018;32(2):372 - 388。gydF4y2Ba
- 62.gydF4y2Ba
高红,王勇,徐平,张哲。WRKY转录因子TaWRKY2的过表达提高了转基因小麦的抗旱性。中国植物科学,2018;9:997。gydF4y2Ba
- 63.gydF4y2Ba
牛芳芳,魏伟,周启勇,田ag,郝玉军,张伟科,马波,林强,张志斌,张建军,等。小麦WRKY基因TaWRKY2和TaWRKY19调控转基因拟南芥的非生物胁迫耐受力。植物细胞环境学报。2012;35(6):1156-70。gydF4y2Ba
- 64.gydF4y2Ba
Kage U, Yogendra KN, Kushalappa AC. TaWRKY70转录因子在小麦QTL-2DL中调控下游代谢产物生物合成基因以抵抗小麦赤霉病在穗内的传播。科学通报2017;7:42596。gydF4y2Ba
- 65.gydF4y2Ba
吴a, Allu AD, Garapati P, Siddiqui H, Dortay H, Zanor MI, Asensi-Fabado MA, Munne-Bosch S, Antonio C, Tohge T,等。JUNGBRUNNEN1是一种活性氧物种响应的NAC转录因子,调控拟南芥的寿命。植物学报。2012;24(2):482-506。gydF4y2Ba
- 66.gydF4y2Ba
鞠玲,景勇,石萍,刘娟,陈娟,闫娟,褚娟,陈坤明,孙娟。面包小麦和拟南芥JAZ蛋白通过与ABI5相互作用调控种子萌发。新植物学报,2019;223(1):246-60。gydF4y2Ba
- 67.gydF4y2Ba
景勇,刘娟,刘鹏,明东,孙娟。过表达TaJAZ1通过促进活性氧积累提高面包小麦抗白粉病能力。科学通报2019;9(1):5691。gydF4y2Ba
- 68.gydF4y2Ba
赵艳,董伟,张宁,艾霞,王敏,黄忠,肖玲,夏刚。小麦等位基因氧化环化酶基因通过茉莉酸信号增强耐盐性。中国生物医学工程学报,2014;26(2):344 - 344。gydF4y2Ba
- 69.gydF4y2Ba
王勇,袁刚,袁松,段伟,王鹏,白军,张峰,高松,张磊,赵春。TaOPR2编码小麦茉莉酸生物合成过程中12-氧基植物二烯酸还原酶。生物化学与生物物理学报。2016;44(1):344 - 344。gydF4y2Ba
- 70.gydF4y2Ba
陈松,周勇,陈勇,顾杰。fastp:一种超快一体化FASTQ预处理器。生物信息学。2018;34 (17):i884 - 90。gydF4y2Ba
- 71.gydF4y2Ba
Anders S, Pyl PT, Huber W. HTSeq—用于处理高通量测序数据的Python框架。生物信息学,2015,31(2):166 - 9。gydF4y2Ba
- 72.gydF4y2Ba
Kim D, Langmead B, Salzberg SL. HISAT:低内存需求的快速拼接对齐器。光子学报。2015;12(4):357-60。gydF4y2Ba
- 73.gydF4y2Ba
库马尔S, Stecher G,李M, Knyaz C, Tamura K. MEGA X:基于计算平台的分子进化遗传学分析。中国生物医学杂志,2018;35(6):1547-9。gydF4y2Ba
- 74.gydF4y2Ba
陈超,陈宏,张勇,Thomas HR, Frank MH,何勇,夏荣。TBtools:一种用于生物大数据交互分析的集成工具包。植物学报。2020;13(8):1194-202。gydF4y2Ba
- 75.gydF4y2Ba
罗震,孔霞,张勇,李伟,张东,戴军,方松,褚军,董慧。部分根区灌溉条件下叶片源茉莉酸介导水化棉花根系吸水。中国生物医学工程学报,2019;18(3):344 - 344。gydF4y2Ba
确认gydF4y2Ba
感谢李大伟教授和苗颖教授的分享gydF4y2Baatwrky53gydF4y2Ba突变体。感谢黄占景教授提供小麦品种“石滦02-1”。gydF4y2Ba
资金gydF4y2Ba
本工作得到国家自然科学基金(No. 31671694和31871616 - CZ, No. 31600227和31970199 - GW),河北省重大基础研究计划(No. 18966337D - CZ), HAAFS农业科技创新计划(No. 2019-4-8-1 - GW)和中国博士后科学基金(No. 2017 M621096 - GW)的资助。资助者在研究的设计、数据的收集、分析和解释以及撰写手稿方面没有任何作用。gydF4y2Ba
作者信息gydF4y2Ba
从属关系gydF4y2Ba
贡献gydF4y2Ba
CZ和GW构想并设计了实验。MZ、XZ和QT生成了构建物和转基因株系。MZ、XZ、YL和SZ对其进行转录活性检测,并进行表型和生理分析。KL进行了生物信息学分析。MZ进行EMSA实验。MZ、GW和CZ撰写了手稿。所有作者都阅读并批准了最终的手稿。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
伦理批准并同意参与gydF4y2Ba
不适用。gydF4y2Ba
发表同意书gydF4y2Ba
不适用。gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者宣称他们没有竞争利益。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。gydF4y2Ba
补充信息gydF4y2Ba
附加文件1:图S1。gydF4y2Ba
序列比对gydF4y2BaTaWRKY42-BgydF4y2Ba,gydF4y2BaTaWRKY42-AgydF4y2Ba,gydF4y2BaTaWRKY42-D。gydF4y2Ba(a) WRKY亚群与TaWRKY42-B的聚类分析。(b)核苷酸序列比对gydF4y2BaTaWRKY42-B, TaWRKY42-AgydF4y2Ba,gydF4y2BaTaWRKY42-D。gydF4y2Ba(c) TaWRKY42-B对中gydF4y2Ba,gydF4y2BaDNAMAN中的TaWRKY42-A和TaWRKY42-D蛋白序列。gydF4y2Ba
附加文件2:图S2。gydF4y2Ba
的目标片段gydF4y2BaTaWRKY42-BgydF4y2BaBSMV-VIGS。(a)的目标片段序列gydF4y2BaTaWRKY42-BgydF4y2Ba在BSMV-VIGS。(b) BSMV检测::TaWRKY42-BgydF4y2Ba198gydF4y2Ba病媒已渗入gydF4y2Ban benthamianagydF4y2Ba.BSMV::00为阴性对照,BSMV::TaWRKY42-B为阴性对照gydF4y2Ba198gydF4y2Ba质粒作为阳性对照(PC)。Lane 1和Lane 2分别为BSMV::TaWRKY42-B198载体在两片渗透叶片中的PCR产物。gydF4y2Ba
附加文件3:图S3。gydF4y2Ba
TaWRKY42-B在酵母中具有转录活性。(a)在SD/−Trp-His-Leu培养基上培养含有指示载体的酵母菌株。阴性对照菌株为pGBKT7载体。gydF4y2BaTaNAC6gydF4y2Ba而且gydF4y2BaTaWRKY5-DgydF4y2Ba与pGBKT7融合作为阳性对照。(b)用X-gal染色分析上述酵母菌菌落。gydF4y2Ba
附加文件4:图S4。gydF4y2Ba
启动子分析gydF4y2BaTaWRKY42-BgydF4y2Ba在PlantCARE。的本土化gydF4y2Ba独联体gydF4y2Ba元素在gydF4y2BaTaWRKY42-BgydF4y2Ba启动子区域。cgtca -基序参与MeJA反应,tca -基序参与SA反应,ABRE参与ABA反应。gydF4y2Ba
附加文件5:图S5。gydF4y2Ba
过度的gydF4y2BaTaWRKY42-BgydF4y2Ba促进暗诱导的叶片衰老。(a) 4周龄Col-0和gydF4y2BaTaWRKY42-B -gydF4y2Ba过表达植株在黑暗条件下处理6天。暗处理前后离体叶片叶绿素含量(b)和离子泄漏率(c)如图(a)所示。星号表示两者在SPAD和离子泄漏方面有显著差异gydF4y2BaTaWRKY42-B-OEgydF4y2Ba直线和col0。学生的gydF4y2Bat -gydF4y2Ba测试中,*gydF4y2BaPgydF4y2Ba< 0.05, **gydF4y2BaPgydF4y2Ba< 0.01)。gydF4y2Ba
附加文件6:图S6。gydF4y2Ba
TaWRKY42-B不能直接与的启动子结合gydF4y2BaAtLOX1gydF4y2Ba.(a)探测图gydF4y2BaAtLOX1gydF4y2BaEMSA启动子区。(b) TaWRKY42-B与的启动子区相互作用gydF4y2BaAtLOX1gydF4y2BaEMSA分析。TaWRKY42-B-MBP融合蛋白与标记探针和100×或200×未标记探针混合作为竞争对手。特定探测是否存在(+)或不存在(−)。条带上方的数字表示归一化至对照组后TaWRKY42-B-MBP融合蛋白与标记探针的相对结合强度。gydF4y2Ba
附加文件7:表S1。gydF4y2Ba
本研究使用的引物和探针。gydF4y2Ba
附加文件8:表S2。gydF4y2Ba
每个库中的读取数。gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.创作共用公共领域奉献弃权书(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)适用于本条所提供的资料,除非在资料的信用额度中另有说明。gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
赵,MM,张晓伟。,刘,YW。gydF4y2Baet al。gydF4y2BaWRKY转录因子TaWRKY42-B通过促进茉莉酸的生物合成来促进叶片衰老。gydF4y2BaBMC植物生物学gydF4y2Ba20.gydF4y2Ba444(2020)。https://doi.org/10.1186/s12870-020-02650-7gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12870-020-02650-7gydF4y2Ba
关键字gydF4y2Ba
- 叶片衰老gydF4y2Ba
- WRKYsgydF4y2Ba
- 晶澳gydF4y2Ba
- 转录调控gydF4y2Ba
- 小麦gydF4y2Ba