摘要
背景
在真核生物中,自噬是一种用于降解细胞内成分的进化保守系统。自噬在预防维管植物早衰和延长维管植物寿命中起着重要作用。然而,自噬在陆地基生植物抗衰老中的作用机制和生理作用尚不清楚。
结果
在这里,我们研究了与自噬相关基因的功能作用PPATG3.从Physcomitrella金属盘证明了它的缺失会阻止自噬。此外,PPATG3.与正常生长条件下的野生型(WT)相比,突变体的配子体过早衰老,原丝形成减少。氮(N)丰度差异显著,而碳(C)丰度差异不显著PPATG3.突变体和WT植物,如相对脂肪酸水平。体内蛋白质定位表明PPATG3定位于细胞质,体外Y2H测定证实PPATG3与PPATG7和PPATG12相互作用。Plastoglobuli(pgs)积累在PPATG3.,表明该突变体在衰老配子体细胞中降解受损叶绿体的过程受到了损害。RNA-Seq揭示了一组受自噬突变影响的详细、全面的调控通路。
结论
autophagy-related基因PPATG3.是自噬体形成的必要条件吗p .金属盘.我们的研究结果提供了N型利用,脂肪酸代谢和受损的叶绿体病症下的自噬作用。我们识别出差异表达的基因PPATG3.涉及许多生物合成和代谢途径,例如叶绿素生物合成,脂质代谢,去除反应性氧物种,由于缺陷的自噬导致该突变体的过早衰老的不必要的蛋白质。我们的研究提供了新的见解,以自噬在预防衰老方面增加衰老,以增加基底植物中的寿命。
背景
自噬在真核细胞中是一种进化上保守的、普遍存在的过程,它降解细胞内受损或有毒的成分,以便循环利用,以维持必要的细胞功能和生命活动[1,2,3.].在植物中,自噬有助于养分利用效率和能量代谢,并在衰老过程中上调,以促进细胞稳态和寿命[4,5,6].植物中有两种自噬途径:巨自噬和微自噬[7].被广泛研究的巨噬细胞是由自噬(阿格)基因,其表达导致双膜细胞器的形成,称为自噬小体[2].大量胞质成分,包括细胞器片段和大分子,通过与自噬小体融合转移到液泡中,随后被液泡内的水解酶降解。今后我们使用“自噬”这个术语专门指巨自噬。迄今为止,在酵母中至少鉴定出30种ATG蛋白(酿酒酵母酿酒酵母),可分为几个功能类:a) ATG1-ATG13激酶复合物;b) ATG9和ATG9相关蛋白;C)磷脂酰肌醇3-激酶复合物;d) ATG8或ATG12介导的两种泛素类缀合系统[8].这些蛋白质大多数在植物中都有同源物。自噬在植物中起着多种生理作用,在生物和非生物胁迫反应等过程中发挥作用[9,10],花药发展[11]、叶淀粉降解[12]、脂质/脂肪酸稳态和转化[11,13,14,15,受损的叶绿体降解[16,17,可溶性/聚集蛋白降解[18和衰老[2,19].ATG3是一种e2样酶,参与自噬小体形成过程中的ATG8和磷脂酰乙醇胺(PE)偶联系统[20.].的晶体结构酿酒酵母ATG3、半胱氨酸234 (Cys-234)是ATG8-PE偶联脂化反应中重要的活性残基[21.].自动胸腺组形成有缺陷ATG3酵母中的突变体[22.),弓形虫[23.[过表达,通过过表达增强自噬活性ATG3在烟草(24.].
自噬是真核生物特别是植物细胞寿命和衰老的基本因素[2,4].包括碳(C)和氮(N)在内的营养物质的循环和再动员对于植物的生存和适应至关重要,特别是在营养受限的条件下[25.].最近的报道拟南芥(拟南芥)揭示了自噬对n再调动效率的重要作用[26.,27.,28.],并控制C/N比率[29.].然而,迄今为止,在营养饥饿或非生物胁迫条件下进行了拟南芥对自噬作用和衰老的大多数研究,并且在正常生长条件下,很少的研究重点关注这些过程。此外,最近的研究表明,自噬在脂质/脂肪酸代谢中起重要作用[11),组成(13]和营业额[14],尽管自噬是否影响基生陆生植物的脂肪酸还不清楚。尽管自噬对植物的C/N状态和脂质/脂肪酸代谢至关重要,但关于自噬调控机制的细节却知之甚少。
Physcomitrella金属盘是一个常用于发育生物学研究的基底土地植物,已被用来在黑暗中衰老期间研究自噬[30.和配子分化期间[31.].然而,到目前为止,只有两个自噬基因,ATG5和ATG7,已被识别和研究p .金属盘.进一步阐明阿格苔藓中的S将增加我们对自噬在植物发育中的作用的认识。在目前的研究中,我们分析ATG3昏死p .金属盘正常生长条件下的线条。该突变体配子体表现出早期衰老症状,包括黄化、光合作用减弱、叶绿素水平降低、叶绿体质体(PGs)积累和衰老差异表达-相关基因(SAGs)在正常生长条件下。通过对全株C/N和脂肪酸含量的分析,发现自噬在植物体内氮利用效率和脂肪酸代谢中起着重要作用p .金属盘配子托。此外,我们进行了全面的RNA-Seq分析,以深入了解自噬在配子体衰老中的作用p .金属盘.我们的研究提供了在非胁迫条件下在非应激条件下在不胁迫条件下进行了脂肪酸/脂质代谢,受损叶绿体降解,反应性氧物种(ROS)去除和再循环不必要的蛋白质的证据证明了不必要的蛋白质,以防止衰老,并在基础上提高细胞长寿和增强细胞寿命土地植物p .金属盘.
结果
的识别ATG3从p .金属盘
924年英国石油公司PPATG3.编码序列包含9个外显子,几乎与拟南芥的大小相同ATG3(AT5G61500, 942 bp,含9个外显子)。蛋白序列比对结果显示,ATG3蛋白的三个主要功能域具有保守性和差异性p .金属盘vs。Klebsormidium nitens.,中间人Endlicherianum.,Anthoceros angustus,Marchantia polymorpha,Brachypodium distachyon,A. Thaliana.,酿酒酵母,亩骶和智人(附加文件1A).其中两个结构域(Autophagy_act_C和Autophagy_C)表现出较高水平的保守,而第三个结构域(Autophagy_N)则表现出较弱的保守。值得注意的是,Autophagy_C结构域在陆上绿藻中缺失中间人Endlicherianum.(肉豆蔻).此外,ATG3的三个域在植物中更加守恒,与动物。然而,在所有物种的ATG3中检测到键,功能肯定的CYS-234残基。19个氨基酸在植物物种中受到高度保守,但与酵母和人/小鼠不同。
我们根据ScATG3的晶体结构预测了atg3的二级结构(附加文件1一种)。自噬_n,upophagy_act_c和upophagy_c结构域包括三个α螺旋(α1,α2,α3)和两个β1,β1,β2),两个α螺旋(α4,α5)和三个β(β4,β5,β6)和一个alpha螺旋(α7)分别。β3部分包含在自动原理_C域中,并且α6位于自动原理_c_c和自动噬码之间。来自植物和动物的八个基序(1,2,3,4,5,6,8和10),而两个基序(7和9)仅存在于植物中(附加文件1b)。序列对准和基序分析指向植物和动物之间的ATG3s的分歧。系统发育分析也表明了ATG3基因聚集成两个不同的分支(附加文件1C)。这些结果表明,这些基因在植物和动物谱系之间经历了早期分歧和独立演化。此外,土地植物与亚藻生绿藻之间的ATG3的保守特征表明,在土地植物陆地化之前发生了这些基因的功能分歧。
PpATG3的组织特异性表达谱和亚细胞定位
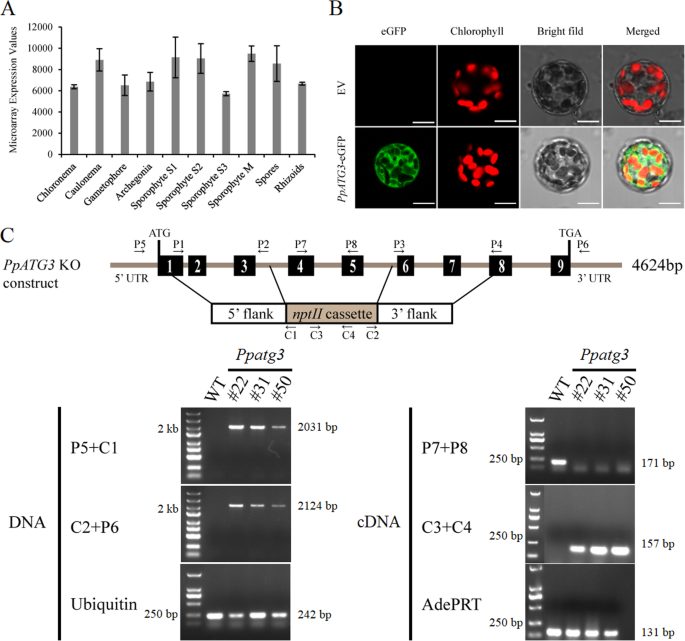
的表达模式PPATG3.在不同组织中,我们从转录组中检索相应的微阵列数据p .金属盘[32.].PPATG3.在整个p .金属盘生命周期,与转录丰度(稳健的多阵列平均)值> 5000(图。1a).确定PpATG3的亚细胞定位p .金属盘,我们融合了完整的编码序列PPATG3.构建型CaMV35S启动子控制下的增强绿色荧光蛋白(eGFP) (p35区域:PpATG3-eGFP)和短暂的转变p .金属盘原生质体具有这种结构(图。1b).我们使用空向量(EV)作为控制(图。1b)。共聚焦显微镜揭示了荧光信号PPATG3.-eGFP融合蛋白在原生质体胞质中分布均匀,而EV对照未产生信号。
组织表达谱,亚细胞定位和有针对性的破坏PPATG3.基因。一个PPATG3.不同的表达式配置文件p .金属盘组织。表达数据来源于Ortiz-Ramírez等人之前的一项研究。b亚细胞定位PPATG3..共聚焦显微镜成像p .金属盘利用空载体(EV)或聚乙二醇(peg)介导转化原生质体p35区域:PpATG3-eGFP构造。比例尺= 10 μm。c有针对性的中断PPATG3.基因和PCR确认。示意图显示4-5外显子的缺失,对应于去除一个573 bp的基因组区域并插入一个2078 bpnptII录音带。左右箭头分别表示正向引物和反向引物。采用PCR分析验证基因组插入nptII盒式磁带及遗失PPATG3.记录。使用P5/C1和C2/P6引物对验证the的双端插入nptII基因组水平的盒式磁带。用P7/P8和C3/C4引物对验证缺失PPATG3.成绩单和表达nptII盒子分别。PpUbiquitin和PpAdePRT用作DNA或cDNA模板质量控制。片段长度和DNA尺寸标记分别显示在凝胶上和左侧
PPATG3.敲除破坏配子体衰老和原丝形成
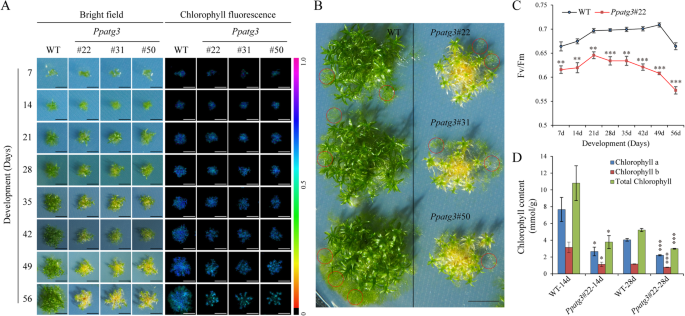
进一步探讨作用PPATG3.我们生成了PPATG3.通过同源重组(HR)破坏外显子4和5敲除转基因植物(图。1c).这产生了3个敲除系(ko#22, ko#31和ko#50)PPATG3.,PCR确认其身份。我们分离出种子组DNA和来自这些植物的总RNA,以验证基因组插入nptII盒式磁带及遗失PPATG3.由于其5'和3'侧翼的HR事件引起的转录物(图。1c)分别。PPATG3.是否通过插入一个2078-bp的片段成功地破坏了基因组位点nptII通过HR将盒式磁带装进目标的双臂。调查是否PPATG3.在传染媒介开发中的功能p .金属盘,我们检测了7- 56日龄野生型(WT)和PPATG3.敲除植物在正常生长条件下。两者之间存在显著差异PPATG3.敲除和WT植物,突变体显示出越来越过性的衰老表型随着时间的推移(图。2a).叶绿素荧光PPATG3.突变体较野生型弱(图1)。2a).这种早衰现象在56日龄植株中最为显著,表现为叶状配子体的茎段和基叶PPATG3.敲除植物变为黄色(图。2b).此外,在56年生的植物中,新形成的原体要少得多PPATG3.敲除植株与WT植株的比较(图。2b,红圈)。
7日龄时光合产量(Fv/Fm)也有不同PPATG3.与WT植株相比,该突变体的荧光明显降低(图1)。2c).这一发现得到了叶绿素生物合成减少的支持PPATG3.敲除植株:14日龄和28日龄的叶绿素a、叶绿素b和总叶绿素含量均显著降低PPATG3.突变体与WT植株(图。2d)。然而,叶绿素含量在28天龄WT植物中也略低于14天的WT植物,可能是因为在较年轻的植物中存在更多的protonemata。这些结果表明了PPATG3.敲除植株的叶绿素含量比WT更低,导致早熟表型。
PPATG3.功能障碍会影响细胞开发p .金属盘
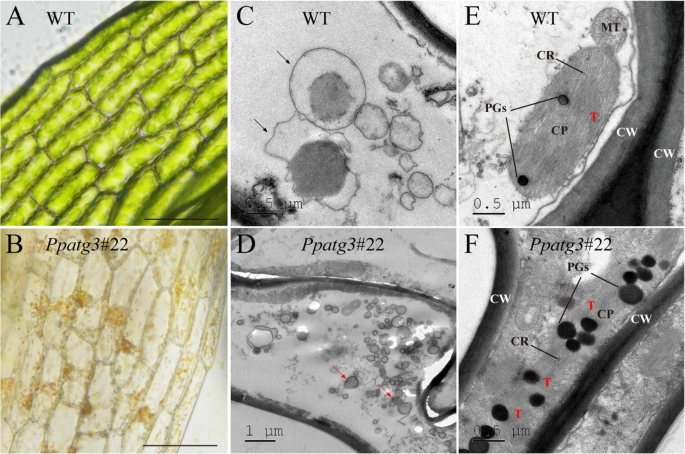
探索如何PPATG3.调控植物衰老,我们检测了野生型和野生型的叶状配子体细胞PPATG3.详细介绍在正常条件下生长的植物。细胞PPATG3.突变体呈空心,呈黄色,而野生型则保持饱满和绿色(图1)。3.a和b).验证删除PPATG3.防止自噬体的形成p .金属盘,我们治疗28天大的WT和PPATG3.用100 mM NaCl处理1 h后,用透射电镜观察。自噬体包含在WT植物中形成的细胞载体(图。3.C),而大量胞质成分积累在突变体由于PPATG3.击倒(无花果。3.d).这些结果表明细胞自噬被破坏PPATG3.突变体。
为了进一步探讨效果PPATG3.在苔藓衰老方面,我们检测了WT和WT的叶绿体PPATG3.细胞。我们观察到叶状配子体细胞的细胞物质密度较高PPATG3.突变体与wt相比(图。3.此外,在突变体中,这些细胞积累了异常高密度的叶绿体PGs;这些脂蛋白颗粒在各种代谢过程中发挥重要作用,如光合调节、类囊体脂质再动员和衰老[33.].叶绿体中PGs密度较高PPATG3.多叶配子体细胞提示PGs积累可能与自噬突变体叶绿素水平降低有关。
C/N比和脂肪酸含量的变化
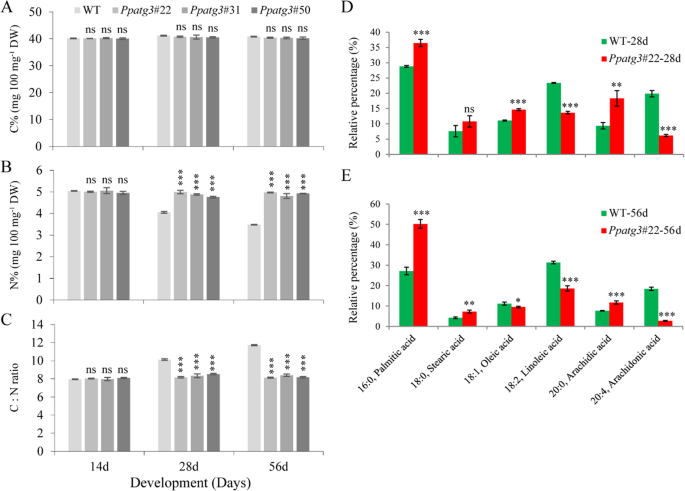
拟南芥自噬突变体的C/N比值降低[29.],脂质代谢在大米中受损osatg7.敲除突变体(11].基于C / N比率和脂肪酸内容物的变化导致早期衰老表型观察到的假设PPATG3.我们测定了WT和C/N的比值PPATG3.在14、28、56天三个时间点的植株(图1)。4a - c)。在第14天,我们没有检测到任何显著差异的C或N浓度或C/N比值PPATG3.敲除和WT植株。然而,在第28天和第56天,PPATG3.植株的C/N明显低于WT,这是由于植株的N含量(N%)较高。总体上,在3个时间点上,WT植株的N%率逐渐下降,而在3个时间点上,N%率保持不变PPATG3.迷人的植物。这些结果表明,水稻对氮的利用是完全不充分的PPATG3.突变体。值得注意的是,C含量(C%)之间没有显著差异PPATG3.敲除和WT植株。
贝克等人[34.]检测到野生型配子体中脂肪酸含量高(%)p .金属盘.在此,我们分析了六种脂肪酸的含量p .金属盘:棕榈酸(16:0)、硬脂酸(18:0)、油酸(18:1)、亚油酸(18:2)、花生酸(20:0)、花生四烯酸(20:4)。我们选择了两个时间点:28天和56天。4d e)。28 d时,3种脂肪酸(棕榈酸、油酸和花生酸)的相对丰度(%)显著升高,2种脂肪酸(亚油酸和花生四烯酸)的相对丰度显著降低PPATG3.同样,56 d时,棕榈酸、硬脂酸和花生酸3种脂肪酸含量显著升高,油酸、亚油酸和花生四烯酸3种脂肪酸相对丰度显著降低PPATG3.vs. wt。相比之下,相对硬脂酸内容物在相对差异之间没有显着差异PPATG3.和WT植物在28天。总的来说,脂肪酸曲线之间显着不同PPATG3.敲除和WT植株。
为了进一步研究自噬缺陷突变体中C / N比和脂肪酸内容物之间的关系,我们进行了脂肪酸补充实验。因为亚油酸和花生素酸内容物显着降低PPATG3.突变体(无花果。4D-E),我们假设这两个脂肪酸在C / N状态下函数p .金属盘.的确,与对照相比,单独或同时向野生型植物补充亚油酸和花生四烯酸,改变了C/N状态,降低了C/N比值2A-C)。相比之下,补充PPATG3.单独添加亚油酸和花生四烯酸的植株对氮的利用率没有提高,同时添加亚油酸和花生四烯酸的植株对氮的利用率降低,碳氮比与野生型植株相似2A-C)。但是,突变体的过早的游戏衰老表型未被脂肪酸补充救出(附加文件2d)。
RNA-Seq鉴别差异表达基因PPATG3.
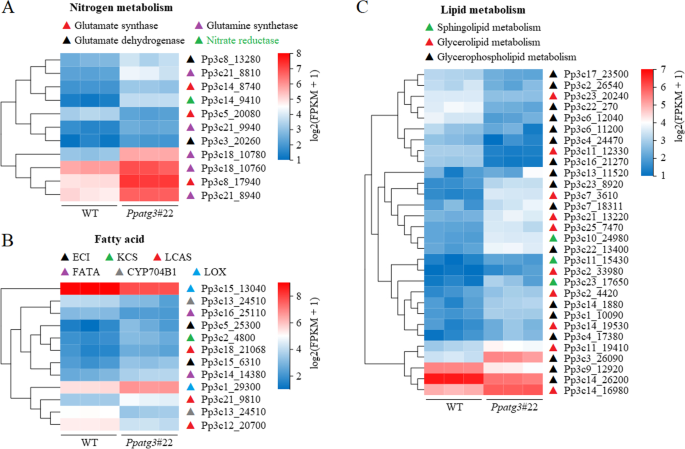
检查ATG3的损失是否会影响基因表达谱p .金属盘,我们分析了全局基因表达模式PPATG3.突变体与WT控制相比,使用BGISEQ-500平台。FPKM≥1的转录本进行进一步分析。主成分分析显示两组间的转录差异极显著PPATG3.和WT植物(附加文件3.A).在所有样本中共检测到23219 / 16564个表达的转录本/基因,其中23139 / 16503个转录本/基因在两者中均有表达PPATG3.和WT植物,45/38独特转录本/基因PPATG3.WT中35/23个独特转录本/基因(附加文件3.B和附加文件4).使用的标准p -值≤0.001和表达fold change > 2鉴定差异表达转录本/基因(DETs/DEGs),比较PPATG3.WT检测出3080/2634 DETs/DEGs。其中,1845/1621 DETs/ deg和1235/1013 DETs/ deg表达上调和下调PPATG3.vs. WT(附加文件5).
然后,我们鉴定了上调和下调DETs/DEGs的前20个KEGG通路问值≤0.05(附加文件3.D-E和附加文件6).在上调和下调的DETs/DEGs中,富集的途径均为生物合成代谢途径,大致可分为五大功能类:碳水化合物代谢、能量代谢、氨基酸代谢、辅助因子和维生素代谢以及全球途径。值得注意的是,氮代谢途径显著丰富(附加文件3.D),这可能与土壤中N含量的变化有关PPATG3.突变体。
在拟南芥中,衰老相关基因(SAGs)的差异表达和光合能力减弱与植物衰老有关[35.].值得注意的是,大量与叶绿素生物合成和光系统相关的基因被下调PPATG3.vs. WT(附加文件7).此外,有一半的sag(11 / 22)显著上调PPATG3.与WT(附加文件7).这些结果为黄酮的加速衰老过程提供了证据PPATG3.突变体。
氮和脂肪酸/脂质代谢相关基因的转录发生改变PPATG3.突变体
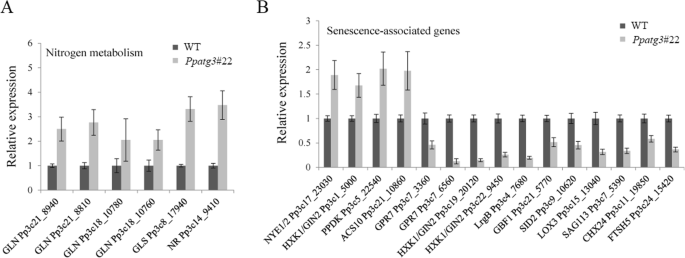
目的:进一步探讨肝细胞内N、脂肪酸代谢紊乱的原因PPATG3.,我们比较了氮和脂肪酸/脂代谢相关基因转录水平的差异。11个基因中有10个显著上调,包括谷氨酰胺合成酶(GLN)、谷氨酸合成酶(GLS)、硝酸还原酶(NR)和谷氨酸脱氢酶(GDH)相关基因(图5)。5a和附加文件8).这些结果表明,氮代谢途径存在缺陷PPATG3.,导致参与氮代谢的基因表达差异。这一现象可能是由于氮素利用不足导致的氮相关脱氢酶的反馈调控所致PPATG3.突变体。但上调这些基因的表达并不能恢复氮利用效率,说明自噬对氮利用的调控机制更为复杂。
氮代谢和脂质/脂肪酸代谢相关基因的差异表达PPATG3.植物。一个-c对WT和WT中与氮代谢和脂质/脂肪酸代谢相关的基因子集进行转录分析PPATG3..表达水平显示为log2(FPKM+ 1)值。对3个生物重复进行分析。每个基因的详细信息在附加文件中提供8
此外,12个与脂肪酸生物合成和代谢相关的基因在突变体中显著差异表达,包括7个上调基因和5个下调基因(图5)。5b和附加文件8).一个上调的基因,脂氧合酶同源基因(LOX5;Pp3c1_29300),可能参与亚油酸代谢;其较高的表达水平与中亚油酸含量的降低一致PPATG3..然而,另一个脂氧合酶同源基因(LOX3;Pp3c15_13040)可能参与花生四烯酸代谢,在突变体中表达下调,其表达水平降低可能与中花生四烯酸含量降低无关PPATG3..与脂质代谢相关的30个基因中,有19个基因表达显著上调PPATG3.,包括涉及甘油脂、甘油磷脂和鞘脂代谢的基因(图。5C和附加文件8).
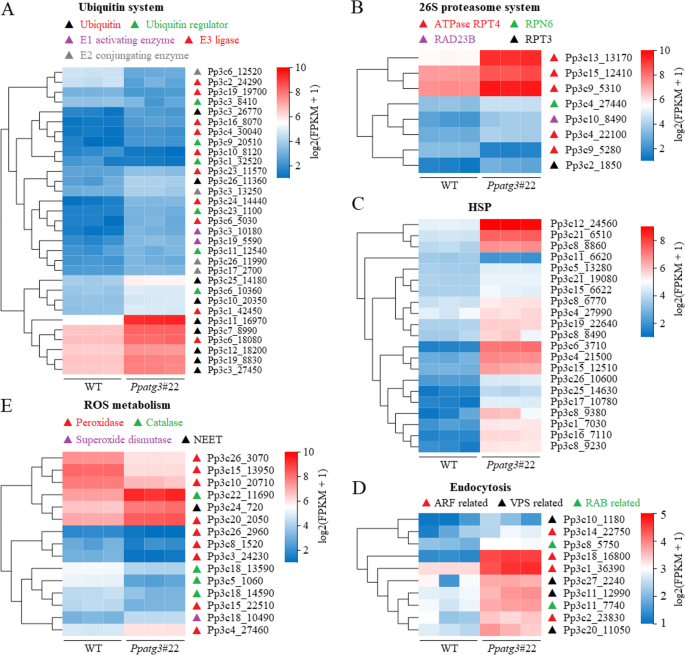
功能障碍自噬导致蛋白质代谢,内吞作用和相关基因的差异转录
在31个泛素相关基因中,有25个显著上调PPATG3.突变体与WT(图。6a和附加文件8).这些高表达基因编码的蛋白质包括泛素蛋白或调控因子、泛素激活酶(E1)、泛素偶联酶(E2)和泛素连接酶(E3)。此外,26S蛋白酶体系统的基因转录被突变体中调控基因亚群的上调激活(图5)。6b和附加文件8).这些结果表明,由于自噬缺损,在突变体中增强了泛素蛋白-26s蛋白酶体途径(UPP)的活性。
与蛋白质代谢相关的子集基因的转录谱,ROS代谢和内吞作用PPATG3.植物。一个-c泛素、26S蛋白酶体、HSP相关基因差异表达。d与内吞作用相关的差异表达基因。e与ROS代谢相关的差异表达基因。表达水平显示为log2(FPKM+ 1)值。对3个生物重复进行分析。每个基因的详细信息在附加文件中提供8
热休克蛋白(HSPs)在防止蛋白质的错误折叠和阻止严重阻碍细胞功能的大蛋白聚集物的形成方面发挥着重要作用[36.].编码HSP /伴侣的许多基因(21个)的转录物水平显着提高PPATG3.比WT(图。6C和附加文件8),这表明在突变体中,热休克蛋白/伴侣蛋白能够激活错误折叠蛋白聚集物的分解,从而维持适当的蛋白构象,延长细胞寿命。
此外,在突变体中,与吞入途径相关的10个基因显著上调(图。6d和附加文件8);该途径参与细胞表面蛋白质和细胞脂肪酸/脂类的招募和降解,以支持基本的细胞功能[37.,38.].然而,与与蛋白质代谢和内吞作用有关的高表达的基因相反,突变体中,大多数ROS代谢相关基因(10个)的转录物水平显着降低,包括分别编码过氧化物酶和过敏酶的7和3个基因(如图。6e和其他文件8),可能导致活性氧(ROS)的积累和受损或有毒物质的产生PPATG3.突变体。
RT-qPCR对DEGs的验证
最后,为了验证RNA-Seq所示的基因表达模式,我们使用与RNA-Seq分析相同的mRNA样本,对21个DEGs、15个同源SAGs和6个与氮代谢相关的基因进行了RT-qPCR分析。这些基因包括若干与氮代谢相关的基因,包括与氮代谢相关的同源基因GLN.(Pp3c21_8940, Pp3c21_8810, Pp3c18_10780, Pp3c18_10760),格尔斯(Pp3c8_17940)和NR(Pp3c14_9410)(图。7a).我们还鉴定出4个和11个SAG同源基因在中分别上调和下调PPATG3.淘汰赛植物(图。7B),包括同源物NYE1/2(Pp3c17_23030),HXK1 / GIN2.(Pp3c1_5000, Pp3c19_20120, Pp3c22_9450)PPDK(Pp3c5_22540),ACS10(Pp3c21_10860),GPR7.(Pp3c7_3360和Pp3c7_6560),LRGB.(Pp3c4_7680),GBF1(PP3C21_5770),SID2(Pp3c9_10620),LOX3(PP3C15_13040),SAG113(Pp3c7_5390),CHX24(Pp3c11_19850)和FTSH5(Pp3c24_15420)。检测的所有基因的表达模式与RNA-Seq分析获得的表达模式相似。
讨论
自噬在植物发育和衰老过程中起着重要作用,是维持细胞基本功能和生命活动的普遍过程[3.,7,19].广泛的研究表明,自噬对氮的利用很重要[26.,27.,28.,29.]、脂肪酸/脂质稳态[13,14,15]受损叶绿体的降解[16,17或聚合蛋白[18]在植物中。虽然先前的研究表明,自噬对维持氨基酸代谢的平衡至关重要p .金属盘[30.],这一过程如何调节苔藓的C/N状态和脂肪酸代谢在很大程度上是未知的。在这里,我们证实了在组织中广泛表达的e2样酶PpATG3(图。1a),并定位于细胞质(图。1b),对自噬和正常植物开发至关重要p .金属盘.因此,PPATG3.突变体在正常培养基上培养7 ~ 56天,叶片配子体明显早衰(图。2a)和减少新的原丝形成(图。2b)与在相同条件下种植的WT植物相比。
叶片早衰老是拟南芥自噬突变体的主要表型[19,39.].因此,我们检测了一些生理和代谢标记物,并进行转录组分析PPATG3.在叶形传染率过早衰老的外观突变体。在培养7天后,检测到泛黄和薄弱的叶绿素荧光PPATG3.(无花果。2a),这与该突变体Fv/Fm值显著降低相一致(图5)。2c).在此时间点之后,观察到更严重的黄变,说明PPATG3.确实是过早衰老。实际上,叶绿素含量明显较低PPATG3.突变体比野生型(图。2d)。此外,PPATG3.细胞呈空心黄色。3.(a和b),这伴随着自噬体形成的缺陷,导致大量胞质物的积累(图。3.c和d)。这些结果表明,该自噬突变体存在生理缺陷,导致早熟衰老表型。
生理缺陷PPATG3.植株在培养后期,即28和56 d时更严重。在第14天,突变体的Fv/Fm值和叶绿素生物合成已经显著降低(图。2c和d),但N含量和c /N比值在WT和d之间没有显著差异PPATG3.植物(图。4a - c)。相比之下,在第28天PPATG3.突变体不仅表现出光合能力下降(图。2c和d),但它们也表现出氮代谢功能紊乱,导致c /N比值降低(图。4a - c)。一个自噬缺陷的拟南芥突变体表现出降低的N水平,导致更高的C/N比率[29.].相比之下,C / N比率下降PPATG3.与野生型植株相关的突变体明显与28天和56天的氮代谢功能失调有关(图。4a - c)。这些结果表明,自噬对氮代谢的影响是不同的p .金属盘和A. Thaliana..
叶绿体PGs是一种脂蛋白比高的脂蛋白颗粒,在植物衰老过程中其数量增加,在叶绿体生物发生中起作用[33.].据估计,植物叶片中75-80%的总氮含量储存在叶绿体中[40.].在本研究中,我们观察到叶状配子体细胞中含有高浓度的PGs的不规则叶绿体PPATG3.但WT植物除外(图。3.e-f)。叶绿素合成和氮代谢的缺陷可能是造成该突变体叶绿体发育缺陷的原因之一。拟南芥叶绿体在正常衰老过程中积累了PGs,这是有规律的[33.];然而,叶绿体积累的PGsPPATG3.看起来有损伤,形状不规则。也许是自噬的缺陷PPATG3.突变体破坏了不必要或损坏的叶绿体的降解和周转过程,导致PGs的积累和叶绿体形状异常,从而导致叶绿素水平降低。
自噬在拟南芥、玉米等维管植物的脂质/脂肪酸代谢、组成和转化中起着重要作用[13,14].此外,在水稻中,在自噬突变体的花粉成熟过程中,脂质代谢如三酰基甘油(TAGs)和二酰基甘油(DAGs)的代谢受损[11].脂肪酸是tag和DAGs的重要组成部分[41.];然而,自噬在苔藓脂肪酸代谢中的潜在作用尚未见报道。在本研究中,我们发现自噬的缺失影响了六种脂肪酸的相对水平,导致它们的代谢受损(图。4d e)。其中亚油酸(18:2)和花生四烯酸(20:4)的相对含量显著降低PPATG3.突变体。与WT相比,同时添加亚油酸和花生四烯酸(而不是单独添加)能恢复突变体的C/N比(附加文件2A-C),提示突变体N代谢中断可能与脂肪酸含量降低有关。这些结果提示,早衰老表型PPATG3.部分原因是氮利用率下降和脂肪酸含量不平衡。然而,补充脂肪酸并不能缓解配子体过早衰老2D),表明自噬依赖的衰老除了受C/N比和脂肪酸代谢的影响外,还受其他因素的影响,这是一个值得进一步研究的问题。
在正常的衰老过程中,脂肪酸积累在叶绿体PGs中,叶绿素和脂类被广泛降解[42.].在水稻中,衰老伴随着叶绿体PGs数量的增加和脂肪酸含量的显著变化,特别是棕榈酸(16:0)水平的增加[43.].同样,在当前的研究中,我们观察到PPATG3.突变体含有异常高的叶绿体PGs(图。3.e和f)和高含量棕榈酸(16:0)(图。4d和e),与之前的报告一致。除此之外PPATG3.突变体含有28-和56天植物中的WT的另一种脂肪酸(20:0)含量显着较高的脂肪酸(20:0)(图。4然而,硬脂酸(18:0)和油酸(18:1)这两种脂肪酸的水平在第28天和第56天表现不同(图。4这些结果表明,自噬依赖衰老过程中脂肪酸含量的变化也可能与叶绿体中PG的积累有关,这可能是自噬突变体生理缺陷的部分原因。
此外,RNA-Seq显示ATG3缺失p .金属盘显着改变的转录物丰度/基因表达(附加文件3.).对前20个富集的KEGG途径的分析表明,突变体的生物合成和代谢途径受到严重影响(补充文件3.D-E和附加文件6).与预期的一样,氮代谢途径显著富集(附加文件3.d)通过氮素相关基因子集的差异表达(图。5a),可能与土壤中N含量有关PPATG3.突变体。此外,与脂肪酸/脂质代谢相关的许多基因在突变体与野生型中表达显著差异(图。5B和C),这可能与脂肪酸内容物的变化和由于缺陷的自噬引起的过早衰老有关。功能障碍自噬导致与UPP和HSP相关的基因的转录增加,该现象也发生在内吞作用相关基因中(图。6模拟)。这些发现表明,在肝脏中,不必要的蛋白质或脂肪酸/脂类的降解被促进PPATG3.突变体的循环利用,以支持基本的细胞功能和延长寿命。然而,在突变体中,ROS代谢相关基因的一个亚群显著下调(图。6e和其他文件8),这可能导致由ROS积累产生的受损或有毒物质产生的衰老PPATG3..
如拟南芥所述[35.],大量与SAGs、叶绿素生物合成和光系统相关的基因差异表达PPATG3.与野生型植株相比,表明衰老过程在早期就开始了PPATG3.突变体(附加文件7).例如,p .金属盘同源染色体的NYE1/2和PPDK被上调了PPATG3.突变体,如RNA-SEQ分析和RT-QPCR验证所证明。NYE1/2和PPDK编码叶绿素降解和氮再活化的重要调节因子,分别在绿色叶片衰老过程中起作用[44.,45.,46.)(附加文件7和无花果。7b).这些结果表明,叶绿素降解和氮素利用机制可能在自噬缺陷衰老和正常绿叶衰老之间存在一定程度的保守。然而,一些p .金属盘下垂同源物,如SAG113,被下调PPATG3.突变体(附加文件7和无花果。7B),指出自噬缺陷衰老与正常绿叶衰老的调节机制可能存在差异。
近期的酵母研究表明,ATG3变构激活开关元件E123IR在去除用E1样酶ATG7和E3样酶ATG12-ATG5络合物中除去ATG3的分子间相互作用以改组ATG3的活性位点,从而介导ATG8-PE在自噬过程中的脂质反应[47.].与预期的一样,Y2H检测结果显示PpATG3与PpATG7和PpATG12有很强的相互作用p .金属盘(附加文件9),表明ATG3与ATG7和ATG12的相互作用网络可能是保守的。然而,ATG3与植物中E1-或e3 -类酶的确切相互作用机制是否与酵母中发现的相同,还有待进一步研究。
综上所述,早衰表型是由PPATG3.基因敲除受到一系列复杂代谢途径的影响,包括N的利用、脂肪酸/脂质代谢、受损的叶绿体降解、ROS去除以及自噬破坏导致的不必要蛋白质的循环利用。然而,自噬在这些生理缺陷中作用的确切机制应该在未来得到更充分的阐明。
结论
我们的分析p .金属盘自噬是一种新兴的自噬研究模式,它为自噬在预防植物衰老中的作用提供了新的视角。我们的结果支持PPATG3.在自噬小体的形成。自噬缺陷突变体PPATG3.在非胁迫条件下,缺失配子体导致配子体过早衰老,这可能与氮代谢受损有关。我们也为自噬在脂肪酸代谢中的作用提供了证据。的PPATG3.突变体亚油酸和花生四烯酸水平降低,同时棕榈酸和花生四烯酸水平升高。同时补充亚油酸和花生四烯酸可恢复突变体的N含量,但不能促进其过早衰老,这表明自噬依赖的长寿机制更为复杂。我们的结果也表明,许多生物合成和代谢途径基因的差异表达在过早衰老中发挥了作用PPATG3.自噬缺陷导致突变。这些结果表明PPATG3.在正常生长条件下,通过起自噬作用,直接或间接影响C/N稳定性和脂肪酸代谢,以及叶绿体受损降解和不必要的蛋白质循环等多种生物合成代谢途径,从而防止植物过早衰老,延长植物寿命。
方法
植物材料、生长条件和苔藓转化
Physcomitrella金属盘Gransden野生型植物由日本国家基本生物学研究所Mitsuyasu Hasebe教授提供。植物在补充有5mM酒石酸铵和1mm CaCl的BCD培养基上生长2[48.在光周期为16 h,光子通量为60 ~ 80 μmol m的条件下,在25°C下进行- 2年代- 11到8周。为了产生质子组织,植物材料被ULTRA-TURRAX®试管驱动器压碎在5毫升无菌水中,并在BCD培养基上繁殖。用镊子将7日龄原核组织(1-2 mm)的小外植体接种到新鲜培养基中以保持培养。Shi和Theg先前描述了聚乙二醇(PEG)介导的原生质体转化以实现基因瞬时表达或基因稳定缺失[49.].
蛋白质序列比对,基序及系统发育分析
基因的全长蛋白序列PPATG3.(pp3c8_11900),KNATG3.(GAQ83284),肉豆蔻(ME000344S06021),aaatg3.(AANG000634),MpATG3(Mapoly0003s0208),BdATG3(Bradi3g33350)AtATG3(AT5G61500),MmATG3(NP_080678),HsATG3(NP_071933)和ScATG3(YNR007C)分别来自Phytozome、NCBI和SGD数据库。利用ClustalX2.0对多个蛋白序列进行比对获得ALN文件[50],以及ScATG3 (PDB ID: 2DYT)的晶体结构[21.]用于通过Web工具ESPRIPT 3.0进行二次结构描述[51].域和主题搜索由SMART执行[52和MEME SUITE [53),分别。系统发育树由MEGA 6进行[54]使用邻居加入(NJ)方法。
微阵列表达分析
基于前期数据分析PpATG3基因在不同组织中的表达值[32.] 的p .金属盘.共获得10个组织,包括原丝体(绿线体和球茎体)、配子体、颈卵器、4个孢子体发育阶段(S1、S2、S3和M)、孢子和根状结构。
PpATG3的亚细胞定位
的全长编码序列(缺少终止密码子)PPATG3.PCR扩增自p .金属盘使用引物PPATG3-F和PPATG3-R的cDNA模板(附加文件10).用PCR方法克隆得到的921 bp片段KpnI和XBai.限制性内切酶(Thermo Scientific FastDigest, FD0524和FD0684)进入载体pM999 [55通过粘端结扎。pM999包含由35S启动子驱动的eGFP编码序列。嵌合基因p35区域:PpATG3-eGFP是通过熔合PPATG3.CDNA序列到EGFP的5'端框架。此后,将所得质粒引入原生质体中p .金属盘通过peg介导的转化[48.].25°C培养48 h后,用共聚焦显微镜观察原生质体的GFP荧光。
PPATG3.基因的破坏
5’和3’侧翼区(分别为863 bp和800 bp)PPATG3.分别用2对引物P1/P2和P3/P4扩增基因。分别用KpnI/HindIII和XbaI/BamHI (Thermo Scientific FastDigest, FD0524, FD0504, FD0684和FD0054)对两个片段进行酶切,并依次克隆到pTN182载体的上游和下游nptIIPm35S启动子驱动的基因(耐药基因盒)(http://moss.nibb.ac.jp/).Construct被线性化KpnI和BamHI之前转换。如前所述,已完成转换[48.].基因分型的引物PPATG3.基因敲除可在附加文件中找到10.PpUbiquitin[56),PpAdePRT[57]分别评估DNA和cDNA模板质量。
叶绿素荧光和叶绿素含量分析
用成像PAM FluorImager和Imaging Win软件监测叶绿素荧光价值。在确定FV / FM之前,培养物是深色适应至少30分钟。使用DMF(N,N-二甲基甲酰胺)如前述从培养物中分离叶绿素[58].以DMF为空白,测定上清液647和664处的吸光度。叶绿素a (mmol/g) = [(12 × A664 - 3.11 × A647) × mL DMF] / mg干重和叶绿素b (mmol/g) = [(20.78 × A647 - 4.88 × A664) × mL DMF] / mg干重计算总叶绿素含量(叶绿素a +叶绿素b)。
表型观察
用于记录WT和PPATG3.植株,培养物在正常条件下生长7 ~ 56天。光镜下观察到多叶配子体。用透射电镜观察PPATG3.突变体。28日龄WT和WT的配子体PPATG3.植物在3%戊二醛中固定过夜,然后在1%四氧化锇(OsO4)中固定2 h,在连续乙醇梯度中脱水,Epon 812树脂包埋。样品固定在4℃。用Leica EM UC7超微切片机对配子体叶细胞进行了连续、均匀的切片,切片厚度约为70 nm。切片置于100目铜栅格上,然后依次用2%醋酸铀酰溶液和柠檬酸铅染色。然后在JEM 1400Plus显微镜下12万伏观察切片。检测野生型和野生型的自噬体PPATG3.用100 mM NaCl处理28日龄突变体植株1 h后,进行透射电镜观察。
碳、氮含量测定
收集植株,在100°C的烘箱中干燥10 h。然后将亚样品磨成均匀的细粉末,用Elementar vario Micro cube全自动碳氮分析仪在锡胶囊中仔细测量,建立碳氮含量。
脂肪酸含量分析
在这项研究中,1克苔藓组织wt和PPATG3.用植物进行脂质提取。然后利用样品进行甲基酯化,详细方法如前所述[34.].脂肪酸含量采用Agilent Technologies 7890A气相色谱-质谱分析仪测定。用MSD ChemStation软件进行峰识别和脂肪酸分析。
脂肪酸补充
对于脂肪酸的补充,21日龄的WT和PPATG3.将生长在正常BCD培养基上的植株转移到加20 μg/ml亚油酸(上海元叶,DC14635400)的BCD培养基上或加20 μg/ml花生四烯酸(上海元叶,B20540)的BCD培养基上7天,或同时加相同浓度的亚油酸和花生四烯酸培养基上7天。作为对照,21日龄的WT和PPATG3.将正常BCD培养基上生长的植株转移到含0.1% DMSO的BCD培养基中,培养7天。
rna测序和数据分析
WT和PPATG3.植株在BCD培养基上生长28d。采用RnaExTM溶液(Generay)提取全株总RNA。cDNA文库构建、测序和数据分析由中国武汉华大基因科技有限公司建立的BGISEQ-500平台进行。reads比对和表达水平计算采用Bowtie 2 [59]及RSEM [60),分别。具有至少两倍变化的差异表达转录本/基因p-value≤0.001作为进一步分析[61].采用R程序princomp、phyper和pheatmap分别进行PCA分析、KEGG通路富集和热图构建。本研究的RNA-Seq数据保存在BIG基因组序列档案馆(GSA),生物项目标识符为PRJCA001964,登录号为SAMC116811至SAMC116814。
RNA分离与实时定量PCR
RNAextm解决方案(Generay)用于总RNA提取。通过逆转录试剂盒(转基因)合成第一链cDNA。如前所述进行实时定量PCR(RT-QPCR)[62].本研究中使用基因表达分析的引物可以在附加文件中找到10.使用相对表达水平使用PpAdePRT[57作为表达控制。
Y2H分析
为了确定PpATG3和PpATG7 (Pp3c24_8100)或PpATG12 (Pp3c4_29920)之间的蛋白相互作用,我们进行了Y2H分析(Clontech)。本研究扩增PpATG3基因CDS并克隆到诱饵载体pGBKT7 (BD)中,同时扩增PpATG7或PpATG12基因CDS并克隆到猎物载体pGADT7 (AD)中。Y2H的测定由Frozen-EZ酵母转化II试剂盒(Zymo Research)进行。本研究中用于Y2H检测的引物列于附加文件10.
可用性数据和材料
本研究中产生或分析的所有数据均包含在本文及附加文件中。原始文件的数字可以在附加文件中找到11和12.其他数据可根据合理要求从通讯作者处获得。RNA-Seq原始数据提交至GSA数据库,生物项目ID: PRJCA001964,登录号SAMC116811至SAMC116814 (https://bigd.big.ac.cn/gsa/).
缩写
- 阿格:
-
自噬
- 半胱氨酸:
-
半胱氨酸
- 减少:
-
Senescence-associated基因
- WT:
-
野生型
- PGS:
-
Plastoglobuli
- ROS:
-
活性氧
- UPP:
-
Ubiquitin-26S蛋白酶体通路
- DETS:
-
差异表达成绩单
- 度:
-
差异表达基因
- FPKM:
-
每千碱基中的片段每百万片段
- KEGG:
-
京都基因和基因组百科全书
- 透射电镜:
-
透射电子显微镜法
- RT-QPCR:
-
实时定量聚合酶链反应
参考文献
- 1.
Klionsky DJ Yang Z。活吃:巨噬细胞自噬的历史。Nat Cell Biol. 2010; 12:814-22。
- 2。
自噬、植物衰老和营养物质循环。实验机器人。2014;65:3799-811。
- 3。
Üstün S, Hafrén A, Hofius D.自噬在植物中的作用。植物生物学杂志。2017;40:122-30。
- 4.
Masclaux-Daubresse C, Chen Q, Havé M.通过自噬调节营养循环。植物生物学杂志。2017;39:8-17。
- 5.
Liao CY, Bassham DC。抗应激:植物激素信号与自噬的相互作用。实验机器人。2020;71:1723-33。
- 6.
王平,Mugume Y, Bassham DC。植物自噬的新进展:调节、选择性和功能。Semin Cell Dev Biol. 2018; 80:113-22。
- 7.
Bassham DC, Laporte M, Marty F等。植物发育中的自噬和胁迫反应。自噬。2006;2(1):2 - 11。
- 8.
谢Z,Klionsky DJ。自噬体组:核心机械和适应。NAT细胞BIOL。2007; 9:1102-9。
- 9.
刘y,xiong y,bassham dc。植物中干旱和盐压力的耐受性需要自噬。自噬。2009; 5:954-63。
- 10.
Daudi A,Cheng Z,O'Brien Ja,等。妊娠氧化爆发过氧化物酶拟南芥是模式触发免疫的主要成分。植物细胞。2012;24:275 - 87。
- 11.
Kurusu T, Koyano T, Hanamata S等。osatg7.是水稻减数分裂后花药发育中自噬依赖的脂质代谢所必需的。自噬。2014;10:878 - 88。
- 12.
王颖,于斌,赵娟,等。自噬有助于叶淀粉的降解。植物细胞。2013;25:1383 - 99。
- 13。
Havé M, Luo J, Tellier F, et al.;蛋白质组学和脂质组学分析拟南芥atg5自噬突变体揭示了内质网和过氧化物酶体代谢和脂质组成的主要变化。新植醇。2019;223:1461 - 77。
- 14。
Mcloughlin F,奥古斯丁RC,Marshall Rs等。玉米多OMICS揭示蛋白质组重塑和脂质周转中自噬回收的作用。Nat植物。2018; 4:1056-70。
- 15.
Masclaux-Daubresse C, d'Andrea S, Bouchez I, Cacas JL。储备脂质和植物自噬。实验机器人。2020;71:2854-61
- 16.
otegui ms。叶绿体组分的真空降解:自噬及超越。J Exp Bot。2018; 69:741-50。
- 17.
伍德森jd。叶绿体应力信号:调节细胞降解和叶绿体周转。CurrOp植物BIOL。2019; 52:30-7。
- 18.
yu l,chen y,太过Sa。自噬途径:细胞和分子机制。自噬。2018; 14:207-15。
- 19.
白野等。叶片的衰老和饥饿引起的褪绿,加速了破坏拟南芥自噬基因。植物杂志。2002;129:1181 - 93。
- 20.
Ichimura Y,Kirisako T,Takao T等人。泛素状的系统介导蛋白质脂质。自然。2000; 408:488-92。
- 21.
山田洋,Suzuki NN, Hanada T,等。的晶体结构ATG3.,一种介导自噬相关泛素载体蛋白(E2)的酶ATG8.lipidation。生物化学杂志。2007;282:8036-43。
- 22.
Sakoh-Nakatogawa M,Kirisako H,Nakatogawa H,Ohsumi Y.本地化ATG3.自噬相关膜及其增强由ATG8.-家族相互作用基序促进细胞膜的扩张。2月。2015;589:744-9。
- 23.
Besteiro S, Brooks CF, Striepen B, Dubremetz JF。自噬蛋白ATG3.是维持线粒体完整性和正常细胞内发育所必需的吗刚地弓形虫个速。公共科学图书馆Pathog。2011;7 (12):e1002416。
- 24.
韩胜,王勇,郑鑫,等。细胞塑料甘油醛-3-磷酸脱氢酶相互作用ATG3负向调节细胞自噬和免疫烟草benthamiana.植物细胞。2015;27:1316-31。
- 25.
刘毅,Bassham DC。自噬:植物细胞中自噬的途径。植物生物学杂志。2012;63:215-37。
- 26.
Guiboileau A, Yoshimoto K, Soulay F, Bataillé MP, Avice JC, Masclaux-Daubresse C.自噬机制在限制和充足的硝酸盐条件下控制整个植物水平的氮再流动拟南芥.新植醇。2012;194:732-40。
- 27.
陈Q,Shinozaki D,Luo J,等。植物中的自噬和营养管理。细胞。2019; 8:1426。
- 28.
自噬:散装和选择性回收的大师。植物生物学杂志。2018;69:173-208。
- 29.
guboileau A, Avila-Ospina L, Yoshimoto K等。自噬缺乏对氮和蛋白质资源管理的生理和代谢后果拟南芥叶片取决于硝酸盐的有效性。新植醇。2013;199:683 - 94。
- 30.
Mukae K,Inoue Y,Moriyasu Y.ATG5敲除突变体的Physcomitrella为分析自噬参与植物细胞衰老过程提供一个平台。植物信号处理研究进展。2015;10(11):e1086859。
- 31.
Sanchez-Vera V, Kenchappa CS, Landberg K等。苔藓中配子分化需要自噬Physcomitrella金属盘.自噬。2017; 13:1939-51。
- 32.
Ortiz-Ramírez C, Hernandez-Coronado M, Thamm A等。转录组图谱Physcomitrella金属盘提供对陆地植物的进化和发展的见解。摩尔。2016;9:205-20。
- 33.
Van Wijk KJ,Kessler F.Plastoglobuli:塑体微量组分,具有新陈代谢,塑性发育过渡和环境适应的综合作用。Annu Rev植物Biol。2017; 68:253-89。
- 34.
Beike Ak,Jaeger C,Zink F,Decker El,Reski R.在不同苔藓物种中非常长链多不饱和脂肪酸的高含量。植物细胞代表2014; 33:245-54。
- 35.
关键词:H3K27me3,去甲基化酶,H3K27me3REF6通过直接激活叶中主要衰老调控基因和功能基因来促进叶片衰老拟南芥.公共科学图书馆麝猫。2019;15 (4):e1008068。
- 36.
关键词:热休克蛋白/伴侣网络;植物生物技术2017;15:05 - 14。
- 37。
植物的内吞作用及其调控。植物学报,2015;20:388-97。
- 38。
Jaishy B,Abel Ed。脂质,溶酶体和自噬。J Lipid Res。2016; 57:1619-35。
- 39。
Doelling JH, Walker JM, Friedman EM, Thompson AR, Vierstra RD. TheAPG8/12激活酶APG7需要适当的营养回收和衰老所必需的拟南芥.生物化学杂志。2002;277:33105-14。
- 40.
关键词:小麦,氮营养,叶绿体,线粒体,分配abstract:植物杂志。1991;96:355 - 62。
- 41.
Durrett TP,Chning C,Ohlrogge J.植物三酰基甘油作为生产生物燃料的原料。工厂J. 2008; 54:593-607。
- 42.
Tevini M, Steinmüller D.塑料球的组成和功能:山毛榉叶片衰老过程中叶片和塑球的脂质组成。足底。1985;163:91-6。
- 43.
张明平,张成军,于光辉,等。超高产杂交稻及其亲本生殖期旗叶叶绿体超微结构、类囊体膜脂肪酸组分及叶绿素a荧光瞬态变化植物生理学杂志。2010;
- 44.
Ren G, An K, Liao Y,等。一种新的叶绿体蛋白的鉴定AtNYE1调节叶片衰老过程中的叶绿素降解拟南芥.植物杂志。2007;144:1429-41。
- 45.
等。胞质丙酮酸、磷酸二激酶在叶片衰老过程中发挥氮再流动的作用,并限制个体种子的生长和氮含量。植物j . 2010; 62:641-52。
- 46.
吴松,李忠,杨磊,等。NON-YELLOWING2(NYE2.),类似于NYE1.,在拟南芥的叶绿素降解中起积极作用。摩尔。2016;9:624-7。
- 47.
郑y,秋y,grace crr,liu x,klionsky dj,schulman ba。自噬E2中的开关元件ATG3.通过脂质级联调节变构。Nat Commun。2019;10:3600。
- 48.
刘L,McNeilage RT,Shi LX,SM。叶绿体蛋白质进口的ATP要求由km为ATP水解的基质Hsp70在Physcomitrella金属盘.植物细胞。2014; 26:1246-55。
- 49.
shi lx,sm。基质热休克蛋白70系统在苔藓中进口蛋白质进口叶片Physcomitrella金属盘.植物细胞。2010;22:205-20。
- 50。
李建平,李建平,等。Clustal W和Clustal X版本2.0。生物信息学。2007;23:2947-8。
- 51.
用新的ENDscript服务器解读蛋白质结构的关键特征。核酸杂志2014;42:W320-4。
- 52.
Letunic I, Bork P. 20年SMART蛋白域注释资源。核酸图谱2018;46:D493-6。
- 53.
Bailey TL,Boden M,Buske Fa,等。MEME SUITE:主题发现和搜索的工具。核酸RES。2009; 37:W202-8。
- 54.
Tamura K, Stecher G, Peterson D, Filipski A, Kumar S. MEGA6:分子进化遗传学分析6.0版。中国生物医学工程学报,2013;
- 55.
濮兴,杨玲,刘玲,等。MYB转录因子超家族的全基因组分析Physcomitrella金属盘.国际分子科学杂志。2020;21:975。
- 56.
艾莉亚D,卡普尔S,卡普尔M。Physcomitrella金属盘DNA甲基转移酶2需要从盐和渗透胁迫中恢复。2月j . 2016; 283:556 - 70。
- 57.
关键词:内参基因,RT - qPCR,结构特异性,激素调控Physcomitrella金属盘配子体。Plos一个。2013; 8:E70998。
- 58.
杨晓东,李建军,李建军。一种利用N, N-二甲基甲酰胺测定浮游植物叶绿素的新方法。日本海洋学会学报,1990;46:19 19 - 19。
- 59.
Langmead B, Salzberg SL.快速缺口读对齐领结2。Nat方法。2012;9:357-9。
- 60.
Li B,杜威CN。RSEM:具有或不具有参考基因组的RNA-SEQ数据的准确转录物定量。BMC生物信息学。2011; 12:323。
- 61.
关键词:DEGseq, RNA-seq,差异表达基因,R包引用本文:生物信息学。2010;26:136-8。
- 62.
徐W,陈泽,艾哈迈德N,汉B,崔Q,刘A. Gras基因家族在蓖麻籽中的基因组鉴定,进化分析和应力反应。int j mol sci。2016; 17:1004。
确认
感谢Hasebe Mitsuyasu教授提供苔藓孢子和pTN182质粒,也感谢Wu Jianqiang教授提供pM999质粒。
资金
这项工作得到了中国国家自然科学基金(No.31971410)和云南省博士基金(No. y732681261)的支持。资金机构在研究的设计中没有作用,数据的集合,分析和解释以及写作稿件。
作者信息
从属关系
贡献
ZC和WW同样为这项工作贡献。ZC和WW执行了实验,写了稿件并分析了数据。XP,XD和PL致力于苔藓转型。LL设计了实验,监督了研究,并修改了稿件。所有作者讨论了该项目并批准了稿件。
相应的作者
伦理宣言
伦理批准和同意参与
不适用。
同意出版物
不适用。
利益争夺
作者们宣称他们没有相互竞争的利益。
额外的信息
出版商的注意
《自然》杂志对已出版的地图和附属机构的管辖权主张保持中立。
权利和权限
开放访问本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料包括在文章的创作共用许可中,除非在材料的信用线中另有说明。如果材料没有包含在文章的创作共用许可证中,而您的预期使用不被法律法规允许或超过允许的使用,您将需要直接获得版权持有人的许可。如欲浏览本许可证的副本,请浏览http://creativecommons.org/licenses/by/4.0/.“创作共用公共领域”豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用这篇文章
陈卓,王伟,蒲新。et al。综合分析PPATG3.突变体揭示自噬在配子体衰老中起重要作用Physcomitrella金属盘.BMC植物BIOL.20.440(2020)。https://doi.org/10.1186/s12870-020-02651-6
收到了:
接受:
发表:
关键字
- 自噬缺陷
- 阿格
- C / N比值
- 脂肪酸
- 叶绿体plastoglobuli
- 过早衰老
- 莫斯