- 研究文章gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
观赏羽衣甘蓝低温诱导白化病候选基因的精细定位gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba20.gydF4y2Ba,文章号:gydF4y2Ba460gydF4y2Ba(gydF4y2Ba2020gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
低温诱导褪绿症在高等植物中广泛存在。虽然许多研究表明,在模式植物中,CTIC的遗传机制一般是由隐性基因控制的,但白化病的显性遗传至今未见报道。本研究利用两个CTIC突变体Red Kamome和White Kamome对观赏甘蓝白化性状的遗传进行了分析。这项研究的目的是精细定位目标位点,并确定最可能的白化病候选基因。gydF4y2Ba
结果gydF4y2Ba
遗传分析表明,羽衣甘蓝内叶白化病是半显性遗传,在两个分离居群中由一个位点控制。采用BSR-seq结合连锁分析对致病基因进行精细定位,命名为gydF4y2Ba正义与发展党gydF4y2Ba(gydF4y2Ba白化羽衣甘蓝gydF4y2Ba),至C03染色体上约60 kb的间隔。来自两个极端库的转录组数据表明,差异表达的基因gydF4y2BaBol015404gydF4y2Ba该基因编码细胞色素P450蛋白,是候选基因。的gydF4y2BaBol015404gydF4y2BaqPCR结果表明,该基因在观赏羽衣甘蓝白化叶片中表达上调。另外,通过梯度试验确定白化病的临界温度在10℃~ 16℃之间。gydF4y2Ba
结论gydF4y2Ba
使用两个独立的分离群体,白化突变体被证明是由一个半显性基因控制的,gydF4y2Ba正义与发展党gydF4y2Ba用羽衣甘蓝装饰。的gydF4y2BaBol015404gydF4y2Ba基因与白化病表型共分离,提示该功能未知的P450基因是最有可能的候选基因。白化性状主要是低温所致,而非光周期所致。本研究结果为羽衣甘蓝白化病的遗传控制奠定了基础。gydF4y2Ba
背景gydF4y2Ba
叶绿素生物合成是地球上最重要的生化过程[gydF4y2Ba1gydF4y2Ba].叶绿素生物合成途径发生在叶绿体中,涉及许多酶催化反应[gydF4y2Ba2gydF4y2Ba].因此,叶绿体是绿色植物光合作用的独特单位,产生光合作用过程的多种代谢产物[gydF4y2Ba3.gydF4y2Ba].大量研究报道叶绿体来源于前质体,叶绿体的形成涉及质体和核基因的调控[gydF4y2Ba4gydF4y2Ba].迄今为止,大量的证据表明,叶绿体的生物发生是由一系列基因精确调控的。gydF4y2Ba
低温是一种常见的非生物胁迫gydF4y2Ba芸苔属植物gydF4y2Ba植物和必需的春化和繁殖。低温诱导褪绿症(CTIC)的症状通常见于高等植物,如拟南芥[gydF4y2Ba5gydF4y2Ba],大米[gydF4y2Ba6gydF4y2Ba,gydF4y2Ba7gydF4y2Ba],玉米[gydF4y2Ba8gydF4y2Ba)等。利用遗传分析方法,已经在水稻中鉴定出许多温度敏感突变体,包括gydF4y2Batsc-1gydF4y2Ba[gydF4y2Ba9gydF4y2Ba),gydF4y2Bacde1gydF4y2Ba[gydF4y2Ba10gydF4y2Ba),gydF4y2BaysagydF4y2Ba[gydF4y2Ba11gydF4y2Ba),gydF4y2Batcd5gydF4y2Ba[gydF4y2Ba12gydF4y2Ba)等。在绿豆中,黑暗中的黄化苗在10℃时完全被抑制,在正常光照条件下无法再次变绿[gydF4y2Ba13gydF4y2Ba].因此,双子叶和单子叶都有CTIC症状,这是高等植物中普遍存在的现象。然而,低温诱导叶绿体缺乏的分子机制尚未完全阐明。gydF4y2Ba
羽衣甘蓝(gydF4y2Ba头叶甘蓝gydF4y2Ba)及其相关品种,包括羽衣甘蓝(gydF4y2Bab . oleraceagydF4y2Bavar。gydF4y2BasabellicagydF4y2BaL.)、千头甘蓝(gydF4y2Bab . oleraceagydF4y2Bavar。gydF4y2BaramosagydF4y2Ba)、芥蓝(gydF4y2Bab . oleraceagydF4y2Bavar。gydF4y2BamedullosagydF4y2BaThellg.)等,属于羽衣甘蓝属成员gydF4y2Bab . oleraceagydF4y2Ba[gydF4y2Ba14gydF4y2Ba].就人类而言,羽衣甘蓝主要分为两种:可食用羽衣甘蓝,用作蔬菜或饲料作物(如卷曲羽衣甘蓝),以及装饰性羽衣甘蓝,用于景观美化。羽衣甘蓝是世界上最受欢迎的观赏作物之一。在中国,羽衣甘蓝由于其色彩鲜艳的形态,通常被用作冬季的景观植物。栽培观赏羽衣甘蓝的主要颜色是白色和红色。对羽衣甘蓝CTIC症状的研究可以追溯到二十世纪中叶。1959年,马丁发现了一个可能控制冬季白化病的显性基因,但在夏季却得出了一个矛盾的结论[gydF4y2Ba15gydF4y2Ba].另一项研究表明,装饰性羽衣甘蓝的白化性状与叶片内部叶绿素缺乏有关。gydF4y2Ba16gydF4y2Ba].在之前的一项研究中,一种名为red Kamome的红羽衣甘蓝被发现保留了花青素积累和白化病的两个独立性状,揭示了白化病表型可能由不同的位点控制[gydF4y2Ba17gydF4y2Ba].然而,羽衣甘蓝白化病的遗传和分子机制仍然知之甚少。gydF4y2Ba
白化病是羽衣甘蓝的一种独特变异,可以由未被发现和罕见的遗传机制产生。为了证实这一假设,使用两个独立的分离种群仔细分析了这一性状的遗传。本研究旨在阐明这一遗传关系,以进一步鉴定候选基因。在这项研究中,一种罕见的半显性遗传模式被反复鉴定为观赏羽衣甘蓝白化病。此外,利用BSR-seq和连锁分析在较窄的区间内对目标性状进行了精细映射。本研究揭示了控制羽衣甘蓝白化病的遗传机制,为进一步鉴定候选基因的功能提供了有用的信息。gydF4y2Ba
结果gydF4y2Ba
观赏羽衣甘蓝白化性状的遗传分析gydF4y2Ba
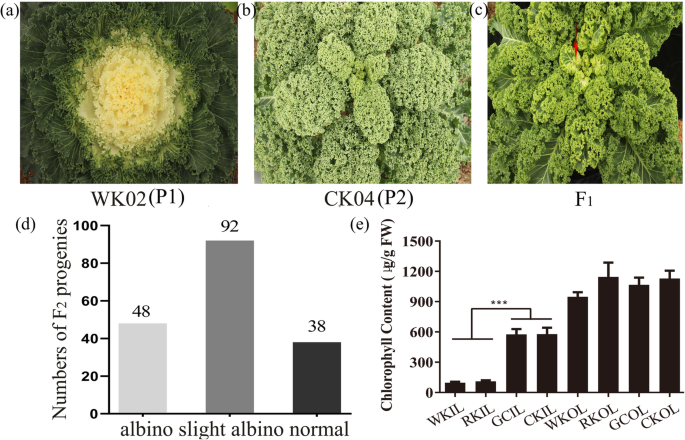
利用2个白化突变体RK01和WK02对观赏羽衣甘蓝白化遗传进行了分析。一个FgydF4y2Ba2gydF4y2Ba分离群体由WK02生成(图;gydF4y2Ba1gydF4y2Baa)在内叶和CK04中出现白化表型(图;gydF4y2Ba1gydF4y2Bab)绿色的叶子,FgydF4y2Ba1gydF4y2Ba子代在内叶表现出轻微的白化表型(图。gydF4y2Ba1gydF4y2Bac)选项cgydF4y2Ba2gydF4y2Ba后代表现出3种叶片颜色表型,包括48株白化、92株轻度白化和38株正常,分离比为1:2:1 (gydF4y2BaχgydF4y2Ba2gydF4y2Ba= 1.33,gydF4y2BaPgydF4y2Ba= 0.52 > 0.05,图gydF4y2Ba1gydF4y2Bad).结果表明,白化性状由一个半显性位点控制gydF4y2Ba白化羽衣甘蓝gydF4y2Ba(gydF4y2Ba正义与发展党gydF4y2Ba),在WK02。此外,FgydF4y2Ba1gydF4y2Ba植物和BCgydF4y2Ba1gydF4y2BaRK01和绿白菜的种群[gydF4y2Ba17gydF4y2Ba].共公元前603年gydF4y2Ba1gydF4y2Ba利用子代对白化病的遗传进行独立分析。603个子代的表型分析显示,304个白化个体与299个绿色个体的分离比为1:1 (gydF4y2BaχgydF4y2Ba2gydF4y2Ba= 0.04,gydF4y2BaPgydF4y2Ba= 0.84 > 0.05,图SgydF4y2Ba1gydF4y2Ba和表gydF4y2Ba1gydF4y2Ba).此外,一个小BCgydF4y2Ba1gydF4y2BaFgydF4y2Ba2gydF4y2Ba选择群体进一步确定亲缘关系。公元前的后代gydF4y2Ba1gydF4y2BaFgydF4y2Ba2gydF4y2Ba群体表现出3种叶片颜色表型,其中白化植株27株,轻度白化植株52株,正常植株20株,孟德尔比为1:2:1 (gydF4y2BaχgydF4y2Ba2gydF4y2Ba= 1.24,gydF4y2BaPgydF4y2Ba= 0.54 > 0.05,图SgydF4y2Ba2gydF4y2Ba和表gydF4y2Ba1gydF4y2Ba).这些结果也表明,羽衣甘蓝白化病是一种独特的半显性性状,可能是由单基因控制的。测定亲本品系4月龄叶绿素含量。白化区叶绿素含量RK01和WK02显著低于绿白菜和CK04的内叶(gydF4y2BaPgydF4y2Ba< 0.001),而RK01、WK02、CK04与绿色白菜的外叶无显著差异(图;gydF4y2Ba1gydF4y2Bae).研究结果表明,白化表型可能是由于抑制叶绿素生物合成和/或叶绿体发育所致。gydF4y2Ba
亲本系及其子代的表型和叶绿素含量。gydF4y2Ba一个gydF4y2BaWK02。gydF4y2BabgydF4y2BaCK04(野生型)。gydF4y2BacgydF4y2BaFgydF4y2Ba1gydF4y2Ba后代。gydF4y2BadgydF4y2BaFgydF4y2Ba2gydF4y2Ba后代。gydF4y2BaegydF4y2BaWK02、RK01、大白菜和CK04的叶绿素含量。RK RK01;GC,绿白菜;周,WK02;CK, CK04;OL,外叶;IL,内叶。* * *意味着gydF4y2BapgydF4y2Ba学生的< 0.001gydF4y2BatgydF4y2Ba测验gydF4y2Ba
白化羽衣甘蓝基因型的表型和叶绿体分析gydF4y2Ba
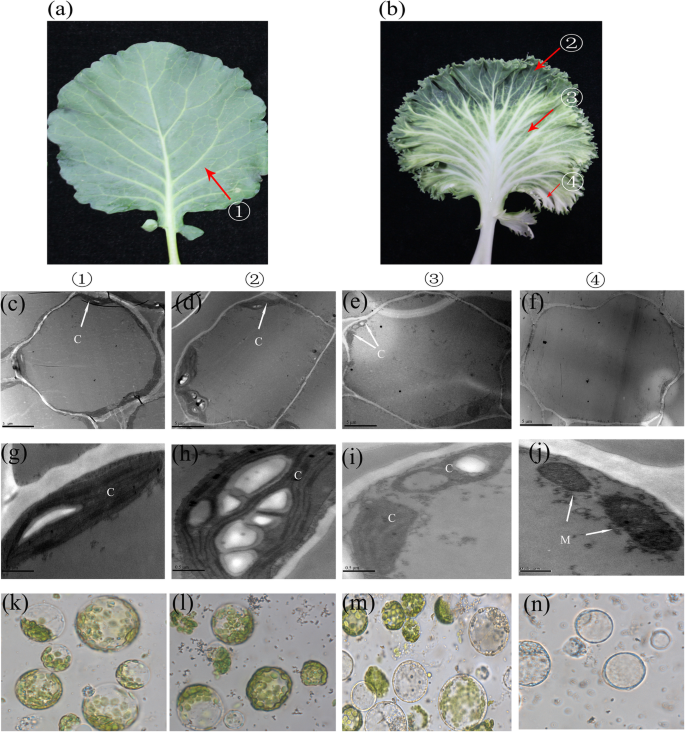
为了解叶绿素和/或叶绿体对白化表型的影响,利用透射电镜观察了WK02和绿白菜叶绿体的超微结构。选取WK02叶片中全绿、白化绿和全白化组织3个区域进行叶绿体形态观察(图;gydF4y2Ba2gydF4y2Bab),以绿白菜为对照(图。gydF4y2Ba2gydF4y2Baa).与绿色白菜不同的是,在WK02中,从全绿色到全白化组织,叶绿体数量逐渐减少到零(图2)。gydF4y2Ba2gydF4y2Ba氟)。在WK02的全绿色组织中,叶绿体形态在低温下发育正常(图2)。gydF4y2Ba2gydF4y2Bah).此外,叶绿体超微结构显示排列松散,颗粒堆积异常,在白化绿色组织中甚至可见一些空泡(图。gydF4y2Ba2gydF4y2Bai).有趣的是,在全白化组织中未观察到叶绿体(图。gydF4y2Ba2gydF4y2Baf),但线粒体是(图。gydF4y2Ba2gydF4y2Baj).这些结果与WK02的表型和叶绿素含量一致。因此,我们推测WK02的全白化组织中没有叶绿体由前质体转化而来。为了进一步证实这一假设,对WK02和青菜的原生质体进行了分离和观察。与绿色白菜类似,全绿色组织原生质体在WK02中叶绿体形态正常(图2)。gydF4y2Ba2gydF4y2Bak-l),并且在所有白化组织的原生质体中没有发现叶绿体(图。gydF4y2Ba2gydF4y2Ban).在绿白化组织中,可以清楚地观察到正常叶绿体和无叶绿体的形态,显示出一种介于全绿和全白化组织之间的状态(图。gydF4y2Ba2gydF4y2Bam).这些结果表明,白化表型是由叶绿体缺乏引起的。gydF4y2Ba
大白菜与WK02细胞学特征。gydF4y2Ba一个gydF4y2Ba绿卷心菜的叶子。gydF4y2BabgydF4y2BaWK02的叶子。位置的透射电子显微镜图像gydF4y2Ba①gydF4y2Ba所示gydF4y2BacgydF4y2Ba而且gydF4y2BaggydF4y2Ba、位置gydF4y2Ba②gydF4y2Ba所示gydF4y2BadgydF4y2Ba而且gydF4y2BahgydF4y2Ba、位置gydF4y2Ba③gydF4y2Ba所示gydF4y2BaegydF4y2Ba而且gydF4y2Ba我gydF4y2Ba、位置gydF4y2Ba④gydF4y2Ba所示gydF4y2BafgydF4y2Ba而且gydF4y2BajgydF4y2Ba.原生质体位置图像(60倍)gydF4y2Ba①gydF4y2Ba-gydF4y2Ba④gydF4y2Ba所示gydF4y2BakgydF4y2Ba-gydF4y2BangydF4y2Ba,分别。酒吧gydF4y2BacgydF4y2Ba-gydF4y2BafgydF4y2Ba表示5 μm;酒吧gydF4y2BaggydF4y2Ba-gydF4y2BajgydF4y2Ba表示0.5 μm。C,叶绿体;米,线粒体gydF4y2Ba
正义与发展党gydF4y2Ba基因图谱gydF4y2Ba
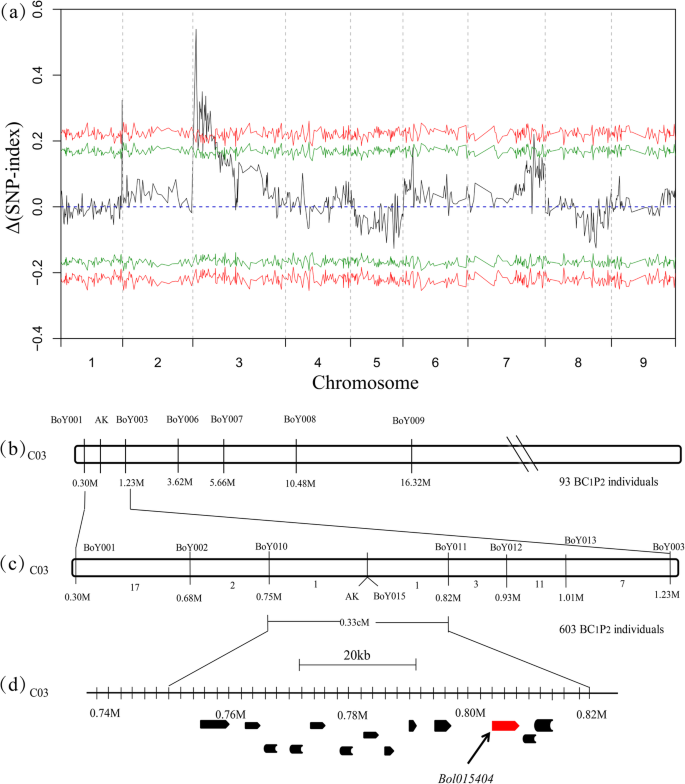
BSR-seq用于初步定位gydF4y2Ba正义与发展党gydF4y2Ba基因。A-pool和N-pool两个池通过RNA-seq分别生成5.29 Gb和6.21 Gb的干净数据。根据N-pool和A-pool对参考基因组02-12的数据计算Δ (SNP-index)图。gydF4y2Ba18gydF4y2Ba].的高峰gydF4y2Ba正义与发展党gydF4y2Ba该位点位于C03染色体前部(图3)。gydF4y2Ba3.gydF4y2BaA),表明有一个单一基因座控制羽衣甘蓝的白化病。gydF4y2Ba
映射gydF4y2Ba正义与发展党gydF4y2BaBC基因gydF4y2Ba1gydF4y2Ba人口gydF4y2Ba一个gydF4y2Ba基于N-pool和A-pool数据对参考基因组02-12的平均Δ (SNP-index)图gydF4y2BaXgydF4y2Ba设在)。C03染色体上出现靶区峰值。ci以绿线显示(gydF4y2BaPgydF4y2Ba< 0.05)和红线(gydF4y2BaPgydF4y2Ba< 0.01)。gydF4y2BabgydF4y2Ba的gydF4y2Ba正义与发展党gydF4y2Ba用随机选取的93个BC在分子标记BoY001和BoY003之间进行基因定位gydF4y2Ba1gydF4y2Ba个人。gydF4y2BacgydF4y2Ba精细映射gydF4y2Ba正义与发展党gydF4y2Ba分子标记BoY010 (754, 756 bp)和BoY011 (815, 202 bp)之间存在基因差异。染色体下方的数字表示两个标记之间的重组数。gydF4y2BadgydF4y2Ba预测基因的示意图gydF4y2Ba正义与发展党gydF4y2Ba轨迹。宽箭头表示候选区域中预测的13个基因。的gydF4y2BaBol015404gydF4y2Ba被认为是候选基因gydF4y2Ba
在CI值为95和99%时gydF4y2Ba正义与发展党gydF4y2Ba基因锚定在0-15.10 (gydF4y2BaPgydF4y2Ba< 0.05) Mb和0-13.30 Mb (gydF4y2BaPgydF4y2Ba< 0.01)在C03染色体上(图;gydF4y2Ba3.gydF4y2Baa).此外,我们随机筛选了93个BC的后代gydF4y2Ba1gydF4y2Ba采用BoY001、BoY003、BoY006、BoY007、BoY008和BoY009等6种分子标记进行种群鉴定。利用93个子代gydF4y2Ba正义与发展党gydF4y2Ba基因在分子标记BoY001 (300,692 bp)和BoY003 (12229, 918 bp)之间进行了初步定位。gydF4y2Ba3.gydF4y2Bab)。gydF4y2Ba
精细映射gydF4y2Ba正义与发展党gydF4y2Ba基因,我们筛选了603个BC的后代gydF4y2Ba1gydF4y2Ba利用分子标记BoY001和BoY003,分别鉴定出20个和22个重组体。在BoY001和BoY003之间发现了新的多态性标记,包括BoY002、BoY010、BoY011、BoY012、BoY013和BoY015。最后,gydF4y2Ba正义与发展党gydF4y2Ba基因被划分在分子标记BoY010 (754, 756 bp)和BoY011 (815, 202 bp)之间的区域,物理区域约为60 kb,遗传距离为0.33 cM(图2)。gydF4y2Ba3.gydF4y2Bac)。gydF4y2Ba
候选人gydF4y2Ba正义与发展党gydF4y2Ba基因预测gydF4y2Ba
在目标区域,在BoY010和BoY011之间获得了13个预测基因(表11)gydF4y2Ba2gydF4y2Ba,无花果。gydF4y2Ba3.gydF4y2Bad).然后进行FGENESH和基因扫描,鉴定出13个与参考基因组一致的orf。五个预测基因,包括gydF4y2BaBol015395gydF4y2Ba,gydF4y2BaBol015396gydF4y2Ba,gydF4y2BaBol015399gydF4y2Ba,gydF4y2BaBol015401gydF4y2Ba而且gydF4y2BaBol015402gydF4y2Ba,编码未特征的蛋白质。gydF4y2BaBol015394gydF4y2Ba可能编码一种网格蛋白适配器复合物亚基蛋白,与AT5G05010具有78.1%的氨基酸同源性。gydF4y2BaBol015397gydF4y2Ba编码泛素偶联酶22,参与雌性配子体发育[gydF4y2Ba19gydF4y2Ba].gydF4y2BaBol015398gydF4y2Ba是一种mybc1样转录因子,负调控拟南芥的耐寒性[gydF4y2Ba20.gydF4y2Ba].gydF4y2BaBol015406gydF4y2Ba编码参与纤维素生物合成过程的纤维素合酶[gydF4y2Ba21gydF4y2Ba].gydF4y2BaBol015400gydF4y2Ba,gydF4y2BaBol015403gydF4y2Ba而且gydF4y2BaBol015405gydF4y2Ba分别与抑制半胱氨酸蛋白酶、RNA聚合酶转录和自噬体组装等基本生物学过程有关。gydF4y2BaBol015404gydF4y2Ba编码细胞色素P450 708A亚家族蛋白,该亚家族蛋白与gydF4y2BaAT3G44970gydF4y2Ba氨基酸同源性为73.7%。Bol015404的功能还没有得到验证。在精细定位区,只有一个基因gydF4y2BaBol015404gydF4y2BaA-pool与N-pool的FPKM值≈27.1。因此,gydF4y2BaBol015404gydF4y2Ba基因暂时被认为是候选基因(图;gydF4y2Ba3.gydF4y2Bad)。gydF4y2Ba
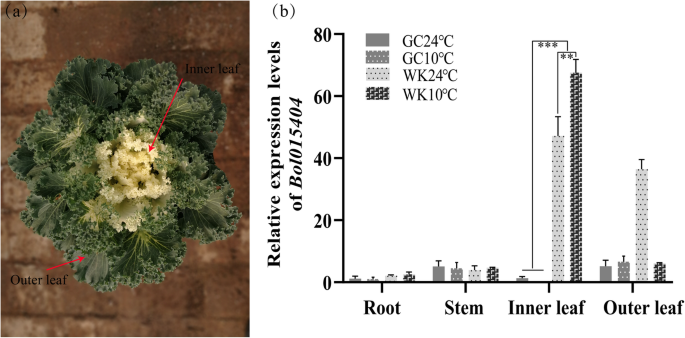
确定可能的候选基因,表达水平gydF4y2BaBol015404gydF4y2Ba用qPCR法检测不同温度处理下的样品。结果显示gydF4y2BaBol015404gydF4y2Ba在WK02和青菜的根和茎组织中含量相对较低(图2)。gydF4y2Ba4gydF4y2Ba).然而,gydF4y2BaBol015404gydF4y2Ba在WK02内叶中的表达量高于绿白菜(gydF4y2BaPgydF4y2Ba< 0.001)在10°C和24°C。与24℃处理相比,表达水平明显降低gydF4y2BaBol015404gydF4y2Ba在10°C时,WK02内叶显著上调(gydF4y2BaPgydF4y2Ba< 0.01)。结果表明gydF4y2BaBol015404gydF4y2Ba在叶片内部可能是由低温诱导的gydF4y2Ba.gydF4y2Ba此外,一个SNP标记BoY015位于蛋白质的内含子区域gydF4y2BaBol015404gydF4y2Ba,与BC表型共分离gydF4y2Ba1gydF4y2Ba人口(图。gydF4y2Ba3.gydF4y2Bac)。因此,gydF4y2BaBol015404gydF4y2Ba被认为是最有可能调控白化病的候选基因。gydF4y2Ba
相对表达量gydF4y2BaBol015404gydF4y2Ba(gydF4y2Ba一个gydF4y2Ba)低温下WK02表型。gydF4y2BabgydF4y2Ba表达水平gydF4y2BaBol015404gydF4y2Ba在10°C和24°C的不同组织中数据代表平均值±SD (gydF4y2BangydF4y2Ba= 3)。表达水平gydF4y2BaBol015404gydF4y2Ba在24℃时,取绿白菜的温度为1。周,WK02;GC,绿色卷心菜。**和***的意思是gydF4y2BaPgydF4y2Ba< 0.01,gydF4y2BaPgydF4y2Ba学生的< 0.001gydF4y2BatgydF4y2Ba测验gydF4y2Ba
序列分析gydF4y2BaBol015404gydF4y2Ba
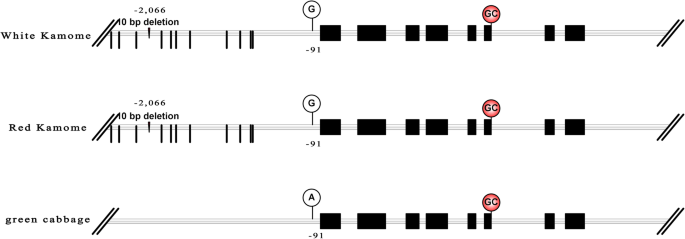
我们扩增和测序了基因组序列(包括大约2.5 kb启动子区域)gydF4y2BaBol015404gydF4y2BaRK01, WK02和绿卷心菜。基因组序列显示RK01和WK02之间的内含子和启动子区域完全相同(文本S1)。在编码区,白化羽衣甘蓝RK01和WK02与绿甘蓝的序列同一性为100%(图SgydF4y2Ba3.gydF4y2Ba).有趣的是,在三个亲本系中内含子6的剪接位点偶见GC-AG而非GT-AG。详细分析了WK02和大白菜的启动子序列。与绿色卷心菜不同的是,WK02的启动子区域分布有12个点突变,在- 2066 bp位置发现了一个10 bp的缺失(图2)。gydF4y2Ba5gydF4y2Ba).我们推测这些启动子区域的突变可能是诱导表达的原因gydF4y2BaBol015404gydF4y2Ba在WK02叶片内侧gydF4y2Ba.gydF4y2Ba
白化病是由低温而不是光周期引起的gydF4y2Ba
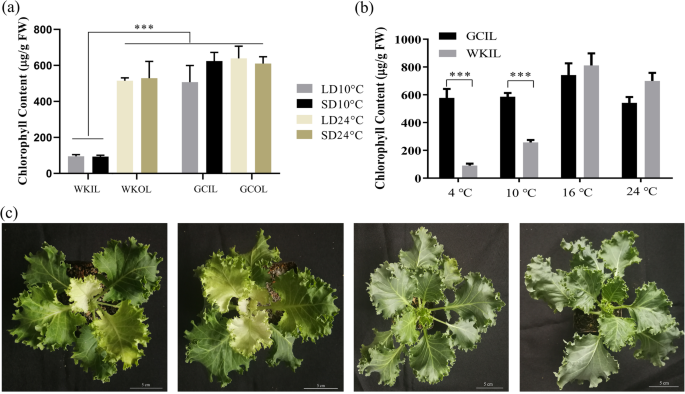
观赏羽衣甘蓝白化表型多见于秋冬田。我们推测白化病是由低温和/或短光周期引起的。为了确定环境因素,我们进行了4种温度和光周期处理,以探索关键的非生物因素。LD和SD光周期对WK02和绿白菜叶绿素含量无显著影响。而WK02的表型表现为内叶明显白化,其叶绿素含量在低温(10℃)条件下明显低于常温(24℃)条件下(图2)。gydF4y2Ba6gydF4y2Baa).因此,白化表型是由低温诱导的,而不是由光周期诱导的。gydF4y2Ba
为了探索白化病发生的临界温度,本研究进行了温度梯度试验。结果表明,WK02内叶在4°C和10°C条件下逐渐发生白化,但在16°C和24°C条件下3周后,内叶始终呈现正常的绿色(图2)。gydF4y2Ba6gydF4y2Bac).因此,在低温(4°c和10°c)下,WK02的叶绿素含量较其他温度(gydF4y2BaPgydF4y2Ba< 0.001,图;gydF4y2Ba6gydF4y2Bab)。gydF4y2Ba
讨论gydF4y2Ba
在本研究中,大块分离分析(BSA)结合RNA-seq (BSR-seq) [gydF4y2Ba18gydF4y2Ba],初步定位了观赏羽衣甘蓝白化表型的靶区。在C03染色体上发现了一个单峰(图3)。gydF4y2Ba3.gydF4y2Baa)通过计算a -pool和N-pool之间的Δ (SNP-index)值。这些结果表明,BSR-seq是一种识别目标性状对应区域的有效方法。此外,BSA联合DNA重测序(QTL-seq)也可以提高遗传作图的效率[gydF4y2Ba19gydF4y2Ba].因此,BSR-seq和QTL-seq已被广泛应用于鉴定几种致病基因gydF4y2Bab . oleraceagydF4y2Ba物种,比如gydF4y2Ba棉子gydF4y2Ba[gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba21gydF4y2Ba),gydF4y2Ba博普爵士乐gydF4y2Ba[gydF4y2Ba22gydF4y2Ba),gydF4y2BaBoMYB2gydF4y2Ba[gydF4y2Ba17gydF4y2Ba),gydF4y2BaBoCCD4gydF4y2Ba[gydF4y2Ba23gydF4y2Ba,gydF4y2Ba24gydF4y2Ba].与QTL-seq不同,BSR-seq利用了来自两个库的差异表达基因,这同时为候选基因选择提供了更多信息。此外,我们利用BC映射白化性状gydF4y2Ba1gydF4y2Ba隔离人群(表SgydF4y2Ba1gydF4y2Ba),该群体已被用来阐明观赏羽衣甘蓝花青素积累的遗传机制[gydF4y2Ba17gydF4y2Ba].因此,通过构建合适的群体,使基于图谱的克隆效率提高了一倍。gydF4y2Ba
白化病形成的分子机制是复杂的。它们与多种生物化学过程有关,如叶绿素生物合成[gydF4y2Ba25gydF4y2Ba],类胡萝卜素生物合成[gydF4y2Ba26gydF4y2Ba],血红素代谢[gydF4y2Ba27gydF4y2Ba].低温通常被认为是导致植物白化病的主要非生物胁迫。低温诱导的褪绿/白化病,也称为CTIC症状,已在许多高等植物中报道,包括拟南芥[gydF4y2Ba5gydF4y2Ba]和米[gydF4y2Ba6gydF4y2Ba,gydF4y2Ba7gydF4y2Ba]gydF4y2Ba.gydF4y2Ba一般来说,在大多数植物育种环境中,白化表型被视为异常和负面性状[gydF4y2Ba25gydF4y2Ba].然而,装饰羽衣甘蓝中色彩缤纷的叶子因其美丽的形态而深受消费者欢迎[gydF4y2Ba28gydF4y2Ba].虽然有一系列基因与低温下叶绿体的生物发生有关,但这些突变体通常是由隐性基因控制的。在我们的研究中,两个对温度敏感的白化突变体RK01和WK02被鉴定为表现出半显性性状,而不是普遍隐性遗传。使用BSR-seq和连锁分析,我们缩小了gydF4y2Ba正义与发展党gydF4y2Ba基因转移到C03染色体上约60kb的区域。然而,这些靶区基因既没有叶绿素生物合成基因,也没有叶绿素分解基因,如gydF4y2BaDVRgydF4y2Ba[gydF4y2Ba29gydF4y2Ba),gydF4y2BaCHLGgydF4y2Ba[gydF4y2Ba30.gydF4y2Ba),gydF4y2Ba曹gydF4y2Ba[gydF4y2Ba31gydF4y2Ba],也没有任何众所周知的调节叶绿体生物发生的基因,如小反刍草(PPR)家族[gydF4y2Ba11gydF4y2Ba].这些结果表明,羽衣甘蓝白化病可能受到某种未知机制的控制。gydF4y2Ba
植物基因组测序结果显示,细胞色素P450基因家族是高等植物中最大的基因超家族之一。P450s的数量估计约占所有注释基因的1% [gydF4y2Ba32gydF4y2Ba].例如,在拟南芥和水稻中分别鉴定出246个和356个P450s [gydF4y2Ba33gydF4y2Ba].P450基因在植物中的功能涉及到各种生化反应和生物合成过程,如与甾醇相关的反应[gydF4y2Ba34gydF4y2Ba]、植物激素[gydF4y2Ba32gydF4y2Ba]、防卫化合物[gydF4y2Ba35gydF4y2Ba]和叶片发育[gydF4y2Ba36gydF4y2Ba].基于启动子变异和差异表达基因,gydF4y2BaBol015404gydF4y2Ba,编码细胞色素P450蛋白,被选为最有可能的候选基因gydF4y2Ba正义与发展党gydF4y2Ba.在这项研究中,gydF4y2BaBol015404gydF4y2Ba是属于CYP708A亚家族的一个未鉴定的基因。的表达式gydF4y2BaBol015404gydF4y2Ba新生长区域低温10℃诱导。因此,表达上调可能导致观赏羽衣甘蓝内叶白化病的发生。有趣的是,gydF4y2BaCYP708gydF4y2Ba基因在水稻中不存在,但在拟南芥中存在,这表明单子叶植物和双子叶植物在相应的代谢产物上存在差异[gydF4y2Ba33gydF4y2Ba].在CYP708A亚家族中,CYP708A2被定性为通过操纵子样簇参与三萜的合成gydF4y2Ba拟南芥gydF4y2Ba[gydF4y2Ba37gydF4y2Ba].然而,CYP708A亚家族的其他成员的功能尚未在植物中得到验证。对羽衣甘蓝白化病分子机制的研究将拓宽我们对叶绿体发育和生物发生的认识。gydF4y2Ba
结论gydF4y2Ba
在观赏羽衣甘蓝中发现了2个表现CTIC症状的半显性遗传白化突变体。我们用BSR-seq方法确定了白化病候选基因的靶区。的gydF4y2Ba正义与发展党gydF4y2Ba该基因被精确定位到60 kb的狭窄区域,遗传距离为0.33 cM。在定位区域预测了13个基因,细胞色素P450基因gydF4y2BaBol015404gydF4y2Ba被选为最有可能的候选基因gydF4y2Ba正义与发展党gydF4y2Ba基于它的差异表达和启动子变异。温度和光照处理的结果表明,低温是诱发羽衣甘蓝白化病的关键因素,而不是光周期。此外,通过梯度试验确定了10 ~ 16℃是观赏羽衣甘蓝白化的临界温度。本研究为高等植物白化病提供了一种新的类型,也为了解羽衣甘蓝白化病的遗传控制奠定了基础;一种候选基因gydF4y2Ba正义与发展党gydF4y2Ba被确认。gydF4y2Ba
方法gydF4y2Ba
植物材料和表型gydF4y2Ba
两种商业品种的观赏羽衣甘蓝(gydF4y2Bab . oleraceagydF4y2Bavar。gydF4y2BaacephalagydF4y2Ba)与白化病表型,Red Kamome和White Kamome (TAKII SEED, Japan)在本研究中使用。另外两种材料,青菜“HGDH”(gydF4y2Bab . oleraceagydF4y2Bavar。gydF4y2Ba性的gydF4y2Ba)和羽衣甘蓝“周野羽衣”(东胜种业,中国)作为正常亲本进行群体构建。大白菜“HGDH”是由华中农业大学王涛涛教授提供的双单倍体(DH)系。所有商业材料均经过三代自花授粉,证实表型稳定一致,特别是叶片颜色。自花授粉的红佳美、白佳美和“周野玉一”亲本分别命名为RK01、WK02和CK04。在我们之前的研究中,由RK01和绿白菜“HGDH”产生回交分离群体[gydF4y2Ba17gydF4y2Ba].BCgydF4y2Ba1gydF4y2Ba由于两个性状是由两个基因座独立控制的,因此可以利用群体来阐明观赏羽衣甘蓝花青素积累和白化病的遗传机制(表SgydF4y2Ba1gydF4y2Ba).一个公元前gydF4y2Ba1gydF4y2BaFgydF4y2Ba2gydF4y2Ba为进一步验证观赏羽衣甘蓝白化性状的亲缘关系,选择居群进行研究。另外,FgydF4y2Ba2gydF4y2Ba采用WK02和CK04培养群体,分析红葛美和白葛美白化性状的遗传关系。8月底或9月初,在华中农业大学(中国武汉)的“黄土坡”基地进行了所有分离群体的播种。白化病表型在10月底和11月初首次观察到。2014年9月平均高温和低温分别为30°C和20°C。然而,2014年11月的平均高温和低温分别下降到14°C和7°CgydF4y2Bawww.tianqi.comgydF4y2Ba).通过肉眼观察,这些表型在四个月龄植株中被鉴定了两次。在人工气候室中进行了四种温度和光周期处理。长日光周期(LD)和短日光周期(SD)分别在16 h/8 h(明/暗)和8 h/16 h(明/暗)下进行。植物生长以荧光灯为光源,光密度约为280 μmol /mgydF4y2Ba2gydF4y2Ba/ s。设置相对湿度为75%。为了探究临界温度,在4℃、10℃、16℃、24℃LD光周期下进行了温度梯度实验。以上处理均在3周龄植株上进行,3周后进行表型鉴定。gydF4y2Ba
叶绿素测量gydF4y2Ba
新鲜叶片(0.2 g)剪成小片,除去叶脉和叶柄。用10 mL乙醇溶液(96%,v/v)提取叶绿素。在649 nm和665 nm处测量叶绿素的浓度[gydF4y2Ba38gydF4y2Ba].本研究采用4月龄植株检测亲本系叶绿素含量,并在相应生育期测定其他处理材料。所有测量都进行了4次生物重复和3次技术重复。gydF4y2Ba
叶绿体的显微分析gydF4y2Ba
利用透射电镜观察叶绿体的超微结构。样品按照曹氏方法制备[gydF4y2Ba39gydF4y2Ba].为了进一步观察叶绿体,按照Yoo等人的方法分离原生质体。[gydF4y2Ba40gydF4y2Ba].用倒置显微镜(Olympus 1 × 71,日本)记录原生质体。gydF4y2Ba
BSR-seq分析gydF4y2Ba
结合RNA-seq分析(BSR-seq) [gydF4y2Ba18gydF4y2Ba]被用来鉴定白化病性状。对于BSR-seq,通过混合来自BC中50个白化叶片和50个正常叶片的等量组织,构建了两个池,白化池(a池,突变池)和正常池(n池,野生池)gydF4y2Ba1gydF4y2Ba人口,分别。从两个池中提取总RNA,使用RNAiso plus kit法(Takara,日本)完成RNA测序。gydF4y2Ba
在Illumina Hiseq™2500平台上准备插入尺寸约为350 bp的对端(125 bp)文库进行测序。RNA-seq为每个池生成大约5gb的干净数据(NCBI提交档案,PRJNA580294)。对端reads的比对由Hisat2程序处理[gydF4y2Ba41gydF4y2Ba]对照参考基因组02-12 [gydF4y2Ba42gydF4y2Ba],使用SAMtools进行SNP调用[gydF4y2Ba43gydF4y2Ba].计算SNP-index和Δ (SNP-index),以确定白化性状的候选区域。Δ的关键参数(SNP-index)由A-pool的SNP-index减去N-pool的SNP-index得到。如先前研究所述,为Δ (SNP-index)计算95%和99%的置信区间[gydF4y2Ba22gydF4y2Ba].使用StringTie程序通过FPKM(每千碱基每百万读对转录片段)值分析差异表达基因[gydF4y2Ba44gydF4y2Ba].gydF4y2Ba
分子标记开发与遗传定位gydF4y2Ba
几种类型的分子标记被用于gydF4y2Ba正义与发展党gydF4y2Ba表SgydF4y2Ba2gydF4y2Ba),包括CAPS、出席/缺席和SNP。这些标记的特异性引物采用Primer 3.0设计(gydF4y2Bahttp://primer3.ut.ee/gydF4y2Ba)根据参考基因组02-12 [gydF4y2Ba42gydF4y2Ba].在BC中随机选择了93个后代gydF4y2Ba1gydF4y2Ba采用种群进行初步测绘。的gydF4y2Ba正义与发展党gydF4y2Ba对603个BC后代进行了精细定位gydF4y2Ba1gydF4y2Ba人口。BC基因分型资料gydF4y2Ba1gydF4y2Ba采用JoinMap4程序对个体进行连锁分析[gydF4y2Ba45gydF4y2Ba].gydF4y2Ba
候选基因预测gydF4y2Ba
差异表达基因通过StingTie [gydF4y2Ba44gydF4y2Ba],为候选基因的选择提供更多的信息。从参考基因组02-12中提取目标区域的基因组序列,利用FGENESH对其进行开放阅读框架(orf)预测(gydF4y2Bahttp://www.softberry.com/gydF4y2Ba)及基因扫描(gydF4y2Bahttp://genes.mit.edu/gydF4y2Ba).这些基因的功能注释检索自Blast2Go软件(gydF4y2Bahttps://www.blast2go.com/gydF4y2Ba)及TAIR网站(gydF4y2Bahttps://www.arabidopsis.org/gydF4y2Ba).gydF4y2Ba
基因表达分析gydF4y2Ba
用RNAiso plus试剂(Takara,日本)从新鲜组织中分离总RNA。RNA质量由NanoDrop 2000 (ThermoFisher Scientific, USA)测定。此外,本研究要求RNA样本的值为260/280 > 1.8。利用TransScript One-Step gDNA Removal和cDNA Synthesis SuperMix kit (TransScript, China),用2 μg RNA合成第一链cDNA。合成的cdna用ddH稀释gydF4y2Ba2gydF4y2BaO为RT-PCR。定量RT-PCR在QuantStudio 5 Real-Time PCR系统(ThermoFisher Scientific, USA)中进行。反应体积为10 μL,含5 μL SYBR qPCR Master Mix (Vazyme, China), 0.3 μL浓度为10 μL的正向引物和反向引物,1 μL cDNA模板,3.4 μL ddHgydF4y2Ba2gydF4y2BaO. PCR扩增采用两步循环法,95°C持续30s, 95°C持续5s, 60°C持续20s,循环40次。利用熔化曲线验证引物的特异性。候选基因的表达水平gydF4y2BaBol015404gydF4y2Ba(qP450-F: GGGAAACATCCACAAGCACA;qP450-R: TCTTTGGCCAGCCTTCAAAT)在10℃下在根、茎、内叶和外叶等多个组织中进行了3个生物重复和3个技术重复检测。的白菜gydF4y2BaβgydF4y2Ba-gydF4y2Ba肌动蛋白gydF4y2Ba基因(AF044573)作为内参基因[gydF4y2Ba46gydF4y2Ba].用公式2计算相对表达量gydF4y2Ba-gydF4y2Ba△gydF4y2Ba△gydF4y2BaCqgydF4y2Ba[gydF4y2Ba17gydF4y2Ba].学生的gydF4y2BatgydF4y2Ba用检验来估计不同样本间的显著性差异。gydF4y2Ba
数据和材料的可用性gydF4y2Ba
在当前研究中生成的数据集可在NCBI (PRJNA580294)中获得。gydF4y2Ba
缩写gydF4y2Ba
- CTIC:gydF4y2Ba
-
Cool-Temperature-Induced萎黄病gydF4y2Ba
- BSR-seq:gydF4y2Ba
-
BSA + RNA-seqgydF4y2Ba
- SNP:gydF4y2Ba
-
单核苷酸多态性gydF4y2Ba
- 帽子:gydF4y2Ba
-
C1eaved扩增多态序列gydF4y2Ba
- LD:gydF4y2Ba
-
漫长的一天gydF4y2Ba
- SD:gydF4y2Ba
-
短暂的一天gydF4y2Ba
- 顺式:gydF4y2Ba
-
置信区间gydF4y2Ba
参考文献gydF4y2Ba
- 1.gydF4y2Ba
埃克哈特U,格林B, Hörtensteiner S.高等植物叶绿素生物合成和分解的最新进展。植物学报,2004;26(1):1 - 14。gydF4y2Ba
- 2.gydF4y2Ba
Stenbaek A, Jensen PE。叶绿素生物合成的氧化还原调控。植物化学,2010;71(2010):853 - 9。gydF4y2Ba
- 3.gydF4y2Ba
叶志刚,李志刚。叶绿体的进化、结构和功能。F1000Prime代表2014;6:40。gydF4y2Ba
- 4.gydF4y2Ba
López-Juez E.质体生物发生,在光与影之间。中国机械工程学报,2006;32(1):11-26。gydF4y2Ba
- 5.gydF4y2Ba
Routaboul J-M, Fischer SF, Browse J.在低温下维持叶绿体功能需要三烯脂肪酸。植物科学进展。2000;26(4):457 - 457。gydF4y2Ba
- 6.gydF4y2Ba
吉田,甘野,李志刚,李志刚。低温诱导水稻黄化病的研究进展(1 .诱导与黄化体发育障碍的关系)。植物科学进展。1996;gydF4y2Ba
- 7.gydF4y2Ba
陶玲,梁凯杰,陈忠文,段玉玲,王金林,叶楠,吴文瑞。水稻冷致幼苗褪绿病的遗传分析及基因定位。Hereditas。2007;29:1121-5。gydF4y2Ba
- 8.gydF4y2Ba
Rodríguez VM, Velasco P, Garrido JL, Revilla P, Ordás A, Butrón A.玉米自交系A661冷致白化病的遗传调控。中国机械工程学报,2013;36(12):457 - 457。gydF4y2Ba
- 9.gydF4y2Ba
董勇,董伟,石松,金强。水稻温敏苗色突变体的鉴定与遗传分析(gydF4y2Ba栽培稻gydF4y2Bal .)。育种科学2001;51(1):1 - 4。gydF4y2Ba
- 10.gydF4y2Ba
刘伟,付勇,胡刚,司华,朱林,吴超,孙哲。水稻叶绿素缺乏突变体的鉴定与精细定位(gydF4y2Ba栽培稻gydF4y2Bal .)。足底。2007;226(3):785 - 95。gydF4y2Ba
- 11.gydF4y2Ba
苏楠,胡明兰,吴晓东,吴丰强,费桂兰,蓝燕,陈小玲,舒小玲,张欣,郭小鹏,程志军,雷晓玲,齐志强,姜林,王辉,万建明。水稻五肽重复蛋白的破坏导致了一种幼苗特异性白化表型,并利用它来提高杂交水稻生产中的种子纯度。中国生物医学工程学报,2012;29(1):344 - 344。gydF4y2Ba
- 12.gydF4y2Ba
王艳,张娟,石霞,彭艳,李萍,林东,董勇,滕松。温度敏感型白化病基因gydF4y2BaTCD5gydF4y2Ba编码一种单加氧酶,影响低温下叶绿体的发育。中国生物医学工程学报,2016;26(4):567 - 567。gydF4y2Ba
- 13.gydF4y2Ba
杨mt,陈世林,林春春,陈玉明。低温胁迫抑制绿豆幼苗叶片叶绿体发育和核基因表达。足底。2005;221(3):374 - 85。gydF4y2Ba
- 14.gydF4y2Ba
林奈CS。斯德哥尔摩,植物物种。斯德哥尔摩:Salvius;1753.gydF4y2Ba
- 15.gydF4y2Ba
温度诱导的“观赏性羽衣甘蓝”杂色优势的逆转。Experientia。1959;15: 34-35。gydF4y2Ba
- 16.gydF4y2Ba
周松,胡忠,朱明,张斌,邓龙,潘勇,陈刚。羽衣甘蓝白鸽温敏突变体的生物化学和分子分析。植物生理学报,2013;26(3):344 - 344。gydF4y2Ba
- 17.gydF4y2Ba
闫超,安刚,朱涛,张伟,张磊,彭林,陈杰,匡辉gydF4y2BaBoMYB2gydF4y2Ba基因导致紫色性状gydF4y2Ba芸苔属植物oleraceagydF4y2Ba.应用理论与实践。2019;32(4):895-906。gydF4y2Ba
- 18.gydF4y2Ba
刘珊珊,叶婷婷,唐慧敏,Nettleton D, Schnable PS.基于BSR-Seq的基因定位。公共科学学报,2012;7(5):e36406。gydF4y2Ba
- 19.gydF4y2Ba
Takagi H, Abe A, Yoshida K, Kosugi S, Natsume S, Mitsuoka C, Uemura A, Utsushi H, Tamiru M, Takuno S, Innan H, Cano LM, Kamoun S, Terauchi R. QTL-seq:通过对两个大群体DNA的全基因组重测序快速定位水稻数量性状位点。植物学报,2013;26(1):344 - 344。gydF4y2Ba
- 20.gydF4y2Ba
任娟,刘忠,杜娟,付伟,侯安,冯慧。浅裂叶基因的精细定位,gydF4y2Ba棉子gydF4y2Ba,用于装饰羽衣甘蓝(gydF4y2Ba芸苔属植物oleraceagydF4y2Bal . var。gydF4y2BaacephalagydF4y2Ba).动物育种。2019;39(3):40。gydF4y2Ba
- 21.gydF4y2Ba
冯霞,李霞,杨霞,朱平。叶片形状基因的精细定位与鉴定gydF4y2BaBoFLgydF4y2Ba用羽衣甘蓝装饰。应用理论与实践,2020;33(4):1303-12。gydF4y2Ba
- 22.gydF4y2Ba
唐强,田敏,安刚,张伟,陈娟,闫超。紫茎的快速鉴定(gydF4y2BaPsgydF4y2Ba)芥蓝基因(gydF4y2Ba甘蓝变种gydF4y2Ba)在分离畸变群体中,通过膨胀分离分析和RNA测序。动物育种,2017;37(12):153。gydF4y2Ba
- 23.gydF4y2Ba
陈郭罗许X, W, J, H, Akram W,谢D,李·g·好映射和黄色花瓣基因的候选基因分析gydF4y2BackpcgydF4y2Ba在芥蓝中(gydF4y2Ba芸苔属植物oleraceagydF4y2Bal . var。gydF4y2BaalboglabragydF4y2Ba通过全基因组重测序。Mol育种,2019;39:96。gydF4y2Ba
- 24.gydF4y2Ba
闫超,黄燕,刘震,郭峰,焦忠,杨伟,朱峰,邱哲。黄花基因的快速鉴定gydF4y2BaBofcgydF4y2Ba花椰菜里(gydF4y2Ba甘蓝变葡萄孢gydF4y2Ba)通过批量分离分析和全基因组重测序。Euphytica。2020;216:26。gydF4y2Ba
- 25.gydF4y2Ba
马强,李华,邹志,Arkorful E,吕强,周强,陈霞,孙凯,李霞。茶新品种“花白1号”白化相关基因的转录组分析。Hortic res 2018;5(1):54。gydF4y2Ba
- 26.gydF4y2Ba
袁慧,张娟,纳吉斯瓦然D,李林。园艺作物类胡萝卜素代谢与调控。Hortic Res. 2015;2:15036。gydF4y2Ba
- 27.gydF4y2Ba
张凯,穆勇,李伟,单霞,王宁,冯慧。2个隐性黄化基因的鉴定(gydF4y2Bapy1gydF4y2Ba,gydF4y2Bapy2gydF4y2Ba)在小白菜里(gydF4y2Ba芸苔属植物拉伯gydF4y2Bal . ssp。gydF4y2Ba对gydF4y2Ba).植物科学进展。2020;20(1):68。gydF4y2Ba
- 28.gydF4y2Ba
Schmidt S, Zietz M, Schreiner M, Rohn S, Kroh LW, Krumbein A.基因型和气候对羽衣甘蓝黄酮含量和组成的影响(gydF4y2Ba芸苔属植物oleraceagydF4y2Bavar。gydF4y2BasabellicagydF4y2Ba).食品化学学报,2010;29(4):339 - 339。gydF4y2Ba
- 29.gydF4y2Ba
王鹏,万春,徐震,王鹏,王伟,孙春,马霞,肖勇,朱军,高旭。一种二乙烯基还原酶在叶绿素生物合成的各种中间产物中还原8-乙烯基,但同工酶在不同种间存在差异。中国生物医学工程学报,2013;29(1):344 - 344。gydF4y2Ba
- 30.gydF4y2Ba
林玉萍,李泰,田中A,张玉玉。对拟南芥热敏突变体的分析表明,叶绿素合成酶在叶绿素转化过程中参与叶绿素的再利用。植物学报(自然科学版);2015;26(1):1 - 7。gydF4y2Ba
- 31.gydF4y2Ba
李志刚,李志刚,李志刚。拟南芥Chl B转录重编程抑制衰老的研究进展。中国生物医学工程学报,2012;29(3):344 - 344。gydF4y2Ba
- 32.gydF4y2Ba
李志刚,李志刚,李志刚。陆生植物P450基因的多样性研究。植物学报,2010;gydF4y2Ba
- 33.gydF4y2Ba
孙文杰,李志刚,李志刚,李志刚。水稻与拟南芥的比较基因组学研究。单子叶和双子叶727个细胞色素P450基因及伪基因的分析。植物科学进展。2004;35(2):344 - 344。gydF4y2Ba
- 34.gydF4y2Ba
森川文,李文杰,李文杰,李文杰。拟南芥和番茄细胞色素P450 CYP710A基因的克隆及表达。植物学报。2006;18(4):1008-22。gydF4y2Ba
- 35.gydF4y2Ba
Jensen NB, Zagrobelny M, Hjernø K, Olsen CE, Houghton-Larsen J, Borch J, Møller BL, Bak S.植物和昆虫中氰基防御化合物生物合成的趋同进化。《Nat Commun》2011;2:273。gydF4y2Ba
- 36.gydF4y2Ba
杨晓明,杨晓明,杨晓明,杨晓明。植物细胞间KLUH/ cyp78a5信号通路对植物器官大小的影响。生物工程学报。2007;13(6):843-56。gydF4y2Ba
- 37.gydF4y2Ba
B场,奥斯本AE。代谢多样化——不同植物中操纵子样基因簇的独立组装。科学。2008;320(5875):543 - 7。gydF4y2Ba
- 38.gydF4y2Ba
总类胡萝卜素和叶绿素的测定gydF4y2Ba一个gydF4y2Ba而且gydF4y2BabgydF4y2Ba不同溶剂中的叶子提取物。生物化学学报,1983;11:591-2。gydF4y2Ba
- 39.gydF4y2Ba
曹辉,张娟,徐娟,叶娟,云珍,徐强,徐娟,邓霞gydF4y2BaβgydF4y2Ba-胡萝卜素的积累,通过比较工程细胞模型和天然富含类胡萝卜素的柑橘系统。中国科学(d辑:自然科学),2012;gydF4y2Ba
- 40.gydF4y2Ba
刘思德,赵永华,陈杰,等。拟南芥叶肉原生质体的瞬时基因表达分析。物理学报。2007;2(7):1565-72。gydF4y2Ba
- 41.gydF4y2Ba
Daehwan K, Ben L, Salzberg SL. HISAT:一种低内存需求的快速拼接对齐器。光子学报。2015;12(4):357-60。gydF4y2Ba
- 42.gydF4y2Ba
王静,金辉,李震,李旭,张静,肖磊,周勇,刘震,刘旭,秦锐,唐旭,刘伟,王勇,张勇,李俊,金海辉,Denoeud F,徐旭,梁旭,华伟,王旭,王杰,Chalhoub B, Paterson AH。的gydF4y2Ba芸苔属植物oleraceagydF4y2Ba基因组揭示了多倍体基因组的不对称进化。Nat Commun. 2014;5:3930。gydF4y2Ba
- 43.gydF4y2Ba
李华,Handsaker B, Wysoker A, Fennell T, ruj, Homer N, Marth G, Abecasis G, Durbin R.序列比对/映射格式与SAMtools。生物信息学。2009;25(16):2078 - 9。gydF4y2Ba
- 44.gydF4y2Ba
裴德华,李志强,李志强,等。应用HISAT、StringTie和Ballgown进行RNA-seq实验的转录水平分析。自然科学进展。2016;11(9):1650-67。gydF4y2Ba
- 45.gydF4y2Ba
Van Ooijen JW。JoinMap4:用于计算实验群体遗传连锁图谱的软件。瓦赫宁根:Kyazma BV;2006.gydF4y2Ba
- 46.gydF4y2Ba
袁艳,赵丽文,李玲。红甘蓝花青素生物合成的转录调控。足底。2009;230(6):1141 - 53年。gydF4y2Ba
致谢gydF4y2Ba
我们感谢Robert Larkin教授和华中农业大学王涛涛教授在这个项目上的帮助和建议。gydF4y2Ba
资金gydF4y2Ba
国家自然科学基金资助[31902058];湖北省农业科学院青年科学基金[2020NKYJJ04];中国农业研究系统[car -23—B-09]。所有的资助者都没有参与研究的设计、数据分析和写作。gydF4y2Ba
作者信息gydF4y2Ba
从属关系gydF4y2Ba
贡献gydF4y2Ba
C.Y.完成了主要的实验。L.Z.分析了BSR-seq数据。l。p。种植种群,检测表型,提取dna。C.Y.在z.q的帮助下完成了手稿,所有作者都阅读并批准了手稿。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
伦理批准并同意参与gydF4y2Ba
不适用。gydF4y2Ba
发表同意书gydF4y2Ba
不适用。gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者宣称他们之间没有利益冲突。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。gydF4y2Ba
补充信息gydF4y2Ba
附加文件1:表S1gydF4y2Ba
.BC1群体白化和花青素性状的表型。gydF4y2Ba表S2。gydF4y2Ba分子标记的定位gydF4y2Ba正义与发展党gydF4y2Ba在C03。gydF4y2Ba图S1。gydF4y2BaBC区白化病和正常人的表型gydF4y2Ba1gydF4y2Ba人口。gydF4y2Ba图S2gydF4y2BaBC区白化病、轻度白化病和正常人的表型gydF4y2Ba1gydF4y2BaFgydF4y2Ba2gydF4y2Ba人口。gydF4y2Ba图S3。gydF4y2Ba编码序列的对齐gydF4y2BaBol015404gydF4y2BaWK02 (WK)、RK01 (RK)和绿白菜(GC)的等位基因。文本S1基因组序列gydF4y2BaBol015404gydF4y2BaRK01 (RK)、WK01 (WK)和绿白菜(GC)。gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.创作共用公共领域奉献弃权书(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)适用于本条所提供的资料,除非在资料的信用额度中另有说明。gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
闫超,彭丽丽,张丽丽。gydF4y2Baet al。gydF4y2Ba观赏羽衣甘蓝低温诱导白化病候选基因的精细定位。gydF4y2BaBMC植物生物学gydF4y2Ba20.gydF4y2Ba460(2020)。https://doi.org/10.1186/s12870-020-02657-0gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12870-020-02657-0gydF4y2Ba
关键字gydF4y2Ba
- 白化特征gydF4y2Ba
- Semi-dominant继承gydF4y2Ba
- BSR-seqgydF4y2Ba
- 细胞色素P450基因gydF4y2Ba
- 观赏羽衣甘蓝gydF4y2Ba