- 研究文章gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
一种稳定的CRISPR/ rnps介导的甜辣品种基因编辑无dna筛选系统gydF4y2Ba甜椒gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba20.gydF4y2Ba、物品编号:gydF4y2Ba449gydF4y2Ba(gydF4y2Ba2020gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
无dna、聚类规律间隔短回文重复(CRISPR)相关蛋白(Cas)核糖核蛋白(RNP)的基因组编辑是一种简单、令人信服且有前景的精准作物育种工具。设计的基于crispr的基因组编辑工具的有效性是在作物中成功进行精确基因编辑的关键前提。gydF4y2Ba
结果gydF4y2Ba
该研究表明,土壤培养的叶片或愈伤组织来源的辣椒原生质体是筛选CRISPR/Cas9或CRISPR/Cas12a (Cpf1)高效向导rna的有用系统。将CRISPR/Cas9或Cpf1作为纯化的内切酶的CRISPR/RNP复合物与设计的单导RNA混合递送,可以编辑靶基因。gydF4y2BaCaMLO2gydF4y2Ba在两个全基因组测序的辣椒品种中,gydF4y2Ba甜椒gydF4y2Ba“CM334”和gydF4y2Bac .建立gydF4y2Ba邓普西。设计的引导rna (Cas9的sgrna或Cpf1的crrna)被保存为gydF4y2BaCaMLO2gydF4y2Ba在CM334和Dempsey和cleave中gydF4y2BaCaMLO2gydF4y2Ba体外。将CRISPR/Cas9-或/Cpf1-RNP复合物通过peg介导转染到辣椒CM334和甜椒Dempsey纯分离原生质体中。靶向深度测序分析表明gydF4y2BaCaMLO2gydF4y2Ba基因在两个品种中被不同地编辑,这取决于所应用的CRISPR/RNPs。gydF4y2Ba
结论gydF4y2Ba
基于辣椒原生质体的CRISPR引导rna选择是检验设计的CRISPR工具有效性的可靠方法,也是再生编辑过的植物的先决条件,这是一个关键的限时程序。针对目标基因组的快速和令人信服的引导RNA选择减少了组织培养的费力工作,并促进了辣椒改良的有效基因编辑。gydF4y2Ba
背景gydF4y2Ba
聚集规律间隔短回文重复序列(CRISPR)-CRISPR相关蛋白(Cas), CRISPR/Cas9在2012年被报道为可编程分子剪刀后,已成为第一个在任何测序基因组中引入目标突变的rna引导基因组编辑工具[gydF4y2Ba1gydF4y2Ba]。自获得基于spcas9的CRISPR工具以来gydF4y2Ba酿脓链球菌gydF4y2Ba在美国,从不同的菌株开发出了各种工具,例如gydF4y2Ba金黄色葡萄球菌gydF4y2BaCas9 [gydF4y2Ba2gydF4y2Ba],gydF4y2Ba弗朗西斯氏菌属novicidagydF4y2BaCas9 [gydF4y2Ba3.gydF4y2Ba],gydF4y2Ba乳酸链球菌gydF4y2BaCas9 [gydF4y2Ba4gydF4y2Ba),而gydF4y2Ba空肠弯曲杆菌gydF4y2BaCas9 [gydF4y2Ba5gydF4y2Ba]。这些开发的基于crispr的工具已迅速应用于从产生敲除细胞系和生物体到动物生物技术的各种研究领域[gydF4y2Ba6gydF4y2Ba,gydF4y2Ba7gydF4y2Ba],植物[gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10gydF4y2Ba,gydF4y2Ba11gydF4y2Ba]和人类[gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba,gydF4y2Ba14gydF4y2Ba]gydF4y2Ba。gydF4y2Ba
CRISPR/Cas12a (Cpf1)已被用于另一种有用的rna引导的基因组编辑工具,包括单个crRNA和Cpf1蛋白,其在crRNA加工,靶点识别和DNA切割中起作用[gydF4y2Ba15gydF4y2Ba]。从不同菌株中获得多种Cpf1蛋白,包括FnCpf1gydF4y2Ba土拉杆菌内gydF4y2Ba无性系种群。gydF4y2BanovicidagydF4y2BaU112 [gydF4y2Ba16gydF4y2Ba], LbCpf1 fromgydF4y2BaLachnospiraceae细菌gydF4y2BaND 2006和AsCpf1来自gydF4y2Ba氨基酸球菌属gydF4y2Basp. BV3L6 [gydF4y2Ba15gydF4y2Ba]。LbCpf1和AsCpf1工具均通过表达质粒在人细胞中显示出成功的编辑活性[gydF4y2Ba15gydF4y2Ba]或cpf1核糖核蛋白(RNP) [gydF4y2Ba17gydF4y2Ba]。LbCpf1和AsCpf1的编辑作用也通过Cpf1-RNP在大豆和烟草中成功验证[gydF4y2Ba18gydF4y2Ba]。然而,植物特异性降低了水稻中成熟含crrna质粒的编辑效率[gydF4y2Ba19gydF4y2Ba]以及大豆和烟草[gydF4y2Ba18gydF4y2Ba]。gydF4y2Ba
为了在不发生脱靶突变的情况下成功改进靶基因编辑,利用蛋白质工程技术设计了高保真版本的Cas9蛋白[gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba21gydF4y2Ba]。使用截断的Cas9引导RNA设计了一种引导RNA格式[gydF4y2Ba22gydF4y2Ba],化学合成Cpf1蛋白的向导RNA [gydF4y2Ba18gydF4y2Ba,gydF4y2Ba22gydF4y2Ba],或作为Cas9和Cpf1的5 ' -羟基引导RNA的解毒格式[gydF4y2Ba23gydF4y2Ba]。CRISPR工具靶向生物体的递送方法多种多样,包括基于机械力、化学和生物系统的方法。在植物中,轰击[gydF4y2Ba11gydF4y2Ba]、聚乙二醇(PEG)介导的[gydF4y2Ba24gydF4y2Ba),而gydF4y2Ba农杆菌属gydF4y2Ba介导的(gydF4y2Ba25gydF4y2Ba应用程序被用来传递设计好的CRISPR工具。gydF4y2Ba
辣椒gydF4y2Ba众所周知,来自茄科(Solanaceae)的辣椒对基因操作(如靶基因的转化和突变植物的产生)是难以抵抗的。虽然粒子轰击法对该属植物进行了有效的反向遗传研究,但仍缺乏有效的方法gydF4y2Ba农杆菌属gydF4y2Ba-介导的转化已经被广泛地测试了30多年,类似的方法也被开发出来用于茄科的其他属,如gydF4y2Ba茄属植物gydF4y2Ba包括番茄[gydF4y2Ba26gydF4y2Ba,gydF4y2Ba27gydF4y2Ba),gydF4y2Ba烟草gydF4y2Ba(烟草)gydF4y2Ba28gydF4y2Ba,gydF4y2Ba29gydF4y2Ba]。此外,基于crispr的基因组编辑工具尚未在辣椒中报道。gydF4y2Ba
c .建立gydF4y2Ba“CM334”和“Dempsey”分别具有完整的基因组信息,是研究辣椒和甜椒性状的优秀资源[gydF4y2Ba30.gydF4y2Ba,gydF4y2Ba31gydF4y2Ba]。与模式植物的原生质体系统不同,例如gydF4y2Ba拟南芥gydF4y2Ba辣椒原生质体是一种广泛用于细胞基础研究的植物,而辣椒原生质体在分离后由于其粘性而容易坍塌。最近,我们成功地从两种辣椒(辣椒CM334和甜椒Dempsey)的土生叶片中诱导并维持了辣椒源性愈伤组织[gydF4y2Ba32gydF4y2Ba]。这些愈伤组织支持稳定的辣椒原生质体,以表征辣椒和甜椒的细胞功能遗传学研究。gydF4y2Ba
白粉病是温室和大田作物(如番茄和胡椒)的一种重要真菌病。gydF4y2Ba33gydF4y2Ba,gydF4y2Ba34gydF4y2Ba]。在gydF4y2Ba抗霉位点gydF4y2Ba(gydF4y2Ba枣疯病gydF4y2Ba)植物的基因;gydF4y2BaAtMLO2gydF4y2Ba同属于V枝gydF4y2BaAtMLO6gydF4y2Ba和gydF4y2BaAtMLO12gydF4y2Ba,它是一种众所周知的易感基因,使零突变体对植物病原体具有广谱抗性,特别是对白粉病的抗性[gydF4y2Ba35gydF4y2Ba,gydF4y2Ba36gydF4y2Ba]。的基因组序列gydF4y2Bac .建立gydF4y2Ba' CM334 '大概包含18个成员gydF4y2BaCaMLOgydF4y2Ba(表gydF4y2Ba1gydF4y2Ba)。在此之前,gydF4y2BaCaMLO2gydF4y2Ba的同源词gydF4y2BaAtMLO2gydF4y2Ba据报道,该基因是辣椒抗生物营养和半生物营养病原体的易感基因[gydF4y2Ba37gydF4y2Ba,gydF4y2Ba38gydF4y2Ba]。由于辣椒缺乏靶向诱变,没有可用的辣椒gydF4y2BaCaMLOgydF4y2Ba基因突变体,除了自然变异。gydF4y2Ba
在这里,我们在两个辣椒品种中提出了一种无dna的基因组编辑方法,gydF4y2Bac .建立gydF4y2Ba' CM334 '和' Dempsey ',分别使用预组装的SpCas9或LbCpf1与单个引导RNA RNP, CRISPR/Cas9-RNP或CRISPR/LbCpf1-RNP。为了测试CRISPR- rnp工具是否可以在两种辣椒的细胞系统中筛选,我们将CRISPR/Cas9-RNPs或lbcpp1 - rnps传递到从土壤生长的登普西叶和增殖的CM334愈伤组织中分离的辣椒原生质体中,并分析了目标的插入和缺失(indel)频率和模式gydF4y2BaCaMLO2gydF4y2Ba基因。因此,基于辣椒原生质体的引导RNA筛选是评估所设计的CRISPR系统有效性的一个起点,可以进一步研究产生稳定转基因辣椒的相关基因。gydF4y2Ba
结果gydF4y2Ba
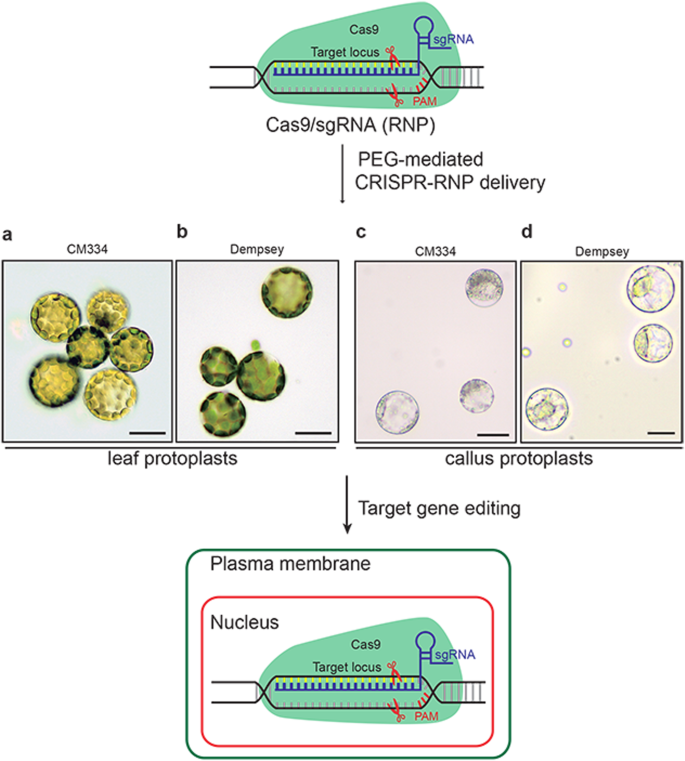
peg介导的CRISPR-RNP在辣椒原生质体中的传递gydF4y2Ba
为了评估CRISPR-RNPs是否可以传递到CM334和Dempsey的原生质体中,我们从土壤中生长的两种辣椒品种中分离出原生质体(图2)。gydF4y2Ba1gydF4y2Baa和b).邓普西叶原生质体足够稳定,可以应用于CRISPR-RNPs。相比之下,CM334叶片原生质体分离物虽然纯(图2)。gydF4y2Ba1gydF4y2Bab)在传递CRISPR/Cas9-RNP后不稳定且难以收获。此前,我们从土壤培养的CM334和Dempsey中建立了叶片衍生的愈伤组织,它们可以为细胞研究提供稳定的原生质体[gydF4y2Ba32gydF4y2Ba]。因此,我们探索了愈伤组织衍生的辣椒原生质体作为筛选合适基因编辑工具的平台(图2)。gydF4y2Ba1gydF4y2BaC和d)。gydF4y2Ba
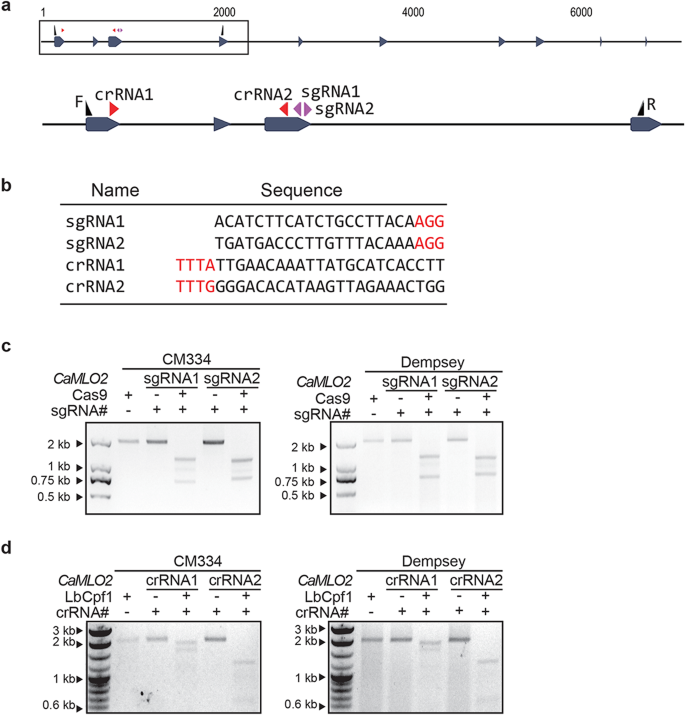
设计的Cas9和LbCpf1基因的CRISPR RNPs的体外验证gydF4y2Ba
的基因组区域gydF4y2BaCaMLO2gydF4y2Ba首先对CM334和Dempsey的基因进行Sanger测序分析,确认保守外显子序列。随后,我们在Cas9蛋白的第3外显子上设计了两个sgrna (sgRNA1: 5’-ACATCTTCATCTGCCTTACA-3’和sgRNA2: 5’TGATGACCCTTGTTTACAAA-3’),在LbCpf1的第1外显子和第3外显子上设计了两个crrna (crRNA1: 5’-TTGAACAAATTATGCATCACCTT-3’和crRNA2: 5’-GGGACACATAAGTTAGAAACTGG-3’)。gydF4y2Ba2gydF4y2Baa和b)。我们使用RGEN工具中的Cas-Designer对当前辣椒参考基因组进行了整个同源性搜索,选择了不超过两个核苷酸错配的特定引导rna [gydF4y2Ba39gydF4y2Ba]。我们在两个辣椒品种中进行了体外裂解实验,验证了Cas9- sgrna和LbCpf1- crrna的CRISPR-RNP复合物(分别由重组Cas9和LbCpf1蛋白以及体外转录的引导rna组成)的活性。的目标片段gydF4y2BaCaMLO2gydF4y2Ba用一对引物F和R扩增,如图所示。gydF4y2Ba2gydF4y2Baa和表gydF4y2Ba3.gydF4y2Ba。Cas9-RNPs和LbCpf1-RNPs有效地切割了gydF4y2BaCaMLO2gydF4y2Ba在CM334和Dempsey中gydF4y2Ba,gydF4y2Ba如预期(图2)。gydF4y2Ba2gydF4y2BaC和d)。gydF4y2Ba
CRISPR/Cas9或CRISPR/Cpf1 rnp介导的体外裂解实验gydF4y2BaCaMLO2gydF4y2Ba吉恩在两个辣椒里。gydF4y2Ba一个gydF4y2Ba的目标轨迹gydF4y2BaCaMLO2gydF4y2Ba基因,四个设计的引导rna (Cas9的sgRNA1和sgRNA2, LbCpf1的crRNA1和crRNA2)和一个特定的引物对F和R。gydF4y2BabgydF4y2Ba四种引导rna的靶序列。gydF4y2BacgydF4y2Ba体外裂解实验以预组装的Cas9-only为对照,Cas9-sgRNA1和Cas9-sgRNA2为对照gydF4y2BaCaMLO2gydF4y2BaCM334或Dempsey基因。gydF4y2BadgydF4y2Ba体外裂解实验以预组装的LbCpf1-only为对照,LbCpf1-crRNA1和LbCpf1-crRNA2为对照gydF4y2BaCaMLO2gydF4y2BaCM334和Dempsey基因gydF4y2Ba
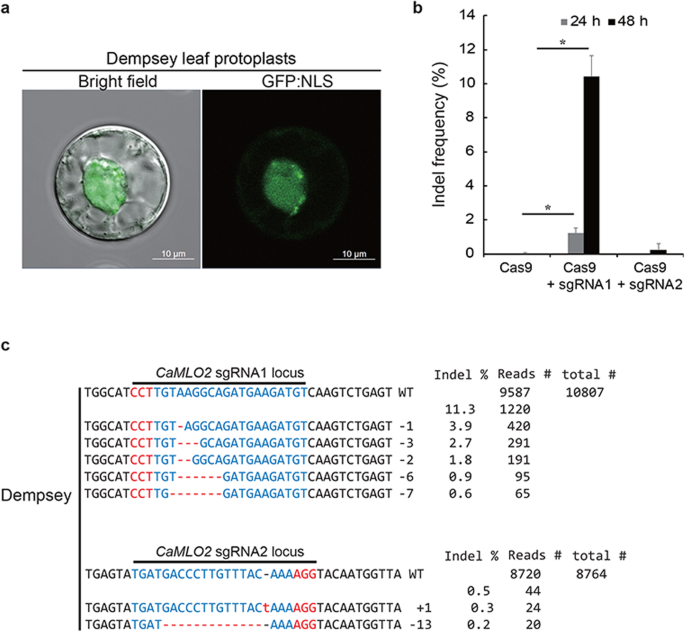
邓普西叶原生质体CRISPR/Cas9-RNP分析gydF4y2Ba
我们研究了peg介导的CRISPR/Cas9 RNP在CM334和邓普西叶原生质体中的传递。首先,我们测试了辣椒原生质体是否被含有GFP:NLS表达盒作为核标记的传统质粒瞬时转染。邓普西叶原生质体被有效转染,孵育24小时后细胞核内显示出GFP信号(图2)。gydF4y2Ba3.gydF4y2Baa).然而,CM334叶片原生质体不够稳定,无法表达转染的质粒或CRISPR/Cas9 RNP。此外,成功转染邓普西叶原生质体并维持到转染的GFP质粒检测或随后的基因型分析。转染CRISPR/Cas9-RNP的Dempsey原生质体在孵育24 h和48 h时收获(图2)。gydF4y2Ba3.gydF4y2Bab).这些用于提取基因组DNA并进行靶向深度测序,以分析目标位点的indel频率和模式gydF4y2BaCaMLO2gydF4y2Ba基因。24 h时使用CRISPR/Cas9-RNP的Indels在靶位点被捕获,sgRNA1的频率为1.23%,sgRNA2的频率为0.02%gydF4y2BaCaMLO2gydF4y2Ba24 h(图2)gydF4y2Ba3.gydF4y2Bab).孵育48小时后,靶位点上的指数显著增加,sgRNA1的指数为11.3%,sgRNA2的指数为0.5%(图2)。gydF4y2Ba3.gydF4y2Bab).绝大多数的索引都是在gydF4y2BaCaMLO2gydF4y2Ba与Cas9-sgRNA2相比,使用Cas9-sgRNA1复合物的基因缺失了位于PAM上游3bp的几个核苷酸(如5 ' -CCT-3 ')。gydF4y2Ba3.gydF4y2Bac).这一结果表明,设计的含有CRISPR/Cas9-RNP复合物的sgRNA1能够更有效地编辑gydF4y2BaCaMLO2gydF4y2BasgRNA2基因。这些结果表明,登普西叶原生质体是一个稳定的细胞系统,可用于验证CRISPR/Cas9-RNP在甜椒中的高效靶基因编辑。gydF4y2Ba
CRISPR/Cas9 rnp介导的登普西叶原生质体gydF4y2BaCaMLO2gydF4y2Ba编辑。gydF4y2Ba一个gydF4y2Ba邓普西叶原生质体表达核靶向GFP:NLS。gydF4y2BabgydF4y2BaCas9-sgRNA1和Cas9-sgRNA2转染邓普西叶原生质体的频率比较低。竖线代表平均值±标准差(gydF4y2BangydF4y2Ba= 3)。星号表示有显著差异gydF4y2BaPgydF4y2Ba与仅cas9相比,方差分析< 0.01。gydF4y2BacgydF4y2BaCas9-sgRNA1和Cas9-sgRNA2编辑的Indel模式gydF4y2BaCaMLO2gydF4y2Ba位点。通过靶向深度测序获得总reads。Indel频率(%)计算为测量的读取数除以总读取数。红色,PAM序列;蓝色,CRISPR靶序列;红色虚线和-,缺失的核苷酸;红色字母和+,插入的核苷酸gydF4y2Ba
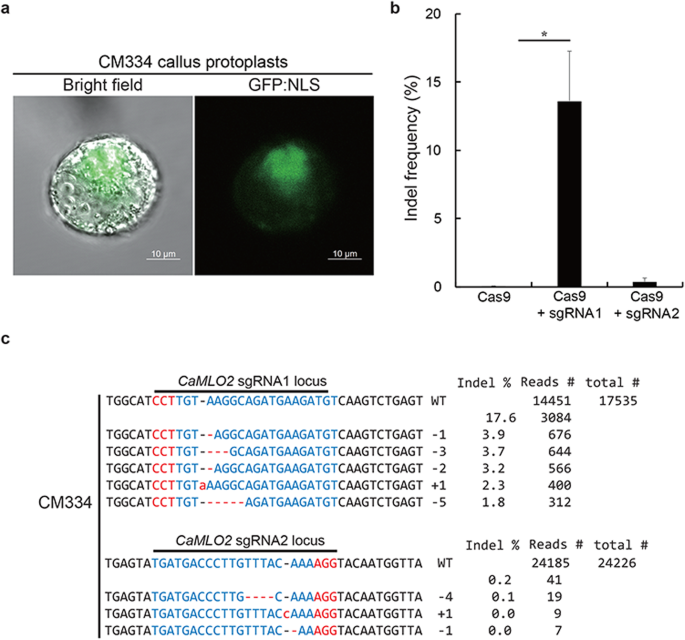
CM334愈伤组织原生质体CRISPR/Cas9-RNP分析gydF4y2Ba
为了探索CM334的细胞系统,我们使用了CM334叶片的愈伤组织。获得了CM334愈伤组织原生质体的纯分离物(图2)。gydF4y2Ba1gydF4y2Bac)用含有GFP:NLS表达盒的质粒转染。转染后的CM334愈伤组织原生质体在孵育48 h后在细胞核中表达并明显显示出GFP信号(图2)。gydF4y2Ba4gydF4y2Baa).因此,我们进一步探究了CM334愈伤组织原生质体是否携带CRISPR/Cas9-RNP,并验证了活性引导rna作为评价CRISPR- rnp的筛选系统。我们将预组装的Cas9蛋白与设计的sgRNA1和sgRNA2作为RNP复合物一起递送到CM334愈伤组织原生质体中。转染后的CM334愈伤组织原生质体孵育48 h,分析编辑效果。Cas9-only对照未在靶位点诱导任何突变gydF4y2BaCaMLO2gydF4y2Ba而Cas9-sgRNA1复合物在靶位点诱导了17.6%的indel突变(图2)。gydF4y2Ba4gydF4y2Ba然而,与Cas9-sgRNA1复合物不同,Cas9-sgRNA2复合物的活性(约0.2%)在诱导indel突变方面效率较低,尽管存在稀疏的indel模式(图2)。gydF4y2Ba4gydF4y2Bab和c)。活性Cas9-sgRNA1复合物主要导致几个核苷酸的缺失。这些结果表明Cas9-sgRNA1 RNP复合物积极编辑gydF4y2BaCaMLO2gydF4y2Ba并可用于进一步的再生程序生产gydF4y2BaCaMLO2gydF4y2Ba辣椒CM334的突变。gydF4y2Ba
CRISPR/Cas9 rnp介导的CM334愈伤组织原生质体gydF4y2BaCaMLO2gydF4y2Ba编辑。gydF4y2Ba一个gydF4y2BaCM334愈伤组织原生质体表达以细胞核为靶点的GFP:NLS。gydF4y2BabgydF4y2BaCas9-sgRNA1和Cas9-sgRNA2转染CM334愈伤组织原生质体的频率无显著差异。竖线代表平均值±标准差(gydF4y2BangydF4y2Ba= 4)。星号表示差异显著gydF4y2BaPgydF4y2Ba与仅cas9相比,方差分析< 0.01。gydF4y2BacgydF4y2BaCas9-sgRNA1和Cas9-sgRNA2编辑的Indel模式gydF4y2BaCaMLO2gydF4y2Ba位点。通过靶向深度测序获得总reads。Indel频率(%)计算为测量的读取数除以总读取数。红色,PAM序列;蓝色,CRISPR靶序列;红色虚线和-,缺失的核苷酸;红色字母和+,插入的核苷酸gydF4y2Ba
CM334愈伤组织原生质体CRISPR/LbCpf1-RNP分析gydF4y2Ba
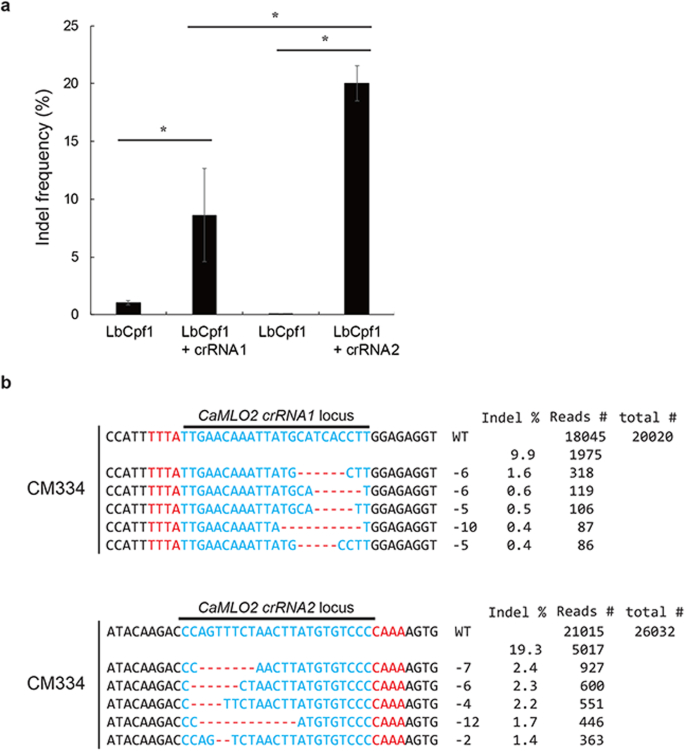
我们通过peg介导的传递检测了LbCpf1-RNP在CM334愈伤组织原生质体中的活性。LbCpf1-crRNA1和LbCpf1-crRNA2复合物成功转染到CM334愈伤组织原生质体中。与叶片原生质体不同,转染的愈伤组织原生质体足够稳定,可用于评估indel突变。以仅含LbCpf1的原生质体为对照,进行LbCpf1 RNP转化。转染LbCpf1-crRNA复合物的原生质体中,LbCpf1-crRNA1的indel频率为9.9%,LbCpf1-crRNA2的indel频率为19.3%。gydF4y2Ba5gydF4y2Baa).基于诱导indel频率,设计的LbCpf1-crRNA2活性比LbCpf1-crRNA1活性高2倍gydF4y2BaCaMLO2gydF4y2Ba基因位点。正如先前报道的那样,设计的引导rna在大豆、卷心菜和矮牵牛中具有不同的活性[gydF4y2Ba18gydF4y2Ba,gydF4y2Ba40gydF4y2Ba,gydF4y2Ba41gydF4y2Ba],两个设计的crrnagydF4y2BaCaMLO2gydF4y2Ba基于靶基因序列背景的未知特性,表现出不同的编辑效果。gydF4y2Ba
CM334愈伤组织原生质体为CRISPR/LbCpf1 rnp介导gydF4y2BaCaMLO2gydF4y2Ba编辑。gydF4y2Ba一个gydF4y2Ba培养48 h后,LbCpf1-crRNA1和LbCpf1-crRNA2转染CM334愈伤组织原生质体的频率比较。竖线代表平均值±标准差(gydF4y2BangydF4y2Ba= 3)。星号表示差异显著gydF4y2BaPgydF4y2Ba单因素方差分析与LbCpf1比较< 0.01。gydF4y2BabgydF4y2BaLbCpf1-crRNA1和LbCpf1-crRNA2编辑的Indel模式gydF4y2BaCaMLO2gydF4y2Ba位点。通过靶向深度测序获得总reads。Indel频率(%)计算为测量的读取数除以总读取数。红色,TTTN的PAM序列;蓝色,CRISPR靶序列;红色虚线和-,删除的核苷酸gydF4y2Ba
靶向LbCpf1-crRNA1复合物的indel模式在不同的位点发生变化gydF4y2BaCaMLO2gydF4y2Ba在CM334愈伤组织原生质体中,有几个核苷酸缺失(- 6,- 5和- 10)。gydF4y2Ba5gydF4y2Bab).其他靶向LbCpf1-crRNA2复合物也表现出不同的indel模式,核苷酸(- 7,- 6,- 4,- 12和- 2)明显缺失gydF4y2BaCaMLO2gydF4y2BacrRNA2位点位于前5位的reads中(图2)。gydF4y2Ba5gydF4y2Bab).经验证的LbCpf1-crRNA2配合物可用于gydF4y2BaCaMLO2gydF4y2Ba在CM334中编辑。这些数据表明,已建立的稳定的辣椒原生质体是筛选有效CRISPR工具的强大系统,可用于辣椒的精确编辑。gydF4y2Ba
讨论gydF4y2Ba
在这里,我们证明了邓普西叶原生质体和CM334愈伤组织原生质体是基于细胞的稳定和强大的系统,用于评估CRISPR工具Cas9和LbCpf1。使用设计的引导rna, Cas9的sgRNAs和LbCpf1的crrna,我们可以检查应用的引导rna是否足够活跃,能够在目标位点特异性诱导基因编辑。在Dempsey中,Cas9-sgRNA1 RNP的平均频率为11.3%。因此,设计的Cas9-sgRNA1复合体可以用于生成gydF4y2BaCaMLO2 -gydF4y2Ba广谱抗白粉病编辑邓普西椒[gydF4y2Ba38gydF4y2Ba]和半生物营养细菌病原体,如gydF4y2Ba黄定gydF4y2Bapv。gydF4y2Ba实验gydF4y2Ba和gydF4y2Ba两gydF4y2Bapv。gydF4y2Ba番茄gydF4y2Ba(gydF4y2Ba太平洋标准时间gydF4y2Ba) dc3000 [gydF4y2Ba37gydF4y2Ba]。然而,Cas9-sgRNA2 RNP并不足以诱导sgRNA2位点的indel突变gydF4y2BaCaMLO2gydF4y2Ba。虽然在整个参考基因组中都可以使用硅设计的引导rna,但设计的引导rna的功效需要在目标基因组的目标基因中进行验证。由于靶基因序列背景的染色质结构或表观遗传修饰等未知特性,我们在之前的报道中经常观察到基因编辑效率的差异[gydF4y2Ba18gydF4y2Ba,gydF4y2Ba40gydF4y2Ba,gydF4y2Ba41gydF4y2Ba]。因此,一个稳定的活性CRISPR工具筛选工具对于作物编辑的成功至关重要。gydF4y2Ba
在登普西叶原生质体中进行CRISPR/Cas9-RNP分析,结果显示设计的Cas9-sgRNA1复合体的编辑效率提高了22倍gydF4y2BaCaMLO2gydF4y2Ba与Cas9-sgRNA2复合物相比同样,Cas9-sgRNA1 RNP复合物在CM334愈伤组织原生质体中的indel频率比Cas9-sRNA2 RNP高88倍。设计的用于Cas9编辑的sgrna的功效gydF4y2BaCaMLO2gydF4y2Ba尽管两种辣椒属不同品种,但登普西辣椒叶片原生质体与CM334的愈伤组织原生质体相似。此外,Cas9-sgRNA1复合物诱导的indel模式与Dempsey和CM334中的主要缺失相似。不可否认,现在提出辣椒基因组编辑中引导RNA的功效和模式的一般规则还为时过早。然而,这一结果提出了一个有趣的问题,即为保守目标位点设计的引导RNA是否在辣椒品种中具有广泛的功效。这种可能性可以在全基因组尺度上进行系统的研究。gydF4y2Ba
之前,我们报道了另一种CRISPR-RNP工具,LbCpf1-crRNA复合物,成功地在两个靶向位点诱导了索引gydF4y2BaFAD2-1AgydF4y2Ba和gydF4y2BaFAD2-1BgydF4y2Ba在大豆中[gydF4y2Ba18gydF4y2Ba]。在这里,我们还测试了CRISPR/LbCpf1-RNP在辣椒基因编辑中的活性。我们证明了设计的crRNA1和cRNA2对LbCpf1的功效显着差异超过两倍。结果表明,CRISPR/LbCpf1-RNP对两种辣椒的靶基因进行了精确有效的编辑。gydF4y2Ba
作为通过CRISPR RNPs进行目标特异性编辑的对照实验,我们将不含引导RNA的CRISPR蛋白(Cas9-only或LbCpf1-only)递送到辣椒原生质体中。在sgRNA1和sgRNA2中仅存在cas9, crRNA2中仅存在lbcpf1的情况下,该基因的靶位点未发生诱导突变gydF4y2BaCaMLO2gydF4y2Ba基因。然而,lbcpf1只针对crRNA1位点gydF4y2BaCaMLO2gydF4y2Ba边际indel频率如图所示。gydF4y2Ba5gydF4y2Baa.目标crRNA1位点3 '下游侧翼区胸腺嘧啶13bp的重复核苷酸序列可能导致了频率上的噪声(图2)。gydF4y2Ba5gydF4y2Baa)和模式(图S)gydF4y2Ba1gydF4y2Ba),与CRISPR-crRNA1复合物的特异性indel突变不同(图2)。gydF4y2Ba5gydF4y2Baa和b)。LbCpf1-only在crRNA1位点上的缺失很可能是由于进行下一代测序(NGS)时连续三次PCR制备所引入的错误。LbCpf1系统需要在引导RNA (crRNA)上游5 '处有TTTN, T-rich protospacer邻基序(PAM)序列。几个gydF4y2Ba在sillicogydF4y2Ba在靶基因组中为LbCpf1设计的crrna位于富含at的位点或重复序列,这是由于PAM特性的高可能性。因此,验证目标突变是否在目标基因中设计的crRNA的靶位点诱导是至关重要的。gydF4y2Ba
此外,我们还发现,在邓普西叶原生质体中,活性引导rna(如Cas9的sgRNA1)的编辑效果与辣椒原生质体的培养时间有关。对于编辑效率gydF4y2BaCaMLO2gydF4y2Ba在CM334中,设计的Cas9-sgRNA1-RNP与测试的LbCpf1-crRNA2-RNP相当。结果显示,在所测试的Cas9和LbCpf1 rnp中,Cas9- rnp和LbCpf1- rnp的indel频率最高,分别为17.6%和19.3%。因此,Cas9-sgRNA1复合体和LbCpf1-crRNA2都可以作为实用的编辑工具gydF4y2BaCaMLO2gydF4y2Ba在CM334辣椒。gydF4y2Ba
自从第一次开创性的出版以来gydF4y2Ba拟南芥gydF4y2Ba烟草和大米[gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10gydF4y2Ba],使用基于crispr的工具获得了各种编辑作物,包括大米等主食[gydF4y2Ba8gydF4y2Ba],小麦[gydF4y2Ba11gydF4y2Ba],大豆[gydF4y2Ba18gydF4y2Ba,gydF4y2Ba42gydF4y2Ba]和玉米[gydF4y2Ba43gydF4y2Ba]以及蔬菜和水果,如西红柿[gydF4y2Ba44gydF4y2Ba],土豆[gydF4y2Ba45gydF4y2Ba],西瓜[gydF4y2Ba46gydF4y2Ba]和卷心菜[gydF4y2Ba40gydF4y2Ba]。据我们所知,本报告为辣椒和甜椒品种的精确辣椒编辑提供了第一个数据。我们成功编辑了gydF4y2BaCaMLO2gydF4y2Ba两个已知全基因组序列辣椒品种原生质体中的基因。已建立的叶片或愈伤组织原生质体是强大的系统,适合探索已解决的crispr - rnp以及新开发的基因组编辑工具,以改善辣椒性状。gydF4y2Ba
结论gydF4y2Ba
设计的无dna、聚类规则间隔短回文重复序列(CRISPR)/核糖核蛋白(RNPs)筛选系统是对辣椒和甜椒进行精确基因组编辑的强大和先决工具。gydF4y2Ba
方法gydF4y2Ba
植物材料和原生质体分离gydF4y2Ba
c .建立gydF4y2Ba品种CM334和Dempsey由韩国蔬菜育种研究中心(VBRC)提供gydF4y2Ba。gydF4y2BaCM334和Dempsey在25±1°C的生长室内,在16 h光照和8 h暗光周期下在土壤中萌发和生长。辣椒CM334在愈伤组织诱导培养基(CIM,含B5维生素、3%蔗糖、1 mg/L 2,4-二氯苯氧乙酸的MS培养基)中产生愈伤组织,每3周在CIM中定期继代培养。gydF4y2Ba32gydF4y2Ba]。将两个品种的辣椒愈伤组织在细胞壁消化酶溶液中消化[gydF4y2Ba47gydF4y2Ba]在24±1℃下培养3-4 h,分离原生质体。将消化后的辣椒原生质体用等体积的W5溶液(154 mM NaCl, 125 mM CaCl)稀释gydF4y2Ba2gydF4y2Ba, 5mm KCl, 5mm葡萄糖,1.5 mM Mes-KOH, pH 5.6)去除细胞壁消化酶溶液。在58℃下离心,轻轻收集辣椒原生质体gydF4y2BaggydF4y2Ba5分钟,然后用W5溶液冲洗2次。用血细胞计对纯分离辣椒原生质体进行计数。大约5 × 10gydF4y2Ba4gydF4y2Ba分离的原生质体用于peg介导的CRISPR-RNPs传递,如前所述[gydF4y2Ba18gydF4y2Ba稍加修改。简单地说,将Cas9或LbCpf1蛋白与硅设计的导RNA按1:6 M的比例在室温下预混1小时。将预组装好的RNP混合物与计算好的原生质体一起仔细悬浮在300 μl的MMG溶液中(400 mM甘露醇,15 mM MgCl)gydF4y2Ba2gydF4y2Ba, 5 mM MES;pH值5.6)。随后,取等体积新鲜制备的PEG溶液(200mm甘露醇,100mm氯化钙)gydF4y2Ba2gydF4y2Ba加入40% PEG 4000)。将与peg混合的辣椒原生质体用W5溶液等量连续稀释洗涤三次。58 g离心5分钟,然后在W5溶液中孵育。孵育指定时间(24或48 h)后,制备转染crispr - rnps的原生质体,提取基因组DNA,最后分析目的基因编辑。gydF4y2Ba
导RNA的设计与制备gydF4y2Ba
CaMLO2gydF4y2Ba采用Sanger测序对两个品种的基因组区域进行测序,确定核苷酸序列并设计引导rna。我们使用了RGEN工具中的Cas-Designer (gydF4y2Bahttp://rgenome.netgydF4y2Ba)设计Cas9特异性候选sgrna和LbCpf1特异性候选crrna。我们在Cas9的第三外显子上获得了两个sgrna (sgrna1:5 ' -ACATCTTCATCTGCCTTACA-3 ', sgRNA2: 5 ' -TGATGACCCTTGTTTACAAA-3 '),在LbCpf1的第一和第三外显子上获得了两个crrna (crrna1:5 ' -TTGAACAAATTATGCATCACCTT-3 ', crRNA2: 5 ' -GGGACACATAAGTTAGAAACTGG-3 ')。采用T7 RNA聚合酶(New England Biolabs, MA, USA)体外转录合成引导RNA,如前所述[gydF4y2Ba18gydF4y2Ba,gydF4y2Ba24gydF4y2Ba]。用于体外转录的引物列于表中gydF4y2Ba2gydF4y2Ba。gydF4y2Ba
使用CRISPR工具进行体外切割实验gydF4y2Ba
辣椒基因组DNA是用Plant SV Mini试剂盒(GeneAll, Seoul, South Korea)制备的,并用作扩增目标DNA区域的模板gydF4y2BaCaMLO2gydF4y2Ba。设计的引导rna的活性通过体外裂解实验得到验证[gydF4y2Ba18gydF4y2Ba]。简单地说,用纯化的Cas9或LbCpf1 2 μg和导RNA 1.5 μg,在2 μL的10X NEB 3.1缓冲液(NEB)中,在37℃下酶切240 ng目标DNA扩增子1.5 h,然后与RNase A在37℃下孵育1 h。用MG PCR纯化SV试剂盒(MGmed, Seoul, South Korea)纯化酶切目标DNA,琼脂糖凝胶电泳分析。gydF4y2Ba
靶向深度测序gydF4y2Ba
通过靶向深度测序分析indel频率和模式[gydF4y2Ba18gydF4y2Ba]。用特定引物扩增辣椒基因组DNA(见表)gydF4y2Ba3.gydF4y2Ba)。目标扩增子通过连续pcr连接多路索引和特异性测序接头,并使用Illumina Miseq (V2, 300周期)(Macrogen, Seoul, South Korea)进行高通量测序。配对端Miseq原始数据采用Cas-Analyzer (gydF4y2Bahttp://www.rgenome.net/cas-analyzer/ !gydF4y2Ba)从RGEN工具[gydF4y2Ba48gydF4y2Ba]。gydF4y2Ba
统计分析gydF4y2Ba
这些数据是至少三个具有标准偏差的生物重复的平均值。显著性差异(*,gydF4y2BaPgydF4y2Ba< 0.01),采用事后Tukey HSD进行单因素方差分析。gydF4y2Ba
数据和材料的可用性gydF4y2Ba
当前研究中使用和/或分析的数据集可根据通讯作者的合理要求提供。辣椒品种应向蔬菜育种研究中心(VBRC)申请。gydF4y2Ba
缩写gydF4y2Ba
- 中科院:gydF4y2Ba
-
CRISPR-associated蛋白质gydF4y2Ba
- CRISPR:gydF4y2Ba
-
有规则间隔的短回文重复gydF4y2Ba
- crRNA:gydF4y2Ba
-
CRISPR RNAgydF4y2Ba
- 枣疯病:gydF4y2Ba
-
抗霉位点OgydF4y2Ba
- 挂钩:gydF4y2Ba
-
聚乙二醇gydF4y2Ba
- RNP:gydF4y2Ba
-
核糖核蛋白gydF4y2Ba
- sgRNA:gydF4y2Ba
-
单导RNAgydF4y2Ba
参考文献gydF4y2Ba
- 1.gydF4y2Ba
李建军,刘建军,李建军,等。一种可编程双rna引导DNA内切酶在细菌免疫中的应用。科学。2012;337:816-21。gydF4y2Ba
- 2.gydF4y2Ba
冉发,孔磊,闫文新,Scott DA, Gootenberg JS, Kriz AJ,等。体内基因组编辑使用gydF4y2Ba金黄色葡萄球菌gydF4y2BaCas9。大自然。2015;520:186 - 91。gydF4y2Ba
- 3.gydF4y2Ba
Price AA, Sampson TR, Ratner HK, Grakoui A, Weiss DS。真核细胞中cas9介导的病毒RNA靶向。科学通报,2015;12(2):664 - 664。gydF4y2Ba
- 4.gydF4y2Ba
Muller M, Lee CM, Gasiunas G, Davis TH, Cradick TJ, Siksnys V,等。gydF4y2Ba乳酸链球菌gydF4y2BaCRISPR-Cas9系统能够对人类基因组进行特异性编辑。医学通报,2016;24:636-44。gydF4y2Ba
- 5.gydF4y2Ba
金恩,具涛,朴世文,金东,金坤,赵海燕,等。体内基因组编辑与一个小的Cas9同源物衍生自gydF4y2Ba空肠弯曲杆菌gydF4y2Ba。学报。2017;8:14500。gydF4y2Ba
- 6.gydF4y2Ba
王辉,杨辉,Shivalila CS, Dawlaty MM,程文华,张飞,等。通过CRISPR/ cas介导的基因组工程一步生成携带多个基因突变的小鼠。细胞。2013;153:910-8。gydF4y2Ba
- 7.gydF4y2Ba
李丹,邱忠,邵毅,陈毅,关毅,刘敏,等。使用CRISPR-Cas系统在小鼠和大鼠中进行遗传基因靶向。生物工程学报。2013;31(1):681 - 683。gydF4y2Ba
- 8.gydF4y2Ba
单强,王勇,李军,张勇,陈坤,梁震,等。利用CRISPR-Cas系统对农作物进行靶向基因组修饰。生物工程学报。2013;31(6):686 - 888。gydF4y2Ba
- 9.gydF4y2Ba
李建峰,Norville JE, Aach J, McCormack M, Zhang D, Bush J,等。多重和同源重组介导的基因组编辑gydF4y2Ba拟南芥gydF4y2Ba和gydF4y2Ba烟草benthamianagydF4y2Ba使用向导RNA和Cas9。生物工程学报。2013;31(1):688 - 691。gydF4y2Ba
- 10.gydF4y2Ba
李建军,李建军,李建军,等。植物诱变技术的研究进展gydF4y2Ba烟草benthamianagydF4y2Ba使用Cas9 rna引导的内切酶。生物工程学报。2013;31(6):691 - 391。gydF4y2Ba
- 11.gydF4y2Ba
王勇,程霞,单强,张勇,刘健,高超,等。同时编辑六倍体面包小麦的三个同等位基因可获得对白粉病的遗传抗性。生物工程学报,2014;32:947-51。gydF4y2Ba
- 12.gydF4y2Ba
丛丽,冉芳,Cox D,林世生,Barretto R, Habib N,等。使用CRISPR/Cas系统的多重基因组工程。科学。2013;339:819-23。gydF4y2Ba
- 13.gydF4y2Ba
Mali P, Yang L, Esvelt KM, Aach J, Guell M, DiCarlo JE,等。rna引导的Cas9人类基因组工程。科学。2013;339:823-6。gydF4y2Ba
- 14.gydF4y2Ba
赵秀文,金生,金建民,金建生。Cas9 rna引导的核酸内切酶在人类细胞中的靶向基因组工程。生物医学工程学报。2013;31(1):230 - 2。gydF4y2Ba
- 15.gydF4y2Ba
Zetsche B, Gootenberg JS, Abudayyeh OO, Slaymaker IM, Makarova KS, Essletzbichler P,等。Cpf1是一类CRISPR-Cas系统的单rna引导内切酶。细胞。2015;163:759 - 71。gydF4y2Ba
- 16.gydF4y2Ba
Schunder E, Rydzewski K, Grunow R, Heuner K.第一个功能CRISPR/Cas系统的适应症gydF4y2Ba土拉杆菌内gydF4y2Ba。中华微生物学杂志,2013;33(3):51 - 60。gydF4y2Ba
- 17.gydF4y2Ba
许建军,金坤,陈国强,白国光,叶思,许建伟,等。Cpf1核糖核蛋白电穿孔致小鼠靶向突变。生物工程学报,2016;34(4):847 - 856。gydF4y2Ba
- 18.gydF4y2Ba
金海,金绍涛,刘健,姜宝成,金建生,金绍国。CRISPR/ cpf1介导的无dna植物基因组编辑。生态学报,2017;8:14406。gydF4y2Ba
- 19.gydF4y2Ba
徐锐,秦锐,李红,李东,李丽,魏鹏,等。利用CRISPR-Cpf1系统产生靶向突变水稻。植物学报,2017;15(3):713 - 713。gydF4y2Ba
- 20.gydF4y2Ba
kleinstver BP, Pattanayak V, Prew MS, Tsai SQ, Nguyen NT,郑铮,等。高保真CRISPR-Cas9核酸酶,无可检测的全基因组脱靶效应。大自然。2016;529:490-5。gydF4y2Ba
- 21.gydF4y2Ba
Slaymaker IM, Gao L, Zetsche B, Scott DA,闫文霞,Zhang F.合理修饰Cas9核酸酶的特异性。科学。2016;351:84-8。gydF4y2Ba
- 22.gydF4y2Ba
付勇,Sander JD, Reyon D, Cascio VM, young JK。利用截断的引导rna提高CRISPR-Cas核酸酶特异性。生物工程学报,2014;32(2):279 - 84。gydF4y2Ba
- 23.gydF4y2Ba
金,古永锵T, Jee h G,曹H-Y,李G, Lim d, et al。CRISPR rna在人类细胞中引发先天免疫反应。生物医学工程学报,2018;28(2):367 - 73。gydF4y2Ba
- 24.gydF4y2Ba
吴建伟,金俊,权思,Corvalan C,赵世文,金辉,等。利用预组装的CRISPR-Cas9核糖核蛋白对植物进行无dna基因组编辑。生物工程学报。2015;33:1164 - 4。gydF4y2Ba
- 25.gydF4y2Ba
苗军,郭东,张军,黄强,秦刚,张旭,等。利用CRISPR-Cas系统进行水稻靶向诱变。科学通报,2013;23:1233-6。gydF4y2Ba
- 26.gydF4y2Ba
朴世祥,Morris JL, Park JE, Hirschi KD, Smith RH。高效且不依赖基因型gydF4y2Ba农杆菌属gydF4y2Ba介导的番茄转化。植物生理学报,2003;16(2):554 - 557。gydF4y2Ba
- 27.gydF4y2Ba
Cortina C, Culiáñez-Macià FA。番茄转化及转基因植株生产。植物细胞、组织和器官。2004;76:269-75。gydF4y2Ba
- 28.gydF4y2Ba
Klein TM, Harper EC, Svab Z, Sanford JC, Fromm ME, Maliga P.gydF4y2Ba烟草gydF4y2Ba细胞被粒子轰击过程。科学通报,1998;35(5):391 - 391。gydF4y2Ba
- 29.gydF4y2Ba
李建军,李建军,李建军,李建军。gydF4y2Ba农杆菌属gydF4y2Ba的-介导变换gydF4y2Ba烟草attenuata则gydF4y2Ba,一个典型的生态表达系统。Chemoecology。2002;12:177 - 83。gydF4y2Ba
- 30.gydF4y2Ba
金顺,朴敏,廉世义,金玉明,李建明,李海霞,等。辣椒的基因组序列为辣椒的辛辣进化提供了新的见解gydF4y2Ba辣椒gydF4y2Ba物种。Nat Genet. 2014; 46:270-8。gydF4y2Ba
- 31.gydF4y2Ba
秦超,于超,沈勇,方旭,陈磊,闵军,等。栽培辣椒和野生辣椒的全基因组测序提供了深入了解gydF4y2Ba辣椒gydF4y2Ba驯化和专业化。科学通报,2014;31(5):556 - 556。gydF4y2Ba
- 32.gydF4y2Ba
金辉,林俊。辣椒“CM334”和甜椒“Dempsey”叶片诱导愈伤组织的形成。植物信号学报,2019;14:16 - 16。gydF4y2Ba
- 33.gydF4y2Ba
Cerkauskas RF, Buonassisi A.温室辣椒白粉病的首次报道gydF4y2BaLeveillula tauricagydF4y2Ba在加拿大不列颠哥伦比亚省。植物学报,2003;87:1151。gydF4y2Ba
- 34.gydF4y2Ba
刘建军,刘建军,刘建军,等gydF4y2BaLeveillula tauricagydF4y2Ba甜椒白粉病。植物病理学。2007;97:813-24。gydF4y2Ba
- 35.gydF4y2Ba
conhnni C, Humphry ME, Hartmann HA, Livaja M, Durner J, Westphal L,等。白粉病发病机制中植物寄主细胞蛋白的保守需求。生物医学学报。2006;38:716-20。gydF4y2Ba
- 36.gydF4y2Ba
Acevedo-Garcia J, Gruner K, reinstler A, Kemen A, Kemen E, Cao L,等。抗白粉病gydF4y2Ba拟南芥mlo2 mlo6 mlo12gydF4y2Ba三突变体显示不同类型的植物病原体改变感染表型。科学通报2017;7:939。gydF4y2Ba
- 37.gydF4y2Ba
Kim DS, Hwang BK.辣椒gydF4y2Ba枣疯病gydF4y2Ba的基因,gydF4y2BaCaMLO2gydF4y2Ba参与易感性细胞死亡反应以及细菌和卵菌的增殖。植物科学学报,2012;32(2):444 - 444。gydF4y2Ba
- 38.gydF4y2Ba
郑忠,野村T, Appiano M, Pavan S, Matsuda Y, Toyoda H,等。功能丧失gydF4y2Ba枣疯病gydF4y2Ba同源物降低了辣椒和番茄对白粉病的易感性gydF4y2BaLeveillula tauricagydF4y2Ba。科学通报,2013;8:e70723。gydF4y2Ba
- 39.gydF4y2Ba
朴杰,裴三,金继生。Cas-designer:一个基于网络的选择CRISPR-Cas9靶点的工具。生物信息学。2015;31:4014-6。gydF4y2Bahttps://doi.org/10.1093/bioinformatics/btv537gydF4y2Ba。gydF4y2Ba
- 40.gydF4y2Ba
郑世勋,安海,刘健,吴勇,Sivanandhan G,元开辉,等。早花大白菜代(gydF4y2Ba芸苔属植物拉伯gydF4y2Ba通过CRISPR/ cas9介导的基因组编辑。植物学报,2019;13:491-9。gydF4y2Bahttps://doi.org/10.1007/s11816-019-00566-9gydF4y2Ba。gydF4y2Ba
- 41.gydF4y2Ba
徐军,康宝成,奈阿娜,裴少军,金金生,金辉,等。CRISPR/ cas9介导的1-氨基环丙烷-1-羧酸氧化酶1编辑提高矮牵牛花寿命植物学报。2020;18(6):779 - 779。gydF4y2Ba
- 42.gydF4y2Ba
蔡勇,陈磊,刘霞,郭超,孙生,吴超,等。CRISPR/ cas9介导的GmFT2a靶向诱变延迟大豆开花时间植物科学学报,2018;16(1):591 - 591。gydF4y2Ba
- 43.gydF4y2Ba
梁震,张凯,陈凯,高昌。靶向诱变技术的研究进展gydF4y2Ba玉米gydF4y2Ba使用TALENs和CRISPR/Cas系统。中国生物医学工程学报,2014;41(1):693 - 698。gydF4y2Ba
- 44.gydF4y2Ba
Brooks C, Nekrasov V, Lippman ZB, Van Eck J.利用聚类规则间隔短回文重复序列/ crispr相关系统的第一代番茄高效基因编辑。植物生理学报,2014;16(6):1293 - 1297。gydF4y2Ba
- 45.gydF4y2Ba
王松,张生,王伟,熊霞,孟峰,崔霞。利用CRISPR/Cas9系统实现马铃薯高效靶向诱变。植物科学进展,2015;34(4):373 - 376。gydF4y2Ba
- 46.gydF4y2Ba
田松,姜林,高强,张军,宗明,张宏,等。高效CRISPR/ cas9基因敲除西瓜植物学报,2017;36:399-406。gydF4y2Ba
- 47.gydF4y2Ba
解义勇,金世文,张红荣,林德生,刘建荣。肌醇可提高白菜子叶原生质体的电镀效率(gydF4y2Ba芸苔属植物oleraceagydF4y2Bavar.性)。植物生理学报,2011;38(1):1 - 6。gydF4y2Ba
- 48.gydF4y2Ba
朴杰,林凯,金金生,裴顺生。cas -分析仪:利用NGS数据评估基因组编辑结果的在线工具。生物信息学。2017;33:286-8。gydF4y2Ba
致谢gydF4y2Ba
感谢首尔大学的姜炳哲教授和蔬菜育种研究中心,分享了CM334和Dempsey两个辣椒品种。我们感谢kiyeon kwon博士、Ha Rim Shin女士、Yongsub Kim教授和Min Kyung Choi女士提供的技术贡献。我们感谢江原国立大学中央实验室的Hyunah Lee女士对LSM880显微镜的帮助。我们感谢韩国政府(教育部)资助的韩国基础科学研究院(KBSI)国家研究设施与设备中心(NFEC)的成像支持(2019R1A6C1010006)gydF4y2Ba
资金gydF4y2Ba
这项工作得到了新育种技术发展计划(项目编号:No. 1)的资助。PJ01477602],韩国农村发展管理局(RDA),韩国教育科学技术部国家研究基金基础科学研究计划[批准号:2018R1A2B6006233],韩国国家研究基金和科学工程技术女性中心[批准号:2018R1A2B6006233]资助。WISET-2019-674ho]致JC。资助者在研究的设计、数据的收集、分析和解释以及撰写手稿方面没有任何作用。gydF4y2Ba
作者信息gydF4y2Ba
从属关系gydF4y2Ba
贡献gydF4y2Ba
香港设计并执行了这个项目。JC和KHW进行并协助实验。HK, JC和KHW分析了结果。香港写了手稿。所有作者都认可了这份手稿。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
伦理批准并同意参与gydF4y2Ba
不适用。gydF4y2Ba
发表同意书gydF4y2Ba
不适用。gydF4y2Ba
相互竞争的利益gydF4y2Ba
所有作者都声明他们没有竞争利益。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba
施普林格·自然对已出版的地图和机构关系中的管辖权要求保持中立。gydF4y2Ba
补充信息gydF4y2Ba
附加文件1图S1gydF4y2Ba
的序列信息gydF4y2BaCaMLO2gydF4y2BacrRNA1位点仅在lbcpf1中应用于CM334原生质体。ID, NGS对序列读取的排序数;黄色,crRNA1靶序列;序列盒内上部序列为参考基因组序列;序列盒内底部序列,测序reads采用NGS;错位-或T,计算为删除或插入。注意,诱导indel突变的LbCpf1-crRNA1复合物位于黄色标记的位点内。gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议,该协议允许以任何媒介或格式使用、共享、改编、分发和复制,只要您适当地注明原作者和来源,提供知识共享许可协议的链接,并注明是否进行了更改。本文中的图像或其他第三方材料包含在文章的知识共享许可协议中,除非在材料的署名中另有说明。如果材料未包含在文章的知识共享许可中,并且您的预期用途不被法律法规允许或超过允许的用途,您将需要直接获得版权所有者的许可。如欲查阅本许可证副本,请浏览gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba。创作共用公共领域免责声明(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)适用于本文中提供的数据,除非在数据的信用额度中另有说明。gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
Kim, H., Choi, J. & Won, KH.。一种稳定的CRISPR/ rnps介导的甜辣品种基因编辑无dna筛选系统gydF4y2Ba甜椒gydF4y2Ba。gydF4y2BaBMC Plant BiolgydF4y2Ba20.gydF4y2Ba449(2020)。https://doi.org/10.1186/s12870-020-02665-0gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12870-020-02665-0gydF4y2Ba
关键字gydF4y2Ba
- 辣椒基因组编辑gydF4y2Ba
- 甜椒gydF4y2BaCM334gydF4y2Ba
- c .建立gydF4y2Ba邓普西gydF4y2Ba
- CRISPR / Cas9gydF4y2Ba
- CRISPR / LbCpf1gydF4y2Ba
- 辣椒叶原生质体gydF4y2Ba
- 辣椒愈伤组织原生质体gydF4y2Ba