摘要
背景
盐胁迫是一种严重的非生物胁迫,会抑制作物生长,导致产量下降。前人已经报道了γ -氨基丁酸(GABA)的合成及其与植物在各种非生物胁迫下抗性的关系。然而,外源GABA缓解植物盐胁迫损伤与离子通量、氨基酸合成和关键酶表达之间的关系尚不清楚。我们调查了植物的生长+研究了氨基丁酸对氨基酸的转运和积累、活性氧(ROS)代谢的影响SlGADs基因表达与番茄内源GABA含量的关系茄属植物lycopersicumL) 5 mmol·L处理或不处理的幼苗−1GABA低于175 mmol·L−1氯化钠的压力。
结果
外源GABA显著降低了盐害指数,提高了NaCl胁迫下番茄植株的株高、叶绿素含量、干重和鲜重。GABA显著降低了Na的含量+通过抑制钠在叶片和根系中的积累+根的流入和叶片的运输。的转录表达SlGAD1-3在NaCl胁迫下,尤其是在GABA的作用下,诱导的基因明显增多。其中,SlGAD1NaCl和GABA处理对谷氨酸脱羧酶(GAD)活性的影响最大,表达最为敏感;与单独NaCl胁迫相比,外源GABA提高了番茄叶片GAD活性和氨基酸含量,尤其是内源GABA、脯氨酸、谷氨酸等8种氨基酸的含量。这些结果表明SlGADs转录表达通过提高GAD活性和氨基酸含量在番茄植株抗NaCl胁迫中发挥重要作用。GABA通过提高叶片抗氧化酶活性、降低叶片活性氧和丙二醛含量,显著减轻了NaCl胁迫下叶片活性氧相关损伤。
结论
外源GABA对番茄幼苗抗盐胁迫有积极作用,这与减少Na含量密切相关+从根到叶的通量,增加氨基酸含量,加强抗氧化代谢。内源性GABA含量受盐和外源性GABA在转录和代谢水平上的诱导。
背景
近年来,土壤盐渍化已成为一个令人担忧的严重问题,影响着全球10%的地表[1]以及中国42.9%的受保护土壤[2].这一问题已成为保护农业可持续生产的主要障碍。盐胁迫对作物的危害主要是由于土壤中存在过量的离子;其中,Na+和Cl−不是必需的矿物质,但却是对植物造成盐胁迫伤害的主要离子[3.].近年来,温室蔬菜田土壤全盐含量增加了69.3%(其中Na+和Cl−分别增加140及58%)[4].番茄(茄属植物lycopersicumL.)是最广泛种植的蔬菜作物之一,是一种中等盐敏感作物[4,5].然而,土壤盐渍化往往由于离子毒性、渗透胁迫、养分缺乏等原因,降低番茄光合效率,干扰番茄生理代谢,严重影响番茄果实产量和品质。显然,与育种进展缓慢相比[1],外源物质调节作物耐盐性是缓解作物盐害的一种快速有效的方法,特别是通过调节各种离子运输途径和相关代谢。
γ -氨基丁酸(GABA)是一种连接植物碳氮两大代谢途径的四碳非蛋白源性氨基酸,其含量显著高于其他非蛋白性氨基酸[3.].它作为信号物质或代谢产物,通过调节细胞质pH值,充当临时氮池,诱导抗氧化反应,对植物生长和抗非生物胁迫具有重要作用[6,7].维持细胞离子稳态是植物在盐胁迫下的重要适应特征[8].我们前期的研究表明,外源GABA在NaCl胁迫和添加5 mmol·L的条件下影响了黄瓜幼苗对矿质元素的吸收和抑制−1GABA显著降低盐胁迫下黄瓜根系钠离子的积累[9].然而,没有强有力的证据表明GABA直接还原Na+缓解盐的压力。
先前的研究表明,盐胁迫可以激活GABA的合成代谢,因此,在许多植物物种中,如番茄、茶叶、烟草和烟草,GABA的积累迅速增加拟南芥[10,11,12,13,14].在这些植物中,GABA含量增加了约20倍拟南芥150 mmol·L的幼苗−1氯化钠(1325 ~ 100 mmol·L处理的小扁豆幼苗GABA水平显著升高−1氯化钠(15].此外,有研究表明,内源GABA的合成相关积累与外源GABA的补充密切相关,在无皮大麦中增加29%,在无皮大麦中增加1倍锦鸡儿0.5 mmol·L处理−1和10更易·L−1盐胁迫下GABA的含量[16,17].因此,认为内源性GABA受盐刺激和外源性GABA诱导的影响,通过调控代谢途径在提高植物对盐胁迫的抗性中起着至关重要的作用[18,19,20.].然而,外源性GABA如何在转录和代谢水平上影响内源性GABA合成仍是未知的。
GABA提高植物的耐盐性与许多生理代谢途径有关,包括控制番茄活性氧(ROS)的积累[21],氧化还原平衡和叶绿素生物合成的调节[22,使能细胞质K+保留和Na+排除在拟南芥[1]和细胞壁成分的改变[13].我们之前报道过,GABA的合成和补充对于通过减少番茄ROS生成和光合作用来提高耐盐性至关重要[23和加速NO3.−小白菜的还原和同化[24].尽管与GABA相关的植物耐盐性有许多生理代谢途径参与,但GABA提高植物耐盐性的机制尚未明确。然而,植物中GABA的这些功能主要是通过被称为GABA分流的短通路来实现的[7].在此过程中,由于谷氨酸脱羧酶(GAD;EC 4.1.l.15) [12,25]以及外源性GABA的吸收和运输[22].
事实证明迦得是GABA代谢对非生物胁迫响应最敏感的基因。GAD酶活性和基因表达水平与gaba介导的植物抗逆性增强密切相关[12].GAD同时催化谷氨酸(Glu)降解和GABA合成。到目前为止,迦得许多植物的基因已经被克隆和鉴定出来,包括番茄[25),柑橘类(26)、茶叶(11和其他植物。此外,GABA的水平是由迦得转录表达和酶活性调控,对nacl处理大豆内源性GABA积累的贡献率约为61% [27成熟的绿色果实中GABA含量下降约50-81%SlGAD2 -抑制线(25].迦得在盐和渗透胁迫下,基因表达显著增加了5个小麦品种的GABA积累[28].OsGAD2是水稻中GABA积累最重要的基因,其体内外活性均有增加,表明转基因OsGAD2其活性是野生型的40多倍[29].SlGAD2而且SlGAD3在番茄果实中GABA水平的调节中起着关键作用,表明转基因过表达系的GABA含量比WT高(2.7- 5.2倍)[25].然而,不同植物在NaCl胁迫下的表达位点存在显著差异。CiGAD1在茎、叶和种皮中表达锦鸡儿中间物,而CiGAD2在树皮中高度表达[17].表达的增加CiGAD1而且CiGAD2诱导GABA在盐处理24小时内积累[17].GAD2所有部位的表达拟南芥烟草显著增强,伴随GAD活性增加和GABA含量增加[12,13].的CsGAD基因通过增加叶片GAD活性和GABA含量来增强甜瓜耐盐耐碱能力[22].然而,只有有限的研究检验了两者之间的关系迦得, GABA和番茄耐盐性,代谢过程和相关代谢尚未确定。
为了实验阐明添加GABA与番茄耐盐性之间的关系,我们研究了植物生长和Na的变化+添加了GABA的植物在nacl处理中的通量和积累。我们首次分析了四种基因的转录水平迦得并检测番茄叶片中氨基酸合成(包括GABA)和ROS代谢,以探讨GABA在盐损伤番茄幼苗中的生理功能。本研究的目的是阐明外源GABA增强番茄植株耐盐性的调控机制,为研究外源GABA的分子调控提供新的信息迦得基因和GABA对高盐条件下番茄植株离子吸收或代谢过程的后续影响。
结果
外源GABA对盐胁迫下番茄幼苗表型的影响
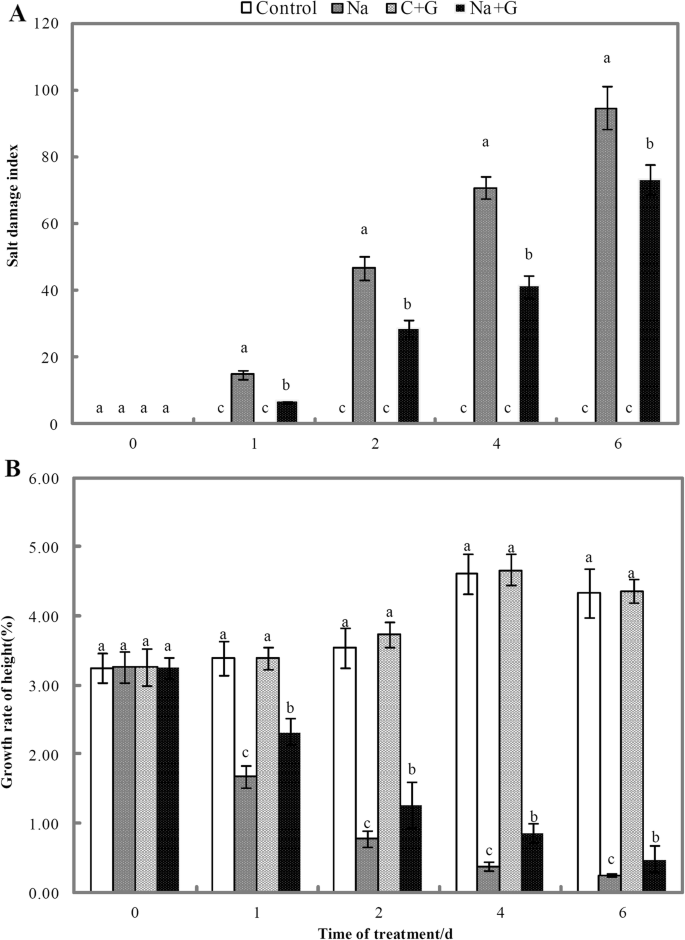
在盐胁迫下培养的幼苗的根和叶受到了明显的广泛损伤(图1)。1).na处理组在盐胁迫后1 d根系出现变色萎缩,2 d新叶枯萎。幼苗高度明显缩短,4 d后叶片和根系严重萎缩。NaCl胁迫6 d时,幼苗较弱,表现为近一半叶片变黄萎蔫,根系失去活力。而外源GABA显著缓解了盐害植株的表型症状。在盐胁迫初期,GABA处理的幼苗根系没有变色,叶片没有枯萎,而在2 d时出现了少量气根。NaCl和GABA处理4 d时,幼苗明显短于对照。叶片保持拉伸状态,没有出现明显的萎蔫现象,气根数量较NaCl处理多。在试验结束(6 d)时,NaCl+GABA处理的幼苗的大部分叶和根明显比单独盐胁迫下的幼苗更健康。
NaCl处理的幼苗盐害指数随处理时间的延长而增加,而GABA处理显著降低了幼苗的盐害指数(图1)。2a). NaCl+GABA处理的幼苗盐害指数比na处理组分别降低了54.5、38.6、41.5和22.5%。在同一试验期间,以株高来衡量生长速率(图5)。2b).正常生长条件下苗高增长率约为3.2%,NaCl显著抑制苗高生长;此外,随着处理时间的延长,苗高的增长率逐渐降低。在对照条件下,GABA处理虽然没有提高株高,但在NaCl处理下,GABA缓解了盐胁迫对苗高生长的抑制作用。Na + g处理组株高生长速率显著高于Na处理组,在1、2、4、6 d时分别提高了39.2、63.6、126.3和92.0%。
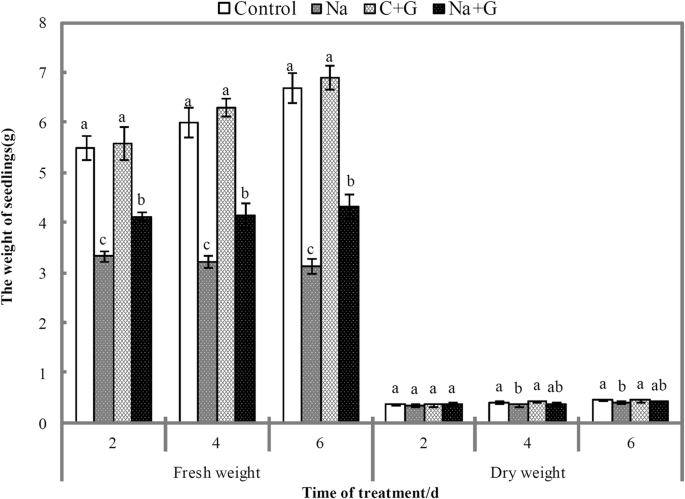
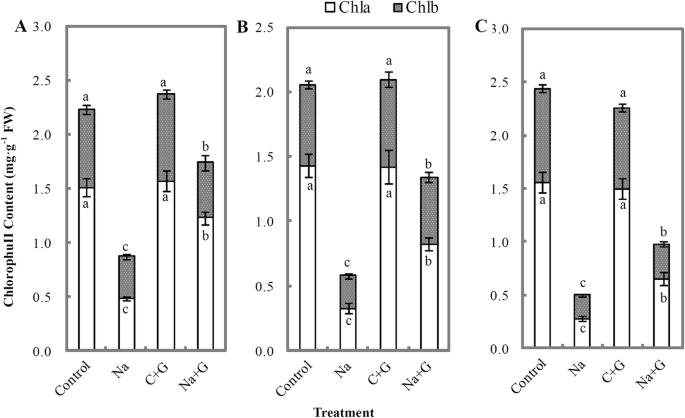
NaCl和NaCl+GABA处理的番茄幼苗鲜重显著低于C-和g -处理组(图4)。3.).与NaCl处理组相比,NaCl+GABA处理组在处理后第2、4、6 d时的鲜重分别显著增加了23.7、28.8、37.9%。与对照组相比,nacl处理组干重显著降低,但与Na + g处理组无显著差异。与对照处理相比,NaCl处理下幼苗叶片叶绿素含量显著降低,随着盐胁迫时间的延长,叶绿素含量逐渐降低(图1)。4).外源GABA可以延缓NaCl处理下叶绿素a水平的下降。在整个盐胁迫期间,Na + g处理组的叶绿素a和b水平均显著高于Na处理组,在盐胁迫后6 d时,提高幅度分别为132.1和50.0%。
外源GABA对Na的影响+通量和Na+盐胁迫下叶、根含量
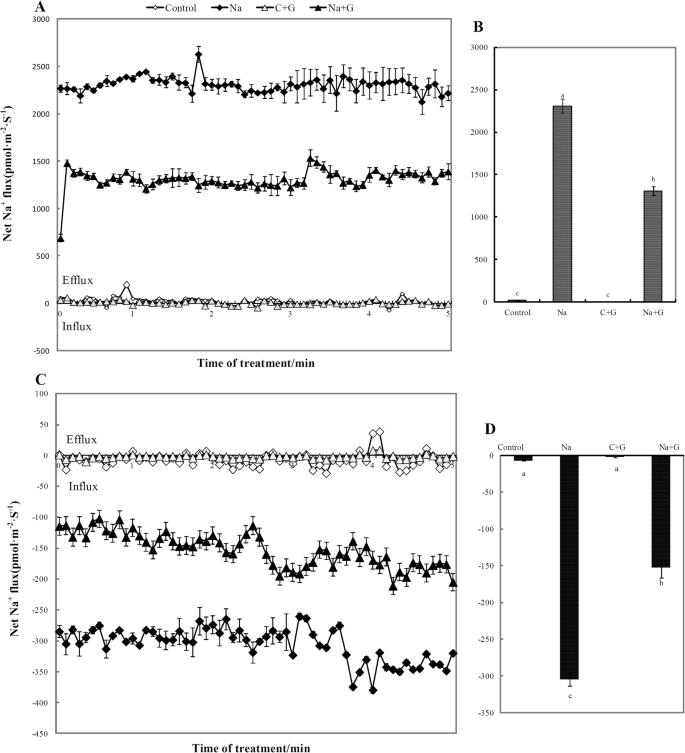
进一步阐明纳的过程+利用无创微测技术(NMT)测定Na的含量+盐处理2 d后叶和根的通量(图。5a和b)。正常情况下,净Na+叶片和钠的外流+根内流极低(接近0),加或不加GABA处理。NaCl胁迫显著增加净钠+叶片和净钠的外流+根内流,平均2309 pmol·cm−2·年代−1和305.08 pmol·厘米−2·年代−1分别在叶和根中。然而,网娜+叶片和净钠的外流+NaCl处理下,gaba处理的幼苗根系内流明显减少,其中NaCl处理下叶片下降约43.2%,根系下降约50.2%。
Na+盐胁迫的主要症状是叶片和根系的积累,结果表明根系积累较多+相比于所有处理的叶片(图。6).钠含量无显著差异+叶、根含量与GABA处理间无显著差异。Na+nacl处理的幼苗叶片和根系的含量显著高于对照。而外源GABA显著抑制Na+盐胁迫下,盐胁迫下的叶片和根系产量分别较对照降低了28.6%和32.4%。
外源GABA对四种基因表达水平的影响迦得盐胁迫下叶片GAD活性的变化
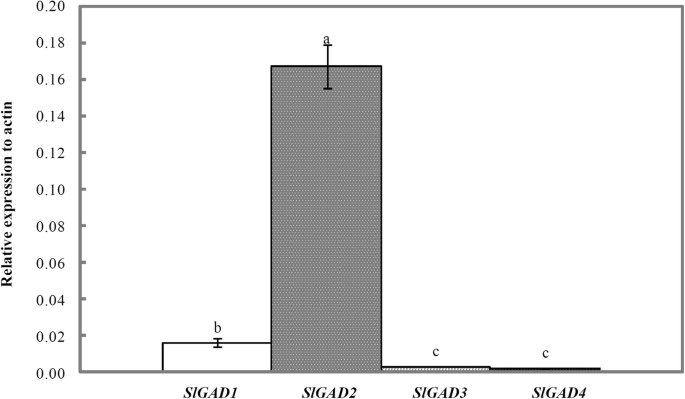
我们克隆了4个迦得序列保守区同源性高,序列对齐一致性为83.73%(图1)。S1).在正常培养条件下,对4个GAD副基因在番茄幼苗叶片中的初始相对表达谱进行了分析迦得基因转录本表现出显著的表达差异(图。7).在这些基因中,SlGAD2是表达最高的,表达约为?的10.7倍,47.8倍和69.6倍SlGAD1, SlGAD3而且SlGAD4,分别。的基因,SlGAD4表现出最低的表情。
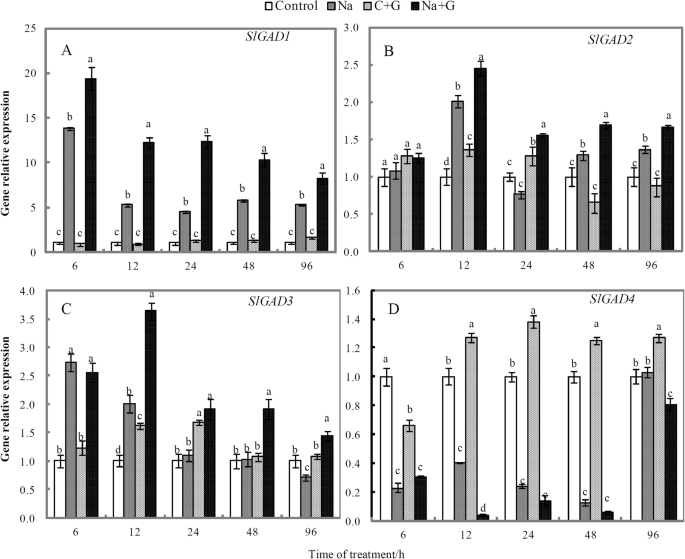
盐胁迫显著增加了SlGAD1-3与对照组比较(图。8).SlGAD1-3各处理(Na +G > Na > C +G和C)均表现出相同的表达趋势,NaCl+GABA处理诱导了更多的SlGAD1-3表达高于单独nacl处理。相比之下,SlGAD4NaCl+GABA处理12 h时,表达量为C +G > Control > Na > Na +G,表达量最低,仅为对照的0.039倍。在这四个基因中,SlGAD1Na + G处理6 h后转录水平变化最大,约为对照的19.4倍;na处理组在6 h时达到对照组的14.5倍。的变化范围SlGAD2而且SlGAD3明显低于SlGAD1.在Na处理后12 h,最大的变化SlGAD2而且SlGAD3仅为对照处理的2.45倍和3.64倍。SlGAD4盐处理下表达量显著降低,为4个基因中表达量最低的基因。然而,这种表达模式对基因表达上调的总趋势变化影响不大SlGAD基因。
四种番茄相对表达量的动态变化迦得在正常培养和NaCl处理(加或不加GABA)下,番茄幼苗叶片中基因的变化。注:取各处理0 h的基因表达量为1,纵坐标为其他时间的基因表达量与0 h的基因表达量之比。的seedlings were shown to one of the following four treatments: Control (white squares), Na (salinity, grey squares), C + G (Control+GABA, grid squares), and Na + G (NaCl+GABA, black squares). Each value is the mean ± SD of three independent experiments. Different lower-case letters in each column shape indicate significant difference atP邓肯检验< 0.05
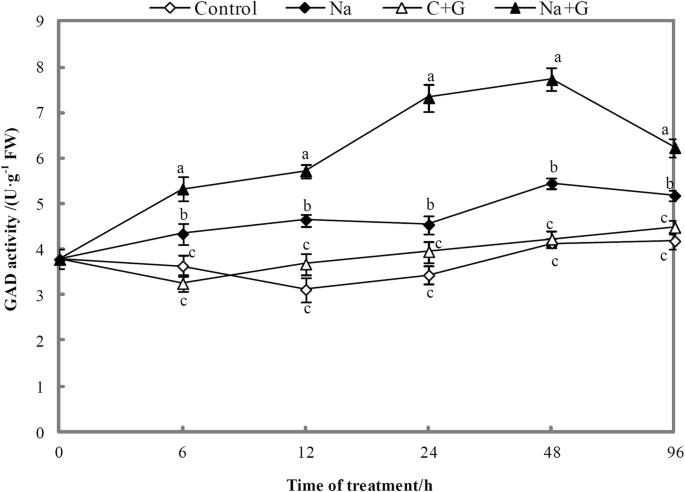
NaCl+GABA或NaCl处理的植株GAD活性显著高于对照(图1)。9), 6 ~ 48 h呈上升趋势,96 h呈下降趋势。Na+ g处理组的GAD活性在整个处理过程中最高,显著高于Na处理组,提高了20.3 ~ 61.3%。
外源GABA对盐胁迫下叶片氨基酸含量的影响
为了分析氨基酸含量的变化,我们检测了不同处理组叶片中的16种氨基酸(图1)。10a和b)。从总体趋势看,盐胁迫下大部分氨基酸的含量较对照处理有不同程度的升高。其中,蛋氨酸(Met)、GABA、丙氨酸(Ala)、脯氨酸(Pro)和甘氨酸(Gly)含量在盐胁迫2 d后显著高于对照处理,赖氨酸(Lys)、亮氨酸(Leu)、GABA、Ala、Pro、苏氨酸(Thr)、谷氨酸(Glu)和天冬氨酸(Asp)含量在盐胁迫4 d后显著高于对照处理。在NaCl胁迫下,GABA、Glu和Pro在所有氨基酸中均表现出显著的变异。本文重点研究的GABA水平在盐胁迫2 d和4 d后分别显著增加1.5-和1.3倍。GABA水平呈现如下趋势:NaCl+GABA > C +G > NaCl >对照,处理后2 d, Na +G -和C +G -处理组GABA水平分别显著高于盐胁迫后的1.6-和1.3倍。具有代表性的Pro水平在盐胁迫下显著增加1.38倍。与盐胁迫水平相比,外源GABA的添加使Pro提高了18.9%(图1)。10c).但在正常处理下,外源GABA的添加对Pro水平无显著影响。与对照组相比,钠处理组Glu明显升高。外源GABA进一步提高了盐胁迫下的Glu水平,分别提高了16.3%和15.7%。
外源GABA对盐胁迫下抗氧化酶活性的影响
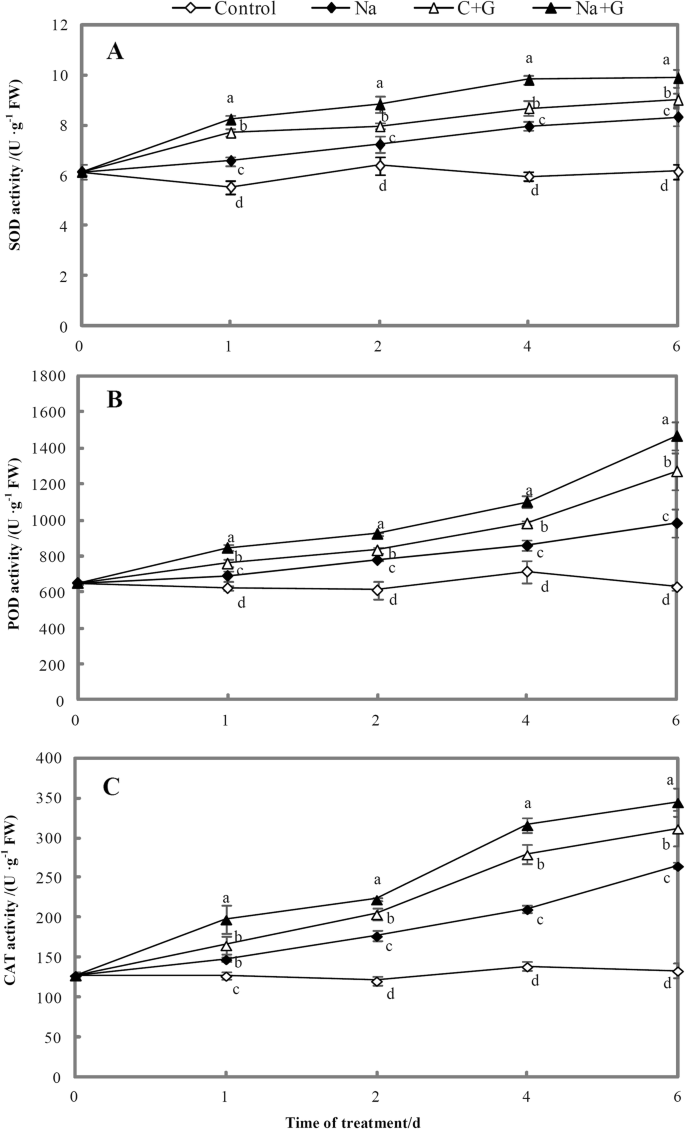
Na、C + G和Na + G处理叶片的超氧化物歧化酶(SOD)活性随着处理时间的增加逐渐升高,且各处理组均显著高于对照组(图2)。11a).在整个处理过程中,Na + g处理组SOD活性最高,显著高于Na处理组,分别在1、2、4、6 d时提高25.1、22.1、23.4和18.6%。NaCl处理次之,较对照提高19.0 ~ 35.4%。
随着处理时间的延长,NaCl+GABA、C +G或NaCl处理叶片过氧化物酶(POD)活性显著升高,且明显高于对照组(图2)。11b). Na + g处理组POD活性最高,其次为GABA处理组和Na处理组,Na处理组POD活性最低。NaCl+ gaba处理组POD活性较na处理组显著提高22.5、18.7、28.3和49.2%,na处理组较对照显著提高11.0 ~ 56.5%。
在整个处理期间,番茄叶片过氧化氢酶(CAT)活性表现为Na + G > C + G > Na > C(图1)。11c).与单独盐胁迫相比,外源GABA处理显著提高了盐胁迫下CAT活性;活性分别比NaCl处理高33.9、25.9、50.1和30.2%。
外源GABA对盐胁迫下叶片活性氧生成的影响
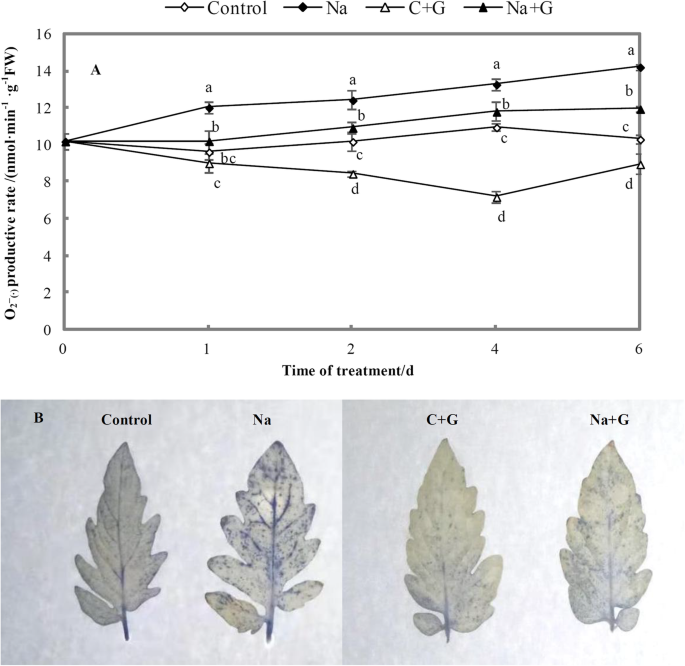
在盐胁迫下,超氧阴离子(O2\(\眉题{\子弹}\))的含量明显高于对照组(图5。12a).在盐胁迫下添加GABA, O2\(\眉题{\子弹}\)在叶片中的含量显著低于na处理组,降幅接近11%。在无花果。12b,蓝色点表示O的含量2\(\眉题{\子弹}\).盐胁迫下的蓝点数量显著高于对照和GABA处理,而Na + G处理下的蓝点数量显著低于NaCl处理。
过氧化氢(H2O2)含量采用DAB染色法测定(图。13H)。2O2含量随盐处理时间的延长而增加。H的水平2O2盐处理显著增加,GABA显著抑制H2O2在NaCl处理下减少21.9-23.5%。在盐胁迫下,番茄叶片上的棕色斑点表明了H的含量2O2(无花果。13b). H2O2在NaCl+GABA处理下,叶片中的叶绿素含量显著低于NaCl处理。外源GABA处理显著缓解了盐胁迫下幼苗活性氧相关损伤。
如图所示。14NaCl处理叶片中丙二醛(MDA)含量在整个处理时间内均显著高于对照处理。NaCl处理苗的营养液中加入GABA后,MDA含量显著降低,分别降低了15.8、15.1、22.8和14.0%。这说明外源GABA可显著降低盐胁迫下番茄幼苗叶片MDA含量,缓解盐胁迫下活性氧对番茄幼苗的伤害。
盐胁迫下表型指标与活性氧水平的关系
表型和生理指标的相关分析显示了几种显著的相关关系1).盐害指数与株高、叶绿素总量和鲜重增长率呈负相关,与叶片钠离子含量呈正相关。钠离子含量与各表型指标及活性氧含量呈显著正相关。ROS水平与盐害指数、各表型指标及钠离子含量显著相关。
讨论
外源GABA通过减轻盐损伤表型症状来提高盐胁迫的耐受性
生物量是许多作物品种对盐胁迫反应的综合指标。高盐浓度减少了生物量,这反映在作物生长和产量的减少[30.].以前的研究表明,盐度通常会降低植物的生长[31]通过改变水势和诱导营养缺乏[32,33].外源施用GABA已被证明可通过减少叶绿素降解和保持高光合能力来缓解盐胁迫对植物生长的抑制作用[20.].例如,与未处理gaba的生菜植株相比,处理过gaba的生菜植株的鲜枝和干枝质量受盐水的负面影响更小[23,34].在本研究中,番茄幼苗逐渐表现出典型的盐害症状,包括生长速度、鲜重和干重以及叶绿素含量的降低。我们的研究结果还表明,外源GABA处理通过提高生长速率、鲜重和干重以及叶绿素水平来缓解盐胁迫造成的伤害(图5)。1,2,3.,4).这些结果表明,外源性GABA的添加可以缓解生长的减缓,这与我们之前对黄瓜的研究一致[9].GABA可能通过抑制胁迫对叶绿体结构的破坏来缓解盐胁迫对植物生长的抑制作用。
外源性GABA调节Na+通量和Na+盐胁迫下叶、根含量
盐胁迫对植物细胞的损伤和生长抑制主要是由于钠的过度吸收和积累造成的+[35].植物减少有毒钠积累的能力+在敏感嫩枝中是耐盐性的一个重要特征[36].因此,钠离子在组织中的积累常被认为是盐胁迫损伤程度的指标之一。外源GABA对植物钠离子含量影响的研究较少,也不清楚GABA是否能直接降低钠离子含量。但有研究表明,GABA含量高的拟南芥突变体的根钠通量明显低于GABA含量低的突变体[1].我们的研究表明,Na+盐胁迫下钠通量显著增加,并且首次观察到外源GABA显著降低Na+叶片的外流和根系的流入(图4)。5).这些数据表明,外源GABA确实可以减少钠离子的吸收,并且由于吸收的减少,钠离子运输到叶片的量明显低于盐胁迫下,从而出现了低流出现象。这种钠离子通量的调节可能是外源GABA盐胁迫下番茄叶片和根系钠离子含量显著降低的原因。
盐敏感品种根、叶钠离子通量显著高于耐盐品种[36].盐敏感突变体的叶片钠离子含量也显著高于耐盐突变体[1].因此,我们认为外源GABA显著降低钠离子通量和钠离子含量是缓解盐胁迫的重要生理机制。外源GABA可以抑制Na的吸收+减少钠离子输送到叶片的总量(图5)。6).前人研究表明,GABA提高植物耐盐性主要是通过改变离子质膜电位差和负离子转运体的渗透调节,从而影响离子转运[37].结合我们对以Pro为代表的叶片中游离氨基酸含量的分析,我们认为外源GABA的吸收刺激叶片细胞中内源氨基酸的合成,导致叶片中游离氨基酸含量急剧增加,从而增加细胞渗透调节物质,诱导大量钠离子进入液泡。这种作用减轻了植物细胞质离子的毒性。叶片的光合系统得到保护,番茄幼苗表现出较好的表型缓解。
外源性GABA通过上调GAD活性来提高GAD活性SlGAD表达式
四个迦得番茄基因组中的基因已被报道过[21,38,39].之前的研究迦得番茄的基因主要集中在对SlGAD1-3对果实发育过程中GABA积累的影响[25].我们的研究是第一个检测的相对表达水平SlGADs在盐胁迫下番茄叶片中的含量(图5)。8).转录水平SlGAD1-3基因增加SlGAD4盐胁迫下显著降低。在这些基因中SlGAD1基因对盐胁迫反应最敏感。此外,SlGAD1水平与GAD活性显著正相关。因此,我们推测SlGAD1在这四个中起着最重要的作用SlGAD在盐胁迫下改变GAD活性的基因。
之前的研究表明迦得在应激诱导下的表达。在白杨,六个人中只有两个迦得基因在NaCl胁迫下表达上调,表达水平显著高于其他4个基因[40].在目前的研究中,SlGAD1-3调节,但SlGAD4被下调,主要是因为不同的异构体在压力下有不同的功能。在之前的研究中,外源性GABA得到了改善PSGAD2而且PSGAD4与单次缺氧处理下的转录水平比较[41].我们的结果表明,相对表达SlGAD1-3Na + g治疗组显著高于Na治疗组。可能的原因是GABA被植物的根部吸收并运输到叶片细胞。在应激过程中,GABA在细胞中的积累可诱导表达SlGADS,且效果强于单独的盐胁迫。先前的报道表明,GAD活性是由细胞质酸化或细胞内钙升高所刺激的2 +水平(20.,42].强烈诱导的表达SlGAD盐胁迫下外源性GABA存在的s也应该与细胞内钙离子和氢离子的变化有关。
一般认为植物细胞中GABA的积累主要是由于谷氨酸脱羧酶的激活[43].研究发现,在盐胁迫下,脱壳的大麦和杨树叶片的GAD活性显著升高[16,40].此外,外源性GABA处理已被证明可以增强Ca (NO3)作用下GAD的活性。2压力(22].我们的研究结果表明,na处理组植物叶片GAD活性明显高于对照组,且外源GABA诱导的GAD活性高于NaCl处理(图1)。9).GAD活性的变化与蛋白的表达模式一致SlGAD1-3。作为证据,外源GABA在胁迫条件下诱导内源GABA含量的增加迦得基因表达和GAD酶活性的增加量测定。这些结果表明,叶片中内源GABA含量的增加不仅来自于外源GABA的吸收,还来自于转录和代谢水平上的GABA合成代谢。
外源GABA增加了盐胁迫下叶片氨基酸含量
GABA是游离氨基酸库的重要组成部分,在调节植物细胞对胁迫的反应和增强植物对胁迫的适应性方面起着重要作用[16,20.].谢尔普等人[19]表明GABA可以减轻盐度伤害,主要作为渗透物质。我们的研究发现,NaCl处理的叶片增加了GABA和Glu的积累(图1)。10).外源GABA进一步提高了这两种氨基酸的水平。Glu可在应激下维持GABA分流的流动和TCA代谢[44].Glu含量的增加为合成GABA提供了大量的原料,从而合成了大量的GABA。这个过程可以消耗H+从而降低细胞的酸化程度。这一发现与我们之前对缺氧应激的研究一致[45].
在盐胁迫下,细胞内正常的氮代谢受到干扰,容易产生渗溶物[46,47].游离氨基酸被认为是渗透调节物质,通过降低膜的通透性保护植物免受盐胁迫[8,48].Pro是主要的含氮小分子,可以提高细胞质浓度,防止液泡从细胞质中吸收水分,保护细胞质的代谢中心。外源施用GABA可增加叶片Pro在胁迫条件下的积累[49,50,51].我们的研究与前人的研究一致,发现在盐胁迫下,随着外源GABA的施用,Pro含量进一步增加。盐胁迫诱导Ala [39],丝氨酸(丝氨酸)[16和其他氨基酸[52],但它们的变化模式并不一致。这些氨基酸是否与盐胁迫反应直接相关还不清楚。我们还发现,11种氨基酸的水平波动很大。其中占比最大的5种氨基酸是Glu、Ser、Pro、Ala和GABA。以往的报道表明,一些参与植物防御反应的代谢物是由氨基酸代谢途径合成的,在植物对胁迫的防御反应中起着关键作用[53,54].Glu是Pro和GABA的前体,是转化为α-酮戊二酸的底物,α-酮戊二酸是碳和能量代谢的重要中间体[55].增加的Glu的主要功能可能是在外源GABA的盐胁迫下维持代谢平衡。Ala和Ser前体来源于糖酵解途径,在叶绿素合成和蛋白质加工中发挥重要作用[56],即使它们的内容变化没有Pro那么大或敏感。因此,我们认为,游离氨基酸的积累在增强对盐胁迫的耐受性方面是至关重要的,但氨基酸不仅仅是渗透调节物质。外源GABA作为连接碳氮代谢的重要氨基酸,其诱导氨基酸含量的意义不仅在于维持代谢平衡以增加对盐胁迫的耐受性,而且还在于提高渗透调节能力以抵抗水分流失和中和过多的Na+在叶子的液泡中。我们对表型和钠离子通量的测定也证实了这一点。
外源GABA通过调节抗氧化系统提高盐胁迫的耐受性
植物细胞在胁迫下积累ROS被认为会导致光合系统效率降低[57].诱导抗氧化防御系统可保护植物免受ROS积累[58].盐胁迫诱导渗透和氧化胁迫干扰植物代谢[16],并导致膜损伤和脂质过氧化物的积累[59].我们的结果表明,盐胁迫显著影响了SOD、POD和CAT的活性,并伴随活性氧代谢产物的快速增加(图1)。11),与先前的研究一致[23,60,61].GABA被认为是脂质过氧化过程中MDA形成的抑制剂[62].Liu等人发现GABA具有清除ROS的能力,有助于缓解压力[63],尽管还需要研究来确定GABA是否可以直接清除ROS以缓解压力。在本研究中,外源GABA增强了上述三种酶的活性,从而促进了O的转化2\(\眉题{\子弹}\)在H2O2然后分解成水和氧气。结果还表明,O2\(\眉题{\子弹}\)和H2O2施用外源性氨基丁酸后,其含量显著下降(图5。11而且12).MDA含量被认为是植物氧化损伤的重要指标[64].我们观察到,在盐胁迫下,外源性GABA处理后MDA含量显著下降。14).一些研究提出外源应用GABA作为清除ROS和调节抗氧化酶活性的信号分子[13,65].根据我们的测试结果,叶片中氨基酸的积累可能有助于诱导蛋白质周围形成强氢键水,保护细胞蛋白聚合物的自然状态,从而降低MDA含量。结果表明,GABA对番茄幼苗具有较强的氧化保护作用,从而提高番茄幼苗的耐盐性。
结论
外源GABA通过调节Na对缓解盐胁迫有积极作用+氨基酸合成和活性氧代谢。这种缓解盐胁迫损伤的作用主要是由于内源性GABA诱导渗透调节和抗氧化反应。在转录和代谢水平上,盐和外源性GABA诱导内源性GABA含量。
方法
植物材料及栽培
该实验是在河北保定河北农业大学实验农场的一个塑料大棚中进行的,当时正值春夏生长周期(2019年3月至7月)。种子材料为番茄品种美国lycopersicumL.‘中杂9号’盐敏中型品种[66大果(70-80毫米),购自中国蔬菜种子技术有限公司(北京),1998年通过国家作物品种审定委员会批准(品种登记号:030823581)。: Guoshencai 98006)。幼苗在四真叶期移栽到20升的灰色塑料罐中(每罐10株),无底孔,灌入16升的Hoagland营养液(pH 6.5, EC 2.0-2.2)进行水培。用气泵维持正常通风。预培养3天后进行以下处理。
处理与实验设计
- (1)
对照:用霍格兰营养液正常培养。
- (2)
盐处理(Na): 175 mmol·L−1在营养液中加入NaCl。
- (3)
GABA处理(C + G): 5 mmol·L−1在营养液中加入GABA。
- (4)
盐+ GABA处理(Na + G): 175 mmol·L−1NaCl和5 mmol·L−1在营养液中加入GABA。
所有用于实验的植物都在同一天发芽,并置于相同的生长环境中。在预试中,175 mmol·L−1NaCl是造成植株表型差异显著的浓度。除非另有说明,所有化学品均为分析级,并从Sigma-Aldrich Co., LLC(美国)获得。对于每个处理,在移植后采集顶部第二片叶子(4个重复),立即在液氮中冷冻,并在- 80°C保存,直到进一步的分子分析。移植后收获叶片和根系(4个复制体),保存在- 20°C以待进一步的生化分析。
盐害指数和株高生长速率的测定
处理后0、1、2、4、6 d,选取30株幼苗进行处理,测定盐害统计指数[67],株高增长率按公式(确定株高-先前确定株高)/先前确定株高× 100%计算。
鲜重、干重和叶绿素含量的测定
处理后2、4、6 d,测定植株鲜重。然后,在105°C的烤箱中杀死植株30 min,在80°C恒重干燥,测量植株的干重。用丙酮-乙醇(1:1)提取幼苗叶绿素含量[68].
Na的量化+通量和Na+叶和根的含量
钠活性的定量分析+根据“恢复协议”执行射流系统[69].在本试验中,净钠+使用NMT (YoungerUSA LLC, Amherst, MA, USA)、ASET 2.0 (scienceware, Falmouth, MA, USA)和iFluxes 1.0 (YoungerUSA)软件测量通量[70].处理2 d后,对照组和其他3个处理组的叶片和根系用蒸馏水冲洗,转移到含极少量盐(0.1 mmol·L)的测定溶液中−1氯化钾、0.1更易·L−1CaCl20.1更易·L−1MgSO40.1更易·L−1氯化钠,0.3更易·L−1市场经济地位,pH值6.0)。植物标本固定在测定室中2 × 2 cm聚赖氨酸包覆盖层的中间。净通量在低钠平衡15 min(叶片)和30 min(根系)后测定+解决方案。叶片的测量部位为叶肉细胞。根内测量点距根尖100 μm+我们在实验中观察到了通量。稳态离子通量的大小是从300秒内记录的数据中计算出来的。按照Lei等人(2014)的描述制备玻璃微管和测量溶液。[71].
Na+含量的确定如Chen等人(2010)所述[72].处理2 d和4 d后,番茄幼苗叶片和根部100 mg干燥,HNO 5 ml3.(65-68%)加入微波消化系统进行消化。消化后的样品用去离子水稀释至指定体积,用0.25 μm孔滤膜过滤。Na+含量采用电感耦合等离子体质谱法(ICP-MS, PerkinElmer Inc., ELAN DRC-e)测定。
RNA提取,cDNA合成,克隆SlGADs叶片的qRT-PCR
处理0、6、12、24、48和96 h后获得番茄叶片样品(100 mg)。RNA提取如前所述,稍作修改[73].采用上海生物技术有限公司(上海)Eastep®超级总RNA提取试剂盒提取总RNA。使用NanoDrop (NanoDrop 2000)定量RNA的浓度,并在1%的琼脂糖凝胶上验证RNA的完整性。cDNA合成使用的是Transcript®One Step gDNA Removal and cDNA Synthesis Supermix Reverse Transcription Kit (TransGen Biotech, Beijing)。
的全长序列SlGAD1,SlGAD2,SlGAD3而且SlGAD4番茄基因在GenBank中分别为AB359913.1、NM_001246893.1、NM_001246898.2和XM_004237202.4。本实验所用引物如表所示2.以番茄叶片的cDNA为模板进行PCR扩增。反应体系为:cDNA模板,2 μL;正向引物和反向引物,0.5 μL;2× Flash Hot Start Mastermix(染料),12.5 μL;ddH2啊,9.5μL。反应条件为:94℃反应3 min;35个循环,98°C 5 s,退火10 s, 72°C 15 s;72°C 10分钟。的退火温度SlGAD1,SlGAD2,SlGAD3而且SlGAD4分别为55°C、52°C、47°C和50°C。琼脂糖凝胶电泳(1.2%)检测扩增产物。目标片段用DNA凝胶回收试剂盒(TIANGEN, Beijing)进行回收。将扩增产物在16℃下连接到pMD19-T克隆载体(TaKaRa, Beijing)上过夜,然后转化为大肠杆菌DH5α (TransGen Biotech,北京)。将细胞置于涂有氨苄西林的LB固体培养基上,倒置板,37℃孵育12-16 h。选取阳性斑点送上海生物技术公司进行测序,最终获得基因cDNA的全长序列。守恒区域SlGAD1,SlGAD2,SlGAD3而且SlGAD4用DNAMAN软件进行基因比较。
的表达水平SlGADs番茄进行qRT-PCR;引物由上海生物技术公司合成。反应混合物包含:2 × Super EvaGreen®qPCR Master Mix, 10 μL(美国光大®Inc);上下游引物(10 μmol·L−1),各1 μL;cDNA、2μL;将水加入最终体积为20 μL。反应过程如下:95°C预变性2 min, 95°C变性5 s, 58°C退火5 s, 72°C延伸25 s,循环45次。实验结果用2-△△CT方法。两者的相对表达量SlGAD基因归一化到表达水平Actin-7基因(GenBank登录号X58253),作为内控。本实验所用引物序列如表所示3..
叶片中GAD酶活性和氨基酸含量的测定
在处理0、6、12、24、48和96 h后采集番茄植株叶片样品(100 mg)。采用2,4-二硝基氟苯(DNFB)柱前衍生化和反相高效液相色谱法(RP-HPLC)测定番茄叶片中GAD活性。GAD活性的一个单位定义为释放1 mmol·L所需的酶的量−1每克植物组织中每30分钟(40°C)的GABA含量[74].处理2 d和4 d后,用DNFB和RP-HPLC柱前衍生化法测定氨基酸含量[75].
抗氧化酶和活性氧的测定
如Giannopolitis等人(1977)所述,测定SOD活性[76].将NBT的光化学还原抑制率降低50%作为活性单位(U)。POD活性的测定如Zeng等人(1997)所述[77].CAT活性的测定如Dhindsa等人(1982年)所述[78].酶的活性单位(U)被定义为0.1 OD /分钟。O2−由王爱国等(1990)确定[79];O2\(\眉题{\子弹}\)和H2O2按照Christensen等人(1997)的描述进行[80];硫代巴比妥酸测定丙二醛含量[81].每个过程重复三次。
统计分析
采用SAS 8.1统计程序(SAS Institute, Cary, NC)分析不同处理的效果,采用Fisher最小显著性差异(LSD)检验结合单因素方差分析(one-way ANOVA),差异评价为0.05显著性水平。
数据和材料的可用性
在当前研究中使用和/或分析的数据集可根据合理要求从通讯作者处获得。
缩写
- 猫:
-
过氧化氢酶
- GABA:
-
γ-氨基丁酸
- 迦得:
-
谷氨酸脱羧酶
- H2O2:
-
过氧化氢
- MDA:
-
丙二醛
- O2\(\眉题{\子弹}\):
-
超氧化物阴离子
- 圆荚体:
-
过氧化物酶
- ROS:
-
活性氧
- SOD:
-
超氧化物歧化酶
- NMT:
-
非侵入性的微观检测技术
- Glu:
-
谷氨酸
- 正方观点:
-
脯氨酸
- 爵士:
-
丝氨酸
- 阿拉巴马州:
-
丙氨酸
- 满足:
-
甲硫氨酸
- 通用电气:
-
甘氨酸
- 利斯河:
-
赖氨酸
- 低浓缩铀:
-
亮氨酸
- 刺:
-
苏氨酸
- Asp:
-
天冬氨酸
- WT:
-
野生型
参考文献
- 1.
苏乃宁,吴强,陈建华,沙巴拉,Mithöfer A,王海辉,等。氨基丁酸在H+拟南芥通过激活胞质K+保留和Na+排斥。J Exp Bot. 2019; 70:6349-61。
- 2.
黄思伟,郭伟,唐建伟,李春春。中国蔬菜主产区土壤耕层全盐含量与离子组成。植物营养肥料学报,2016;22:965-77。
- 3.
Ramesh SA, Tyerman SD, Xu B, Bose J, Kaur S, Conn V,等。GABA信号通过直接调节植物特异性阴离子转运蛋白的活性来调节植物生长。Nat Commun。2015;6:7879。
- 4.
王晓燕,王晓燕,王晓燕。基于土壤盐分和水分胁迫日指数的作物耐盐性分类。农业水垫2000;43:99-109。
- 5.
王晓燕,王晓燕,王晓燕,等。盐胁迫对小麦生长发育和产量的影响。不同盐胁迫分类方法对小麦耐盐性的影响。农业水垫2003;62:37-66。
- 6.
植物中的氨基丁酸:只是一种代谢物吗?植物科学进展2004;9:110-5。
- 7.
关闭植物中GABA分流回路:GABA代谢和信号转导是相互纠缠的吗?植物科学进展2015;6:419。
- 8.
盐和水胁迫的比较生理学。植物细胞环境,2002;25(2):239-50。
- 9.
王春春,郭艳君,张晓强,高海斌,高晓明,郝丽丽。不同NaCl浓度下γ-氨基丁酸对黄瓜幼苗生长及矿质元素含量的影响北方园艺。2014;03:5-8。
- 10.
尹耀刚,富永T,饭岛Y,青木K,柴田D,石原H,等。番茄发育过程中有机酸和-氨基丁酸的代谢变化茄属植物lycopersicuml .)水果。植物细胞学报2010;51:1300-14。
- 11.
梅欣,陈勇,张磊,付旭,魏强,Grierson D,等。茶叶中谷氨酸脱羧酶和-氨基丁酸积累的双重调控机制(茶树)暴露在多重压力下的叶子。Sci众议员2016;6:23685。
- 12.
Akçay N, Bor M, Karabudak T, Özdemir F, Türkan I. -氨基丁酸(GABA)对盐胁迫响应的贡献烟草的抗旱性CMSII突变型和野生型植物。植物生理学报,2012;169:452-8。
- 13.
雷诺H,鲁塞尔V, El AA, Arzel M,雷诺D, Bouchereau A等。拟南芥的pop2-1突变揭示了GABA转氨酶与盐胁迫耐受性有关。BMC Plant Biol. 2010;10:20。
- 14.
张军,张勇,杜勇,陈松,唐慧。烟草动态代谢组学响应(烟草)植物对盐胁迫的反应。J蛋白质组。2011;10:1904-14。
- 15.
AL-Quraan NA和AL-Quraan HA。盐、渗透和H对GABA积累和氧化损伤的响应2O2在两个小扁豆(Lens culinaris Medik)材料中进行处理。植物Biosyst 2015:1-10。
- 16.
马勇,王平,陈志军,顾志祥,杨荣强。GABA增强了NaCl胁迫下发芽大麦的生理生化代谢和抗氧化能力。植物生理学报,2018;
- 17.
季军,郑亮,岳娟,姚旭,嫦娥,谢涛,等。识别的两个CiGAD年代从锦鸡儿中间物以及它们对非生物胁迫和外源脱落酸的转录应答。同行j . 2017; 5:3439。
- 18.
Faës P, Niogret MF, Montes E, Le CLF, Bouchereau A, Deleu C.甘蓝型油菜中编码gaba -转氨酶的基因经抄录分析揭示了它们受水分亏缺的调控作用。environment Exp Bot. 2015; 116:20-31。
- 19.
Shelp BJ, Bozzo GG, Trobacher CP, Zarei A, Deyman KL, Brikis CJ。假设/综述:腐胺在响应非生物胁迫时对4-氨基丁酸(GABA)产生的贡献。植物科学。2012;193 - 194:130 5。
- 20.
Shelp BJ, Bown AW, Zarei a . 4-氨基丁酸(GABA):一种具有实际意义的代谢物和信号。植物学。2017;95:1015-32。
- 21.
包华,陈霞,吕松,蒋萍,冯娟,范萍。病毒介导的基因沉默揭示了γ-氨基丁酸代谢途径对番茄活性氧积累和耐盐性的控制。植物细胞环境学报2015;38:600-13。
- 22.
胡霞,徐铮,徐伟,李娟,赵宁,周勇。γ-氨基丁酸对钙(NO)胁迫下甜瓜幼苗多胺和GABA代谢的保护作用3.)2压力。植物生理与生物化学,2015;92:1-10。
- 23.
罗海燕,高海波,夏秋萍,龚宝波,吴晓丽。外源GABA对NaCl胁迫下番茄活性氧代谢及叶绿素荧光参数的影响农业科学,2011;44:753-61。
- 24.
李静,田铮,吴旭,吕刚,马伟,张勇,等。-氨基丁酸(GABA)调节小白菜叶片硝酸盐浓度和代谢。芸苔属植物定ssp。对用富氮溶液处理。植物分子生物学报告2018;36:530-42。
- 25.
高山M,小池S,草野M,松仓C,斋藤K,有泉T,等。番茄谷氨酸脱羧酶基因SlGAD2而且SlGAD3在调节番茄γ-氨基丁酸水平中起关键作用(茄属植物lycopersicum).植物细胞物理学报2015;56:1533-45。
- 26.
刘旭,胡明明,金福林。谷氨酸脱羧酶基因的鉴定及转录分析,CsGAD1而且CsGAD2,揭示两者之间的强烈关系CsGAD1柑桔类水果中柠檬酸的利用。Mol Biol journal 2015; 41:6253-62。
- 27.
邢光光,军亚波,郝志伟,梁丽丽。在盐胁迫下,通过刺激双胺氧化酶的活性,使γ-氨基丁酸积累增加大豆(l)稳定。的根源。植物生理与生物化学,2007;45:560-6。
- 28.
AL-Quraan NA, Sartawe FA, Qaryouti MM.小麦γ—氨基丁酸代谢及氧化损伤的研究进展(生物谷学报)小麦L.)盐和渗透胁迫下的幼苗。植物生理学报,2013;30(4):447 - 447。
- 29.
刘丽丽,赵玲,李强,等。水稻谷氨酸脱羧酶新基因的克隆与表达。水稻遗传学通讯2004;21:39-41。
- 30.
朱勇,谭戈,何长青,崔晓华,张强。斜坡化处理对紫菜幼苗生长和离子稳态的影响季.生态学报2017;27(12):5447-54。
- 31.
王晓燕,王晓燕,王晓燕,等。nacl对植物光合系统ⅰ和ⅱ失活的影响(生物技术学报). 2000;
- 32.
钦努沙米五,贾根多夫A,朱克杰。了解和提高植物的耐盐性。作物科学。2005;45:437-48。
- 33.
Genc Y, Mcdonald GK, Tester m+浓度作为面包小麦耐盐性的标准。植物细胞环境杂志2007;30:1486-98。
- 34.
Kalhora MS, Sasan A, Seif M, Asayesh EJ, Bernard F, Hassani B.ɤ-氨基丁酸对盐胁迫生菜光合性能的影响(摘要以l .)植物。植物生理与生物化学,2018;130:157-72。
- 35.
Flowers TJ, Colmer TD。植物耐盐性:盐生植物的适应性。安机器人。2015;115(3):327 - 31所示。
- 36.
牛明良,黄毅,孙圣,孙建勇,曹海生,沙巴拉,别志良。根呼吸爆发氧化酶同源依赖H2O2通过对Na的控制,黄瓜的耐盐性得到提高+排斥和气孔关闭。中国科学(d辑:自然科学版)2018;
- 37.
Seifikalhor M, Aliniaeifard S, Hassani B, Niknam V, Lastochkina O. γ-氨基丁酸在植物细胞动态反应中的不同作用。植物细胞学报2019;38:847-67。
- 38.
高志A, K中聪,T良治,T武弘,Shin W,洋子I,等。番茄果实发育过程中GABA积累的生化机制。植物细胞学报2008;49(9):1378-89。
- 39.
Clark SM, Di LR, Van COR, Mullen RT, Shelp BJ。利用丙酮酸和乙醛酸酯的多种番茄γ-氨基丁酸转氨酶的亚细胞定位和表达。J Exp Bot 2009; 60:3255-67。
- 40.
贾军,石铮,谢婷婷,张晓明,陈伟,杜cj,等。NaCl和CdCl胁迫下杨树GABA分流与碳氮代谢的响应2压力。生态毒理学环境Saf. 2020;193:110322。
- 41.
Salvatierra A, Pimentel P, Almada R, Hinrichsen P.外源GABA的施用瞬时提高了敏感基因型李子砧木对根系缺氧的耐受性。environment Exp Bot. 2016; 125:52-66。
- 42.
史斯登,王晓燕,王晓燕。钙/钙调蛋白激活大豆谷氨酸脱羧酶。植物杂志。1995;108:543-9。
- 43.
鲍恩·AW,谢尔普·BJ。-氨基丁酸的代谢与功能。植物杂志。1997;115:1-5。
- 44.
彬颖,欢霞,周丽,李一平,严志,刚N,等。外源施加GABA提高了白三叶草peg诱导的耐旱性,与GABA分流、多胺和脯氨酸代谢呈正相关。杂志。2017;8:1107-15。
- 45.
王春春,李建军,夏秋平,吴晓丽,高海斌。外源γ-氨基丁酸(GABA)对缺氧胁迫下甜瓜幼苗根中GABA代谢及氨基酸含量的影响应用生态学报,2014;25(7):2011-8。
- 46.
于炳杰,张文华,刘玉林。NaCl对大麦根系蛋白质和游离氨基酸含量的影响。西北植物学报。1997;17(4):439-45。
- 47.
王晓燕,王晓燕。盐胁迫对绿豆及盐生植物多亚光生物合成及含量的影响。杂志。1989;76:295 - 302。
- 48.
质体表达的甜菜碱醛脱氢酶基因在胡萝卜培养细胞的根和叶中增强了耐盐性。植物杂志。2004;136(1):2843 - 54。
- 49.
李智,彭宇,黄斌。γ-氨基丁酸对提高匍匐屈草耐热、耐旱性的生理效应。中国科学(d辑:自然科学版)2016;
- 50.
Nayyar H, Kaur R, Kaur S, Singh R. γ-氨基丁酸(GABA)通过改善叶片膨润和上调渗透保护剂和抗氧化剂,对水稻幼苗提供部分保护,免受热胁迫伤害。植物生长学报2014;33:408-19。
- 51.
γ-氨基丁酸(GABA)启动增强Piper nigum Linn的渗透胁迫耐受性。受聚乙二醇诱导胁迫的植物。植物生长规律,2016;78:57-67。
- 52.
张玉军,李红华,周锐,王鑫,多萨科,王lh,张yx,余建勇,龚海红,张晓瑞,尤杰。两种不同基因型芝麻的转录组和代谢组分析揭示了快速适应盐胁迫的关键生物学通路。BMC Plant Biol. 2019;19:66。
- 53.
拟南芥双功能赖氨酸酮戊二酸还原酶/糖糖苷脱氢酶的合成赖氨酸分解代谢的酶受代谢和应激相关信号的共同调控。植物杂志。2003;133:1407-15。
- 54.
Facchini PJ, Hagel J, Zulak KG。羟基肉桂酸酰胺代谢:生理生化。化学学报2002;80(6):577-89。
- 55.
福特BG, Lea PJ。谷氨酸在植物中的代谢、调节和信号传递。实验学报2007;58(9):2339-58。
- 56.
王世生,高凤峰,吴刚。植物生理学。北京:林业出版社;1990.
- 57.
张晓燕,张晓燕,张晓燕,等。胁迫条件下植物活性氧种类、氧化损伤及抗氧化防御机制的研究。science J Bot. 2012;26:217037。
- 58.
氧化应激、抗氧化剂与应激耐受性。植物学报2002;7:405-10。
- 59.
Mittler R, Vanderauwera S, Gollery M, Van Breusegem F.植物活性氧基因网络。植物学报2004;9:490-8。
- 60.
康克林PL,最后一个RL。暴露于臭氧的拟南芥抗氧化信使rna的差异积累。植物杂志。1995;109(1):203 - 12所示。
- 61.
Demidchik V, Cuin TA, Svistunenko D, Smith SJ, Miller AJ, Shabala S,等。拟南芥根K+羟基自由基激活的外排电导:单通道特性、遗传基础和参与应激诱导的细胞死亡。中华细胞科学杂志2010;123:1468-79。
- 62.
邓勇,徐玲,曾旭,李智,秦斌,何宁。GABA作为高级脂氧化最终产物形成抑制剂的新视角:与丙二醛的相互作用。生物与纳米技术。2010;6:318。
- 63.
刘超,李铮,于刚。烟草叶片在水分胁迫下产生γ-氨基丁酸的优势谷氨酸代谢通量与其显著的抗氧化活性有关。植物生物学杂志,2011;53(8):608-18。
- 64.
Taulavuori E, helstrom E, Taulavuori K, Laine K.两种分析油脂过氧化的方法的比较Vaccinium myrtillus(l)在除雪、再适应和冷适应期间。实验学报2001;52:2375-80。
- 65.
杨志强,张志强,张志强,等。拟南芥幼苗对硝态氮的吸收和利用受外源γ -氨基丁酸的调控。植物生理与生物化学。2010;48:43 3。
- 66.
胡晓红,杜丽娟,邹志荣。Spd预插种子对NaCl胁迫下番茄幼苗的保护作用。生态学报2009;29:5152-7。
- 67.
刘旭,徐敏,李志伟。番茄幼苗耐盐指数的研究。北方园艺。2007;26:4-7。
- 68.
张XZ。植物叶绿素含量的测定丙酮-乙醇混合法。辽宁农业股份有限公司1986;3:26-8。
- 69.
Cuin TA, Bose J, Stefano G, Jha D, Tester M, Mancuso S,等。评估根质膜和液泡膜钠的作用+/小时+小麦耐盐交换体:植物定量方法。植物细胞环境学报2011;34:947-61。
- 70.
Kochian LV, Shaff JE, Kühtreiber WM, Jaffe LF, Lucas WJ。使用细胞外,离子选择性,振动微电极系统定量K+H+, Ca2 +玉米根系和玉米悬浮细胞的通量。足底。1992;188:601-10。
- 71.
雷斌,黄勇,孙建勇,谢建军,牛明良,刘志祥,等。扫描离子选择电极技术和x射线显微分析提供了对比钠的直接证据+盐胁迫下盐敏黄瓜和耐盐南瓜根茎运输能力的研究。杂志。2014;152:738-48。
- 72.
陈亮,吴芳华,刘文涛,陈杰,李志军,裴志明,等。基于优势种冷杉年轮信息的西南亚高山森林生态系统土壤酸度重建环境Pollut。2010;158:3219-24。
- 73.
王晓燕,王晓燕,王晓燕,等。植物组织中RNA分离方法的改进。学生物化学肛门。1987;163:16-20。
- 74.
Lǚ YG,张宏,孟XY,王玲,郭晓宁。2,4-二硝基氟二硝基苯柱前衍生高效液相色谱法测定GABA及其在植物GAD活性研究中的应用。肛门。2010;43:2663 - 71。
- 75.
邓永春,邓斌,杨军,蒋学勇,夏永强,莫高刚,等。耐盐番茄与其他番茄营养成分的比较。食品科学技术,2014;39:73-7。
- 76.
超氧化物歧化酶:ⅱ。苗木水溶性蛋白的纯化及定量关系。植物杂志。1977;59:315-8。
- 77.
曾世祥,王逸尔,李mr。不同胁迫处理增强水稻幼苗抗寒性过程中膜保护系统变化的比较。植物学报。1997;39:308-14。
- 78.
Dhindsa RS, plumm -Dhindsa P, Thorpe TA。叶片衰老与膜通透性和脂质过氧化水平的增加以及歧化酶和过氧化氢酶水平的降低有关。实验学报1982;32:91-101。
- 79.
王亚光,罗光华。植物中超氧自由基与羟胺反应的定量关系。植物生理学报,1990:55-7。
- 80.
张铮,魏元元。H . H .的亚细胞定位2O2在植物。H2O2大麦与白粉病互作过程中乳突积累与过敏反应。植物j . 1997; 11:1187 - 94。
- 81.
分离叶绿体的光过氧化:I.脂肪酸过氧化的动力学和化学计量学。生物化学。1986;125:189-98。
确认
我们感谢我们实验室的所有同事提供了有用的技术援助。
资金
本研究获得河北省重点研发计划项目(19227214D、20326901D)资助。资助机构只提供本研究的实验费用和出版费用。资金用于研究的设计;数据的收集、分析和解释;写稿子和开放存取付款。
作者信息
从属关系
贡献
本研究由XW和HG构思和设计。XW, QJ和SJ进行了实验。BG, JL和GL贡献了新的试剂和分析工具。所有作者阅读并批准了该手稿。
作者的信息
河北农业大学园艺学院,河北保定071001
相应的作者
道德声明
伦理批准和同意参与
不适用。
同意出版
不适用。
相互竞争的利益
作者声明他们没有竞争利益。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构附属的管辖权要求保持中立。
补充信息
额外的文件1
:图S1。四种番茄保守区氨基酸序列的比对迦得基因。注:相同和相似的碱基以黑色表示。
权利和权限
开放获取本文遵循创作共用署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),该协议允许在任何媒体或格式中使用、分享、改编、分发和复制,只要您给予原作者和来源适当的署名,提供创作共用许可协议的链接,并说明是否有更改。本文中的图片或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果材料不包含在文章的创作共用许可中,并且您的预期用途不被法律法规允许或超出了允许的用途,您将需要直接从版权所有者那里获得许可。欲查看此许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献放弃书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信用额度中另有说明。
关于这篇文章
引用这篇文章
吴,X,甲,Q,吉,S。et al。γ -氨基丁酸(GABA)通过调节Na减轻番茄的盐害+吸收,迦得基因、氨基酸合成和活性氧代谢。BMC植物杂志20.465(2020)。https://doi.org/10.1186/s12870-020-02669-w
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12870-020-02669-w
关键字
- 番茄
- γ-氨基丁酸
- 生理盐水压力
- Na+通量和运输
- SlGAD转录表达
- 氨基酸积累
- 活性氧代谢