摘要
背景
在研究不同生物的基因表达之前,确定最佳的内参基因是很重要的。目前,检测基因表达最准确的方法是实时荧光定量PCR (RT-qPCR)。通过这种方法,可以获得在不同生物系统和不同条件下稳定的内参基因。Toona ciliataRoem (t . ciliata).是一种有价值且生长迅速的木材品种。本研究利用RT-qPCR技术鉴定了20个内参基因,为进一步进行基因表达分析奠定了基础。采用geNorm、NormFinder、BestKeeper和RankAggreg四种不同的方法评估20个候选内参基因在不同条件下在不同组织中的表达稳定性。
结果
实验结果表明浴缸-α所有样本中表达最稳定的内参基因是UBC17最稳定的是在叶片和幼茎下Hypsipyla罗布斯塔(h·罗布斯塔)和茉莉酸甲酯(MeJA)处理。此外,PP2C59和UBC5B表现最好的基因是在叶片中吗h·罗布斯塔治疗,而HIS1和ACT7是幼茎中最好的内参基因。两个最佳内参基因为60 s-18和浴缸-α在4°C处理后。的表达式HIS6和MUB1在PEG6000处理下最稳定。所选内参基因的准确性用转录因子MYB3 (TcMYB3)基因。
结论
这是第一次报道验证基因表达正常化的最佳参考基因t . ciliata在不同的条件下,这将有助于未来阐明该物种的基因调控。
背景
Toona ciliataRoem。属楝科,广泛分布于中国、澳大利亚和印度。由于它笔直的树干和赤褐色的木材,t . ciliata有“中国红木”的称号[1]。但在过去的一个世纪里,由于环境退化和人类的破坏,其数量急剧下降,已被列为中国“国家二类重点保护的濒危植物”之一。t . ciliata具有很大的经济价值,例如,它的木材常被用来生产高档家具、仪器和工艺品[2]。更重要的是,它也是一种药用植物,因为它的根、茎和叶中含有丰富的化学物质[3.]。从中分离出来的化合物t . ciliata包括酮类、类固醇和香豆素,其中许多具有抗真菌、抗糖化或抗肿瘤活性[4,5,6,7],其花提取物对胃溃疡有治疗作用[8]。然而,从t . ciliata很低。此外,在以往的研究中,已经发现t . ciliata很容易受到飞蛾害虫的影响Hypsipyla罗布斯塔摩尔(9它们主要吃嫩茎,导致空心树枝无法生长,有时甚至会死亡。这种害虫不仅是中国的区域性问题,而且是世界性问题。在一些主要地区h·罗布斯塔分布在澳大利亚和巴西等地,t . ciliata也面临着严重的损害h·罗布斯塔[10,11,12]。目前,还没有化学或物理的方法来预防或控制h·罗布斯塔目前有效的害虫防治方法费时费力,不适用于大规模的人工林[13]。通过分子育种获得抗虫植物可能有助于害虫防治。为了合成与耐药机制相关的理想化合物,有必要首先探索其途径及其相关调控基因[14,15]。基因表达分析是探索植物生物合成和抗虫机制的最有力工具之一t . ciliata.迄今为止,知识库ICG (http://icg.big.ac.cn)收集了120多种植物的内参基因,包括拟南芥[16],花生[17],黄瓜[18]和大豆[19),除了t . ciliata。也没有关于管家基因的文献参考t . ciliata可用于基因表达的标准化。
RT-qPCR具有重复性好、灵敏度高、定量准确、反应速度快等优点,是开展整个PCR过程的有力工具,也是目前最常用的测定基因表达水平的方法[20.]。然而,RT-qPCR可能受到多种错误来源的影响,例如起始材料的数量、RNA的完整性和酶促反应的效率。因此,有必要引入稳定表达的管家基因作为校正和标准化的参考,以控制样品内部和样品之间产生的不必要的误差[21]。
常用的管家基因是那些在所有条件下都一致表达的基因,例如编码肌动蛋白(行为)、甘油醛-3磷酸脱氢酶(GAPDH)和微管蛋白(浴缸) [22]。然而,现在越来越多的研究开始质疑在不同组织、不同实验条件、不同物种中稳定表达的基因的存在。为了保证实验的准确性,在特定的实验条件下选择合适的内参基因是很重要的[23]。软件包,包括geNorm [24]、NormFinder [25]和BestKeeper [26],广泛用于评估候选内参基因的表达稳定性并确定最佳选择。许多研究人员已经使用这些算法成功地识别了不同物种的内参基因[27,28]。利用内参基因进行表达分析,极大地促进了植物发育和进化机制的研究,在有内参基因组序列的物种中[29]。
在这项研究中,20个候选基因来自t . ciliata我们组生成的转录组数据库进行了调查,以确定最合适的t . ciliata在不同组织(成熟叶、幼叶、花、芽和幼茎)和处理(4°C、MeJA、PEG6000和MeJA)的特定条件下,利用RT-qPCR技术对候选基因作为参比进行基因表达分析h·罗布斯塔),包括肌动蛋白7 (ACT7)、磷酸甘油酸激酶(PGK),60年代核糖体蛋白L13 (60 13)及L18 (60 s-18),组蛋白去乙酰化酶1 (HIS1)及6 (HIS6)、蛋白磷酸酶2c57 (PP2C57)及C59 (PP2C59),泛素偶联酶E2 5B (UBC5B)及17 (UBC17)、s -腺苷甲硫氨酸脱羧酶原(SAMDC)、延伸系数1 (EF1)及2 (EF2)、肽基脯氨酸顺式反式异构酶CYP95 (PPIA95)及CYP26-2 (PPIA26日),18岁核糖体rna (18岁)、微管蛋白-3链(浴缸-α)、微管蛋白-5链(浴缸-β)、膜锚定泛素折叠蛋白1 (MUB1)和tip41样蛋白(TIP41).此外,TcMYB3用基因对筛选的内参基因进行信度和效度验证。MYB蛋白是植物中最大的转录因子家族之一,在植物生长发育、生物和非生物胁迫反应、昼夜节律调节等方面发挥着重要作用[30.,31]。例如,R2R3 MYB转录因子MdMYB30调节植物对病原体的抗性拟南芥转录因子MYB102增加植物对蚜虫的易感性[32,33]。本研究为RT-qPCR分析提供了最佳的内参基因t . ciliata在不同条件下,为研究分子机制奠定基础t . ciliata通过基因表达分析。
结果
引物特异性、扩增效率和候选内参基因的表达谱
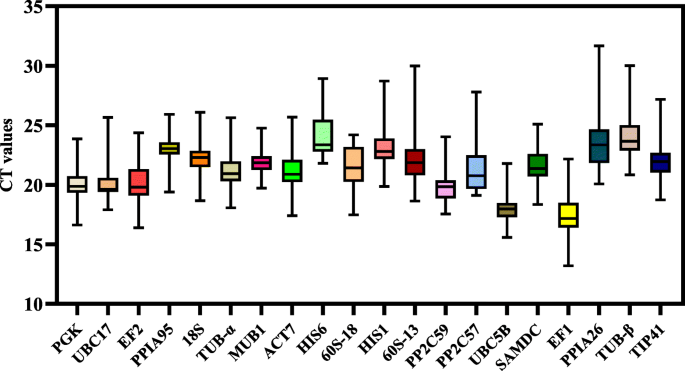
每个样本的反转录cDNA作为模板,用引物进行标准PCR扩增。电泳证实所有PCR产物在凝胶中都具有单条带特异性(图5)1).使用RT-qPCR扩增的所有候选内参基因的熔化谱均为单峰(图5)2).通过连续稀释得到各候选物的标准曲线,其线性相关系数均大于0.99 (R2> 0.99)。20个候选内参基因的扩增效率为90.41%PPIA95到102.44%PGK.引物的进一步细节见表1.
采用RT-qPCR检测所有候选内参基因在以下条件下的表达水平:不同组织;h·罗布斯塔4℃处理、MeJA处理和PEG6000处理。候选基因的表达水平在不同的样品中差异很大。周期阈值(CT)最大值为31.66,最小值为13.18。1).其中,PPIA26位表达丰度最高,CT值最大值31.66,最小值20.07,中位数23.36。EF1表达丰度最低,CT值最大值为22.16,最小值为13.18,中位数为17.17。此外,候选基因在表达上表现出显著的变异性。MUB1和UBC5B与其他基因相比,其CT值范围相对较窄,表明其表达更为稳定。值得注意的是,这些结果表明,没有一个基因在所有条件下都是稳定表达的,因此有必要筛选内参基因t . ciliata在特定条件下。
候选内参基因表达的稳定性
采用geNorm、NormFinder和BestKeeper软件对20个候选内参基因在不同实验条件下的表达稳定性进行评价。综合排名采用R软件RankAggreg包[34]。
GeNorm分析
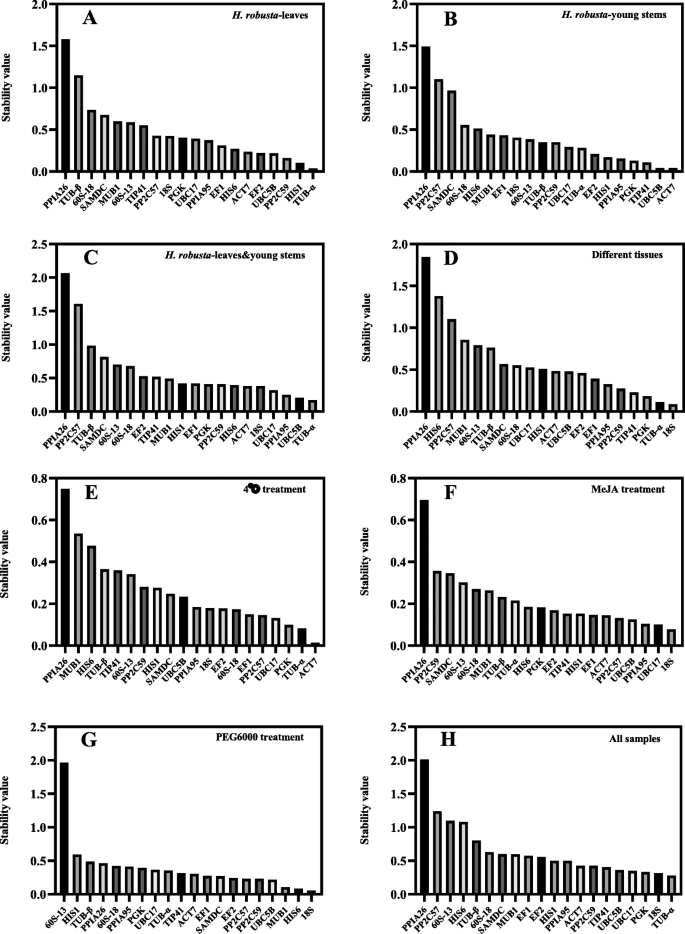
在geNorm分析中,对每对基因计算M值。根据M值评价基因表达的稳定性;阈值M值低于1.5的基因视为稳定表达,M值最低的基因视为表达最稳定的内参基因。20个候选内参基因在不同条件下的geNorm分析结果如图所示。2a -。所有检测样本的候选基因M值均小于1.5(图2)。3.).下h·罗布斯塔治疗,UBC17,PP2C59,UBC5B在叶片中表达最稳定(图2)。2),而HIS1,UBC5B,ACT7在幼茎中表达波动很小(图2)。2b).两个组织的数据分析h·罗布斯塔治疗表明UBC5B,HIS1,ACT7的表达最稳定,因为其M值最低(图2)。2c).不同组织间表达最稳定的基因为18岁和浴缸-α, M值在0.2左右(图2)。2d)。PPIA95株在4°C和MeJA处理下均表现出良好的稳定性;60 s-18和UBC17分别在4°C和MeJA处理下稳定表达(图2)。2e和f)。PEG6000处理模拟干旱胁迫下M值最低的两个基因分别为PP2C57和EF1(无花果。2g)。EF2和EF1稳定性最高,M值为0.49(图2)。2h)。
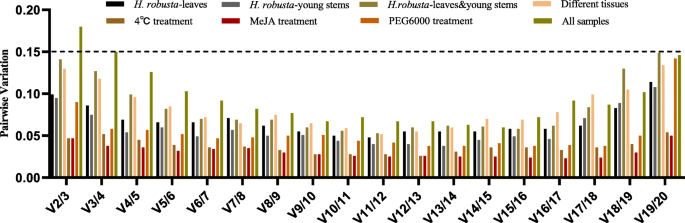
一般情况下,使用多个内参基因进行基因定量分析比使用单个内参基因更可靠。鉴于此,geNorm计算成对变化(V)n/n + 1)的归一化因子,并根据该比值确定最优内参基因数。默认的Vn/n + 1软件值为0.15。若比值小于0.15,则满足相对定量要求的内部基因组合数为n,否则需要引入另一个内参基因。在我们的研究中,两两变异V2/3在h·罗布斯塔处理、4℃处理、MeJA处理、PEG6000处理和不同组织,均小于0.15,说明内参基因组合的最佳数量为2个(图2)。3.).在所有样本中,成对变化(V2/3)为0.180,V3/4为0.15,V4/5为0.126,说明添加第3个和第4个内参基因对结果的影响不同。考虑到时间和成本的经济性,选用较少的内参基因为佳,故最佳内参基因组合为EF2,EF1,ACT7和UBC5B对于所有的样本。
NormFinder分析
为了进一步确定候选内参基因的稳定性,使用NormFinder对数据进行重新分析。结果如图所示。4a -。下h·罗布斯塔处理后,叶片中稳定表达的前3个基因为浴缸-α(稳定值=0.038),HIS1(0.105)PP2C59(0.161)(图4A),而最稳定的基因是ACT7(0.042),UBC5B(0.042)TIP41(0.109)。4b).两个组织(叶和茎)中排名前三的参考候选物为浴缸-α(0.170),UBC5B(0.206)PPIA95(0.250)。4c)基因18岁(0.088)和浴缸-α(0.112)在不同组织中的稳定性值较低,因为它们的表达最稳定,这与geNorm分析结果一致(图1)。4然而,d)。ACT7(0.014),浴缸-α(0.082)PGK(0.099)是4°C处理下最稳定的候选基因(图2)。4e),与geNorm分析结果不一致;这可能是由于两个软件包使用不同的算法。在MeJA处理下,两个最稳定的内参基因是18岁(0.078)和UBC17(0.100)(图4f),而在PEG6000处理下,最稳定的两个是18岁(0.055)和HIS6(0.082)(图4g)。浴缸-α(0.281),18岁(0.316)PGK(0.335)是所有样本中稳定性值最低的三个基因(图3)。4h).与geNorm分析结果不一致,结果显示PPIA26、PP2C59和HIS6是最不稳定的基因。
BestKeeper分析
BestKeeper将每个基因-引物对组合的CT数据作为输入,计算变异系数(CV)和标准差(SD),如表所示2.用CV±SD值评价基因的稳定性。越稳定的基因CV±SD值越低。UBC17(1.16±0.23)18岁(1.62±0.36)为最稳定的基因h·罗布斯塔治疗,和表达HIS1(1.40±0.31)UBC17(1.70±0.33)在幼茎中最稳定。在两种组织中表达最稳定的基因为UBC17(1.73±0.34)18岁(2.12±0.47),与叶片相同。HIS6(5.41±1.38)MUB1(5.48±1.16)是不同组织中表达最稳定的基因;18岁(0.73±0.16)60 s-18(0.83±0.18);60 s-18(0.67±0.14)EF1MeJA组(0.83±0.14);PPIA26(3.89±0.87)60 s-18(4.48±1.02)。对于所有样本,MUB1(3.95±0.87)为表达稳定性的最高值。
RankAggreg分析
本研究采用三种算法分析了20个候选内参基因的表达稳定性。由于算法不同,它们生成的基因排名表也不同。RankAggreg是一个用于聚合大型排名列表的算法。它通过交叉熵蒙特卡洛算法或遗传算法根据排序执行有序列表的聚合[34]。为了提供一个一致的排名,我们使用RankAggreg计算每个实验条件下的总体基因排名,如表所示3..最重要的两个基因h·罗布斯塔叶片处理和MeJA处理与geNorm分析结果一致。HIS1在幼茎组织中排名第一h·罗布斯塔治疗。排在第一位的基因是60 s-18和HIS6分别在4°C处理和PEG6000处理下。浴缸-α是不同组织和所有样本中最稳定的基因。的表达式PPIA除PEG6000处理外,26在所有实验条件下最不稳定。
内参基因的验证
为了通过软件验证所选内参基因的表达稳定性,将TcMYB3使用两个最稳定的基因(单独和组合)或共识排名中两个最不稳定的基因对基因进行量化。下h·罗布斯塔治疗,相对表达TcMYB3叶片和幼茎在12 h达到高峰,此时使用最稳定的基因及其组合进行标准化。的相对表达TcMYB3与最不稳定的基因标准化后异常增加(图2)。5a, b).如图所示。5C,当使用最稳定的基因作为内参基因时,表达水平TcMYB3与成熟叶相比,幼叶表达量增加1 ~ 1.5倍,其他组织(芽、幼茎、根、花)表达量下调,且抑制倍数基本相同。但表达水平TcMYB3在花中使用最不稳定基因的比例最高(PPIA26)作为参比基因。此外,使用最稳定的两个内参基因及其组合进行相对定量时,在包括4°C处理在内的其他胁迫下的表达水平和趋势也非常相似(图2)。5d), MeJA处理(图2)。5e), PEG6000处理(图6)。5f).而当使用两个最不稳定的内参基因进行相对定量时,表达量和趋势都不一致。很明显,在基因表达分析中使用不稳定参考t . ciliata可能导致有偏差的结果。
讨论
理想的情况是,内参基因在所有实验条件下都能稳定表达,并在生物体的各个组织和生长阶段表现出稳定的表达水平,但这样的基因几乎不存在[35]。越来越多的研究表明,在不同物种和不同条件下稳定表达的基因会发生变化[36,37,38,39]。因此,使用RT-PCR选择最适合特定条件的内参基因非常重要。本研究旨在寻找最佳的内参基因进行基因表达分析t . ciliata在不同的条件下.有20个候选基因来自t . ciliataRT-qPCR筛选转录组数据库并进行分析。结果表明,最佳内参基因在不同条件下并不一致。为例子,PP2C59和UBC5B叶子底下最适合吗h·罗布斯塔治疗,而HIS1和ACT7是否更适合幼嫩的茎下h·罗布斯塔治疗,浴缸-α和PPIA95用于比较不同的组织,和60 s-18和浴缸-α4°C处理的叶片。
本研究采用geNorm、NormFinder、BestKeeper和RankAggreg四种方法对20个候选基因的表达稳定性进行了评价。前三种算法用于评价候选基因的表达稳定性。我们的结果表明,三种算法的参考值和计算方法有很大的不同[40]。NormFinder根据组内和组间差异计算稳定性值[25],而geNorm则将内参基因与给定样本中的所有基因进行比较,以评估最佳内参基因[24]。在BestKeeper中,CV和SD值决定了候选基因的稳定性排名[41]。由于三个软件包的算法不同,对于同一组实验数据,它们会产生不同的排名,尽管本研究中使用geNorm和NormFinder进行分析的结果几乎没有变化。例如,18岁根据geNorm和NormFinder,在不同组织条件下使用的最佳内参基因为HIS6由BestKeeper分析确定。对于幼嫩茎组织暴露于h·罗布斯塔压力,ACT7和UBC5B是由geNorm和NormFinder提出的,但在BestKeeper的结果中排名较低。为了整合三种算法的结果,采用RankAggreg进行综合排序[34]。许多研究人员使用ReFinder来计算最终排名[42,43,44]。ReFinder为每个基因分配适当的权重,并计算其权重的几何平均值,从而给出最终排名[45]。RankAggreg使用交叉熵蒙特卡罗算法或遗传算法生成基于排名的聚合有序列表[34]。这两种工具在整合其他软件的内参基因筛选结果方面发挥了非常重要的作用。
其他研究人员已经研究了害虫胁迫下植物的最佳参考基因STP4被发现是最好的参考基因用于芸苔属植物juncea在蚜虫侵害造成的生物胁迫下[46]。ABCT和FBOX在大豆蚜虫(SBA)胁迫下最稳定;TUB4和TUA4在双斑蜘蛛螨(TSSM)胁迫下是稳定的[47]。米兰达表示GmELF1A和GmTUA5从感染了? ?的大豆根系中是否获得了表达数据规范化的稳定参考基因有隐姓埋名的女人,GmCYP2和GmELF1A大豆叶片的最佳内参基因是否受Anticarsia gemmatalis[48]。下h·罗布斯塔胁迫下,在叶片和幼茎组织中表现最好的内参基因不同。PP2C59和UBC5B在叶片中表现出较高的表达稳定性,而只有PP2C59幼茎排名高。同样,不同物种在不同条件下和不同组织中合适的内参基因是不同的。因此,有必要通过RT-qPCR鉴定出适合特定条件的最佳内参基因。蛋白磷酸酶可以逆转蛋白激酶的磷酸化,从而动态控制蛋白磷酸化和蛋白磷酸酶2c (PP2Cs)是植物中最丰富的一种磷酸酶[49]。虽然它不常被用作候选内参基因,但在我们的研究中,它在害虫胁迫和不同组织中都是稳定的檀香[50]。因此,在筛选其他物种的内参基因时,PP2Cs可以考虑作为候选内参基因。
在本研究的大多数实验条件下(除PEG6000处理外),表现最差的内参基因为PPIA该基因是BestKeeper推荐的在PEG6000胁迫下使用的最佳参考基因。这个家族的另一个基因,PPIA95,在4°C冷胁迫和MeJA处理的geNorm分析中排名第一。下面是树叶和嫩茎h·罗布斯塔治疗和MeJA压力,PPIA95在NormFinder分析中排名第三。在BestKeeper分析中,PPIA在4°C冷胁迫和peg6000诱导的干旱胁迫下,95样品排名第三,在所有样品中排名第二。总的来说,PPIA基因家族是一种很有前途的参考基因t . ciliata.的PPIA基因家族编码在免疫反应中具有功能的蛋白质,以及对癌症、自身免疫性疾病、原生动物和病毒感染的抵抗力[51]。在植物中,基因的PPIA家族基因很少被用作内参基因,但它们在基因组中大量表达t . ciliata每个样本的转录组数据和表达水平非常相似,这是选择它们的主要原因。作为内参基因,它们在动物体内也稳定表达。例如,在不同的心脏和疾病条件下,PPIA被ReFinder认可为小鼠不同骨骼肌的最佳内参基因,在人类子宫内膜癌中排名第一[52,53]。PPIB被认为是分析马查多-约瑟夫病(MJD)患者血液的最佳参考基因[54]。
结论
本研究首次报道了一系列内参基因在不同条件下表达稳定性分析的筛选和验证t . ciliata,表明最优内参基因为浴缸-α和PGK在所有样本中;PP2C59和UBC5B在树叶和HIS1和ACT7在幼嫩的茎下h·罗布斯塔治疗;浴缸-α和PPIA95在不同的组织中;60 s-18和浴缸-α4℃处理;UBC17和PPIA95MeJA处理;HIS1和MUB1PEG6000处理下,我们认为本研究对准确定量和分析不同条件下的基因表达具有重要意义t . ciliata.它将在分子育种工作中发挥至关重要的作用t . ciliata,如对的研究h·罗布斯塔-抗性和抗旱品种,以及未来植物珍贵化合物代谢途径的研究。
方法
植物材料
进行了5种不同的实验进行数据收集(表1)4).实验样本均取自一岁大的儿童t . ciliata它生长在华南农业大学的一个温室里。2019年8月25日上午9点采集了不同组织的成熟叶、嫩叶、花、芽和嫩茎样本。治疗前h·罗布斯塔在28℃光照16 h, 22℃黑暗8 h的培养箱中模拟野外环境,将所有幼苗在培养箱中预孵育7 d。为h·罗布斯塔处理后,幼苗暴露于食草动物中,在0、6、12、24和36 h后收获叶片和幼茎。用0、5、10、20和30% (w/v) PEG6000处理幼苗7天后,收集叶片。对于4℃处理,将幼苗置于4℃,并在0、6、12、24和36 h采集样品(叶片)。用100 μM MeJA喷施幼苗,密封于塑料袋中,于0、6、12、24、36 h采集叶片。每个采样点进行3次生物重复,所有样品立即在液氮中冷冻,保存于- 80°C。
RNA提取,质量评估和DNA合成
使用HiPure HP Plant RNA Mini Kit (Magen)从所有样品中提取总RNA,并使用DNA酶处理去除基因组DNA。用NanoDrop ND1000 (Thermo Scientific)检测RNA的质量。选取吸光度比A260/A280和A260/A230均在2.0左右的RNA样本进行进一步分析。按照HiScript II逆转录试剂盒(Vazyme)的说明书,使用0.5 μg总RNA合成cDNA。随后的RT-qPCR实验采用5倍稀释的cDNA。
候选内参基因选择及引物设计
选取20个候选内参基因t . ciliata通过查阅文献建立叶片转录组数据库:Pgk、60s-18、60s-13、his1、his6、pp2c57、pp2c59、ubc5b、ubc17、act7、samdc、ef1、ef2、18s、tub -α、tub -β、mub1、ppia26、ppia95、tip41.因为没有可用的基因组序列数据t . ciliata,我们根据序列设计引物t . ciliata转录组数据库。首先分别扩增候选内参基因的编码序列(CDS)和基因组DNA序列(gDNA)(表S)1),然后通过序列比对(NCBI- blast)获得候选内参基因的内含子和外显子,最后利用NCBI的基于web的Primer-Blast工具(https://www.ncbi.nlm.nih.gov/tools/primer-blast/).除了60 -18, samdc,浴缸-β和PPIA26,RT-qPCR引物设计跨内含子。这些基因和引物的详细情况见表1.
PCR和RT-qPCR分析
每个PCR扩增反应混合物的体积为20 μL,其中Phata Max Buffer 10 μL, 5倍稀释cDNA 2 μL,每个引物2 μL (10 μM), dNTP 0.5 μL, Phata Max Super-Fidelity DNA Polymerase 0.5 μL, ddH 5 μL2O. PCR反应程序如下:95°C 3 min, 95°C 15 s, 55°C 15 s, 72°C 15 s 35个循环,72°C延长5 min。RT-qPCR反应混合物由10 μL ChamQ Universal SYBR qPCR Master Mix (Vazyme)、2 μL cDNA、各引物0.4 μL (10 μM)、7.2 μL ddH组成20至终体积为20 μL,在LightCycler480 (Roche Molecular Biochemicals, Mannheim, Germany)光学96孔板上进行。为检验RT-qPCR引物的特异性,PCR产物在2% (w/v)凝胶上进行核酸电泳分析,扩增后绘制熔融曲线。所有用于RT-qPCR分析的样品均有3个生物重复,每个重复包含3个技术重复。为了计算基因特异性PCR效率(E)和相关系数(R)2),使用5倍稀释系列从混合的互补DNA (cDNA)生成标准曲线。
候选内参基因表达稳定性分析
RT-qPCR获得CT值,用于评价候选基因在不同实验条件和组织中的表达水平。三种常用算法geNorm [24]、NormFinder [25]和BestKeeper [26],以评价候选内参基因在不同实验中的稳定性。
包geNorm (Version3.5)通过计算每个候选基因的稳定性M值来筛选稳定的内参基因,M值越小,候选基因的稳定性越高。计算引入新的内参基因后归一化因子的两两变化,并根据比值V确定最优内参基因的个数n/ Vn + 1.如果V的值n/ Vn + 1小于0.15,则最优内参基因个数为nn/ Vn + 1大于0.15,则最优内参基因数为n + 1。NormFinder通过计算候选基因表达的稳定性值来选择最合适的内参基因。稳定值越低,基因越稳定。利用BestKeeper软件,可以得到各候选基因表达的SD和CV。然后比较不同基因的CV±SD值,以确定候选基因表达的相对稳定性。最后,为了从geNorm、NormFinder和BestKeeper生成的数据中生成候选基因的总体排名,我们使用了R中的RankAggreg(版本0.6.5)软件包,如前所述[14,55,56,57]。RankAggreg是一个算法包,可以组合不同的排名列表。基于排名列表的大小,我们使用了交叉熵蒙特卡罗算法[34]。使用之前由三个软件包生成的排名列表作为输入,并带有以下参数:使用Spearman 's Footrule函数计算距离,其中ρ设置为0.1,种子为100,“convIn”参数为50。
内参基因的验证
为了验证所选内参基因排名的准确性和表达的稳定性,采用RankAggreg推荐的两个最稳定的内参基因单独和组合,以及两个最不稳定的内参基因来验证其相对表达TcMYB34℃以下,MeJA, PEG6000,不同组织,及以下h·罗布斯塔处理(叶和嫩茎)。最后,我们用了2-△△CT方法计算验证基因的相对表达量,其中△CT = CT(靶基因)-CT(参比基因);△△CT =△CT(治疗)△2 . CT(对照)-△△CT=相对表达式。每个生物样本进行三次技术重复[58]。
数据和材料的可用性
本研究中生成和/或分析的数据集可在[基因库]存储库中获得,[基因库登录号为MW003991至MW004010]。
缩写
- RT-qPCR:
-
实时定量PCR
- t . ciliata:
-
Toona ciliataRoem
- h·罗布斯塔:
-
Hypsipyla罗布斯塔
- 惩罚:
-
甲基jasmonate
- CT:
-
循环阈值
- TcMYB3:
-
转录因子MYB3
- 简历:
-
变异系数
- SD:
-
标准偏差
- cd:
-
编码序列
- gDNA:
-
基因组DNA
- 互补脱氧核糖核酸:
-
互补脱氧核糖核酸
参考文献
李鹏,詹鑫,阙启明,曲文涛,刘明明,欧阳克新,李建军,邓晓明,张建军,廖碧,等。遗传多样性与种群结构Toona CiliataRoem。基于序列相关扩增多态性(SRAP)标记。森林。2015;6(12):1094 - 106。
李鹏,尚云云,周伟,胡学祥,毛文明,李建军,李锦江,陈学祥。珍贵速生木材高效再生系统的开发Toona ciliata.植物生物技术(东京,日本)。35(1): 2018; 51-8。
朱国良,万丽玲,彭小荣,石qq,李小娜,陈建军,周磊,邱明辉。从植物枝条和叶片中提取具有细胞毒性的柠檬素Toona ciliata.中国生物医学工程学报,2019;32(9):2419-29。
Beseni BK, Matsebatlela TM, Bagla VP, Njanje I, Poopedi K, Mbazima V, Mampuru L, Mokgotho MP。潜在的抗糖化和降糖作用Toona ciliatam . Roem。和Schkuhria pinnata林。Thell。C2C12细胞的粗提物。循证补体替代医学,2019;2019:5406862。
罗健,黄文伟,胡思明,张鹏,周晓伟,王旭,杨明辉,罗建国,王超,刘超,等。具有独特的6/5/6/5四碳环骨架的重排柠檬素Toona ciliata和仿生结构发散。有机化学前沿,2017;4:2417-21。
Veiga TA, Gonzalez-Vazquez R, Neto JO, Silva MF, King-Diaz B, Lotina-Hennsen BToona ciliata菠菜类囊体光系统II抑制剂。生物化学学报,2007;41(1):368 - 368。
夏建军,李学祥,张思忠,刘建强,张文明,闫永勇,丁志涛,邱明辉。一种罕见的9,11-seco柠檬素Toona ciliata.四面体学报。2014;55(13):2104-6。
Malairajan P, Gopalakrishnan G, Narasimhan S, Veni KJ, Kavimani SToona ciliata罗默(心木)。中国生物医学工程学报,2009;31(2):368 - 368。
王晓明,王晓明。红木螟虫的繁殖与生物学研究Hypsipyla罗布斯塔在人工培养基上的摩尔(鳞翅目:皮蝇科)。昆虫学报,1983;4(04):319-25。
杨建军,李建军,李建军,等。红木树种的嗅觉特征及其对雌性的影响Hypsipyla罗布斯塔.昆虫学报,2014,67(1):21-30。
坎宁安后卫,弗洛伊德后卫。叶片成分的差异预测了植株的变化Hypsipyla罗布斯塔损害Toona ciliata在田间试验中。气象学报,2011;34(3):642-8。
莫J, Tanton MT, Bygrave FL.树内攻击分布Hypsipyla罗布斯塔澳洲红杉(Toona南极光(f . Muell)。伤害)。林业科学与技术,1997;16(1):1 - 4。
莫杰,Tanton MT, Bygrave FL.红杉尖蛾饲养技术的改进,Hypsipyla罗布斯塔蛾(鳞翅目:蛾科)。南方昆虫学报,2014;37(1):64-9。
郭春春,迟志祥,姜道林,徐涛,余文文,王铮,陈森,张磊,刘启勇,郭小春,等。胆固醇稳态调节因子SCAP-SREBP2在巨噬细胞中整合NLRP3炎性体激活和胆固醇生物合成信号。免疫力。2018;49 (5):842 - 856. - e847。
Kundu A.植物香兰素生物合成途径。足底。2017;245(6):1069 - 78。
韩波,杨志,Samma MK,王锐,沈伟。铁缺乏条件下qRT-PCR归一化候选内参基因的系统验证拟南芥.Biometals。2013;26(3):403 - 13所示。
Reddy DS, Bhatnagar-Mathur P, Cindhuri KS, Sharma KK。花生实时荧光定量PCR基因表达研究规范化内参基因的评价与验证。科学通报,2013;8(10):888 - 888。
Warzybok A, Migocka M.不同氮营养条件下黄瓜基因表达正常化的可靠内参基因。科学通报,2013;8(9):e72887。
高敏,刘玉萍,马鑫,帅青,盖建勇,李勇。铝、镉和热胁迫下大豆基因表达正常化内参基因的定量RT-PCR评价。科学通报,2017;12(1):e0168965。
邓丽玲,吴玉玲,李建军,欧阳克新,丁明明,张建军,李思清,林明辉,陈海斌,胡学祥,等。筛选可靠的内参基因进行RT-qPCR分析辣木属鉴定.科学通报,2016;11(8):e0159458。
引用本文:黄婷,龙建明,刘文文,杨志伟,朱启军,赵晓玲,彭春春。实时荧光定量PCR法检测黄芪mRNA表达内参基因的选择与验证Neolamarckia cadamba.科学通报,2018;8(1):931 - 931。
曲荣军,苗玉军,崔玉军,曹勇,周玉伟,唐晓青,杨军,王飞。选择内参基因进行实时荧光定量PCR表达归一化Isatis indigotica财富。中国生物医学工程学报,2019;20(1):9。
张于欧美,G,陈YK、白QQ,高CS,曾庆红磅,李ZM评选,程Y,陈J,太阳XP,等。11个非生物/生物处理下苎麻叶和根基因表达qPCR分析的内参选择科学通报,2019;9(1):2004。
Vandesompele J, De Preter K, Pattyn F, Poppe B, Van Roy N, De Paepe A, Speleman F.多内控基因几何平均实时定量RT-PCR数据的精确归一化。中国生物医学工程学报,2002;3(7):0034。
李建平,李建平,李建平。实时定量逆转录- pcr数据的归一化:一种基于模型的方差估计方法,用于识别适合归一化的基因,应用于膀胱癌和结肠癌数据集。中国癌症杂志,2004;32(5):544 - 544。
蔡可夫斯基T, Stitt M, Altmann T, Udvardi MK, Scheible WR。在全基因组范围内鉴定和检测转录规范化的优质内参基因拟南芥.植物生理学报,2005;39(1):5-17。
Smitha PK, Vishnupriyan K, Kar AS, Anil Kumar M, Bathula C, Chandrashekara KN, Dhar SK, Das M.基因全基因组搜索鉴定基因表达分析候选基因陆地棉.植物学报,2019;19(1):405。
宋艳,王艳,郭德东,景丽。植物病原菌实时荧光定量PCR标准化内参基因的选择柄锈菌helianthi等。植物学报,2019;19(1):20。
陈晓军,陈海,袁建军,Köllner TG,陈云云,郭玉峰,庄晓峰,陈晓龙,张玉军,付建勇,等。水稻萜类合成酶基因OsTPS19作为一种(S)-柠檬烯合成酶足底,其过表达导致对blast真菌的抗性增强Magnaporthe oryzae.植物学报。2018;16(10):1778-87。
濮晓军,杨丽霞,刘琳,董晓明,陈少林,陈志祥,刘广军,贾玉英,袁文伟,刘磊。MYB转录因子超家族的全基因组分析Physcomitrella金属盘.中国生物医学工程学报,2011;21(3):975。
王辉,张辉,杨勇,李曼曼,张玉涛,刘建军,董军,李军,Butelli E,薛志,等。一个MYB转录因子家族对八倍体草莓(Fragaria x ananassa)水果。植物学报。2020;18(6):1109 - 1109。
张玉玲,张春林,王国良,王永勇,齐超,赵强,游春霞,李云云,郝玉军。R2R3 MYB转录因子MdMYB30通过调节角质层蜡的生物合成来调节植物对病原体的抗性。植物学报,2019;19(1):362。
朱丽,郭建军,马志勇,王建峰,周超。拟南芥转录因子MYB102通过大量激活乙烯生物合成提高植物对蚜虫的敏感性。生物分子。2018;8(2):39。
Pihur V, Datta S, Datta S.聚类验证措施的加权秩聚集:蒙特卡罗交叉熵方法。生物信息学(牛津,英国)。2007; 23(13): 1607 - 15所示。
Razavi SA, Afsharpad M, Modarressi MH, Zarkesh M, Yaghmaei P, Nasiri S, Tavangar SM, Gholami H, Daneshafrooz A, Hedayati M.甲状腺乳头状癌相关qRT-PCR研究的标准化内参基因验证。科学通报,2019;9(1):1 - 4。
李春华,李春华,李春华,等。生物能源作物qPCR数据标准化内参基因的筛选Arundo donax[j] .科学通报,2017;7(1):1 - 7。
杨启平,李志,曹建军,张世德,张海军,吴学勇,张秋文,刘祥祥。飞蝗定量PCR归一化内参基因的选择与评价状花序migratoria(直翅目:Acrididae)。科学通报,2014;9(6):e98164。
张凯,李明明,曹山,孙勇,龙瑞敏,康建民,严林,崔海。利用实时荧光定量PCR技术分析目的基因的内参基因的选择与验证苔属植物rigescens在非生物胁迫下。中国生物医学工程学报,2019;38(2):557 - 557。
朱学祥,李晓平,陈文雄,陈建勇,卢文杰,陈丽,傅大伟。评估木瓜新内参基因在不同实验条件下的准确转录归一化。科学通报,2012;7(8):e44405。
李文文,张丽莲,张永远,王国光,宋元达,张一文。雄蕊雄花雄蕊雄花和雄蕊雄花实时荧光定量PCR标准化内参基因的选择与验证Taihangia rupestris.植物科学,2017;8:729。
Pfaffl MW, Tichopad A, program C, Neuvians TP。确定稳定的管家基因,差异调节的目标基因和样本完整性:BestKeeper-基于excel的工具,使用成对相关性。生物工程学报。2004;26(6):509-15。
高东,孔锋,孙鹏,毕国强,毛永祥。转录组内最佳内参基因的鉴定Pyropia yezoensis对非生物胁迫的反应。生物医学工程学报,2018;19(1):251。
引用本文:李海红,戴国光,张荣荣,何云峰,冉海燕,陈山。东方粘虫实时荧光定量PCR分析的潜在内参基因筛选。PloS one。2018; 13 (4): e0195096。
Perez LJ, Rios L, Trivedi P, D'Souza K, Cowie A, Nzirorera C, Webster D, Brunt K, Legare JF, Hassan A,等。用于肥胖和糖尿病研究的肌肉和脂肪组织实时定量PCR的最佳内参基因验证。科学通报,2017;7(1):366。
何士森,安婷,刘莎。RT-qPCR研究目的基因表达的可靠内参基因验证炭疽菌camelliae在孢子萌发、菌丝生长和与寄主植物相互作用过程中。微生物学报,2019;10:2055。
Ram C, Koramutla MK, Bhattacharya R. RT-qPCR分析宿主基因表达的内参基因鉴定与综合评价芸苔属植物juncea-aphid使用微阵列数据进行交互。植物生理学报,2017;16(6):557 - 567。
Bansal R, Mittapelly P, Cassone BJ, Mamidala P, Redinbaugh MG, Michel A.大豆定量PCR推荐内参基因在不同生物胁迫下的稳定性。科学通报,2015;10(8):e0134890。
de Jesus Miranda V, Coelho RR, Viana AA, de Oliveira Neto OB, Carneiro RM, Rocha TL, de Sa MF, Fragoso RR。大豆线虫寄生和昆虫侵害qPCR数据准确归一化的内参基因验证。生物医学工程学报。2013;6:196。
Bhaskara GB, Wong MM, Verslues PE。磷酸化信号传导的另一面:蛋白去磷酸化和蛋白磷酸酶2c的调控。植物学报,2019;42(10):2913-30。
颜辉,张勇,熊勇,陈强,梁宏,牛明,郭斌,李敏,张翔,李勇,等。激素刺激下和不同组织中RT-qPCR新内参基因的选择与验证檀香.科学通报,2018;8(1):1 - 5。
Ayakannu T, Taylor AH, Willets JM, Brown L, Lambert DG, McDonald J, Davies Q, Moss EL, Konje JC。子宫内膜癌基因表达正常化研究的内源性对照内参基因验证。生物学报,2015;21(9):723-35。
Molina CE, Jacquet E, Ponien P, Munoz-Guijosa C, Baczko I, Maier LS, Donzeau-Gouge P, Dobrev D, Fischmeister R, Garnier A.正常和患病人类心脏转录组学分析的最佳内参基因鉴定。中国生物医学工程学报,2018;39(2):557 - 557。
中尾荣,王晓明,王晓明,等。小鼠代谢组织昼夜节律研究中与摄食节律无关的内参基因测定。中华生物医学工程学报,2017;21(2):190-7。
Ferreira AF, Raposo M, Vasconcelos J, Costa MDC, Lima M. Machado-Joseph病/脊髓小脑性共济失调3型(MJD/SCA3)患者血液基因表达规范的内参基因选择。中华神经科学杂志,2019;39(3):450-5。
杨建军,李建军,李建军,等。水稻非生物胁迫下内参基因的筛选与表达分析柳树viminalis.中华医学杂志,2019;20(17):421。
马洛纳,李晓峰,李晓峰,等。植物叶片和花发育内参基因的实时荧光定量PCR分析佩妮矮牵牛.植物学报,2010;10(4)。
Ponton F, Chapuis MP, Pernice M, Sword GA, Simpson SJ。植物生理反应逆转录- qpcr研究的潜在内参基因评价黑腹果蝇.昆虫学报,2011;57(6):840-50。
王明明,生物技术,MJFJ。Real-time PCR用于mRNA定量。生物医学工程学报,2005;39(1):75-85。
致谢
感谢广东省森林植物种质资源创新开发利用重点实验室提供的实验设备。
资金
本研究得到国家重点科研项目“林业资源培育与利用技术创新”(批准号:2016yfd0600606)、广东省自然科学基金(批准号:2018a030313798)和广东省教育厅特色创新项目(批准号:2019ktscx017)的资助。
作者信息
从属关系
贡献
PL和XC设计了研究;HS和WM进行实验;QQ、ZD、WZ分析数据;PL XC和HS撰写了手稿。所有作者都阅读并认可了稿件。
相应的作者
道德声明
伦理批准并同意参与
不适用。
发表同意书
不适用。
相互竞争的利益
作者宣称他们没有竞争利益。
额外的信息
出版商的注意
施普林格·自然对已出版的地图和机构关系中的管辖权要求保持中立。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,该协议允许以任何媒介或格式使用、共享、改编、分发和复制,只要您适当地注明原作者和来源,提供知识共享许可协议的链接,并注明是否进行了更改。本文中的图像或其他第三方材料包含在文章的知识共享许可协议中,除非在材料的署名中另有说明。如果材料未包含在文章的知识共享许可中,并且您的预期用途不被法律法规允许或超过允许的用途,您将需要直接获得版权所有者的许可。如欲查阅本许可证副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域免责声明(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非在数据的信用额度中另有说明。
关于本文
引用本文
宋辉,毛伟,段忠。et al。测定基因表达的内参基因的选择与验证Toona ciliata在不同实验条件下进行实时荧光定量PCR分析。BMC Plant Biol20.450(2020)。https://doi.org/10.1186/s12870-020-02670-3
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12870-020-02670-3
关键字
- Toona ciliata
- RT-qPCR
- 参考基因
- 法案
- Hypsipyla罗布斯塔
- TcMYB3