抽象的
背景
HD-ZIP转录因子对植物是独一无二的,在植物生长,发育和应力反应中起重要作用。HD-Zip转录因子家族由高度保守的同性恋(HD)和亮氨酸拉链结构域(LZ)结构域组成。虽然HD-Zip基因家族已被广泛研究了许多植物物种,但系统的系统研究桉树HD-ZIP家族尚未在今天报告。在这里,我们系统地鉴定了40个高清ZIP基因桉树(桉树祖母).此外,我们全面分析了HD-ZIP桉树通过研究同源性,保守的蛋白质区域,基因结构,蛋白质的3D结构,染色体上基因的位置和不同组织中基因的表达水平。
结果
HD-ZIP家族桉树有四个亚科,这与其他植物,如拟南芥和米饭。此外,在同一组中的基因倾向于具有类似的外显子系统结构,基序和蛋白质结构。在盐胁迫和温度胁迫下,桉树HD-Zip转录因子表现出不同的表达模式。
结论
本研究揭示了HD-Zip转录因子在盐胁迫和温度胁迫下的响应,为今后的分析奠定了基础桉树HD-ZIP转录因子。
背景
转录因子(TFs)是与特定蛋白结合的必要蛋白质独联体-基因启动子区的作用元件,激活或抑制其转录,从而在信号通路中发挥关键作用。转录因子也是真核生物生长和分化过程中的重要参与者[1,2].通过形成复杂的网络,转录因子可以在时间和空间两个维度上调控各种基因的表达。因此,它们有潜力成为改善具有经济和生态重要性的性状的有用工具[3.,4].直到今天,已经克隆了几种TFS基因,参与非生物应激反应,如AP2 / ereBP,NAC,WRKY,MYB,HSF,ZFP和BHLH [5,6].
同源域亮氨酸拉链(HD-ZIP)基因家族仅在植物中报告并调节植物特异性的生长和开发过程[7,8].HD-Zip具有高度保守的同性恋(HD)由61个氨基酸和亮氨酸拉链(LZ)结构域组成。HD基序可以特异性结合DNA,而LZ作为二聚化图案[9]. HD-Zips已经在多种植物中被鉴定和分析,例如Medicago truncatula葡萄(vitis Vinifera),大米(奥雅萨苜蓿),玉米(玉米), 土豆 (茄属植物tuberosum),小麦(Triticum aestivum.)和香蕉[10,11,12,13,14,15,16,17].HD-Zip根据其基因结构、保守序列、独联体- 和生物学功能[18,19].相似地,桉树也有四个亚科,HD-ZipⅠ到HD-ZipⅣ。其中HD-ZipⅠ包含两个基本基序;然而,HD-Zip-II、III和IV家族除了HD和LZ基序之外还拥有其他基序。1) CPSCE(由Cys、Pro、Ser、Cys和Glu五个保守的氨基酸序列组成)存在于HD-ZipⅡ亚家族中[20.,21].2)在HD-ZIP III和IV亚壳中,发现了与脂质转移相关的类固醇型急性调节蛋白质基序(星形相关脂质转移)[22,23].HD-ZIP I和HD-ZIP II蛋白质识别类似的假盲均序列Caat(C / G)ATTG [7,20.,21]而HD-ZIP III和HD-ZIP IV蛋白分别识别序列GTAAT(G / C)attac和TaaATG(C / T)A [22,24].
HD-ZipⅠ蛋白在植物光信号转导中的作用已被报道[5],叶片和种子发育[20.,24]植物生长、去黄和植物对胁迫的反应[1,21,25].在拟南芥当HD-ZipⅠ成员ATHB12过度表达时,会导致叶片变大,细胞变大,从而显示其在叶片生长中的作用。另一个HD-ZipⅠ成员ATHB1参与细胞壁的组成和延伸[18,26]. 另外,费德里科等人证明了这一点Medicago truncatula侧根发育需要HD-ZipⅠTF-HB1[16,18].此外,HD-ZIP I蛋白也在非生物应激反应期间发挥至关重要的作用。例如,干旱和脱落酸强烈上调ATHB7和ATHB12,其作为PP2C的正调节剂拟南芥[27].在向日葵中,Hahb4通过乙烯介导的老化来调节对干旱状况的耐受性[28].此外,过表达ZmHDZip10和TaHDZipI-5可以提高植物对低温、干旱、盐碱胁迫的耐受性[29,30.,31.].HD-Zip I家庭成员在打击生物应激方面也具有防御作用。例如,胡椒HD-ZIP I蛋白对耐受性增加的积极影响青枯菌[32.].
HD-ZIP II亚家族具有保守的域名CPSCE,其在调解植物响应对轻质质量和阴影的变化中起重要作用33.,34.[非生物应激反应[35.].光化学条件主要调控它们的表达[36.,37.].
HD-Zip III蛋白的结构是HD-Zip中最复杂的。HD-Zip III家族具有START结构域、homeodomain-START相关结构域(HD-SAD)和Met-Glu-Lys-Hi-Leu-Ala (MEKHLA)结构域。START域是aba响应域,HD-SAD域的功能目前尚不清楚。值得注意的是,HD- zip III的HD结构域与其他亚家族相比,有两个氨基酸残基发生了改变,这种变化可能与唯一的MEKHLA结构域有关[38.]. MEKHLA结构域是一个PAS样结构域,与多种化学和物理刺激有关[39.].HD-Zip III蛋白不仅参与植物特异性光合作用,还抑制转录[40],暗示HD-ZIP III基因可能在转录中发挥作用[40].HD-Zip III蛋白也被认为参与植物胚胎发育[41.],营商形成[39.,血管发育[42.[植物开发期间的植物素极性转运[10].
microRNAs(miRNA)是小型非编码RNA,后转录调节基因表达[43.].mirna与互补的mRNA分子结合,通过切片或翻译抑制负调控靶标的表达[44.].据报道,III类HD-Zip基因转录后受microRNAs miR165/166调控[45.,46.].在拟南芥开发根部,串扰至少六种不同的植物激素动态调节miR165 / 166和HD-ZIP III的时空表达模式。此外,HD-ZIP III介导的根部发育通过植物激素和KAN进行转录调节,并通过MIR165 / 166进行后转录[47.].II类和III类HD-zips确定上叶组织的正确图案,并在一起抑制MiRNA MiR165 / 166,最终调节III类HD-ZIPS功能。这种三种互动在开发期间保持组织身份平衡,这有助于开发平坦的叶子拟南芥[48.,49.].此外,MiR166G过表达Arabidopsis Jabba.1 d (jba-1D)突变植物影响III类同源域 - 亮氨酸拉链家族基因的转录物[50.].
HD-Zip IV亚家族包含与HD-Zip III亚家族相同的4个保守域,分别是HD、Zip、START和HD- sad域。然而,HD-Zip IV缺乏MEKHLA域[51.,52.].在生物和非生物胁迫中,该亚家族的基因在多种物种的外细胞、表皮和亚表皮细胞中均有明确表达[53.,54.]. HD-Zip-IV在毛发形成、花青素积累、脂质合成和转运中也起着重要作用[53.,54.,55.,56.].
桉树,澳大利亚东南海岸的一种本地植物,是该属的一员myrtaceae..在中国,桉树主要种植在广西省。它享受潮湿和肥沃的河水土壤和玄武岩风化的红壤。桉树由于其短暂的增长周期和其他优势,具有高的经济价值。叶子桉树可用于提取芳族油[57.].此外,它还具有消炎、杀菌、祛痰的作用,可作为药物使用[58.].桉树木材具有耐腐蚀性特性,它广泛用于这种结构,造纸和燃料产业。此外,它通常用于世界各地的人工造林,作为独特的商业树种,桉树被大规模种植。然而,桉树通常受生物胁迫的影响,如干旱,低温和盐胁迫在生长过程中,导致产量下降[59.,60.,61.].因此,研究和分析水稻的应激相关基因具有十分重要的意义桉树改善优异的性状和育种。
在这里,我们鉴定并分类了HD-Zip蛋白桉树,分析了HD-ZIP系列和HD-ZIPS对温度和盐度应力的关系之间的关系。这些结果为功能表征提供了必要的基础桉树HD-ZIP家族和随后改进的理论依据桉树品种免受压力。
结果
中HD-Zip蛋白的系统发育和进化分析桉树
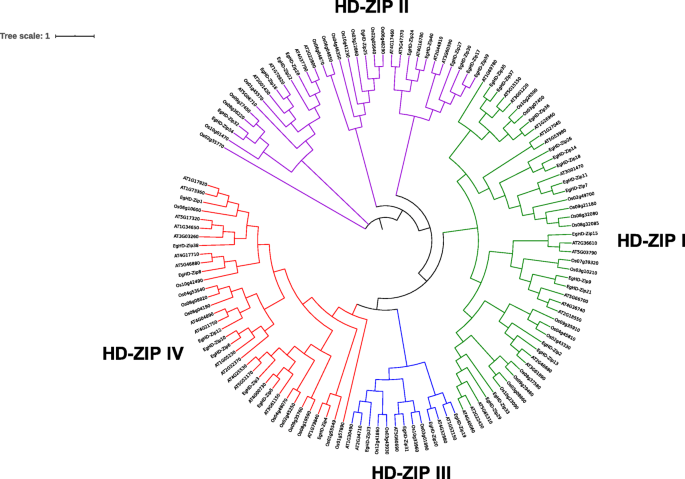
共鉴定了40个候选HD-ZIP基因桉树命名为EgHD-Zip 1-40。为进一步分析所选序列,构建了40条序列的系统发育树。同时,为了更好地突出两者的区别桉树以及其他植物,拟南芥水稻也包括在进化分析中。结果表明桉树,就像拟南芥和米饭,也有4个HD-zip基因的4个亚属。其中,HD-ZIP I亚家族具有最大成员(15个NOS),HD-ZIP III亚家族具有最小的构件(4 NO)(图。1,补充图1,S.2).
在II亚家族,EGHD-ZIP16和AT1G70920(ATHB18)中,EGHD-ZIP40和AT4G16780(ATHB2)显示出高同源性。此外,在亚家族I中,返回ZIP36与AT1G26960(ATHB23)具有高同源性。在Subfamily III中,EGHD-ZIP19和AT1G52150(ATHB15)是高度同源的,因此可以推测,返回力ZIP19也可能在诱导血管束的发育方面具有类似的作用。类似地,效率,ZIP20和AT4G32880(ATHB8)位于同一分支上,因此可以推测EGHD-ZIP20还可以诱导血管束的发展。在Subfamily IV中,EGHD-ZIP4与AT1G79840(ATHB10),返回ZIP5和AT4G00730(ANL2)具有高同源性,表明EGHD-ZIP4可参与表皮细胞分化过程,返回ZIP5可以影响花发育。葡萄糖苷在叶片表皮中的积累,以及突变发生时,它将抑制花青素的积累。同时,它也可以参与确定根部中细胞的身份[7].
如表所示1,来自第二亚家族的蛋白质的等电点大于7,表明这些蛋白质含有更多的碱性氨基酸。虽然来自其他亚壳的基因的等电点通常小于7,但表明每种蛋白质含有更多的酸性氨基酸。此外,效率为91至848氨基酸,平均长度为430氨基酸,分子量为10.39kDa至93.01kDa,平均为47.51kDa。亚细胞定位分析表明桉树HD-ZIP基因全部位于细胞核中。
抗ZIP基因结构与基序结构分析
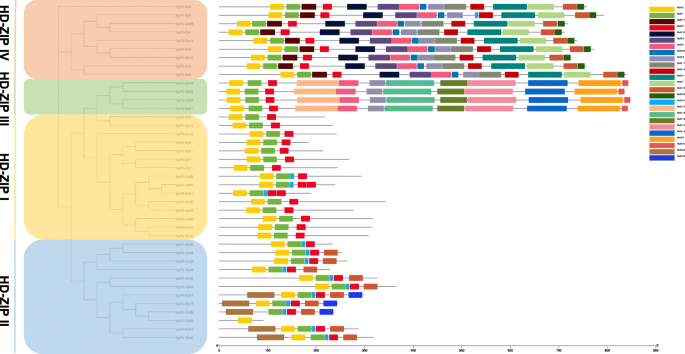
用于主题诱导(MEME)和基因结构显示服务器(GSD)的多个EM用于了解EGHD-ZIP蛋白及其结构之间的关系。值得注意的是,所有效率ZIP蛋白都具有编码HD和LZ结构域的保守基序。高度同源的构件由相同的基序组成,表明同一亚家族的HD-ZIP蛋白可以具有相似的功能。结果还表明,除了EGHD-ZIP30之外的所有效率 - ZIP蛋白质具有基序1,2和5.图案1和2表示编码HD域的保守基序,图案5表示域的编码LZ保守基序(图。2).在HD-ZIP II亚家族的所有成员中找到编码CPSCE域的图案12。然而,HD-ZIP-N在HD-ZIP II亚家族中的保守较少,因为它在EGHD-ZIP16, - 22, - 25, - 28,30, - 32和-34中未发现。此外,Motif在Subfamilies III和IV中发现了开始域名。由图案8和图案24编码的Mekhla域对亚家族III独特,仅在4个成员中发现(补充图。S3.,S.4).
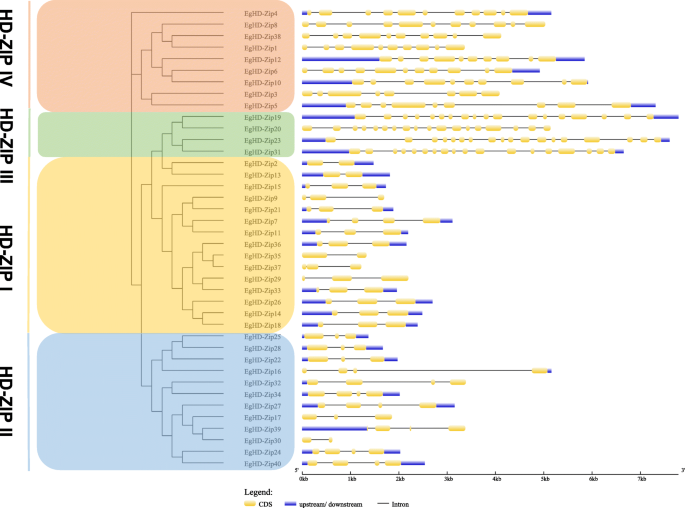
基因结构显示服务器(GSD)用于分析HD-ZIP基因的结构分集桉树(图。3.).结果表明,40个HD-Zip基因的遗传结构在外显子/内含子排列和内含子数量上存在显著差异。同时,同一亚家族中最相关的成员具有相似的外显子/内含子。内含子的结构和数量与上述系统发育分析中定义的特征一致。此外,在HD-Zip基因家族中,III亚家族基因的结构最为复杂,这与基序分析结果一致。例如,HD-Zip基因亚家族I和亚家族II包含2 ~ 4个外显子,HD-Zip基因亚家族IV包含8 ~ 11个外显子,HD-Zip基因亚家族III包含18个外显子。
为了获得所有姐妹对的内含子增益/损失信息,我们还比较了聚类于系统发育树末端分支的基因的内含子/外显子结构。其中,HD-Zip6/−10、HD-Zip3/−5、HD-Zip7/−11、HD-Zip35/−37、HD-Zip39/−30为内含子/外显子结构变化。4通过与邻近基因比较,我们发现HD-Zip7和HD-Zip6在进化过程中获得了一个内含子,而HD-Zip35则丢失了一个内含子(图1)。4).
效率的3D结构分析
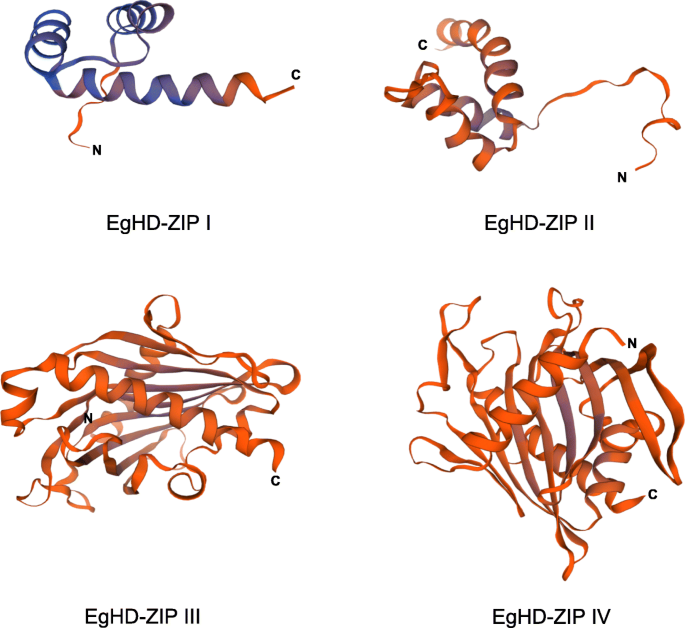
利用基于遗传算法的蛋白质同源性建模方法桉树SWISSMODEL数据库的HD-ZIP结构,来自四个亚属的成员的结构桉树HD-Zip预测。EgHD-Zip蛋白三维结构的N端和c端如图所示。4.选择具有最高分的结构作为效率为XGD-ZIP蛋白的最佳结构。每个亚家族的3D结构具有显着差异,并且HD-ZIP III和HD-ZIP IV的3D结构最复杂。与先前的研究一致,HD-ZIP I在羧基末端区域(CTR)和氨基 - 末端区域(NTR)处具有一些保守的结构[62.].模拟分析显示,四个亚家族在蛋白质结构水平上存在显著的基因差异。
EgHD-Zip基因的染色体定位
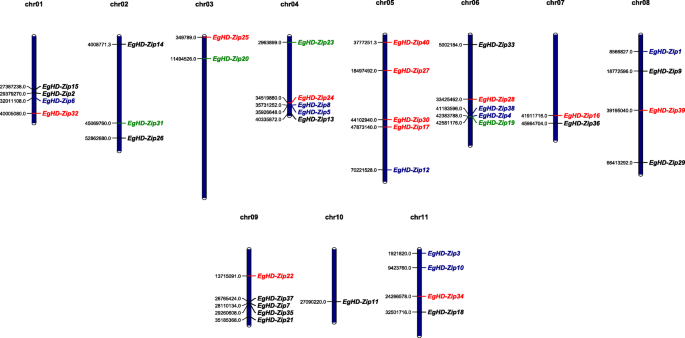
MapChart软件用于根据其11染色体的位置确定效率的延伸基因的分布桉树.我们发现HD-ZIP基因的分布桉树是不平衡的。染色体10只有一个HD-ZIP基因,而剩余的染色体有两到五个基因(图。5).在染色体9上有四种亚家族的基因,亚家族II主要分布在染色体上。亚家族III和IV的基因分散在桉树亚家族IV在1号染色体上。在第4、5、6、8号染色体上分别有1或2个基因。5).
表达谱的桉树各种组织中的HD-ZIP基因
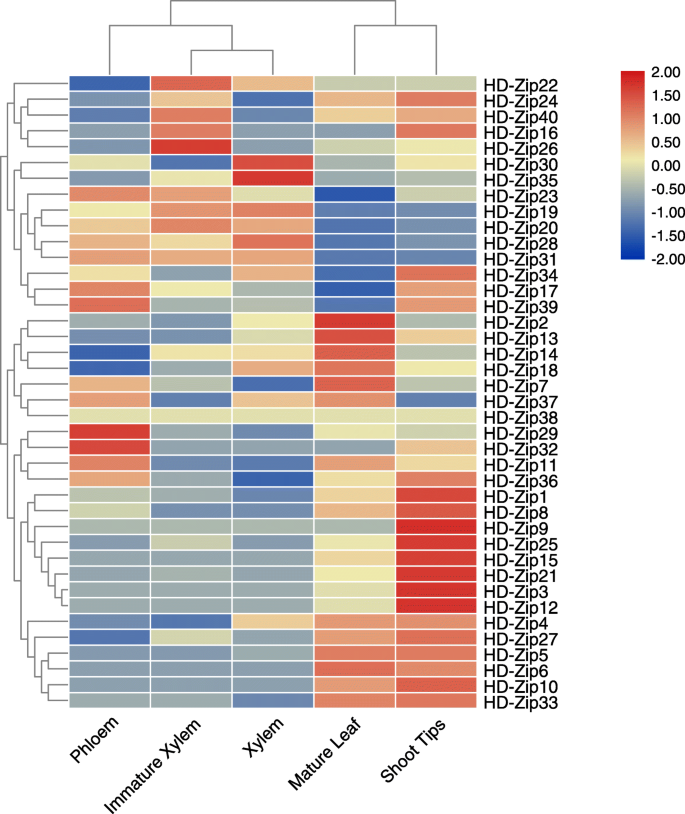
在本试验中,从成熟叶片,韧皮部,幼嫩木质部,成熟木质部和茎尖的样品桉树选择EgHD-Zip基因,利用TBtools生成EgHD-Zip基因表达热图(图5)。6,补充图5,S.6,S.7,S.8).分析表明,在IV亚家族中,除EgHD-Zip4和EgHD-Zip38外,其他基因在木质部和韧皮部的表达水平较低。相比之下,该家族在茎尖和叶片中的表达量较高,说明该家族可能参与了顶端分生组织和叶片的生长发育。此外,亚科III的4个基因在木质部和韧皮部均有高表达,表明来自亚科III的基因可能参与维管束的发育,可能与植物激素的运输有关。在亚家族I中,8个基因EgHD-Zip2、−7、−11、−13、−14、−18、−33和−37在成熟叶片中表达量较高。EgHD-Zip9、−15、−21、−33和−36在茎尖的表达量较高,可能与叶片的生长发育和顶端分生组织的发育有关。值得注意的是,有三个基因在维管组织中高表达。其中,EgHD-Zip26在幼木质部组织中高表达,可能在木质部的形成和发育中发挥独特的作用。EgHD-Zip35在成熟木质部中高度表达,可能与植物体内激素、水分和营养物质的运输有关。同样,EgHD-Zip29在韧皮部中也有高表达,提示它可能在韧皮部的发育中发挥了重要作用。 In subfamily II, 67% of genes are related to the growth and development of vascular bundles and the transport of plant hormones. Interestingly, some genes had low or no expression in the selected samples, which does not mean that these genes are not essential. Instead, it may be expressed in other developmental stages. In general, we found each subfamily has its unique expression characteristics and thus plays a different role.
盐胁迫下EgHD-Zip基因表达谱的变化
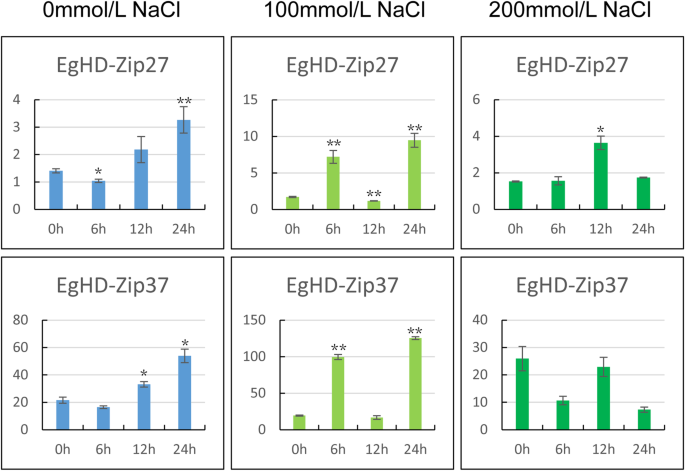
的反应桉树对温度和盐的胁迫比较突出。我们发现EgHD-Zip27和EgHD-Zip37在0 mmol/L NaCl处理下的响应趋势相同。在0 mmol/L NaCl胁迫下,EgHD-Zip27和EgHD-Zip37在6 h后呈现先下降后上升的趋势,说明植物的生物钟可以调控EgHD-Zip27和EgHD-Zip37的表达水平。在100 mmol/L NaCl处理下,EgHD-Zip27和EgHD-Zip37的表达量明显高于0 mmol/L NaCl处理,且呈现先升高后下降的趋势。200 mmol/L NaCl处理显著降低了EgHD-Zip27和EgHD-Zip37的表达量,但高于0 mmol/L NaCl处理。综上所示,EgHD-Zip27和EgHD-Zip37在应对NaCl胁迫中具有重要作用(图1)。7).
效率响应于温度的返回力ZIP基因表达谱
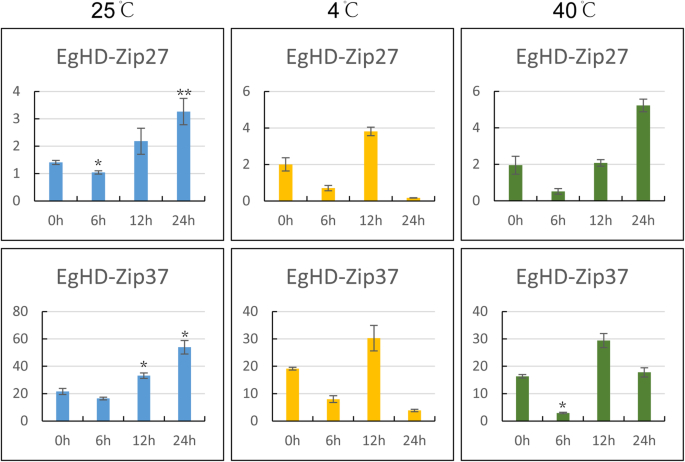
四点钟 在25℃时,EgHD-Zip27和EgHD-Zip37基因的表达均低于25℃时 尤其是EgHD-Zip37基因的表达在4℃时下降了一半 摄氏度。40岁 ℃时,EgHD-Zip37的表达也减少了一半,推测EgHD-Zip37受到高温和低温的抑制。EgHD-Zip27在40℃的表达模式 °C与25℃时相同 °C(图。8).
讨论
植物的生长发育是一个极其复杂的过程。在这个过程中,植物受到各种生物和非生物的胁迫。为了应对这些胁迫,植物表现出生理生化调控机制。植物感知并传递调节基因表达的应激信号[63.,64.].HD-Zip蛋白是植物特异性转录因子,在植物发育和应对各种逆境中发挥重要作用[8,18,24,65.].本研究对EgHD-Zip基因进行了全面的鉴定和分析桉树被执行。结果表明,HD-Zip家族可分为4个亚家族,HD-ZipI-IV [24].多序列比对和系统发育树分析显示这些基因具有较高的同源性。
保守的域分析表明,除了EGHD-ZIP30之外的所有效率蛋白质都有图案1,2和5.智能分析表明这三个图案代表了HD域和LZ域。对亚家族III和亚家族IV的研究表明,两者都有编码HD,LZ,开始和悲伤域的主题。相比之下,子类IV没有编码Mekhla域的图案8和4。以前的研究表明,亚家族III在陆地植物中发现。值得注意的是,在陆地植物的出现之前形成了Mekhla结构域,这可能是植物适应陆地生活条件的“初步准备”。因此,可以推测Subfamilies III和IV具有最新的评论祖先。基因结构的分析表明,不同亚壳的外显子内布置具有显着差异,而同一亚家族具有相似的结构和外显子数。但在进化过程中,外显子会丢失或增加,并且每个基因的外显子长度也可能发生变化。我们发现HD-ZIP35丢失了内含子和HD-ZIP7,HD-ZIP6在进化期间获得了内含子,这可能是影响同源基因不同功能的因素之一。
表达热图分析表明,亚家族I高表达,甚至在研究的五种组织中甚至最高表达基因。据推测,他们可能在增长和发展中发挥重要作用桉树. 除了亚家族II在成熟叶片中的低表达水平外,其余四个组织中都有高表达基因,说明该家族在植物的生长和运输中起着重要的作用桉树.在III亚家族中,所有基因在血管束组织中表达,具有高表达水平,但叶片和茎尖的表达低。因此,可以推测它们在中发挥着重要作用桉树植物素转运和血管组织形成。
有趣的是,IV和III亚壳的表达在五种选定的组织中对立。值得注意的是,HD-ZIP38未在五种选定的样本中表达,这并不意味着在增长和发展方面并不重要桉树.相反,它可以在其他组织中明确表达,从而影响了增长和发展桉树(无花果。3.,S.4,S.5,S.6,S.7).
HD-Zip在蒸馏水处理的幼叶中的表达呈先降低后升高的趋势。6点以后 在盐胁迫下,EgHD-Zip基因表现出一定的生理活性,表达量先上升后下降,12天后又上升,表达量最低 h压力。推测在中度盐胁迫下,HD-Zip基因在小麦幼叶中的表达受到抑制桉树。
两个选定基因的表达模式,来自HD ZipII亚家族的EgHD-Zip27和来自HD ZipI亚家族的EgHD-Zip37,表明这两个亚家族在应对盐胁迫中起着重要作用,并在叶片的生长发育中发挥作用(图。9).
在低温应激下,HD-ZIP基因的表达模式首先降低,然后再增加和减少。在高温胁迫下,HD-ZIP27的表达与25℃处理下的表达相同。同时,HD-ZIP37显示了首次减小的模式,然后再增加然后再次减少,表明其通过温度变化的调节。
结论
HD-Zip家族在植物的生长和发展中起着至关重要的作用。这里,共鉴定了总共40个效力基因基因桉树.根据进化分析,EgHD-Zip家族桉树分为四组。此外,在同一组中的基因倾向于具有类似的外显子系统结构,基序和蛋白质结构。在暴露于盐和温度胁迫期间,HD-ZIP基因的表达桉树显示差异表达。我们在这里表明HD-ZIP可能在不同的压力条件下发挥独特作用。本研究为进一步研究了关于功能表征的进一步研究的基础桉树HD-Zip基因。这也为其他学者研究我国的对策提供了理论依据桉树非生物胁迫期间的HD-ZIP转录因子。随着土地遗产正成为严重威胁,进一步研究改善桉树品种可以帮助扩张桉树种植区域。
方法
桉树HD-zip转录因子家族成员的鉴定与染色体定位
HD-ZIP蛋白序列来自拟南芥米在TAIR数据库中用作查询(http://www.arabidopsis.org)和planttfdb v4.0数据库(植物转录因子数据库)。此外,桉树HD-Zip HMM search [66.),结合SMART (Simple Molecular Agricultural Research Tool, Simple Molecular Agricultural Research Tool,http://smart.embl-heidelberg.de/)及EMBL pfam (https://pfam.xfam.org/)数据库用于检测保守域。最后通过人工筛选去除错误序列。筛选后的40个候选序列被认为是桉树HD-Zip基因(EgHD-Zip)。EgHD-Zip基因的染色体位置来自植物染色体v12.1.6 (https:///phytozome.jgi.doe.gov/pz/portal.html.),并使用Mapchart软件将其可视化。
系统发育和基因重复分析桉树HD-Zips
多个序列对齐桉树,米饭和拟南芥HD-Zip蛋白序列采用MUSCLE v3.8.31 [67.].使用最大可能性(ml)方法构建IQ-Tree软件,用于使用Bootstrap选项构建系统发育树n = 1000. After that, the results were imported to iTOL (https://itol.embl.de/)用于处理的在线软件。
蛋白质保守基序及基因结构分析
基因结构显示服务器(GSDS) [68.,69.的外显子-内含子桉树HD-zip基因。我们以来自Phytozome的GFF的格式下载了注释文件,并检索了HD-ZIP基因的注释信息。根据HD-ZIP基因的外显子内结构的默认参数,向GSD上载到GSD。用于图案诱导(MEME)的多个EM用于进一步确定可能在公共数据库中记录的图案的组成[70,71].宽度保持100aa,主题数量为25,其他参数设置为默认值。最后,基于swiss模型数据库中的蛋白同源性模型,我们还推断了HD-Zip蛋白的三维结构桉树.
EgHD-Zip表达模式分析
RNA-SEQ数据从公共网站和Phytozome下载[72].其中,桉树RNA-Seq数据包括:未成熟木质部、成熟叶片、韧皮部、茎尖、木质部。利用TBtools软件获得不同组织EgHD-Zip表达谱的热图[73].
植物材料和生长条件
实验材料,桉树祖母克隆eg5从福建农业和林业大学林业学院收集。桉树祖母在户外条件下,植物在当地土壤上生长了十个月。种植区年平均气温16 ~ 20℃,年平均降雨量900 ~ 2100 mm,年相对湿度77%左右。采用pH值为5,有机质含量为2.57 ~ 6.07%的红壤进行栽培。
温度和盐胁迫下氢化ZIP基因的表达谱
年度桉树用100mmol / L氯化钠处理幼苗,200mmol / L氯化钠0,6,12和24小时进行盐胁迫,用蒸馏水处理对照幼苗。对于温度应激,桉树分别置于4℃和40℃下,和对照组置于室温(25℃)下保存0、6、12和24 h。应力处理后,样品保存在−80℃,以备后续分析。每个处理使用五种不同的幼苗,试验至少重复三次。
定量RT-PCR(qRT-PCR)
使用RNA提取试剂盒(欧米茄Bio-Tek,Shanghai,China)从控制和胁迫处理样品中提取总RNA。cDNA合成EasyScript®制造商协议(Transgen,China)之后的一步GDNA拆除和cDNA合成超混合物。使用Transstart®PopGreen QPCR SuperMix(Transgen,北京)进行了QRT-QPCR。作为参考基因actin被使用。使用比较2计算相对转录性丰度-ΔΔcT方法 [74].所有实验均采用3个生物重复和3个技术重复。本研究使用的引物见补充表S1.
统计分析
应用了双尾学生的T检验以找到统计学意义。结果被描绘为三种生物重复的平均值±SE。
数据和材料的可用性
可以通过联系相应作者来共享再现这些发现所需的所有数据和材料。本研究期间生成或分析的所有数据都包含在本发布的文章中作为补充文件S10和S11。在当前研究期间分析的数据集可在NCBI SRA数据库中使用SRA RisciveS代码:PRJNA30415和PRJNA223526。以下链接可访问SRA记录:https://www.ncbi.nlm.nih.gov/sra/prjna30415.和https://www.ncbi.nlm.nih.gov/sra/SRX367258.
参考
- 1.
Franco-Zorrilla JM,Solano R.植物转录因子靶序列的鉴定。BBA-基因调节机械。2017; 1860(1):21-30。
- 2.
羌L,贵友Z,寿义C.植物转录因子的结构和监管功能。Chin Sci Bull。2001; 46(4):271-8。
- 3.
GOLLDACK D,Luking I,Yang O.植物耐受性和盐度:胁迫调节转录因子及其在细胞转录网络中的功能意义。植物细胞批准。2011; 30(8):1383-91。
- 4.
Nakashima K,Ito Y,Yamaguchi-Shinozaki K.转录监管网络,以应对拟南芥和草的非生物胁迫。植物理性。2009; 149(1):88-95。
- 5。
李莹莹,白BC,文峰,赵敏,夏启元,杨德华,王光辉。HD-ZIP I基因亚家族的全基因组鉴定与表达分析烟草.Genes-Basel。2019; 10(8): 575。
- 6。
王海英,王海林,邵海斌,唐晓丽。利用转录因子提高植物抗非生物胁迫能力的转基因研究进展。植物科学与技术,2016;
- 7.
Ariel FD,Manavella Pa,Dezar Ca,Chan RL。HD-ZIP系列的真实故事。趋势植物SCI。2007; 12(9):419-26。
- 8.
Henriksson E,Olsson As,Johannesson H,Johannesson H,Jansson H,Hanson J,Engstrom P,Soderman E.同源域亮氨酸拉链I类基因In拟南芥.表达模式和系统发育关系。植物理性。2005; 139(1):509-18。
- 9
Viola IL,Gonzalez DH:第6章-植物同源盒基因的结构和进化。植物转录因子。编辑:Gonzalez DH。波士顿:学术出版社;2016年。101–12.
- 10.
Agalou A, Purwantomo S, ovas E, Johannesson H, Zhu X, Estiati A, de Kam RJ, Engstrom P, Slamet-Loedin IH, Zhu Z,等。水稻HD-zip基因全基因组调查及干旱响应家族成员分析。中国生物医学工程学报,2008;
- 11.
陈X,陈泽,赵立,赵y,程富,湘玉。盐度和干旱处理下的大豆HD-ZIP基因家族的基因组自分析。Plos一个。2014; 9(2):E87156。
- 12.
HD-Zip基因家族在葡萄胚胎败育调控中的潜在作用(vitis Viniferal .)。BMC基因组学。2017;18:744。
- 13.
毛高清,Yu LJ,Li ZJ,刘H,汉族,Zea Mays L. Genetica的HD-Zip转录因子家族内的分子演化和基因表达差异。2016; 144(2):243-57。
- 14。
悦H,舒D,王M,xing g,zhan h,du x,song w,nie x。小麦HD-zip基因家族的基因组型鉴定及表达分析(Triticum aestivum.l .)。基因(巴塞尔)。2018; 9(2):70。
- 15。
关键词:番茄,同源结构域,亮氨酸拉链,基因表达,低温响应中国生物医学工程学报,2014;
- 16。
Li Z,Gao Z,Li R,Xu Y,Hu R. Genome-ide-ide idence id and表达剖析HD-zip基因家族Medicago truncatula.基因组学。2020; 112(5):3624-35。
- 17。
杨y y,山w,kuang j-f,chen j-y,lu w-j。通过激活乙烯生物合成和细胞壁改性基因的转录,四个高清曲线涉及香蕉果实成熟。植物细胞批准。2019; 39(3):351-62。
- 18
Ariel F,饮食A,Verdenaud M,Gruber V,Frugier F,Chan R,Crespi M.在Medicago truncatula中横向根出苗的环境调节需要HD-ZIP I转录因子HB1。植物细胞。2010; 22(7):2171-83。
- 19
Aoyama T、Dong CH、Wu Y、Carabelli M、Sessa G、Ruberti I、Morelli G、Chua NH。子宫内膜异位表达拟南芥转录激活剂ATHB-1改变烟草中的叶片细胞命运。植物细胞。1995年; 7(11):1773-85。
- 20.
Harris JC,HRMova M,Lopato S,Langridge P. HD-Zip I类和II转录因子的调节促进环境刺激。新植物。2011; 190(4):823-37。
- 21.
Meijer AH, de Kam RJ, d'Erfurth I, Shen W, Hoge JH。水稻家族I和II的HD-zip蛋白:相互作用和功能特性。中国生物医学工程学报,2000;
- 22.
COTE CL,Booteau F,Roy V,Ouellet M,Levasseur C,Morency MJ,Cooke Jek,Seguin A,Mackay JJ。高清ZIP III基因的基因族结构,表达和功能分析,植物林林树木。BMC植物BIOL。2010; 10:273。
- 23.
Pandey A,Misra P,Alok A,Kaur N,Sharma S,Lakhwani D,Asif MH,Tiwari S,Trivedi PK。同源域亮氨酸ZIPPER亚家族IV(HDZ IV)基因家族的基因组鉴定及表达分析Musa Accuminata..植物科学,2016;7:20。
- 24.
ELHITI M,Stasolla C.同型瘤亮氨酸拉链(HD-ZIP)蛋白的结构和功能。植物信号表现。2009; 4(2):86-8。
- 25.
Yang Y,HHJ A,Harris J,Riboni M,Kovalchuk N.Featb和Barley中的DREB / CBF表达使用HD-ZIP I基因的应力诱导促进剂:对植物发育,应力耐受性和产量的影响。植物Biotechnol J. 2020; 18(3):829-44。
- 26。
五车二属植物M,核糖PA,Arce AL,Chan RL。拟南芥同源盒1(AtHB1)是一种家族结构域亮氨酸拉链Ⅰ(HD-zipⅠ)转录因子,受光敏色素相互作用因子1调控,促进下胚轴伸长。新植物醇。2015;207(3):669–82.
- 27。
Valdes AE,Overnas E,Johansson H,Rada-iglesias A,Engstrom P.Hyodomain-亮氨酸拉链(HD-ZIP)I类转录因子ATHB7和ATHB12通过调节蛋白质磷酸酶2C和脱钙酸受体基因活性调节脱落酸信号。植物mol biol。2012; 80:405-18。
- 28。
Manavella Pa,Arce Al,Dezar Ca,Bitton F,Renou JP,Crespi M,Chan RL。乙烯和干旱信号通路之间的串扰由向日葵HAHB-4转录因子介导。工厂J. 2006; 48(1):125-37。
- 29。
杨毅,琅,哈里斯J,Riboni M,Li Y,Bazanova N,Hrmova M,Haefele S,Kovalchuk N,Lopato S.阶级I ododomain转录因子Tahdzipi-5增加了转基因小麦的干旱和霜冻耐受性。植物Biotechnol J. 2018; 16(6):1227-40。
- 30.
赵y,ma q,金x,peng x,liu j,邓l,严h,盛l,姜h,程b。一种小说玉米同源域 - 亮氨酸拉链(HD-zip)I基因,ZMHDZ10,积极调节干旱和稻米和拟南芥中的耐盐性。植物细胞生理。2014; 55(6):1142-56。
- 31。
李士,陈,李F,梅F,毛泽东特征小麦同源域 - 亮氨酸植物髓鞘系列基因,转基因拟南芥干旱耐受性耐旱5-6A的功能分析。BMC植物BIOL。2020; 20(1):50。
- 32。
MOU S,LIU Z,GAO F,YANG S,SU M,SHEN L,WU Y,HE S. CAHDZ27,一种同源域 - 亮氨酸拉链I蛋白,积极调节抵抗力青枯菌辣椒感染。Mol植物微生物相互作用。2017; 30(12):960-73。
- 33.
Franklin KA, Praekelt U, Stoddart WM, Billingham OE, Halliday KJ, Whitelam GC。光敏色素B、D和E可冗余控制多种生理反应拟南芥.植物杂志。2003;131(3):1340 - 6。
- 34.
同源结构域-亮氨酸zipper II转录因子家族是植物发育的中枢调控因子。植物信号处理技术研究进展。2013;
- 35.
公园我的,金萨,李SJ,金苏。ATHB17是早期幼苗生长期间脱落酸反应的阳性调节因子。mol细胞。2013; 35(2):125-33。
- 36.
Soderman E、Hjellstrom M、Fahleson J、Engstrom P。拟南芥HD-zip基因ATHB6在发育中的叶片、根和心皮中表达,在水分亏缺条件下表达上调。植物分子生物学。1999;40(6):1073–83.
- 37.
Rueda Ec,Dezar Ca,Gonzalez DH,Chan RL。Hahb-10是一款向日葵Homeobox-亮氨酸拉链基因,由轻质和数量进行调节,并在表达时促进早期开花拟南芥.植物细胞生理。2005; 46(12):1954-63。
- 38。
Sessa G, Steindler C, Morelli G, Ruberti i拟南芥ATHB-8,-9和-14基因是用于高效HD-ZIP蛋白的小基因系列的成员。植物mol biol。1998年; 38(4):609-22。
- 39。
zhu yy,song dl,xu p,sunjy,li lg。HD-ZIP III基因,PTRHB4是杨树中的杂交晶虫发育所必需的。植物Biotechnol J. 2018; 16(3):808-17。
- 40。
小贩NP,Bowman JL。III级HD-ZIP和Kanadi基因的角色在拟南芥根系中。植物理性。2004; 135(4):2261-70。
- 41。
Prigge MJ,Otsuga D,Alonso JM,Ocker JR,Drews Gn,Clark SE。III类同源域 - 亮氨酸拉链基因家族成员具有重叠,对抗和不同的作用拟南芥发展。植物细胞。2005; 17(1):61-76。
- 42。
3 . Robischon M, Du J, Miura E, Groover A. The Populus class III HD ZIP, popREVOLUTA, influence of形成层的形成和模式。植物杂志。2011;155(3):1214 - 25所示。
- 43。
Bartel DP。MicroRNAs:基因组学、生物发生、机制和功能。细胞。2004;116(2):281 - 97。
- 44。
voinnet O.植物microRNA的起源,生物生物和活性。细胞。2009; 136(4):669-87。
- 45.
Carlsbecker A, Lee JY, Roberts CJ, Dettmer J, Lehesranta S, Zhou J, Lindgren O, Moreno-Risueno MA, Vaten A, Thitamadee S, et al. .microRNA165/6的细胞信号传导决定了基因剂量依赖性的根细胞命运。大自然。2010;465(7296):316 - 21所示。
- 46.
Emery JF、Floyd SK、Alvarez J、Eshed Y、Hawker NP、Izhaki A、Baum SF、Bowman JL。径向图形化拟南芥采用III类HD-ZIP和KANADI基因拍摄。咕咕叫医学杂志。2003;13(20):1768 - 74。
- 47.
辛格a,roy s,singh s,das ss,gautam v,yadav s,kumar a,singh a,samantha s,sarkar ak。植物狂暴串扰在根系生长期间调节MIR166 / 165s,靶III级HD-拉链和Kanadi基因的表达拟南芥蒂利亚纳.Sci众议员2017;7(1):3408。
- 48.
等。关键词:复合材料,复合材料,复合材料,复合材料,复合材料II类和III类同源结构域亮氨酸拉链蛋白调控MIR165/166建立叶片极性。中国科学:地球科学,2016;
- 49.
辛格A,Singh S,Panigrahi KC,Reski R,Sarkar AK。MicroRNA166 / 165的平衡活性及其来自III类同性恋肌肉亮氨酸ZIPPER家族的目标转录物调节拟南芥的根生长。植物细胞代表2014; 33(6):945-53。
- 50。
Williams L,Grigg Sp,谢米,克莱斯滕斯,弗莱彻·杰克。MicroRNA miR166G及其Athd-Zip靶基因的拟南芥调节射击顶端分泌和侧外器官形成。发展。2005; 132(16):3657-68。
- 51。
Tron AE, Bertoncini CW, Palena CM, Chan RL, Gonzalez DH。在植物同源结构域二聚体蛋白中,两个氨基酸与一个碱基对的组合相互作用确定了目标位点的特异性。微生物学杂志,2001;29(23):4866-72。
- 52。
咀嚼W,HRMova M,Lopato S.同源域亮氨酸拉链(HD-ZIP)IV转录因子在植物开发和植物保护免受有害环境因素的作用。int j mol sci。2013; 14(4):8122-47。
- 53。
Ingram GC,Boisnard-Lorig C,Dumas C,Rogowsky PM。编码HD-ZIPIV Homeo结构域蛋白的基因的表达模式限定了玉米胚胎和商品中的特异性结构域。工厂J. 2000; 22(5):401-14。
- 54。
关键词:拟南芥,同源结构域,亮氨酸拉链基因家族,同源结构域植物杂志。2006;141(4):1363 - 75。
- 55。
ITO M,Sentoku N,Nishimura A,Hong Sk,Sato Y,Matsuoka M. pl2型Homeobox基因的位置依赖性表达,Roc1:Protoderm分化和早稻胚胎发生中的径向模式形成的重要性。工厂J. 2002; 29(4):497-507。
- 56。
PaHB1是一种进化保守的HD-GL2同源盒基因,在挪威云杉胚胎发育过程中表达于原皮层。《创世纪》。2001;30(4):220 - 30。
- 57.
Medbouhi A,Benbelaid F,Djabou N,Beaufay C,Bendahou M,Quetin-Leclercq J,Tintaru A,Costa J,Muselli A.阿尔及利亚eryngium Campestre的精油:化学变异性和生物活性的评价。分子。2019; 24(14):2575。
- 58.
Silva J,Abebe W,Sousa Sm,Duarte VG,Machado Mi,Matos FJ。桉树精油的镇痛和抗炎作用。J属植物。2003; 89(2-3):277-83。
- 59.
de Sá-Martins R, Cleiton-José A, Rocha-Faria JM, de Melo LA。水盐胁迫对不同桉树种种子萌发和活力的影响科学学报,2019;31(1):12-8。
- 60.
Coscolin RBS,Broetto F,Marchese Ja,Campobhermoso MC,Paladini MV。水晶缺乏对桉树克隆煤气交换参数和代谢的影响。BRAZ J植物理体。2011; 23(4):255-62。
- 61.
Myburg AA、Grattapaglia D、Tuskan GA、Hellsten U、Hayes RD、Grimwood J、Jenkins J、Lindquist E、Tice H、Bauer D等。巨桉的基因组。自然。2014;510(7505):356–62.
- 62。
陈瑞麟,陈瑞麟。HD-zip亚家族I转录因子中HD-zip域外的未特征保守基序;一个功能多样性的潜在来源。植物生物学杂志。2011;11:42。
- 63。
Verslues Pe,Agarwal M,Katiyar-Agarwal S,朱茹,朱杰克。影响影响植物水状况的抗旱,盐和冷冻,非生物应力的方法和概念。工厂J. 2006; 45(4):523-39。
- 64。
关键词:细胞,转录调控网络,脱水,低温胁迫植物生物学杂志,2006;57(1):781-803。
- 65。
4 .王东东,王春梅,王春梅,王东东。马铃薯HD-ZIP基因的全基因组鉴定与特性分析。基因。2019;697:103-17。
- 66。
涡流SR。配置文件隐藏马尔可夫模型。生物信息学。1998年; 14(9):755-63。
- 67。
Edgar Rc。肌肉:具有减少时间和空间复杂性的多序列对准方法。BMC生物素。2004; 5:113。
- 68。
郭爱,朱庆华,陈旭,罗继昌。GSDS:基因结构显示服务器。栓。2007;29(8):1023 - 6。
- 69.
胡b,金吉,郭艾,张h,罗j,高g. gsds 2.0:升级基因特征可视化服务器。生物信息学。2015; 31(8):1296-7。
- 70.
Bailey TL,Boden M,Buske Fa,Frith M,Grant Ce,Clementi L,Ren J,Li WW,Noble Ws:Meme Suite:Meme Suite:MOTIF发现和搜索的工具。核酸RES 2009,37(Web服务器问题):W202-W208。
- 71.
通过期望最大化拟合一个混合模型来发现生物高聚物中的基序。Proc Int Conf Intell system Mol Biol. 1994; 2:28-36。
- 72.
Goodstein DM, Shu S, Howson R, Neupane R, Hayes RD, Fazo J, Mitros T, Dirks W, Hellsten U, Putnam N等。植物基因组:绿色植物基因组学的比较平台。核酸杂志2012;40:D1178-86。
- 73.
Chen C,陈H,张Y,Thomas HR,Frank Mh,He Y,夏R.TBTOOLS:用于大型生物数据的互动分析开发的一体化工具包。莫尔植物。2020; 13(8):1194-202。
- 74。
Livak KJ,Schmittgen TD。使用实时定量PCR和2分析相对基因表达数据−ΔΔCT方法。方法。2001;25(4):402 - 8。
致谢
恳求秦立实验室成员的帮助。
资金
福建农林大学林业高峰学科建设项目(no . 71201800739)。资助机构在研究的设计、收集、分析、解释数据和撰写手稿方面没有任何作用。
作者信息
从属关系
贡献
SJC构思了研究,MA,JSZ和JZW进行了实验,数据分析和稿件写作;MLG在QRT-PCR上工作;QW和Hym对RNA分离和SBL有助于实验。SJC和MA修订了稿件。所有作者阅读并认可的终稿。
相应的作者
道德声明
伦理批准并同意参与
不适用。
同意出版
不适用。
相互竞争的利益
作者声明他们没有相互竞争的利益。
附加信息
出版商的注意事项
《自然》杂志对已出版的地图和附属机构的管辖权主张保持中立。
补充信息
附加文件1:图S1。
中HD-Zip基因的系统发育分类桉树祖母,拟南芥蒂利亚纳和奥雅萨苜蓿.
附加文件2:图S2。
中HD-Zip基因的系统发育分类桉树祖母
附加文件3:图S3。
HD-zip蛋白的基序组成。
附加文件4:图S4。
由MEME识别的每个主题的序列信息。
附加文件5:图S5。
EgHD-ZipI基因在不同组织中的相对表达水平。
附加文件6:图S6。
各种组织中EGHD-ZIP II基因的相对表达水平。
附加文件7:图S7。
各种组织中EGHD-ZIP III基因的相对表达水平。
附加文件8:图S8。
各种组织中EGHD-ZIP IV基因的相对表达水平。
附加文件9:表S1。
本研究中使用的引物的细节。
附加文件10:表S2。
不同组织和发育阶段菠萝BHLH基因的表达谱。
附加文件11:表S3。
目前研究中使用的桉树HD-ZIP序列。
权利和权限
开放获取本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料包括在文章的创作共用许可中,除非在材料的信用线中另有说明。如果材料没有包含在文章的创作共用许可证中,而您的预期使用不被法律法规允许或超过允许的使用,您将需要直接获得版权持有人的许可。如欲浏览本许可证的副本,请浏览http://creativecommons.org/licenses/by/4.0/.“创作共用公共领域”豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用这篇文章
张军,吴军,郭敏。et al。全基因组特性和表达谱桉树祖母HD-Zip基因家族对盐和温度胁迫的响应。BMC植物BIOL.20,451 (2020). https://doi.org/10.1186/s12870-020-02677-w
已收到:
接受:
发表:
关键字
- HD-zip
- 桉树祖母
- 转录因子
- 生物信息分析