摘要
背景
影响光捕获和叶绿素含量的叶子尺寸和形状是影响光合效率的重要因素。这些组分的遗传变异显着影响产量潜力和种子质量。鉴定这些特征的遗传基础和它们之间的关系对于实现理想的工厂建筑和提高产量的高光合效率具有很大的实际意义。
结果
在这里,我们使用三个映射群进行了大规模的联系映射研究,以确定两种环境中大豆叶相关性状和叶绿素含量之间的遗传相互作用。相关性分析显示叶片尺寸和形状之间的显着负相关,而两种性状与叶绿素含量呈正相关。通过主成分分析确定的三种测绘群体验证了这种表型关系,表明这些特征是在复杂和相互关联的遗传组分的控制下。部分共享叶叶相关性状和叶绿素的QTL,这进一步支持两种特征之间的紧密遗传关系。最大效应的主要基因座,Q20,在所有人口和环境中稳定地识别,并覆盖了狭窄的宣传叶基因Gm-JAG1(Ln/ln),这是大豆中传单形状的关键调节器。
结论
我们的研究结果揪出几个主效QTL(Q4-1,q4-2,的事情,问题,的时候和Q20)及其候选基因在叶片相关性状和叶绿素中具有特异性或共性,并表现出复杂的上位性相互作用。与这些有价值的qtl紧密相连的SNP标记可用于改良植株构型、光合能力甚至产量的分子设计育种。
背景
大豆是为全球人口提供油脂和蛋白质的重要作物。近年来,全球对大豆的需求迅速增长。因此,提高产量是大豆育种的重要目标之一。农作物的产量很大程度上取决于叶片的光合作用能力。作物的产量和品质也受到叶片相关性状的影响,如叶片形状,不仅影响光穿透、光吸收、CO2同时也决定了种群的冠层结构,从而决定了光的分布、光能的利用效率和透气性[1].叶宽(LW)、叶长(LL)和叶面积(LA)是大豆植株构型的重要组成部分;优化这些叶片形状特征可以改善叶片的几何和空间排列,达到理想的植物冠层形状,降低个体遮阳反应,提高叶片的光合效率和产量[2].叶绿素含量(CC)也是影响作物光合效率、生物量和产量的重要因素[3.,4,5,6]并且已经用于估计水稻叶片的光合效率和产量潜力[7].高CC是所期望的特性,因为它表明,在光合作用光抑制的程度低[8].因此,露出叶相关性状和CC的QTL及其与环境的相互作用之间的遗传关系和相互作用epistasic具有十分重要的现实意义与高光效和高产育种大豆。
目前,虽然在大豆中鉴定了许多与叶相关性状和CC相关的QTL(https://www.soybase.org/)的遗传关系,包括上位性和环境互作效应,尚未见报道。此外,大豆叶片相关性状和CC的qtl鉴定研究也受到分离群体遗传背景狭窄和使用低分辨率分子标记的限制。此前有研究报道,小麦中许多与叶片性状相关的qtl与CC的qtl共定位[9,10,11].多个QTL的共定位与表型之间的遗传相关相关联,并且还指示多基因键或多种效应的可能性。因此,QTL的鉴定/候选基因控制叶片相关性状和CC以及它们之间的亲缘关系,不仅可以为育种改进的植物结构大豆提供指导,但也可以用于提高光合效率很重要,甚至产生。
为了深入了解叶片相关性状和CC变异的遗传结构,我们利用广泛捕获大豆种质库表型变异的3个重组自交系(RILs)群体,绘制了LA、LL、LW、L/W(叶长宽比)、并分析了每株100粒种子的重量(100 sw),以供参考和比较。本研究的目的是我)分析leaf-related表型关系特征和CC使用三个瑞来斯跨多个环境,人口增长(二)确定叶related-traits之间的关系的基因结构和CC利用QTL定位,3)识别主要法在多个环境中稳定,(4)鉴定与有价值qtl相关的分子标记,这些标记可能有助于提高植物的构型和光合能力;(5)预测有价值qtl的潜在候选基因。结果表明,多个基因座可作为大豆光合效率和产量相关性状遗传改良的有效工具。
结果
叶叶相关的特征和叶绿素含量显示出三种大豆群体的显着表型变异
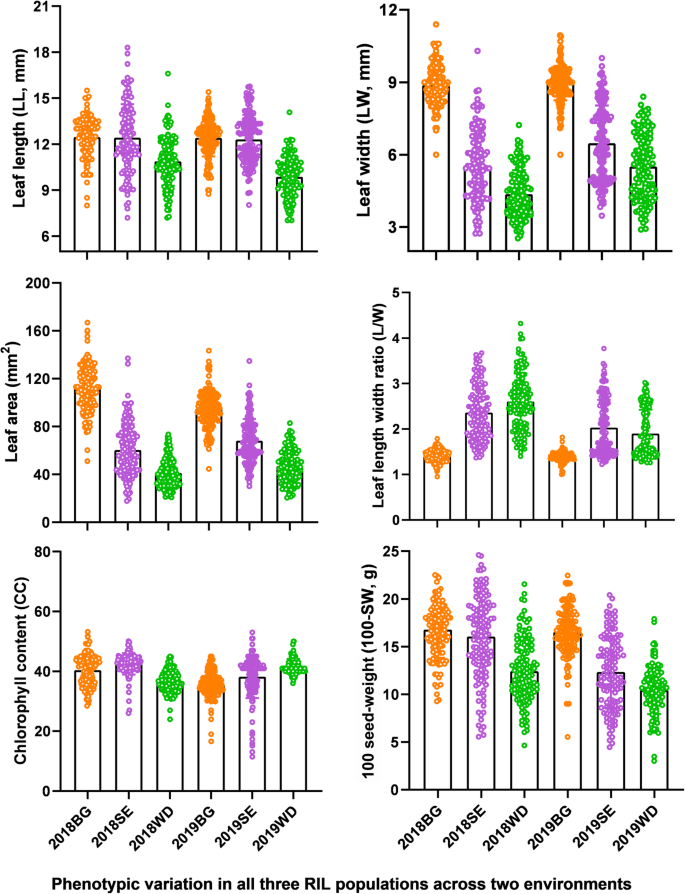
测量总共六个参数,LL,LW,LA,L / W,CC和100-SW,以确定三个RIL测绘的集合中的叶子尺寸,形状,光合容量和产量相关性状潜力的变化种群在两个环境中生长(图。1、表1).除LW和LA无显著差异的南农94 - 156和博高外,亲本各性状均存在显著差异(表S1).此外,在所有三个RIL群体中,所有6个性状均存在广泛的越位分离,部分后代品系表现出优于亲本的表型值(fig .;1和2图。S.1和表年代1).后代株系表型值范围为:LL 7.86 ~ 13.43 cm, LW 3.83 ~ 9.13 cm, 24.32 ~ 92.49 cm2对于洛杉矶(表S.1).rils的平均cc值范围为7.19-53.23,平均100-sw值范围为3.02-28.44 mg。在不同的大豆线中,最高L / W的比例为3.04;然而,一个大豆ril的比例仅为1.36(表S1).总体而言,大豆株系在叶片大小、形状和叶绿素等性状上表现出相当大的自然变异,并表现出很高的遗传多样性。越界观察表明,叶片相关性状和CC具有多基因遗传,双亲均对性状等位基因的增加和减少有贡献。在RIL系中,所有6个性状在每个个体群体中均存在显著差异(P< 0.01)。此外,我们观察到所有群体和性状在年内和年内的显著基因型和环境效应。所有性状的广义遗传力均为中高,范围为0.59 ~ 0.89,其中L/W遗传力最高(h2 = 0.81–0.89) across all populations (Table S1).
叶片相关和叶绿素性状的表型结构
使用简单的线性相关系数(Pearson相关性)的六个性状的成对分析表明,最多的叶子相关的性状,CC和100-SW显着相关(P < 0.05 or 0.01) with each other in all three RIL populations and in both years (Table S2).说明叶片相关性状和CC可能是影响大豆产量相关性状的重要因素。LL、LW、LA均与100-SW呈正相关,相关性最强(r = 0.23–0.34) identified between LL and 100-SW, suggesting that soybean yield related traits was most affected by LL. In addition, the leaf-related traits were also inter-correlated to various degrees. For example, LA was highly positively correlated (r ≥ 0.86,P < 0.01) with LW and moderately correlated with LL (r ≥ 0.37,P < 0.01) in all three populations and in both years, suggesting that LA is mainly determined by LW. Interestingly, LW was significantly negatively correlated with L/W, which had a very weak correlation or no significant with either CC and 100-SW (Table S2).这些结果表明,叶片长径比主要反映叶片形状,与CC、100-SW、光合作用和产量无关。综上所述,相关分析结果表明,LL对CC和100-SW有正向影响。
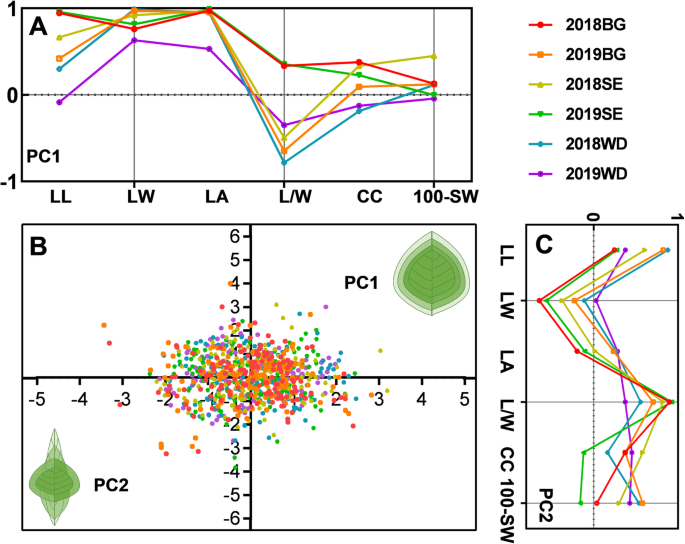
分析每个RIL群体和整个群体表型变异的主要来源(表S3.),我们进行了主成分分析(PCA),同时考虑到各种表型性状之间的复杂的相互关系。In the present study, only variables with loading values > 0.4 were considered important. Two significant principal components (PCs), including PC1 and PC2 were extracted for each RIL population, and these PCs capture 71.3 to 75.8% of the phenotypic variation across three populations (Table S3.).PC1和PC2显示在所有三个作图群体相似的结构;PC1(44.7至46.5%)和PC2(26.4至29.3%)主要是占叶大小(LW,LA和LL)和叶形状(LL,L / W),分别为(图的变化。3.a和c)。因此,PC1主要解释了叶片尺寸的差异,并且沿长度和宽度轴的比例的增加与La和100-v的增加呈正相关(图。3.B)。相比之下,PC2主要捕捉叶片形状的差异(图2)。3.C),其中L/W比和LL是主要的解释因素。有趣的是,PC1和PC2也捕获了CC和100-SW的部分变异(图。3.a和c)。总体而言,叶相关性状与产量相关性状CC的密切关系,表型是由PCA三个RIL群体捕获,表明这些性状是复杂的,相互关联的遗传成分的控制下。
遗传结构的变异与表型变异的变化一致
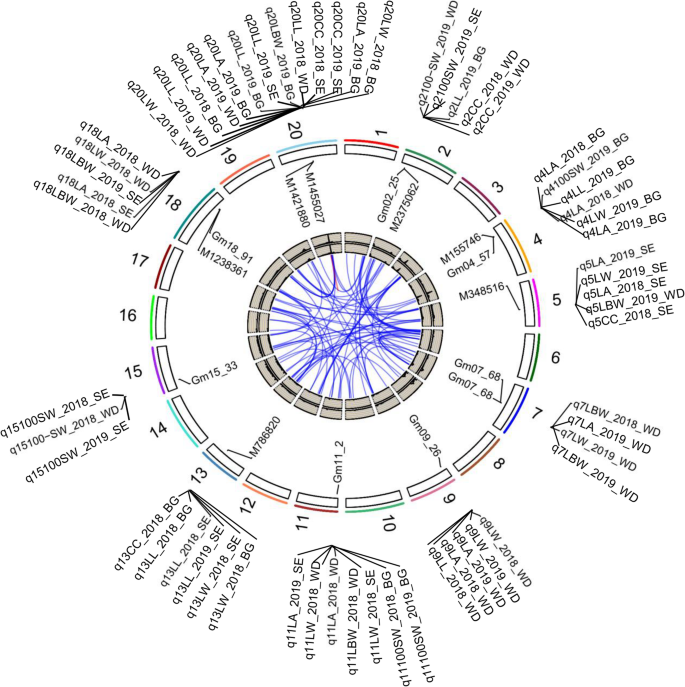
给出叶片大小、形状、CC和100-SW参数的表型模型(表S2,无花果。3.),我们推测这些性状可以依赖性不同遗传元件的控制之下被继承。为了检验这一假设,我们使用叶片相关性状,CC和100 SW在跨两个不同的环境三个RIL群体中的数据进行QTL分析。高密度遗传图谱对每个群体使用;these maps were constructed using 6159 SNPs for N × B [12S × E的5660个箱型标记,W × D的2015个箱型标记。与观察到的广泛海侵分离相一致(图。1和2图。S.1),叶片性状在RIL群体中定量遗传。通过性状、环境(年)和定位群体共鉴定出96个QTL (W × D 40个,N × B 32个,S × E 26个)。4、表2和表年代4).每个qtl的LOD值在2.0 ~ 22.6之间,解释了5.6 ~ 42.4%的表型变异。总体而言,近1 / 3的qtl是多效性的,影响叶片相关性状和CC,与这些被测性状之间的密切相关性一致(表1)2).例如,QTLQ20同时控制叶的大小,形状和CC跨越人口和环境(表2,无花果。4).同时,我们还观察到一些qtl具有群体特异性或环境特异性,这表明潜在的变异可能只存在于特定的群体中,也可能对环境敏感。例如,在W × D RIL群体中,15条染色体上共鉴定出40个qtl,涉及所有选择性状(表S4).40个qtl中,22个仅在2018年检测到,18个仅在2019年检测到(图1)。4、表2和表格4).百分比表型变异通过这些QTL从2.74%范围解释(q5L / W4_2019_WD)至42.44%(Q20L / W4_2019_WD)LOD值范围从2.11到22.59。
与叶片相关性状和叶绿素含量相关的主要和共定位位点测定
以前的研究报告称,间隔小于或大约5mb的lead SNPs被认为是由影响性状的单个位点引起的[13].根据该标准,将96个qtl分为25个位点2和表年代4),几乎所有的被认为是多效性,这与表型性状的显著相关性一致。此外,我们发现,在一个性状的广义遗传非常高(例如,L / W),一些主效QTL(如的时候和Q20)在所有特定的人群中都很常见(图。4、表2和表年代4).对25个位点的进一步分析表明,其中6个位点可以在不同性状、年份或群体之间重复识别(超过5次)。然后是六个基因座,q1 - 1, q4-2, q11-1, q13, q18,Q20,被认为是主效或稳定的qtl(图。4、表2和表年代4).
6个主要qtl分布在第4、11、13、18和20染色体上2),平均LOD评分为5.96,可解释约13.16%的表型变异(表2,表S.5).此外,比较分析表明,3个qtl (的事情,的时候,Q20)与之前通过全基因组关联研究(GWAS)在自然群体中鉴定的叶相关qtl共定位[14,15].值得注意的是,本研究通过连锁作图,在性状、年份和群体中分别鉴定了这3个位点,表明这些位点可能在大豆叶片相关性状、CC甚至产量中发挥重要作用。在三个位点中,Q20是包含与所有叶子相关特征(LL,LW,LA和L / W)和CC相关联的21个QTL的QTL群集是多年或人口的CC。该基因座的LOD评分平均为9.27(图。4、表2和表格4),平均可解释19.74%的表型变异。此外,Q20和Ln轨迹(Gm-JAG1),是一种重要的单张形状调节器[16].
有趣的是,另外两个主要的qtl,的事情和的时候,均与LW、LA和L/W在不同年份和种群中相关,与前面提到的LA和L/W与LW高度相关的相关分析结果一致。进一步对这两个qtl进行分析发现,L/ w相关位点在2年和群体中表现出正加性效应,而LW-和la相关位点表现出负加性效应,这与表型性状之间正负相关一致。因此,qtl如的事情,的时候,和Q20具有高LOD值并解释了高比例的表型变异,可以是有助于叶相关性状和CC的关键QTL热点。
另外三个基因座(q4-1 q4-2,和问题),是控制大豆叶片相关性状和CC的新位点。问题后,用LL,LW和CC跨越年和人群相关联,提示LL,LW和CC可以通过在大豆中共同基因来控制。该位点的LOD为5.52的平均值,和问题可以解释的表型变异的5.61-25.17%(表S =4).有趣的是,我们发现了两个新的主要基因座,Q4-1和q4-2,均与叶片相关性状、CC和产量相关性状连锁,说明这两个位点可能对大豆的光合作用甚至产量有重要影响。更重要的是,所有有价值的QTL等位基因Q4-1和q4-2分别来自父本(DN50,绥农14,和博高)具有较大LL或L / W比率。这些结果表明,Q4-1和q4-2可有效应用于大豆育种,提高大豆的光合能力和产量。这些结果表明,利用高密度遗传图谱对多个群体进行QTL定位是在全基因组范围内鉴定主要稳定QTL的有效手段。
叶叶相关性状的认证QTL,叶绿素含量和100种种子重量
叶片相关性状、CC和100-SW为复杂性状,不同qtl之间可能存在上位性效应。在25个位点中,10个位点仅在1个作图群体中被检测到,5个位点仅在1个环境中被检测到,表明这些qtl可能与环境互作。因此,除了qtl的加性效应外,本研究还鉴定了6个性状qtl的上位性效应。结果表明,在不同群体中,20条染色体上共74对qtl (LOD > 4.0)之间存在上位性相互作用。这些qtl对2.22 ~ 19.25%(图2)。4,表S.5)表型变异。在W×D中有21对,在N×B中的29对,S×E中的24对被横跨特征,年和映射群体识别。在位于不同染色体的QTL之间检测到有13对磷酸钙肌科QTL,例如1和6,3和12,以及5和18和18,跨越特征,年份和群体。
候选基因预测和基因本体(GO)富集分析
为了确定影响每个性状的候选基因,我们调查了6个有希望的基因组区域(q1 - 1, q4-2, q11-1, q13, q18,Q20),基于大豆参考基因组注释W82.a2.v1,哪个更大r2跨环境稳定表达的值和LOD分数(表2).共鉴定出60、98、128、56、23和401个注释基因Q4-1,q4-2,Q11-1,问题,的时候,Q20分别。(表S =6).基因本体(Gene ontology, GO)富集分析表明,富集GO的主要条件为细胞过程、蛋白质代谢过程、蛋白质修饰过程、大分子修饰、核苷结合、脂质结合、ATP结合、磷酸化、磷酸盐代谢过程、苹果酸转运、c4 -二羧酸转运、色素生物合成过程、氧化还原酶活性、激酶活性、转移酶活性和甲基化(表S7).
为了进一步探索特异性性状的候选基因,我们在6个主要位点上重点研究了与LL、LW、光合作用和产量相关的基因。例如,Q20轨迹,它坐落在一个地区大约4.6 mb和以前发现叶子形状特征使用GWAS(方et al . 2017),包含几个预测基因编码蛋白可能参与调节叶片大小和形状和光合代谢过程:狭窄的传单(Glyma.20G116200), WUSCHEL相关homeobox 13 (glyma.20G099400.)、光致反应NPH3家族蛋白(glyma.20g133100.)、光系统I亚基D-2 (Glyma.20G144700),在内膜的叶绿体(Glyma.20G129100),叶绿体生物合成酶(Glyma.20G142000),以及叶绿素A-B结合蛋白家族(Glyma.20G150600).以前。
在这些上述基因,Glyma.20G116200已被报道为大豆小叶形状和每荚种子数的关键调节因子[16),glyma.20G099400.基于转录组分析,与叶涛相比,在窄叶和高光效基因型Nanong94-156的叶子中显着上调(5.7倍)[17].染色体4上的另一个新位点,Q4-1CC和100-SW被定位在一个约4.0 mb的基因组区域。有98个注释基因(表S6),其中一个编码光系统II反应中心蛋白D (glyma.04g095000.)和一个编码光系统I亚基G(Glyma.04G112800).主要轨迹,q4-2在4号染色体上约3.5 mb的基因组区域中,发现了与叶相关性状相关的染色体。该区域包含128个注释基因(表S7),其中两种编码纤维素合酶6 (Glyma.04G173700),以及捕光叶绿素 - 蛋白复合物(Glyma.04G167900).
讨论
作物的生长和产量取决于光合作用,而光合作用又在很大程度上受到叶片相关性状和CC的影响[4].而叶片性状和光合相关性状都是典型的复杂数量性状,容易受到环境的影响,可能具有上位性效应。因此,叶相关性状与CC的遗传基础尚不完整,特别是这些性状之间的遗传关系研究不足。以往的研究大多集中于单个作图群体中个体性状的离散分析,对复杂数量性状遗传结构的综合分析能力有限[18,19].另一个限制可能是单双亲作图群体只能揭示部分性状的遗传结构,从而阻碍了对特定有利等位基因的挖掘[20.,21].一种有效方法是将不同的指标(相关分析,主成分分析和遗传分析集成到低维框架中,以鉴定叶子相关性状和CC之间的表型关系[22].除了这种方法之外,通过用更广泛的遗传变异样本分析多个群体,可以提高对分离定量性状的遗传结构的功率。
在这项研究中,我们使用这种方法来描述叶绿素和叶片相关性状的遗传基础以及它们在大豆之间的关系。我们选择了三种代表性的RIL群体,其在遗传图中具有高密度分子标记,为目标QTL和基于地图的克隆的微映射提供了保证。表型分析表明,六个父母及其衍生的群体表现出高水平的遗传多样性和在现场生长时叶相关性状,CC和100-SW的显着遗传变异(图。1,表S.1).例如,LL(范围从7.03至18.30 mm)、LW(2.53至11.40 mm)、LA(17.69至166.76 mm)存在广泛的差异2在三个RIL人口中,CC(7.19至53.23)(表S1).RIL群体中复杂数量性状的表型变异较大,确保了对这些性状遗传结构的有效剖析和主要稳定基因组区域的确定。叶片相关性状之间高度相关,与CC之间中度相关,说明控制这些性状的功能基因可能具有一定程度的密切相关或多效性。此外,在三个RIL群体中,叶片相关性状和CC与产量相关性状的表型关系密切,表明这些性状受复杂且相互关联的遗传成分控制(图1)。3.和表年代3.).
在这项研究中,的QTL之间的重叠进一步支持叶相关性状和CC之间的图密切的亲缘关系(。4、表2和表格4).我们发现即使在分别分析不同的特征时,叶叶相关性状和CC的QTL也经常在不同的RIL群体中共同地定位,这表明常见的遗传成分是观察到的表型变异的基础。与CC QTLS重叠的相当大比例的叶子相关QTL(40%,10个座位)(表2和表年代4),包括两个性状的4个主要QTL群(图。4).值得注意的是,叶片相关性状QTL与CC之间的关系可能与多效基因的控制有关。综上所述,显著的表型相关性和共定位qtl的鉴定为叶片相关性状与CC之间的密切遗传关系提供了证据。此外,考虑到叶绿素可能受植物成熟度的影响,我们将这些QTL与其他研究中成熟日期的主要基因/QTL进行了定位比较。我们发现了几个与成熟度相关的qtl,如生殖期4-G5,生育期4-G9与CC qtl共定位(表S4),提示CC可能与到期日有关。事实上,我们之前的实验结果也证明了这一点,所以我们在本研究中选择了R6的叶绿素含量,主要是因为我们发现R6的叶绿素对产量的影响更大。
早在20世纪60年代,人们就认为理想的小麦具有小而直立的叶子[23].在大豆,已经报道了密植条件下,长和小叶子下捕获更多的光的能量比圆叶,它的人口是光能利用率有益[24].但是目前,理想的植物结构为光能利用的基本遗传机制尚不清楚。In our study, favorable alleles responsible for most overlapping QTLs came from the male parents, Dongnong50 (DN50), Suinong 14 and Nannong 94–156 (NN94156), which had larger L/W ratios (~ 3.0) than the female parents (~ 1.5). Interestingly, we found that parents with larger L/W ratios tended to have higher CC (Table S1).此外,QTL分析显示,对CC和100-SW产生正加性效应的等位基因大部分也来自父本(表S4).这些结果可能为理想的大豆植株构型要求叶片呈直线型且较小,更有利于通风和透光的尖叶提供了遗传基础。选择LL或L/W比值较大的基因型可能是改善大豆植株构型、光合效率甚至产量的潜在途径。
植物的生长发育是一个非常复杂的过程,这是由基因型,环境以及它们之间的相互作用[影响25].As an important factor affecting phenotype, QTL × environment interaction may explain one of the reasons why QTLs can not be identified stably in different environments [26,27].此前,许多研究表明了大豆遗传和环境因素控制了复杂的定量性状[19,28,29].在本研究中,表型值在基因型、年份和群体间存在显著差异,说明叶片相关性状和CC均受到潜在基因、环境和不同遗传背景的影响(表S1).根据我们的期望,只在一个映射群体中检测到10个QTL,只在一个环境中检测到五个QTL,表明叶叶相关性状和CC的遗传基础受环境的影响部分(图。4、表2和表年代4).此结果与报告相似,即叶状性状和环境之间存在互动[18].此外,qtl在群体间分布的差异表明,通过分析多个群体确定背景效应是分析遗传结构的关键。
数量性状遗传结构的另一个重要贡献因素是上位性,有报道称上位性在控制玉米LA中发挥重要作用[30.].本研究共检测到6个性状的74个additive×additive上位性相互作用。这些上位性qtl的表型贡献率平均为9.83%,范围为2.22 ~ 19.25%(图2)。4,表S.5),表明上位性在大豆叶片相关性状和CC的遗传中可能发挥了相当大的作用。与其他研究相比,本研究发现了更多的上位性qtl,这可能是因为遗传分析是基于高密度遗传图谱和多环境多群体的遗传分析。
在本研究中,几乎所有染色体上都鉴定出了qtl,但4、11、13、18和20号染色体上的qtl对叶片相关性状和CC的影响最大且最一致(见表)2和图。4).此外,叶相关性状和CC的主效QTL进行共定位(Q4-1,Q4-1,Q13和Q20)或具体的(的事情和的时候)(表2和图。4).例如,主效QTL,Q20,共定位于之前发现的与LL、LW、LA、叶形和结荚相关的基因座[14],植物身高[31]和分支号[32]、用水效率[33],拍摄磷含量[34,表明该区域存在的重要基因可能参与调控大豆植株结构甚至产量。更重要的是,我们还发现Q20硝唑与Ln,是大豆叶片形状的关键调节因子[19].为了进一步分析之间的关系Ln基因和叶片相关性状在本研究中进行了部分单标记分析Lnlocus by using investigating the association of all the molecular markers (45 SNPs) distributed in the range of within 1 Mb upstream and downstream ofLn具有叶片相关性状的基因座,包括叶宽(LW),叶片长度(LL)和叶面积(LA)和叶绿素含量(CC)。结果表明,与之相邻的标记Ln基因显著相关(p< 10−5)与叶片相关性状(特别是LW),强烈提示Ln可能是主要QTL的候选人,Q20.此外,我们还发现在的编码区的单核苷酸取代(G / C)Gm-JAG1基因而导致单个氨基酸的改变基于所述测序数据。这种等位基因变异是对应于叶型母体,包括G型为W82,エンレイ和博高,C型为DN50,SN14,和NN94-156。
有趣的是,我们发现了Q20在多年来,在S×E人群中控制叶叶相关的特征和CC;我们是第一项研究,发现有与此基因座中的光合作用有关的QTL。此外,编码WUSCHEL相关Homeobox 13的推定基因(glyma.20G099400.)被认为是该地区可能的候选者,因为它通常被认为是叶片形状和叶片发育的关键,如叶拟南芥[35)、大米(36,37],Medicago[38和杜鹃花[39].Futhermore,我们之前的表达分析表明表达了glyma.20G099400.在窄叶和高光效率母体基因型(N)的基础上显着高于转录组分析(张等人。2017)。表达水平glyma.20G099400.在南农94 - 156中显著增加,说明可能参与了叶片发育和光合作用。因此,glyma.20G099400.被认为参与了两个特征的调节,这是值得进一步的实验验证。
一种新的QTL,q4-2,被定位于两个叶相关性状和CC染色体4检测,这表明该QTL是多效,进一步证明叶相关性状和CC之间的关联的生理。一个有前途的假定基因(Glyma.04G173700)基础q4-2,编码纤维素合成酶,已经被先前确定在叶发展水稻中发挥重要作用[40,41.],玉米[42.]和花椰菜[43.].此外,我们还在该基因区和其他主要QTL区发现了几个预测基因,包括编码光合响应NPH3家族蛋白、光系统I亚基D-2、叶绿体内膜转位子、叶绿体生物合成酶和叶绿素a - b结合家族蛋白的基因。可能参与了叶片发育和光合代谢过程(表S6).
结论
综上所述,尽管叶片相关性状和CC的复杂性较高,但控制这两个性状的主要qtl之间存在密切的遗传关系。这些结果为更好地理解叶片相关性状和CC的遗传基础提供了新的视角,可用于构建具有理想植株构型和高效光合作用的大豆基因型。这些主要的位点,Q4-1,q4-2,的事情,问题的时候和Q20其候选基因或与这些qtl紧密相连的SNP标记可进一步用于分子育种(遗传工程育种、分子标记辅助选择育种)。综上所述,本研究同时利用叶片相关性状和CC数据,深入研究了多种环境和大豆群体中植物构型和光合作用之间的遗传关系。
方法
植物材料
具有独特叶片形状的三个RIL群体用于识别控制叶相关性状和CC的QTLS(表1).The first segregating population consisted of 152 F12 - 13父本南农94 - 156 (N × B)组合衍生的品系[44.],其具有相对狭窄,长的叶子和短的间隙,以及圆形,短的叶子和更长的节间的Bogao(女父母)(n×b)。父母线在我们之前的研究中表现出与光合相关性状的特性和植物高度的显着变化[13].第二组RIL包括127名F11 - 12采用单种子亲本法,由母本东农50与父本Williams82杂交(D × W)获得[45.].Dongnong50是一种从加拿大引入的小叶片品种,叶片尺寸和植物高于威廉姆斯82的小叶片。第三个群体由154岁组成12 - 13来自Suinong14×EnRei之间的十字架(S×e)的线条[45.].穗农14是生长在中国北方的早熟春大豆品种,叶片窄,叶绿素含量高,而恩瑞是日本最常见的宽叶品种之一。6个亲本的基因组均已测序,为QTL区域内的候选基因挖掘奠定了基础。
田间试验
所有三个人口以及父母在中国的两种环境中都在实地试验中进行了评估。2018年河南省郑州的毛泽和实验站和2019年河南省叶阳的毛泽东实验站生长了N×B人口;D×W和S×e种群在2018年和2019年河南的Yuanyang中生长在2018年和2019年的裁剪季节。在现场试验中采用具有三个重复的随机块设计,每条线以三排种植,具有200厘米的行长,行间距为60厘米。根据每个地点的当地海关进行农艺管理。
表型测量
从中间行选取5株作为样本,分别测定每个小区的LL、LW、LA、L/W、CC和100-SW。根据我们之前对不同发育阶段控制叶绿素含量的qtl的研究结果(Cui和Yu 2007),我们发现CC在种子完全生殖生长阶段(R6)对产量的影响更大,因此我们在本研究中测定了R6叶片相关性状和CC。在R6期,每3个重复5个株系的上3个叶片用于表型分析。简单地说,在上午9点到11点(CCM-200, OptiSciences, Inc., USA)用叶绿素仪测量了叶绿素含量。然后立即采集叶片样品,在4°C下保存,直到使用STD 4800扫描仪(日本爱普生)测量叶片相关性状(LL、LW、LA和L/W)。基于MATLAB 2013a的图像分析软件LEAFAREAS2.0 (http://pan.baidu.,得到LL、LW、LA和L/W的表型值。所有长度都以厘米为单位报告。100- sw是通过计数和称重每个样本中的100个种子来确定的,以克为单位。
高密度遗传地图
在本研究中,Zhang et al.(2016)报道了N × B种群的高密度连锁图谱。该连锁图谱包含6159个SNP标记,相邻标记间的平均距离为0.49 cM [12].广州大学都提供了另外两个人口(D×W和S×e)的联系地图;通过测序方法使用基因分型构建这些遗传图谱,并分别包含2015和5660箱标记物。简而言之,对于这两个连杆地图,我们使用ICIMAPPAPPT v4.0软件[15]将SNP标记放置在没有重组的情况下;接下来,UE joinmap 4.0 [46.]将帧标记按LOD阈值≥7分为每组;最后,使用MapDisto 1.7 [47.]对框架标记进行排序,计算遗传距离;最后,基于SoyBase (https://www.soybase.org/).
统计分析
通过使用SPSS统计信息的一般线性模型(GLM)程序17.0(SPSS,Inc.,芝加哥,IL,USA),通过使用SPSS统计程序的一般线性模型(GLM)程序来进行差异分析(ANOVA)。将基因型(g)作为固定处理,年份地点的组合被认为是环境(e),并且基因型 - 环境(g×e)相互作用被视为随机处理。通过使用SPSS 17.0基于平均值计算这些特征的Pearson相关系数,并使用R包进一步可视化。GraphPad Prism 7.0用于创建频率分布图。广泛的感觉秘度(h2)用h2= Vg/ (Vg + Ve)。Vg和Ve分别表示遗传变异(从方差分析结果中提取)和环境变异。
QTL鉴定和比较
添加剂和上位性QTL为叶相关-性状和CC是由QTL IciMapping程序4.0版使用在不同环境单个环境表型值进行鉴定[48.].复合区间作图(ICIM)和ICIM-EPI法的参数设置被描述为以前的报告〔16].简单地说,用ICIM方法对加性QTL进行了定位P输入变量(PIN)和移除变量(POUT)的值分别设为0.01和0.02,扫描步长为2 cM。根据LOD评分超过预定义阈值2.5的峰值估计位置。采用ICIM-EPI法检测上位性QTL, PIN和POUT分别设置在0.0001和0.0002,扫描步长为5 cM。并估算了每个加性QTL或上位性QTL解释的表型方差(PVE)及其加性效应。
为了更好地揭示叶片相关性状和叶绿素的遗传机制,基于物理位置的不同群体比较了相同性状的物理位置QTL。G. Max.参考基因组(WM82.A2.v1)。QTL的分类主要遵循以下两个规则:1)跨环境和人群检测到一个特征的QTL(LOD轮廓峰值小于5cm)的距离被认为是相同的;2)QTL可以在多年来识别超过五次,特征或人群被认为是主要和稳定的。
候选基因发现和基因本体(GO)富集分析
在目标区域QTL,首先,候选基因进行了预测基于所述大豆参照基因组的在第12节Phytozome注释(https:////phytozome.jgi.doe.gov.).然后功能候选基因的注释被BLASTP功能手动NCBI比较。最后,我们在网上进行基因本体(GO)富集分析(http://bioinfo.cau.educn/agriGO/分析。php)。
数据和材料的可用性
支持本研究结论的数据在论文和。
它的附加文件。
缩写
- W × D:
-
Williams82×Dongnong50
- S×E:
-
S.uinong14 × Enrei
- N×B:
-
nannong94 - 156×Bogao
- LL:
-
叶片长度
- LW:
-
叶宽度
- 拉:
-
叶面积
- L / W:
-
叶长度和宽度之比
- CC:
-
叶绿素含量
- 100 - sw:
-
100年种子重量
- 瑞来斯:
-
重组自交系
- 旅客:
-
基因型
- 艾凡:
-
环境
- G×E:
-
基因型的环境
- Anova:
-
方差分析
- 全球语言监测机构:
-
一般线性模型
- h2:
-
广义遗传
- QTL:
-
数量性状位点
- LOD:
-
赔率查查
- ICIM:
-
包含复合区间映射
- ICIM-EPI:
-
包容复合区间映射上位性
- SNP:
-
单核苷酸多态性
- 主成分分析:
-
主成分分析
- GWAS:
-
基因组协会研究
- 走:
-
基因本体论
参考资料
- 1.
Sarlikioti V, de Visser PHB, Buck-Sorlin GH, Marcelis LFM。植物结构如何影响番茄的光吸收和光合作用:使用功能-结构植物模型走向植物结构的理想类型。安机器人。2011;108:1065 - 73。
- 2.
Thompson JA, Nelson RL, Schweitzer LE。大豆比叶重、光合速率与种子产量的关系。作物科学。1995;35:1575 - 81。
- 3.
Ma Bl,Morrison MJ,Voldeng HD。大豆的叶子绿色和光合速率。农作物科学。1995年; 35:1411-4。
- 4.
黄志刚,李志刚,李志刚,等。大豆叶绿素缺乏突变体叶片和冠层光合作用的研究进展。植物学报2018;41:1427-37。
- 5。
Curran PJ,Windham WR,Gholz HL。思路落叶叶片叶片反射红边和叶绿素浓度的关系。树生理。1995年; 15:33-48。
- 6。
Todeschini MH,Milioli AS,罗莎交流,Dallacorte LV,Panho MC,侯爵JA,在巴西南部贝宁G.大豆的遗传进展:生理,物候和农艺性状。Euphytica。2019; 215:12。
- 7。
水稻叶绿素含量及其与叶片光合作用的关系。大米。2010;3:172 - 80。
- 8。
侯建军,田芳,张涛,黄明霞。基于遥感影像的大豆繁殖期冠层温度下降、蒸腾和冠层绿度对产量的影响。农业水资源管理。2019;222:182-92。
- 9。
刘旭,刘丽丽,肖艳华,刘淑娟,田玉玲,陈利明,王志强,姜玲,赵志刚,万建明。利用156个染色体片段代换系对叶片相关性状的遗传分析。acta botanica yunnanica(云南植物研究). 2015;
- 10.
Quarrie S,Pekic QSR,Rancic D,Kaminska A,Barnes JD,Leverington M,Ceoloni C,Dodig D.将小麦QTL解剖到一系列环境中存在的产量:从QTL到候选基因。J Exp Bot。2006; 57:2627-37。
- 11.
贾浩,万洪,杨树华,张志强,孔志强,薛胜,张磊,马志强。中国小麦关键亲本重组自交系群体产量相关性状的遗传分析。理论应用遗传学。2013;126:2123-39。
- 12.
张D,李H,王J,张H,Hu Z,Chu S,LV H,Yu D.高密度遗传映射识别大豆低磷胁迫的新主要基因座。前植物SCI。2016; 7:372。
- 13.
利用高密度遗传图谱分析大豆磷效率与光合特性的QTL关系。植物科学学报,2016;
- 14。
方C,马YM,吴西南,刘Z,王Z,杨R,胡锦涛GH,周ZK, Yu H,张M,潘Y,周GA,任HX, Du,严小时,王YP,韩寒DZ,沈欧美,刘SL,刘TF,张JX,秦H,元J,元XH,香港FJ,刘BH,李司法院,张ZW,王GD,朱BG,田ZX。全基因组关联研究剖析了大豆农艺性状的遗传网络。基因组生物学。2017;18:161。
- 15.
黄志强,王志强,王志强,等。大豆叶片性状QTL的鉴定。植物品种。2014;133:61-6。
- 16。
郑N,徐世杰,金M-H,李S,文J-K,金HS,郑S c。Ln是大豆叶片形状和荚果种子数的关键调节因子。植物细胞。2012;24:4807-18。
- 17。
Zhang D, Zhang H, Chu S, Li H, Chi Y, Li H, lu H, Yu D. QTL定位和转录组学鉴定与大豆耐低磷相关的QTL候选基因。acta botanica sinica, 2017; 54(3): 493 - 497。
- 18。
崔涛,胡坤辉,陈立国,张兴华,谢继泉,李建超。玉米叶片面积的QTL定位玉米l .)在多环境下。J integrated Agric. 2017; 16:800-8。
- 19。
王我,程y,ma q,mu y,huang z,xia q,张g,qtl细映射大豆(大豆两个ril居群的叶型相关性状。Bmc基因组学。2019;20:260。
- 20.
利用多亲本定位群体对大麦芒长QTL进行精细定位。理论应用遗传学。2017;130:269-81。
- 21.
Cavanagh C,Morell M,Mackay I,Powell W.从突变到魔法:在作物植物中的基因发现,验证和交付的资源。CurrOp植物BIOL。2008; 11:215-21。
- 22.
Gegas VC, Nazari A, Griffiths S, Simmonds J, Fish L, Orford S, Sayers L, Doonan JH, Snape JW。小麦粒度和形状变异的遗传框架。植物细胞。2010;22:1046-56。
- 23.
唐纳德厘米。作物情色的繁殖。Euphytica。1968年; 17:385-403。
- 24.
J.荣文,。,M.S.Akkaya,A.A.巴格瓦特,U.幼狮,。,P.B.Cregan,使用微卫星标记大豆基因型鉴定,理论应用遗传学,90(1995)43-48中。
- 25.
埃尔 - 纯碱男,Malosetti男,Zwaan酒店BJ,Koornneef男,AARTS MG。Genotypexenvironment互动QTL定位植物:从教训拟南芥.趋势植物SCI。2014; 19:390-8。
- 26。
Boer MP, Deanne W, Lizhi F, Podlich DW, Lang L, Mark C, Eeuwijk FA。Van,一个混合模型数量性状位点分析(QTL)的多环境试验数据使用环境协变量的QTL与环境的互作,以玉米为例。遗传学。2007;177:1801-13。
- 27。
Veldboom LR,在应力和无负荷的环境中qunatitative性状基因座在玉米李M.遗传apping:II。株高和开花。农作物科学。1996; 36:1320-7。
- 28。
张D,张清,胡ZB,楚ss,yu ky,lv ll,杨ym,张xq,陈x,kan gz,唐y,yqcrl,yu dy。Gmoleo1的人工选择有助于大豆驯化过程中种子油的增加。Plos Gen. 2019; 15:E1008267。
- 29。
关键词:大豆,低磷胁迫,酸性磷酸酶编码基因,GmACP1公共科学图书馆将军2014;10:e1004061。
- 30.
玉米株高和单株叶面积的上位性检测(玉米L.)从产生装置分析。Maydica。2010; 55:33-9。
- 31.
张军,宋强,Cregan PB, Nelson RL,王鑫,吴军,姜光良。早熟大豆开花时间、成熟期和株高的全基因组关联研究(大豆)种质。BMC基因组学。2015; 16:217。
- 32.
张H,Hao D,Sitoe HM,Yin Z,Hu Z,张G,Yu DJPB。多种环境结合分析遗传解剖植物结构与大豆(甘氨酸MAX)中产量分性的关系。植物品种。2015; 134:564-72。
- 33.
利用ssr分子标记分析大豆水分利用效率的变化。环境科学学报。2015;36:1011-6。
- 34.
Dhanapal AP,雷JD,JR史密斯,赛尔LC,Fritschi FB。大豆芽组织的宏观和微量营养素的浓度相关联的新型基因组基因座的鉴定。植物基因组。2018; 11(2):170066。
- 35.
王军,田春华,张超,史波林,曹晓伟,张天奇,赵智,王建伟,焦玉玲。细胞分裂素信号在腋生分生组织启动过程中激活WUSCHEL的表达。植物细胞。2017;29:1373 - 87。
- 36.
吴超,付亚平,胡国光,司红梅,程胜,刘文忠。水稻狭叶卷叶突变体的分离与鉴定。足底。2010;232:313-24。
- 37.
町S-H,柳S-C,张H,潘德亚d,酸值H-Ĵ,黄J-Y,金G-T,白南舜N-C。水稻窄leaf2和缩小leaf3基因座编码WUSCHEL相关同源框3A(OsWOX3A)和功能在叶,穗,分蘖和侧根发育。新植物。2013; 198:一○七一年至1084年。
- 38.
孟Y, Liu H, Wang H, Liu Y, Zhu B, Wang Z, Hou Y, Zhang P, Wen J, Yang H, myore KS, Chen J, Tadege M, Niu L, Lin H. HEADLESS,一个WUSCHEL同源物,揭示了Medicago truncatula茎分生组织调控和叶片发育的新方面。J Exp Bot. 2019; 70:149-63。
- 39。
田崎K,中冢A,川KS的WUSCHEL相关同源框(WOX)基因在狭窄的花瓣和窄叶突变在日本传统的杜鹃花品种的介入小林N.遗传示范。Euphytica。2019; 215(1):5。
- 40。
丁ZQ,林ZF,李青,吴男,湘CY,王JF。DNL1,编码纤维素合酶像-D4,是在水稻植物的高度和叶宽一个主效QTL(奥雅萨苜蓿L.)。Biochem Biophysical res通信。2015; 457:133-40。
- 41。
Yoshikawa T, Eiguchi M, Hibara K-I, Ito J-I, Nagato Y. Rice SLENDER LEAF 1基因编码纤维素合成酶样D4,并在M期细胞中特异表达,调控细胞增殖。J Exp Bot. 2013; 64:2049-61。
- 42.
亨特CT,KIRIENKO DH,西尔维斯特AW,彼得GF,麦卡蒂DR,科赫KE。纤维素合酶样D1是不可或缺的正常细胞分裂,膨胀和在玉米叶的发育。植物理性。2012; 158:708-24。
- 43.
李爽,张丽,王勇,徐飞,刘敏,林鹏,任胜,马琳,郭亚东。纤维素合酶基因BoiCesA的敲除对花椰菜叶片结构、纤维素含量和耐盐性的影响。Sci众议员2017;7:41397。
- 44.
张东,程华,耿磊,阚刚,崔胜,孟Q,盖杰,于东。大豆苗期耐缺磷数量性状位点的检测。Euphytica。2009;167:313-22。
- 45.
孔林,卢树华,王勇,方超,王芳,南辉,苏涛,李飞,李昕,赵旭,袁旭,刘波,孔芳。基于新一代测序的大豆开花期和成熟期数量性状位点定位。植物学报。2018;9:995。
- 46.
利用计算机软件包构建遗传连锁图谱。植物j . 1993; 3:739-44。
- 47.
LORIEUX M. MapDisto:遗传连锁图谱的快速,高效的计算。mol品种。2012; 30:1231-5。
- 48.
孟L,李慧,张磊,王军。QTL IciMapping:构建双亲本群体遗传连锁图谱和数量性状位点定位的集成软件。作物j . 2015; 3:269 - 83。
致谢
不适用。
资金
国家自然科学基金项目(no . 32072088);河南省重点科技项目(no . 192102110023, no . 192102110024, no . 202102110005);河南省高校重点科研项目(no . 20A210017);河南农业大学科技创新基金(KJCX2019C02)。资助机构只提供实验费用和出版费用。然而,实验设计和数据收集和分析由贡献作者管理。
作者信息
从属关系
贡献
DZ,LDD和Kyy构思和设计了实验;Kyy,Ymy和Cys进行了样本的正式识别;XQL HQX执行了现场试验。JSW Kyy分析了数据并进行了QTL映射;JSW LDD贡献了材料和分析工具;Kyy和Dz写了这篇论文。所有作者均阅读并批准最终手稿。
相应的作者
道德声明
伦理批准和同意参与
我们遵守《濒危野生动植物种贸易公约》。
同意出版
不适用。
相互竞争的利益
提交人声明他们没有竞争利益。
附加信息
出版商的注意事项
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
补充信息
附加文件1:图S1。
跨环境六种特征的表型分布。BG,SE和WD表示相应环境中的映射填充。
附加文件2:表S1。
亲本系和三个RIL作图群体的性状变异和遗传力.表S2。不同年份和三个作图群体中所有被调查的ril特征之间的皮尔逊相关系数(r).表S3。三个RIL映射群体的主要成分分析(PCA)。表S4。3个RIL群体历年所有调查性状的QTL检测结果总结。表S5。3个RIL群体研究性状的上位性QTL。表S6。在6个主要QTL区域预测与叶片相关性状和叶绿素含量相关的候选基因。表S7。基因本体论(GO)富含叶片相关性状和叶绿素含量相关的六个主要QTLREGoins的富集分析。
权利和权限
开放获取本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料都包含在本文的知识共享许可中,除非在该材料的信用额度中另有说明。如果资料不包括在文章的知识共享许可协议中,并且你的预期用途没有被法律规定允许或超过允许用途,你将需要直接从版权所有者获得许可。如欲查阅本许可证副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用这篇文章
于凯,王建军,孙传忠。et al。3个大豆RIL群体叶片相关性状和叶绿素含量的高密度QTL定位BMC植物BIOL.20.470(2020)。https://doi.org/10.1186/s12870-020-02684-x
收到了:
接受:
发表:
关键字
- 大豆
- 叶子相关特征
- 叶绿素含量
- 数量性状位点
- 亲缘关系