摘要
背景
尖孢镰刀菌F服务提供商。niveum(FON)引起西瓜枯萎病。为了防治西瓜枯萎病,已培育出几种抗病西瓜品种。然而,在这些西瓜品种中产生防御反应的关键代谢物尚不清楚。在此,我们分析了零(0)抗性(PI-296341、Calhoun灰和Charleston灰)和感病(糖宝贝)西瓜品种在感染前后叶组织中的激素、褪黑素、酚酸和氨基酸谱。
结果
我们发现茉莉酸 - 异氨酸(JA-ILE)和茉莉(JA-ILE)和茉莉酸甲酯(MEJA)在感染后在一个或多个学习的抗性品种中被选择性积累。然而,仅在接种后第16天的第16天在所有品种的FON 0接种植物中仅观察到吲哚-3-乙酸(IAA)。PI-296341的褪黑激素含量在感染时降低。相反,褪黑激素仅在FON 0接种的糖婴儿和查尔斯顿灰色品种中检测到。在接种后的第16天,抗性品种的赖氨酸含量显着降低,而发现它在易感品种中升高。
结论
综上所述,meja、JA-Ile、褪黑素和赖氨酸可能在发展对fon0病原菌的防御反应中起着关键作用,IAA可以作为fon0侵染西瓜植株的生物标志物。
背景
西瓜枯萎的镰刀菌是由真菌引起的尖孢镰刀菌F. SP。niveum(FON)。它是世界上几乎所有生产领域的西瓜的主要疾病之一,包括美国在内,包括美国的亚热带地区[1,2].几种化学,生物和作物旋转方法,包括将西瓜间隙的嫁接到耐腐砧座上,通常建议在西瓜中控制镰刀菌枯萎病3.]. 然而,由于镰刀菌在土壤中的长期存在及其新品种的进化,镰刀菌枯萎病的防治逐渐变得昂贵,甚至困难[4]. 因此,利用抗病品种是防治西瓜枯萎病的最佳方法之一。
到目前为止,在一组不同的西瓜品种中,已经鉴定出四个FON小种(0–3),它们的攻击性或克服特定抗性的能力[4].比赛0是最不侵略性的比赛,主要发现在没有枯萎的基因的品种上导致枯萎病,如糖婴儿[5].比赛1是一种媒体侵略性的比赛,这导致大部分品种都会受到适度的枯萎,例如被归类为抗镰刀枯萎病,例如Charleston Gray [5,6]. 西瓜品种卡尔霍恩灰对FON-1有较强的抗性[6]. 小种2具有很强的抗枯萎病能力,可以克服所有商品西瓜品种的枯萎病抗性[5]. 为此,对野生西瓜的几个品种进行了抗2号小种的筛选,发现美国农业部的两个引种品种pi296341和pi271769对2号小种具有抗性[7]. 单显性基因Fom-2和Fom-1分别对FON小种1和0产生抗性[8]. 除了小种2外,在佛罗里达州和马里兰州还发现了一个毒性最强的小种3,目前还没有商业上可买到的西瓜抗性品种[6,9].
FON在西瓜植株上的侵染是一个复杂的过程,由寄主-病原相互作用的几个阶段组成[10]. 该病原菌通过克服植物防御障碍,侵入西瓜根部并定殖。在感染的最后阶段,病原体分解酶和毒素会引起疾病症状[10,11]. 近年来,通过转录组学和蛋白质组学的研究,阐明了FON致病的分子机制,以及西瓜植株对FON侵染的免疫。以枯萎病胁迫下的西瓜品种PI296341为材料,构建了一个全长富集的cDNA文库,结果表明,在12℃时,转录因子ClWRKY1基因的表达水平达到最高水平 接种后h[12]. 此外,在FON 1侵染期间,植物防御素样基因ClPDF2.1和ClPDF2.4、苯丙氨酸解氨酶、几丁质酶和抗坏血酸过氧化物酶的转录水平在枯萎病敏感西瓜品种的根中被显著诱导[10]. 接种FON后,在叶片组织中鉴定出抗真菌的thaumatin样蛋白(ClTLP27)[13].
除了基因和蛋白质之外,还发现若干西瓜植物的代谢产物参与为FON感染提供防御。发现抗性多样性具有更高的抗真酚酸含量,例如4-羟基苯甲酸,邻苯二甲酸(PHA)和Gallic酸(Gaa)[14]. 同样,抗FON西瓜品种的游离氨基酸含量高于感FON西瓜品种[15].然而,关于这些代谢物在FON-西瓜植物相互作用的不同阶段提供防御性反应的确切作用的知名信息很少。
在此,为了鉴定西瓜植物中枯萎病的生物标志物,我们在FON感染后系统地分析了抗抗性和可-Utclectiby西瓜品种的叶片组织中的激素,褪黑素,酚酸和氨基酸水平。此外,在植物 - 病原体相互作用的不同阶段,用于在不同阶段可视化抗性和易感西瓜品种的代谢物变化。
结果
代谢轮廓分析
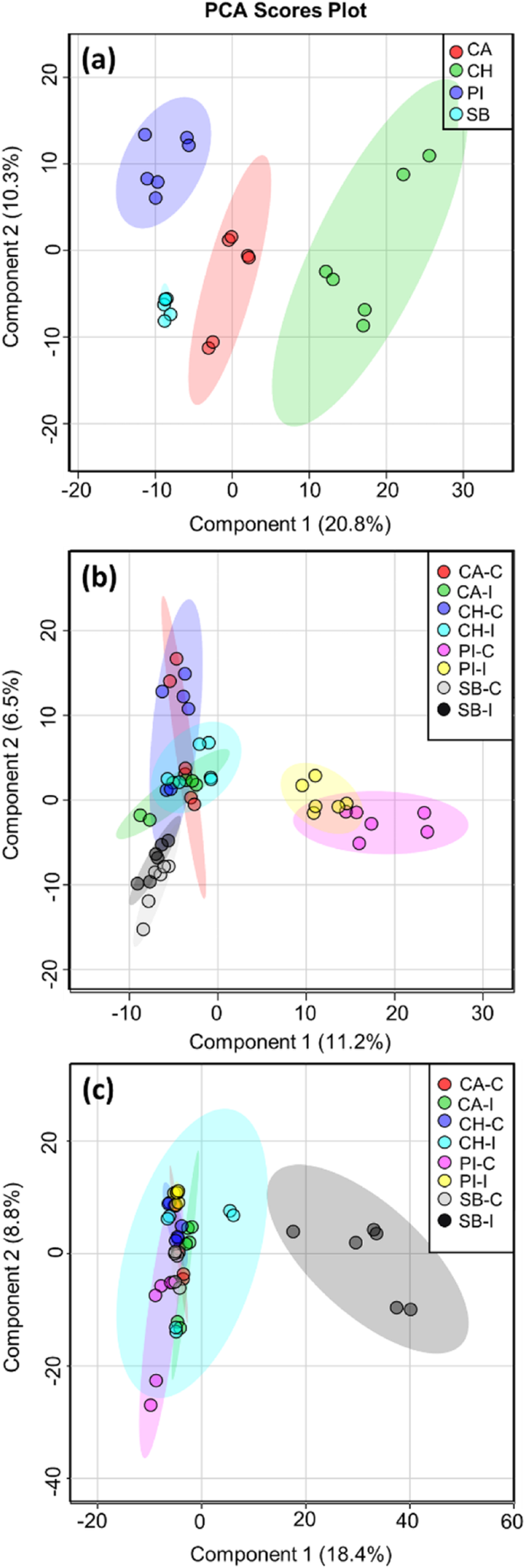
数字1给出了不同西瓜品种在FON0侵染前后(接种后第8天和第16天)的主成分分析(PCA)评分曲线。在图。1a、 前两个主成分(PCs)占总方差的31.1%,对每个西瓜品种表现出不同的聚类。在感染后第8天,每个研究品种的对照植株和接种植株都表现出一定程度的重叠,前两个PCs之间观察到的数据总方差为17.7%(图。1b) 是的。对照组和接种组的卡尔霍恩灰和查尔斯顿灰品种集群紧密分组。它们与糖婴对照组和接种组有一定程度的重叠。此外,PI-296341的对照组和接种组的簇与其他品种组的重叠簇完全分离(图。1b) 是的。然而,在感染后的第16天,Sugar Baby FON 0接种的植株与其各自的对照组植株以及未处理和接种的其他品种的一组植株形成了一个离散的簇(图。1c、 S码2).
植物-病原相互作用不同阶段激素水平的评价
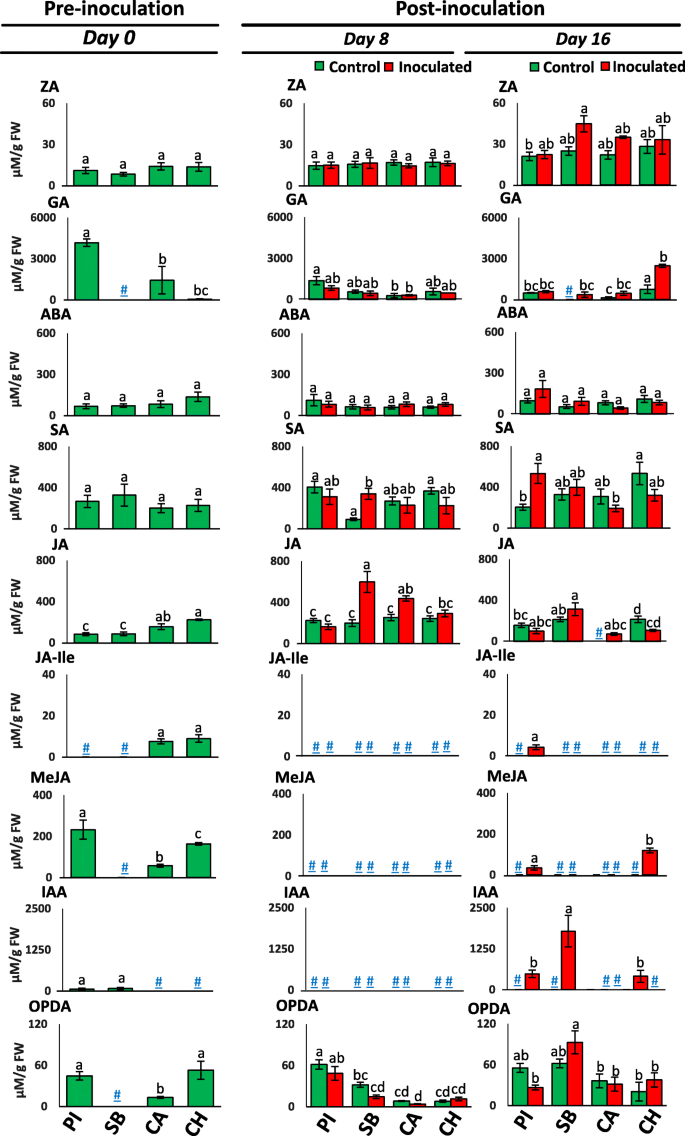
在FON 0预先和接种阶段,差动西瓜品种,PI-296341,糖婴儿,Calhoun灰色和查尔斯顿灰度的叶子激素水平如图2所示。2. 预接种阶段(10分钟) 所有研究的抗0品种如PI-296341、Calhoun灰和Charleston灰都检测到赤霉素(GA)、茉莉酸甲酯(MeJA)和12-氧代植物二烯酸(OPDA)。糖胚叶片组织仅在接种前(第8天和第16天)有GA和OPDA的积累。MeJA在PI-296341和Charleston-Grey接种植株后的后期积累。
在接种后第8天,接种FON 0的糖婴植株中茉莉酸(JA)和水杨酸(SA)含量显著高于对照植株。同样,在接种后的第8天,与对照相比,FON 0接种的Calhoun Grey植株的JA水平也显著升高。
茉莉酸-异亮氨酸(JA-Ile)仅在预接种阶段检测Calhoun Grey和Charleston Grey幼苗叶片组织。在接种FON 0后的第16天,所有研究品种的JA-Ile水平均未检测到,仅在接种FON 0的PI-296341品种的植株上出现。与jia - ile类似,PI-296341、Sugar Baby和Charleston Grey三个品种FON 0接种植株在接种后的后期(第16天)以激素、吲哚-3-乙酸(IAA)为主。
FON感染后褪黑素含量的变化
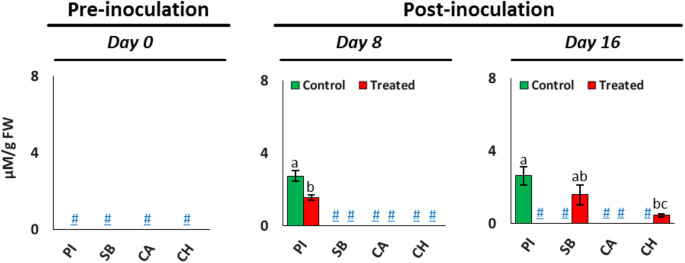
不同西瓜品种(PI-296341、糖宝贝、Calhoun灰和Charleston灰)侵染前后叶组织中褪黑素含量的定量分析结果如图所示。3.. 有趣的是,在接种前的所有西瓜品种的叶组织中,褪黑素都不在可检测范围之内。8点以后 在侵染天数内,仅在PI-296341的对照植株和组培植株中检测到褪黑素的存在,发现侵染后PI-296341品种叶片组织中褪黑素含量显著降低。此外,感染后第16天,接种西瓜品种PI-296341和Calhoun-Grey的植株叶片组织中未检测到褪黑素的含量。相反,仅在糖婴和查尔斯顿灰的FON 0接种植株中检测到。
在FON感染之前和之后的差异西瓜品种中的游离氨基酸含量
PI-296341的叶组织中10种不同的氨基酸水平,在0感染之前和之后的糖婴儿,Calhoun灰色和查尔斯顿灰色西瓜品种,在表格中列出1. PI-296341、sugarbaby、Calhoun-Grey和Charleston-Grey品种在接种前的叶片氨基酸谱有明显差异。8点以后 在侵染天数内,与对照相比,所有研究品种侵染样品的叶组织赖氨酸(Lys)含量均显著降低。有趣的是,在感染的第16天,抗病品种(PI-296341、Calhoun-Grey和Charleston-Grey)的受感染植株的Lys水平也降低。与此相反,与对照植物相比,受感染的糖幼植物的叶样品显示Lys水平显著升高(表1)1).
同样,FON 0接种后第16天,其他一些氨基酸水平也发生了变化。缬氨酸和组氨酸的叶片组织水平在可检测范围内或显著升高,在所有被研究的品种(表1).此外,在感染后期感染的糖婴儿植物中仅发现脯氨酸水平显着增加。该观察结果表明脯氨酸的积累可能与枯萎症状的发育联系起来。
FON感染前后差动西瓜品种的酚醛酸水平
PI-296341,Sugar Baby,Calhoun Gray和Charlesteron灰色品种之前和Charleston灰色品种的叶片酚醛酸谱的结果显示在表格中1.酚酸含量的变化主要发生在接种后的后期(第16天),尤其是感病品种Sugar Baby的植株。侵染第16天,糖宝贝侵染植株叶片样品中苯甲酸(BA)、咖啡酸(CFA)、GAA、PHA含量均显著高于对照植株。同样,绿原酸(CGA)和p-香豆酸(p在感染的糖婴儿植物的叶子样本中是特性检测到的CA)。
讨论
未明确的代谢组学,可视化镰刀菌耐腐蚀和可启动的西瓜品种的FON感染和疾病发展状态
在致病性试验中,在所研究的西瓜品种中,只有糖胚的枯萎病发生率较高。除查尔斯顿灰外,其它抗病品种如PI-296341和Calhoun灰在接种后第16天未出现枯萎病症状。因此,在抗枯萎病品种中很难区分病原菌的侵染和病害的进展。在最近的研究中,一个绿色荧光蛋白标记的FON1分离物被用来测定抗枯萎病和感枯萎病品种根样本中的侵染差异,并了解真菌与植物的相互作用[10,16]. 近年来,代谢组学方法被用来研究植物对病原的化学防御[17]. 本研究采用非靶向代谢组学方法研究了FON 0抗性和感病西瓜品种的FON侵染和病害发展状况。利用主成分分析(PCA)算法对多维UPLC/ESI-HR-QTOFMS数据进行降维处理,生成不同抗感枯萎病品种间植物-病原相互作用的图形输出[18,19]. PCA分析结果表明,每个西瓜品种的代谢组是不同的(图。1a),表明这些品种对研究病原体的可能不同的防御性状。在感染后第8天的PI-296341和糖婴儿品种的对照和接种组簇中观察到的PCA分数中的轻微隔离可以反映这些植物中FON 0病原体的感染/定植阶段(图。1b)。此外,在感染后第16天,无论西瓜基因型如何,症状和无症状植物在PCA分数图上显示了两个不同的簇(图。1C)。此外,我们发现所有研究的抗性品种的病原体接种植物在PCA分数图中形成了单一的簇,比较了易感品种,糖婴儿(图S2)表明抗病和感病西瓜品种在侵染后期对FON-0病菌可能有不同的代谢产物反应。这些发现提示了PCA技术在区分枯萎病有症状和无症状植物中的潜在作用。与我们的研究类似,PCA评分图也曾被用来显示西瓜白粉病敏感砧木和抗性砧木代谢谱之间的分离[20]. 在初步了解了西瓜植株中基于基因型的代谢组学变化对感染的反应后,进一步开展了有针对性的代谢组学研究,以确定西瓜植株中真菌-植物相互作用和镰刀菌抗枯萎病的生物标记。
茉莉酸盐(Meja和Ja-Ile)诱导对FON 0的全身性抵抗,IAA是西瓜枯萎的镰刀菌的生物标志物
植物激素在植物-病原相互作用中决定定殖和病害症状的发展[21].通常,为了从病原体辩护,植物依赖于植物激素调节的复杂信号网络。植物病原体操纵这些激素监管的主体防御[22].然而,植物激素在植物-病原体相互作用中的整体作用是非常复杂的,并且随着植物和真菌基因型的不同而不同[21].目前的结果表明,FON 0将激素信号通信网络截然不同,在镰刀菌枯萎病和 - 培养的西瓜基因型中明显。糖婴儿(易感品种)的接种植物显示出主要植物防御激素SA和JA在0感染的早期积累的增加(图。2). 相反,抗枯萎病品种Calhoun Grey在感染时只提高了JA的产量。这表明在感染早期,fon0的定植可能同时诱导JA和SA的生物合成。小麦间作增加了西瓜对水杨酸的积累,诱导水杨酸提高了西瓜对FON的抗性[2].在本研究中,在FON感染后期的PI-296341的叶组织中仅观察到SA的增加,这表明SA可能有助于为FON 0病原体提供增加的免疫。
茉莉酸盐在寄主-植物相互作用中促进抗性或敏感性[21]. 在这里,我们观察到Me-JA和JA-Ile在抗病品种感染后期积累(图。2).这表明在感染后阶段的ME-JA和JA-ILE的积累可能对提供西瓜中的FON 0病原体的抵抗力至关重要。在最近的研究中,发现外源MejA治疗通过增加防御酶和降低反应性氧(ROS)的活动来诱导香蕉和小麦植物的抗病抗性。[23,24].类似地,发现内源性JA-ILE水平的提升,以增强水稻中植物氧素的积累,从而造成抗痛Xanthomonas oryzae.PV。稻属[25].
IAA是由植物和微生物生产的关键养羊酸,包括镰刀菌物种[26]. 结果表明,感病品种和抗病品种在侵染后期,IAA主要在叶片组织中积累。2). 这表明累积的IAA可能完全或部分来源于真菌禾谷镰刀菌小麦感染,其内源性浓度可能是镰刀菌枯萎病症的决定性毒力因子[27].
褪黑素在西瓜枯萎病感病品种和抗病品种中的差异作用
褪黑素是一种普遍存在的分子,在植物中起着抗氧化剂或生长促进剂的作用[28]. 近年来的研究证实,褪黑素在不同植物对镰刀菌病原菌的抗性形成中具有重要作用[29,30]. 研究发现,病原菌侵染植物引起氧化爆发,进而诱导内源性褪黑素的生物合成。这种升高的褪黑素水平通过丝裂原活化蛋白激酶(MAPK)途径影响植物的天然免疫[31].褪黑激素的分解产物如2-羟丙替素(2HOM),环-3-羟基肽(C3HOM)和N.1-乙酰-N2-甲酰-5-甲氧基滚花胺(AFMK)具有更高的ROS清除活性,并与褪黑素一样激活MAPK级联反应[31,32]. 因此,考虑到这一点,有人提出在西瓜等特种作物中增加褪黑素对于诱导对多种丝状病原菌的抗性至关重要[30].在此,我们发现镰刀菌耐枯萎病,PI-296341具有高褪黑激素含量,其在FON 0感染时显着降低(图。3.). 相反,镰刀菌对枯萎病敏感的品种,糖宝宝只在FON感染后期积累褪黑素,作为最终的防御武器。总之,本研究结果表明,较高的内源褪黑素含量,包括从褪黑素中形成更多的生物活性代谢物,如2HOM、C3HOM和AFMK,可能是西瓜对FON 0病原菌产生抗性的关键。
Lys的分解代谢可能会加强西瓜植物防御FON 0病原体
在植物中,氨基酸的代谢是木质素和防御化合物等下游天然产物生物合成的关键事件[33]. 本研究的结果表明,无论是枯萎病敏感品种还是抗病品种,在接种后的后期,所研究的大多数游离氨基酸的合成代谢都有所增加(表1)1,图。4); 这表明游离氨基酸,主要是组氨酸、瓜氨酸、缬氨酸和苯丙氨酸参与了西瓜植株的防御反应。有趣的是,在接种后赖氨酸的积累减少,尤其是在抗枯萎病的品种中。这一发现强调了赖氨酸分解代谢的增加是诱导防御FON 0病原体的关键事件。近年来,人们发现赖氨酸的分解代谢产生免疫诱导剂哌啶酸[34].果酸是一种无环的非蛋白氨基酸,在大豆幼苗木质部汁液和叶片中积累镰刀菌感染[34,35]. 根据这些文献报道和我们的观察,西瓜植株可能通过增加赖氨酸的分解代谢,在叶片组织中积累胡椒酸来抵御FON 0病菌。
酚酸信号可能是西瓜枯萎病症状期的特征
酚酸普遍存在于维管植物中,并在亲和和不亲和的相互作用中明显积累[36]. 然而,对于酚酸在植物防御和疾病易感性中的确切作用知之甚少。结果表明,无论是感病品种还是抗病品种,在FON 0侵染初期,西瓜植株的酚酸特征都是一致的。在接种后第16天,大多数研究酚酸的积累,如BA、CFA、CGA、GAA、PHA、PCA和TCA,在枯萎病敏感品种Sugar Baby的叶片样品中显著增加(表1)1,图。5). 这个p据报道,加入孢子萌发和繁殖抑制潜力,相反,阿魏酸,4-羟基苯甲酸和PHA发现促进FON SPORE萌发和繁殖[37]. 由于FON抑制和促进酚酸在枯萎病症状期均有积累,因此FON抑制和促进酚酸的比值对枯萎病症状的发展至关重要。
结论
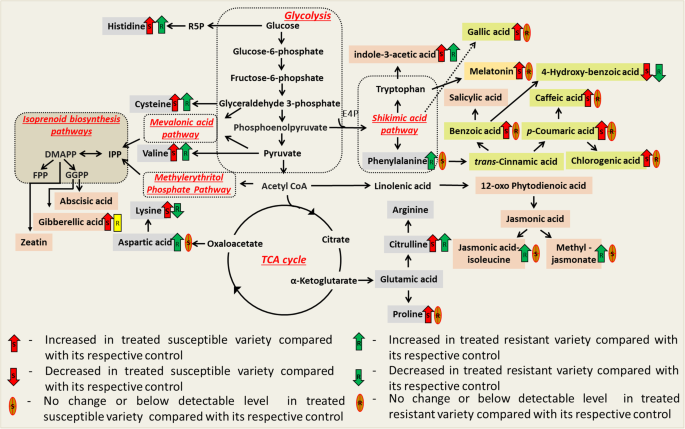
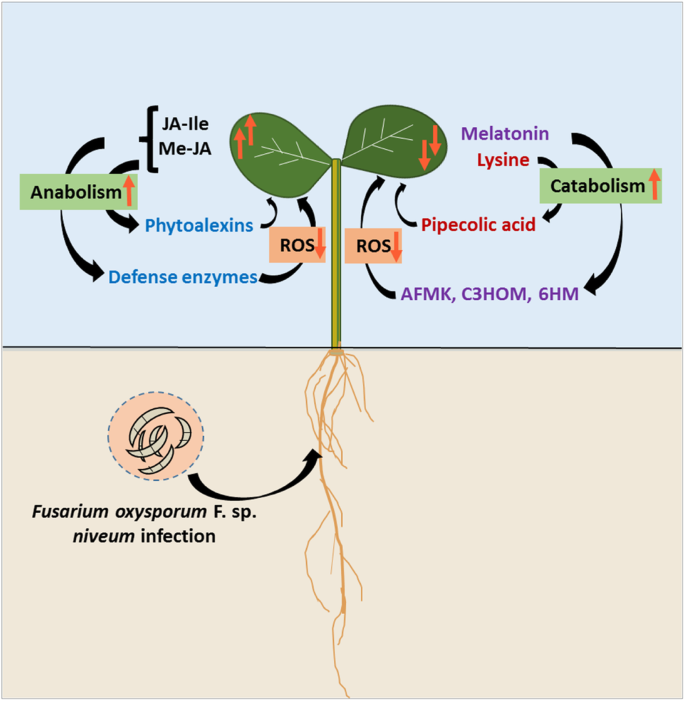
在此,我们已经证明Me-Ja,Ja-Ile,褪黑激素和溶液在发育西瓜植物的抗病抵抗对FON-0病原体中具有显着作用。根据我们的研究结果和其他文献报告[19,24,25,32,34]我们提出了西瓜植株对FON 0病原的多方面抗病模型(图。5)其中(i)Me-JA和JA-Ile在侵染后期在抗病品种中积累,并可能通过增加防御酶和植物抗毒素的生物合成,包括降低ROS来提供诱导抗性镰刀菌[24];(ii)高内源性褪黑激素含量,和/或从褪黑素和赖氨酸形成更多的生物活性代谢物在感染时可能进一步诱导某些FON抗性西瓜品种的抗性[31,34].除了这些生物标志物进行抗病抗性,我们还将IAA鉴定为某些西瓜基因型中FON感染的生物标志物,可用于监测西瓜植物中的FON感染。其中的整体目标是鉴定鉴定患有差异FON抗性的西瓜基因型中发育疾病抗性的代谢物。需要进一步的多常规和相关性研究以破译各种西瓜抗性基因型中的差异疾病抵抗机制,以防止不同种族的FON。
方法
化学试剂
褪黑素的正宗标准,酚酸(4-羟基 - 苯甲酸,苯甲酸,咖啡酸,绿原酸,阿魏酸,神经酸,ProtocateChuic酸,邻苯二甲酸,p-coumaric acid acid and和trans-cinnucic acid),植物激素(脱钙,赤霉酸,茉莉酸,甲基己酸酯,吲哚-3-乙酸,水杨酸和zeatin)和氨基酸(丙氨酸,精氨酸,天冬氨酸,Sigma-Aldrich,圣路易斯,美国,美国,美国,美国,美国,美国,美国,美国,美国,美国,美国,美国,美国,美国,美国,美国,美国,但美国,美国,美国,美国,美国,美国,美国,美国,美国,但美国,美国,美国,美国,但美国,杨玛-Aldrich,采购了芦笋,组氨酸,瓜氨酸,半胱氨酸,谷氨酸,赖氨酸,苯基,脯氨酸,丝氨酸,丙氨酸,缬氨酸,谷氨酸,丝氨酸,苏氨酸,缬氨酸。茉莉酸 - 异亮氨酸和12-氧代植物酸从美国传曼化学品,MI,MI。所使用的所有其他化学物质都是分析级。
尖孢镰刀菌F. SP。niveum(FON)分离和接种物制备
2017年8月,从美国德克萨斯州普莱蒙市商业区采集了具有典型枯萎病症状的西瓜植株。为了分离病原,在流水下冲洗根和茎组织。经过表面灭菌和用水复洗后,将这些植物部分置于马铃薯葡萄糖琼脂(PDA)平板上,培养7-10天 25天 摄氏度。采用单孢培养技术获得纯培养物[38]. 2的盘子 使用一周前的FON分离物培养物来制备接种物。在培养板上加入无菌生理盐水,用无菌塑料细胞撒布器轻轻擦洗,使菌落悬浮在生理盐水中,得到分生孢子和菌丝碎片悬浮液。
植物材料和幼苗发育
Sugar Baby和Charleston Gray的种子来自Johnny的选定种子,美国缅因州。Calhoun Gray和PI-296341种子被收到了来自美国格里芬的USDA-Ars-Grin储存库的样本。将这四种品种的种子浸泡在蒸馏水中12小时。在第二天,在填充灌封土的插头托盘(200平方电池)中播种每次繁殖的每种各种种子(Metro-Mix 900,Sun Gro园艺,温哥华,加拿大),并放置在增长室内(PGC Flex,Compuriron,ND,USA)在70%的相对湿度下,在14h / 10h(光/暗,28°C / 18°C)光 - 萌发和幼苗发育中的相对湿度下。在第10天,收集3-4种幼苗的叶样品并在-80℃下储存,用于代谢组研究。
致病性试验,种族测定
每个品种的10天生苗木样品移栽到2.5〃方形盆中,盆中装有盆栽土。将每个品种的幼苗均分为对照组和处理组。随后,处理组苗木接种1 mL分生孢子和菌丝碎片悬浮液(2.6 × 105 (CFU)在他们的牙冠上使用无菌尖端。接种和未接种的对照植物都按照生物安全3级(BSL-3)的指导方针在温室中转移和生长。连续16天每天监测疾病症状 记录出现枯萎病症状的苗木天数和百分比(研究期间的平均昼夜温室温度为31.1/22.2) 摄氏度)。所描述的标准[6]对西瓜品种进行了小种划分和感病品种分类(≥33%枯萎病)和抗性(< 33%枯萎)。在所研究的不同西瓜品种中,糖婴(对0号小种敏感)的萎蔫率仅超过33%。FON分离物在查尔斯顿灰树上的枯萎病发病率最低(≥17) 在PI-296341和Calhoun Grey上没有发病率(图S)1). 根据这些观察结果,确认Premont,TX FON分离物(W-2-2)为FON零(0)[16,39]. 在代谢组学研究中,在接种后第8天和第16天采集每个对照组和处理组的3-4个幼苗样品,并将叶片样品储存在− 80 °C直到使用。
褪黑素、酚酸和非靶向代谢组学分析的量化
根据我们先前描述的程序使用褪黑激素和酚酸的定量,包括未确定的代谢组科[40]. 简单地说,冷冻的叶片组织样品用杵在液氮中研磨,1 甲醇加入50毫升 每样mg。经过涡流和超声处理后,混合物离心(10621 x g,10 最小值)。将分离的上清液注入配备有Eclipse Plus C18 RRHD(1.8)的UPLC/ESI-HR-QTOFMS中 μm,50 × 2.1 mm)柱。使用色谱分离和质谱条件,如我们以前的出版物所述[19,40,41]. 对于非靶向代谢组学研究,类似数据通过数据分析软件进一步预处理,并在Excel中提取包含化合物比质量、保留时间和峰强度的信息,然后导出到在线软件MetaboAnalyst 3.0(http://www.metaboanalyst.ca/)对于数据标准化和多变量分析[42].
激素分析
植物激素分析是按照我们先前描述的程序进行的[19,40]. 通过添加1 mL萃取溶剂,2-丙醇:水:乙酸(80:19:1,v/v)至含有50 在液氮中粉碎叶片组织。后来,混合物被涡流(30 s) ,超声处理,离心(10621 x g,10分钟) 最小值)。分离上清液并用于基于UPLC/ESI-HR-QTOFMS的激素定量分析。激素的分离在Eclipse+C18-RRHD(1.8)上进行 μm,50 × 2.1 mm)柱。梯度二元流动相,0.1%甲酸水溶液(A)和0.1%甲酸乙腈溶液(B),梯度程序:0 最小值,0%B;11 最小值,80%B;15 最小值,100%B;16 用最小0%B进行分析。柱温保持在30℃ 摄氏度。在上述质谱仪工作参数下获得了ESI(+)-MS/MS光谱[40].
氨基酸谱
从叶片组织样品中的游离氨基酸在70%甲醇中萃取,并根据前面描述的程序(DNS-CL)衍生物后使用HPLC定量估计[19].
统计分析
结果以平均值表示 ± 三个生物复制品的两次技术测量的标准误差(SE)。采用msexcel进行回归分析和数据可视化。统计显著性(P < 0.05) between treatment groups was assessed using the SPSS software (IBM SPSS Statistics, IBM Corp., Chicago, IL, USA).
数据和材料的可用性
本研究中使用的数据集可根据合理要求从通讯作者处获得。
缩写
- 阿巴:
-
脱盐酸
- BA:
-
苯甲酸(BA)
- C:
-
控制
- CA:
-
卡尔霍恩灰色
- CFA:
-
咖啡酸
- CH:
-
查尔斯顿灰
- DMAPP:
-
焦磷酸二甲基烯丙基酯
- 丰:
-
尖孢镰刀菌F服务提供商。niveum
- FPP:
-
焦磷酸法尼酯
- GA公司:
-
赤霉素
- 砷化镓:
-
没食子酸
- GGPP公司:
-
焦磷酸香叶基香叶基
- IAA:
-
吲哚乙酸
- 独立发电商:
-
焦磷酸异戊烯酯
- JA:
-
茉莉酸
- JA-Ile:
-
茉莉acid-isoleucine
- 赖氨酸:
-
赖氨酸
- 梅贾:
-
茉莉酸甲酯
- OPDA公司:
-
12-oxo phytodienoic酸
- OPDA公司:
-
12-oxo-phytodienoic酸
- 主成分分析:
-
主要成分分析
- 个人计算机:
-
主成分
- PHA:
-
邻苯二甲酸
- 圆周率:
-
编号:PI-296341
- R5P型:
-
核糖5-磷酸盐
- SA:
-
水杨酸
- SB:
-
糖宝宝
- 电话:
-
治疗
- za:
-
玉米素
参考
- 1.
Saminathan T、García M、Ghimire B、Lopez C、Bodurrin a、Nimmakayala P等。对不同西瓜品种的亚基因组和亚转录组DNA分析揭示了果实相关微生物群在碳水化合物代谢和成熟果实成熟中的作用。前植物科学。2018;9:4.
- 2.
吕宏,曹宏,马乃华,苏海林,黄勇,程富,等。小麦间作提高西瓜对枯萎病的抗性。前植物科学。2018;9:696.
- 3.
Everts Kl,Himmelstein JC。西瓜的镰刀菌枯萎:迈向重新出现植物病的可持续管理。作物保护。2015; 73:93-9。
- 4.
Meru G,McGregor C.基因分型通过测序SNP发现和抵抗比赛1的遗传映射尖孢镰刀菌在西瓜里。科幻电影。2016;209:31–40.
- 5.
周晓,Everts K.小种与接种量尖孢镰刀菌F服务提供商。niveum在马里兰州和特拉华州的商业西瓜地里。植物分布。2003;87(6):692–8.
- 6.
周X,埃弗茨K,布鲁顿B。小种3,一个新的高毒力小种尖孢镰刀菌F服务提供商。niveum导致西瓜中的镰刀菌枯萎病。植物DIS。2010; 94(1):92-8。
- 7.
Wechter WP、Kousik C、McMillan M、Levi A。抗药性鉴定尖孢镰刀菌F服务提供商。niveum比赛2Citrullus lanatus.var。柠檬虫工厂介绍。HortSci。2012年,47(3):334 - 8。
- 8。
Joobour T、King JJ、Nolin SJ、Thomas CE、Dean RA。甜瓜枯萎病抗性基因座Fom-2包含一个单一的抗性基因,具有复杂的特征。植物J。2004;39(3):283–97.
- 9。
Amaradasa B、Beckham K、Dufault N、Sanchez T、Ertek T、Iriarte F等,首次报道尖孢镰刀菌F服务提供商。niveum比赛3导致西瓜枯萎在佛罗里达州,美国。植物DIS。2018; 102(5):1029。
- 10。
张M,徐杰,刘G,姚X,李普,杨X。西瓜幼苗侵染过程的分子生物学研究尖孢镰刀菌F服务提供商。niveum. 植物病理学。2015;64(5):1076–84.
- 11
张建平,张建平,张建平,等。抗感甜瓜系侵染的差异定殖和防御反应尖孢镰刀菌比赛1·2.植物途径。2010; 59(3):576-85。
- 12
杨B-y,Huo X-A,Li P-F,Wang C-X,Duan H-J。西瓜cDNA表达文库的构建分离Clwrky1转录因子基因患者抗镰刀菌枯萎病。印度j生物志法生物麦子。2014; 51:302-7。
- 13
张明、徐杰、刘庚、杨×。西瓜中类thaumatin蛋白的抗真菌特性。生理植物学报。2018;40(11):186.
- 14
吴海山,刘德英,凌恩,包伟,应瑞瑞,沈庆瑞。西瓜根系分泌物对黄瓜生长的影响尖孢镰刀菌F服务提供商。niveum. 土壤科学杂志。2009;73(4):1150–6.
- 15
刘B,吴师,杨y,王X.西瓜根氨基酸渗出物和血清孢子素生长的影响。sp。nevium。Allofopathy J. 2009; 23(1):139-47。
- 16
吕克,郭某,张H,耿朗,马丁·朗,徐Y。富疮性耐腐蚀和易感西瓜根系的绿色荧光蛋白标记的分离物尖孢镰刀菌F服务提供商。niveum. J植物病理学。2014;162(4):228–37.
- 17
Gauthier L,Atanasova Penichon V,Chéreau S,Richard F。代谢组学研究谷物对禾谷镰刀菌的化学防御和脱氧雪腐镰刀菌烯醇的积累。国际分子科学杂志。2015;16(10):24839–72.
- 18。
Lee Jh,Jayaprakasha G,Rush Cm,Crosby Km,Patil BS。生产系统影响番茄中挥发性生物标志物。代谢组学。2018; 14(7):99。
- 19。
Kasote DM、Jayaprakasha GK、Singh J、Ong K、Crosby KM、Patil BS。西瓜枯萎病的代谢组学生物标记。植物保护。2020;127:591–6.
- 20
Mahmud I,Kousik C,Hassell R,Chowdhury K,Boroujerdi AF。NMR光谱识别从粉末状霉菌抗砧木转移到易感西瓜间隙的代谢物。JAgric Food Chem。2015; 63(36):8083-91。
- 21。
di x,takken fl,tintor n。植物体如何在植物和土壤中的植物之间的相互作用尖孢镰刀菌.植物科学与技术,2016;
- 22。
Kazan K,Lyons R.植物激素途径的介入病原体效应。植物细胞。2014; 26(6):2285-309。
- 23。
孙德,吕×,胡勇,李伟,洪凯,莫勇,等。茉莉酸甲酯诱导的防御反应增强了对烟草的抗性尖孢镰刀菌F服务提供商。库本斯比赛4在香蕉。SCI Hortic。2013; 164:484-91。
- 24
Motallebi P,Niknam V,Ebrahimzadeh H,Hashemi M,Enferadi ST.外源茉莉酸甲酯处理诱导防御反应镰刀菌在小麦幼苗。植物生长规律。2017;36(1):71-82。
- 25
胡k,caoj,张俊,夏f,ke y,zhang h等。通过细胞壁增强改善抗病性基因多种农艺性状。Nat植物。2017; 3(3):17009。
- 26
Tsavkelova E,Oeser B,Oren Young L,Israel M,Sasson Y,Tudzynski B等。植物相关镰刀菌中吲哚-3-乙酰胺介导的IAA生物合成的鉴定和功能表征。真菌基因生物学。2012;49(1):48–57.
- 27
[15]罗凯,祁鹏飞,郑艳玲,赵红艳,李建平。小麦赤霉病菌中吲哚-3-乙酸的生物合成途径及其生理效应研究。植物生理学报,2011,40(5):749 - 754。真菌医学杂志。2016;120(9):1135 - 45。
- 28
Paredes SD,Korkmaz A,曼彻斯特LC,Tan D-X,Reiter RJ。Phytomelatonin:审查。J Exp Bot。2008; 60(1):57-69。
- 29
魏y,胡w,wang q,zeng h,li x,yan y等。香蕉中热休克蛋白90s的鉴定,转录和功能分析(小果野蕉强调它们在褪黑素介导的植物对枯萎病的反应中的新作用。松果体研究杂志,2017年;62(1):e12367。
- 30
Mandal MK、Suren H、Ward B、Boroujerdi A、Kousik C。褪黑素在瓜类植物寄主抗性和病原抑制中的差异作用。松果体研究杂志,2018年;65(3):e12505。
- 31
李希,回来。褪黑素通过mapkk3和oxi1介导h2o2和NO的防御信号拟南芥.j pineal res。2017; 62(2):E12379。
- 32
yu y,lv y,shi y,li t,chen y,zhao d等。Phyto-褪黑素和相关代谢物响应应激的作用。分子。2018; 23(8):1887。
- 33。
Maeda H,Dudareva N.植物中的Shikimate途径和芳香族氨基酸生物合成。Annu Rev植物Biol。2012; 63:73-105。
- 34。
氨基酸代谢途径对植物免疫调节的新认识。植物细胞学报。2013;36(12):2085-103。
- 35。
Abeysekara NS,Swaminathan S,Desai N,Guo L,Bhattacharyya MK.植物免疫诱导剂胡椒酸在大豆镰刀菌侵染后的木质部汁液和叶片中积累。植物科学。2016;243:105–14.
- 36
Nicholson RL,Hammerschmidt R.酚类化合物及其在抗病性中的作用。Annu Rev phytopathol。1992; 30(1):369-89。
- 37
郝W,冉W,沈Q,任L。西瓜、水稻根系分泌物及酚酸对黄瓜幼苗生长的影响尖孢镰刀菌F服务提供商。niveum. 科学农业罪。2010;43(12):2443–52.
- 38
莱斯利JF,萨默尔文学学士。镰刀菌实验室手册。艾姆斯:布莱克威尔出版社;2006
- 39
黄昌华,罗伯茨警察,达诺夫LE。硅对番茄枯萎病和根腐病有抑制作用。J Phytopathol。2011;159(7 - 8):546 - 54。
- 40
Kasote DM、Lee J、Jayaprakasha GK、Patil BS。纳米氧化铁引发西瓜种子对西瓜幼苗抗氧化能力和防御相关激素的影响。ACS Sustain Chem Eng.2019年;7(5):5142–51.
- 41
Kasote DM、Jayaprakasha GK、Patil BS。快速测定抗氧化活性的叶盘分析法。Sci代表,2019年;9(1):1–10.
- 42
夏J,维哈特DS。使用MetaboAnalyst 3.0进行全面的代谢组学数据分析。现代生物信息学。2016;55(1):14.10. 11–91.
致谢
我们感谢Cecilia E。麦克格雷戈,Athens乔治亚大学,GA为PI-9631和Calhoun Grey西瓜品种提供种子。作者还感谢John Prokop先生和Bagley Product Co.,Edinburg,TX为本研究提供了受感染的植物样本。
资金
这项研究由美国德克萨斯州农业部项目# SC-1607-013资助。作者承认,美国农业部- nifa - scri - 2017-51181-26834通过德克萨斯州农工大学蔬菜和水果改良中心的国家甜瓜卓越中心获得了资助。
作者信息
从属关系
贡献
DMK和KO设计了实验。DMK、KO和GKJ进行了研究工作。DMK和GKJ分析了数据。DMK撰写了手稿,所有作者都讨论了结果,并为最终的手稿做出了贡献。BSP、KMK和KO为研究的实施和协调做出了贡献。作者们阅读并批准了最后的手稿。
通讯作者
道德宣言
伦理批准并同意参与
不适用。
同意出版
不适用。
相互竞争的利益
作者声明他们没有相互竞争的利益。
附加信息
出版商说明
《自然》杂志对已出版的地图和附属机构的管辖权主张保持中立。
补充信息
附加文件1:图S1。
普莱蒙的致病性试验尖孢镰刀菌F. SP。niveum(FON)从PI-296341、Sugar Baby、Calhoun Grey和Charleston Grey等西瓜品种中分离。结果表明,“糖宝贝”是敏感品种,其余3个品种(PI-296341、calhougrey和Charleston Grey)对FON-0均有抗性。
附加文件2:图S2。
(a) 控制和(b)尖孢镰刀菌F. SP。niveum0(fon0)西瓜品种、PI-296341(PI)、糖宝贝(SB)、卡霍恩灰(CA)和查尔斯顿灰(CH)在感染后第16天的主成分分析(PCA)评分图。
权利和权限
开放存取本文是根据知识共享署名4.0国际许可证授权的,该许可证允许以任何媒体或格式使用、共享、改编、分发和复制,只要您给予原作者和来源适当的信任,提供到知识共享许可证的链接,并指出是否进行了更改。本文中的图像或其他第三方材料包含在文章的知识共享许可证中,除非在材料的信用额度中另有说明。如果材料未包含在文章的知识共享许可证中,并且您的预期用途不受法律法规的允许或超出允许的用途,您将需要直接获得版权持有人的许可。要查看此许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/. 知识共享公共领域放弃(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用本文
Kasote,D.M.,Jayaprakasha,G.K.,Ong,K。等。西瓜枯萎病感病与抗病植株在植物-病原互作过程中激素和代谢产物的反应。BMC植物生物学20,481 (2020). https://doi.org/10.1186/s12870-020-02686-9
收到:
接受:
出版:
关键词
- 尖孢镰刀菌F服务提供商。niveum
- 吲哚乙酸
- 茉莉acid-isoleucine
- 茉莉酸甲酯
- 赖氨酸
- 褪黑素
- 代谢组学
- 西瓜