- 研究文章gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
BrrICE1.1通过调控萝卜抗冻性中精氨酸脱羧酶基因与腐胺合成有关(gydF4y2Ba芸苔属植物拉伯gydF4y2Bavar。gydF4y2Ba拉伯gydF4y2Ba)gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba20.gydF4y2Ba、物品编号:gydF4y2Ba504gydF4y2Ba(gydF4y2Ba2020gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
青藏高原农区生长季节昼夜温差大,极端温度成为作物产量的限制因素之一。萝卜(gydF4y2Ba油菜,变种油菜gydF4y2Ba)是生长在青藏高原的西藏传统作物,但其耐冻的分子和代谢机制尚不清楚。gydF4y2Ba
结果gydF4y2Ba
本研究基于冷冻处理下藏萝卜转录和代谢水平的变化,研究了精氨酸脱羧酶基因的表达gydF4y2BaBrrADC2.2gydF4y2Ba腐胺含量不同,呈累积模式。此外,我们还证明了BrrICE1.1 (CBF表达诱导剂1)可以直接结合gydF4y2BaBrrADC2.2gydF4y2Ba子,激活gydF4y2BaBrrADC2.2gydF4y2Ba促进腐胺的积累,通过RNAi和过表达分析证实了这一点gydF4y2BaBrrADC2.2gydF4y2Ba和gydF4y2BaBrrICE1.1gydF4y2Ba使用转基因发根。在耐冻条件下,外源施用腐胺及其抑制剂DL-α-(二氟甲基)精氨酸(DFMA),进一步分析了腐胺在萝卜中的作用。此外,还发现BrrICE1.1参与了ICE1-CBF通路,从而增加了萝卜的冰冻胁迫。gydF4y2Ba
结论gydF4y2Ba
BrrICE1.1可以结合的启动子gydF4y2BaBrrADC2.2gydF4y2Ba或gydF4y2BacbfgydF4y2Ba通过转录组学和靶向代谢组学分析参与萝卜的抗冻性。本研究揭示了萝卜抗冻过程的调控网络,增加了对西藏高原作物对极端环境响应的认识。gydF4y2Ba
背景gydF4y2Ba
多胺是广泛存在于各种生物体中的低分子量脂肪族聚合物。在高等植物中发现了许多种类的多胺,如革胺、腐胺、亚精胺、精胺和尸胺[gydF4y2Ba1gydF4y2Ba]。其中,腐胺是多胺的第一关键因子,在大多数生物体中,多胺的合成始于腐胺代谢的合成。植物腐胺可通过精氨酸脱羧酶(ADC)和Orn脱羧酶(ODC)两种途径形成[gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba]。ADC途径由三种酶催化:ADC、agmatine亚胺水解酶(AIH)和gydF4y2BaNgydF4y2Ba-氨基甲酰腐胺水解酶。此外,亚精胺合成酶(SPDS)催化腐胺生成亚精胺,精胺合成酶(SPMS)催化亚精胺与氨基丙基结合生成精胺,其中氨基丙基由s -腺苷蛋氨酸(SAM)经SAM脱羧酶生成[gydF4y2Ba3.gydF4y2Ba]。gydF4y2Ba
大量研究表明,多胺代谢的变化和平衡对许多植物的生长和胁迫反应具有重要的调节作用[gydF4y2Ba4gydF4y2Ba,gydF4y2Ba5gydF4y2Ba],包括对寒冷压力的影响[gydF4y2Ba6gydF4y2Ba]、高温应力[gydF4y2Ba7gydF4y2Ba],干旱[gydF4y2Ba8gydF4y2Ba],盐度[gydF4y2Ba9gydF4y2Ba],疾病[gydF4y2Ba10gydF4y2Ba]和氧化应激[gydF4y2Ba11gydF4y2Ba]。通过多胺生物合成基因的遗传转化或外源应用增加内源多胺,可增强多种植物的耐受性[gydF4y2Ba6gydF4y2Ba,gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba]。例如,关键基因的过度表达gydF4y2BaADC1gydF4y2Ba和gydF4y2BaADC2gydF4y2Ba用于腐胺合成gydF4y2Ba拟南芥gydF4y2Ba增加腐胺含量,提高耐寒性,但突变体中存在缺陷gydF4y2Baadc1gydF4y2Ba和gydF4y2Baadc2gydF4y2Ba与对照植物相比,耐寒性降低[gydF4y2Ba8gydF4y2Ba,gydF4y2Ba14gydF4y2Ba]。(Urano et al. 2003) [gydF4y2Ba9gydF4y2Ba也表明gydF4y2BaADC2gydF4y2Ba在盐胁迫下诱导gydF4y2Ba拟南芥gydF4y2Ba通过调节游离腐胺的含量来增强抗逆性gydF4y2Baadc2gydF4y2Ba突变体对盐胁迫非常敏感。此外,转基因植物表达酵母gydF4y2BaSAMDCgydF4y2Ba对高温应力的耐受性增强[gydF4y2Ba15gydF4y2Ba]。此外,外源多胺和多胺抑制剂是研究多胺与植物抗逆性关系的重要手段。例如,外源腐胺和亚精胺可以减轻盐敏水稻的胁迫[gydF4y2Ba16gydF4y2Ba],但多胺抑制剂(如DFMA)降低了耐冷水稻的耐寒性[gydF4y2Ba17gydF4y2Ba]。此外,外源施用腐胺提高了马铃薯的冷驯化抗冻性[gydF4y2Ba6gydF4y2Ba]。因此,调控多胺代谢途径是提高植物抗逆性的有效途径,在植物抗逆性育种中具有广阔的应用前景。gydF4y2Ba
冰冻胁迫是限制作物产量的一个主要因素,阻碍了全球数百万公顷的作物生长,并减少了作物的地理分布。植物已经进化出复杂的机制来适应极端温度,例如低温胁迫,这伴随着数千个基因表达的变化[gydF4y2Ba18gydF4y2Ba]。其中,ICE1-DREB/CBF轴被确定为植物低温下的关键调控通路[gydF4y2Ba19gydF4y2Ba]。ICE1是一种表征良好的螺旋-环-螺旋(bHLH)蛋白,在植物冷反应的转录调控级联中起上游调节作用gydF4y2Ba拟南芥gydF4y2Ba。ICE1通过结合MYC元件(cantg)调控下游基因的转录表达gydF4y2BaCBFgydF4y2Ba基因,gydF4y2BaCBFgydF4y2Ba从而调节许多冷调节(gydF4y2Ba天哪gydF4y2Ba)基因[gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba21gydF4y2Ba,gydF4y2Ba22gydF4y2Ba]。然而,其他尚未探索的潜在机制的可能性gydF4y2BaICE1gydF4y2Ba不能完全消除。事实上,除了已建立的ICE1-CBF级联之外gydF4y2BaCdICE1gydF4y2Ba也可以通过调节microRNA miR398的表达介导菊花的抗冻性[gydF4y2Ba23gydF4y2Ba]。特别是,PtICE1与ADC相互作用,而ADC与多胺途径调节植物的耐寒性有关gydF4y2Ba枳壳trifoliatagydF4y2Ba[gydF4y2Ba24gydF4y2Ba]。因此,一些尚未确定的分子机制可能也有助于耐冷性gydF4y2BaICE1gydF4y2Ba以及它的同系物。gydF4y2Ba
青藏高原气候特殊,高海拔、低温、低氧、强辐射、干旱、强风等不利气候条件频繁发生。在长期的适应过程中,植物进化出了许多生存策略。因此,了解西藏植物如何适应和生存非生物胁迫,对于有效开发与抗逆性相关的遗传资源,开发增强抗逆性的新途径,并为青藏高原多作物分析提供重要的理论支持。萝卜(gydF4y2Ba油菜,变种油菜gydF4y2Ba)是青藏高原的一种传统作物,用于食品、饲料和医药,在青藏高原的长期生长过程中对极端环境具有良好的适应性[gydF4y2Ba25gydF4y2Ba]。研究表明,藏萝卜对寒冷的暴露非常敏感[gydF4y2Ba26gydF4y2Ba]。然而,关于萝卜耐冻性的机制,目前所知甚少。分析萝卜对冰冻环境的适应性,有助于阐明萝卜耐冻性的分子机制,并为西藏地区萝卜育种提供建议。本研究通过转录组学和代谢组学的差异基因表达分析和加权基因共表达相关网络分析(WGCNA),确定了一个关键基因gydF4y2BaBrrADC2.2gydF4y2Ba这可能与腐胺代谢有关。BrrICE1.1绑定到gydF4y2BaBrrADC2.2gydF4y2Ba启动子调控腐胺合成,经生化鉴定gydF4y2Ba农杆菌属rhizogenesgydF4y2Ba-介导的(LBA9402菌株)遗传转化试验表明腐胺在抗冻性中的重要作用。除经典的ICE1-CBF-COR途径外,多胺代谢途径对藏萝卜在极低温条件下的抗冻性也有贡献。gydF4y2Ba
结果gydF4y2Ba
藏萝卜KTRG-B49对抗冻性的响应gydF4y2Ba
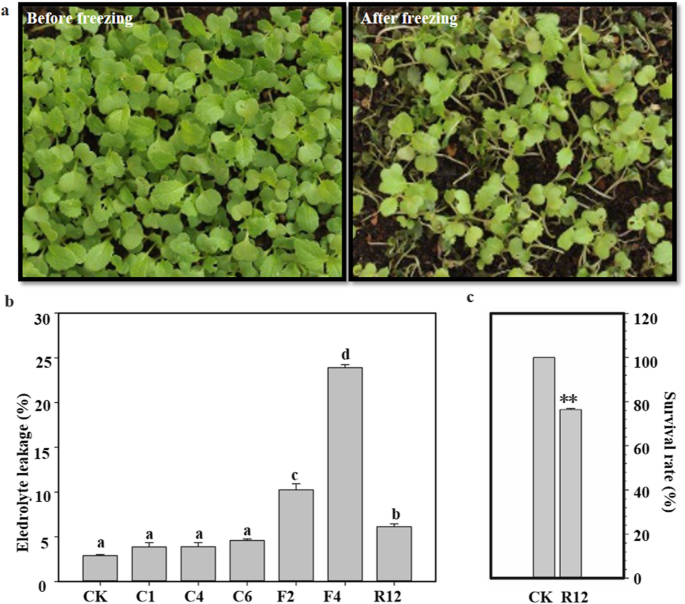
以青藏高原萝卜品种KTRG-B49为材料,对萝卜的抗冻性进行了评价。不出所料,与对照苗相比,大部分处理苗成活(图2)。gydF4y2Ba1gydF4y2Baa).随着冻结应力时间的延长,萝卜细胞的电解质泄漏量逐渐增大(图2)。gydF4y2Ba1gydF4y2Bab).在- 4℃条件下培养1 h,植株的损伤程度比在标准条件下培养的植株严重。在环境中恢复生长12 h后,植株得到恢复,电解质泄漏率为23.9%,但仍有78.9%的高存活率(图2)。gydF4y2Ba1gydF4y2Bac).这些数据表明,KTRG-B49具有青藏高原萝卜的繁殖特征,能够对低温做出响应。gydF4y2Ba
萝卜KTRG-B49冷冻处理及生理指标测定。gydF4y2Ba一个gydF4y2Ba冻结表型。gydF4y2BabgydF4y2Ba漏液量(%)。数值为5-8个生物重复的平均值。条形图表示SD。不同的符号表示处理之间的显著差异(gydF4y2BaPgydF4y2Ba< 0.05)。CK、C1、C4、C6、F2、F4和R12为未处理对照样品;4℃,1h, 3h, 6h;−2℃,2h;−4℃1 h;和恢复时间分别为12h。gydF4y2BacgydF4y2Ba存活率。星号表示差异有统计学意义(*gydF4y2BaPgydF4y2Ba< 0.05, **gydF4y2BaPgydF4y2Ba< 0.01,学生gydF4y2BatgydF4y2Ba测试)gydF4y2Ba
KTRG-B49在冷冻处理期间转录组的变化gydF4y2Ba
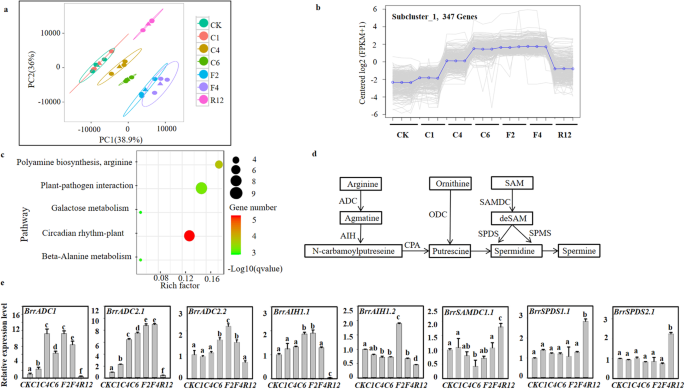
经过冷冻处理的KTRG-B49植株进行了rna测序,以确定负责耐受性的基因。21个KTRG-B49个体共获得144.16 Gb的干净数据,每个样本的干净数据均超过6.18 Gb。样本的测序质量评分为30分(Q30),均大于89.03%,表明reads质量较高(表S)gydF4y2Ba2gydF4y2Ba)。使用TopHat软件将83.27 -89.72%的clean reads定位到芜菁参考基因组,平均定位率为86.56%(表5)gydF4y2Ba3.gydF4y2Ba)。因此,每个样品中有一半以上的萝卜内参基因表达,这足以进行进一步的差异基因表达分析。样本间表达水平的相关性分析(图5)gydF4y2Ba2gydF4y2Ba)和所有样本的FPKM分布(图5)gydF4y2Ba3.gydF4y2Ba)表明各样品的表达水平重复性好。此外,基于21个样本的主成分分析(PCA)结果显示,第一个成分解释了38.9%的变异,第二个成分解释了36%的变异(图2)。gydF4y2Ba2gydF4y2Baa). KTRG-B49沿第一分量轴可以清晰地分离出5个不同的星团。这一发现表明CK与C1、F2与F4之间关系密切,可能具有相似的表达模式。基于PCA可以推断不同处理之间的差异表达分析。gydF4y2Ba
萝卜多胺生物合成途径关键基因的转录组和qRT-PCR分析。gydF4y2Ba一个gydF4y2Ba转录组数据的主成分分析。轴的尺度是相对距离。不同的颜色或形状代表不同组的样品在冷冻处理。gydF4y2BabgydF4y2Badeg的不同趋势(subcluster_1)分析。gydF4y2BacgydF4y2Ba亚cluster_1中差异表达基因(DEGs)富集的KEGG通路散点图。下面列出了KEGG数据库中富集程度最高的5个通路术语。gydF4y2BadgydF4y2Ba植物中的多胺生物合成途径(右)。gydF4y2BaegydF4y2Ba多胺生物合成关键基因的qPCR分析,有3个生物和技术重复。数据采用单因素方差分析(Tukey’s检验)。不同字母表示差异显著(gydF4y2BaPgydF4y2Ba< 0.05)。CK、C1、C4、C6、F2、F4和R12为未处理对照样品;4℃,1h, 3h, 6h;−2℃,2h;−4℃1 h;和恢复时间分别为12hgydF4y2Ba
多胺合成途径与KTRG-B49的冷冻反应有关gydF4y2Ba
为了研究基因表达水平,我们使用RNA-seq的reads计算FPKM值。差异表达基因(deg)数量和功能注释信息如图5所示gydF4y2Ba4gydF4y2Ba和表SgydF4y2Ba4gydF4y2Ba,分别。在分析中,根据deg在不同处理阶段在萝卜中的表达模式,统计学上将其分为六个亚群(图5)gydF4y2Ba5gydF4y2Ba)。有趣的是,subcluster_1中的347个基因在转录组景观的PCA中表现出类似的趋势,值得进一步研究(图2)。gydF4y2Ba2gydF4y2Bab).因此,我们对subcluster_1中的deg进行了KEGG富集分析,以确定在冷冻过程中发挥重要作用的途径。显示了deg上调的前5条途径,以及与昼夜节律-植物、植物-病原体相互作用、多胺生物合成和精氨酸相关的主要途径(图2)。gydF4y2Ba2gydF4y2BaC),这可能表明它们参与了萝卜的抗冻性。在此,基于这些结果和多胺在冰冻胁迫中的作用,我们重点研究了多胺的合成途径(图2)。gydF4y2Ba2gydF4y2Bad)。通过qRT-PCR验证多胺途径中deg的表达水平(图2)。gydF4y2Ba2gydF4y2Bae)在这些基因中,gydF4y2BaBrrADC1, BrrADC2.1gydF4y2Ba,gydF4y2BaBrrADC2.2gydF4y2Ba,gydF4y2BaBrrAIH1.1gydF4y2Ba在冻结胁迫下连续积累,表现出与subcluster_1相似的趋势。这些与多胺合成有关的deg可能在提高萝卜抗冻性方面起着特殊的作用。gydF4y2Ba
冷冻处理后,腐胺在KTRG-B49中特异性富集gydF4y2Ba
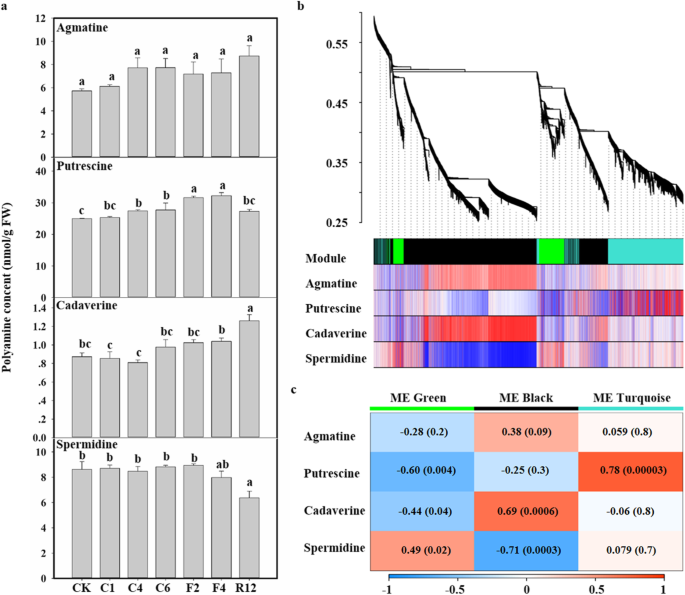
为了证实多胺途径与萝卜抗冻性有关,我们分析了KTRG-B49中多胺的积累。对多胺谱进行评估,重点是胍胺、腐胺、尸胺和亚精胺。如图所示。gydF4y2Ba3.gydF4y2Baa,与未冷冻应激组相比,冷冻处理过程中agmatine和亚精胺含量基本保持不变。冷冻处理显著提高了腐胺含量,其含量为25.34 ~ 32.27 nmol g-1 FW,高于对照处理(24.98 nmol g-1 FW)。在冷冻处理后12 h恢复期,尸胺含量虽然相对较低,但与CK组相比也有显著差异。因此,这些在冷冻处理后特异性增加的代谢物,尤其是腐胺,可能与KTRG-B49的抗冻能力有关。gydF4y2Ba
冷冻处理后多胺含量测定及模块特征基因加权基因共表达网络分析(WGCNA)和多胺代谢谱分析。gydF4y2Ba一个gydF4y2Ba萝卜冷冻处理后的胍丁胺、腐胺、尸胺、亚精胺含量。数值为5个生物重复的平均值。条形图表示SD。不同的符号表示处理之间的显著差异(gydF4y2BaPgydF4y2Ba< 0.05)。gydF4y2BabgydF4y2Ba表达基因的聚类树状图。采用动态分层树切法对基因模块进行识别,并以不同颜色显示。gydF4y2BacgydF4y2Ba对于每个模块,热图显示了模块特征基因(ME)与性状的相关性。每个矩形中的数字表示显著ME-trait关系的相关系数和Student 's渐近P值。底部的刻度条表示可能的相关性范围,从正(红色,1)到负(蓝色,-1)gydF4y2Ba
基因相关网络分析gydF4y2Ba
首先,通过WGCNA对转录组测序获得的3886个deg (FPKM≥1)的表达模式进行分析,并根据表达模式的相似性将其分为三个模块(图3)。gydF4y2Ba3.gydF4y2Bab).黑色、绿色、绿松石色各模块的独特基因数分别为2378、571、937。获得整个模块的基因表达谱(图5)gydF4y2Ba1gydF4y2Ba)。然后,分析各模块与性状之间的相关性,数据如图所示。gydF4y2Ba3.gydF4y2Bac.我们感兴趣的一个模块是绿松石模块;该模组与腐胺的相关系数最高,为0.78;gydF4y2BaPgydF4y2Ba-value = 0.00003),说明模块“Turquoise”与萝卜腐胺积累密切相关。为了进一步识别“绿松石”模块特征,我们使用KEGG通路分析进行深度分析(图S6)。METurqoise模块包含6个基因,并被发现参与“精氨酸和脯氨酸代谢”途径(ko0330, M00133)。在这些基因中,gydF4y2BaBrrADC2.2gydF4y2Ba(GenBank编号:MN630676)被发现参与多胺合成,且gydF4y2BaBrrADC2.2gydF4y2Ba冷冻处理下的表达与腐胺的积累一致。综合来看,这些结果表明gydF4y2BaBrrADC2.2gydF4y2Ba可能在萝卜冰冻胁迫下多胺合成中起关键作用,而gydF4y2BaBrrADC2.2gydF4y2Ba腐胺的表达和增加可能是萝卜耐冻性的关键。gydF4y2Ba
上游调控转录因子的鉴定gydF4y2BaBrrADC2.2gydF4y2Ba
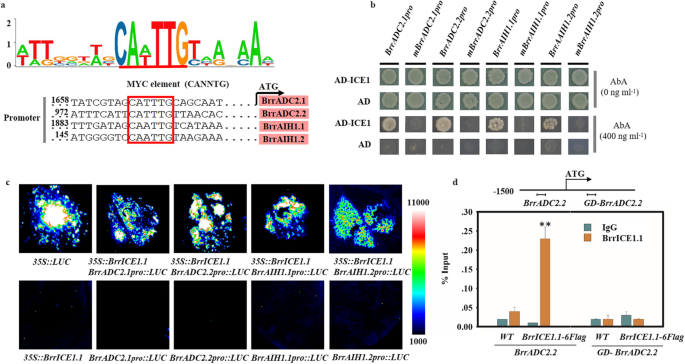
我们进行了酵母单杂交实验来筛选转录因子与gydF4y2BaBrrADC2.2gydF4y2Ba启动子为诱饵,萝卜cDNA文库为猎物,利用BLAST分析对阳性菌落进行部分测序和鉴定。最后,我们鉴定出agydF4y2Bab·拉伯gydF4y2Ba并命名为类似ice1的转录因子gydF4y2BaBrrICE1.1gydF4y2Ba(GenBank号码:MN630673)在我们的萝卜。BrrICE1.1具有定义典型bHLH转录因子所需的全套特征基序(图5)gydF4y2Ba7gydF4y2Ba)。此外,据报道ICE1能够特异性结合MYC识别序列(CANNTG)。因此,我们进一步分析的启动子区域gydF4y2BaBrrADC2.2gydF4y2Ba使用PlantCARE数据库(gydF4y2Bahttp://bioinformatics.psb.ugent.be/webtools/plantcare/html/gydF4y2Ba)。正如预期的那样,在ATG上游的1kb区域内存在一个潜在的MYC识别元件(CATTTG)(958-963)。gydF4y2Ba4gydF4y2Baa、表SgydF4y2Ba5gydF4y2Ba)。因此,我们推测BrrICE1.1与的启动子区CATTTG元件结合gydF4y2BaBrrADC2.2gydF4y2Ba对抗冻性起作用。此外,我们还分析了多胺途径中其他DEGs的启动子序列,以及另外6个DEGs (gydF4y2BaBrrADC1gydF4y2Ba, GenBank编号:MN630674;gydF4y2BaBrrADC2.1gydF4y2Ba, GenBank编号:MN630675;gydF4y2BaBrrAIH1.1gydF4y2Ba, GenBank编号:MN630677;gydF4y2BaBrrAIH1.2gydF4y2Ba, GenBank号码:MN630678;gydF4y2BaBrrSAMDC1.1gydF4y2Ba, GenBank编号:MN630679;gydF4y2BaBrrSPD2.1gydF4y2Ba, GenBank编号:MN630681)含有MYC识别元件(表5)gydF4y2Ba5gydF4y2Ba)。gydF4y2Ba
芜菁BrrICE1.1靶区的结合基序分析及BrrICE1.1与体内外多胺途径中差异表达基因启动子的相互作用分析。gydF4y2Ba一个gydF4y2BaBrrICE1.1的潜在myc结合位点(CANNTG)。BrrICE1.1的结合序列gydF4y2BaBrrAIH1.1gydF4y2Ba,gydF4y2BaBrrAIH1.2, BrrADC2.1gydF4y2Ba,gydF4y2BaBrrADC2.2gydF4y2Ba在红框中显示。gydF4y2BabgydF4y2Ba酵母单杂交实验表明,MYC元件介导BrrICE1.1与酵母的结合gydF4y2BaBrrAIH1.1gydF4y2Ba,gydF4y2BaBrrAIH1.2gydF4y2Ba,gydF4y2BaBrrADC2.1gydF4y2Ba,gydF4y2BaBrrADC2.2gydF4y2Ba发起人和发起人gydF4y2BaBrrAIH1.1gydF4y2Ba,gydF4y2BaBrrAIH1.2gydF4y2Ba,gydF4y2BaBrrADC2.1gydF4y2Ba,gydF4y2BaBrrADC2.2gydF4y2Ba对启动子进行突变(删除MYC元件)以单独取消MYC元件。实验重复了三次,结果都一样。gydF4y2BacgydF4y2BaBrrICE1.1激活的活动gydF4y2BaBrrAIH1.1gydF4y2Ba,gydF4y2BaBrrAIH1.2gydF4y2Ba,gydF4y2BaBrrADC2.1gydF4y2Ba,gydF4y2BaBrrADC2.2gydF4y2Ba体内。gydF4y2Ban benthamianagydF4y2Ba叶子。的代表形象gydF4y2Ban benthamianagydF4y2Ba示入渗72 h后的叶片。gydF4y2BadgydF4y2BaChIP实验gydF4y2BaBrrICE1.1-6flaggydF4y2Ba转基因发根。的结构gydF4y2BaBrrADC2.2gydF4y2Ba基因启动子。用于ChIP测定的引物序列区域在TSS左侧用一条水平线标记。对照引物序列(GD)位于TSS左侧。ChIP-qPCR显示BrrICE1.1与gydF4y2BaBrrADC2.2gydF4y2Ba体内启动子。WT和gydF4y2BaBrrADC2.2-GDgydF4y2Ba作为阴性对照。数据为三个重复的平均值±SD,星号表示与IgG(*)比较差异有统计学意义gydF4y2BaPgydF4y2Ba< 0.05, **gydF4y2BaPgydF4y2Ba< 0.01,学生gydF4y2BatgydF4y2Ba测试)gydF4y2Ba
BrrICE1.1在体外和体内结合多胺途径DEGs的启动子gydF4y2Ba
利用酵母单杂交系统检测BrrICE1.1与上述基因启动子MYC元件可能的相互作用。我们发现BrrICE1.1可以被激活gydF4y2BaBrrADC2.1pro: pAbAigydF4y2Ba,gydF4y2BaBrrADC2.2pro: pAbAigydF4y2Ba,gydF4y2BaBrrAIH1.1pro: pAbAigydF4y2Ba,gydF4y2BaBrrAIH1.2pro: pAbAigydF4y2Ba,而不是他们的突变体,这表明MYC元素,CATTTG位点为gydF4y2BaBrrADC2.1gydF4y2Ba和gydF4y2BaBrrADC2.2gydF4y2Ba和CAATTG网站gydF4y2BaBrrAIH1.1gydF4y2Ba和gydF4y2BaBrrAIH1.2gydF4y2Ba发起人是必要的gydF4y2BaBrrICE1.1gydF4y2Ba酵母中的结合(图2)gydF4y2Ba4gydF4y2Bab)。gydF4y2Ba
接下来,使用建立的瞬时表达试验gydF4y2Ban benthamianagydF4y2Ba我们进一步用以上四个基因验证了BrrICE1的转录激活活性(图2)。gydF4y2Ba4gydF4y2Bac).共表达gydF4y2Ba35 s:: BrrICE1.1gydF4y2Ba与gydF4y2BaBrrADC2.1pro::LUC, BrrADC2.2pro::LUC, BrrAIH1.1pro::LUC,gydF4y2Ba和gydF4y2BaBrrAIH1.2pro:卢克gydF4y2Ba可以检测到gydF4y2Ba卢克gydF4y2Ba活性,表明BrrICE1.1分别激活了它们的表达。此外,ChIP实验使用gydF4y2BaBrrICE1.1-6FlaggydF4y2Ba利用转基因发根和抗flag抗体在体内证实BrrICE1.1与这四个基因启动子的结合。qPCR结果显示,只有BrrICE1.1-6Flag蛋白能够免疫沉淀gydF4y2BaBrrADC2.2gydF4y2Ba包含CATTTG元素的启动子区域(与IgG和WT相比)。gydF4y2Ba4gydF4y2Ba然而,d)。gydF4y2BaBrrADC2.1gydF4y2Ba,gydF4y2BaBrrADC2.2gydF4y2Ba,gydF4y2BaBrrAIH1.1gydF4y2Ba和gydF4y2BaBrrAIH1.2gydF4y2Ba未被检测到。综上所述,这些数据表明BrrICE1.1可以直接结合的启动子gydF4y2BaBrrADC2.2gydF4y2Ba的CATTTG元素gydF4y2BaBrrADC2.2gydF4y2Ba启动子为BrrICE1.1的结合位点。gydF4y2Ba
转基因和RNAi发根显示出不同水平的gydF4y2BaBrrADC2.2gydF4y2Ba转录本和多胺gydF4y2Ba
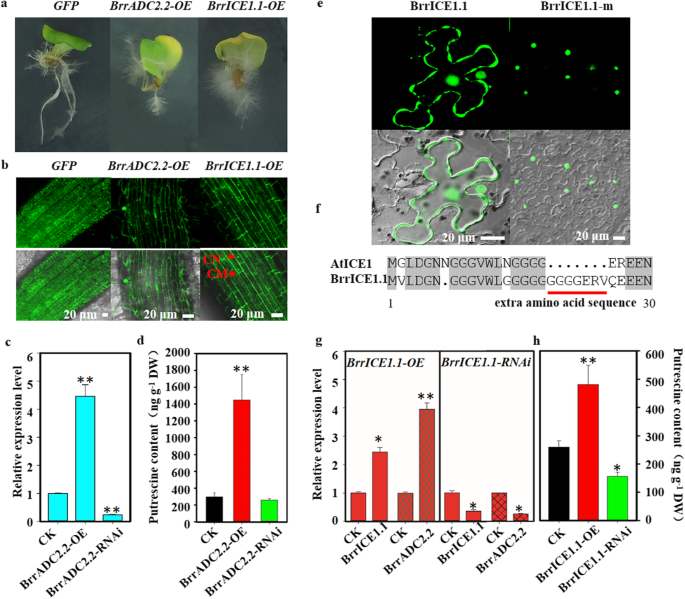
的效果gydF4y2BaBrrADC2.2gydF4y2Ba对腐胺合成的基因进行了进一步的验证gydF4y2Ba答:rhizogenesgydF4y2Ba-介导的萝卜子叶感染获得gydF4y2BaBrrADC2.2gydF4y2Ba转基因和RNAi毛状根(图。gydF4y2Ba5gydF4y2Baa).过表达毛状根的荧光gydF4y2BaBrrADC2.2-OEgydF4y2Ba通过激光共聚焦显微镜获得(图2)。gydF4y2Ba5gydF4y2Bab).此外,我们检测了gydF4y2BaBrrADC2.2gydF4y2Ba在gydF4y2BaBrrADC2.2-OEgydF4y2Ba和gydF4y2BaBrrADC2.2-RNAigydF4y2Ba采用qRT-PCR分析(图2)。gydF4y2Ba5gydF4y2Bac).的表达gydF4y2BaBrrADC2.2gydF4y2Ba有明显的上下调节吗gydF4y2BaBrrADC2.2-OEgydF4y2Ba和gydF4y2BaBrrADC2.2-RNAigydF4y2Ba发根分别与对照比较,说明gydF4y2BaBrrADC2.2gydF4y2Ba基因在根中成功表达。此外,转基因玉米的腐胺含量gydF4y2BaBrrADC2.2-OEgydF4y2BaLC-MS测得的含量显著高于对照组。正如所料,gydF4y2BaBrrADC2.2-RNAigydF4y2Ba降低腐胺含量(图2)。gydF4y2Ba5gydF4y2Bad)gydF4y2BaBrrADC2.2gydF4y2Ba表达水平和腐胺含量表明gydF4y2BaBrrADC2.2gydF4y2Ba在腐胺合成中起关键作用。gydF4y2Ba
转基因和RNAi毛状根中腐胺含量及表达的检测。gydF4y2Ba一个gydF4y2Ba毛根表型(GFP,对照;gydF4y2BaBrrADC2.2-OEgydF4y2Ba,过度表达gydF4y2BaBrrADC2.2gydF4y2Ba在发根;gydF4y2BaBrrICE1.1-OEgydF4y2Ba,过度表达gydF4y2BaBrrICE1.1gydF4y2Ba发根)。gydF4y2BabgydF4y2Ba激光共聚焦检测过表达gydF4y2Ba绿色荧光蛋白gydF4y2Ba,gydF4y2BaBrrADC2.2-OEgydF4y2Ba和gydF4y2BaBrrICE1.1-OEgydF4y2Ba在毛茸茸的根里。CN:细胞核,CM:细胞膜。Bar = 20 μm。gydF4y2Bac dgydF4y2Ba的表达水平gydF4y2BaBrrADC2.2gydF4y2Ba和腐胺含量gydF4y2BaBrrADC2.2-OEgydF4y2Ba转基因和gydF4y2BaBrrADC2.2-RNAigydF4y2Ba毛状根与对照相比。gydF4y2BaegydF4y2Ba激光共聚焦检测过表达gydF4y2BaBrrICE1.1gydF4y2Ba及其氨基酸序列突变体(brrice1.1 m)蛋白定位于gydF4y2Ban benthamianagydF4y2Ba叶子。Bar = 20 μm。gydF4y2BafgydF4y2BaAtICE1和BrrICE1.1蛋白n端结构(1-30)。红线表示BrrICE1.1蛋白中的单个肽。gydF4y2BaggydF4y2Ba的表达水平gydF4y2BaBrrICE1.1gydF4y2Ba和gydF4y2BaBrrADC2.2gydF4y2Ba在gydF4y2BaBrrICE1.1-OEgydF4y2Ba转基因发根(左)和gydF4y2BaBrrICE1.1gydF4y2Ba和gydF4y2BaBrrADC2.2gydF4y2Ba在gydF4y2BaBrrICE1.1-RNAigydF4y2Ba转基因发根(右)。gydF4y2BahgydF4y2Ba腐胺含量gydF4y2BaBrrICE1.1-OEgydF4y2Ba转基因和gydF4y2BaBrrICE1.1-RNAigydF4y2Ba多毛的根源。在gydF4y2BacgydF4y2Ba,gydF4y2BadgydF4y2Ba,gydF4y2BaggydF4y2Ba和gydF4y2BahgydF4y2Ba,数据为三个重复的平均值±SD,星号表示与CK(*)比较有显著差异gydF4y2BaPgydF4y2Ba< 0.05, **gydF4y2BaPgydF4y2Ba< 0.01,学生gydF4y2BatgydF4y2Ba测试)gydF4y2Ba
BrrICE1.1gydF4y2Ba直接监管gydF4y2BaBrrADC2.2gydF4y2Ba在腐胺合成中gydF4y2Ba
确定…的角色gydF4y2BaBrrICE1.1gydF4y2Ba在腐胺合成中,我们获得了转基因和RNAi毛状根(图2)。gydF4y2Ba5gydF4y2Baa). BrrICE1.1-GFP融合蛋白在毛根的膜和细胞核中发出绿色荧光信号(图2)。gydF4y2Ba5gydF4y2Bab).有趣的是,BrrICE1.1在萝卜中存在细胞膜定位,而在萝卜中不存在gydF4y2Ba拟南芥gydF4y2Ba(无花果。gydF4y2Ba5gydF4y2Bae(左)。为了探究萝卜BrrICE1.1的膜定位,我们分析了BrrICE1.1和AtICE1的氨基酸序列特征(图2)。gydF4y2Ba5gydF4y2Baf).我们发现BrrICE1.1的c端是保守的,而在n端有一个额外的氨基酸序列(GGGGERV)。我们推测这个氨基酸序列影响了BrrICE1.1的位置。因此,我们将其删除以测试BrrICE1.1的位置,我们惊讶地发现它的膜定位消失了,在gydF4y2Ban benthamianagydF4y2Ba叶子(图。gydF4y2Ba5gydF4y2Bae,右)。因此,这个额外的氨基酸序列确实是BrrICE1.1膜定位的原因。gydF4y2Ba
进一步比较了转基因、RNAi和WT毛状根的表达水平和腐胺含量。的表达水平gydF4y2BaBrrICE1.1gydF4y2Ba被略微上调了gydF4y2BaBrrADC2.2gydF4y2Ba在转基因gydF4y2BaBrrICE1.1-OEgydF4y2Ba毛状根与野生根比较,而在gydF4y2BaBrrICE1.1-RNAigydF4y2Ba毛状根比野生型低(图2)。gydF4y2Ba5gydF4y2Bag).关于腐胺含量,LC-MS测量显示,转基因系增加了腐胺的含量,而RNAi毛状根则减少了腐胺的含量(图2)。gydF4y2Ba5gydF4y2Bah).通过表达水平分析和腐胺含量分析可以看出gydF4y2BaBrrICE1.1gydF4y2Ba正向调节的表达gydF4y2BaBrrADC2.2gydF4y2Ba萝卜在冰冻胁迫下。gydF4y2Ba
外源施用腐胺及其抑制剂对萝卜抗冻性的影响gydF4y2Ba
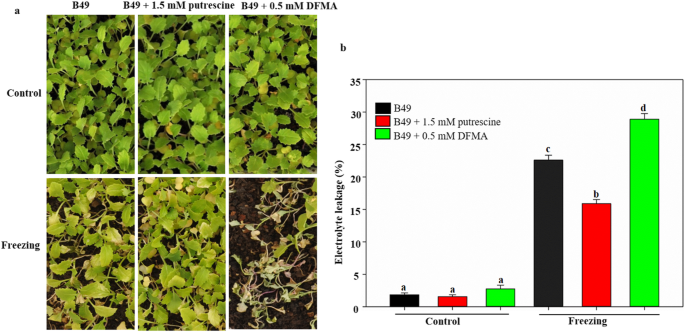
为了证实腐胺在萝卜抗冻性中的作用,我们在冷冻条件下分别对KTRG-B49施加外源腐胺和抑制剂(DFMA)(图2)。gydF4y2Ba6gydF4y2Ba)。在冷冻处理前,腐胺处理、抑制剂处理和对照植株的形态无明显变化。经冷冻处理后,经腐胺处理的植株受到的伤害明显小于对照,而经抑制剂处理的植株受到的伤害最为严重(图2)。gydF4y2Ba6gydF4y2Baa).为了进一步证实上述结果,我们用电解液泄漏量来测量冷冻处理后的植株。同样,经腐胺处理的叶片在冷冻处理后的电解质泄漏量明显降低(图2)。gydF4y2Ba6gydF4y2Bab).以上结果提示腐胺在萝卜耐冻性中起重要作用。gydF4y2Ba
低温胁迫增强了KTRG-B49的CBF信号通路gydF4y2Ba
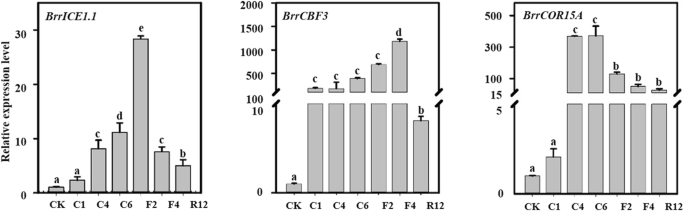
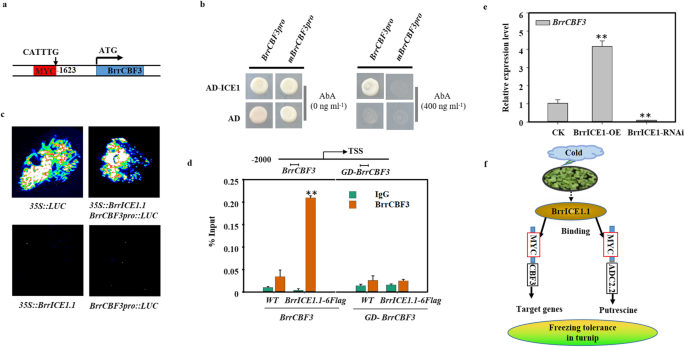
CBF代表了一个充分证明的途径,涉及植物的冷反应。为了阐明可能的信号转导,我们监测了gydF4y2BaBrrICE1.1gydF4y2Ba,gydF4y2BaBrrCBF3gydF4y2Ba下游gydF4y2BaBrrCOR15AgydF4y2Ba冰冻胁迫下萝卜的基因。我们观察到所有三个基因的升高,尽管在冷冻处理的所有时期都没有观察到显著性(图2)。gydF4y2Ba7gydF4y2Ba)。接下来,我们询问BrrICE1.1是否受到监管gydF4y2BaBrrCBF3gydF4y2Ba采用体内法和体外法。我们首先分析的启动子区域gydF4y2BaBrrCBF3gydF4y2Ba发现它在1623区域含有MYC识别元件(CATTTG)(图2)。gydF4y2Ba8gydF4y2Baa),因此,我们确认BrrICE1.1可以绑定到gydF4y2BaBrrCBF3gydF4y2Ba。事实上,Y1H实验显示BrrICE1.1可以激活gydF4y2BaBrrCBF3gydF4y2Ba箴gydF4y2Ba:: pAbAigydF4y2Ba提示BrrICE1.1的结合位点可能是CATTTG。删除CATTTG后,记者的BrrICE1.1激活被完全取消(gydF4y2BamBrrCBF3gydF4y2Ba箴gydF4y2Ba的CATTTG元素gydF4y2BaBrrCBF3gydF4y2Ba启动子是酵母中BrrICE1.1结合所必需的。gydF4y2Ba8gydF4y2Bab).因此,我们进行了LUC分析,以确定BrrICE1.1对含有基因的报告基因表达的影响gydF4y2BaBrrCBF3gydF4y2Ba启动子与LUC报告基因融合。我们发现的共表达gydF4y2Ba35 s:: BrrICE1.1gydF4y2Ba与gydF4y2BaBrrCBF3pro:卢克gydF4y2Ba导致LUC活性明显升高,说明BrrICE1.1激活了gydF4y2BaBrrCBF3gydF4y2Ba(无花果。gydF4y2Ba8gydF4y2Bac).为了证实这种效应,我们使用ChIP-qPCR分析。IgG抗体和WT作为对照,两组不同的引物,gydF4y2BaCBF3gydF4y2Ba含有CATTTG元素的启动子引物(gydF4y2BaBrrCBF3gydF4y2Ba),gydF4y2BaCBF3gydF4y2Ba基因背景引物(gydF4y2BaBrrCBF3-GDgydF4y2Ba),用于检测BrrICE1.1-6Flag免疫沉淀复合物。值得注意的是,gydF4y2BaBrrCBF3gydF4y2BaBrrICE1.1-6Flag免疫沉淀复合物中启动子引物富集显著增加(图2)。gydF4y2Ba8gydF4y2Bad).这一发现暗示BrrICE1.1直接调控gydF4y2BaBrrCBF3gydF4y2Ba。检查:检查…的功能gydF4y2BaBrrCBF3gydF4y2Ba和gydF4y2BaBrrICE1.1gydF4y2Ba,我们产生了gydF4y2BaBrrICE1。gydF4y2Ba1 .过表达与RNAi发根。过度的gydF4y2BaBrrICE1.1gydF4y2Ba导致了感应的增强gydF4y2BaBrrCBF3gydF4y2Ba基因,而表达水平gydF4y2BaBrrCBF3gydF4y2Ba在gydF4y2BaBrrICE1.1-RNAigydF4y2Ba发根(图2)gydF4y2Ba8gydF4y2Bae).这些调查表明gydF4y2BaBrrICE1.1gydF4y2Ba信号通路可能与cbf介导的萝卜抗冻性有关。gydF4y2Ba
BrrICE1.1绑定到gydF4y2BaBrrCBF3gydF4y2Ba启动子。gydF4y2Ba一个gydF4y2BaBrrICE1.1的潜在结合位点是MYC元件(CATTTG)gydF4y2BaBrrCBF3gydF4y2Ba启动子。gydF4y2BabgydF4y2Ba酵母单杂交实验表明,MYC元件介导BrrICE1.1与酵母的结合gydF4y2BaBrrCBF3gydF4y2Ba发起人和gydF4y2BaBrrCBF3gydF4y2Ba对启动子进行突变(删除MYC元件)以单独取消MYC元件。实验重复了三次,结果都一样。gydF4y2BacgydF4y2BaBrrICE1.1在体内激活BrrCBF3的结合活性;gydF4y2Ban benthamianagydF4y2Ba用阳性对照(gydF4y2Ba35个年代gydF4y2Ba::gydF4y2Ba卢克gydF4y2Ba)和阴性对照(gydF4y2Ba35 s:: BrrICE1.1gydF4y2Ba,gydF4y2BaBrrCBF3pro:卢克gydF4y2Ba),并检测到交互作用。的代表形象gydF4y2Ban benthamianagydF4y2Ba示入渗72 h后的叶片。gydF4y2BadgydF4y2BaChIP实验gydF4y2BaBrrICE1.1-6flaggydF4y2Ba转基因发根。的结构gydF4y2BaBrrCBF3gydF4y2Ba基因启动子。用于ChIP测定的引物序列区域在TSS左侧用一条水平线标记。对照引物序列(GD)位于TSS的左侧。ChIP-qPCR显示BrrICE1.1与gydF4y2BaBrrCBF3gydF4y2Ba体内启动子。WT和gydF4y2BaBrrCBF3-GDgydF4y2Ba作为阴性对照。gydF4y2BaegydF4y2Ba的表达式gydF4y2BaBrrCBF3gydF4y2Ba在gydF4y2BaBrrICE1.1-OEgydF4y2Ba和gydF4y2BaBrrICE1.1-RNAigydF4y2Ba转基因发根。gydF4y2BafgydF4y2Ba萝卜冷冻胁迫下BrrICE1.1调控网络。在gydF4y2BadgydF4y2Ba和gydF4y2BaegydF4y2Ba,数据为三个重复的平均值±SD,星号表示与对照比较有显著差异(*)gydF4y2BaPgydF4y2Ba< 0.05, **gydF4y2BaPgydF4y2Ba< 0.01,学生gydF4y2BatgydF4y2Ba测试)gydF4y2Ba
讨论gydF4y2Ba
低温限制了植物的生长和地理分布,因此在世界范围内每年都有因低温伤害造成的重大作物损失[gydF4y2Ba27gydF4y2Ba]。在青藏高原农区,作物生长季节的平均温度很低,极端温度已成为作物产量的限制因素之一。因此,有必要揭示作物在冰冻胁迫下的代谢和分子机制,这将有助于培育耐冻作物品种,从而减少生产损失。藏萝卜抗冻性好,适合在高寒地区栽培;该植物具有较强的抗冻性和对西藏气候的良好适应性[gydF4y2Ba26gydF4y2Ba]。在萝卜中,对冰冻胁迫的反应途径还没有系统的研究。分析萝卜对低温环境的适应性,有助于阐明萝卜耐冻性的分子机制,并为西藏地区萝卜育种提供建议。在我们的研究中,我们首次证明了萝卜KTRG-B49具有抗冻性,并在一定程度上阐明了西藏地区萝卜的抗冻性特征(图2)。gydF4y2Ba1gydF4y2Ba)。gydF4y2Ba
增加gydF4y2BaBrrADC2.2gydF4y2Ba表达与冷冻处理下腐胺的积累一致gydF4y2Ba
在低温胁迫下,植物的代谢和生理状态发生改变,并伴随着数千种基因表达的变化[gydF4y2Ba18gydF4y2Ba]。例如,多胺被认为是植物对低温反应的一个关键因素[gydF4y2Ba12gydF4y2Ba,gydF4y2Ba24gydF4y2Ba]。在本研究中,差异表达基因(DEGs)的表达谱分析与具有转录组背景的PCA分析类似,显示多胺途径富集(图2)。gydF4y2Ba2gydF4y2Baa, b, c,图5gydF4y2Ba4gydF4y2Ba)。此外,多胺,特别是腐胺(Put),已被认为在植物应对冷胁迫的能力中发挥重要作用[gydF4y2Ba6gydF4y2Ba]。在我们的研究中,游离腐胺在低温胁迫下继续快速特异性积累,达到较高水平(图2)。gydF4y2Ba3.gydF4y2Baa).此外,植物体内多胺含量可作为衡量其抗逆性的重要指标,因为富含多胺的植物通常具有较高的抗逆性[gydF4y2Ba9gydF4y2Ba,gydF4y2Ba13gydF4y2Ba,gydF4y2Ba28gydF4y2Ba,gydF4y2Ba29gydF4y2Ba]。但对胍丁胺和亚精胺含量无显著影响。类似结果表明,腐胺的下游产物亚精胺不随腐胺含量的增加而增加[gydF4y2Ba6gydF4y2Ba],另一项研究报告说,腐胺含量gydF4y2Ba答:芥gydF4y2Ba和gydF4y2BaThellungiella halophilagydF4y2Ba,但其前体在冷处理下无显著变化[gydF4y2Ba30.gydF4y2Ba]。因此,我们的研究表明,腐胺含量的特定增加可能与响应低温胁迫的胁迫信号密切相关,并可能减缓低温对萝卜的伤害,增强其抗冻性。gydF4y2Ba
多胺途径复杂,涉及许多关键酶[gydF4y2Ba1gydF4y2Ba,gydF4y2Ba6gydF4y2Ba],包括腐胺,由ODC一步合成或由ADC、AIH和CPA三步合成[gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba]。我们的WGCNA发现gydF4y2BaBrrADC2.2gydF4y2Ba随着腐胺含量的增加而增加,说明gydF4y2BaBrrADC2.2gydF4y2Ba参与了萝卜冷冻处理下内源腐胺的合成(图2)。gydF4y2Ba3.gydF4y2Bab, c)gydF4y2Ba拟南芥gydF4y2Ba,过度表达gydF4y2BaADC2gydF4y2Ba基因增加了转基因植物的抗冻性[gydF4y2Ba31gydF4y2Ba,gydF4y2Ba32gydF4y2Ba),gydF4y2Baadc2gydF4y2Ba外源施用腐胺可使突变体的抗冻能力恢复到野生型的水平[gydF4y2Ba14gydF4y2Ba]。有趣的是,gydF4y2BaADC2gydF4y2Ba还与渗透胁迫、伤害、光照、蔗糖、花发育、种子萌发和盐度有关[gydF4y2Ba31gydF4y2Ba,gydF4y2Ba32gydF4y2Ba,gydF4y2Ba33gydF4y2Ba,gydF4y2Ba34gydF4y2Ba,gydF4y2Ba35gydF4y2Ba]。因此,gydF4y2BaBrrADC2.2gydF4y2Ba-催化腐胺的合成可能会促进萝卜的抗冻性,这些结果为进一步研究萝卜抗冻性的分子机制提供了有用的信息gydF4y2BaBrrADC2.2gydF4y2Ba参与萝卜抗冻性研究。gydF4y2Ba
BrrICE1.1直接绑定到gydF4y2BaBrrADC2.2gydF4y2Ba启动子调节腐胺的合成gydF4y2Ba
目前,对二者调控关系的研究较少gydF4y2BaADCgydF4y2Ba还有其他基因。先前的研究只指出gydF4y2BaADC1gydF4y2Ba-相关腐胺途径在马铃薯的耐冷性中起重要作用,很可能是通过增强gydF4y2BaCBFgydF4y2Ba基因(gydF4y2Ba6gydF4y2Ba]。在目前的研究中,gydF4y2BaBrrADC2.2gydF4y2Ba被萝卜BrrICE1.1激活,通过体内和体外实验显示(图2)。gydF4y2Ba4gydF4y2Ba)。和过度表达gydF4y2BaBrrICE1.1gydF4y2Ba腐胺水平升高(图2)。gydF4y2Ba5gydF4y2Ba)。同时,过度表达gydF4y2BaPtrICE1gydF4y2Ba在酵母双杂交实验中,基于ADC与PtrICE1的相互作用,可以提高转基因系中精胺和精胺的水平gydF4y2Bap . trifoliatagydF4y2Ba。然而,目前尚不清楚是哪个多胺途径基因作用于PtrICE1调控多胺水平[gydF4y2Ba24gydF4y2Ba]。在植物对寒冷的响应过程中,ICE1通过特异性结合启动子区域的MYC元件对基因进行正向调节,在应对环境变化中起着关键作用,这被认为是ICE1的经典作用模式[gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba36gydF4y2Ba]。我们的结果是gydF4y2BaBrrADC2.2gydF4y2Ba和gydF4y2BaBrrICE1.1gydF4y2Ba转基因和RNAi根显示过表达腐胺含量增加gydF4y2BaBrrICE1.1gydF4y2Ba主要是由于BrrICE1.1与MYC元素的绑定gydF4y2BaBrrADC2.2gydF4y2Ba芜菁启动子区(图2)gydF4y2Ba5gydF4y2Ba)。并且,是否更大的激活还有待研究gydF4y2BaADCgydF4y2BaBrrICE1.1的转录后修饰,如sumo酰化和泛素化。因此,我们的数据表明,BrrICE1.1在腐胺合成中发挥了积极作用,可能是通过与gydF4y2Ba的BrrADC2.2gydF4y2Ba启动子。此外,叶面施用腐胺由于其作为生长调节剂的能力,能够调节植物的代谢和代谢产物的产生,参与胁迫耐受[gydF4y2Ba6gydF4y2Ba]。在我们的研究中,无论是外源施用腐胺还是其抑制剂,都进一步证实了腐胺在萝卜耐冻性中的作用(图2)。gydF4y2Ba6gydF4y2Ba)。gydF4y2Ba
BrrICE1.1蛋白细胞膜定位的原因gydF4y2Ba
值得注意的是,在我们的研究中,GFP-BrrICE1.1融合蛋白位于细胞膜和细胞核中(图2)。gydF4y2Ba5gydF4y2Bae, f),与GFP-AtICE1的核定位相反gydF4y2Ba拟南芥gydF4y2Ba[gydF4y2Ba20.gydF4y2Ba]。与AtICE1相比,通过删除BrrICE1.1蛋白的n端额外单肽(GGGGERV), BrrICE1.1蛋白的膜定位消失,表明该单肽影响了BrrICE1.1蛋白的定位。在芜菁中首次发现具有核位和细胞膜位的转录因子。更精确的细胞膜定位的生物学意义或作用有待进一步研究。在gydF4y2Ba拟南芥gydF4y2Ba,这种膜相关转录因子也被研究过(如gydF4y2BaNAC089gydF4y2Ba)。NAC089蛋白膜定位的存在保证了这一点gydF4y2Ba拟南芥gydF4y2Ba能对外界刺激作出快速的转录反应,并能在应激下从内质网转移到细胞认可的位点[gydF4y2Ba37gydF4y2Ba,gydF4y2Ba38gydF4y2Ba]。BrrICE1.1和AtICE1在细胞定位上的差异可能与植物物种的内在差异有关,这是未来研究的一个重要问题。这些发现为ICE1的功能和潜在机制提供了新的认识,并扩展了我们对复杂冷信号网络的理解。gydF4y2Ba
BrrICE1.1-BrrCBF3通路参与萝卜的冰冻胁迫gydF4y2Ba
在这里,我们无法排除除腐胺途径外的其他信号通路对萝卜抗冻性的贡献,因此我们试图将其与已知的冷冻胁迫相关信号通路联系起来。CBF调控途径是已知的最重要的途径之一,在许多物种的冷信号转导中起着关键作用[gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba39gydF4y2Ba,gydF4y2Ba40gydF4y2Ba,gydF4y2Ba41gydF4y2Ba]。在目前的研究中,冷冻胁迫导致CBF3和下游COR基因的诱导增强(图2)。gydF4y2Ba7gydF4y2Ba)。此外,BrrICE1.1被证明与的启动子结合gydF4y2BaBrrCBF3gydF4y2Ba在CATTTG站点(图2)gydF4y2Ba8gydF4y2Baa, b, c, d)。这一发现与gydF4y2Ba拟南芥gydF4y2Ba因为ICE1可以直接绑定到规范gydF4y2BaMYC独联体gydF4y2Ba中的-元素(CANNTG)gydF4y2BaCBF3gydF4y2Ba启动子(gydF4y2Ba20.gydF4y2Ba]。此外,在gydF4y2BaBrrCBF3gydF4y2Ba表达模式与发根一致,均为过表达和沉默gydF4y2BaBrrICE1.1gydF4y2Ba(无花果。gydF4y2Ba8gydF4y2BaE),暗示gydF4y2BaBrrICE1.1gydF4y2Ba起了积极的作用gydF4y2BaBrrCBF3gydF4y2Ba-介导的萝卜冻结信号。gydF4y2Ba
结论gydF4y2Ba
本研究的转录组学和靶向代谢组学分析为西藏萝卜的抗冻性提供了新的见解,基于这一结果,我们提出了一个参与萝卜冷冻过程的BrrICE1.1调控网络的工作模型(图2)。gydF4y2Ba8gydF4y2Baf).当萝卜遭受冰冻胁迫时,BrrICE1.1不仅可以通过ICE1-CBF通路调控下游靶基因参与萝卜冻害,还可以与gydF4y2BaBrrADCgydF4y2Ba2.2启动子调节腐胺的合成,从而参与萝卜冷冻调节。综上所述,调控细胞多胺含量是提高抗冻性的一种方便有效的方法。gydF4y2Ba
方法gydF4y2Ba
植物栽培、冷冻处理、电解液泄漏测量gydF4y2Ba
的种子gydF4y2Ba油菜,变种油菜gydF4y2Ba(KTRG-B49)来自中国科学院昆明植物研究所野生物种种质资源库,采自中国西藏昌都区巴苏县(N30°03′25.76″,E96°55′37.70″)。将收获的种子播种于育苗板中,在受控温室条件下(28°C昼/25°C夜,200 mmol光子m),适当浇水gydF4y2Ba−2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba光照强度,相对湿度75-80%)。对于冷冻处理,2周大的植株(每次试验约100株幼苗)按所述[gydF4y2Ba42gydF4y2Ba]。简单地说,将植株在4°C下孵育6小时。然后,温度依次降低2℃hgydF4y2Ba−1gydF4y2Ba直到达到- 2°C,并在- 2°C下保持2小时,在编程培养箱中保持- 4°C 1小时。接下来,将植株在4°C下保存12小时,然后返回温室条件下恢复,随后评估成活率。同时,以未经处理的植株为对照,其他条件不变。在冷冻0 h (CK)、4℃冷冻1 h (C1)、3 h (C4)、6 h (C6)、- 2℃冷冻2 h (F2)、- 4℃冷冻1 h (F4)、恢复12 h (R12)后采集叶片样品(随机化方法),立即在液氮中冷冻,然后在- 80℃保存。每次采集3株以上植物,每次采集重复3次,获得生物重复(3个生物重复包括3组单独的冷冻胁迫处理实验)。共有21份样本用于RNA-seq和代谢物分析。此外,根据先前描述的方法,使用电解质泄漏来评估每个采样时间的冷冻耐受性[gydF4y2Ba43gydF4y2Ba]。gydF4y2Ba
Illumina rna测序和数据分析gydF4y2Ba
从21个叶片样品中分离总RNA,纯化信使RNA (mRNA),通过片段缓冲产生短片段,合成第一链cDNA和第二链cDNA。提取双链cDNA片段,并与测序适配器连接。然后,用agcourt AMPure XP珠(Beckman Coulter, Inc.)分离合适的片段,用PCR扩增富集。利用Illumina HiSeq 2000系统对构建的cDNA文库进行末端100 bp的配对测序。本文报道的RNA-seq原始序列数据已存入NCBI (PRJNA667167),可在以下网址公开访问gydF4y2Bahttps://www.ncbi.nlm.nih.gov/bioproject/PRJNA667167gydF4y2Ba。gydF4y2Ba
使用perl脚本删除低质量的读取,例如只有适配器和未知(' N ' > 5%)或低质量的碱基(分数< 20),从而获得干净的读取。clean reads被映射到萝卜参考基因组[gydF4y2Ba44gydF4y2Ba使用TopHat 2.0.8程序[gydF4y2Ba45gydF4y2Ba]。使用DESeq R软件包(1.10.1)进行差异表达分析[gydF4y2Ba46gydF4y2Ba]。通过袖扣归一化(Cufflinks normalization),使用FPKM(每百万映射读取的外显子每千碱基片段数)来估计丰度差异(gydF4y2Bahttp://cufflinks.cbcb.umd.edu/gydF4y2Ba。以错误发现率(FDR)≤0.001和倍数变化≥4作为判断基因表达差异(DEG)显著性的阈值。使用BLASTx将序列与各种蛋白质数据库进行比较,包括NCBI非冗余蛋白(Nr)数据库,Swiss-Prot,截止e值为10gydF4y2Ba−5gydF4y2Ba。使用基因本体(GO)术语、COG数据库和KEGG通路对基因进行注释。gydF4y2Ba
RNA提取,实时定量PCR (qRT-PCR)gydF4y2Ba
总RNA提取、cDNA合成及qRT-PCR分析如前所述[gydF4y2Ba25gydF4y2Ba]。qRT-PCR所用引物见表SgydF4y2Ba1gydF4y2Ba。采用IBM SPSS Statistics 20.0软件进行统计学分析。gydF4y2Ba
代谢物提取和衍生化gydF4y2Ba
每个样品的等价物被精确称重并转移到离心管中。样品以500 μL乙腈:甲醇:水= 2:2:1(预冷- 20℃)提取,45 Hz涡旋匀浆4 min 30 s,冰水浴超声处理5 min。重复上述步骤3次,然后在- 20°C下孵育1 h,离心得到上清。取上清液200 μL进行LC-MS分析。UHPLC-MS/MS分析时,将100 μL的清上清(或标准溶液)转移到离心管中,在40℃黑暗条件下,与50 μL 20 mg/mL氯丹酰丙酮和50 μL 0.1 mol/L碳酸钠混合60 min。将丹酚衍生物加入50 μL 1%甲酸水溶液中,旋涡30 s, 4℃,12000 rpm离心15 min。取80 μL的清上清液转移到自动进样瓶中进行UHPLC-MS/MS分析。gydF4y2Ba
加权基因共表达网络分析(WGCNA)gydF4y2Ba
WGCNA使用R包(版本3.4.1)构建基因共表达网络。用于网络的FPKM值> 1的基因基于上述来自7个不同冷冻处理样本的RNA-seq数据,将每个生物和技术重复作为一个单独的数据集(共21个样本)。构造了一个阈值幂为10的拓扑重叠矩阵(图5)gydF4y2Ba1gydF4y2Ba),采用TOM相似度算法将邻接矩阵变换为拓扑重叠矩阵,以降低噪声和假相关。执行动态树切过程(mergeCutHeight = 0.25, minModuleSize = 30)来识别层次聚类树中的相似模块。聚类树的不同分支代表不同的基因模块。如果鉴定为同一模块,那么模块内这些基因之间的关系就比较密切。将每个模块基因表达谱的加权平均值定义为模块特征基因(ME)。MEs与应激刺激的相关热图显示了各模块与给定性状之间的关系。该性状与该模块相关性较高,说明该性状可能与该模块的基因功能有关。gydF4y2Ba
酵母单杂交(Y1H)筛选gydF4y2Ba
Y1H实验采用Matchmaker™金酵母单杂交文库筛选系统(Clontech)进行。的启动子区(起始密码子上游2000 bp)gydF4y2BaBrrADC2.2gydF4y2Ba被克隆到了gydF4y2BapAbAigydF4y2Ba载体为诱饵,转化为Y1HGold。在不含Ura的SD培养基上对金黄色葡萄球菌进行耐药试验(SD/Ura + AbA)。然后,对芜菁的cDNA库进行了smai线性化处理gydF4y2BapGADT7-RecADgydF4y2Ba将克隆载体共转化到已创建的Y1HGold菌株中。用酵母集落PCR筛选阳性克隆,PCR产物测序分析。gydF4y2Ba
对于酵母单杂交验证试验,启动子gydF4y2BaBrrADC1gydF4y2Ba,gydF4y2BaBrrADC2.1gydF4y2Ba,gydF4y2BaBrrADC2.2gydF4y2Ba,gydF4y2BaBrrAIH1.1gydF4y2Ba,gydF4y2BaBrrAIH1.2, BrrSAMDC1.1gydF4y2Ba,gydF4y2BaBrrSPD2.1gydF4y2Ba和gydF4y2BaBrrCBF3gydF4y2Ba也分别克隆到了gydF4y2BapAbAigydF4y2Ba向量的CDSgydF4y2BaBrrICE1.1gydF4y2Ba被亚克隆到gydF4y2BapGADT7gydF4y2Ba向量。为了产生这些具有突变的启动子,使用TaKaRa MutanBEST试剂盒使用定点突变来删除这些启动子的CANNTG基序。酵母单杂交检测使用Frozen-EZ酵母转化II试剂盒(Zymo Research, Irvine, CA, USA)。在不含Ura的SD培养基上对金黄色葡萄球菌进行耐药试验(SD/Ura + AbA)。在SD(−Ura /Leu + AbA)培养基上选择dna -蛋白相互作用。本研究使用的引物如表5所示gydF4y2Ba1gydF4y2Ba。gydF4y2Ba
中的瞬时表达测定gydF4y2Ba烟草benthamianagydF4y2Ba叶子gydF4y2Ba
的gydF4y2Ba荧光素酶gydF4y2Ba基因(gydF4y2Ba卢克gydF4y2Ba)序列重组为空向量gydF4y2BaPRI101-AN-FlaggydF4y2Ba阳性对照质粒gydF4y2Ba35 s:: luciferase-6FlaggydF4y2Ba获得了。的gydF4y2BaBrrADC2.1pro::LUC, BrrADC2.2 pro::LUC, BrrAIH1.1pro::LUC, BrrAIH1.2pro::LUCgydF4y2Ba和gydF4y2BaBrrCBF3pro:卢克gydF4y2Ba报告基因构建是用一个大约2000 bp的启动子序列与基因融合而成的gydF4y2Ba卢克gydF4y2Ba报告基因利用HindIII和SalI位点gydF4y2BapRI101-AN DNAgydF4y2Ba向量。本次实验使用的所有引物列于表SgydF4y2Ba1gydF4y2Ba。使用了类似的方法来生成gydF4y2Ba35 s:: BrrICE1.1-6FlaggydF4y2Ba构造。的gydF4y2Ba35 s:: BrrICE1.1-6FlaggydF4y2Ba质粒与gydF4y2Ba职业:卢克gydF4y2Ba报告基因导入gydF4y2Ba烟草benthamianagydF4y2Ba叶子使用gydF4y2Ba根癌土壤杆菌gydF4y2BaEHA105压力。然后,利用Tanon 5200自动化学发光图像分析系统(Tanon, Shanghai, China)采集浸润植物的LUC图像并确定其发光强度。至少评估了5个独立的LUC定量,结果相似。gydF4y2Ba
农杆菌属rhizogenesgydF4y2Ba介导的转换gydF4y2Ba
的信用违约掉期gydF4y2BaBrrICE1.1gydF4y2Ba和gydF4y2BaBrrADC2.2gydF4y2Ba它们的反向互补序列被克隆到gydF4y2BaPRI101-AN-FlaggydF4y2Ba向量。然后,将这些构念分别转移到gydF4y2Ba答:rhizogenesgydF4y2BaLBA9402电穿孔[gydF4y2Ba47gydF4y2Ba]。采用子叶侵染法将上述基因转化为萝卜根茎,采用qRT-PCR和LC-MS分别提取萝卜根茎中上述基因的表达量和腐胺含量,并进行分析。转基因的发根gydF4y2BaBrrICE1.1-6FlaggydF4y2Ba也用于染色质免疫沉淀(ChIP)测定。本研究使用的引物如表5所示gydF4y2Ba1gydF4y2Ba。gydF4y2Ba
芯片分析gydF4y2Ba
ChIP实验按描述进行,只做了轻微修改[gydF4y2Ba48gydF4y2Ba]。简单地说,2ggydF4y2BaBrrICE1.1-6FlaggydF4y2Ba转基因毛根和空根gydF4y2Ba六旗gydF4y2Ba载体(WT)毛状根在1%甲醛缓冲液中交联。提取固定根,洗涤纯化细胞核。细胞核悬浮在溶核缓冲液中,染色质溶液超声剪切DNA(冷冻保存,超声时间30 s,间隔时间30 s, 30次,功率400 w, JY92-2)。将SDS浓度为0.1%的超声混合液加入ChIP稀释缓冲液中,用DYKDDDDK Tag (D6W5B) rabbit mAb兔单抗孵育(与Sigma的Anti-FLAG M2具有相同的表位)gydF4y2Ba®gydF4y2Ba抗体)和阴性对照抗体lgG。用平衡蛋白A + G磁珠(LOT: 2923270)孵育收集蛋白质- dna复合物。然后,将蛋白- dna复合物洗净,用ChIP洗脱缓冲液孵育释放蛋白- dna复合物。然后用5 M NaCl进行反交联。纯化免疫沉淀DNA后,进行qPCR检测gydF4y2BaBrrADC2.1 / BrrADC2.2 BrrAIH1.1 / BrrAIH1.2 / BrrCBF3gydF4y2Ba启动子片段水平。基因体(GD)引物也作为对照。所使用的引物如表5所示gydF4y2Ba1gydF4y2Ba。gydF4y2Ba
亚细胞定位gydF4y2Ba
亚细胞定位测定在gydF4y2Ban benthamianagydF4y2Ba叶子。的编码序列(CDS)gydF4y2BaBrrICE1.1gydF4y2Ba被克隆并融合成二进制向量gydF4y2BaPRI101-AN DNAgydF4y2Ba用绿色荧光蛋白(GFP)驱动gydF4y2Ba花椰菜花叶病毒35SgydF4y2Ba启动子,形成gydF4y2Ba35 s:: BrrICE1.1-GFPgydF4y2Ba构造。此外,我们删除了上多余的氨基酸序列(GGGGERV)gydF4y2BaBrrICE1.1-GFPgydF4y2Ba构造后送上海通用生物科技有限公司合成获得gydF4y2BaBrrICE1.1-m-GFPgydF4y2Ba构造。gydF4y2Ba农gydF4y2Ba携带感兴趣构念的EHA105被渗透gydF4y2Ban benthamianagydF4y2Ba叶子。如前所述获得荧光图像[gydF4y2Ba25gydF4y2Ba]。所使用的引物列于表5gydF4y2Ba1gydF4y2Ba。gydF4y2Ba
外源性腐胺及其抑制剂DL-α-(二氟甲基)精氨酸的应用gydF4y2Ba
在冷冻条件下,分别向KTRG-B49施用外源腐胺及其抑制剂(DFMA),研究腐胺对萝卜抗冻性的影响。这些实验在前面有描述[gydF4y2Ba49gydF4y2Ba]。2周龄植株分别喷洒1.5 mM腐胺和0.5 mM DFMA,每天1次,连用3 d,对照用水。溶液中均添加0.01% (v/v)的Tween 20作为洗涤剂。在4℃条件下培养6 h。然后,温度依次降低2℃hgydF4y2Ba−1gydF4y2Ba直到达到- 2°C,在- 2°C下保持2小时,在- 4°C下保持1小时,在- 6°C下保持2小时。然后,将植株在4°C下保存12 h,然后用叶片测量电解质泄漏。gydF4y2Ba
数据和材料的可用性gydF4y2Ba
本研究中生成或分析的数据集包含在这篇发表的文章及其附加文件中。21份样本的所有转录组数据已存入NCBI, SRA登录号为PRJNA667167 (gydF4y2Bahttps://www.ncbi.nlm.nih.gov/bioproject/PRJNA667167gydF4y2Ba)。gydF4y2Ba
缩写gydF4y2Ba
- BrrICE1.1:gydF4y2Ba
-
CBF表达诱导剂gydF4y2Ba
- BrrCBF:gydF4y2Ba
-
c -重复结合因子;gydF4y2Ba
- BrrADC2.2:gydF4y2Ba
-
精氨酸脱羧酶基因gydF4y2Ba
- 林后:gydF4y2Ba
-
Cold-regulatedgydF4y2Ba
- ADC:gydF4y2Ba
-
精氨酸脱羧酶gydF4y2Ba
- ODC:gydF4y2Ba
-
内在的脱羧酶gydF4y2Ba
- AIH:gydF4y2Ba
-
胍基丁胺iminohydrolasegydF4y2Ba
- 注册会计师:gydF4y2Ba
-
N-carbamoylputrescine酰胺水解酶gydF4y2Ba
- 法拉第笼:gydF4y2Ba
-
亚精胺合成酶gydF4y2Ba
- spm:gydF4y2Ba
-
精胺合成酶gydF4y2Ba
- 山姆:gydF4y2Ba
-
S-adenosylmethioninegydF4y2Ba
- DFMA:gydF4y2Ba
-
DL -α- (Difluoromethyl)精氨酸gydF4y2Ba
- RNA:gydF4y2Ba
-
核糖核酸gydF4y2Ba
- 互补脱氧核糖核酸:gydF4y2Ba
-
互补脱氧核糖核酸gydF4y2Ba
- RNA-seq:gydF4y2Ba
-
核糖核酸测序gydF4y2Ba
- FPKM:gydF4y2Ba
-
每百万次映射读取的外显子每千碱基的片段数gydF4y2Ba
- 主成分分析:gydF4y2Ba
-
主成分分析gydF4y2Ba
- 度:gydF4y2Ba
-
差异表达基因gydF4y2Ba
- KEGG:gydF4y2Ba
-
京都基因和基因组百科全书gydF4y2Ba
- 存在:gydF4y2Ba
-
Quantitativereal-time PCRgydF4y2Ba
- WGCNA:gydF4y2Ba
-
加权基因共表达相关网络分析gydF4y2Ba
- 英国石油公司:gydF4y2Ba
-
碱基对gydF4y2Ba
参考文献gydF4y2Ba
- 1.gydF4y2Ba
李建军,李建军,李建军,等。植物多胺对非生物胁迫的响应。植物物理学报,2013;35(7):2015-36。gydF4y2Ba
- 2.gydF4y2Ba
Alcázar R, Marco F, Cuevas j, Patron M, Ferrando A, Carrasco P, Tiburcio AF . Altabella T.多胺在植物非生物胁迫响应中的作用。生物技术通讯。2006;28(23):1867-76。gydF4y2Ba
- 3.gydF4y2Ba
刘建军,刘建军,刘建军,等。多胺代谢的研究进展。植物物理学报。1997;100(3):664-74。gydF4y2Ba
- 4.gydF4y2Ba
Valero D, martinnez - romero D, Serrano Ma:多胺在提高水果保质期中的作用。食品科技动态,2002,13(6-7):228-234。gydF4y2Ba
- 5.gydF4y2Ba
张建军,张建军,张建军,等。多胺类化合物的研究进展。植物科学,1999;140(2):103-25。gydF4y2Ba
- 6.gydF4y2Ba
寇松,陈丽,涂伟,Scossa F,王勇,刘健,Fernie AR,宋斌,谢超。精氨酸脱羧酶基因gydF4y2BaADC1gydF4y2Ba转录组学和代谢组学分析显示,与腐胺途径相关的一个基因在马铃薯的冷驯化抗冻性中起重要作用。植物学报,2018;36(6):1283-98。gydF4y2Ba
- 7.gydF4y2Ba
A.热胁迫和亚精胺对番茄叶绿素荧光的影响。生物化学学报,2001;44(1):53 - 57。gydF4y2Ba
- 8.gydF4y2Ba
[Alcázar]王晓明,王晓明,王晓明,等。水分胁迫下植物多胺代谢与脱落酸的关系gydF4y2Ba拟南芥gydF4y2Ba。植物物理学报,2006;28(3):448-55。gydF4y2Ba
- 9.gydF4y2Ba
Urano K, Yoshiba Y, Nanjo T, Igarashi Y, Seki M, Sekiguchi F, Yamaguchi-Shinozaki K, Shinozaki KgydF4y2Ba拟南芥gydF4y2Ba在非生物胁迫反应和发育阶段参与多胺生物合成的基因。植物学报,2003;26(11):1917-26。gydF4y2Ba
- 10.gydF4y2Ba
李建军,李建军,李建军,等。寄生虫感染与健康人群多胺谱分析gydF4y2BaVaccinium myrtillusgydF4y2Ba氮富集下的植物。化学学报,2005;31(3):561-75。gydF4y2Ba
- 11.gydF4y2Ba
ryider J, Hacker A, Mackintosh C, Pegg A, Woster P, Casero RA。精胺和亚精胺对过氧化氢引起的氧化损伤起保护作用。氨基酸学报,2007;33(2):231-40。gydF4y2Ba
- 12.gydF4y2Ba
Palma F, Carvajal F, Ramos JM, Jamilena M, Garrido D.施用腐胺对冷藏西葫芦果实品质维持的影响:GABA转运及其他相关氮代谢产物的贡献。中国生物医学工程学报,2015;39(9):1390 - 1390。gydF4y2Ba
- 13.gydF4y2Ba
何丽娟,何丽娟,李建平,李建平,等。转基因植物亚精胺合成酶基因的表达及其对多种环境胁迫的抗性gydF4y2Ba拟南芥gydF4y2Ba。植物生理学报,2004;45(6):712-22。gydF4y2Ba
- 14.gydF4y2Ba
Cuevas JC, López-Cobollo R, Alcázar R, Zarza X, Koncz C, Altabella T, Salinas J, Tiburcio AF, Ferrando A.腐胺参与gydF4y2Ba拟南芥gydF4y2Ba低温条件下通过调控脱落酸水平的抗冻性和冷驯化。植物生理学报,2009;38(2):1094 - 1095。gydF4y2Ba
- 15.gydF4y2Ba
程丽,邹颖,丁森,张健,于新,曹军,吕刚。转基因番茄多胺积累增强了对高温胁迫的耐性。植物遗传学报,2009;31(5):489 - 498。gydF4y2Ba
- 16.gydF4y2Ba
长期施用腐胺可提高盐敏水稻的产量。植物学报。2007;29(1):225-38。gydF4y2Ba
- 17.gydF4y2Ba
李天明,鲁华生,朱晨。脱落酸在水稻抗寒性中的作用(gydF4y2Ba栽培稻gydF4y2Bal .)幼苗。: II。调节游离多胺水平。植物科学,1997;26(1):1 - 10。gydF4y2Ba
- 18.gydF4y2Ba
朱军,朱建奎。冷胁迫对植物基因表达的调控。植物科学进展,2007;12(10):444-51。gydF4y2Ba
- 19.gydF4y2Ba
郭晓,刘东,钟凯。植物冷信号转导及其调控机制。植物学报,2018;60(9):745 - 756。gydF4y2Ba
- 20.gydF4y2Ba
李宝华,洪鑫,Agarwal M,朱建奎。ICE1:一个冷诱导转录组和抗冻性的调节因子gydF4y2Ba拟南芥gydF4y2Ba。基因工程学报,2003;17(8):1043-54。gydF4y2Ba
- 21.gydF4y2Ba
托莱多-奥尔蒂斯G, Huq E,鹌鹑博士gydF4y2Ba拟南芥gydF4y2Ba基本/螺旋-环-螺旋转录因子家族。植物学报。2003;15(8):1749-70。gydF4y2Ba
- 22.gydF4y2Ba
赵国强,赵国强,赵国强。冷感应gydF4y2Ba拟南芥CBFgydF4y2Ba基因涉及多种gydF4y2Ba冰gydF4y2Ba(CBF表达的诱导剂)启动子元件和低温脱敏的冷调节回路。植物生理学报,2003;33(2):991 - 998。gydF4y2Ba
- 23.gydF4y2Ba
陈毅,蒋军,宋安,陈生,单华,罗华,顾超,孙杰,朱磊,方伟gydF4y2Ba菊花二色素CdICE1拟南芥gydF4y2Ba通过miR398。中国生物医学工程学报,2013;11(1):121。gydF4y2Ba
- 24.gydF4y2Ba
黄新祥,张强,朱东,付霞,王敏,张强,森口涛,刘建辉。ICE1的gydF4y2Ba枳壳trifoliatagydF4y2Ba通过与精氨酸脱羧酶相互作用调节多胺水平,在耐寒性中起作用。实验学报,2015;66(11):3259-74。gydF4y2Ba
- 25.gydF4y2Ba
尹鑫,王强,陈强,向宁,杨燕,杨勇。萝卜钙调磷酸酶b样蛋白和钙调磷酸酶b样蛋白相互作用蛋白激酶基因家族的全基因组鉴定及功能分析(英文)gydF4y2Ba油菜,变种油菜gydF4y2Ba)。植物科学,2017;8:1191。gydF4y2Ba
- 26.gydF4y2Ba
郑艳,罗丽,刘艳,杨艳,王超,孔霞,杨艳。春化对西藏萝卜块茎和开花的影响与基因表达的变化有关gydF4y2Ba方法gydF4y2Ba同系物。植物潜水,2018;40(2):50-6。gydF4y2Ba
- 27.gydF4y2Ba
Hayashi T, Yamaguchi T, Nakayama K, Koike S.高氮供应对水稻幼小孢子期冷敏感性的影响[j]。gydF4y2Ba栽培稻gydF4y2BaL.):成熟花药基因表达分析。植物生产科学,2009;12(3):271-7。gydF4y2Ba
- 28.gydF4y2Ba
史慧,陈哲。多胺途径调控植物非生物胁迫耐受性的研究。植物学报,2014,35(2):394 - 394。gydF4y2Ba
- 29.gydF4y2Ba
宋艳,刁强,齐华。腐胺增强番茄耐冷性(gydF4y2BaLycopersicon esculentumgydF4y2Ba通过调节抗氧化系统。植物物理学报,2014;36(11):3013-27。gydF4y2Ba
- 30.gydF4y2Ba
Benina M, Obata T, Mehterov N, Ivanov I, Petrov V, Toneva V, Fernie AR, geechev TS.比较代谢谱gydF4y2BaHaberlea rhodopensisgydF4y2Ba,gydF4y2BaThellungiella halophylagydF4y2Ba,gydF4y2Ba拟南芥gydF4y2Ba暴露在低温下。植物科学,2013;4:499。gydF4y2Ba
- 31.gydF4y2Ba
Alcázar R, Planas J, Saxena T, Zarza X, Bortolotti C, Cuevas J, Bitrián M, Tiburcio AF, Altabella T.腐胺积累对转基因抗旱性的影响gydF4y2Ba拟南芥gydF4y2Ba过表达同源基因的植物gydF4y2Ba精氨酸脱羧酶gydF4y2Ba基因。植物生理与生物化学,2010;48(7):547-52。gydF4y2Ba
- 32.gydF4y2Ba
Alcázar R, García-Martínez JL, Cuevas JC, Tiburcio AF, Altabella T.gydF4y2BaADC2gydF4y2Ba在gydF4y2Ba拟南芥gydF4y2Ba由于GA缺乏导致侏儒症和晚花。植物学报,2005;43(3):425-36。gydF4y2Ba
- 33.gydF4y2Ba
李建军,李建军,李建军,李建军,等。精氨酸脱羧酶基因表达的研究进展gydF4y2BaADC1gydF4y2Ba和gydF4y2BaADC2gydF4y2Ba在gydF4y2Ba拟南芥gydF4y2Ba:种子萌发和幼苗发育过程中的转录调控特征。植物学报,2004;32(3):519 - 531。gydF4y2Ba
- 34.gydF4y2Ba
李建军,张建军,李建军,等。多胺类化合物在甘薯抗阿特拉津化学胁迫中的作用gydF4y2Ba拟南芥gydF4y2Ba。植物学报,2019;38(1):1 - 11。gydF4y2Ba
- 35.gydF4y2Ba
Podlešáková K, Ugena L, Spíchal L, Doležal K, De Diego N.植物激素和多胺对GABA通路的调控。生物工程学报,2019;48:53-65。gydF4y2Ba
- 36.gydF4y2Ba
魏东,刘敏,陈红,郑艳,刘艳,王欣,杨生,周明,林杰:CBF诱导因子1表达是影响花药脱水的雄性育性调节因子gydF4y2Ba拟南芥gydF4y2Ba。科学通报,2018;14(10):e1007695。gydF4y2Bahttps://doi.org/10.1371/journal.pgen.1007695gydF4y2Ba。gydF4y2Ba
- 37.gydF4y2Ba
金世义,金绍成,金永义,徐培杰,裴敏,尹洪,朴志明。探索膜相关gydF4y2Ba南汽gydF4y2Ba转录因子gydF4y2Ba拟南芥gydF4y2Ba膜生物学在基因组调控中的意义。核酸学报,2007;35(1):203-13。gydF4y2Ba
- 38.gydF4y2Ba
杨振涛,王俊杰,孙磊,卢世杰,毕德良,孙磊,宋志涛,张世生,周顺生,刘建新。膜相关转录因子gydF4y2BaNAC089gydF4y2Ba调控内质网应激诱导的植物程序性细胞死亡。科学通报,2014;10(3):e1004243。gydF4y2Ba
- 39.gydF4y2Ba
董春华,Agarwal M,张勇,谢强,朱建奎。植物冷响应的负调控因子ho1是一个介导ICE1泛素化和降解的环E3连接酶。中国科学:自然科学进展,2006;30(2):1 - 6。gydF4y2Ba
- 40.gydF4y2Ba
丁艳,李华,张欣,谢强,龚忠,杨松。OST1激酶通过增强冰激子1的稳定性调控水稻的抗冻性gydF4y2Ba拟南芥gydF4y2Ba。生态学报,2015;32(3):278-89。gydF4y2Ba
- 41.gydF4y2Ba
史艳,丁艳,杨松。冷驯化过程中植物激素与冷信号转导的相互作用。植物生理学报,2014;56(1):7-15。gydF4y2Ba
- 42.gydF4y2Ba
赵超,王鹏,司涛,徐春春,王磊,Zayed O,于忠,朱勇,董军,陶华。MAP激酶级联通过调节ICE1蛋白的稳定性来调节冷反应。生态学报,2017;43(5):618-29。gydF4y2Ba
- 43.gydF4y2Ba
李建军,李建军,李建军,等。水稻幼苗对盐胁迫的抗氧化反应。植物科学,1998;35(1):1 - 9。gydF4y2Ba
- 44.gydF4y2Ba
林凯,张宁,谢文华,Nijveen H,程峰,Visser RG,王晓,de Ridder D, Bonnema G.三种基因组变异的比较和功能注释gydF4y2Ba芸苔属植物拉伯gydF4y2Ba基因组:一个萝卜,一个快速循环和一个白菜。生物医学工程学报,2014;15(1):250。gydF4y2Ba
- 45.gydF4y2Ba
trappnell C, Roberts A, Goff L, Pertea G, Kim D, Kelley DR, Pimentel H, Salzberg SL, Rinn JL, Pachter L. TopHat和袖链的差异基因和转录本表达分析。地理学报,2012;7(3):562。gydF4y2Ba
- 46.gydF4y2Ba
Love MI, Huber W, Anders S.使用DESeq2对RNA-seq数据的折叠变化和离散度进行调节估计。基因工程学报,2014;15(12):550。gydF4y2Ba
- 47.gydF4y2Ba
Basu A, Joshi RK, Jha S.白桦的遗传转化gydF4y2Ba农杆菌属rhizogenesgydF4y2Ba菌株lba9402及其转化根线特性。植物组织培养技术。2015;25(1):21-35。gydF4y2Ba
- 48.gydF4y2Ba
刘建军,刘建军,李建军,李建军,等。植物细胞染色质的研究进展。植物学报,2004;39(5):776 - 789。gydF4y2Ba
- 49.gydF4y2Ba
Phornvillay S, Pongprasert N, Wongs-Aree C, Uthairatanakij A, Srilaong V.外源腐胺处理延缓秋葵荚冷伤的发生[j]。gydF4y2Ba现esculentusgydF4y2Ba),贮存温度低。植物科学学报,2019;56(6):1085。gydF4y2Bahttps://doi.org/10.1016/j.scienta.2019.108550gydF4y2Ba。gydF4y2Ba
致谢gydF4y2Ba
作者感谢实验室所有学生成员的技术协助。gydF4y2Ba
资金gydF4y2Ba
本研究得到了中国科学院战略重点研究项目“绿色丝绸之路泛第三极环境研究”(批准号:XDA2004010306),国家自然科学基金重大项目(31590820、31590823),国家自然科学基金(31601999、41771123),中国科学院西光基金(to YQY),中国科学院信息化“十三五”规划项目(批准号:XDA2004010306);XXH13506。资助者在研究的设计、数据的收集、分析和解释以及撰写手稿方面没有任何作用。gydF4y2Ba
作者信息gydF4y2Ba
从属关系gydF4y2Ba
贡献gydF4y2Ba
设计实验:YQY, YPY, XY。进行实验:XY, YLV, YLI, DY。分析数据:YQY, XY。提供的试剂/材料/分析工具:XY, YQY, YLY。论文写的是:XY。所有作者都阅读并批准了稿件。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
伦理批准并同意参与gydF4y2Ba
不适用。gydF4y2Ba
发表同意书gydF4y2Ba
不适用。gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者宣称他们没有竞争利益。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba
施普林格·自然对已出版的地图和机构关系中的管辖权要求保持中立。gydF4y2Ba
补充信息gydF4y2Ba
附加文件1:图S1。gydF4y2Ba
权力价值的决定。gydF4y2Ba一个gydF4y2Ba横轴表示不同的功率值。gydF4y2BabgydF4y2Ba不同功率值下的平均网络连通性。gydF4y2BacgydF4y2Ba网络热图,整个模块的基因表达谱。gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议,该协议允许以任何媒介或格式使用、共享、改编、分发和复制,只要您适当地注明原作者和来源,提供知识共享许可协议的链接,并注明是否进行了更改。本文中的图像或其他第三方材料包含在文章的知识共享许可协议中,除非在材料的署名中另有说明。如果材料未包含在文章的知识共享许可中,并且您的预期用途不被法律法规允许或超过允许的用途,您将需要直接获得版权所有者的许可。如欲查阅本许可证副本,请浏览gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba。创作共用公共领域免责声明(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)适用于本文中提供的数据,除非在数据的信用额度中另有说明。gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
尹,X,杨,Y,吕,Y。gydF4y2Baet al。gydF4y2BaBrrICE1.1通过调控萝卜抗冻性中精氨酸脱羧酶基因与腐胺合成有关(gydF4y2Ba芸苔属植物拉伯gydF4y2Bavar。gydF4y2Ba拉伯gydF4y2Ba)。gydF4y2BaBMC Plant BiolgydF4y2Ba20.gydF4y2Ba504(2020)。https://doi.org/10.1186/s12870-020-02697-6gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12870-020-02697-6gydF4y2Ba
关键字gydF4y2Ba
- 油菜,变种油菜gydF4y2Ba
- 冻结公差gydF4y2Ba
- 转录组gydF4y2Ba
- 代谢物gydF4y2Ba
- 腐胺gydF4y2Ba