摘要
背景
干旱胁迫对水稻生长的几个方面都有不利影响。然而,水稻抗旱性的机制尚不清楚。为了解水稻干旱响应的分子机制,利用干旱敏感型染色体单替代片段线(CSSL) PY6对水稻干旱敏感表型的qtl进行了定位,并揭示了这些qtl对转录谱的影响。
结果
QTL的dss-1定位于水稻1号染色体短臂上。转录组学分析显示,所鉴定的差异表达基因(DEGs)表现出下调的模式,主要富集于光合作用相关的氧化石墨烯项,表明干旱条件下光合作用受到了极大抑制。此外,根据加权基因共表达网络分析(WGCNA),特定基因模块(指定一组具有相似表达模式的基因)与H2O2(4个模块)和MDA(3个模块)。同样,氧化石墨烯分析显示,与光合作用相关的氧化石墨烯术语在H2O2相关的模块。差异表达枢纽基因(DEHGs)的功能注释2O2这些基因编码WRKYs和PR家族蛋白,在PY6和PR403之间的表达差异显著。
结论
我们推测干旱诱导的光合抑制导致H2O2和MDA积累,然后触发水稻转录组的重编程,包括参与活性氧清除的中心基因,以防止氧化应激损伤。我们的研究结果揭示了水稻的抗旱机制,并提供了深入的见解。
背景
干旱、寒冷、高温和盐度等非生物胁迫是广泛存在的因素,对植物的代谢、生长和发育等方面产生有害影响,在极端情况下会导致植物死亡。然而,高等植物作为无根生物,在遇到极端环境胁迫时通常采取“克服”策略;与动物的策略相反,这种策略优先选择容忍或避免不利的环境。一般而言,各种容忍/避免机制[1],如调节内源性激素信号[2],角质层中蜡沉积的增加[3.]和气孔调节[4],用于应对非生物胁迫。
大米(栽培稻是世界范围内的主要粮食作物。随着全球水资源短缺的日益频繁,干旱已成为制约水稻生产的主要非生物因素之一。植物采用两种重要的策略来应对干旱胁迫,即耐脱水和避免脱水。脱水的避免依赖于一个大而深的根系的发展,以吸收土壤中的水分,并通过气孔开放的调节减少水分流失。脱水耐受性主要通过发生在干旱胁迫后期的复杂机制来增强抗旱性,如抗氧化过程、ABA信号转导、渗透调节和细胞膜保护[qh]5,6]。先前的报告显示波斯核桃的两个基因型(胡桃regiaL.), Chandler '和' Panegine20,在种子萌发过程中表现出很高的渗透胁迫耐受性[7]。进一步研究发现,耐旱核桃品种的胚根和胚珠在萌发过程中均有较强的糖和脯氨酸积累,表明糖和脯氨酸参与了植物对干旱胁迫的渗透调节[qh]8]。
大量的根系生长qtl [9]、渗透压调节[10]、活性氧调节和表皮蜡质积累有助于增强抗旱性,通过基于图谱的克隆已经定位到水稻基因组的不同位置[11,12,13]。DRO1是水稻根系在干旱胁迫下发育的调控基因之一。DRO1调节根尖细胞伸长,使根系向下弯曲,通过增加深层生根来避免水分亏缺[13]。DST被鉴定为H2O2在保护细胞中积累并参与气孔开放的调节。的损失DST功能增加气孔关闭,从而提高水稻的耐旱性[12]。此外,DS8在干旱胁迫下参与植物角质层蜡质合成和气孔运动调控[j]。11]。对这些基因的研究表明,水稻植物对干旱胁迫的适应具有复杂的机制。相反,通过对干旱敏感性状的调查,绘制了一些与干旱胁迫相关的qtl。例如,在高蒸汽压亏缺条件下,利用F - 1鉴定了4个有助于增加蒸腾速率的qtl7珍珠粟重组自交系[狼尾草(L.)r . Br。]。这些等位基因均来源于对干旱敏感的亲本icmb841 [14]。因此,在抗旱机制研究中,干旱敏感性也是QTL鉴定的替代性状。此外,利用单核苷酸多态性(snp)对波斯核桃的表型、基因型和环境变量进行关联分析,以确定与耐旱性相关的基因座。在已鉴定位点的候选基因中,大部分涉及ABA信号、气孔调节、信号转导、抗氧化防御、渗透调节和叶片生长发育[qh]15]。
叶绿体是植物细胞中进行光合作用的细胞器。作为响应性调控的关键过程,水稻植株在受到非生物胁迫时,光合活性受到极大抑制[16]。光合作用的抑制降低了吸收光能的利用,导致活性氧(ROS)的产生,包括单线态氧H2O2,以及叶绿体中的超氧阴离子,进而对光系统蛋白(如光系统II的核心成分D1)造成光损伤[17]。植物已经进化出一系列酶促和非酶促的抗氧化系统。该酶系统包括超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和抗坏血酸过氧化物酶(APX),参与清除ROS和防止氧化应激造成的损伤[18]。sod在O的畸变中起作用2−到H2O2和O2;合成H2O2然后催化生成H2O和O2CAT和APX的活性[19]。活性氧的过度积累会对植物细胞造成严重伤害,甚至导致细胞程序性死亡。因此,ROS稳态在植物抗旱性调控中起着关键作用[20.,21]。据报道,耐旱基因型波斯核桃的抗氧化活性水平随着POD、APX、CAT、SOD和LOX酶的增加而显著提高(胡桃regial .) [22,23]。此外,新出现的证据表明,抗氧化机制、光合作用调节和抗旱性之间存在很强的相关性[20.,24,25]。具体来说,ROS可以作为次生信使参与胁迫信号响应、光合调节、气孔运动和高等植物的发育[26]。此外,ABA诱导H的积累2O2通过激活NADPH氧化酶,该氧化酶被SnRK2磷酸化激活,最终导致气孔关闭。然而,另一方面,ABA的积累诱导了猫表明ABA信号与H2O2平衡(27,28,29,30.,31,32]。
最近的报道表明,WRKY转录因子(TFs)参与了非生物胁迫的调控机制途径,包括对干旱和盐度的响应[qh]33,34]。WRKY tf是一组植物特异性锌指转录因子,其特征是含有一个保守的WRKY结构域,并与共识相结合独联体-元件W-box (TTGACT/C) [35]。水稻中100多个WRKY成员中的大多数以消极或积极的方式参与植物防御反应[35,36,37]。一些WRKY成员在非生物胁迫响应中发挥重要作用;例如,OsWRKY13已被认为是通过抑制SNAC1和WRKY45-1[33,34]。此外,致病相关(PR)蛋白已被很好地表征为一组蛋白,它们不仅受到病原体(如病毒、细菌和真菌)的感染诱导,而且还响应非生物胁迫,包括干旱和盐度[38]。单子叶植物和双子叶植物的PR蛋白均可分为17个科[39]。PR3和PR4蛋白具有植物几丁质酶活性,PR5蛋白家族包括永久蛋白、渗透蛋白、玉米蛋白和梭玛蛋白样蛋白[40]。PR10基因属于一个多基因家族,存在于多种植物物种中,发挥rna酶活性和配体结合活性,参与翻译后修饰(磷酸化)和植物激素信号传导以应对逆境。的发起人PR10基因港独联体- WRKY, bZIP, ERF和MYB转录因子的作用元件,表明PR10基因在应激反应途径中起关键作用[40]。
随着新一代测序技术的迅速发展,RNA-seq已被广泛用于研究植物在逆境条件下的转录组学特征。最近的研究表明,在转录水平上,抗氧化过程、ABA途径和光合作用是植物响应环境变化的目标生物过程[41,42]。有趣的是,在干旱胁迫下,光合速率下降,特别是在干旱敏感基因型中,这表明抗氧化能力的增强有利于保持较高的光合活性,从而提高植物的抗旱性[qh]42]。此外,植物激素信号和钙2 +在转录谱分析中也强调了信号传导,并揭示了植物激素信号传导途径之间的串扰[43,44]。此外,大量转录因子家族如WRKY、bZIP、MYB家族参与了非生物胁迫下aba介导的信号转导[qh]45,46]。然而,耐旱/敏感的分子机制仍需进一步研究。
加权基因共表达网络分析(Weighted gene coexpression network analysis, WGCNA)是一种新技术,可用于识别基因间连通性最高的潜在基因模块,这些模块与基因表达数据中的某些表型相关[47,48]。WGCNA涉及一个共表达网络的构建,该网络可以指示跨样本基因之间的相关性。根据共表达关系,将表达相似的基因归为同一模块,这表明同一模块中的基因可能具有相似的功能或可能具有共同的生物调控作用[49]。该方法已成功应用于许多研究案例中,这些研究案例已被用于识别中心基因,并确定基因表达数据与相关表型之间的关系[50,51,52,53,54,55]。
本研究通过回交与耐旱品种PR403的杂交,鉴定出一株干旱敏感水稻CSSL PY6,该水稻携带来自干旱敏感品种Lambayeque 1的代换片段。的dss-1PY6干旱敏感表型的基因座位于1号染色体短臂上。调查…的影响dss-1对PY6的转录谱分析,采用RNA-seq方法鉴定干旱胁迫下差异表达的基因。此外,利用WGCNA从模块中鉴定出与干旱诱导生理指标密切相关的枢纽基因。通过使用这种方法,我们的目的是阐明dss-1介导的潜在调控网络与水稻抗旱性有关。
结果
识别dss-1CSSLs干旱敏感表型的基因座
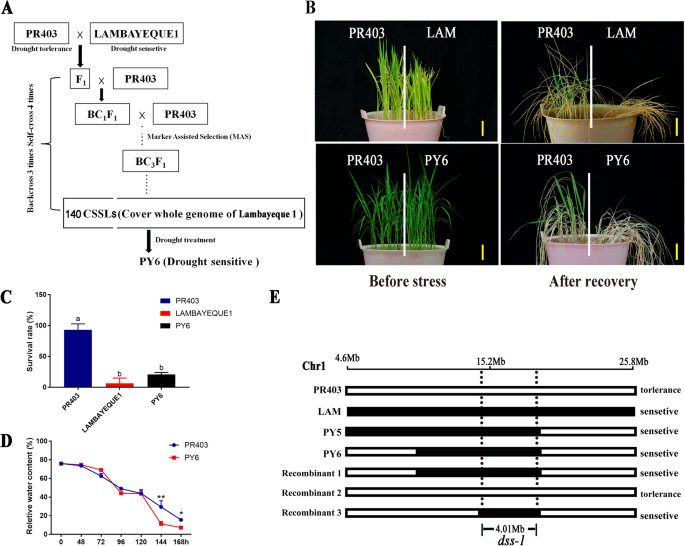
通过回交将干旱敏感品种Lambayeque 1的基因组片段渗入抗旱品种PR403的基因组,构建了140个水稻CSSLs(未发表数据;无花果。1a).为阐明Lambayeque 1号干旱敏感表型的分子调控机制,采用干旱胁迫处理鉴定了干旱敏感性状的主要qtl。其中一个CSSLs, PY6因其干旱敏感表型而受到关注。干旱处理10 d后,重新浇水,3 d后恢复。在筛选中,发现了一种CSSL, PY6与其复发亲本PR403(93.3%)相比,生存率有显著差异(20.0%),而PY6与其供体亲本Lambayeque 1的生存率无显著差异(图1)。1c)。在干旱胁迫处理期间,PY6和PR403的幼苗相对含水量随着土壤含水量的降低而下降。然而,从120 h开始,PY6和PR403之间观察到显著差异,前者在处理后期表现出更严重的脱水,这表明干旱胁迫破坏了PY6的水分吸收和蒸发平衡(图6)。1d). PY6在1号染色体短臂上携带一条来自Lambayeque 1的10 mb染色体片段。这些结果表明,来自Lambayeque 1的片段可能包含PY6干旱敏感表型的主要QTL位点。我们将这个QTL命名为dss-1.
揭示干旱敏感表型的遗传基础dss-1将基因座PY6与亲本PR403回交,构建定位群体。F1植株表现出与亲本PR403相似的抗旱性。然后是F2生成种群以确定遗传特征dss-1.在151个人的F2种群中抗旱性状111个,抗旱性状40个(抗旱:敏感≈3:1,χ2= 0.1788 < χ20.05= 3.84),说明干旱敏感性状受单隐性基因控制。然后,对重组体进行遗传连锁分析筛选dss-1最终缩小到4.01 mb的间隔(图3)。1e)。
干旱诱导H2O2和丙二醛在PY6叶片中的积累
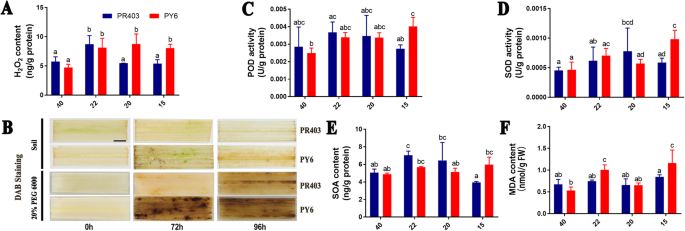
鉴于先前的报告表明,由于光捕获和利用之间的不平衡,已知干旱胁迫会抑制植物的光合活性[56]并且伴随着叶绿体中超氧化物和过氧化氢积累增加的巨大潜力[57],我们检测了干旱处理的PY6植株叶片中ROS的积累及其清除酶的活性。在4个采样点收获叶片样本(图2)。S1)。与PR403相比,H2O2在PY6的第40 ~ 15点检测到,而PR403仅在第22点检测到;因此,H的积累显著增加2O2与各自的对照相比,在采样点22和15 PY6中检测到(图2)。2a) H2O2通过DAB染色证实了PY6叶片中基因的表达(图2)。2b).一致地,POD的活性,H2O2在H2O2(无花果。2c)。然而,H的另外两个主要酶APX和CAT的活性2O2在干旱处理期间,两种基因型之间没有观察到显著差异(图2)。S2A, B)。对于超氧化物活性的动态变化,在点15处,SOA(超氧阴离子)含量及其清除酶SOD的活性在两个基因型之间表现出显著差异,且PY6的值较高。然而,在整个干旱处理期间,SOA的含量并不显著大于未处理的对照组(第40点)(图4)。2d、e;无花果。S2此外,丙二醛(MDA)的含量在PY6中显著高于PR403,丙二醛是由生物膜的多不饱和脂肪酸(PUFA)成分过氧化产生的一种主要活性醛,是一种作为非生物应激诱导的生物膜损伤指标的化合物(图22和15)。2f)。
综上所述,我们的研究结果表明,干旱敏感表型可能是由于ROS的过度积累,特别是H2O2,会对植物细胞造成严重的损伤和细胞膜过氧化,从而导致水稻植株在干旱胁迫下脱水。
干旱胁迫下ABA的积累与气孔调节
如上所述,PY6在处理后期表现出比处理前期更严重的脱水,说明PY6在干旱胁迫下蒸腾速率更高或吸水能力更低。ABA是植物胁迫反应的关键调节剂,调控一系列生理过程,包括对非生物胁迫的耐受和气孔关闭[qh]58]。为了确定ABA介导的气孔运动在PY6干旱严重脱水中的作用,研究了干旱处理样品的ABA含量和气孔孔径状态。干旱胁迫处理期间ABA积累,尽管在任何采样点PY6和PR403之间没有观察到显著差异(图4)。S2D).利用扫描电镜观察叶片样品气孔状态。与未处理对照样品相比,干旱处理样品的气孔完全闭合百分率显著高于未处理对照样品。然而,PY6和PR403在干旱胁迫下调节气孔的能力方面表现出相似的模式,并且两种基因型在气孔密度方面没有观察到显著差异(图2)。S2因此,这些结果表明,干旱处理的PY6的严重脱水不是由于aba介导的气孔蒸腾调节的中断,而是由于水分吸收的限制或其他水分流失途径造成的。
干旱胁迫下PY6的转录比较分析
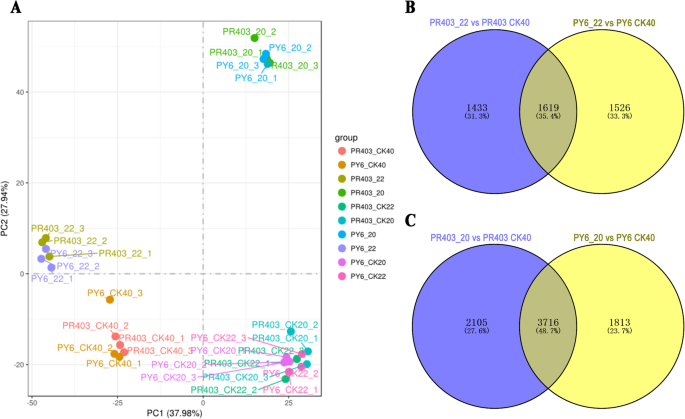
进一步揭示的影响dss-1干旱胁迫诱导H2O2因此,我们通过RNA-seq研究了PY6和PR403在干旱胁迫下的转录谱。首先根据所有转录谱数据进行主成分分析(PCA),以检测干旱处理下样品之间的变化(图2)。3.a). PC1解释了总变异的37.98%。PY6和PR403的CK40和CK22/20样品被PC1明显分离,表明发育对变异的影响,而PC1也将22点和20点的干旱处理样品分离开来,表明干旱处理对样品的转录组有影响。PC2解释了总变化的27.94%,并清楚地将干旱处理的样品与平行的未处理的样品分开(图2)。3.a).此外,20号点的PY6和PR403样品与其他采样点的差异明显,表明该采样点发生了剧烈的转录组重编程。
通过与未处理对照进行比较,鉴定了干旱诱导的差异表达基因(DEGs)S2)。值得注意的是,在相同标准下,在水分充足的样品的相同采样点检测到发育依赖的DEG,并且它们被排除在DEG集之外,以避免对干旱诱导的转录组反应产生误解(表1)S2-1 ~−8)。最后,在PR403的两个采样点,在第22点检测到3052个deg,其中上调1135个deg,下调1917个degS2-9),而在第20点检测到5821个deg,其中上调deg 2383个,下调deg 3438个(表2)S2-10)。在PY6中,在第22点和第20点分别检测到3145个(1748个上调/1397个下调)和5529个(2655个上调/2874个下调)deg1;表格S2-11, - 12)。在所得的deg中,Venn图分析显示,PR403和PY6在22点共有1142个deg, PR403和PY6在20点共有3184个deg,分别占两个采样点总deg的38.4%和48.7%(图4)。3.c;表格1)。这些结果表明,PY6与PR403具有相似的遗传背景和干旱胁迫响应。
为了验证RNA-seq数据质量,随机选择5个基因进行qRT-PCR。在qRT-PCR和RNA-seq数据之间观察到相似的表达变化趋势,表明转录组学数据对进一步分析是可靠的(图2)。S3a e;表格S1)。
基因本体富集分析
进行氧化石墨烯富集分析,将鉴定的deg聚类为生物过程(BP)、细胞成分(CC)和分子功能(MF)亚群。结果表明,所有的deg都富含与叶绿体光合作用相关的氧化石墨烯(图2)。4模拟,P≤0.01)。例如,在BP组中,涉及光合作用的GO项(GO:0015979);光合作用,光收集(GO:0009765);光合作用,光系统I中的光收获(GO:0009768);光合作用,光反应(GO:0019684);叶绿素生物合成过程(GO:0015995);和含卟啉化合物的生物合成过程(GO:0006779)被高度过度代表。过度代表的氧化石墨烯术语,如涉及CC类别中的叶绿体部分(GO:0044434)、叶绿体包膜(GO:0009941)、叶绿体类囊体(GO:0009534)、叶绿体类囊体膜(GO:0009535)和叶绿体类囊体腔(GO:0009543)的术语(图1)。S4模拟,P≤0.01),以及MF类别的过度代表项,如色素结合(GO:0031409)和叶绿素结合(GO:0016168)(图2)。S5模拟,P≤0.01),表明所鉴定的deg与干旱胁迫下的光合调节有关。此外,与超氧化物代谢相关的氧化石墨烯术语超氧化物代谢过程(GO:0006801)和超氧化物代谢过程调控(GO:0090322)在PR403第20点鉴定的deg中高度富集,这表明活性氧清除过程参与了干旱胁迫响应(图4)。4c,P≤0.01)。氧化石墨烯富集分析表明,光合调节在水稻植物响应干旱胁迫的调控网络中起重要作用;因此,叶绿体是干旱胁迫响应的靶细胞器。
干旱诱导枢纽基因共表达网络的构建与鉴定
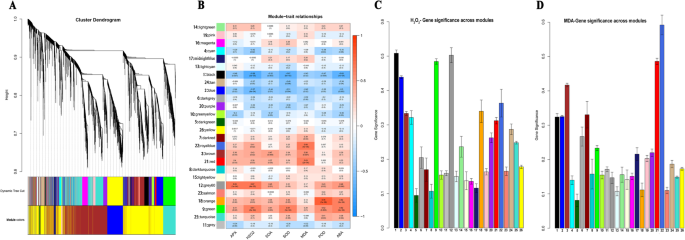
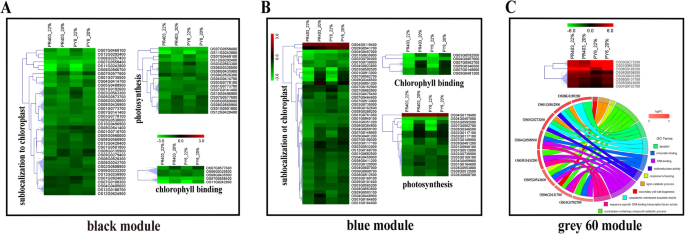
进一步调查的影响dss-1为了确定与水稻干旱诱导生理变化密切相关的特定基因,我们进行了WGCNA研究。在去除FPKM较低(FPKM< 1)的基因后,共使用23178个基因构建基于软阈值能力的无标度共表达网络β= 12(图。S6)。根据WGCNA结果,将基因高度互联的集群定义为模块,相同模块中的基因具有高相关系数。采用动态树切法(核心参数:MEDissThres = 0.25),共识别出26个模块(用不同颜色表示不同的模块)。5a).关于生理性状与过度代表模块的相关性,在相关性中观察到有趣的结果。总的来说,黑色、蓝色和棕褐色模块与大多数生理性状呈负相关,而蓝色、棕色、红色、灰色、橙色和绿色模块与这些性状呈正相关,这表明聚集在一个模块中的基因在干旱胁迫下具有相似的表达模式改变(图2)。5b).考虑到H2O2在干旱胁迫下,我们重点研究了H和MDA的相关性2O2与两个干旱相关生理指标密切相关的基因模块和鉴定的枢纽基因(图2)。2A, b, f;无花果。5b, c, d)。在GS (Gene Significance)临界值> 0.4的情况下,26个模块中,黑色(741个)基因;R2= -0.69,P= 3.0 × 10−5),蓝色(4810个基因;R2= -0.57,P= 9.0 × 10−4), grey60(148个基因;R2= 0.67,P= 4.0 × 10−5)和绿色(1099个基因;R2= 0.61,P= 3.0 × 10−4)被认为是与H密切相关的模块2O2红色(913个基因);R2= 0.63,P= 2.0 × 10−4),棕色(3132个基因;R2= 0.56,P= 1.0 × 10−3)和royalblue(45个基因;R2= 0.68,P= 4.0 × 10−5)模块被认为与MDA密切相关(图2)。5b, d)。模块聚集的基因与其各自的模块表现出很强的相关性(图2)。S7此外,根据阈值强化,黑色、蓝色、绿色和宝蓝色模块的GS > 0.60和MM(模块隶属度)> 0.80,灰色、红色和棕色模块的GS > 0.5和MM > 0.8。用log去除基因后2FC| < 1,在干旱胁迫下,所有获得的枢纽基因在PY6和PR403中的表达都发生了显著差异,并在随后的功能分析中得到了突出显示(图1)。S8f;表格S3-1 ~−7)。此后,我们将这些中心基因命名为dehg。
H .相关枢纽基因功能富集分析2O2积累
我们进行了氧化石墨烯富集分析,对与H密切相关的模块中的枢纽基因进行功能聚类2O2.在黑色和蓝色模块中分别鉴定出115和204个dehg(表1)S3-1,−2)。与上述结果一致,这些中心基因在涉及叶绿体的氧化石墨烯项中高度富集(GO:0009507);叶绿体包膜(GO:0009941);类囊体(去:0009579);叶绿体基质(GO:0009570);叶绿素结合(GO:0016168);光合作用(GO: GO:0015979);光系统I (GO:0009522);光合作用,光收集(GO:0009765);光合作用,光反应(GO:0019684)。 These terms are related to photosynthesis (问值≤0.05)。S9a - b;表格S5-1,−2)。有趣的是,与之前的报告一致[59],黑色和蓝色模块中大部分dehg的表达下调,无显著log2FC差异(|log2足球俱乐部PY6日志2足球俱乐部PR403|≥1,P< 0.05),在干旱处理期间PY6和PR403之间观察到(图2)。6a、b;无花果。S8A, B),说明PY6和PR403具有共同的干旱响应调控,它们的光合活性在干旱胁迫下受到抑制。
模块grey60富集了41个dehg(表5)3.3)。干旱胁迫下,大多数dehg的表达量升高(图2)。S8C)。在这些基因中,8个基因在两个基因型之间至少在一个采样点上表现出显著不同的差异表达量,显示出对干旱处理的强烈动态诱导(|log)2足球俱乐部PY6日志2足球俱乐部PR403|≥1,P< 0.05)。6c;表格2)。Os01G0842500和Os03G0273200编码与漆酶相似的蛋白质,它们都富含氧化石墨烯,涉及外质体(GO:0048046)/木质素分解代谢过程(GO:0046274)/细胞质膜结合囊泡(GO:0016023)/氧化还原酶活性(GO:0016491),它们的表达在PY6和PR403的两个点上持续增强,在PY6中表现出更高的幅度(特别是在点20)(图6)。6c;无花果。S9C;表格2;表格S53)。5个被标注为转录因子的基因(Os01G0702700、Os06G0131700、Os05G0543600、Os03G0433200和Os04G0508500)主要富集于氧化石墨烯中,涉及DNA结合(GO:0003677)、序列特异性DNA结合转录因子活性(GO:0003700)和冷冻反应(GO:0050826),它们在PR403的第22点被显著一致地诱导,在第20点被下调,而在PY6的第20点被显著诱导。除Os03G0433200外(图2)6c;表格2;表格S53)。Os01G0702700、Os05G0543600、Os04G0508500为MYB系列TF, Os06G0131700为NAC TF。最近的一项研究表明,OsSWN1)与次生细胞壁形成有关[60],暗示次生细胞壁的形成可能在抗旱过程中起一定作用。此外,Os08g0189200被注释为编码发芽样蛋白8-3的基因,并被认为参与了抗病[61]。在PY6和PR403中观察到该基因在干旱胁迫下的不同上调模式(图2)。6c;表格2)。
在绿色模块中共鉴定出96个枢纽基因,其中36个基因在干旱响应中下调,60个基因上调(图2)。S8D;表格S34)。氧化石墨烯富集分析显示,大多数被过度代表的氧化石墨烯项与氧化还原过程(GO:0055114)、盐胁迫响应(GO:0009651)、碳水化合物代谢过程(GO:0005975)、生物合成过程(GO:0009058)和代谢过程(GO:0008152)有关。这些枢纽基因亚定位于不同的细胞成分,具有不同的分子功能(图2)。S9D;表格S54)。然而,除了铁-硫簇结合(GO:0051536)外,在我们的分析中没有GO项显着过度代表(表5)S54)。值得注意的是,只有1个枢纽基因OS04G0685300编码harpin诱导的1结构域蛋白,与PR403相比,该基因在PY6(2.03/2.67)的两个点上表达差异显著,上调幅度更大(表1)S34)。
综上所述,在H2O2相关模块分析表明,PY6和PR403均经历了干旱引发的光合活性抑制,导致H的积累2O2在稻谷里。在模块grey60中发现的高度差异表达的枢纽基因可能负责H的积累2O2在水稻中。
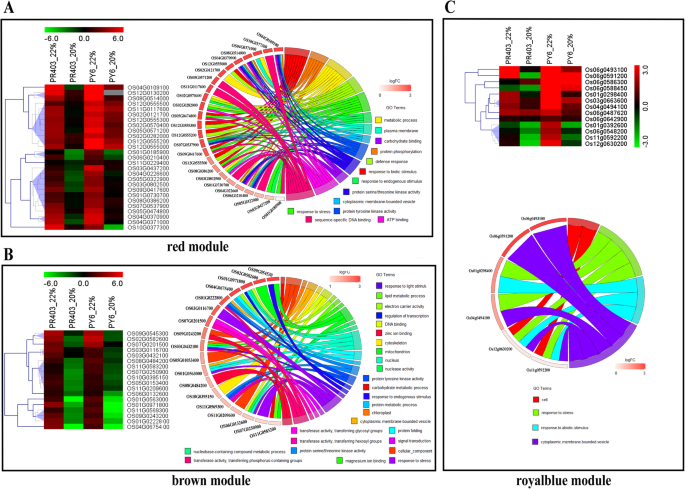
枢纽基因与MDA积累相关的功能富集分析
丙二醛是膜脂过氧化的重要指标。干旱处理下,红色、棕色和宝蓝色与MDA呈显著正相关;在这些模块中分别鉴定出303个、304个和13个轮毂基因(表1)S3-5 ~−7)。对于模块红色,GO分析显示枢纽基因参与生物应激和防御反应(图2)。S10一个;表格S55)。在这些中心基因中,29个在两个基因型之间至少在一个采样点上表现出差异表达(|log2FC)PY6-log2FCPR403|≥1,P< 0.05)。7一个;表格3.)。引人注目的是,他们中的大多数人在两种基因型中一致表现出相似的表达模式,在第22点转录本升高,之后表达水平下降到与各自未经治疗的对照组相当甚至更低的水平(图2)。S8E;表格3.)。氧化石墨烯分析显示,这些基因参与了生物应激反应;例如,涉及防御反应(GO:0006952)、对生物刺激的反应(GO:0009607)、对压力的反应(GO:0006950)和对内生刺激的反应(GO:0009719)的GO术语在结果中被过度代表(图2)。7一个;表格S55)。在这些基因中,有8个是WRKY家族tf(图2)。7一个;表格3.)。具体地说,OsWRKY70(Os05g0474800)和OsWRKY76(Os09g0417600)被认为参与ABA信号传导和生物应激反应[34,62]。OS01g0185900和OS05g0322900在第22点的表达上调相对较高,而另外两个基因OS05g0571200和OS11G0117600在PY6的第20点的表达相对高于PR403(图4)。7一个;表格3.)。考虑到PY6和PR403中MDA的积累,这些结果提示4个基因可能与MDA的过度积累呈正相关,并导致PY6在干旱胁迫下死亡。此外,PR-10a(OS12g0555300),该基因在茉莉酸途径下游发挥作用,在干旱和高盐胁迫下受WRKY TFs的正调控[38,63],以及另外三个PR-10蛋白家族中心基因(Os12g0555200、Os12g0555500和Os12g0555000),这些基因被注释为编码probenazole诱导的PBZ1蛋白并参与抗病的基因,在PY6的两个采样点与PR403相比,表达上调幅度更高(图403)。7一个;表格3.)。BSR-d1 / ZFP36(Os03g0437200),它编码一个C2H2型锌指蛋白,参与ABA-OsMPK转导,导致H2O2[64,65]。同样,该基因在PY6中的上调表达也高于在PR403中的上调表达(表4)3.)。此外,在整个干旱处理期间,OS02g0121700和OS02g0570400在PY6中被显著诱导表达,而这些基因仅在PR403的第22点被显著诱导表达,之后其表达水平下降到未处理对照的水平(图2)。7一个;表格3.)。这些基因编码含有萜类合酶结构域的蛋白质和ent与赤霉素(赤霉素)生物合成有关,提示赤霉素在水稻干旱胁迫响应中发挥作用。OS04g0109100是一个注释为刀豆蛋白a样凝集素/葡聚糖酶的基因,在两种基因型中表达模式相似。
在棕色和宝蓝色模块中分别鉴定出18和13个dehg(图2)。7b, c;表格4;表格S4)。氧化石墨烯分析显示,模块棕色中的dehc在各种生物过程中发挥着不同的作用,包括应激反应(GO:0006950)、内源性刺激反应(GO:0009719)、蛋白质磷酸化(GO:0006468)、蛋白质代谢过程(GO:0019538)、脂质代谢过程(GO:0006629)、碳水化合物代谢过程(GO:0005975)、蛋白质折叠(GO:0005515)、转录调节(GO:0006355)和信号转导(GO:0007165)(图1)。7b;表格S56)。两种基因型在干旱条件下,几乎所有这些基因都在22点被诱导,在20点被抑制。虽然它们具有相似的表达模式,但在几个中心基因中观察到不同程度的下调;如OS11G0569300、OS01G0971800、OS04G0675400、OS09G0243200在PY6的第20点下调幅度较低,而OS07G0201500、OS11G0209600在PR403的第20点下调幅度较低(图2)。7b;表格S4)。在royalblue模块中,由于dehg的数量相对较少,只有一个GO项显着过度代表。枢纽基因表达模式的显著特征是,在PY6的第22点,它们的转录本受到干旱的显著诱导,在下一个采样点,它们的水平也略有下降。有趣的是,Os04g0494100和Os11g0592200被注释为编码PR3和PR4家族蛋白的基因,具有植物几丁质酶活性。Os03g0663600和Os12g0630200是两个编码与发病相关的thaumin样蛋白的基因,它们是PR5家族的成员,这表明这些基因在本研究中干旱和生物胁迫之间的串扰中发挥了作用(图5)。7c;表格4;表格S57)。
讨论
在本研究中,使用CSSL PY6来表征一个QTL位点,dss-1研究其对干旱敏感的表型,并研究其对干旱的影响dss-1通过RNA-seq和WGCNA对干旱胁迫下PY6转录谱重编程的研究。
干旱引起的H2O2可能导致敏感表型dss-1
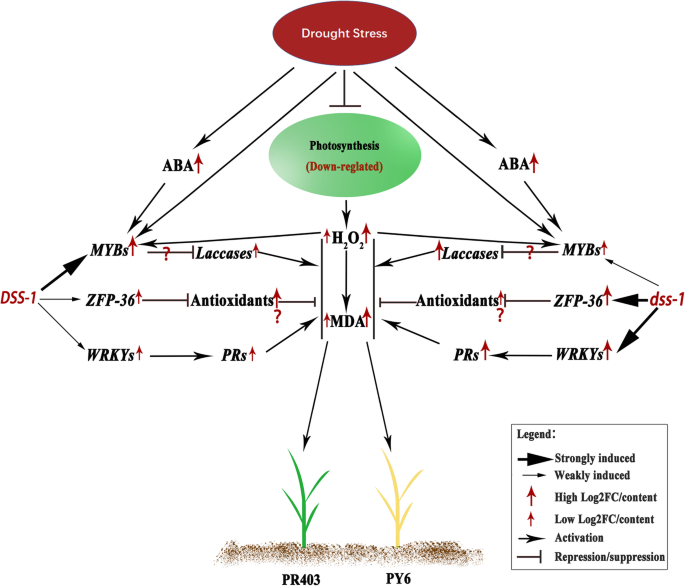
活性氧(ROS)(如O2. -H2O2,哦,˙1O2)是植物在应对非生物/生物胁迫时产生的不可避免的有毒副产物[66]。细胞中ROS的过度积累会对细胞膜(脂质过氧化)、蛋白质、RNA和DNA分子造成严重的氧化损伤[67]。高等植物因此进化出专门的清除途径来保护自己免受ROS毒性,包括涉及解毒酶的途径,如CAT、SOD、POD和APX,以及抗氧化剂抗坏血酸-谷胱甘肽(GSH)循环[19,68]。在本研究中,H2O2在干旱处理期间,与PR403相比,PY6中检测到(图2)2a, b).关于PY6的干旱敏感表型,这是由dss-1在PR403的背景下,我们的结果表明,两者之间存在明显的重要关系dss-1H2O2积累,和敏感表型。也就是说,我们推测,渗入dss-1可能直接或间接导致H2O2在水稻细胞中。H的过度积累2O2导致细胞膜氧化损伤(脂质过氧化),这在MDA和其他测量中反映出来,随后导致水稻植株在严重干旱胁迫条件下死亡。
光合作用调控:水稻对干旱胁迫的共同调控过程
叶绿体是固定光能的重要细胞器,而光能是高等植物和我们生物圈中所有其他生命形式的生物活动所必需的。69]。除了在光合作用中的正常作用外,越来越多的证据表明叶绿体是参与环境胁迫反应的目标细胞器,通过积极或被动地调节光合活性以适应环境变化[24]。根据氧化石墨烯富集分析,PR403和PY6中鉴定的干旱诱导的氧化石墨烯主要富集于与光合作用相关的氧化石墨烯(图2)。4;无花果。S4;S5)。此外,对聚集在黑色和蓝色模块中的差异表达枢纽基因的分析表明,与叶绿体中光合作用过程相关的一组类似的氧化石墨烯术语被过度代表(图2)。S9A, B)。在干旱处理过程中表达量的变化,与前人研究结果一致[59],大部分聚集在黑色和蓝色模块中的枢纽基因在PY6和PR403中持续下降,下降程度相似(图2)。S8A, B),这表明两种基因型的光合活性在干旱胁迫下均受到显著抑制。光合作用的抑制降低了吸收光能的利用;过量的光能会产生有毒的活性氧[17]。因此,光合活性调节可能是水稻品种间共同的调节过程,以适应环境胁迫。本研究中两种基因型对光合作用的抑制可能与H积累有关2O2在水稻细胞中。H的差异积累2O2在PY6和PR403叶片中dss-1对相关模块中鉴定的枢纽基因的不同表达变化进行了研究。此外,以往的研究认为光合能力的提高对植物的抗旱性很重要[42]。然而,在本研究中,PR403和PY6中所鉴定的与光合作用相关的deg均未见明显的表达差异,这表明PR403和PY6中与光合作用相关的deg表达差异较大dss-1-诱导的干旱敏感表型不是由于光合作用受到严重抑制,而是由于H的过度积累2O2.
干旱胁迫下ros相关枢纽基因的差异调控
转录因子在植物对逆境胁迫的调控网络中起着关键作用。MYB家族是植物中最大的转录因子家族之一;其成员具有保守的MYB结合结构域,并且MYB家族tf已被证明是由H诱导的2O2在大豆非生物胁迫响应中发挥重要作用[j]70,71]。在本研究中,标记为转录因子的5个deg,包括3个MYBs, 1个NAD和1个SHR,在模块grey60中高度聚集,这与H的积累具有统计学相关性2O2在干旱压力下。其中,Os01G0702700、Os05G0543600、Os04G0508500为MYB家族转录因子,在PR403的第22点上调幅度较大。考虑到H的积累相对较低2O2PR403和MYB家族tf中的MDA含量可能受到干旱胁迫或其他信号信使的诱导,并可能触发干旱响应信号通路下游组分的激活。这种作用还可能包括胁迫反应基因的上调,这些基因参与增加渗透保护剂的含量以及POD、CAT和SOD的活性,并维持H的亚致死含量2O2在干旱胁迫下,植物细胞中的MYB TFs与抗旱性呈正相关(图2)。2和6c;表格2) [72]。此外,WRKY TFs,一个参与植物防御反应的转录因子家族[73],发现与MDA强相关,模块红色中鉴定的8个差异表达的WRKY tf在PY6中与PR403相比,在22点的诱导程度更高,在20点的诱导程度更低(表4)3.)。
PR蛋白是另一组参与植物防御反应的蛋白质[38]。在本研究中,在模块red中鉴定的4个PR10家族编码基因和在模块royalblue中鉴定的另外3个PR蛋白家族(PR3、PR4和PR5)在干旱胁迫下表现出类似的表达模式改变。在已鉴定的pr编码基因中,OS12G0555000 (RSOsPR10)是一种编码水稻根特异性致病相关蛋白PBZ1的基因,此前有报道称该基因可由干旱和盐度胁迫以及茉莉酸诱导;但水杨酸对其有很强的抑制作用[38,63]。此外,的表达RSOsPR10被假定为sa诱导的OSTGA年代或OsWRKY年代(38]。我们的研究结果表明,在干旱胁迫下,非生物和生物胁迫响应途径之间发生了串扰。最近的报道表明,参与非生物和生物胁迫反应的信号通路中有一些共同的成分:植物激素脱落酸、水杨酸和茉莉酸;独联体-代理监管要素;蛋白激酶级联的成分[2]。植物可以通过其会聚节点对通路间的串扰进行协同或拮抗调节,从而对环境变化做出快速反应[2]。OsWRKY76(OS09G0417600)是模块红色的枢纽基因,在水稻中编码IIa组WRKY TF。研究表明,过度表达OsWRKY76在水稻植株中抑制了一组特定的PR基因,并增加了非生物胁迫相关基因的表达,从而导致对Magnaporthe oryzae(m . oryzae)和提高对冷应力的耐受性[34]。此外,OsWRKY13提示通过抑制SNAC1和WRKY45-1[33]。因此,在这里发现的WRKY TF-和PR家族蛋白编码基因可能是趋同节点,并可能负责非生物和生物胁迫之间的串扰。
此外,引人注目的是,Os01G0842500和Os03G0273200这两个被注释为推测漆酶编码基因的基因型在干旱响应中一致表现出表达升高。而PY6在第20点的表达上调相对较高,说明漆酶基因转录本的过度积累可能与PY6的干旱敏感表型有关。已经证明,水稻漆酶编码基因,OsChi1,据报道在ROS信号通路中起重要作用[74],表明在本研究中,MYB tf调控的差异表达漆酶参与了干旱胁迫耐受性的提高(图2)。8)。然而,矛盾的是,另一种漆酶编码基因的过度表达,OsChi1(Os01g0827300)拟南芥增加了对干旱和盐胁迫的耐受性[74]。因此,需要进一步的研究来探索研究中发现的漆酶的功能并确定差异。此外,ZFP36(OS03G0437200),一个编码C2H2锌指蛋白(Brs-d1)是调节水稻细胞氧化还原状态的关键因子,参与aba诱导的SOD和APX的表达和活性上调ZFP36增强了对干旱和氧化胁迫的耐受性,但降低了对稻瘟病的抗性[64,65]。然而,的表达却急剧增加ZFP36这表明该基因可能在水稻WRKY TFs和pr响应干旱胁迫的调控网络中发挥协同作用。
的影响dss-1干旱胁迫下枢纽基因重编程研究
综上所述,本文提出了一个工作模型来描述这种可能性dss-1-介导的水稻植株在转录水平上响应干旱胁迫的机制(图2)。8)。当水稻遭受严重干旱胁迫时,胁迫引起的水稻植株脱水和叶片保护细胞气孔关闭导致光合作用活性受到抑制,ABA的生物合成增强。光合作用的抑制降低了吸收光能的利用,导致有毒ROS的产生,包括H2O2.活性氧的过度积累会引起植物细胞的氧化应激损伤,导致水稻的干旱敏感表型。干旱胁迫信号、ABA积累与H2O2信号被水稻细胞整合和感知,并触发响应信号通路的激活。首先,包括MYBs、WRKYs、ZFP36、NACs等一系列tf的表达被差异重编程,这些tf引起干旱和生物胁迫响应之间的串扰。诱导TFs可调控下游应答基因的表达,包括多种PR家族蛋白和漆酶,从而调动体内多个方面的资源来应对干旱胁迫,最终降低植物细胞中ROS的含量,改善水稻干旱诱导的敏感表型。的introgresseddss-1可能会对我们研究中发现的枢纽基因产生影响,从而差异地改变其表达,从而导致抗旱品种和干旱敏感品种之间ROS积累的差异。活性氧相关响应途径的激活差异可能导致水稻品种抗旱/敏感表型的差异。
在本研究中,我们使用干旱敏感的植物材料来精细定位QTLdss-1并研究其对水稻转录组谱的影响。随后,我们将通过定位克隆从Lambayeque1中鉴定一个干旱敏感的QTL等位基因;的耐旱等位基因dss-1也可以从PR403中分离出来。然后对它们进行研究,以阐明耐旱机制和耐旱等位基因DSS-1将应用于水稻育种。
结论
综上所述,我们的研究结果表明叶绿体是PR403和PY6响应干旱胁迫调控的目标细胞器。与H强相关模块枢纽基因的功能注释分析2O2和MDA积累,为我们提供了干旱影响的全球图景dss-1在转录水平上调控机制的重编程。的差异表达模式MYB年代,WRKYs, PR蛋白编码基因;ZFP36这两种基因型的差异暗示了它们在活性氧和丙二醛积累变化中的作用,从而导致水稻对干旱胁迫的敏感表型。
方法
植物材料、生长和处理条件
通过将供体亲本Lambayeque 1的基因组片段导入到复发亲本PR403中,在罗吉静、刘建斌和余百阳构建的一组CSSLs中筛选到PY6。亲本PR403(登记号:AAV003680)和兰巴依克1号(登记号:AAV003699)储存于上海农业生物基因中心遗传资源库(http://seed.sagc.org.cn/front/custom/enterViewResourceList.action?gerTypeId=4028940b44ba2d910144ba3062d00002&gerTypeCode=AA&gerTypeName=%E6%B0%B4%E7%A8%BB%E7%B1%BB&isFeature=0)。所有的植物材料都是在广西大学的实验水田中按照中国法律的规定,按照先前描述的方法种植的,并进行了轻微的修改[16]。简而言之,水稻种植在等量的水稻土上。此外,常规应用等量的水。根据先前描述的方法进行干旱处理[25]。在干旱处理的17天内,利用EM-WSYP土壤水分检测器(中国恒美公司)定期监测土壤水分,以确定干旱胁迫的阶段。在温室(35°C白天/30°C夜晚)中生长的3周龄土培水稻幼苗(3个生物重复),在4个土壤水分点收集次叶,40(40%土壤水分,代表水分充足的条件),22(22%土壤水分,在40%土壤水分条件下干旱处理96 h), 20(20%土壤水分,干旱处理120 h), 15(15%土壤水分,干旱处理168 h)。S1),并在液氮中快速冷冻,用于RNA-seq和生理指标测量。在第15点采集的样品仅用于生理测量分析。水培苗在96孔板中添加20% (w/v) PEG 6000的水稻营养液中进行干旱胁迫处理。处理5天后,复水3天后测定存活率。
RNA-seq文库构建及转录组学数据处理
转录组文库由NEBNext®Ultra™RNA library Prep Kit for Illumina®(NEB, USA)按照制造商的说明生成。经酶切、纯化和PCR扩增后,用AMPure XP beads (Beckman, USA)纯化cDNA片段(250 ~ 300 bp)。在Illumina 2500平台上进行cDNA测序,生成成对末端reads。在从数据中去除低质量reads后,获得了足以实现最佳转录组覆盖的6gb clean reads深度,并将其映射到参考基因组(Rice Annotation Project Database,https://rapdb.dna.affrc.go.jp/index.html)。采用DESeq检测各处理点与未处理对照组之间的deg,检测结果为|log2FC|≥1 (FC, fold change的缩写)padj采用≤0.05作为阈值来识别干旱诱导的deg。此外,以相同的标准,在水分充足的样品的相同采样点检测到发育依赖的deg。由于发育依赖的deg可能是由水稻植物的发育引起的,因此它们被排除在最终的数据集之外。
通过PlantRegMap (http://plantregmap.cbi.pku.edu.cn/)。使用ggplot2和GOplot R包将过度表示的GO术语可视化[75]。MEV v4.9生成的热图[76]。
共表达网络分析
使用WGCNA R包构建共表达网络,并根据先前描述的方法分析模块与生理数据的相关性[47]。对所有样本的原始转录组数据集进行过滤,去除所有FPKM (Fragments Per Kilobase Million) < 1的基因,即使对样本的任何采样点的单个重复也是如此。使用干净的数据生成共表达网络。首先,通过pickSoftThreshold函数估计软阈值功率,为网络构建提供合适的软阈值功率;其次,根据得到的软阈值功率构造相关矩阵,然后根据变换后的相关矩阵计算拓扑重叠矩阵(TOM);最后,利用hclust函数,基于拓扑重叠不相似度(1-TOM)进行平均分层聚类。然后使用动态树截断算法(最小聚类大小为30,合并阈值函数为0.25)识别基因模块。根据表达水平与模块特征基因之间的Pearson相关性计算模块隶属度(MM),以识别模块内的枢纽基因。较高的MM表示这些基因在模块内具有较高的连通性。
为了将生理数据与网络相关联,模块特征基因与每个生理数据点相关联。基因显著性(GS)用于将生理数据与单个基因的表达数据相关联。
气孔孔径运动的分析
选取4周龄幼苗进行扫描电镜(SEM)分析。将倒数第二叶的中间部分切成0.5 cm的小片,然后在液氮中速冻以保持气孔形态。采用FEI Quattro S扫描电镜(Thermo Fisher Scientific, USA)对叶片气孔开度进行了观察。利用ImageJ软件分析气孔的开放状态和密度。每个重复选取4个随机大田计算气孔数。
定量实时反转录PCR分析
从叶片样品中分离总RNA(每个样品3个生物重复)。cDNA合成采用Thermo Scientific Revert Aid第一链cDNA合成试剂盒(Cat# K1622)进行逆转录(RT),按照制造商的方案进行。从RAP-DB (https://rapdb.dna.affrc.go.jp/index.html)。相关基因的引物序列从qPrimerDB (https://biodb.swu.edu.cn/qprimerdb/)(表S1) [77]。qPCR在Roche LightCycler 480 Real-Time PCR系统上进行,反应量为10 μL,使用SYBR绿色PCR Master Mix Kit (BIO-RAD, USA)。每个基因的相对表达量根据2——ΔΔCT方法(78]。的肌动蛋白基因(Os11g0163100)作为内参进行分析。
叶片相对含水量的测定
在每个采样点采集叶片样品,称重测定鲜重(FW)。然后将样品烘干至恒定干重(DW)。相对含水量计算公式为:RWC (%) = [(FW - DW) / FW] × 100%。
测定ABA、ROS和酶清除活性
采集PR403和PY6的新鲜叶片样品(0.15 g),在液氮中研磨成细粉,然后在1.35 mL PBS缓冲液(10 mM, pH 7.2)中重悬。上清液在5000rpm离心5min后用于后续检测。H2O2采用酶联免疫吸附测定(ELISA)试剂盒(MSKBIO,中国),按照制造商的说明测定SOA、ABA、SOD、CAT、POD和APX。
采用3,3′-二氨基联苯胺(DAB)和硝基蓝四氮唑(NBT)染色检测H的积累2O2和SOA在前面描述的方法之后[16]。
数据和材料的可用性
本研究过程中产生或分析的所有数据都包含在这篇发表的文章[及其补充信息文件]中。测序数据存入NCBI基因表达综合数据库(GEO)(登录号:GSE158928;https://www.ncbi.nlm.nih.gov/geo/query/acc.cgi?acc=GSE158928)。
改变历史
2020年11月10日
本文的修订版已经发布,可以通过原文访问。
缩写
- CSSL:
-
染色体单代换段线
- 度:
-
差异表达基因
- 单核苷酸多态性:
-
单核苷酸多态性
- MDA:
-
丙二醛
- WGCNA:
-
加权基因共表达网络分析
- ROS:
-
活性氧
- SOD:
-
超氧化物歧化酶
- 猫:
-
过氧化氢酶
- APX型:
-
抗坏血酸盐过氧化物酶
- TFs:
-
转录因子
- 公关:
-
Pathogenesis-related
- 圆荚体:
-
过氧化物酶
- PUFA:
-
多不饱和脂肪酸
- 主成分分析:
-
主成分分析
- 英国石油公司:
-
生物过程
- 答:
-
蜂窝组件
- MF:
-
分子功能
- DEHGs:
-
差异表达的枢纽基因
- 汤姆:
-
拓扑重叠矩阵
- MM:
-
会员模块
- g:
-
基因的意义
- 扫描电镜:
-
扫描电子显微镜
- 弗兰克-威廉姆斯:
-
鲜重
- DW:
-
干重
- 轻拍:
-
3, 3 ' -Diaminobenzidine
- 电视台:
-
硝基蓝四氮唑
参考文献
李建军,李建军,李建军,等。植物抗氧化活性的研究进展。植物科学进展,2016;21(8):677-85。
李建军,李建军,李建军,等。植物激素对逆境胁迫的调控作用。植物学报,2016;16(6):886。
朱霞,熊磊。水稻巨酶DWA1在水稻抗旱性调控中的作用中国科学:自然科学版,2013;39(5):391 - 391。
胡柏,李春华,李春华,等。干旱胁迫下植物气孔关闭前后的信号协调。新植物学报,2019;24(2):675 - 88。
胡华,熊林。抗旱作物的基因工程与育种。植物学报,2014,31(1):715 - 741。
罗LJ。中国节水抗旱水稻的选育。实验学报,2010;61(13):3509-17。
王晓明,王晓明。核桃种子萌发期抗旱基因型的筛选。HortScience。2009年,44(7):1815 - 9。
罗菲N, Vahdati K, Amiri R, Kholdebarin B.干旱对核桃萌发期胚根和胚芽糖和脯氨酸积累的影响。植物学报,2010;31(1):389 - 396。
娄强,陈玲,梅慧,魏慧,冯峰,王鹏,夏慧,李涛,罗林。水稻深生根数量性状位点的连锁关联定位。实验学报,2015;66(15):4749-57。
李利JM, Ludlow MM, mcouch SR, O'Toole JC。水稻渗透调节和耐脱水QTL定位。[J] .中国生物医学工程学报。1996;47(1):427 - 436。
黄丽,陈丽,王丽,杨艳,饶艳,任东,戴丽,高燕,邹伟,陆霞,等。nck相关蛋白1样蛋白通过参与水稻叶片表皮发育和气孔关闭来影响干旱敏感性。植物学报,2019;38(5):884 - 897。
黄学祥,晁达元,高建平,朱明志,石敏,林海霞。一种以前不为人知的锌指蛋白DST通过气孔孔径控制调节水稻的耐旱性和耐盐性。基因学报,2009;23(15):1805-17。
Uga Y, Sugimoto K, Ogawa S, Rane J, Ishitani M, Hara N, Kitomi Y, Inukai Y, Ono K, Kanno N,等。在干旱条件下,deep生根1对根系构型的控制可提高水稻产量。植物学报,2013,45(9):1097-102。
李建军,李建军,李建军,李建军,李建军,李建军,李建军,等。珍珠粟水分利用的定量性状分析[J]。r . Br。]。植物学报,2015,17(5):1073-84。
阿拉伯MM, Marrano A, Abdollahi-Arpanahi R, Leslie CA, Cheng H, Neale DB, Vahdati K.波斯核桃水分利用效率遗传因子的表型、基因型和环境组合。[J] .神经学报,2020;71(3):1107-27。
岑伟,刘健,卢生,贾鹏,于坤,韩勇,李锐,罗健。野生稻CTS-12基因在水稻冷驯化和脱驯化中的比较蛋白质组学分析。植物学报,2018;18(1):163。
高志刚,李建军,李建军,李建军,李建军,李建军,李建军,李建军。光合作用对水稻光合系统D1蛋白的影响。中国生物医学工程学报,2009;35(4):936 - 947。
徐丽玲,郭玉坤,白建刚,尚玲,王晓军。长期低温对弱光下2个黄瓜品种叶片超微结构和抗氧化活性的影响植物物理学报,2008;32(4):467 - 478。
Mori IC, Schroeder JI。活性氧激活植物Ca2+通道。极性生长的信号机制,激素转导,应激信号,和假设的机械转导。植物生理学报,2004;35(2):563 - 568。
Ramachandra Reddy A, Chaitanya KV, Vivekanandan M.干旱对高等植物光合作用和抗氧化代谢的响应。植物生理学报,2004;32(1):1 - 4。
王铮,王峰,洪毅,黄军,石辉,朱建军。两种叶绿体蛋白通过影响保卫细胞ROS的产生来抑制抗旱性。植物生理学报,2016;32(4):591 - 593。
王晓明,王晓明,王晓明,等。干旱胁迫下核桃种子萌发的生物化学研究进展。植物科学,2019;25(2):329 - 343。
王晓明,王晓明,王晓明,等。干旱胁迫对核桃叶片和根系过氧化物酶、愈创木酚过氧化物酶和抗坏血酸过氧化物酶活性的影响。植物学报,2010;861:309-16。
甘鹏,刘峰,李锐,王松,罗军。叶绿体对低温胁迫下光合作用的调控。中华医学杂志,2019;20(2):5046。
宗庆后W,唐N,杨J,彭L, Ma,徐Y,李G,熊L . ABA信号和生物合成的反馈调节bZIP drought-resistance-related基因转录因子的目标。植物生理学报,2016;17(4):2810-25。
刘健,张超,魏超,刘霞,王敏,于峰,谢强,杜杰。无名指泛素E3连接酶OsHTAS通过促进h2o2诱导的水稻气孔关闭来增强耐热性。植物生理学报,2016;17(1):429 - 443。
Bailey-Serres J, Parker JE, Ainsworth EA, Oldroyd GED, Schroeder JI。提高作物产量的遗传策略。大自然。2019;575(7781):109 - 18。
刘超,毛斌,欧生,王伟,刘丽,吴勇,初成,王旭。bZIP转录因子OsbZIP71对水稻耐盐耐旱的影响。植物化学学报,2014,31(1):19-36。
王晓明,王晓明,王晓明,王晓明,王晓明。植物抗旱性、抗旱性和抗旱性的研究进展。中国科学:自然科学版,2013;39(5):1272 - 1272。
沈继士,吴宁,郑培杰,金永义,崔永德,金建军。OsNAC14过表达提高水稻抗旱性。植物科学,2018;9:310。
杨马唐N, S,宗庆后W, N, Lv Y,燕C,郭Z,李J,李X, Y,等。MODD介导OsbZIP46的失活和降解,负调控ABA信号和水稻抗旱性。植物学报,2016;28(9):2161-77。
李赵王P, Y, Z,许CC,刘X,傅L,侯YJ, Du Y,谢年代,张C, et al。TOR激酶和ABA受体的相互调节平衡了植物的生长和胁迫反应。生物质化学工程,2018;39(1):1 - 4。
肖军,程华,李霞,肖军,徐超,王松。水稻WRKY13通过选择性结合不同顺式元件调控非生物和生物胁迫信号通路的串扰。植物生理学报,2013,31(4):368 - 368。
Yokotani N, Sato Y, Tanabe S, Chujo T, Shimizu T, Okada K, Yamane H, Shimono M, Sugano S, Takatsuji H等。WRKY76是一种水稻转录抑制因子,在稻瘟病抗性和冷胁迫抗性中起相反的作用。实验学报,2013;64(16):5085-97。
刘勇,沈启军。水稻WRKY基因家族的研究。植物学报,2007;49(6):827 - 842。
读写网。水稻WRKY基因名称冲突及其解决方法的命名报告。水稻学报,2012;5(1):3。
Pandey SP, Somssich IE。WRKY转录因子在植物免疫中的作用。植物生理学报,2009;32(4):448 - 456。
Takeuchi K, gyyohda A, Tominaga M, Kawakatsu M, Hatakeyama A, Ishii N, Shimaya K, Nishimura T, Riemann M, Nick P,等。水稻根系中RSOsPR10的表达受茉莉酸/乙烯和水杨酸信号通路的拮抗调控。植物生理学报,2011;52(9):1686-96。
刘建军,ekramodoullah AKM。植物致病相关蛋白家族10:它们在生物和非生物胁迫下的结构、调控和功能植物生理学报,2006;38(1):3-13。
发病机制相关蛋白-10是一种小的、结构相似但在胁迫信号传导中具有不同作用的蛋白。中华生物医学杂志,2014;41(2):599-611。
张建军,张建军,张建军,张建军,张建军,等。田间干旱高粱从幼苗到成熟的转录组学分析揭示了生物和代谢反应。科学通报,2019;37(5):391 - 391。
张志峰,李云云,肖宝珍。比较转录组分析强调了光合系统在旱稻适应干旱胁迫中的重要作用。科学通报,2016;6(1):349。
黄磊,张峰,张峰,王伟,周勇,付斌,李铮。水稻耐受性渗入系及其亲本对干旱胁迫的转录组比较测序。生物医学工程学报,2014;15(1):1026。
金涛,尹建辉,朴tk,金恩杰,朴超,王震,金思哲,金涛。油菜素类固醇调节激酶cdg1样1在气孔关闭过程中的OST1激活。植物学报,2018,30(8):1848-63。
Borah P, Sharma E, Kaur A, Chandel G, Mohapatra T, Kapoor S, Khurana JP。基于转录组的方法分析两种水稻品种干旱响应信号网络。科学通报,2017;7:42 - 31。
李建军,李建军,李建军,等。小麦WRKY转录因子在干旱胁迫下的转录组分析。生物医学工程学报,2014;39(5):765 - 781。
王志强,王志强。一种加权相关网络分析方法。生物医学工程学报。2008;9:559。
张波,郝华。加权基因共表达网络分析的一般框架。中国生物医学工程学报,2005;17(1):1 - 7。
周晓刚,黄晓林,梁思义,唐思明,吴世克,黄婷婷,莫珠珠,王启勇。加权基因共表达网络分析结肠癌病理分期相关miRNA及基因模块。2018; 11:2815-30。
Clarke C, Madden SF, Doolan P, Aherne ST, Joyce H, O'Driscoll, Gallagher WM, Hennessy BT, Moriarty M, Crown J等。将转录网络与乳腺癌存活相关:大规模共表达分析。致癌作用。2013;34(10):2300 - 8。
邓婷,梁安,梁生,马旭,陆旭,段安,庞超,华刚,刘森,康佩尔,等。利用转录组和GWAS数据进行整合分析,以确定与水牛产奶量性状相关的枢纽基因。《前沿日内瓦》,2019;10:36。
杜军,王生,何超,周波,阮玉玲,寿华。基于RNA测序的大豆结实率和大小调控网络及枢纽基因鉴定。实验学报,2017;68(8):1955-72。
Greenham K, Mockler TC, wening C, Guadagno CR, Ewers BE, Gehan MA, McClung CR.油菜轻度干旱早期生理和转录组学指标的时间网络分析。eLIFE。2017; 6: e29655。
[3]王晓明,王晓明,王晓明,等。拟南芥和水稻对干旱和细菌胁迫响应的基因和共表达模块。科学通报,2013;8(10):771 - 771。
张欣,冯辉,李忠,李东,刘松,黄宏,李敏。应用加权基因共表达网络分析识别口腔鳞状细胞癌发生过程中的关键模块和枢纽基因。Onco目标,2018;11:6 01 - 21。
王志强,王志强。植物光合作用中氧处理的调控及信号转导。中国生物医学工程学报,2009;16(3):359 - 359。
罗宾逊JM,邦斯JA。干旱诱导水分胁迫对大豆和菠菜叶片抗坏血酸-脱氢抗坏血酸水平和氧化还原状态的影响植物科学学报,2000;32(2):391 - 391。
李建军,李建军,李建军。植物脱落酸与非生物胁迫抗性的研究进展。植物学报,2016;7:571。
马鑫,夏慧,刘艳,魏慧,郑鑫,宋超,陈磊,刘宏,罗磊。干旱条件下水稻光合作用维持及抗旱性的关键代谢途径的转录组学和代谢组学研究。植物科学前缘,2016;7(1886):1886。
柴敏,Bellizzi M,万成,崔忠,李勇,王国良。NAC转录因子OsSWN1调控水稻二次细胞壁发育。植物学报,2015;58(1):44-51。
Davidson RM, Manosalva PM, Snelling J, Bruce M, Leung H, Leach JE。水稻芽样蛋白:等位基因多样性及其与早期胁迫反应的关系。大米。2010;3(1):43-55。
张丽,顾玲,Ringler P, Smith S, Rushton PJ,沈启军。三个WRKY转录因子加性地抑制淀粉粉细胞中的脱落酸和赤霉素信号。植物科学,2015;36:214 - 22。
Takeuchi K, Hasegawa H, Gyohda A, Komatsu S, Okamoto T, Okada K, Terakawa T, Koshiba T.水稻PR10基因RSOsPR10的过表达及其对干旱胁迫和盐胁迫的抗性。植物学报,2016;127(1):35-46。
李伟,朱忠,陈敏,尹军,杨超,冉玲,程敏,何敏,王凯,王军,等。水稻中一个转录因子的天然等位基因具有广谱抗病性。细胞学报,2017;17 (1):114-26 e115。
张辉,刘燕,文芳,姚东,王丽,郭军,倪丽,张安,谭明,姜敏。水稻c2h2型锌指蛋白ZFP36是水稻脱落酸诱导的抗氧化防御和氧化胁迫耐受的关键基因。[J] .中国生物医学工程学报,2014;35(6):591 - 591。
乔杜里FK, Rivero RM, Blumwald E, Mittler R.活性氧,非生物胁迫和胁迫组合。植物学报,2017;39(5):856-67。
氧化应激、抗氧化剂和应激耐受性。植物科学进展,2002;7(9):405-10。
非生物胁迫、田间环境与胁迫组合。植物科学进展,2006;11(1):15-9。
蔡铮,贾鹏,张军,甘平,邵强,金刚,王磊,金军,杨军,罗军。水稻白化穗枝质量性状位点wpb1的遗传分析及精细定位。科学通报,2019;14(9):e0223228。
李晨,吴长基,范立明。MYB转录因子在非生物胁迫信号传导中的积极作用。环境科学学报,2015;39(4):591 - 591。
王宁,张伟,秦明,李生,乔敏,刘志,向峰。大豆(Glycine max)的耐旱性。GmMYB84是一种新的R2R3-MYB转录因子。植物生理学报,2017;58(10):1764-76。
Naser L, Kourosh V, Bahman K, Reza a .可溶性糖和脯氨酸积累在波斯核桃萌发期抗旱性筛选中的有效指标。水果。2010;65(2):97 - 112。
Bagnaresi P, Biselli C, Orrù L, Urso S, Crispino L, Abbruscato P, Piffanelli P, Lupotto E, Cattivelli L, Valè G.耐寒抗性和易感水稻对稻瘟病早期反应的比较转录组分析(栽培稻l .)基因型。科学通报,2012;7(12):51609。
赵海燕,李翀,黄绍光,朴玉春,林海龙,张春春。编码漆酶前体的OsChI1基因的过表达增加了转基因拟南芥对干旱和盐胁迫的耐受性。基因。2014;552(1):98 - 105。
Walter W, Sanchez-Cabo F, Ricote M. GOplot:一个可视化地将表达式数据与功能分析相结合的R包。生物信息学,2015,31(17):2912 - 4。
Saeed AI, Sharov V, White J, Li J, Liang W, Bhagabati N, Braisted J, Klapa M, Currier T, Thiagarajan M,等。TM4:一个免费的开源系统,用于微阵列数据管理和分析。生物学技术。2003年,34(2):374 - 8。
陆凯,李涛,何军,常伟,张锐,刘敏,于敏,范勇,马军,孙伟,等。qPrimerDB:基于热力学的147种生物基因特异性qPCR引物数据库。中国生物医学工程学报,2018;46(1):1229 - 1236。
Livak KJ, Schmittgen TD。利用实时定量PCR和2(−△△C (T))方法。方法。2001;25(4):402 - 8。
致谢
我们感谢上海农业科学院高级研究员罗丽君提供亲本水稻种子。感谢审稿人和编辑对我们稿件的认真阅读和建设性意见,感谢广西大学亚热带农业生物资源保护与利用国家重点实验室(广西大学)科学仪器平台的技术支持,感谢在本研究中进行SEM分析的工作人员。
资金
国家自然科学基金(CN)(31671646)、广西百人计划(2015)、广西创新驱动发展专项(guikea - aa17204070)和亚热带农业生物资源保护与利用国家重点实验室(SKLCUSA-a201907,−a2011918, -a201801)资助。资助机构在研究的设计、数据的收集、分析和解释以及撰写手稿方面没有任何作用。
作者信息
从属关系
贡献
JL和RL构思并设计了实验。BY, JBL, DW, YL,和WC完成了所有的实验室实验。BY, JBL和DW进行了现场试验并收集了RNA-seq样本。JL、BY和WC处理数据。JL起草了手稿。JL, RL, BY和SW修改了手稿。所有作者都认可了手稿的最终版本。
相应的作者
道德声明
伦理批准并同意参与
不适用。
发表同意书
不适用。
相互竞争的利益
作者宣称他们没有竞争利益。
额外的信息
出版商的注意
施普林格·自然对已出版的地图和机构关系中的管辖权要求保持中立。
对本文原网络版本进行了修改:修改了归属顺序,修改了李荣白和罗吉静的归属关系。
补充信息
附加文件1:图。S1。
图表显示采样点和相应的植物材料表型。
附加文件2:图S2。
干旱处理下PR403和PY6 APX活性、内源ABA水平及气孔状态的测定(A) APX活性。(B) CAT活性。(C)叶片样品的NBT染色。(D)内源ABA含量。(E)干旱处理期间叶片气孔开放状态。顶板显示气孔孔径为完全打开、部分打开和完全关闭三个层次。下图为PY6和PR403 (n= 100个气孔(PR403和PY6)。(A)、(B)、(D)和(E)中每列顶部的不同字母表示基于Tukey’s HSD检验的方差分析(P< 0.05)。比例尺= 0.5 cm in (B), = 5 μ in (D)。
附加文件3:图S3。
qRT-PCR验证RNA-seq数据。的肌动蛋白以Os11g0163100基因为内源参比进行qPCR。选择Os01g0164600 (A)、Os01g0289600 (B)、Os02g0115700 (C)、Os03g0319400 (D)和Os04g0610400 (E)进行qPCR。所用引物的序列如表所示S1.
附加文件4:图S4。
在DEG GO富集分析中,细胞组分GO术语显着过度代表。(A) PR403取样点22处富含deg的GO项。(B) PY6取样点22处富含deg的GO项。(C) PR403采样点20处富含deg的GO项。(D) PY6取样点20处富含deg的GO项。气泡大小与每个go项的数量成正比,颜色表示-log10 (Qvalue)。
附加文件5:图S5。
分子功能GO项在DEG GO富集分析中显着过度代表。(A) PR403取样点22处富含deg的GO项。(B) PY6取样点22处富含deg的GO项。(C) PR403采样点20处富含deg的GO项。(D) PY6取样点20处富含deg的GO项。气泡大小与每个go项的数量成正比,颜色表示-log10 (Qvalue)。
附加文件6:图S6。
WGCNA中的软阈值功率估计。
附加文件7:图S7。
模块特征基因散点图与H2O2和MDA显著相关。(A) H2O2积累与黑色、蓝色、绿色、灰色模块相关60。(B) MDA积累与红色、棕色和宝蓝色模块相关。
附加文件8:图S8。
热图显示了枢纽基因在模块中的表达模式与H2O2和MDA积累相关。(A)黑色模块。(B)蓝色模块。(C)模块Grey60。(D)模块绿色。(E)红色模块。(F)布朗模块。分析中使用的所有数据都进行了log2变换。
附加文件9:图S9。
在与H2O2积累相关的模块中,中心基因的GO富集分析中,GO术语被过度代表。在模块(A)黑色、(B)蓝色、(C)灰60和(D)绿色中,氧化石墨烯的生物过程、细胞成分和分子功能方面分别被过度代表。气泡大小与每个go项的数量成正比,颜色表示-log10 (Qvalue)。
附加文件10:图S10。
在与MDA积累相关的模块中,中心基因的氧化石墨烯富集分析中,氧化石墨烯项被过度代表。氧化石墨烯在生物过程、细胞成分和分子功能方面分别在(A)红色、(B)棕色和(C)宝蓝色模块中被过度代表。气泡大小与每个go项的数量成正比,颜色表示-log10 (Qvalue)。
附加文件11:表S1。
用于qPCR的基因引物序列。
附加文件12:表S2-1。
PR403_CK22vsPR403_CK40 (log2FC≥1)和pr403_ck40 (log2FC≥1)的差异表达基因(DEGs)padj≤0.05)。表s2 2。PR403_CK20vsPR403_CK40 (log2FC≥1)和pr403_ck40 (log2FC≥1)比较中鉴定的差异表达基因(DEGs)padj≤0.05)。表S2-3。PY6_CK22vsPY6_CK40 (log2FC≥1)和spy6_ck40的差异表达基因(DEGs)比较padj≤0.05)。表S2-4。PY6_CK20vsPY6_CK40 (log2FC≥1)和py6_ck40的差异表达基因(DEGs)padj≤0.05)。表S2-5。PR403_CK22vsPR403_CK40 (log2FC≥1)和padj≤0.05)。表S2-6pr403_ck20vs spr403_ck40 (log2FC≥1)和padj≤0.05)。表S2-7。在PY6_CK22vsPY6_CK40 (log2FC≥1)和padj≤0.05)。表S2-8。在PY6_CK20vsPY6_CK40 (log2FC≥1)和padj≤0.05)。表S2-9。在PR403_22vsPR403_CK40 (log2FC≥1)和pr403_ck40 (log2FC≥1)比较中鉴定出的差异表达基因(DEGs)padj≤0.05)。表S2-10。pr403_20vs spr403_ck40 (log2FC≥1)和padj≤0.05)。表S2-11。比较PY6_22vsPY6_CK40 (log2FC≥1)和PY6_22vsPY6_CK40的差异表达基因(DEGs)padj≤0.05)。表S2-12。PY6_20vsPY6_CK40 (log2FC≥1)和padj≤0.05)。
附加文件13:表S3-1。
模块黑色枢纽基因表。表S3-2。模块蓝色枢纽基因列表。表S3-3。模块grey60枢纽基因列表。表S3-4。绿色模块枢纽基因列表。表S3-5。模块红色枢纽基因表。表S3-6。模块棕枢纽基因表。表S3-7。模块royalblue的枢纽基因列表。
附加文件14:表S4。
棕模块中差异表达的枢纽基因。
附加文件15:表s1 - 1。
模块黑色的GO富集结果。表S5-2。模块蓝的GO富集结果。表S5-3。模块grey60的GO富集结果。表S5-4。模块绿色的GO富集结果。表S5-5。模块红色的GO富集结果。表S5-6。模块棕氧化石墨烯富集结果。表S5-7。模组royalblue的GO富集结果。表S5-8PR403 22 vs PR403 CK40氧化石墨烯富集结果。表S5-9。PR403 20 vs PR403 CK40氧化石墨烯富集结果。表S5-10。PY6 22对PY6 CK40氧化石墨烯富集结果。表S5-11。PY6 20对PY6 CK40氧化石墨烯富集结果。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,该协议允许以任何媒介或格式使用、共享、改编、分发和复制,只要您适当地注明原作者和来源,提供知识共享许可协议的链接,并注明是否进行了更改。本文中的图像或其他第三方材料包含在文章的知识共享许可协议中,除非在材料的署名中另有说明。如果材料未包含在文章的知识共享许可中,并且您的预期用途不被法律法规允许或超过允许的用途,您将需要直接获得版权所有者的许可。如欲查阅本许可证副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域免责声明(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非在数据的信用额度中另有说明。
关于本文
引用本文
于斌,刘杰,吴迪。et al。基于加权基因共表达网络分析的水稻干旱敏感性相关关键模块和枢纽基因鉴定。BMC Plant Biol20.478(2020)。https://doi.org/10.1186/s12870-020-02705-9
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12870-020-02705-9
关键字
- 大米
- 转录组分析
- Drought-sensitive表型
- WGCNA
- 光合作用的抑制
- H2O2/ MDA积累
- 编码wrkeys /PR蛋白的DEGs