抽象的
背景
甜菜(Beta寻常魅力亚种。寻常的)是一种重要的经济作物,提供了全球近三分之一的糖分产量。甜菜孢囊线虫(BCN),异皮线虫属schachtii,造成世界范围内甜菜和其他作物的重大产量损失。防治该线虫最有效、最经济的方法是培育耐性或抗性品种。利用mRNA-seq技术,对甜菜和BCN在两个时间点的亲和和不亲和互作中的转录组进行了研究。
结果
在感病品种中,大部分防御相关基因在4代时被诱导,而在10代时被抑制,而在抗性品种Nemakill中,两个时间点均观察到与植物防御反应有关的基因的诱导。在亲和互作中,检测到植物激素相关基因的改变。研究了外源茉莉酸甲酯和et产生乙烯利对敏感植株的影响,结果表明,茉莉酸甲酯和et产生乙烯利显著降低了敏感植株的敏感性。鉴定了可能参与Nemakill抗性的基因,如苯丙类途径基因和编码CYSTM结构域蛋白、F-box蛋白、几丁质酶、半乳糖-1,4-内酯脱氢酶和casp样蛋白的基因。此外,我们还在感染的根样本中分析了BCN的转录组,发现了一些新的潜在的线虫效应基因。
结论
我们的数据为植物和线虫转录变化提供了详细的洞察,在甜菜和BCN之间兼容和不相容的相互作用期间发生的变化。许多重要的基因在对BCN的易感性或糖甜菜抗性中发挥潜在作用,以及一些具有潜在作用的BCN效应器avr公司鉴定了蛋白质。此外,我们的研究结果表明了茉莉酸酯和乙烯在增强BCN的糖甜菜防御反应中的有效作用。本研究为植物线涂层相互作用提供了新的分子见解,可用于设计对BCN的新颖管理策略。
背景
甜菜(Beta Vulgaris subsp。寻常的)是来自家庭Amaranthaceae的两年期,奥贝德和二倍体(2N = 18)植物,其在温带和亚热带地区培养[1].甜菜是全球最重要的作物之一,在58个国家而生长[2]约占世界食糖总产量的30%。它也是生物乙醇和动物饲料的重要来源[1].
许多农作物受到包括植物寄生线虫在内的各种病虫害的危害。据估计,全球每年因植物寄生线虫造成的作物损失达1570亿美元[3.].甜菜囊肿线虫(BCN,异皮线虫属schachtii[4.])自1859年在德国被鉴定为植物病原[5.]现已广泛分布于世界大部分甜菜种植区,造成相当大的产量损失(高达60%)。受感染的甜菜植株表现出生长发育迟缓、叶片萎蔫、根系发育异常等症状,也称为“胡须根”[6.].BCN的宿主范围非常宽,因为它可以感染200多种植物物种,主要是家庭的植物苋科(许多物种)bet和藜)芸薹科(如。Brassica oleracea.那显著那B拉帕那Rhaphanus sativus和拟南芥(特殊目的)[7.].
BCN的第二阶段幼年(J2)穿透宿主根,并通过皮质细胞迁移到血管圆筒中,以找到适当的喂养部位诱导的细胞。在选择单个细胞作为初始合胞细胞(ISC)后,它通过其探针分泌分子并从ISC开始喂养。然后,发生几百个相邻细胞的部分细胞壁溶解和原生质体融合,导致形成高度代谢的活性和多核合成胞合性。Syncytiaum是整个线虫生活中唯一的营养源。开始喂养过程后,J2变为久坐,三次蜕皮后成熟[8.].成年雄性线虫离开根中的合胞体与雌性线虫交配,而雌性线虫仍附着在进食地点,受精后在其扩大的身体内产生数百个卵。卵发育完成后,雌虫死亡,体壁变硬形成囊肿,囊肿保护卵直到孵化[9.]. 完整的生命周期取决于喂入结构的成功导入和维护。来自食管腺、两性体和表皮的线虫分泌物引起与植物基因表达谱的主要变化相关的细胞重编程事件。根结线虫和胞囊线虫的几种线虫效应因子,如纤维素酶、果胶酶、膨胀蛋白、分支酸变位酶和钙网蛋白等已被报道[10那11那12那13那14那15].
植物激素在线虫取食部位的形成和植物防御/敏感反应中基因表达的调控中起着重要作用[16那17那18那19那20.].在拟南芥中研究了水杨酸(SA)在植物对植物寄生线虫的防御中的作用。Wubben等人[19]结果表明,水杨酸缺乏的拟南芥突变体对BCN的敏感性增加,水杨酸处理的野生型植株对BCN的侵染率降低。Kammerhofer等人[17]建议SA在早期没有发挥重要作用H. Schachtii.感染,但可以在以后的时间点抑制合成和女性发展。此外,Kammerhofer等人。[17]结果表明,茉莉酸(JA)能触发拟南芥对BCN的防御。在其他植物种类中,大量研究表明,外源性施用JA可增强植物对寄生线虫的抗性[21那22那23]. 在拟南芥中,乙烯(ET)正影响BCN对根的吸引[17]ET在合胞体形成中也起着积极的作用[20.那24].
拟南芥亲和过程中的转录变化-H. Schachtii.使用差分显示和微阵列研究了相互作用[25那26那27].Puthoff等人[26]利用Affymetrix基因芯片比较了感染拟南芥根的基因表达H. Schachtii.或甘氨酸异胞菌大豆包囊线虫(大豆包囊线虫,SCN)感染后3天,分别鉴定出128个和12个基因的mRNA水平在BCN和SCN感染后改变。Szakasits等人[27]据报道,在合胞体中基因表达的诱导作用H. Schachtii.在比较两个时间点,5和15次戴时,在拟南芥根系上没有强烈不同。它们分析了21,138个基因的表达和鉴定了3893和3338个基因的表达,与对照根相比,同义词中的表达水平较高或更低。的ir results revealed that genes involved in degradation of cell walls (such as pectate lyases and expansins), chloroplast proteins (such as glyceraldehyde 3-phosphate dehydrogenase A, cytochrome B6-F complex iron-sulfur subunit) and chlorophyll a-b binding proteins were up-regulated. Among the strongly down-regulated genes, peroxidases and major intrinsic proteins (including aquaporins) were observed.
虽然甜菜是烟草的主要寄主H. Schachtii.,有关该宿主植物中基因表达的改变的信息有限,无论是易感还是抗性植物。培养甜菜中未发现对BCN的抗性。然而,一些商业抗性品种(例如,Nemakill,Savasion,Nematop)已经通过间隙之间产生了B. vulgaris.野生近缘种Patellifolia procumbens[28那29那30.那31].抗性品种含有易位的片段p . procumbens携带抗性基因的1号染色体高铁1号PRO-1.虽然高铁1号PRO-1是第一个克隆的抗线虫基因,编码一个282个氨基酸的蛋白,具有富含亮氨酸的重复序列(LRR)和一个跨膜结构域,其在甜菜抗BCN中的作用尚不清楚[32].第二种线虫抗性基因的存在高铁1–2在其附近高铁1号PRO-1尽管缺乏进一步的特征描述,但已经提出[33那34].
耐药甜菜被J2侵入H. Schachtii.合胞体可以建立取食点,但合胞体在线虫成熟之前就退化了,阻碍了线虫完成生命周期[32那35]. Samuelian等人[36]利用cDNA-AFLP技术鉴定了甜菜感染BCN诱导的基因。他们分析了8000个转录衍生片段(TDFs),这些片段来自易感和抗性甜菜(携带抗性基因)的受感染毛状根克隆高铁1号PRO-1).他们发现TDF_6,Beta寻常ki1.,在两种材料中差异表达,但在耐药植物中更强烈地表达。在转基因的过表达后,该基因能够抑制BCN在易感毛状根中的发育。
考虑到甜菜的重要性H. Schachtii.作为甜菜产量的主要限制因素,我们的研究旨在在两个时间点进行甜菜与BCN的糖甜菜相容和不相容的转录研究。结果揭示了防御反应,激素途径,代谢,营养和转录调节所涉及的基因的表达变化。此外,我们的实验表明,在敏感的糖甜菜植物上的外源性茉莉酸甲醇和Et-Dementorator Ethephon造成对BCN的诱导防御。在此旁边,我们已经确定了涉及在敏感或抗性种类的感染期间表达的品种Nemakill和线虫效应的抗性的推定候选基因。
结果
测序和映射
在本研究中,对未感染和BCN感染的感病和抗性甜菜植株的根组织mRNA在接种后4天(dai,早期)和10天(晚期)两个时间点进行了测序,并在2个独立的生物复制中进行了测序,共获得16个测序样本。在亲和互作中,线虫在4dai处于J2期,而在10dai处于J3后期。作为感病品种,我们与7112*SB36(伊朗甜菜种子研究所)合作,而抗性品种是Nemakill[29那31那37那38].
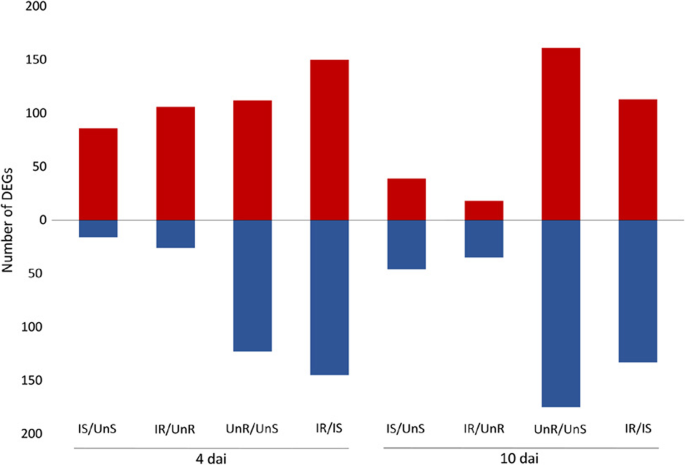
转录组测序共获得442691707个原始读数。每个样本的平均修剪读取数为26581145。总计425298335个修剪读取数为73–74 长度bp与甜菜参考基因组序列(Refbeet1.1[1])使用STAR和90-91%的测序读数可以在所有样本中唯一映射。独特映射读数的总数为385,810,355,表示糖甜菜转录组7.33x的平均样品覆盖率。表中显示了序列数据和映射结果的概述1.在登录号(GSE135555)下,排序数据已在国家生物技术信息(NCBI)基因表达综合症(GEO)中沉积。通过所有执行的一对比较获得的差异表达基因(DEGS)的数量如图4所示。1,并在下面作详细描述。
兼容糖束 - BCN相互作用中的差异表达基因(DEGS)
早期(4 DAI)
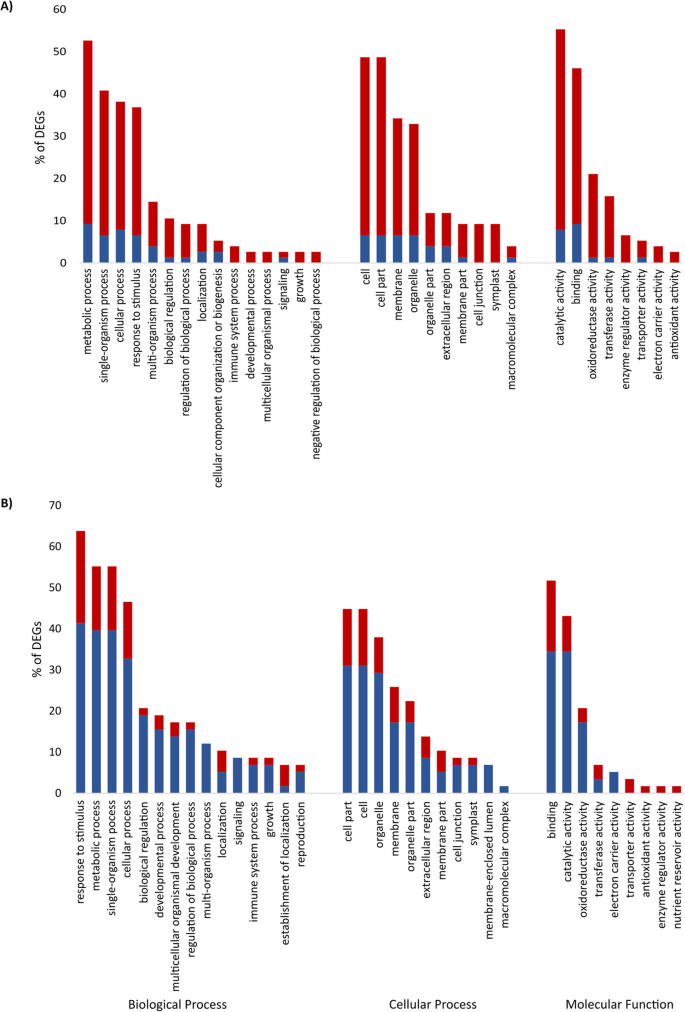
在感染的敏感根部Vs在4次达到其相应的未感染对照中显着差异表达了一百个转录物,其中86个基因上调,16个基因下调,表明在BCN的这种早期基因诱导的一般模式感染(附加文件1:表S1)。值得注意的是,在这102个deg中,有34个基因没有在PLAZA 3.0中进行功能注释。基因集分析显示,氧化石墨烯在代谢过程、单生物过程、细胞过程、刺激响应、多生物过程、催化活性、结合、氧化还原酶活性和转移酶活性等方面具有特殊的富集特征(图1)。2).
晚期(10〜戴)
在稍后的时间点(10dai),鉴定了85次,其中占据了39个基因,46个基因下调(附加文件1:表S1)。GO术语,对刺激,代谢过程,单生体过程,细胞过程,生物调节,结合,催化活性,氧化还原酶活性和转移酶活性的响应是最富集的(图。2).
兼容互动的一般变化
在亲和互作的两个时间点比较感染根和未感染对照的转录组,发现参与代谢、细胞壁结构、发育过程、运输、植物防御反应、转录因子和激素代谢的基因表达发生了显著变化。与细胞壁结构相关的基因,如果胶酯酶和多聚半乳糖醛酸酶(细胞壁降解)、富含甘氨酸的蛋白质(细胞壁蛋白质)和糖基转移酶(细胞壁合成)在两个时间点都显著上调(补充文件2:表S2)。此外,转运蛋白基因的表达,包括脂质转运蛋白、离子转运蛋白、ABC转运蛋白、肽和硝酸盐转运蛋白在两个时间点都发生了显著变化(另附文件)2:表S2)。In addition, the expression of some genes involved in plant hormone metabolism, including genes related to auxin (e.g. indole acetic acid, IAA), gibberellic acid (GA), abscisic acid (ABA) and cytokinin (CK), as well as SA, JA and ET was altered (Additional file2:表S2)。在研究植物防御反应相关基因时,我们发现在感病品种中,这些基因大部分在早期(4dai)被诱导,而在后期(10dai)被抑制。例如,编码NADPH-细胞色素P450还原酶和反式肉桂酸-4-单加氧酶的基因参与苯丙烷途径,分别在4天和10天时上调和下调(补充文件1)2:表S2)。属于Kunitz家族胰蛋白酶和蛋白酶抑制剂蛋白家族的四种蛋白酶抑制基因的表达在4次达中调节。在两个阶段诱导了编码Defensin样蛋白,谷胱甘肽S-转移酶基因(GST),两种芸苔类固醇不敏感1-相关受体(BAK1)基因和一些过氧化物酶基因的基因。另一方面,在4Dai和两种氨基-4,11-二烯-12单氧化蛋白基因,几种热休克蛋白(HSP),两种Diboa-葡糖苷(两种热休克蛋白),两种热休克蛋白(Hsp),两种热休克蛋白(Hsp),两种Diboa-葡糖苷(两种热休克蛋白)(两种热休克蛋白(Hsp))进行下调节基因。参与苯并恶嗪酮合成的二恶英酶Bx6基因 - 在10次达到抑制。分析还揭示了敏感糖甜菜植物中一些转录因子(TFS)的表达的变化:分别在4和10达中调节锌指TF的基因。将编码基本螺旋环 - 螺旋系列(BHLH)TFS的两种基因的表达在4位上调。
参与JA生物合成基因的两种Lineolee 9S-脂氧合酶基因在4位上调。在10 dai的受感染的根中,下调三个et-encooctive基因,例如一个apetala2 /乙烯响应转录因子(ap2 / serf)基因(附加文件2:表S2)。
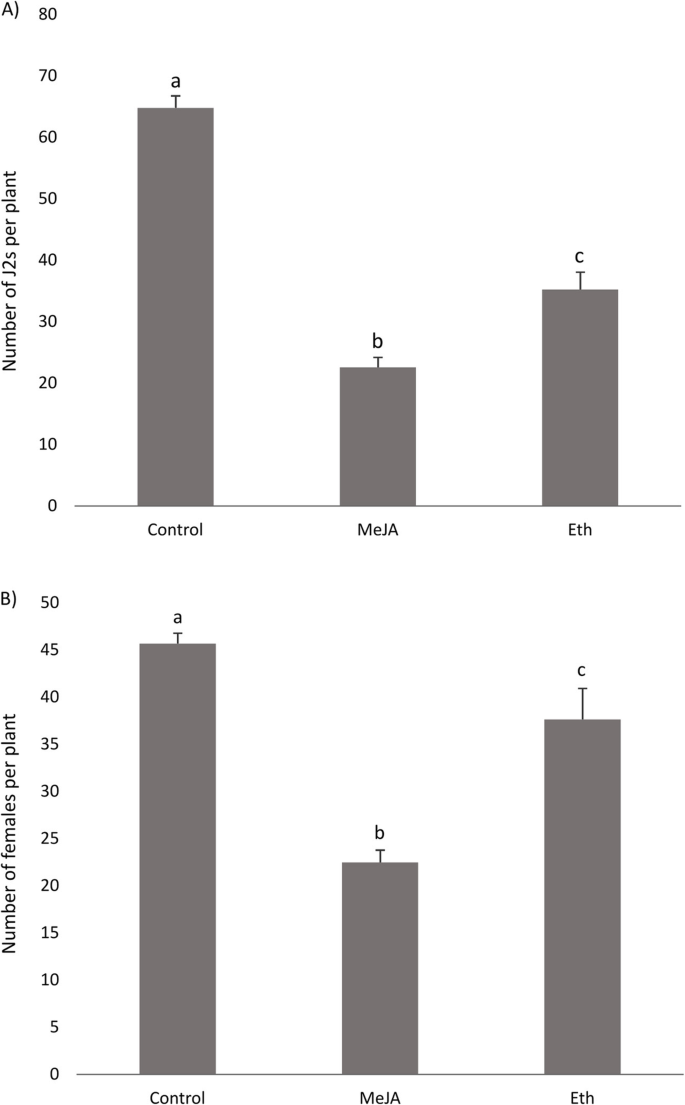
考虑到植物防御激素ET和JA在BCN侵染根中的某些基因发生改变,以及这些激素在甜菜抗BCN中的作用缺乏认识,研究了外源刺激这些激素对甜菜抗BCN免疫的影响。为此,我们用MeJA或ET发生器乙烯利24处理感病甜菜 h接种前。在4日龄和21日龄时,比较了处理植株和对照植株的J2s和雌蛾数量。外源施用Eth后,Eth处理植株的J2s数(4dai)低于对照。然而,在随后的时间点(21 dai)获得的结果(雌性被计数)在实验之间不一致(图。3.). 另一方面,结果表明,在所有试验中,MeJA处理的植株比对照植株的J2s(4dai)和雌株(21dai)显著减少。
在Nemakill中不相容的糖束-BCN相互作用中的差异表达基因(DEGS)
早期(4 DAI)
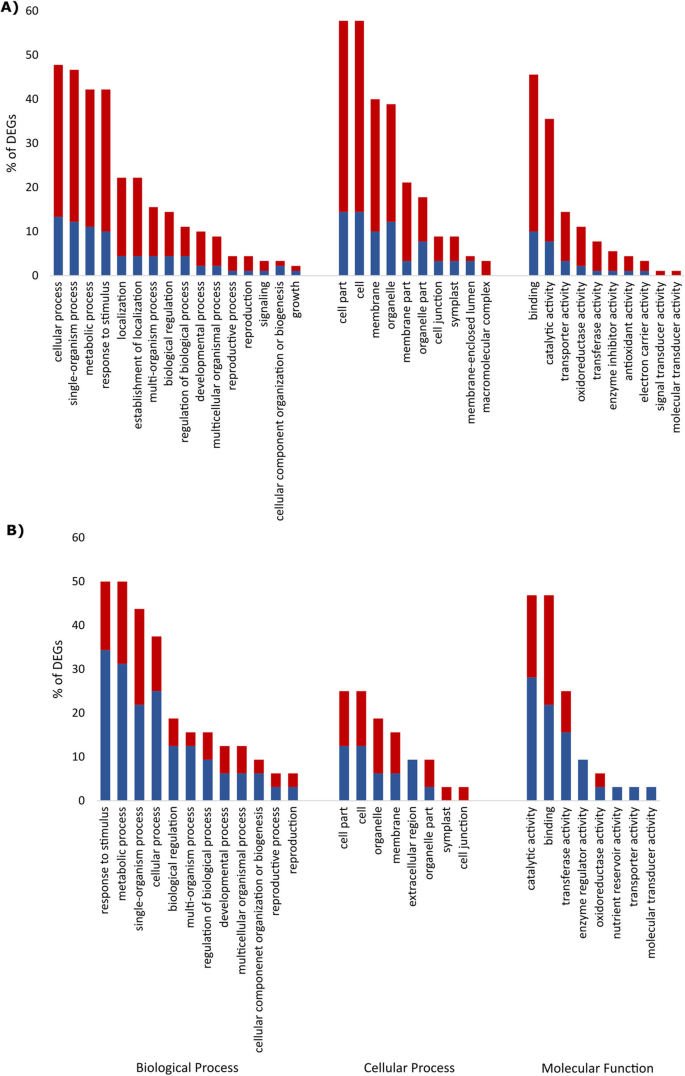
通过对抗病品种Nemakill侵染根与未侵染根在4dai时的转录组比较,共鉴定出132个DEGs,其中106个基因表达上调,26个基因表达下调(另附文件)3.:表S3),再次显示基因诱导的一般模式。这些基因中的四十八个在Plaza 3.0中没有功能注释。基因设定分析显示出特殊的富集,术后术语,细胞过程,单生体过程,代谢过程,对刺激,定位,多生物过程,结合,催化活性,转运蛋白活性,氧化还原酶活性和转移酶活性的响应(图。4.).
晚期(10〜戴)
在10 dai,差异表达53种转录物,其中诱导18个基因,抑制了35个基因(附加档案3.:表S3)。GO术语、对刺激的反应、代谢过程、单体过程、细胞过程、生物调节、催化活性、结合、转移酶活性和酶调节活性最丰富(图。4.).
不相容相互作用的一般变化
当考虑到这两个时间点时,结果通常显示与代谢、细胞壁结构、运输、植物防御反应、转录因子和激素代谢相关的基因表达的变化。一些与细胞壁结构有关的基因的表达,包括与细胞壁降解有关的基因(多聚半乳糖醛酸酶、木聚糖1,4-β-木糖苷酶、细胞壁相关水解酶和扩张蛋白)和细胞壁蛋白(阿拉伯半乳糖肽、富含甘氨酸的蛋白质和富含脯氨酸的蛋白质)的表达发生了改变(补充文件4.:表S4)。编码转运蛋白的几种基因 - 氨基酸转运蛋白,糖转运蛋白,脂质转运蛋白,肽转运蛋白,水素,ABC转运蛋白和离子转运蛋白 - 在4次达到(附加档案4.:表S4)。在专注于植物防御响应基因,蛋白酶抑制剂基因的Kunitz家族胰蛋白酶和蛋白酶抑制剂蛋白质,防御素样蛋白,木质素形成的阴离子过氧化物酶,中间偶联酶,达到的含蛋白质23,Burp畴蛋白质,Pr1,Pr6,囊体结构域-containing proteins and a ‘cell killing protein’ showed up-regulation in the incompatible interaction. Also, two genes of the zinc finger TF family, and a gene encoding basic-leucine zipper (bZIP) TF were induced in the infected sugar beet roots (Additional file4.:表S4)。这个expression of three genes involved in IAA biosynthesis were up-regulated at 4 dai. Genes related to ABA (2 at 4 dai and 1 gene at 10 dai) were induced in the infected roots compared to the uninfected samples. Moreover, a JA-responsive gene was up-regulated at 4 dai while some JA-induced proteins were suppressed at 10 dai (Additional file4.:表S4)。
此外,在10次达到含有富氨酸的重复(LRR)结构域的三种基因的表达上调(附加文件4.:表S4)。这个高铁1号PRO-1-抗病品种在感染和未感染条件下均表现出较强的基因表达。
糖甜菜转录组兼容性和不相容相互作用的比较
首先,应该提到的是,由于甜菜基因组的测序是最近才进行的[1],没有很好的注释基因组可用。其次,本研究中使用的甜菜基因型具有不同的遗传背景,因此比较它们对BCN感染的转录反应具有挑战性。因此,首先比较了两个甜菜品种在两个时间点未侵染根系的转录组,以阐明与这种不同遗传背景相关的一般差异。结果表明,236个基因在两个甜菜品种(UnR和UnS)未侵染根中的表达在4dai时有显著差异。在10dai时,比较两个品种的未侵染根(UnR和UnS),鉴定出337个DEGs。其中一些基因,包括编码咖啡酰辅酶A O-甲基转移酶、定向蛋白、查尔酮合成酶、tricetin 3′、4′、5′-O-三甲基转移酶、柠檬酸合成酶和内肽酶抑制剂的基因,在两个时间点,在未感染抗性植物中的表达均高于感病植物(补充文件1)5.:表S5)。在2个品种侵染植株之间(IR和IS)进行类似的比较,4个品种中发现295个DEGs, 10个品种中发现247个DEGs。在这些基因中,甲基转移酶,磷酸肌醇磷酸酶SAC6,与苯丙类途径相关的基因(如咖啡酰辅酶a o -甲基转移酶和花青素3 ' - o - β -葡萄糖基转移酶),参与信号传导的基因(包括钙结合蛋白,蛋白磷酸酶2c型,蛋白磷酸酶甲基酯酶和乳酰神经酰胺4- α -半乳糖基转移酶),F-box蛋白,水通道蛋白,木瓜样半胱氨酸蛋白酶和一些未知基因在IR和IS中高度诱导4,10或两个时间点(附加文件5.:表S5)。
为了鉴定与抗性相关的候选基因,我们将BCN诱导的两种品种的反应进行了比较,并寻找耐药品种Nemakill的更强或独占诱导。Aquaporin,双磷酸羧酸酶小链,F箱蛋白,受体样蛋白激酶,胰蛋白酶抑制剂,半乳酰-1,4-内酯脱氢酶,CasP样蛋白,丁质酶和16个未知基因在IR vs4 DAI(6.89≥log2fc≥2.0,附加文件6.:表S6)。3个假定的抗病基因、3个热休克蛋白、一个核还蛋白、et反应转录因子、多蛋白桥接因子1和一个未知基因在10代(6.02≥log2FC≥2.19,附加文件6.:表S6)。CYSTM结构域蛋白、14-3-3蛋白、ABC转运体、UDP-葡萄糖黄酮-3-O-葡萄糖基转移酶和一些未知基因也仅在抗病根中诱导表达。这些基因可能与品种Nemakill的不亲和反应有关[29那31那37那38].
转录组数据的验证
进行定量实时PCR(QRT-PCR)以验证mRNA-SEQ数据。从最初选择的基因,特异性扩增是成功的6种转录物。数据分析结果证实了QRT-PCR和MRNA-SEQ数据之间的一致表达模式(表2).
检测H. Schachtii.甜菜感染根中的转录本
在材料和方法一节中详细解释了感染感病根和抗性根的非甜菜图谱读数。共有1707份H. Schachtii.从感染的样本中鉴定。在早期(4dai),在感病样品和抗性样品中分别鉴定出342个和469个基因。在这个时间点上,两个品种之间共有211个线虫基因(附加文件)7.:表S7)。在后期(10dai),在感病和抗性样品中分别鉴定出1321和901个线虫转录本。品种间共有323个线虫基因(附加文件)7.:表S7)。
在所有感染的甜菜根部都表达了肌动蛋白,微管蛋白,泛素,核糖体蛋白,引发和伸长因子和热休克蛋白质的几个线虫管家基因。此外,鉴定了一些参与运输和脂质代谢的基因。在转录物中,检测编码细胞壁降解酶(细胞壁相关水解酶和多糖酶)和肽酶(天冬氨酸,金属和丝氨酸)的一些基因(附加文件7.:表S7)。
关于寄生,检测到编码抗氧化剂的基因,如硫氧还蛋白相关跨膜蛋白(在所有处理中)、超氧化物歧化酶(IS-10 dai和IR-10 dai)、谷胱甘肽S-转移酶(IS-10 dai和IR-10 dai)和细胞色素C-过氧化物酶。此外,还发现了一些已知或推测的效应基因,包括组织蛋白酶(IS-4 dai中有一个转录本,IR-4 dai中有两个转录本,IS-10 dai和IR-10 dai中有三个转录本),泛素延伸蛋白(IS-4 dai,IR-4 dai,IS-10 dai),14–3-3蛋白(IS-4 dai中有一个转录本,IR-4 dai和IR-10 dai以及IS-10 dai中的两个转录物)、钙网蛋白(IR-4 dai中的两个转录物、IS-10 dai和IR-10 dai)、C型凝集素(IS-10 dai和IR-10 dai中的两个转录物)、转甲状腺素样蛋白(IS10中的五个转录物、IR10中的三个转录物),食管腺细胞分泌蛋白(IS-10 dai中有6个转录物,IR-10 dai中有3个转录物)和未鉴定的效应蛋白(IR-4 dai和IR-10 dai中有2个转录物,IS-10 dai中有3个转录物)。一个编码自噬相关蛋白的基因和一个编码冷休克样蛋白的基因仅在两个时间点的抗性根中检测到,表明线虫在不亲和互作中受到胁迫。另外,编码Bax抑制物1蛋白(一种细胞死亡抑制物)的基因仅在感染抗性根的线虫转录物中检测到10天。
讨论
全球对糖的需求,作为食品和饮料最重要的组成部分之一,正在迅速增加。糖甜菜占欧洲几乎所有的糖生产,超过世界总产季度(30%)。在减少糖甜菜产量的因素中,H. Schachtii.(BCN)被称为主要的限制因素,但关于在分子水平的糖甜菜和BCN之间的相互作用众所周知[36].为了提高我们的知识,使用下一代测序(NGS)技术进行转录组分析,以研究与感染的相容和不相容的糖甜菜反应H. Schachtii.因此,收购了总计约4.43亿元的BP原始读数。我们鉴定了与细胞墙架构,代谢,营养,信号转导,应力,防御反应和植物激素有关的大量基因,在BCN感染后表达显着改变了表达。仅在不相容的相互作用中上调但在相容相互作用中较不受影响或甚至抑制的基因可能可能与甜菜对BCN的抗性响应有关。
例如,三个编码含CYSTM结构域蛋白的基因在甜菜抗BCN侵染的根中被上调。有人认为,CYSTM蛋白是包括人类在内的真核生物抵抗应激的细胞保护机制的一部分[39].的PCC1拟南芥的基因属于该组,编码了81-氨基酸蛋白,其富含半胱氨酸的结构域,该致域涉及对包括病原体的应力的发展和防御反应[40].到目前为止,尚未报告这些基因在植物线虫相互作用中的作用。
一个编码几丁质酶的基因在BCN感染的感病植株中早期表达下调,而在感染的抗性植株中表达显著上调。几丁质酶基因在不同植物中的表达变化是线虫的防御机制[18那41].Guimaraes等人[42]建议扮演Aschi2.在辩护响应花生来Meloidogyne arenaria..
此外,与感病植株相比,在4dai时,一个编码SKIP23的基因在感病植株中被高度诱导,SKIP23是一种含有未知功能域的F-box蛋白(DUF295)。F-box蛋白是SCF(SkpⅠ、Cullin和F-box蛋白)泛素连接酶(E3)复合物的组成部分,介导泛素化和随后的蛋白酶体降解靶蛋白。这些蛋白质在植物发育等不同过程中发挥着不同的作用[43那44那45,生物钟调节[46那47],激素感知和信令[48那49那50那51那52那53],对非生物胁迫的反应[54那55那56那57]植物与病原菌的相互作用[58那59那60那61]. 发现蛋白SKIP23与ASK1相互作用,ASK1是例如strigolactone-SCF受体复合物的一个组分[62那63]还有14-3-3蛋白拟南芥[64].有趣的是,与对照相比,编码14-3-3蛋白的线虫衍生的转录物在受感染的抗性根中积聚。虽然需要更多的调查来阐明该基因的确切作用,但虽然需要更多的调查,但F型盒蛋白Skip23在糖甜菜品种Nemakill抗性中的作用似乎可能是阐明该基因的确切作用。另一方面,已经显示了具有Duf295结构域(抗坏血酸甘露糖途径调节剂1,AMR1)的类似F箱蛋白参与调节拟南芥中抗坏血酸生物合成途径中几种基因的表达[65].抗坏血酸是一种具有高抗氧化活性的重要天然化合物。植物中抗坏血酸的主要生物合成途径是“Smirnoff-Wheeler”途径[66]最后一步是L-半乳糖-1,4-内酯被酶氧化成L-抗坏血酸L-galactono-1, 4-lactone脱氢酶(GLDH公司)在线粒体中[67]. 在这里观察到的抑制GLDH公司抗坏血酸在甜菜抗病性中具有潜在的作用H. Schachtii..相似地, [68]表明,根结线虫侵染后,抗根结线虫番茄品种的根系中抗坏血酸有显著积累,而敏感植株中无显著积累。
在易感品种中观察到抑制参与苯基丙醇型途径的一些基因,而在耐药品种中诱导几种苯丙醇相关基因,例如脱脂蛋白,Chalcone合酶,咖啡酰基CoA O-甲基转移酶,花青素3'-O-β- 氟糖基转移酶和UDP-葡萄糖黄酮3-O-葡糖糖基转移酶。这表明该途径在糖甜菜对BCN的抗性中的重要性。苯丙醇素是一类大类次级代谢产物,包括SA,木质素,黄酮类,香豆素,木质素等[69].这种途径的基因抑制已经在以前的植物- rkn相互作用中观察到[18那70]而在亲和植物CN或植物迁飞线虫互作中有诱导的报道[18那71.].
与未感染的抗性植物和4次达到易感植物相比,在感染的抗性根部检测到属于尸体带膜域域蛋白(CasP)-like蛋白的基因,属于“无特征化蛋白质FumF0497”。休息室介导尸体条形,由木质素聚合物组成,并作为选择性营养吸收和胁迫阻力的副细胞屏障,也反对线虫[72.]. 它也在激素信号通路的激活中发挥作用[73.那74.那75.那76.].
在引起激素途径的基因中,与JA生物合成和脂氧基酶和BHLH TFS等反应有关的基因在早期的易感根中上调,同时在后期未诱导它们的表达。同样,Kammerhofer等人。[17]线虫接种早期JA生物合成相关基因表达上调。这种诱导可能与细胞内线虫侵入引起的损伤反应有关,也可能与植物对线虫存在的防御反应有关。结果表明,感病甜菜经MeJA叶面处理后,其J2s侵染率(4dai)和雌株数(21dai)均显著低于未处理植株。这些结果揭示了JA在甜菜抗逆系统防御中的积极作用H. Schachtii..
在我们的转录组数据中,属于ET途径的基因在感病植株中普遍被抑制,而ET反应性TF在侵染抗性根中在10dai时被诱导。为了研究ET在甜菜抗BCN防御反应中的作用,我们在感病甜菜植株的新梢上施用Eth,结果表明Eth处理植株的J2s感染率和雌性发育率低于对照,尽管在一个试验中对雌性发育的影响不显著。与我们的结果相反,24小时高感染率和穿透bcnj2s的数量和Eth处理的拟南芥根中的雌性数量没有显著差异[17]. 事实上,ET在线虫吸引、取食部位形成和发育以及植物防御中的相互矛盾的作用已经被报道[17那20.那24那77.那78.那79.那80那81.那82.那83.],可能是因为它在发展和防御中的肺炎作用[84.]. 综上所述,ET可能在甜菜抗BCN中发挥作用,但还需要进一步的研究来揭示ET在线虫、取食地发育和植物防御的不同阶段中的确切作用。
关于存在的存在高铁1号PRO-1在抗性品种中的基因,评估该基因的表达水平,并且我们的分析表明该基因在抗性栽培品种的感染和未感染条件下高度表达。另外,与10Dai的无感染或受感染的易感根相比,在BCN感染的抗性根部有三种其他推定的疾病抗性基因,具有LRR和NBS弧结构的其他具有LRR和NBS弧结构的另一个基因。这些数据揭示了在BCN感染时Nemakill品种中R-基因复合物的潜在激活。
结论
本研究是首次对甜菜与小麦的亲和和不亲和互作进行转录组分析H. Schachtii.增加了我们对甜菜抗BCN分子机制的认识。已鉴定出大量DEGs基因,包括许多在甜菜抗BCN易感性或抗性中起潜在作用的重要基因。此外,还发现了一些编码线虫效应因子的基因,其中一些基因仅在抗性根中检测到,这表明线虫效应因子可能在植物中发挥重要作用airulence.(avr公司)需要进一步阐明的蛋白质。结果表明,茉莉酸盐和乙烯在提高甜菜对BCN的基础防御反应中发挥了有效作用。本研究的结果扩展了我们对植物-线虫相互作用的认识,可用于甜菜抗BCN育种。
方法
植物材料和线虫感染
本研究以伊朗甜菜种子研究所(SBSI)的一个感病甜菜品系(7112*SB36)和一个抗性品种(Nemakill, Syngenta)的种子为材料。的存在高铁1号PRO-1通过PCR扩增和Sanger测序(genbank登录号MT845291)在Nemakill中证实了该基因。易感品种不含该基因。甜菜种子在无菌土壤上萌发3天 第28天 摄氏度。将幼苗转移到树液基质(吸砂聚合物)上[85.];) 在25岁的时候被关在一个生长室里 ± 2. 摄氏度,16 h灯/8 黑暗。纯粹的人口H. Schachtii.在相同条件下,在无菌盆栽土壤中,对一个感病甜菜品种(Jolgeh,SBSI,Iran)进行繁殖。J2s是从浸泡在3.0μg/l溶液中的囊肿中提取的 氯化锌2刺激孵化。甘蔗植物的十五天旧的根部接种了300个新鲜的J2SH. Schachtii.. 对照植株模拟接种水。在4个(早期)和10个(晚期)dai两个时间点采集感染植株和对照植株的整个根系组织,然后用水冲洗,立即在液氮中冷冻,并储存在贮藏室中− 80 °C,直到提取RNA。对于每个时间点,收集两个独立的生物复制品,每个复制品由六个单独的植物组成。
RNA分离,文库制备和测序
根据制造商的方案,在4和10次戴在4和10次戴中萃取总RNA,并根据制造商的方案,加入缓冲液RLT后的额外超声处理步骤30s。使用Nanodrop 2000c(Thermo Fisher Scientific,Belgium)评估每个RNA样品的数量和质量。对于每个样品,使用QuaneQ 3'MRNA-SEQ库预备试剂盒(Lexogen)用于文库制备的2μg总RNA(Lexogen):在其5'末端的含有illumina相容接头序列的寡码底漆与RNA杂交并进行逆转录。在第一链合成之后,除去RNA,并通过随机灌注和DNA聚合酶引发第二链合成。随机引物在其5'末端还含有illumina相容的接头序列。第二链合成之后是基于磁珠的纯化步骤。进行文库的扩增,在PCR扩增步骤期间执行条形码。在最后一步中,通过磁珠纯化双链文库以除去所有反应组分。使用安捷伦生物分析仪2100确认图书馆的质量。在群集生成之后,在NextSeq 500 Illumina测序平台上测序16个文库以产生单端76bp读取。 The samples were multiplexed to minimize lane effects. Library construction and sequencing were carried out by the NXTGNT sequencing center (Ghent University, Belgium).
mRNA-SEQ数据分析
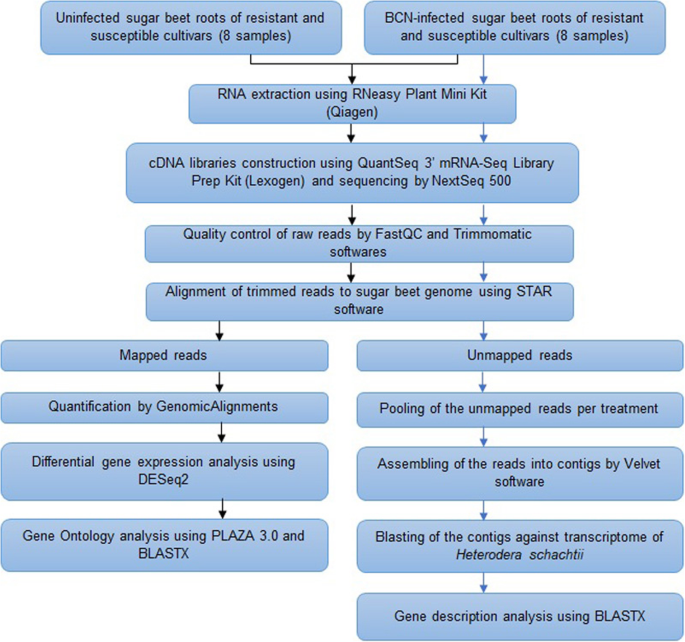
数据分析管道的概述如图2所示。5..对于每个样本,通过FASTQC评估测序数据质量[86.].Trimmomatic [87.]使用5个碱基的滑动窗口来提高数据质量:对phred得分低于20的碱基进行修剪,读取长度小于40 nt被移除。将每个样本的修剪读数与Beta Vulgaris subsp。寻常的参考基因组(参考文献1.1[1])使用星星软件[88.].没有在糖甜菜基因组上映射的读取,以识别线虫转录物(参见'检测感染根样本中的线虫转录物)。转录组大小被计算为所有初级转录物的长度的总和。
使用GenomicaligningR包的汇总逻辑函数计算映射到每个条件的每个条件的调整读数的数量[89.]. 如果一个基因在每种条件的两个重复中的原始计数值都大于1,则认为该基因是表达的。读取数据被标准化,差异表达基因(DEG)被用R包装“DESeq2”鉴定[90.].在该软件中,计数除以通过基因计数相对于每个基因的几何平均值确定的样本特定的大小因子。使用从DESEQ2的WALD统计信息使用FDDOOL包(1.2.15)执行经验空建模作为输入[91.]. 调整P.-使用Benjamin-Hochberg算法计算每个错误发现率(fdr)估计值。转录被认为是显着DEGs时,调整P.-价值是< 0.05. 对于每个时间点,感染样本中每个转录物的表达水平与对照组进行比较2在本研究中进一步使用转化的折叠变化(Fc)值。
基因本体学分析
使用Plaza 3.0进行基因本体(GO)分析(https://bioinformatics.psb.ugent.be/plaza/versions/plaza_v3_dictots/).PLAZA包含植物的结构和功能注释、基因家族、蛋白质结构域等信息[92.]. 使用PLAZA 3.0工具,将差异表达的转录本分配到GO类别并进行功能注释。利用NCBI在线blast服务(E值<1e-5),将PLAZA 3.0中未注释的基因与非冗余蛋白序列进行BLASTX比对。
中存在的验证
根据mRNA-seq结果,选择10个基因进行验证。使用Primer3 (http://bioinfo.ut.ee/primer3-0.4.0/)和ape v2.0.49.10软件。甘油醛3-磷酸脱氢酶,BvGAPDH公司,用作参考基因[93.那94.]. 在qRT-PCR中,取感病株和抗病株的独立样本进行RNA提取。所有的反应都是通过两个生物和三个技术复制来完成的。总共2个 每μg RNA样品用2 DNA酶U(Thermofisher)。cDNA合成采用200 Tetro逆转录酶和寡核苷酸(dT)的U18底漆(Tetro cDNA合成试剂盒,Bioline,德国)根据制造商的协议。在CFX连接实时PCR机(BiORAD,USA)上使用Sensimix TM Sybr No-Rox(Bioline,德国)进行定量实时PCR,如下:95°C和40个放大循环的初始变性10分钟(25s在95°C,25℃,58℃和20s,72℃)。在最后一步之后,通过逐渐增加温度至95℃,使用熔化曲线测试特异性。使用休息2009分析数据[93.].所有基因的表达水平使用内部控制标准化BvGAPDH公司并采用2计算目的基因的相对表达量-ΔΔct方法[94.].本研究中使用的所有引物列于其他文件中8.:表S8。
检测感染根样本中的线虫转录物
使用Velvet软件(版本1.2.10)将每个品种在每个时间点的复制品的未映射读数汇集并组装成重叠群[95.];). 挫败者被击打在H. Schachtii.[96.那些得分略高于50分的连缀被认为是H. Schachtii.. 使用NCBI在线blast服务(E值<1e-5)对非冗余蛋白序列进行BLASTX。
化学处理和统计分析
使用敏感的甜菜系列(7112 * SB36)。将幼苗转移到聚氯乙烯(PVC)管中的无菌土壤中,并在如上所述的相同条件下进一步生长。在含有0.02%(v / v)吐温20的蒸馏水中,制备茉莉酸甲酯(Meja,100μm,sigma-alriCh)或Et发生剂ethephon(eth,500μm,sigma-Aldrich)作为表面活性甜剂。将两周甜菜甜菜植物的叶子喷雾用蒸发器喷洒,直至用两种化合物的细雾耗尽。对于对照植物,施加含有0.02%(v / v)吐温20的蒸馏水。化学处理后的一天,用300个新鲜的J2S接种甘蔗植物的根,如先前步骤所述。通过分别计算J2S和女性的数量,在4和21次达到植物的感染水平。为了使J2S可视化,在4 dai酸紫红色染色根部[22]. 每个试验包括每个处理的10株植物,所有试验独立重复3次。
采用SPSS统计软件V22.0进行统计分析。在确定数据的正态性和同质性后,采用单因素方差分析和邓肯多区间检验检验处理间的显著性差异(P. < 0.05).
数据和材料的可用性
序列的部分序列高铁1号PRO-1甜菜品种Nemakill的基因已保存在GenBank数据库中,登录号为MT845291。在当前研究中产生的mRNA数据集可在NCBI基因表达综合数据库(GEO)获得,登录号为GSE135555。这个Beta Vulgaris subsp。寻常的参考基因组和转录组H. Schachtii.是从http://bvseq.boku.ac.at/genome/download/refbeet-1/1/和https://www.ncbi.nlm.nih.gov/sra/?term=SRX381021分别是。
缩写
- 业务连续性:
-
甜菜囊肿线虫
- 戴:
-
接种后的天数
- 度数:
-
差异表达基因
- 电子技师:
-
乙烯
- 以太币:
-
乙烯利
- 是:
-
感病根
- 红外光谱:
-
抗感染根
- 青年成就组织:
-
茉莉酸
- 梅贾:
-
茉莉酸甲酯
- qRT PCR:
-
定量真正time-PCR
- 运输工具:
-
转录因子
- UnR编号:
-
未侵染抗性根
- 联合国:
-
未感染的易感根
参考
- 1.
Dohm JC、Minoche AE、Holtgrawe D、Capella Gutierrez S、Zakrzewski F、Tafer H、Rupp O、Sorensen TR、Stracke R、Reinhardt R等。最近驯化的作物甜菜的基因组(Beta寻常魅力).自然。2014; 505(7484):546-9。
- 2.
联合国粮食及农业组织。FAOSTAT统计数据库[[罗马][http://www.fao.org/faostat/en].
- 3.
Abad P、Gouzy J、Aury JM、Castagnone Sereno P、Danchin EG、Deleury E、Perfus Barbeoch L、Anthouard V、Artiguenave F、Blok VC等。后生动物植物寄生线虫的基因组序列有隐姓埋名的女人.NAT BIOTECHNOL。2008; 26(8):909-15。
- 4.
施密特A.关于甜菜线虫。Zollverein。1871; 21:1-19。
- 5.
沙赫特H。Über einige Feinde der Rübenfelder.雷本费尔德。Zeitschrift Vereines Rübenzucker Industrie Zollverein公司。1859;9:175–9.
- 6.
Biancardi E、McGrath JM、Panela LW、Lewellen RT、Stevanato P。甜菜。在:根和块茎作物。纽约:斯普林格·维拉格;2010年。173–219.
- 7。
富兰克林山异皮线虫属schachtii. 在:C.I.H.植物寄生线虫的描述。Wallingford CAB international,n.d.St.Albans:联邦蠕虫研究所;1972年。4.
- 8。
Wyss U,Grundler FMW。封闭植物寄生线虫的饲养行为。Neth J植物豪索尔。1992年; 98(2):165-73。
- 9。
赫西RS,格兰德勒调频。线虫寄生植物。正确答案:Perry RN, Wright DJ,编辑。自由生活线虫和植物寄生线虫的生理生化。第1版。Wallingford: CABI出版;1998.213 - 43页。
- 10
Ali S、Magne M、Chen S、Cote O、Stare BG、Obradovic N、Jamshaid L、Wang X、Belair G、Moffett P。线虫的质外体效应物分析,喙突球绦虫,以及一种可以诱导和抑制宿主防御的扩张蛋白样蛋白的鉴定。《公共科学图书馆•综合》。2015;10 (1):e0115042。
- 11
贝卡尔S、尼布拉克TL、兰伯特KN。大豆胞囊线虫的分支酸变位酶甘氨酸异胞菌显示与毒力相关的多态性。植物与微生物相互作用。2003;16(5):439–46.
- 12
Jaouannet M,Magliano M,Agguel MJ,Gourgues M,Evangelisti E,Abad P,Rosso Mn。根结Nematode Calretetitulin Mi-Crt是植物防御抑制中的关键效应器。Mol植物微生物相互作用。2013; 26(1):97-105。
- 13.
Mitrava-Dautova M,Roze E,Overmars H,De Graaff L,Schots A,Helder J,Poverse A,Bakker J,Smant G.来自植物 - 寄生线虫的Symbiont独立的endo-1,4-Beta-β-β-β-二甲苯酶有隐姓埋名的女人.Mol植物微生物相互作用。2006; 19(5):521-9。
- 14.
Qin L,Kudla U,Roze Eh,透过透,Popeijus H,Nieuwland J,Overmars H,Jones JT,Schots A,Smant G等人。植物降解:在植物上作用的线虫扩展素。自然。2004; 427(6969):30。
- 15.
其他线虫效应因子和进化限制。植物线虫相互作用的基因组学和分子遗传学。荷兰:施普林格;2011.p . 287 - 307。
- 16.
摘要/ abstract Ji H, Kyndt T, He W, Vanholme B, Gheysen G. effects of β -氨基丁酸诱导水稻对根结线虫的抗性是基于增强的基础防御。植物与微生物的分子相互作用。2015;28(5):519-33。
- 17.
Kammerhofer N、Radakovic Z、Regis JM、Dobrev P、Vankova R、Grundler FM、Siddique S、Hofmann J、Wieczorek K。胁迫相关激素在胞囊线虫侵染早期植物防御中的作用异皮线虫属schachtii在拟南芥中。新植物。2015; 207(3):778-89。
- 18。
Kyndt T,Denil S,Haegeman A,Trooskens G,Bauters L,Van Criekinge W,De Meyer T,Gheysen G.通过稻米根结和迁徙线虫感染的转录重新编程。新植物。2012; 196(3):887-900。
- 19。
WUBBEN MJ,JIN J,BAUM TJ。囊肿线虫寄生寄生拟南芥被水杨酸(SA)抑制,并在根中诱导SA独立的致病相关基因表达。植物与微生物的相互作用。2008;21(4):424-32。
- 20.
WUBBEN MJ 2ND,SU H,RODERMEL SR,BAUM TJ。对甜菜囊肿线虫的易感性通过乙烯信号转导的调节拟南芥.摩尔潘 - 微生物相互作用。2001; 14(10):1206-12。
- 21.
库珀·W·贾·L·戈金·L。茉莉酸诱导防御对番茄抗感品种根结线虫侵染的影响。化学经济杂志。2005;31(9):1953–67.
- 22。
Nahar K、Kyntt T、Nzogela YB、Gheysen G。脱落酸与水稻迁飞线虫相互作用的经典防御途径相互作用。新植物醇。2012;196(3):901–13.
- 23。
索里亚诺IR,Asenstorfer Re,Schmidt O,Riley It。燕麦(Avena Sativa)的诱导型黄酮是对植物寄生线虫的新型防御。植物病理学。2004; 94(11):1207-14。
- 24。
Goverse A、Overmars H、Engelbertink J、Schots A、Bakker J、Helder J。胞囊线虫取食细胞的诱导和形态发生都是由生长素介导的。植物与微生物相互作用。2000;13(10):1121–9.
- 25。
Hermsmeier D,HART JK,BYZOVA M,RODERMEL SR,BAUM TJ。MRNA丰富的变化异皮线虫属schachtii- 感染根源拟南芥. 植物与微生物相互作用。2000;13(3):309–15.
- 26。
Puthoff DP,Nettleton D,Rodermel SR,Baum TJ。拟南芥基因表达在囊肿寄生期间通过微阵列表达谱的统计分析显示。工厂J. 2003; 33(5):911-21。
- 27
Szakasites D、Heinen P、Wieczorek K、Hofmann J、Wagner F、Kreil DP、Sykacek P、Grundler FM、Bohlmann H。胞囊线虫诱导的合胞体转录组异皮线虫属schachtii在拟南芥根。工厂J. 2009; 57(5):771-84。
- 28
多雷克,瓦罗夸克F。植物文化的历史与发展。法国:巴黎;2006
- 29
Pylypenko L,Kalatur K.糖甜菜品种的育种和用法耐甜菜Nematode Schachtii。农业科技。2015; 1:12-22。
- 30
Pylypenko L、Kalatur K、Hallmann J。甜菜线虫在乌克兰的分布及危害。农业科学实践。2016;3:3–11.
- 31
施朗J。基恩·钱斯·弗雷姆登。DLZ阿格拉马加赞。1999;50:62–5.
- 32
Cai D,Kleine M,Kifle S,Harloff H-J,Sandal Nn,Marcker Ka,Klein-Lankhorst RM,Salentijn Em,Lange W,Stiekema WJ。糖甜菜中线虫抗性基因的定位克隆。科学。1997年; 275(5301):832-4。
- 33
卡皮斯特拉诺GGG。甜菜抗线虫基因Hs1-2的候选序列。德国:基督教阿尔布雷希茨基尔大学;2010
- 34
杰格尔S。两个甜菜全基因组鸟枪序列的杂交组装(Beta寻常魅力携带甜菜孢囊线虫抗性基因Hs1–2的易位系及候选基因的功能分析。德国:基督教阿尔布雷希茨基尔大学;2013
- 35
Yu MH,Steele Ae。宿主寄生虫抗性糖干和viderodera schachtii。J Nematol。1981; 13(2):206-12。
- 36
关键词:甜菜,包囊线虫,基因克隆,功能分析中国生物医学工程学报,2004;
- 37.
多雷克,瓦洛魁F:中国植物文化的历史与发展:码头;2006
- 38.
Ghaemi R,Pourjam E,Safaie N,Mahmoudi Sb,Mehrabi R.在体外条件下评估甜菜品种患者甜菜囊肿线虫。J糖甜菜。2018; 34(1):65-74。
- 39.
Venancio TM,Aravind L. cystm,一种新型半胱氨酸的跨膜模块,具有在真核生物上应力耐受性的作用。生物信息学。2010; 26(2):149-52。
- 40
米尔,利昂J。在拟南芥中,病原菌和昼夜节律控制蛋白1(PCC1)锚定在质膜上并与COP9信号体的亚基5相互作用。公共科学图书馆一号。2014;9(1):e87216。
- 41
Li R,Rashotte Am,Singh Nk,Lawrence Ks,Weaver DB,Locy Rd。转录棉花分析(棉花对肾形线虫敏感、抗性和超敏的基因型(Rotylechululululy eniformis.). 公共科学图书馆一号。2015;10(11):e0143261。
- 42
Guimaraes PM,Guimaraes La,Morgante CV,Silva ob Jr,Araujo Ac,Martive Ac,Saraiva Ma,Oliveira Tn,Togawa RC,Leal-Bertioli Sc,等。野生花生的根转录组分析显示了线虫抗性的候选基因。Plos一个。2015; 10(10):E0140937。
- 43.
Durfee T,Roe JL,Sessions RA,Inouye C,Serikawa K,Feldmann KA,Weigel D,Zambryski PC.含有F-box蛋白的UFO和AGAMOUS参与了控制拟南芥早期花瓣发育的拮抗途径。美国国家科学院学报。2003;100(14):8571–6.
- 44.
冈萨雷斯·卡兰扎(Gonzalez Carranza)ZH、Rompa U、Peters JL、Bhatt AM、Wagstaff C、Stead AD、Roberts JA。夏威夷裙:拟南芥中调节器官融合和生长的F-box基因。植物生理学。2007;144(3):1370–82.
- 45.
Samach A、Klenz JE、Kohalmi SE、Risseeuw E、Haughn GW、Crosby WL。拟南芥不寻常的花器官基因是花分生组织正常形成和生长所必需的F-box蛋白。植物J。1999;20(4):433–45.
- 46。
Baudry A、Ito S、Song YH、Strait AA、Kiba T、Lu S、Henriques R、Prueda Paz JL、Chua NH、Tobin EM等。F-box蛋白FKF1和LKP2与ZEITLUPE协同作用以控制拟南芥的时钟进程。植物细胞。2010;22(3):606–22.
- 47。
imaizumi t,tran hg,swartz te,briggs wr,kay sa。FKF1对于拟南芥中的光周期特异性光信号至关重要。自然。2003; 426(6964):302-6。
- 48。
Binder BM,Walker JM,Gagne JM,Emborg TJ,Hemmann G,Bleecker AB,Vierstra RD.拟南芥EIN3结合F-box蛋白EBF1和EBF2在乙烯信号传导中具有不同但重叠的作用。植物细胞。2007;19(2):509–23.
- 49。
Dill A、Thomas SG、Hu J、Steber CM、Sun TP。拟南芥F盒蛋白SLEEPY1以赤霉素信号阻遏物为靶点,进行赤霉素诱导的降解。植物细胞。2004;16(6):1392–405.
- 50
凯宾斯基S,莱瑟O。拟南芥F盒蛋白TIR1是一种生长素受体。自然。2005;435(7041):446–51.
- 51
Koops P、Pelser S、Ignatz M、Klose C、Marrocco Selden K、Kretsch T。EDL3是拟南芥中参与脱落酸信号转导调控的F-box蛋白。J实验机器人。2011;62(15):5547–60.
- 52
Nelson DC, Scaffidi A, Dun EA, Waters MT, Flematti GR, Dixon KW, Beveridge CA, Ghisalberti EL, Smith SM。F-box蛋白MAX2在拟南芥的karrikin和独脚金内酯信号转导中具有双重作用。美国国家科学研究院学报2011;
- 53
Thines B、Katsir L、Melotto M、Niu Y、Mandaokar A、Liu G、Nomura K、He SY、Howe GA、Browse J。JAZ阻遏蛋白是茉莉酸信号传导过程中SCF(COI1)复合物的靶点。自然。2007;448(7154):661–5.
- 54
Bu Q,LV T,沉H,鲁松P,王家,王Z,黄Z,肖L,工程师C,Kim Th,等。拟南芥F箱蛋白质MAX2对干旱耐受的调节。植物理性。2014; 164(1):424-39。
- 55
Calderon-Villalobos Li,Nill C,Marrocco K,Kretsch T,Schwechheimer C.在温度应激期间有效的平移所需的进化保护拟南芥拟南芥F-Box蛋白ATFBP7。基因。2007; 392(1-2):106-16。
- 56
马尔多纳多卡尔德隆山,塞普尔韦达加西亚E,罗查索萨M。生物和非生物胁迫诱导植物中新型F-box蛋白的特性研究。植物科学。2012;185-186:208–17.
- 57
赵Z,张克,周某,任y,王W.通过麦小箱基因TAFBA1过度表达改善转基因烟草耐盐性。植物SCI。2017; 259:71-85。
- 58
Cao Y,Yang Y,Zhang Y,Li D,Zheng Z,Song F.烟草中水稻防御相关F箱蛋白基因OSDRF1的过度表达通过防御基因表达的增强来提高抗病性。physiol植物。2008; 134(3):440-52。
- 59
右柯蒂斯。Pankaj,powers SJ,Napier J,Matthes MC:拟南芥F-box/Kelch重复蛋白At2g44130在巨细胞中上调并促进线虫易感性。植物与微生物相互作用。2013;26(1):36–43.
- 60。
Piisila M、Keceli MA、Brader G、Jakobson L、Joesar I、Sipari N、Kollist H、Palva ET、Kariola T。拟南芥F-box蛋白MAX2对细菌性植物病原菌的抗性有贡献。BMC植物生物学。2015;15:53.
- 61
Stefanowicz K, Lannoo N, Zhao Y, Eggermont L, Van Hove J, Al Atalah B, Van Damme EJ。拟南芥多糖结合F-box蛋白保护植物免受丁香假单胞菌感染。中国生物医学工程学报。2016;16(1):213。
- 62
Risseeuw EP,Daskalchuk Te,Banks Tw,Liu E,Cotelesage J,Hellmann H,Estelle M,Somers De,Crosby WL。拟南芥中SCF泛素E3连接酶亚基的蛋白质相互作用分析。工厂J. 2003; 34(6):753-67。
- 63
姚睿,明Z,yan l,li s,王f,ma s,yu c,yang m,chen l,chen l等。Dwarf14是杂芳酮的非典型激素受体。自然。2016; 536(7617):469-73。
- 64
Hong JP,Adams E,Yanagawa Y,Matsui M,Shin R. Atskip18和ATSKIP31,SCF E3泛素连接酶复合物的F箱亚基,介导14-3-3蛋白的拟南芥中的降解。Biochem Biophys Res Communce。2017; 485(1):174-80。
- 65
张W,Lorence A,Gruszewski Ha,Chevone Bi,Nessler Cl。AMR1,一种拟南芥基因,其协调和负调节甘露糖/ L-半乳糖抗坏血酸生物合成途径。植物理性。2009; 150(2):942-50。
- 66
惠勒GL,琼斯MA,斯米诺夫N。高等植物维生素C的生物合成途径。自然。1998;393(6683):365–9.
- 67.
Mapson LW、Isherwood FA、Chen YT。L-抗坏血酸的生物合成:植物线粒体将L-半乳糖酮-γ-内酯转化为L-抗坏血酸。生物化学杂志。1954;56(1):21–8.
- 68.
Arrigoni O、Zacheo G、Arrigoni Liso R、Bleve Zacheo T、Lamberti F。番茄抗坏血酸与南方根结线虫抗性的关系。植物病理学。1979;69(6):579–81.
- 69.
弗雷泽CM,C章。拟南芥中的苯丙烷途径。拟南芥书。2011;9:e0152。
- 70
Barcala M,Garcia A,Cabrera J,Casson S,Lindsey K,Favery B,Garcia-Casado G,Solano R,Fenoll C,Escobar C.早期翻译拟查拟南芥线虫诱导的巨细胞的早期翻译组。工厂J.2010; 61(4):698-712。
- 71
伊索尔N、雷克诺J、内特尔顿D、赫恩L、梅尔T、鲍姆TJ、米彻姆MG。大豆孢囊线虫侵染过程中寄主和病原菌的平行全基因组表达谱。植物与微生物相互作用。2007;20(3):293–305.
- 72
Holbein J、Franke RB、MarhavýP、Fujita S、Górecka M、Sobczak M、Geldner N、Schreiber L、Grundler FMW、Siddique S。根-内胚层屏障系统有助于防御植物寄生孢囊和根结线虫。植物J。2019;100(2):221–36.
- 73
Dinneny JR。带护卫的门户:内胚层如何通过激素信号传导来调节生长。植物SCI。2014; 214:14-9。
- 74
Robbins Ne 2nd,Trontin C,Duan L,Dinneny JR。超越屏障:通过内胚层在根中通信。植物理性。2014; 166(2):551-9。
- 75
Roppolo D,De Rybel B,Denervaud Burton V,Pfister A,Alassimone J,Vermeer Je,Vermeer Je,Yamazaki M,Stierhof Yd,Beeckman T,Geldner N.一种新的蛋白质家庭在内胚层中介导尸体条状的形成。自然。2011; 473(7347):380-3。
- 76
关键词:Casparian, CASPL,逆转录因子,生长因子,耐寒性Sci众议员2015;5:14299。
- 77
阿里马、阿巴斯A、克里尔DP、博尔曼H。转录因子RAP2.6的过度表达导致合胞体胼胝质沉积增强和对甜菜孢囊线虫抗性增强异皮线虫属schachtii在拟南芥根。中国生物医学工程学报(英文版),2013(1):31 - 35。
- 78
Fudali SL、Wang C、Williamson VM。乙烯信号途径调控寄主根系对根结线虫的吸引力meloidogyne hapla..Mol植物微生物相互作用。2013; 26(1):75-86。
- 79
研究了乙烯生产抑制剂和刺激剂对葡萄胆汁生长发育的影响有是-受感染的番茄根。线虫杂志。1985;17(2):145–9.
- 80。
Glazer I,Orion D,Apelbaum A.乙烯生产,胆形成和根结线虫在感染的番茄植物中的相互关系有是. 线虫杂志。1983;15(4):539–44.
- 81。
胡y,you j,li c,威廉姆森,王c。亚乙基反应途径调节植物根对大豆囊肿线虫的吸引力甘氨酸异胞菌.SCI批准。2017; 7:41282。
- 82。
MarhavýP、Kurenda A、Siddique S、Dénervaud Tendon V、Zhou F、Holbein J、Hasan MS、Grundler FM、Farmer EE、Geldner N。单细胞损伤引起局部线虫限制根乙烯反应。EMBO J。2019年:e100972。
- 83。
Nahar K,Kyndt T,De Vleesschauwer D,Hofte M,Gheysen G. jasmonate途径是一个关键的球员,在水稻中系统诱导的根结线虫。植物理性。2011; 157(1):305-16。
- 84。
Kyndt T,Vieira P,Gheysen G,De Almeida-Engler J.Nematode饲养地点:植物根的独特器官。Planta。2013; 238(5):807-18。
- 85
Reversat G、Boyer J、Sannier C、Pando Bahuon A。用沙子和吸水性合成聚合物的混合物作为基质在实验室进行植物寄生线虫的xenic培养。线虫学。1999;1(2):209–12.
- 86
FastQC:一个高通量序列数据的质量控制工具。Babraham Bioinform 2010:175-6。
- 87
Bolger AM、Lohse M、Usadel B。Trimmomatic:一种灵活的用于Illumina序列数据的微调器。生物信息学。2014;30(15):2114–20.
- 88
Dobin A,Davis Ca,Schlesinger F,Drenkow J,Zaleski C,JHA S,Batut P,Chaisson M,Gingeras TR。星:超快通用RNA-SEQ对齐器。生物信息学。2013; 29(1):15-21。
- 89
劳伦斯M,胡伯W,H页,阿博扬P,卡尔森M,绅士R,摩根山,凯里VJ。计算和注释基因组范围的软件。计算机生物学。2013;9(8):e1003118。
- 90
爱情MI,Huber W,Anders S.使用DESEQ2的RNA-SEQ数据的折叠变化和分散的调节估计。基因组Biol。2014; 15(12):550。
- 91
斯特里默K。Fdrtool:一个通用的R包,用于估计基于局部和尾部区域的错误发现率。生物信息学。2008;24(12):1461–2.
- 92
Proost S、Van Bel M、Vaneechoutte D、Van de Peer Y、Inze D、Mueller Roeber B、Vandepole K。PLAZA 3.0:植物比较基因组学的接入点。核酸研究,2015年;43(数据库问题):D974–81。
- 93
Pfaffl MW,霍尔根GW,登普勒L。相对表达软件工具(REST),用于实时PCR中相对表达结果的分组比较和统计分析。2002年核酸研究;30(9):e36。
- 94
施密特根TD,利瓦克KJ。用比较C(T)法分析实时PCR数据。Nat协议。2008;3(6):1101–8.
- 95
Zerbino博士,Birney E。Velvet:使用de Bruijn图进行从头短读组装的算法。基因组研究,2008年;18(5):821–9.
- 96
Fosu-nyarko J,Nicol P,Naz F,Gill R,Jones Mg。甜菜囊肿线虫感染阶段的转录组分析,H Schachtii..Plos一个。2016; 11(1):E0147511。
致谢
我们感谢Tarbiat Modares University,伊朗德黑兰,为RG提供博士授予。
基金
这项研究是由伊朗德黑兰的塔比亚特莫达雷斯大学资助的,通过向RG提供博士奖学金。资助机构在研究设计、数据收集、分析和解释以及撰写手稿方面没有任何作用。
作者信息
从属关系
贡献
RG进行了实验和一些数据分析,还撰写了手稿。EP和TK构思了这个项目,设计了实验并改进了手稿。BV进行了生物信息学分析。SBM准备了一些材料并编辑了手稿。NS和RM设计实验并编辑手稿。在TDM的监督下进行下一代测序和生物信息学分析。所有作者都已阅读并批准了手稿。
通讯作者
道德声明
道德认可和参与同意
不适用。
出版许可
不适用。
相互竞争的利益
提交人声明他们没有竞争利益。Tina Kyndt是BMC植物生物学编辑委员会的成员。
附加信息
出版商说明
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
补充信息
附加文件1表S1。
糖甜菜 - 甜菜囊肿线虫(BCN)相互作用中的显着差异表达基因(甜菜甜菜。
附加文件2表S2。
甜菜- BCN亲和互作中与细胞壁结构、代谢、发育过程、运输、防御反应、激素代谢和转录因子相关的显著差异基因。
附加文件3表S3。
甜菜与BCN互作不亲和性中的显著差异。
附加文件4表S4。
与细胞墙建筑,运输,防御反应,激素代谢和转录因子相关的显着差异表达糖甜菜基因在不相容的糖束 - BCN相互作用中。
附加文件5表S5。
在未感染和BCN感染条件下,甜菜抗感品种的显著差异。
附加文件6表S6。
在比较抗感品种时,甜菜对BCN感染表现出差异反应的基因。通过评估感染状况与甜菜品种之间的显著交互作用,在DESeq2中评估了统计显著性。
附加文件7表S7。
甜菜囊肿线虫(BCN)基因与甜菜亲和和不亲和互作过程中检测到的转录本。
附加文件8表S8。
用于QRT-PCR表达分析的糖甜菜基因的引物序列。
权利和权限
开放获取本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/. 知识共享公共领域放弃(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用本文
Ghaemi,R.,Pourjam,E.,Safaie,N ..等。甜菜和甜菜囊肿线虫亲和和不亲和相互作用的分子研究。BMC植物杂志20.483(2020)。https://doi.org/10.1186/s12870-020-02706-8
收到:
公认:
出版:
关键词
- 甜菜
- 异皮线虫属schachtii
- CYSTM domain-containing蛋白质
- 乙烯
- 贾斯莫酸盐
- 转录组