摘要
背景
叶绿素是植物吸收、转移和转化光能的最重要因子,在产量形成中起着重要作用。芸苔属植物显著是最重要的油料作物之一。繁殖芸苔属植物显著通过提高光合作用效率来提高光效具有相当的社会和经济价值。在芸苔属植物显著对叶绿素在种子胚和果皮中的初始定位已有研究,但对叶绿素qtl精细定位的报道较少。我们构建了近等基因系(NIL),精细定位了一个叶绿素位点,并评价了该优势位点对农艺性状的影响。
结果
的cqSPDA2该基因座定位于水稻A02染色体上21.87 ~ 22.91 Mb的区间芸苔属植物显著使用双单倍体(DH)系。对fine-mapcqSPDA2,我们构建了NIL并设计了覆盖映射区间的Indel引物。公元前469人3.F2用这些引物对人群进行分析。在这些indel引物中,有15个可以将Indel3和Indel15之间的映射间隔缩小到188 kb。然后,在新的更窄的映射区间内设计了16条indel引物和19条SSR引物,其中引物扩增的5个片段具有多态性,且与SSR链紧密相连cqSPDA2公元前的轨迹4F2人口。在A02上,SSR2和Indel15之间的映射间隔缩小到152 kb。通过基因表达分析,我们在作图区间内发现了三个注释基因,包括BnaA02g30260D,BnaA02g30290D而且BnaA02g30310D,它可能负责叶绿素的合成。
结论
的轨迹cqSPDA2,为叶绿素含量的优势QTL芸苔属植物显著,被精细映射到A02上的21.89-22.04 Mb区间.三个注释基因(BnaA02g30260D,BnaA02g30290D而且BnaA02g30310D)可能负责叶绿素合成。
背景
作物产量形成的物质基础来源于光合作用,基于光合作用的高产一直是作物育种研究的热点[1].叶绿素是使植物吸收、转移和转化光能的最重要因子,在植物的生长发育中起着重要作用[2].保持叶片中叶绿素含量高是提高光合活性的重要因素[3.].在一定范围内,叶绿素含量与光合速率呈正相关关系,直接决定产量[4,5].因此,叶绿素含量在产量形成中起着重要作用[6,7].旺盛的苗木发育芸苔属植物显著同时也带来了更高的产量稳定性,对植物育种者具有高度的重要性。叶绿素含量是一种主要受核基因控制的数量特征,具有较高的遗传力[8,9].先前的研究表明,叶绿素合成的15个步骤中至少涉及27个基因[10],生物合成缺陷被认为是叶绿素含量低的主要原因之一。叶绿素缺乏的其他原因还包括信号转导不足、血红素反馈受限、有害的光氧化作用等。总的来说,叶绿素合成的分子机制非常复杂[11].近年来,研究人员从不同角度分析了多种作物不同居群幼苗叶片叶绿素含量的qtl,取得了长足进展,为未来阐明叶绿素含量决定分子遗传机制的研究奠定了基础[12,13,14,15,16,17,18].
完成了全基因组测序芸苔属植物显著表明对芸苔属植物显著基因组进入了一个新时代。近年来,随着分子标记技术的迅速发展,构建高密度分子标记遗传图谱成为可能芸苔属植物显著.因此,叶绿素qtl的研究将允许高效育种芸苔属植物显著提高光效率将为提高高产潜力和高产方向提供重要信息芸苔属植物显著未来的繁殖。繁殖芸苔属植物显著通过提高光合作用效率来提高光效具有重要的社会和经济意义。目前,叶绿素含量在种子胚中初始位置的研究[19和果皮[20.的冬天芸苔属植物显著在干旱和盐胁迫下鉴定了qtl,甚至预测了与耐盐性相关的候选基因[21,22,23].然而,植物叶绿素含量qtl的精细定位报道甚少芸苔属植物显著[11].
在之前的一项研究中,我们发现了一个名为cqSPDA2利用中双11 (ZS11,半冬系)和QU(春季系)杂交的DH系在A02的21.87 ~ 22.91 Mb内进行定位,解释了15.72%的表型变异,并在6个环境中稳定检测到(正在研究中)。在本研究中,一个近等基因系(NIL)群体cqSPDA2是为了进一步缩小cqSPDA2.本研究为调控光合功能的叶绿素基因的克隆奠定了基础,为利用分子标记改良种质资源和选育高产新品种提供了理论依据。
结果
表型和遗传分析
第一批完全发育的叶子从公元前2061个个体的顶部开始计数4F2用SPAD (SPAD 502,日本)测定六叶期种群数量。公元前叶绿素含量的分布4F2以柱状图的最低点为分界线(SPAD = 43)。SPAD≥43认为叶绿素含量较高(n= 1514), SPAD<43认为叶绿素含量低(n= 547)。卡方检验表明,叶绿素含量性状的分离模式符合预期的孟德尔分离比3:1 (χ2= 2.53)(高叶绿素含量vs低叶绿素含量)(图1).在公元前随机抽取的198个人中6F1以SSR2和Indel100为标记进行验证cqSPDA2.卡方检验结果符合1∶1 (χ2= 1.46;χ2= 1.82) (AA: AA)孟德尔比(附加文件1:表S1)。
细的映射cqSPDA2
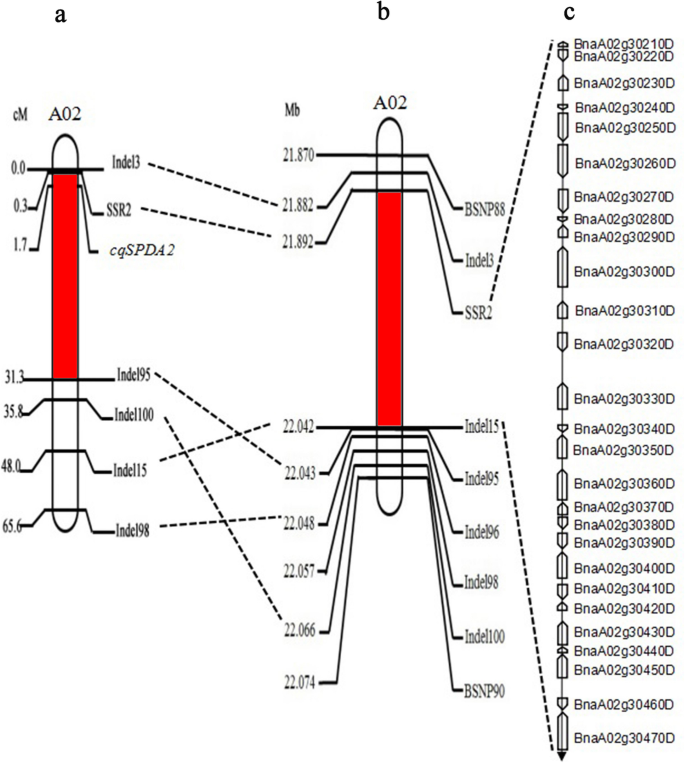
以fine-mapcqSPDA2设计了87对indel标记引物,均匀覆盖初步定位区间(A02 21.87 ~ 22.91 Mb)。结果表明,在两个亲本系和选择的DH系中共检测到28个多态标记。其中23个标记在DH系中共分离。公元前469人3.F2然后用这些引物对人群进行分析。利用indel数据和相应的叶绿素含量表型构建的连锁图显示,有15个indel引物与叶绿素含量表型紧密连锁cqSPDA2轨迹(附加文件2:表S2)。的cqSPDA2locus在Indel3和Indel15之间被分隔为5.2 cM的间隔(附加文件3.:图S1)。引物Indel3、Indel6、Indel15和Indel17在QTL附近扩增的片段被回收。用PMD18-T载体进行TA克隆,发现该区域的物理位置在21.88-22.07 Mb的188 kb范围内4:图S2)。
然后,设计了16条indel引物和19条SSR引物,5条引物扩增出的片段具有多态性,且与SSR位点连接紧密cqSPDA2轨迹(附加文件5:表S3)。这些新的引物帮助缩小了公元前250个个体的间隔4F2人口。结果,cqSPDA2定位到SSR2和Indel15之间152 kb的区间(图5)。2).BSNP88和BSNP90是基于SNP分析开发的竞争等位基因特异性PCR (KASP)标记6:表S4)。SSR2是一个同显性标记,与cqSPDA2.公元前204F2选择低、中、高叶绿素表型植株,测定其SSR2基因型。结果表明,3组不同表型可分为3个基因型:AA(显性纯合子、高叶绿素表型)、AA(杂合子、中叶绿素表型)和AA(隐性纯合子、低叶绿素表型)。这些结果表明,SSR2与cqSPDA2可以有效地用于标记辅助选择(MAS)(图5)。3.).
遗传和物理图谱cqSPDA2基因座和候选基因分析。一个遗传连锁图谱cqSPDA2A02染色体上的区域。标记之间的数字表示在厘木器官中的遗传距离。b的精细映射cqSPDA2公元前的轨迹4F2人口。的cqSPDA2将标记SSR2和Indel15之间的间隔缩小到152 kb。标记之间的数字表示物理距离。c候选基因在目标区间的遗传和物理图谱和注释基因在芸苔属植物显著基因组注释数据库(http://www.genoscope.cns.fr/brassicanapus/)
定位区间内基因的定量RT-PCR
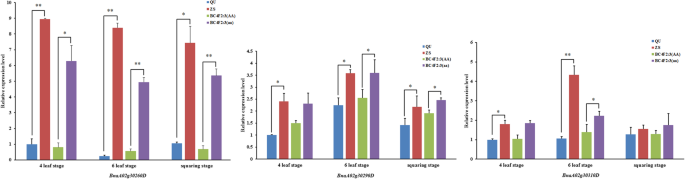
根据芸苔属植物显著基因组注释数据库(http://www.genoscope.cns.fr/brassicanapus/),在A02上21.89-22.04 Mb的定位区间内鉴定出27个基因7:表S5)。采用实时荧光定量PCR (Quantitative real-time PCR, qRT-PCR)方法对不同基因型叶片间靶定位区间内基因的表达水平进行鉴定。分析了27个基因的熔融和扩增曲线,结果表明24对引物可用于分析基因表达(附文件8:表S6)。因此,有24个基因在作图区间和管家基因Actin7用qRT-PCR(附加文件9:表S7)。结果表明,3个基因的表达水平(BnaA02g30260D,BnaA02g30290D而且BnaA02g30310D)均高于ZS11和BC4F2:3(aa)优于QU和BC4F2:3(AA)三个阶段。QU与ZS11、BC比较采用学生t检验4F2:3(AA)与BC4F2:3(aa)。BnaA02g30290D和BnaA02g30310D在BC之间表达有显著差异4F2:3(AA)和BC4F2:3(aa)在六叶期(p< 0.05),差异在BnaA02g30260D非常显著(p< 0.01)(图4).其余基因在QU、BC间无一致性表达差异4F2:3(AA), ZS11和BC4F2:3(aa)在三个阶段。因此,BnaA02g30260D, BnaA02g30290D而且BnaA02g30310D可能的候选基因cqSPDA2.
农艺性状分析
调查…的效果cqSPDA2在农艺性状上,从BC中选择了50株AA基因型(叶绿素含量高)和50株AA基因型(叶绿素含量低)4F2分子标记和SPAD分析。我们调查了株高、角果长度、每角果种子数、单株角果数、千粒重和单株产量。结果表明:aa基因型与aa基因型(P< 0.01)。千粒重在组间有差异,但角果长度在组间无差异(P< 0.05)(表1).
讨论
叶绿素含量的意义及QTL分析
叶片是植物的主要光合器官,其叶绿素含量是影响作物产量的重要农艺性状。90%至95%的植物干物质是由光合作用产生的,而作物产量主要来自叶片的光合产物[24].叶绿素是叶绿体中参与光合作用的重要色素,能吸收和转化光能,是评价叶片光合能力的重要指标[25].通过提高叶绿素含量来提高作物产量是高效育种的重要目标之一[26].高通量测序技术的出现为分子标记的开发提供了新的方法。分子标记技术促进了遗传图谱的快速构建,为精细制图提供了方便的数据。叶绿素含量是一个主要受核基因控制的数量特征,具有较高的遗传力。目前,叶绿素qtl的研究已经在各种作物的不同群体中展开,如水稻[12,14,16,17)、小麦(13,15,大豆27,28,和卷心菜[18,尤其是大米[17].以前的研究检查了叶绿素在胚胎中的位置[19和果皮[20.的冬天芸苔属植物显著此外,在干旱和盐胁迫条件下检测到qtl,并预测了一个与耐盐相关的候选基因[21,22,23].王等人。[11的C08染色体上检测到一个QTL芸苔属植物显著利用叶绿素缺乏突变体,测定叶片中叶绿素的绝对含量。
利用小波分解和MAS进行精细映射
NILs的开发是叶绿素QTL研究中精细定位和评估遗传效应的有效策略[29].在本研究中,一个零总体cqSPDA2以ZS11为重复亲本,带侧翼标记构建区域。利用侧翼标记Indel1、3、15、87进行前景选择,构建BC种群3.F2和公元前4F2,映射间隔缩短至152 kb(图5)。2).这种定位目标基因的策略是合理的、廉价的、高效的。根据公元前4F2表型和公元前6F1基因型分析,叶绿素含量的分离与卡方检验一致(图2。1和额外的文件1:表S1)。这些结果表明cqSPDA2控制叶绿素含量的优势QTL是芸苔属植物显著.空值分析也显示出正相关cqSPDA2以及农艺性状,如产量、株高、每株角果种子数和每株角果数1).
通过精细定位,获得了具有紧密连锁关系的分子标记SSR2。3.).Indel15也在旁边cqSPDA2这些标记可以加快分子标记辅助选择的育种进程。
候选基因预测
根据qRT-PCR分析,BnaA02g30260D,BnaA02g30290D而且BnaA02g30310D是合适的候选基因吗cqSPDA2在注释的24个基因中芸苔属植物显著在映射区间的基因组(附加文件9:表S7)。BnaA02g30260D,属于抗病蛋白家族,具有跨膜受体活性、核苷-三磷酸酶活性、核苷酸结合功能和ATP结合功能,根据注释参与信号转导、防御反应、凋亡和先天免疫反应。需要进一步的研究来确定是否BnaA02g30260D影响叶绿素的合成。BnaA02g30290D为FK506-和雷帕霉素结合蛋白15kd -2 (FKBP15-2),具有与蛋白质折叠相关的肽酰脯氨酰顺反异构酶活性。Luan等人[30.)发现,AtFKBP15-1而且AtFKBP15-2有最高的同源性FKBP13和编码的功能同源物FKBP13.AtFKBP13据报道,在蛋白质进入叶绿体基质之前和之后都与Rieske蛋白有关,而AtFKBP13可以起到下调Rieske蛋白积累的作用。Rieske是细胞色素b的一个亚单位6F配合物,是光合作用电子传递链的四个配合物之一[31].据报道,当ScFKBP12被转移到拟南芥,叶绿体的形成和叶绿体形成相关基因的表达受到抑制[32].在本研究中,表达水平BnaA02g30290D(AtFKBP15-2)在3个生育期均高于NIL (aa)和ZS11植株;如果该基因抑制叶绿素的形成,这一发现将与上述结果一致。BnaA02g30310D是同源GCH-1在拟南芥.GCH-1是四氢生物terin (BH4)生物合成中的第一种酶[33].BH4是三种一氧化氮合酶(NOS)的必需辅酶[34].AtNOA1(AtNOS1)位于拟南芥叶绿体,OsNOA1(OsNOS1)也位于水稻叶绿体中[35,36,37].杨等人。[37]发现叶绿素含量随含量的增加而降低OsNOA1在低温(22°C)下。他(38)建议OsNOA1通过影响叶绿体核糖体的功能直接调控叶绿体编码蛋白,然后通过Mg原卟啉IX介导的叶绿体逆行信号通路向细胞核传递信号,进而影响核基因编码的叶绿体蛋白的表达。本研究的地点青海省位于青藏高原,作物生长期间的平均温度较低。在这个位置,表达水平BnaA02g30310D(GCH-1)在空(aa)和ZS11在三个观察期均较高,特别是在六叶期,这与He [37,38].
进一步的实验,如转基因互补试验,CRISPR/Cas9, VIGS和RNAi,都是值得研究的BnaA02g30260D,BnaA02g30290D而且BnaA02g30310D基因是潜在的cqSPDA2.对叶绿素合成调控网络的分析将有助于植物的分子育种芸苔属植物显著高收益。
结论
在本研究中,我们构建了NILs,并缩小了的区间cqSPDA2在SSR2和Indel15之间的A02上到152 kb。根据芸苔属植物显著基因组注释数据库中,该映射区间共有27个基因。BnaA02g30260D,BnaA02g30290D而且BnaA02g30310D被确定为合适的候选基因cqSPDA2根据qRT-PCR分析,这些基因可能负责叶绿素的合成。此外,显性位点cqSPDA2对农艺性状有积极影响。
方法
植物材料
ZS11叶片的叶绿素含量较低,QU叶片的叶绿素含量较高(图5)。5).获得相对简单的遗传背景并进行精细制图cqSPDA2,我们构建了一个NIL总体。F1与QU基因型相吻合cqSPDA2选择ZS11区域,回交三代。公元前3.F1个体自食产生BC3.F2映射人口回交叉到ZS11。利用侧翼标记Indel1和Indel87构建具有前景选择的NIL种群2:表S2)。
BC4F1具有QU遗传背景的个体cqSPDA2由两侧标记Indel3和Indel15选择的区域(附加文件3.:图S1)自耦生成BC4F2人口,这是用于精细映射cqSPDA2轨迹。人口发展的具体过程在附加文件中加以说明10:图S3。公元前4F2:3AA基因型(纯合子为cqSPDA2)和aa基因型(无cqSPDA2)分别用侧翼标记Indel3和Indel15进行检测,并进行qRT-PCR分析。每个群体在行距30 cm ×行内15 cm的试验田中生长。BC3.F2和公元前4F2在云南元谋(海拔898 m, 101°52′n, 25°42′e)和青海西宁(海拔2225 m, 101°49′n, 36°34′e)田间以相同密度生长。BC4F2:3和公元前6F1种群是在青海大学(青海西宁)农林科学院的温室中培养的。遵循了标准的作物管理做法。
表型性状及数据分析
检测对象为种群中无病虫害的每一株植物。根据之前的叶绿素测定方法,我们在上午9:00-11:00期间,用SPAD (SPAD 502,日本)测量了每株六叶期第一个完全发育的叶片顶端远端三分之一处的三个位置[39].每次测量每片叶子重复三次,避免出现叶脉。用Excel进行统计分析。对分离数据进行卡方检验,以确定叶绿素含量的遗传调控。
DNA的提取和分子标记的开发
用CTAB法从新鲜叶片中提取总DNA [40].PCR在含2 μL DNA、2 μL 2mm dNTPs、2 μL 10× PCR缓冲液、1 μL Taq、1 μL 2 μL正、反引物和12 μL ddH的20 μL反应液中进行2O. PCR程序按照Yang的方法进行,稍作修改[41].PCR产物在6%非变性聚丙烯酰胺凝胶上分离,用银染色法检测[42].Indel(插入/删除)标记是根据亲本的重测序数据开发的显著“darmo -bzh”参考基因组序列在主映射区间。在此基础上开发了SSR标记显著“darmo -bzh”参照基因组序列对应的区间。SSR标记的序列设计采用SSR Hunter 1.3和Primer Premier 5.0 [43,44].
的映射cqSPDA2轨迹
BC3.F2和公元前4F2家庭人口被用来精细绘制cqSPDA2利用indel和SSR标记。首先,我们在引物映射区间(染色体A02上21.87-22.91 Mb)设计了87个indel标记来映射cqSPDA2轨迹。的链接映射cqSPDA2使用JoinMap 4.0构建轨迹[45].的映射间隔cqSPDA2利用BC的作图结果逐渐减少了位点3.F2人口。最后,在新的狭窄的定位区间内设计额外的indel和SSR标记,以实现细定位cqSPDA2基于BC的轨迹4F2WinQTLCart 2.5的人口。物理位置是通过爆破得到的芸苔属植物显著利用indel和SSR序列建立基因组数据库。物理联动图由MapDraw 2.1生成[46].
助教克隆
特异标记紧密相连cqSPDA2用空群体扫描进行测序。根据Yi等人的研究,收集特定片段。[47].将产物连接到PMD18-T载体(Takara)上,用M13引物检测转化克隆。随机选取6个阳性克隆,由生工生物科技(上海)有限公司测序。[48].
定位区间内的基因
在A02上定位区间内的所有基因都通过注释进行鉴定芸苔属植物显著基因组(http://www.genoscope.cns.fr/brassicanapus/),并根据BRAD的注释(http://brassicadb.org/brad/blastPage.php).同源序列用BLASTN (http://blast.ncbi.nlm.nih.gov/).
RNA提取和qRT-PCR分析
公元前4F2:391株aa基因型植株为纯合子cqSPDA2无aa基因型植物104株cqSPDA2)是2019年9月在温室里种植的。总RNA从每株植物(4叶期、6叶期和方正期)顶端的第一批完全发育的叶片中分离4F2:3根据制造商的协议,使用trzol - a +总RNA试剂(Takara,大连,中国)检测群体和亲本系。用1%琼脂糖凝胶电泳检测RNA完整性。使用PrimeScript RT试剂试剂盒(Takara, Dalian, China),按照制造商说明,通过总RNA的反转录获得cDNA。
我们进行了qRT-PCR分析,以确定在作图区间的基因。采用LightCycler 480 II 96孔PCR板(Roche, Rotkreuz, Switzerland)进行实时PCR。所用反应体系包含10 μL 2 × SG Fast qPCR Master Mix (B639271, BBI), 2 μL cDNA和10 μM基因特异性引物,总体积为20 μL。使用的热循环条件为95°C 3分钟,然后在95°C 5 s和60°C 30 s下进行45次循环,最后延长阶段。各基因在定位区间内的相对表达量由2−△△Ct方法,每个样本进行三次重复[49].以管家基因Actin7作为内控,计算各基因的相对表达量。试验设3个生物重复,采用t检验进行统计学分析。
农艺性状的表型分析
评价cqSPDA2100株(50株AA-和50株AA-基因型植物)4F2利用标记Indel3和Indel15对叶绿素含量进行表征。利用Minitab16和Excel2010软件对AA-和AA-基因型植株的各农艺性状进行了均值、标准差和显著性分析。农艺性状分别为株高(cm)、单株总角果数、角果长度(cm)、每角果种子数、千粒重(g)和单株产量(g)。
数据和材料的可用性
在研究中使用的所有数据都包含在这篇发表的文章及其附加文件中。
缩写
- QTL:
-
数量性状位点
- 零:
-
Near-isogenic线
- DH:
-
加倍单倍体
- 存在:
-
定量实时聚合酶链反应
- SNP:
-
单核苷酸多态性
- Indel:
-
Insertion-deletion
- 苏维埃社会主义共和国:
-
简单序列重复
- KASP:
-
kompetitive allele-specific PCR
- SPAD:
-
土壤和植物分析仪的发展
- FKBP:
-
FK506-和雷帕霉素结合蛋白
- GCH-1:
-
三磷酸鸟苷cyclohydrolaseІ
- BH4:
-
Tetrahydroboipterin
- 号/诺亚:
-
一氧化氮合酶
参考文献
增加C3植物的光合碳同化以提高作物产量:当前和未来的策略。植物杂志。2011;155:36-42。
Eggink L, Park H, Hoober JK。叶绿素的作用b在光合作用的假设。植物生物学2001;1:2。
郭萍,Baum M, Varshney RK, Graner A, Grando S, Ceccarelli S.花后干旱条件下大麦叶绿素和叶绿素荧光参数的qtl。Euphytica。2008;163:203-14。
von Korff M, Grando S, Del Greco A, This D, Baum M, Ceccarelli S.大麦适应地中海旱地条件的数量性状位点。应用理论学报2008;117:653-69。
水稻生理氮效率:氮的利用、光合作用和产量潜力。土壤植物。1997;196:201-10。
滕森,钱强,曾东,国弘Y,藤本K,黄东,等。水稻叶片光合速率及相关生理性状的QTL分析(栽培稻l .)。Euphytica。2004;135:1-7。
张广华,徐强,朱晓东,钱强,薛华伟。SHALLOT-LIKE1是一个KANADI转录因子,通过调节叶片背面细胞发育来调节水稻叶卷。植物细胞。2009;21:719-35。
王志华,吴秀生,常雪平,李荣振,景荣龙。小麦旗叶叶绿素含量、叶绿素荧光动力学参数及其与产量的灰色关联度。作物学报。2010;36(2):217-27。
石德坤,姚涛来,刘娜娜,邓敏,段海燕,王丽丽,万杰,高建华,谢海林,唐建华,张晓华。玉米叶绿素含量的全基因组关联研究。中国农业科学,2019;52(11):1839-57。
比尔斯。绿色的基因中。植物科学进展2005;10:309-12。
王玉凯,何玉军,杨梅,何剑杰,徐鹏,邵明奎,褚萍,关润泽。与叶绿素缺乏相关的显性基因的精细定位芸苔属植物显著.Sci众议员2016;6:31419。https://doi.org/10.1038/srep31419.
黄亮,戴亮,王亮,冷艳,杨艳,徐静,等。水稻灌浆过程中顶端三叶叶绿素含量的遗传解剖(栽培稻l .)。植物生长学报2015;34:381-91。
Graziani M, Maccaferri M, Royo C, salvatrelli F, Tuberosa R.硬粒小麦优良群体在不同热雨计量条件下产量组成和形态生理性状的QTL分析。牧草科学,2014;65:80-95。
张广华,李少云,王磊,叶文杰,曾德龙,饶永春,等。LSCHL4从粳稻栽培品种,它是等位基因NAL1,提高收率。籼稻超级稻93 - 11。摩尔。2014;7:1350 - 64。
Kumar S, Sehgal SK, Kumar U, Prasad PVV, Joshi AK, Gill BS。春小麦抗旱性相关性状的基因组分析。Euphytica。2012;186:265 - 76。
水稻叶绿素含量的数量性状位点及其与叶片光合作用的关系。大米。2010;3:172 - 80。
叶伟,胡松,吴磊,常伟,崔勇,徐静,等。精细映射一个主要QTLqFCC7 L有关水稻的叶绿素含量(栽培稻l .)简历。PA64s。植物生长规律2017;81:81-90。
葛颖,王婷,王楠,王铮,梁超,Ramchiary N,等。白菜叶绿素含量数量性状位点的遗传定位与定位(芸苔属植物拉伯ssp。学报).Sci Hortic。2012;147:42-8。
黄建辉,徐晓峰,曲超,闫晓燕,付峰,陈磊,等。胚胎叶绿素qtl的定位芸苔属植物显著植物资源学报,2010;11:766-71。
闫旭,李娟,金明,陈亮,王杰,曲超,等。水稻青果壁叶绿素含量的QTL分析芸苔属植物显著油料作物学报2009;31:269-73。
丁杰。小麦苗期耐盐生理及相关基因QTL定位芸苔属植物显著l .论文。杨凌:西北农林科技大学;2015.
郎林宁,徐阿学,丁俊,闫铮,赵楠,田忠生,刘烨平,王勇,刘旭,梁飞红,等。水稻耐盐性的数量性状位点定位及耐盐基因的鉴定芸苔属植物显著中国植物科学,2017;8:1000。
徐JH。小麦苗期耐旱性性状的QTL分析芸苔属植物显著l .论文。重庆:西南大学;2016.
刘慧敏,周晓霞,刘建峰,邱亚波,范若夫,徐庆刚。植物光合特性的配合力分析籼稻杂交水稻。植物资源学报,2014;15:699-705。
刘杰,王建勇,姚学勇,张勇,李建强,王xx,徐志军,陈伟峰。水稻热敏叶绿素亏缺突变体1的鉴定和精细定位(栽培稻l .)。育种科学。2015;65:161-9。
石德坤,姚天明,刘娜娜,邓敏,段海辉,王丽丽,等。玉米叶绿素含量的全基因组关联研究。农业科学2019;52:1839-57。
李伟,潘晓春,余海霞,齐海清,毛晓荣,黄青云,等。大豆叶绿素含量QTL定位及候选基因预测。中国生物医学工程学报(英文版)2016;
梁洪志,于玉林,杨海虹,董伟,徐立军,牛毅刚,等。大豆叶片性状和叶绿素含量qtl的上位性和QTL×environment互作效应作物学报,2015;41:889-99。
刘勇,安宁张安,王丰芳,孔达元,李明思,毕建刚,张飞,王建华,罗XX,潘志强,于晓强,刘桂兰,罗丽君。精细绘制一个数量性状位点,qSER-7,控制水稻柱头外露率(栽培稻l .)。大米。2019;46。
王晓燕,王晓燕,王晓燕,等。一种来自高等植物的fkbp型亲免疫素的分子结构研究。中国科学(d辑:自然科学版)1996;
叶绿体FKBP与细胞色素bf复合物Rieske亚基相互作用并影响其积累。美国国家科学院2002;99:15806-11。
邓凯,于磊,郑旭,张凯,王伟,董鹏,等。雷帕霉素靶点是植物生长素信号转导的关键分子拟南芥.植物科学进展2016;7:291。
Werner- felmayer G, Golderer G, Werner ER。四氢生物terin的生物合成、利用及药理作用。Curr Drug Metab 2002; 3:159-73。
Kotsonis P, Fröhlich LG, Shutenko ZV, Horejsi R, Pfleiderer W, Schmidt HH。四氢生物terin对神经元一氧化氮合酶的变构调节及自损伤性超氧化物的抑制。生物化学学报,2000;32 (Pt 3): 767-76。
Flores-Pérez U, Sauret-Güeto S, Gas E, Jarvis P, Rodríguez-Concepción M.质体编码蛋白生产受损的突变揭示了在拟南芥叶绿体。植物细胞。2008;20:1303-15。
刘宏,刘娥,林兆明,朱宏,李硕,黄刚,等。OsNOA1/RIF1是AtNOA1/RIF1的功能同源物:提示一种高度保守的植物cGTPase对叶绿体功能至关重要。新植醇。2010;187:83 - 105。
杨强,何浩,李浩,田浩,张杰,翟磊,等。NOA1在水稻中具有调节叶绿素合成和Rubisco形成的温度依赖性功能。《公共科学图书馆•综合》。2011;6:e20015。
何浩,杨启群,沈斌斌,张松,彭XX。OsNOA1在低温条件下调节水稻叶绿体蛋白具有阈值依赖的功能。植物生物学杂志,2018;18(1):44。
凌庆华,黄文辉,杨晓峰。SPAD-502型拟南芥叶片叶绿素含量的测定。Photosynth杂志2011;107(2):209 - 14所示。
Saghai-Maroof MA, Soliman KM, Jorgensen RA, Allard RW。大麦核糖体DNA间隔长度多态性:孟德尔遗传、染色体定位和种群动态。中国科学(d辑:自然科学版)1984;
杨敏,黄超,王敏,范宏,万松,王勇,等。上卷曲叶轨迹的精细定位(BnUC1)芸苔属植物显著.BMC Plant Biol 2019;19:324。
Creste S, Tulmann AN, Figueira A.用银染色法检测变性聚丙烯酰胺测序凝胶中的单序列重复多态性。植物分子生物学报告2012;19:299-306。
李强,万建明。SSRHUNTER: SSR位点局部搜索软件的开发。Hereditas。2005;27(5):808 - 10。
王晓东,王晓东,王晓东。生物技术软件互联网代表2000;1(6):270-2。
Ooijen JWV。JoinMap 4,用于计算实验群体遗传连锁图谱的软件。瓦赫宁根:Kyazma B.V;2006.
刘瑞,刘建林。MapDraw:一个microsoft excel宏,用于根据给定的遗传连锁数据绘制遗传连锁地图。Hereditas。2003;25(3):317 - 21所示。
易斌,陈勇,雷松,涂洁,付涛隐性雄性不育基因的精细定位(Bnms1)芸苔属植物显著《应用科学》2006;113:643-50。
颜泰,李鹏平,欧SC,施恩金华,陆慧敏,张培平。用TA克隆构建番鸭细小病毒感染质粒克隆及部分减毒菌株。鸟类分册。2015;44:124-8。
Livak KJ, Schmittgen TD。相关基因表达数据的实时定量PCR和2(−△△C (T))方法。方法。2001;25:402-8。
确认
不适用。
资金
本研究得到国家重点研发计划项目(2016YFD0101304)、国家自然科学基金项目(31460354)、国家油菜籽产业技术体系(CARS-12)、青海省春季油菜遗传改良实验室(2017-ZJ-Y09;青海省农林科学院科研项目(2018-NKY-011)。
作者信息
从属关系
贡献
YJX、LHD和DDZ构思设计了该研究;YJX和LHD进行实验;YJX、LHD和DDZ讨论了结果和策略;YJX分析了数据并撰写了手稿。ZZ、XL、LKX对稿件进行了修改。所有作者阅读并批准了该手稿。
相应的作者
道德声明
伦理批准和同意参与
本研究不包含任何需要伦理同意或批准的研究。
同意出版
不适用。
相互竞争的利益
作者声明没有竞争的经济利益。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构附属的管辖权要求保持中立。
补充信息
附加文件1:表S1。
基因分型的cqSPDA2在公元前6F1人口。
附加文件2:表S2。
本研究设计的引物序列。
附加文件3:图S1。
遗传连锁图谱cqSPDA2.
附加文件4:图S2。
局部遗传连锁图谱和物理图谱cqSPDA2在公元前的A02染色体上3.F2人口。
附加文件5:表S3。
本研究设计的引物序列。
补充文件6:表S4。
本研究设计了KASP引物序列。
附加文件7:表S5。
在A02染色体上定位区间内的基因及其在拟南芥.
附加文件8:表S6。
为定位区间内基因的qRT-PCR设计引物。
附加文件9:表S7。
A02上定位区间内的基因表达。
附加文件10:图S3。
精细制图的空数据开发方案。
权利和权限
开放获取本文遵循创作共用署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),该协议允许在任何媒体或格式中使用、分享、改编、分发和复制,只要您给予原作者和来源适当的署名,提供创作共用许可协议的链接,并说明是否有更改。本文中的图片或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果材料不包含在文章的创作共用许可中,并且您的预期用途不被法律法规允许或超出了允许的用途,您将需要直接从版权所有者那里获得许可。欲查看此许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献放弃书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信用额度中另有说明。
关于这篇文章
引用这篇文章
叶建军,刘海燕,赵志强,刘海燕。et al。QTL的精细映射cqSPDA2叶绿素含量芸苔属植物显著lBMC植物杂志20.511(2020)。https://doi.org/10.1186/s12870-020-02710-y
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12870-020-02710-y
关键字
- 芸苔属植物显著
- 叶绿素含量
- Near-isogenic线
- 良好的映射
- 中存在