摘要
背景
TaCKX小麦基因家族成员(GFMs)编码细胞分裂素氧化酶/脱氢酶(CKX),该酶能不可逆地降解细胞分裂素。这些基因是细胞分裂素含量的重要调节因子,参与生长发育,对产量相关性状有重大影响。本研究的目的是测试这些基因在田间与实验室条件下的表达是否存在差异,从而对植物发育和产量产生不同的影响。
结果
我们比较了中国的表情和相声TaCKXGFMs和TaNAC2-5A在生长室(GC)和田间栽培的现代品种中,研究基因的差异对产量相关性状的影响。的TaNAC2-5A基因在这些基因的协同调节中发挥重要作用,因此被纳入研究。的相对表达水平范围TaCKXGFMs和TaNAC2-5A被试品种间基因分布为5个TaCKX8到100多岁TaCKX9在GC和从6为TaCKX8到275TaCKX10在野外。在GC中,其中四个的范围相似,但其他七个和TaNAC2-5A在野外。的TaCKXGFMs和TaNAC2-5A形成不同生长条件下的共表达组。因此,这些基因在GC和田间也以不同的方式调节与产量相关的性状。TaNAC2-5A只在控制GC条件下参与幼苗根系分蘖数和CKX活性的负调控。籽粒数和籽粒产量受TaCKX10但积极的是TaCKX8以及这个领域的其他人。部分在幼苗根系表达的基因负向影响分蘖数,正向调节幼苗根重、穗中CKX活性、千粒重和半空穗的形成。
结论
我们已经证明:1)被测基因在两种环境中表达水平的自然变异非常高,表明为育种目的选择有益基因型的可能性;2)为育种创建理想型模型,我们需要考虑自然环境。
背景
小麦是经济上最重要的谷类作物之一。1]。它可以在广泛的环境条件下种植,营养成分丰富。它提供了人类饮食中大约20%的蛋白质[2]。大的六倍体基因组由三个A、B和D二倍体基因组组成,是决定产量相关性状的丰富基因储存库[3.]。然而,在过去的二十年里,小麦产量的增长一直保持温和甚至停滞不前[4,5]。与水稻和玉米相比,对这种谷物的研究要少得多[6]。
CKXGFMs编码细胞分裂素氧化酶/脱氢酶(CKX),该酶可不可逆地降解细胞分裂素[7],因此强烈调节植物不同器官中细胞分裂素的含量。由于细胞分裂素在植物发育中发挥着多种作用,并影响许多重要的农业过程[8,9),CKX基因影响产量相关性状。在谷物中,它是通过沉默的方式记录下来的CKX在米饭里[10],大麦[11,12]和小麦[13导致细胞分裂素水平升高,影响产量成分。该植物激素还调节细胞分裂素诱导基因的基因表达变化,介导其多效性[9,14]。
的数量CKXGFMs因物种而异。在面包小麦中,已经提出了11到14个基因家族成员[15,16,17,18]。TaCKX2经历了基因复制[15],所得基因被赋值为TaCKX2.1和TaCKX2.2基于Ensembl植物数据库[19]和Ogonowska等人的系统发育分析[16]。的编号TaCKXGFMs最近利用最新的数据库(包括IWGSC RefSeq v2.0)进行了修订,它们与密切相关的单子叶植物(包括大麦)的同源性和二倍体基因组特异性[20.]。根据这些数据,有13个TaCKXgfm基本上编号为TaCKX1,TaCKX2.1,TaCKX2.2.1,TaCKX2.2.2,TaCKX2.2.3,TaCKX3(6),TaCKX4,TaCKX5,TaCKX7,TaCKX8(11),TaCKX9(10),TaCKX10(9),TaCKX11(3.),其中12个分配给与A、B和D基因组相关的三条染色体,总共有35个同源基因。例外是TaCKX2.2.2只分配给D基因组。这个新的编号TaCKX基因应用于本出版物,前数字显示在括号中。
的CKXs表现出不同的器官和发育特异性表达模式。在我们之前的研究中HvCKX在大麦中,我们发现这些基因的表达模式表明它们在生长和生殖发育中的作用[21]。因此,我们调查的第一步是CKX小麦基因在不同器官和不同发育阶段的表达特异性[j]。16]。根据这些结果,将这些基因分为四类:1)叶片特异性基因TaCKX9,TaCKX5,TaCKX4;Ii)特定于花序和正在发育的穗TaCKX1和TaCKX2;Iii)幼苗根系特异性TaCKX10,TaCKX7iv)在所有被测器官中以不同水平表达TaCKX11,TaCKX3,TaCKX8[16]。的TaCKXGFMs在机构内部和机构之间进行合作。的影响TaCKX1进一步研究了7个DAP(授粉后天数)穗的沉默[13]。不同程度的TaCKX1T中的沉默1和T2代际影响着不同的共同表达方式TaCKXGFMs和产量相关性状参数。只有线条带着强烈的沉默TaCKX1并与这种强烈的下调相关联TaCKX11和差异TaCKX2.1和TaCKX9具有高产的特点。沉默型水稻穗状花序7dap中大部分细胞分裂素的含量2株系显著增加,并与其他植物激素相互作用。所试各产量相关性状均受各种上调或下调调控TaCKXGFMs和植物激素。
细胞分裂素通过多种转录因子(TF)调控靶器官和发育阶段的基因转录[22]。参与细胞分裂素依赖性调节的最大的植物TFs群体之一是NAC (NAM, ATAF和CUC) TFs家族。已有文献表明,NACs参与了重要农艺性状的调控[23,24,25,26]。硝酸盐诱导小麦的过表达TaNAC2-5A水培条件下和大田条件下,提高了根系生长、硝态氮吸收速率,提高了籽粒产量、籽粒氮浓度和不同供氮水平下的氮素收获指数[23]。该基因作为细胞分裂素活性的重要调节因子被纳入我们的研究。
与田间条件相比,在受控环境中进行的实验使植物在白天暴露于恒定的光照、恒定的温度和人工土壤条件下。在不依赖光源的人工光条件下生长的拟南芥植株的生长参数和形态与自然条件下生长的植株相比有显著差异[j]。27]。大麦在田间和半控制条件下对开花时间有明显的上位相互作用[j]。28]。此外,在正常和非生物胁迫条件下,植物激素对籽粒发育的调节也不同[29,30.,31,32]。另据报道,与实验室条件相比,产量稳定基因在田间的表达存在差异[33]。
用转基因方法提高小麦产量似乎很有希望,但目前还没有转基因品种获得批准。5]。另一方面,自然变异被认为是了解茉莉酸信号传导介导的反应的有益的丰富研究对象来源[34]。我们一直在测试两种可供选择的改变策略TaCKX-依赖性细胞分裂素调控以提高小麦产量。一个是基于修改的TaCKX基于rnai基因沉默的基因表达[13]。第二个,在这里提出,探讨选择的可能性自然变异不同的表达TaCKX小麦基因型/育种材料中的GFMs。这些GFMs在不同环境中共同调节产量相关性状的差异,可能导致在专门针对特定环境的育种计划中选择适当的基因型。因此,在研究的第一部分,我们检查了表达的范围TaCKX在生长室和田间,不同品种和育种系在7个DAP穗和幼苗根中存在GFMs。我们分析了它们之间和它们之间的共表达TaNAC2-5A以及它们在两种环境下对产量相关性状的影响。在本研究的下一部分,我们将研究所选择的标记基因的表达模式是如何遗传的,以及它们是否与产量相关性状的遗传一致。
结果
的表达TaNAC2-5A发育中的小麦植株的不同器官
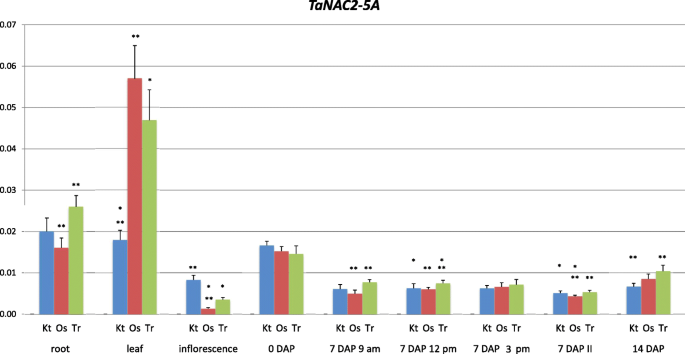
的相对表达水平TaNAC2-5A(NAC2)在叶片、幼苗根和0 DAP穗中含量最高,范围为0.015 ~ 0.057(图2)。1).这一范围很大,主要取决于该基因在三个被试品种之间的表达差异很大。其中两个品种,Ostka和Trappe的表达水平NAC2在叶片中的含量是康特萨的三倍。有趣的是,在同一品种中,在花序中发现了相反的表达水平数据,其表达水平要低几倍。
的表达差异无统计学意义NAC2在品种间的0个DAP穗。的表达水平NAC27、14个DAP峰的变化范围为0.005 ~ 0.01。品种间存在一定差异,但第1穗和第2穗及日采收次数之间无差异。
表达的可变性范围TaCKXGFMs和NAC2在生长室和田间
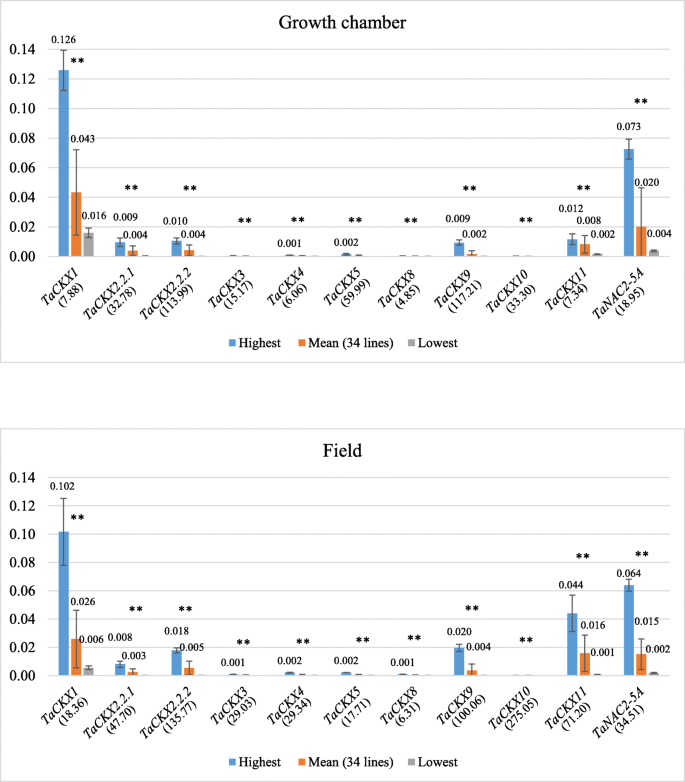
的表达水平TaCKXGFMs和NAC2在生长室(GC)和田间生长的34个育种品系的7个DAP穗部进行了测定。相对表达式的最高、平均值和最低值如图所示。2.的水平CKX1从GC中提取的7个DAP峰的平均相对表达量(0.043)高于从田间提取的相同材料(0.026)。同一基因在GC中的最高值(0.126)和最低值(0.016)差异为7.88倍(变异商),而在田间的差异为18.36倍(变异商),分别为0.102和0.006。
类似于CKX1,卑鄙的表达CKX2.2.1和NAC2(TaNAC2-5A气相色谱(0.0038和0.020)高于野外(0.0025和0.015)。然而,对于大多数人来说TaCKXGFMs (CKX2.2.2,CKX3,CKX5,CKX8, CKX9,CKX10,CKX11),在野外表达的平均值比GC高。在两种条件下生长的7个DAP穗在育种系之间的表达变异范围相似CKX2.2.1,CKX2.2.2,CKX5和CKX9,并显示出很大的差异CKX1,CKX3,CKX4,CKX5,CKX10,CKX11和NAC2在野外条件下。与田间相比,GC基因表达水平之间的最高变异性为5至10倍CKX4,CKX10和CKX11.CKX1是高度表达的,其次是CKX11,CKX2.2.2和CKX9在两种生长条件下。的平均水平NAC2表达类似于CKX11在野外(分别为0.016和0.015),在气相色谱(分别为0.020和0.008)中高出两倍。三个生物重复的基因表达水平的标准偏差在田间穗状物中比在GC中更高。
Co-expression的TaCKX生长室和现场的GFMs
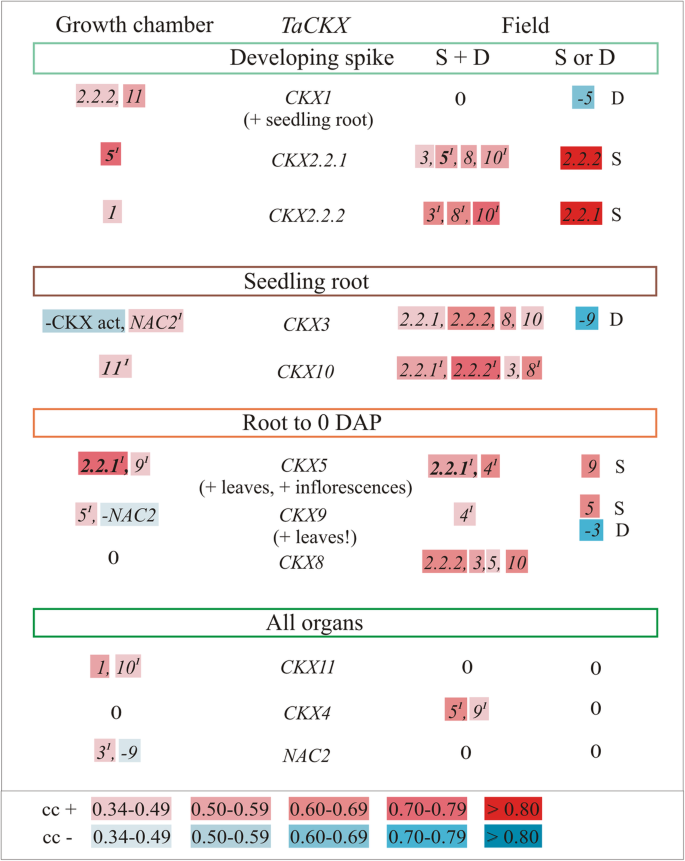
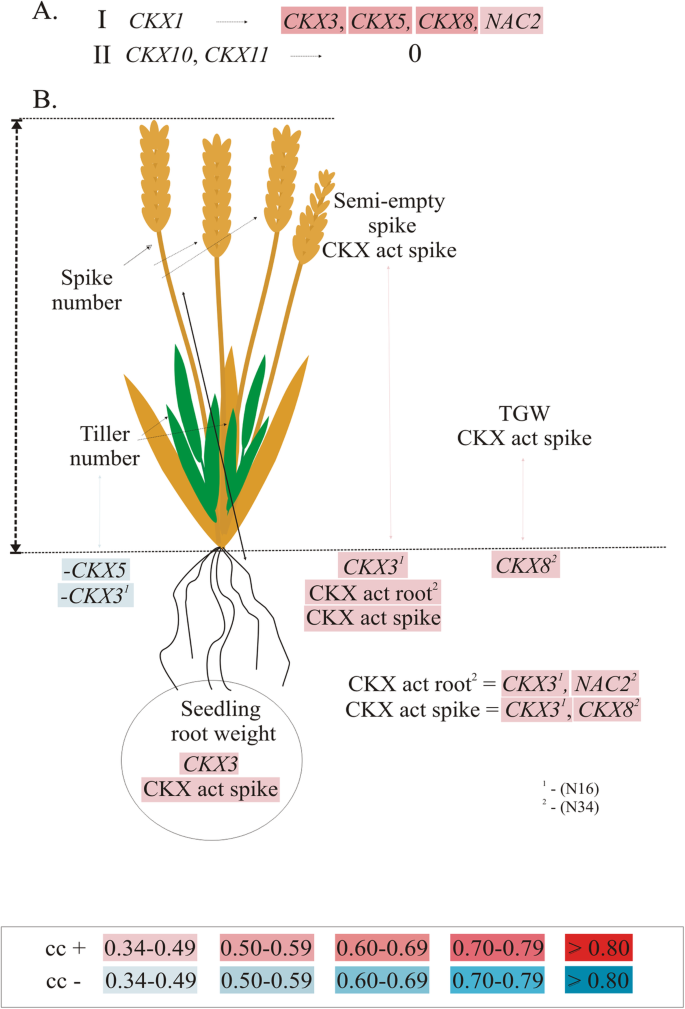
各种表达水平的相关性TaCKXGFMs在生长条件、气相色谱和野外都是不同的(图2)。3.表52).由于选育系是在Strzelce (S)和Danko (D)两家植物育种公司的两个不同的大田上生长的,因此在两个条件下(S + D)和单独(S或D)都存在相关性。通常,在田间条件下,相互相关基因的群体比GC条件下大,并且其中一些基因的共表达是特定于田间的(S或D)TaCKXGFMs被分为四组。第一个基因包含在穗突发育中特异性表达的基因;第二组基因在幼苗根中表达;第三种是对幼苗根部至0 DAP穗的幼嫩器官的特异性,第四种是对所有器官的特异性。
穗特异性表达水平CKX1与表达水平显著相关CKX2.2.2和CKX11在GC中,但在两个领域的峰值中没有发现与其他人的相关性。否则CKX5与特异性阴性共表达CKX1当时在D田种植了穗状花序。CKX2.2.2,其表达与CKX1在GC中,与CKX3, CKX10和CKX8在这两个领域,并单独与CKX2.2.1在S领域。CKX2.2.1与CKX5在两种生长条件下。该基因也与CKX3,CKX8和CKX10在这两个领域和单独与CKX2.2.2在S领域。根特异性表达CKX3来自第二组的基因与表达呈正相关NAC2与CKX活性呈负相关CKX2.2.1,CKX2.2.2,CKX8和CKX10在场以及强负与CKX9在D场。另一个根系比,CKX10与…完全相关CKX11在GC和CKX2.2.1,CKX2.2.2,CKX8在田野里,就像在CKX3.而且,两者的表达水平,CKX3和CKX10在田间条件下表现出相互的相关性。的CKX5,在较年轻的器官中强烈表达,特别是在幼苗根、叶和花序中,与CKX2.2.1在这两种情况下,与CKX9在GC和withCKX4在田地里和在一起CKX9在S领域。这一组中下一个的表达式,CKX9,哪个叶子特别高,与CKX5负的是NAC2与GC呈正相关CKX4在这两个领域,并积极配合CKX5在S场,负与CKX3在D场。的表达与CKX8以及任何GC测试基因。然而,CKX8正相关CKX2.2.2,CKX3, CKX5和CKX10在这两个领域条件。
最后一组代表所有器官中表达的基因。有趣的是,CKX11与的表达相关CKX1和CKX10在GC。在田间条件下,该基因与其他基因无相关性。反之,水平CKX4表达与CKX5和CKX9在两个领域,但在GC没有相关性。的表达呈正相关NAC2和CKX3负相关CKX9在GC。无相关性NAC2和其他人一起在野外被发现。
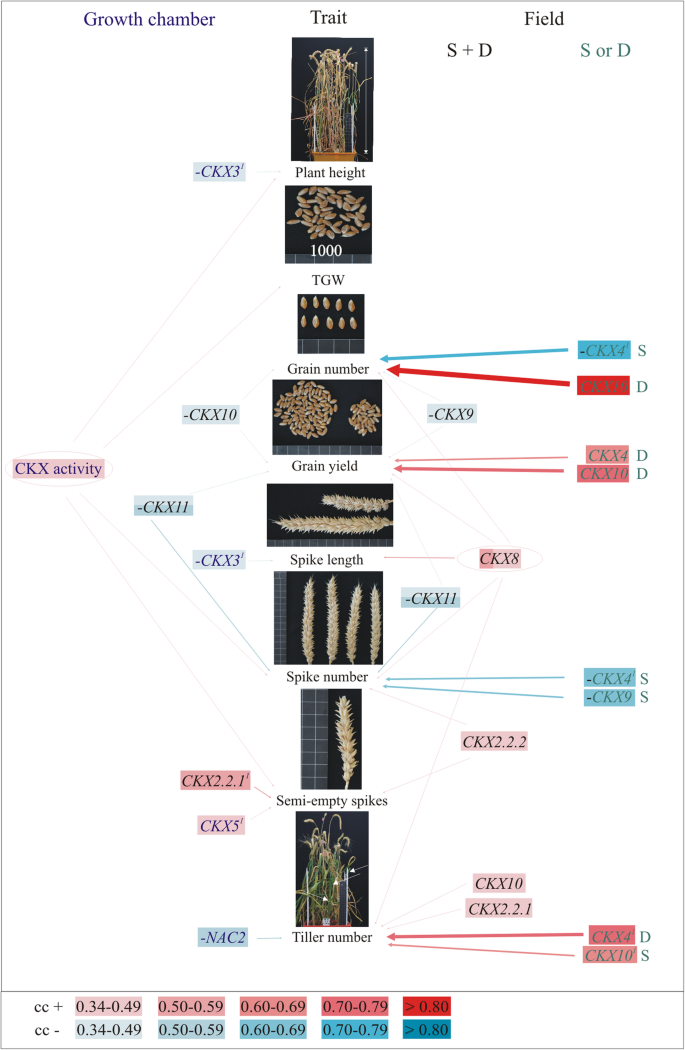
的表达TaCKXGFMs和NAC2在两种生长条件下,7个DAP穗上的CKX活性对产量相关性状的影响不同
在GC中,株高和总重与7个DAP穗的CKX活性呈正相关(图2)。4表53.).而株高和穗长则与小麦籽粒含量呈负相关CKX3.酶活性也与穗数和半空穗数呈正相关。半空尖峰的数目与表达量呈正相关CKX2.2.1和CKX5,分蘖数与NAC2.籽粒数与籽粒产量在相同生长条件下呈负相关CKX10.在田间条件下,籽粒数和籽粒产量与表达量呈负相关CKX9,正相关CKX8,但产量与产量呈负相关CKX11(两个领域的尖峰)。此外,籽粒数与产量呈显著负相关CKX4在S田的穗中表达,且与CKX10以防D场的尖峰。否则,粮食产量受到CKX4和CKX10如果是D场。的CKX8在穗上的表达不仅与粒数、产量呈正相关,还与穗长、穗数、分蘖数呈正相关。尖峰数和半空尖峰数均与CKX2.2.2从两处田地采集的尖峰测量。单独来看,尖峰数与CKX4和CKX9S田的穗数与分蘖数呈正相关CKX4和CKX10分别用D和S场的尖峰测量。
的表达TaCKXGFMs和NAC2幼苗根系中CKX的活性影响产量相关性状
的表达CKX1在幼苗根系中与CKX3, CKX5,CKX8和NAC2(无花果。5a、表S4).两者之间没有相关性CKX10和CKX11以及其他在这个器官中表达的基因。
CKX3在幼苗根中表达的基因是GC中与产量相关性状相互作用最频繁的基因(图2)。5b、表54).其表达量与幼苗根重和半空穗呈正相关,与分蘖数负相关。的正相关CKX3在穗状花序中伴随着CKX活性,在半空穗状花序的情况下,还伴随着根中的CKX活性。此外,CKX3和CKX8是CKX活性峰值的积极调节因子NAC2,与幼苗根系中CKX活性呈正相关。的表达CKX8与CKX在峰值和TGW中的活性正相关。的表达CKX5与分蘖数负相关。
讨论
TaNAC2-5A在小麦植株的不同器官中表达
TaNAC2-5A(NAC2)纳入小麦产量相关性状调控研究TaCKX基因家族可能是这些基因及其相应过程的重要调节因子。这nitrate-inducibleNAC2编码基因由He等人报道。[23是小麦根系生长和产量的重要调节因子。联系NAC2表达到我们之前对表达特异性的研究TaCKX,我们进行了类似的表达实验TaCKX[16]。的相对表达量NAC2在根、叶和He等报道的14个DAP穗中。[23与我们的结果比较。的NAC2在我们新检测的器官:花序、0个DAP和7个DAP穗中也有表达,但表达水平低于14个DAP穗。一般来说,该基因在所有被检测的器官中都有表达。我们还证明,特别是在叶片,花序和根的表达水平NAC2不同品种间差异很大。
很大的差异TaCKXGFMs和NAC2在育种系之间的表达水平允许它们被选择用于育种目的
测试的最高和最低表达水平之间的差异TaCKXGFMs和NAC2在育种系中是显著的,从几倍到一百倍以上。与GC相比,在田间生长的7个DAP穗中表达的6个基因的差异要大得多。这与胁迫诱导基因在田间比在实验室条件下表达更强烈的观察结果是一致的[33]。这些表达差异可能是被测基因之间的等位基因变异、遗传背景和与环境的相互作用的结果。等位基因变异TaCKX与产量相关性状对应的家族基因已被其他文献报道[35,36,37]。数据表明在育种过程中使用该参数进行选择的可能性。
选择TaCKXGFMs在野外和气相色谱条件下的表达是不同的
株系间表达变异范围相似CKX2.2.1,CKX2.2.2,CKX8和CKX9这可能表明这些基因的表达水平与生长条件无关。表明这些基因在不断变化的条件下保持稳定表达的数据与新发表的结果一致TaCKX1两种情况下都是沉默CKX2.2[13]。的表达明显减少TaCKX1基因在无声的线条中同时表达CKX2.2保持在同一水平。否则,不稳定的田间生长条件对表达的影响CKX1,CKX3,CKX4,CKX5,CKX10,CKX11和NAC2是重要的。的确,TaCKX1沉默导致的表达强烈下调CKX11和上调CKX5[13]。它可能依赖于相同的反馈机制之间的诱导和表达的选择CKX细胞分裂素基因及其功能[38]。已经有文献表明,在受控环境中,白天持续的辐照度和缺乏日光转换可能会显著影响植物表型[27]。因此,在正常和逆境条件下决定产量的许多基因组、编码叶绿体定位蛋白或避荫的基因(包括参与激素调节、光照和开花的基因)在生长室内和田间条件下的表达差异[33,39]。的表达CKX以及生物合成IPT基因也可能受到可用的大量营养素水平的调节,如硝酸盐和磷酸盐[40],以及野外的生物/非生物应激条件。
TaCKXGFMs和NAC2在野外或受控环境中形成不同的共表达群
的TaCKXGFMs和NAC2在不同的组中主要在GC和field中共表达。在两种情况下,只有其中两种可以相互合作:CKX2.2.1表现为形成尖刺和CKX5在幼苗根、花序和叶片中高度表达[16]。这种合作可能表明它们在植物生长发育过程中独立于生长条件调节根和穗间细胞分裂素水平的重要性。
值得注意的是,CKX1在穗和根的发育中高度表达CKX11和NAC2仅在GC条件下与其他基因形成共表达组。这并不意味着基因不受不同营养条件的影响NAC2被证明是由硝酸盐诱导的[23]。然而,这些基因的表达可能不受主要环境因素的影响,如光照来源、日光转换以及温度和土壤湿度的变化。CKX11在所有器官中高度表达,与CKX1和CKX10在气相色谱条件下表达量高7倍,而在野外表达量高7倍。这种强有力的共同调控CKX11与CKX1在我们的研究中已经观察到TaCKX1在气相色谱条件下进行[13]。相反CKX4表达于所有器官和CKX8在年轻器官中表达的,在GC中没有表现出任何共表达,被其他领域的人共同调节。因此,这些基因可能参与调节细胞分裂素的含量,使其他基因参与到压力更大的环境中。
的群体明显更大TaCKX基因在不稳定的田间条件下共表达。CKX8在较年轻的器官中表达最多的是与其他器官合作,主要是在发育的穗和根中表达。然而,基因与CKX5属于同一表达组,这可能与两种生长条件下其他基因表达的协同调节有关。的表达CKX2.2.1和2.2.2在发育尖穗中特异性表达与同一根特异性相关CKX3和CKX10以及CKX8特定于年轻的器官,但只在野外条件下。这两个CKX2.2基因与GC中的不同基因相关,CKX2.2.1与CKX5和CKX2.2.2与CKX1,这可能表明它们的不同详细功能(下面讨论)。
同时根系比CKX3和CKX10是与两者共同调控的吗CKX2.2和CKX8对所有器官都是特异的,而且在这个领域彼此都是特异的,但在GC中,这些基因特异地与GC特异协同工作NAC2和CKX11分别。
与产量相关的性状是由不同的TaCKXGFMs和NAC2,取决于自然环境或受控环境
在共表达的情况下,更多CKX大田条件下基因参与调控产量相关性状,尤其是粒数、粒产量、穗数和分蘖数的基因比GC条件下多。在这个领域最活跃的是CKX8在与之共调节的所有器官中表达CKX9粒数,带CKX9和CKX11粮食产量CKX11峰值数CKX2.2.1和CKX10分蘖数和作为单穗长度。在大多数情况下,这些特征是由CKX8但是通过共表达是消极的TaCKX基因,这表明它们在维持激素稳态中起主要作用。有趣的是,籽粒数、产量、穗数和分蘖数等性状受到基因的强烈调控CKX4和CKX10但是这个规则是场相关的。据推测,这两个基因都强烈依赖于环境条件,因为两个研究领域在土壤类型和天气条件上都有所不同。
籽粒数和籽粒产量等性状在GC中均受到负调控CKX10.在两种生长条件下,没有一个基因调节相同的产量相关性状。与Jablonski等人的研究类似。[13], GC的产量和穗数在7个DAP穗上呈负调控CKX11哪个,合作CKX2.1,影响了游离碱、活性的下调反式-玉米素(tZ)和N6-(Δ2-isopentenyl)腺嘌呤(iP),而苄腺嘌呤(BA)上调。在同一项研究中,gc生长的对照植株的穗数受到CKX2.2.1以及,其中与CKX1和CKX5上调tZ和iP,下调BA。我们的一些数据不具有可比性,因为在Jablonski等人。[13只有一个品种,数量有限TaCKX对基因和产量相关性状进行了检测。然而,结果表明,这些基因在7个DAP尖峰中形成了不同的共表达组TaCKX1沉默和非沉默植物,它们控制各种细胞分裂素的含量,并决定最终的产量相关性状。两者的不同协同调节CKX2.2籽粒和田间基因对产量相关性状的影响各不相同。CKX2.2.1在一起CKX5参与了GC中半空尖峰的形成,但是CKX2.2.2在这个领域,只有一个人有这样的参与。CKX2.2.1在一起CKX8和CKX10正向调节田间分蘖数。没有一个在GC和字段中显示相同的角色。Zhang等。[35报道说TaCKX6,由[20.]TaCKX2.2.1-3D是…的同源词OsCKX2调控水稻产量[10]。缺失18bp的品种显示该基因的表达减少,与其他单倍型相比,TGW更大。在最大转录本水平上存在较小的不亲和性,Zhang等人的研究在8dap处达到了这一不亲和性。[35在我们的研究中,从0 DAP增加到7 DAP,并在14 DAP达到最大值(后期未进行测试)。该基因在穗突发育过程中表达的增加更好地解释了该基因在籽粒灌浆中的可能作用,这是大总重的一个重要因素。除此之外,我们没有发现该基因的表达与TGW有任何相关性,尽管它的表达与CKX5正影响了GC半空穗的形成,并与田间其他两种分蘖数呈正相关。因此,联合效应TaCKX家族基因对生长条件下产量相关性状的调控具有重要意义。然而,的表达TaCKX2.2.1-3A(最初TaCKX2.4)被RNAi还原[41]与粒数呈较强的相关性3.因为每穗谷物的数量增加了。我们的研究也得到了类似的结果,其中CKX2.2.1在一起CKX5正调控GC中半空尖峰的形成,尽管同样的性状由CKX2.2.2在野外。此外,TaCKX2.2.1-3A更接近它们的同源物OsCKX2在水稻中,where也与谷粒数有关[10]。根据Li等人。[41],不同的功能TaCKX2.2.1-3D和TaCKX2.2.1-3A基因分别位于染色体3D和3A上的不同位置。我们认为,这些差异可能是由个体遗传背景中可能与其他基因的个体合作而额外调节的。
还有两种特征TaCKX家族基因都被证明是产量相关性状的决定因素。由Lu等分离得到。[36,这是一种新的等位基因TaCKX6a分配给TaCKX2.1基因家族[16],并重命名为TaCKX2.1-3D[20.表明,在我们早期的研究中[13],与重组自交系的粒级、粒重和籽粒灌浆率显著相关。在第二份报告中,两个等位基因中有一个TaCKX4Chang等人发现的[37]与叶绿素含量和籽粒产量正相关。作者没有显示任何表达数据。根据我们的研究,在GC中,该基因在小麦植株发育的所有被测器官中都有表达,在叶片中表达量较高,但相对于其他器官表达量较低[16]。我们没有发现它们的表达与CG的产量相关性状有任何相关性。然而,我们发现与GC相比,该基因在田间条件下的表达量更高,而且它们与产量相关性状的相关性强,这取决于个别田间条件。
选择TaCKXGFMs和NAC2在幼苗根系中表达调控一些与产量有关的性状
如前所述[16],CKX1在幼苗根中表达的与CKX3,CKX5,CKX8和NAC2在同一个器官里。此外,TaCKXGFMs和NAC2幼苗根中表达的基因与发育穗中表达的基因形成不同的共表达群。这意味着这些基因也参与了植物地上部分的协调发育,这取决于生长条件。这样的合作TaCKXGFMs是显而易见的,因为它们调节CKX酶活性,使细胞分裂素失活,而细胞分裂素是已知在茎和根生长中起相反作用的植物激素[42]。一个例子是CKX3,在幼苗根中高表达,与幼苗根重正相关,与株高、穗长负相关。NAC2用…控制CKX3根中CKX活性在穗中表达时,与分蘖数呈负相关。此外,CKX3与CKX5在根中表达负向调控分蘖数,但CKX3根中CKX活性正决定了半空穗的形成CKX8表达对TGW有正向影响。小麦苗根表达基因与地上部器官表达基因的这种协同作用及其对产量性状的影响在我们早期的研究中也有记载[13,16]。
一般来说,过度表达CKX在其他植物的根中,通过降低细胞分裂素的水平来促进根的生长[43,44,45,46]。相反,细胞分裂素水平升高会抑制水稻根的生长,但促进茎的生长[47]。在CKX水稻中的GFMs, Gao等。[48表明了…的关键作用OsCKX4生长素和细胞分裂素在冠根形成过程中的相互作用。毛等。[49]强调了NAC转录因子在水稻根系发育中的作用。过表达OsNAC2几个IPT,减少了OsCKX4和OsCKX5细胞分裂素水平升高。因此OsNAC2通过促进细胞分裂素的生物合成和抑制细胞分裂素的生长来刺激细胞分裂素的积累CKX表达式。这是受绑定的影响OsNAC2致OsCKX4.在我们的研究中,小麦TaCKX4直向同源,OsCKX4未发现与幼苗根重相关,可能是由于其在小麦根系及其他器官中的表达水平极低。然而,我们发现,两者之间存在很强的相关性CKX4基因表达和产量相关性状,这取决于田间条件。水稻的第二个同源物,TaCKX5,连同…CKX3,均与分蘖数呈负相关,但对同一性状有负相关影响NAC2用spike表示。
结论
先前的研究表明,与生长室相比,产量稳定基因在田间的表达存在差异[33]。这些差异可能意味着许多携带单一的、重要的农艺基因的转基因植物不能在实践中应用[5,50]。因此,要指示哪个TaCKX家族基因可能适用于育种计划,但重要的是在环境、实验室条件和实地对它们进行鉴定。事实上,我们发现这些基因的表达水平、串扰以及与农艺性状的相关性在现代品种和育种系中存在很大差异,这取决于环境条件。我们已经证明,为了创建一个理想的育种模型,我们需要考虑到田间环境。被测基因表达水平的自然变异,特别是在田间,非常高,表明为育种目的选择有益基因型/表型的可能性。这种选择基于被选基因的可变表达,由被测遗传背景的突变和与其他基因的串扰引起,可以在其田间环境中的最新育种材料中进行。我们认为,结合在这种环境中选择的有益基因型可以帮助育种者利用现有的遗传变异,并进一步优化其区域土壤和气候条件下的产量潜力。因此,我们研究的下一步是证明是否以及如何表达TaCKXGFMs在后代中遗传。
方法
植物材料
试验植物材料采自34个普通小麦选育系和品种(小麦L.)由两家植物育种公司交付:Strzelce有限公司- IHAR-PIB集团(23个育种品系)和Danko Hodowla Roslin有限公司(11个育种品系)。所选择的基因型在生产力和其他有趣的育种特征上存在差异,如抗病性、株高、蛋白质含量(包括面筋)和籽粒或种子硬度中的淀粉含量。这些植物生长在两种不同的生长条件下:生长室内和田间。
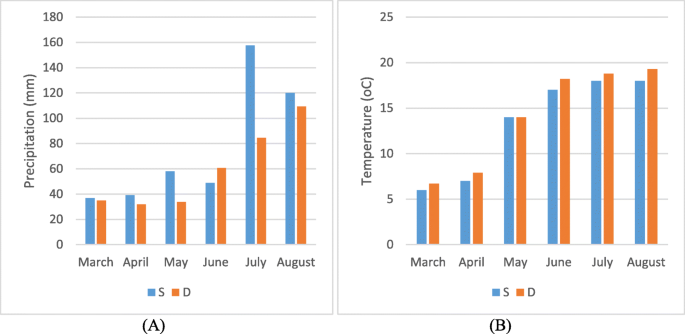
田间条件:田间试验在Strzelce公司(Konczewice)和Danko公司(Choryn)两个试验田进行。第一个位于波兰中北部(Kujawsko-Pomorski地区),第二个位于中西部(Wielkopolska地区),彼此相距约150公里。试验田面积为5 m2(= 5 × 1 m),每1 m播种400粒2.前茬分别为白甜菜和油菜。施氮两次,分别在春季植被开始和茎伸长开始时施氮,施氮量为100-120 kg ha−1总)。土壤施肥20-50公斤公顷−1磷和50-80公斤公顷−1钾,根据现场要求。实验过程中的湿度和热条件如图所示。6.在需要时补充缺水。
种子萌发和生长室条件如先前报道的[16]。5天的幼苗在早期收集幼苗根后,将其从胚轴处剪下3mm,再移栽到有土的花盆中。组织样品:授粉后7天的幼苗根和第一批穗中部(7 DAP)在生长室和田间进行3个生物重复采集。在这两种环境下,在7天后标记和收集穗状花序,穗状花序的前1-3个花药从中部的小穗中伸出。在生长室内随机抽取6个生物重复(每个穗1个),在田间整块地随机抽取3个生物重复(每个穗3个)。当天在田间进行标记,7天后采集。所有样本均于上午9点开始采集。用于测试的额外组织样本NAC2根据Ogonowska等人的研究,从三个普通小麦品种:Kontesa、Ostka和Trappe中收集了表达。[16]。
RNA提取和cDNA合成
根据制造商的协议,使用TRI试剂(Sigma-Aldrich)提取5天树苗根和7个DAP穗的总RNA。按照Ogonowska等人的描述进行RNA纯化和cDNA合成。[qh]16]。
定量RT-qPCR
对11个靶基因进行RT-qPCR分析:TaCKX1(JN128583),TaCKX2.2.1(FJ648070) /TaCKX2.2.2(GU084177),TaCKX3(原TaCKX6) (JN128587),TaCKX4(JN128586),TaCKX5(Lei et al. 2008),TaCKX8(原TaCKX11) (JN128592),TaCKX9(原TaCKX10) (JN128591),TaCKX10(原TaCKX9) (JN128590),TaCKX11(原TaCKX3) (JN128585),TaNAC2-5A(AY625683)。为检测基因设计的引物序列见表51.RT-qPCR反应按照Ogonowska等人的描述进行检测。[16]。每个反应在3个生物重复和3个技术重复中进行。采用两种标准曲线法ADP-ribosylation因素(裁判2)作为规范者[51]用于计算基因表达量。的相对表达式TaCKX与对照品种奥斯特卡组的家族基因计算为1.00。
CKX活性分析
CKX酶活性的测量在相同的样品中进行TaCKX根据Frebort等人开发的程序进行基因表达分析。[52]并对小麦组织进行了优化。Zalewski等人描述了这一过程。[12]。在230 ~ 550 nm的吸收光谱范围内测定了产物的浓度。根据Bradford程序,根据牛血清白蛋白标准曲线估算总蛋白浓度[53]。
产量相关性状的测量
对所选基因型的产量相关性状进行了形态计量学测量。描述性状为:株高、分蘖数、穗数、半空穗数、穗长、粒数、籽粒产量、总重和幼苗根重。
统计分析
统计学分析采用Statistica 13 (StatSoft)软件。采用Shapiro-Wilk检验检验数据分布的正态性。使用方差分析(ANOVA)和事后检验分析变化的显著性。使用参数相关矩阵(Pearson检验)或非参数相关(Spearman检验)确定相关系数。
数据和材料的可用性
本研究过程中产生或分析的所有数据都包含在这篇发表的文章[及其补充信息文件]中。
缩写
- CKX1-11:
-
TaCKX1 - TaCKX11
- NAC2:
-
TaNAC2-5A
- GFMs:
-
基因家族成员
- GC:
-
生长室
- CKX:
-
细胞分裂素氧化酶/脱氢酶
- 史:
-
植物育种专业
- D:
-
丹科·霍多拉·罗斯林
- tZ:
-
反式玉米素
- 知识产权:
-
N6——(Δ2-isopentenyl)腺嘌呤
- 芭:
-
苄基腺嘌呤
- TGW:
-
千粒重
参考文献
- 1.
Schnurbusch T.小麦和大麦生物学:迈向新领域。植物学报,2019;31(3):398 - 398。
- 2.
小麦育种对低投入农业的好处。植物学报,2019;5(7):653 - 53。
- 3.
王晓明,王晓明,王晓明,等。小麦和大麦产量相关性状的基因分析。理论与应用,2017;130(6):1081-98。
- 4.
王晓东,王晓东,王晓东,王晓东,王晓东,王晓东,王晓东,王晓东,王晓东,王晓东,等。sbp酶活性对小麦光合作用和产量的影响。中国生物医学工程学报。2017;32(1):1-10。
- 5.
Araus JL, Serret MD, Lopes MS.转基因解决方案提高小麦产量和稳定性:闪耀的希望还是昙花一现?[J] .神经学报,2019;70(5):1419-24。
- 6.
农业研究人员正在研究正确的作物,以确保在未来气候下的粮食和营养安全吗?环境科学学报,2018;53(3):592 - 594。
- 7.
王晓明,王晓明,王晓明,等。细胞分裂素降解生物学的研究进展。植物学报,2006;8(3):371 - 381。
- 8.
Jameson PE, Song JC。细胞分裂素:种子产量的关键驱动因素。实验学报,2016;67(3):593-606。
- 9.
Kieber JJ, Schaller GE。植物发育中的细胞分裂素信号传导。发展。2018;145(4):7。
- 10.
Ashikari M, Sakakibara H, Lin SY, Yamamoto T, Takashi T, Nishimura A, Angeles ER, Qian Q, Kitano H, Matsuoka M.细胞分裂素氧化酶对水稻产量的影响。科学。2005;309(5735):741 - 5。
- 11.
张建军,张建军,张建军,张建军,等HvCKX1该基因降低了大麦细胞分裂素氧化酶/脱氢酶水平,提高了植株产量。实验学报,2010;61(6):1839-51。
- 12.
张建军,张建军,张建军,等。HvCKX2在大麦中,通过生物或农杆菌介导的转化基因沉默导致不同的表型。植物化学学报,2012;12(2):626。
- 13.
贾布伦斯基,王晓明,王晓明,王晓明,王晓明TaCKX1调解他人的表达TaCKX提高小麦产量参数的基因。中华医学杂志,2020;21(13):1-21。
- 14.
Argyros RD, Mathews DE, Chiang YH, Palmer CM, Thibault DM, Etheridge N, Argyros DA, Mason MG, Kieber JJ, Schaller GE。拟南芥B型应答调节因子在细胞分裂素信号传导和植物发育中起关键作用。植物学报。2008;20(8):2102-16。
- 15.
马梅莫,郭志强,郭志强,郭志强,郭志强,等。植物的分子、系统发育和比较基因组分析细胞分裂素氧化酶/脱氢酶禾本科基因家族。植物学报,2012;10(1):67-82。
- 16.
Ogonowska H, Barchacka K, Gasparis S, Jablonski B, Orczyk W, Dmochowska-Boguta M, Nadolska-Orczyk A.TaCKX小麦发育植株的家族基因及其器官内和器官间的合作关系。科学通报,2019;14(4):1-20。
- 17.
Shoaib M,杨伟,单qq, Sajjad M,张安。面包小麦细胞分裂素代谢新基因的全基因组鉴定及表达分析(小麦l .)。Peerj。2019;7:1-23。
- 18.
宋杰,蒋磊,Jameson PE。小麦旗叶和生殖发育过程中细胞分裂素基因家族成员的协同调控。植物学报,2012;12(1):78。
- 19.
Kersey PJ, Allen JE, Allot A, Barba M, Boddu S, Bolt BJ, Carvalho-Silva D, Christensen M, Davis P, Grabmueller C,等。集成基因组2018:非脊椎动物物种的集成组学基础设施。中国生物医学工程学报,2018;46(1):888 - 888。
- 20.
陈磊,赵建强,宋建军,Jameson PE。细胞分裂素脱氢酶:小麦增产的遗传靶点。植物学报,2010;18(3):614-30。
- 21.
Zalewski W, Gasparis S, Boczkowska M, Rajchel IK, Kala M, Orczyk W, Nadolska-Orczyk A.HvCKX这些基因在大麦的生长和生殖发育中起着重要的作用。科学通报,2014;9(12):e115729。
- 22.
Shanks CM, Hecker A, Cheng CY, Brand L, Collani S, Schmid M, Schaller GE, Wanke D, Harter K, Kieber JJ。基本五半胱氨酸转录因子在细胞分裂素信号反应子集中的作用。植物学报,2018;35(3):458 - 463。
- 23.
何翔,曲碧,李文杰,赵小强,滕伟,马伟,任玉珍,李斌,李志生,童玉萍。硝酸诱导的NAC转录因子TaNAC2-5A控制硝酸盐反应,提高小麦产量。植物生理学报,2015;32(3):391 - 391。
- 24.
梁传志,王玉青,朱勇,唐建勇,胡斌,刘立林,欧思杰,吴洪,孙晓华,褚建峰,等。OsNAP通过调控脱落酸的生物合成和直接靶向水稻衰老相关基因,将脱落酸与叶片衰老联系起来。《美国科学院学报》。2014; 111(27): 10013 - 8。
- 25.
Redillas MCFR, Jeong JS, Kim YS, Jung H, Bang SW, Choi YD, Ha SH, Reuzeau C, Kim JK。的过度表达OsNAC9在田间条件下,改变水稻根系构型,提高抗旱性和产量。植物学报,2012;10(7):792-805。
- 26.
曲碧,何翔,王军,赵云云,滕伟,邵安,赵小强,马文勇,王建勇,李斌,等。小麦CCAAT盒子结合转录因子能在减少肥料投入的情况下提高小麦产量。植物生理学报,2015,32(2):444 - 444。
- 27.
Annunziata MG, Apelt F, Carillo P, Krause U, Feil R, Mengin V, Lauxmann MA, Kohl K, Nikoloski Z, Stitt M,等。回归自然:受控环境下实验的现实检验。实验学报,2017;68(16):4463-77。
- 28.
Afsharyan NP, Sannemann W, Leon J, Ballvora a .大麦占位和环境对开花时间的影响。[J] .中国生物医学工程学报,2010;31(3):893-906。
- 29.
阿比德明,邵永华,刘思祥,王峰,高建伟,姜东,田中伟,戴泰涛。干旱前诱导通过调节冬小麦的生长激素来维持花后干旱胁迫下的籽粒发育。足底。2017;246(3):509 - 24。
- 30.
刘勇,顾德德,吴伟,文XX,廖玉成。多胺与激素在小麦籽粒灌浆调控中的关系科学通报,2013;8(10):1-10。
- 31.
杨利明,方吉杰,季培生,倪小忠,陈世祥,Lee RD, Kemerait RC,郭宝珍。解译干旱诱导的玉米籽粒代谢反应及其调控。植物学报。2018;16(9):1616-28。
- 32.
Farooq M, Hussain M, Siddique KHM。小麦开花期和灌浆期的干旱胁迫。植物学报,2014;33(4):331-49。
- 33.
neissen H, Sprenger H, Demuynck K, De Block J, Van Hautegem T, De Vliegher A, Inze D.从实验室到田间:产量稳定和遮荫躲避基因的大量差异表达。植物学报,2020;18(5):1112-4。
- 34.
Ray R, Li DP, Halitschke R, Baldwin IT。利用自然变异来实现对茉莉酸信号介导的全植物功能反应的理解。植物学报,2019;39(3):444 - 444。
- 35.
张磊,赵玉玲,高丽玲,赵光远,周荣荣,张宝宝,贾建忠。TaCKX6-D1水稻的同源物OsCKX2在六倍体小麦中,与粒重有关。植物学报,2012;19(3):574 - 584。
- 36.
卢健,常昌,张惠平,王思祥,孙刚,肖松,马彩霞。一个新的等位基因的鉴定TaCKX6a02与普通小麦籽粒大小、灌浆率和重量有关。科学通报,2015;10(12):e0144765。
- 37.
常昌,陆军,张惠平,马春霞,孙国良。细胞分裂素氧化酶基因拷贝数变异Tackx4与普通小麦籽粒重和旗叶叶绿素含量有关。科学通报,2015;10(12):15。
- 38.
Schmulling T, Werner T, Riefler M, Krupkova E, Bartrina y Manns .细胞分裂素氧化酶/脱氢酶玉米、水稻、拟南芥和其他物种的基因。植物学报,2003;16(3):391 - 391。
- 39.
张建军,张建军,张建军,张建军。ATHB4在拟南芥幼苗中调节激素反应。植物科学学报,2009;39(2):394 - 394。
- 40.
李建军,李建军,李建军。环境感知途径:细胞分裂素与环境反应途径的相互作用。植物学报,2009;32(9):1147-60。
- 41.
李玉玲,宋国强,高军,张世杰,张荣志,李伟,陈丽丽,刘敏,夏小春,Risacher T,等。RNA干扰提高单穗粒数细胞分裂素氧化酶2面包小麦的基因。Hereditas。2018;155:1-8。
- 42.
Werner T, Motyka V, Laucou V, Smets R, Van Onckelen H, Schmulling T.细胞分裂素缺乏转基因拟南芥植株表现出多种发育改变,表明细胞分裂素在调节茎部和根分生组织活性中的作用相反。植物学报。2003;15(11):2532-50。
- 43.
王晓明,王晓明,王晓明,等。细胞分裂素在植物发育中的作用。植物学报,2009;12(5):527-38。
- 44.
Mrizova K, Jiskrova E, Vyroubalova S, Novak O, Ohnoutkova L, posspisilova H, Frebort I, Harwood WA, Galuszka p细胞分裂素脱氢酶大麦基因(大麦芽简历。黄金承诺)从根本上影响形态和生育能力。科学通报,2013;8(11):e79029。
- 45.
Ramireddy E, Hosseini SA, Eggert K, Gillandt S, Gnad H, von Wiren N, Schmulling T.大麦根系工程:增加细胞分裂素降解产生更大的根系,增加地上部矿物质和提高耐旱性。植物生理学报,2018;17(3):1078-95。
- 46.
引用本文:高平平,肖艳华,徐峰,高晓康,曹世勋,张凤凤,王国强,桑德斯东,褚春春。细胞分裂素依赖性调控模块在水稻锌营养维持中的作用。中国生物医学工程学报,2019;22(1):559 - 561。
- 47.
邹旭,邵建伟,王强,陈培生,朱玉春,尹彩霞。超优细胞分裂素含量通过增加乙烯含量减少根分生组织大小和细胞长度来抑制水稻种子根生长。中华医学杂志,2018;19(12):1-16。
- 48.
高平平,方健,徐峰,王伟,孙晓华,褚建峰,蔡碧波,冯玉青,褚春春。细胞分裂素氧化酶/ DEHYDROGENASE4整合细胞分裂素和生长素信号控制水稻冠根形成。植物生理学报,2014,35(3):1035 - 1046。
- 49.
毛俊杰,何建明,刘琳,邓启明,姚晓峰,刘春明,乔玉玲,李鹏,明飞。OsNAC2整合生长素和细胞分裂素通路调节水稻根系发育。植物学报。2020;18(6):429 - 442。
- 50.
Nuccio ML, Paul M, Bate NJ, Cohn J, Cutler SR.耐旱作物在哪里?对二十多年来植物生物技术在作物改良方面的努力的评估。植物科学,2018;23(3):110 - 9。
- 51.
Paolacci AR, Tanzarella OA, Porceddu E, Ciaffi M.小麦RT-PCR标准化内参基因的鉴定与验证。中华医学杂志,2009;10:11 - 27。
- 52.
刘建军,刘建军,刘建军,等。细胞分裂素氧化酶/细胞分裂素脱氢酶测定方法的研究进展。中国生物医学工程学报,2002;31(1):1 - 7。
- 53.
布拉德福德MM,威廉姆斯WL。一种快速、灵敏的蛋白质测定新方法。美联储公报1976;35(3):274。
致谢
我们感谢Malgorzata Wojciechowska、Izabela Skuza和Agnieszka Glowacka出色的技术援助。
资金
本研究由国家农业与农村发展部资助,项目No. 5 PBwPR 4-1-01-4-02。资助机构在研究的设计、数据的收集、分析和解释以及撰写手稿方面没有任何作用。
作者信息
从属关系
贡献
概念化,A.N-O。和W.O.;方法论、k.s.、H.O.和W.O.;软件,M.D-B。;验证、W.O.;形式分析,k.s., m.d.b。和A.N-O。;调查,k.s., H.O.和R.W.;资源,B.L.和B.Z.;数据管理,k.s., h.o., b.l., B.Z.和R.W.; writing—original draft preparation, A.N-O.; writing—review and editing, A.N-O.; visualization, K.S. and A.N-O.; supervision, A.N-O.; project administration, A.N-O.; funding acquisition, A.N-O. All authors have read and agreed to the published version of the manuscript.
相应的作者
道德声明
伦理批准并同意参与
不适用。
发表同意书
不适用。
相互竞争的利益
作者宣称他们没有竞争利益。
额外的信息
出版商的注意
施普林格·自然对已出版的地图和机构关系中的管辖权要求保持中立。
补充信息
附加文件1表S1
.为扩增基因而设计的引物序列。表S2.的表达之间的相关性TaCKXGFMs和NAC2在生长室(A)、田间(B)和幼苗根系(C)中生长的7个DAP穗。1-非参数分析;加粗* -显著相关atp≤0.05。表S3.的表达之间的相关性TaCKXGFMs和NAC2生长室(A)和田间(B)的7个DAP穗对产量相关性状的影响。1-非参数分析;加粗* -显著相关atp≤0.05。表S4.的表达之间的相关性TaCKXGFMs和NAC2在苗期根系与苗期根重等产量相关性状具有相关性。1-非参数分析;粗体* -显著相关,p≤0.05。表S5.的表达之间的相关性TaCKXGFMs和NAC2从生长室(A)和田间(B)提取7个DAP穗,并在幼苗根中表达。1-非参数分析;粗体* -显著相关,p≤0.05。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,该协议允许以任何媒介或格式使用、共享、改编、分发和复制,只要您适当地注明原作者和来源,提供知识共享许可协议的链接,并注明是否进行了更改。本文中的图像或其他第三方材料包含在文章的知识共享许可协议中,除非在材料的署名中另有说明。如果材料未包含在文章的知识共享许可中,并且您的预期用途不被法律法规允许或超过允许的用途,您将需要直接获得版权所有者的许可。如欲查阅本许可证副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域免责声明(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非在数据的信用额度中另有说明。
关于本文
引用本文
Szala, K, Ogonowska, H, Lugowska, B。et al。不同的TaCKX基因影响在受控环境和田间条件下生长的小麦植株的产量相关性状。BMC Plant Biol20.496(2020)。https://doi.org/10.1186/s12870-020-02713-9
收到了:
接受:
发表:
关键字
- TaCKX
- TaNAC
- 小麦
- 场
- 实验室条件下
- 细胞分裂素
- 植物激素相声
- 粮食产量