摘要
背景
马尾松羊肉。是重要的造林树种,具有较高的经济、生态和药用价值。土壤酸化引起的铝(Al)毒性引起了植物的枯死病马尾松种植园。以往的研究表明外生菌根真菌可以缓解铝胁迫对植物的损伤松果体研究了铝胁迫下外生菌根真菌接种诱导的分子机制和关键基因松果体没有被探索过。在这里,我们施加Al应力60天马尾松苗接种Suillus危害(SL)和未接种的。然后,我们比较了它们的生长参数和转录组,以检测SL诱导的铝耐受性的候选基因马尾松.
结果
结果表明,接种SL使铝的耐受力增强马尾松与未接种的幼苗相比,通过提高生长性能,增强抗氧化酶活性和减少丙二醛积累。转录组测序进一步支持了这些发现,与未接种的植物(2140个基因)相比,SL接种的植物中很少有基因(51个基因)被Al转录改变。我们鉴定出三个核心基因(cox1,cox3而且Nd1),在SL接种的植株中,Al显著上调,而在未接种的植株中,Al显著下调。我们还鉴定了42个由SL接种植物在Al胁迫下特异性调控的基因,这些基因参与了广泛的生物过程,如抗氧化反应、转运蛋白、激素信号通路和植物病原体感染反应。
结论
综上所述,我们的数据表明,接种SL诱导了关键应激反应通路的启动,并触发了有效缓解铝胁迫效应的特定基因马尾松.本研究获得的候选基因资源对于提高植物耐铝性的功能表征和分子生物学研究具有重要意义。
背景
马尾松羊肉。是松树科重要的造林树种。原产于中国南方,是中国林场的优势种之一[1].马尾松是先锋种,对环境压力有很强的耐受性,在贫瘠地区和金属污染的土壤中生长良好[2,3.,4,5,6].它不仅有助于满足对木材产品日益增长的需求,而且还减轻了对天然林的压力,并大大有助于退化土壤的恢复[7,8,9,10].除了这些经济和生态价值,一些研究已经证明了马尾松树皮及针治风湿、肠寄生虫、高血压、神经衰弱、皮肤不适及癌症[11,12,13,14].
松果体物种,包括马尾松,是多种外生菌根真菌的天然宿主[15,16,17,18,19].据报道,根系中外生菌根共生的建立提高了寄主植物的生长性能和对生物和非生物胁迫的耐受性[20.,21,22].这是由于改善了养分和水分的获取、光合速率以及增强了宿主的抗氧化系统和免疫系统[23,24].在松果体,前期研究表明外生菌根真菌可提高植物生长和对干旱胁迫、盐度胁迫、低磷胁迫、重金属毒性等的耐受性。[4,6,25,26,27,28].
由土壤酸化引起的铝(Al)毒性是一个长期存在的问题,导致世界许多地区的森林枯死[29],尤其是在中国,自然和森林种植园正在减少[30.].长期空气污染和大量使用酸性肥料造成的酸雨和人为土壤酸化造成土壤养分耗竭,加速了铝等有毒元素的生物有效性3 +[31,32,33].Von Uexkuell和Mutert早在1995年就估计酸性土壤覆盖了70%以上的潜在耕地土壤[34但随着工业化和集约化农业的不断发展,这一价值可能会更高。土壤中铝含量高会抑制植物根系生长,降低养分和水分的吸收[35,36],导致植物生产力显著降低。它还会增加活性氧(ROS)水平,导致脂质过氧化和细胞死亡[37].对植物铝耐受性机制的破译已经催化了大量的研究,我们对这一主题的理解也在不断增加。例如,铝的排斥和内部解毒已在几种植物中得到证实[38,39,40]和一些相关基因,如铝活化苹果酸转运体(ALMT)和多药有毒复合挤压(MATE)已被发现[40,41,42,43,44,45].
在森林树种中,已观察到对铝毒性有一定程度的耐受,但在树种和基因型之间存在差异[46,47,48].例如,桦木属翻车机可耐受铝浓度高达3mm [49],而Liu和Liu [47]发现,最低浓度的铝毒性马尾松为0.15 mM。外生菌根在根系中建立的共生关系,除了具有固有的根系排斥铝的能力外,还可以为宿主植物抵御铝胁迫的伤害提供另一层防御力。为了支持这一观点,先前的研究表明外生菌根真菌可以缓解铝胁迫对植物的损伤松果体[50,51].然而,铝胁迫下外生菌根真菌接种诱导的分子机制和关键基因松果体没有被探索过。
在初步实验中,我们发现接种外生菌根真菌种Suillus危害(SL)促进马尾松生长,并赋予铝耐受力。因此,我们设计了本研究,以研究接种SL和未接种SL的植物在Al胁迫下的转录组,以检测SL介导的铝胁迫耐受力的候选基因马尾松.
结果
有无铝胁迫的形态生化反应真菌菌接种
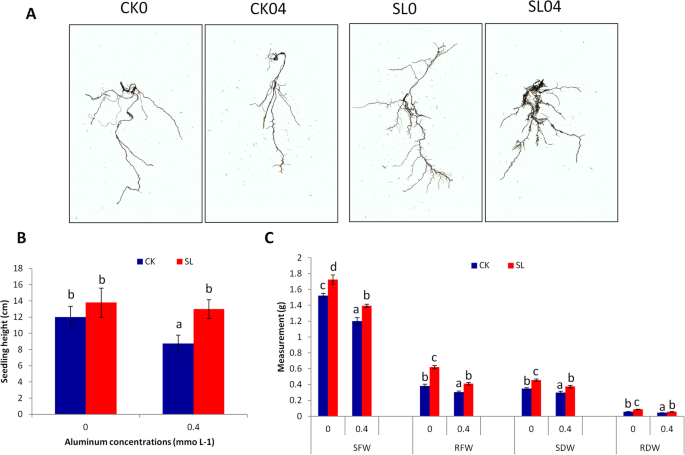
马尾松铝胁迫处理60 dSuillus危害(SL)接种或不接种(CK)。研究了几种形态生化参数。如图所示。1a,接种外生菌根真菌(SL)的幼苗根系密度高于未接种的幼苗(CK),与Al浓度无关,说明本实验接种成功。根系性状定量分析表明,Al处理降低了所有根系性状。但与对照相比,Al处理下,SL接种改善了根系表面积、平均根径和根数性状(表2)1).与对照相比,未接种Al的SL苗高略有增加,但不显著(图2)。1b).接种SL显著提高了茎鲜重(SFW)、根鲜重(RFW)、茎干重(SDW)、根干重(RDW)等性状。1c). 0.4 mmol L−1施铝后,所有形态性状均独立于接种SL而降低(图2)。1b, c),表示Al影响马尾松幼苗的生长。值得注意的是,接种SL的植株所有形态性状均显著高于对照,表明SL改善了植株马尾松对Al应力的耐受性(图;1b, c)。
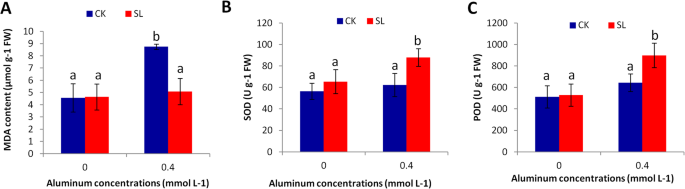
在逆境条件下,植物积累了过量的活性氧(ROS)。丙二醛(MDA)含量通过增加ROS的生成与脂质过氧化有关[52].MDA水平高表明应激损伤水平高。我们测量了四个处理针叶样品中的MDA含量(图2)。2a).无Al胁迫下,CK和SL接种植株的MDA水平相似。在Al胁迫下,CK和SL接种株MDA含量均有所增加,但CK的MDA含量显著高于SL接种株。这表明,在Al胁迫下,CK植株遭受了氧化损伤,而接种SL有助于保持MDA水平在正常范围内。
为了有效地对抗ROS在植物体内的过度积累,强烈激活抗氧化酶如超氧化物歧化酶(SOD)和过氧化物酶(POD)是必不可少的[53].在本研究中,我们观察到接种CK和SL的植株在Al胁迫下SOD和POD活性均有所增加。然而,与CK相比,SL接种的植物SOD和POD活性显著升高(图2)。2b, c).总之,我们的结果表明,接种SL提高了铝胁迫耐受性马尾松通过增强抗氧化酶的活性。
转录组测序和组装的描述
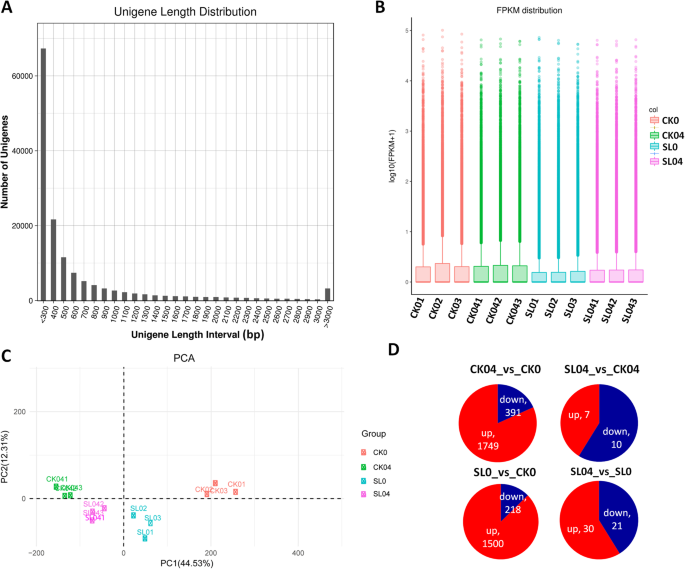
为了深入了解SL接种诱导铝耐应力的分子基础马尾松,我们对四种处理的针头样本的转录组进行了测序。每个处理3个重复,共对12个样品进行测序,平均每个样品产生54,226,624个原始reads(表2).清洗后,我们获得了89 Gb的数据,Q30质量评分高于93%,错误率低于0.03。使用Trinity软件重新组装干净的数据作为参考基因集,得到145434个unigenes,长度90173863 bp,平均长度620 bp, N50长度1022 bp。单基因长度分布如图所示。3.a. unigenes在NR、SwissProt、PFAM、GO和KO等5个不同的数据库中进行了标注,其中67%的unigenes至少在一个数据库中进行了标注(表2)3.).
以FPKM (fragments per kilobase of exon per million fragments mapped, FPKM)估算基因表达量,FPKM值> 1作为判断表达基因的阈值(图2)。3.b).利用FPKM数据,我们进行主成分分析(PCA)来检验四个处理及其重复样本的聚类模式。如图所示。3.c、PC1和PC2共同贡献了全球变异的66%以上。PC1清晰地将Al处理样品和未处理样品区分开。通过PC2,我们可以观察到SL接种样品与未接种样品之间的分离。此外,发现每种处理的重复紧密聚集在一起,表明转录组测序的质量足够好,可以进行进一步分析。
差异表达基因
为了确定差异表达基因(DEG),我们使用以下筛选标准交叉比较了治疗之间的基因计数:|log2倍变化|≥2 [54],错误发现率(FDR)修正值设置为P< 0.05。CK04_vs_CK0、SL0_vs_CK0、SL04_vs_CK04和SL04_vs_SL0共检测到2140个、1718个、17个和51个deg(图。3.d).基因本体富集分析显示,Al和SL处理影响了不同的生物途径(代谢过程、光合作用、氧化还原过程、核苷酸结合等)(图S1).京都基因和基因组百科全书(Kyoto Encyclopedia of Genes and Genomes)对DEGs的富集分析表明,磷phyrin和叶绿素代谢、玉米素生物合成是受Al和SL处理影响最富集的途径(图)S2).比较CK04_vs_CK0提供了未接种SL的Al胁迫响应中的DEGs, SL04_vs_SL0提供了接种SL的Al胁迫响应中的DEGs。两组差异显著(2140 vs 51),表明与未接种SL相比,Al在SL接种条件下转录改变的基因较少。这证实了SL接种对铝胁迫的耐受性马尾松.
核心保守基因受Al胁迫的调控,不受SL接种的影响
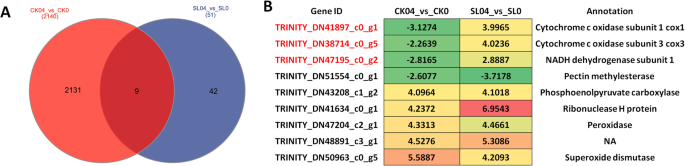
我们比较了未接种SL的Al诱导的DEGs (CK04_vs_CK0)和接种SL的DEGs (SL04_vs_SL0),以鉴定受Al胁迫改变的核心调控DEGs。如图所示。4a,检测到9个核心DEGs,其中6个DEGs (TRINITY_DN51554_c0_g1,TRINITY_DN43208_c1_g2,TRINITY_DN41634_c0_g1,TRINITY_DN47204_c2_g1,TRINITY_DN48891_c3_g1,TRINITY_DN50963_c0_g5)在CK04_vs_CK0和SL04_vs_SL0之间显示出类似的调控模式。4b),表明这些基因对Al反应至关重要马尾松。的基因TRINITY_DN48891_c3_g1没有功能注释,这意味着它可能是一个al响应基因特异性马尾松.相比之下,我们发现了其他三个基因(TRINITY_DN41897_c0_g1(cox1),TRINITY_DN38714_c0_g5(cox3),TRINITY_DN47195_c0_g2(Nd1)),在CK04_vs_CK0和SL04_vs_SL0之间表现出相反的调控模式(图。4b).这些基因在SL04_vs_SL0上的强烈上调可能表明了一种耐受性机制,而对照植物在Al胁迫(CK04_vs_CK0)下未能触发。
SL接种诱导铝胁迫耐受性的候选基因
自马尾松SL04_vs_SL0中的特异调控基因被认为是铝胁迫耐受性的候选基因。在SL04_vs_SL0中共鉴定出42个DEGs(图。4一个,表格4),但在Al胁迫下,未接种的植株(CK04_vs_CK0)没有显著变化。大多数检测到的基因参与抗氧化反应,激素信号,更重要的是植物病原体感染反应。这表明,在暴露于Al胁迫之前,SL接种的植物具有增强的免疫系统和清除ROS的机制,这可能有助于迅速应对Al胁迫。此外,还检测到几个未注释的deg,为未来的功能表征提供了有趣的基因资源。
所选基因的qRT-PCR验证
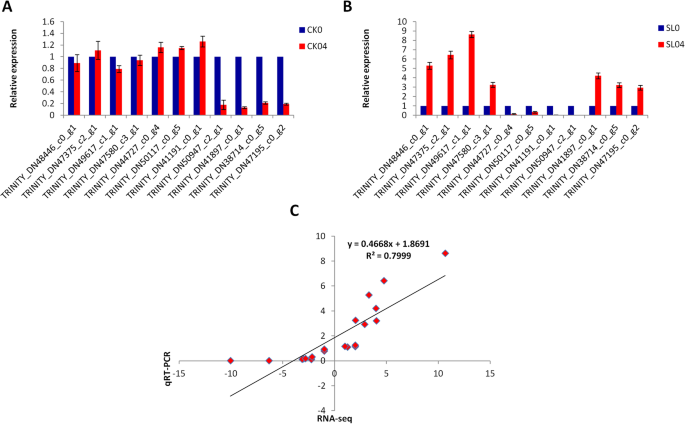
我们选择了11个与铝胁迫反应相关的候选基因马尾松用qRT-PCR验证其表达水平。的基因Actin2作为表达归一化的内控。qRT-PCR结果显示,铝胁迫显著改变了所有基因的表达水平。5).此外,qRT-PCR结果与RNA-seq报告强相关(R2= 0.8),说明本研究中RNA-seq报告的解释是可靠的。
讨论
Suillus危害孕育使铝具有耐应力能力马尾松幼苗
通过应用铝(Al)浓度高于0.1 mM, Liu和Liu [47发现马尾松增长率显著降低。在这项研究中,我们观察到一个显著的抑制马尾松在0.4 mM Al下的生长(图;1;表格1).由于中国南方森林土壤中铝含量较高(> 1 mM), [30.,55,很明显马尾松在野外遭受铝的毒害。各种外生菌根真菌已被证明可以改善松果体生长性能和对各种生物和非生物胁迫的耐受性,包括铝毒性[4,6,25,26,27,28].Suillus危害(SL)是一种外生菌根真菌,广泛发现于松果体种植园(56,57].据报道,SL可在高盐度、缺水、高Mg、Zn、Cd、Pb、Ni、Al等土壤条件下生长[6,50,51,56,58,59].特别是,大量研究表明SL是一种耐铝真菌[60,61,62,63],可促进植物的再生和种植松果体Al污染地区的幼苗。本研究的结果完全证实了先前的发现,因为我们的SL接种马尾松植物对Al胁迫的耐受性良好(图;1).山本等人。[37]揭示了大量的铝会导致细胞中过量的活性氧(ROS)积累,最终导致细胞死亡。在SL接种的植物中,弱丙二醛含量与强抗氧化酶活性相结合(图2)。2)表明SL限制了ROS相关的损伤马尾松.在Al胁迫下,与未接种的植物相比,接种SL的植物中发现的deg数量显著降低,进一步证实了这一点(图2)。3.d) (64,65].在今后的研究中,阐明SL接种诱导铝耐受性的生理机制具有重要意义马尾松.例如,通过测定有SL接种和没有SL接种Al处理前后各种植物组织中的Al含量,我们将能够了解SL是如何影响Al吸收的马尾松.
提高水稻耐铝性的新基因资源马尾松
铝反应的机制,包括减少铝的吸收和吸收铝的排毒在植物中已经得到很好的研究[66].已鉴定出若干具有不同生物学功能的相关基因,如应激反应、膜转运蛋白、有机酸代谢、细胞壁修饰、信号、激素、转录因子等[45,66,67,68,69].在本研究中,我们鉴定了9个在响应铝胁迫中发挥不同功能的核心基因马尾松独立于SL接种(图;4).基因的上调TRINITY_DN47204_c2_g1(SOD)和TRINITY_DN50963_c0_g5(POD)实验表明,抗氧化酶的激活是铝胁迫的基本反应马尾松.根系分泌柠檬酸、苹果酸和草酸等有机酸可解毒土壤铝[70].基因的强烈上调TRINITY_DN43208_c1_g2磷酸烯醇丙酮酸羧化酶(phosphoenolpyruvate carboxylase)参与草酸盐代谢,表明该机制是保守的马尾松正如在其他植物物种中所证明的那样[71,72].我们注意到果胶甲基酯酶基因(PME,TRINITY_DN51554_c0_g1),已知PME与细胞壁结构有关,高水平的PME与高水平的Al吸附相关。因此,马尾松倾向于通过抑制Al的表达来减少Al的吸附中外职业[72,73].三个核心铝反应基因(细胞色素c氧化酶(考克斯)1,cox3和NADH脱氢酶亚基1 (Nad1))与线粒体活性相关,在接种SL和未接种SL的植物中表现出相反的模式。有充分证据表明,线粒体活动的功能障碍严重影响植物的适应性[74,75]和山本等人。[76]证明铝胁迫会破坏烟草和豌豆的线粒体功能,引起ROS的大量积累。在本研究中,所有这些基因在接种SL的植物中都被上调,而在未接种的植物中则被强烈下调。我们推测,铝胁迫诱导的线粒体活性关闭可能导致ROS大量积累,进而在未接种的植物中观察到生长抑制。我们建议这三个基因作为筛选铝耐受性的标记基因,有待进一步验证松果体基因型。
当与耐受性外生菌根真菌共生时,植物对铝的反应得到改善,因为真菌可以将有毒的铝固定在菌根根部和周围的土壤环境中,改善植物的矿物质营养,以保证正常生长[77].然而,外生菌根真菌介导的响应寄主植物铝胁迫的基因研究很少[23].在这项研究中,我们鉴定了42个SL接种植物所特有的可能具有铝胁迫耐受性的候选基因(表2)4).这些基因大多参与了众所周知的Al反应途径,如抗氧化反应、激素信号、转运蛋白和植物病原体感染反应[66].例如,过氧化物酶、谷胱甘肽S转移酶、多药和毒性复合挤压、吲哚-3-乙酸、超氧化物歧化酶、蛋白磷酸酶2C、果胶甲基酯酶已被报道调节植物的Al反应[45,54,72,73,78,79].本研究的一个主要发现是参与防御和植物病原体感染途径的大量基因(表2)4).与我们的结果相似,Luo等人。[23]报道了盐胁迫下外生菌根真菌诱导杨树大量防御和病原感染代谢产物和基因。他们得出结论,外生菌根真菌通过刺激根系增强耐盐性来增强宿主的免疫系统。我们推测在接种的SL中也建立了类似的机制马尾松该方法可以帮助幼苗迅速有效地对抗铝胁迫效应。
结论
接种的马尾松外生菌根真菌Suillus危害(SL)促进幼苗生长,赋予铝(Al)耐受力。通过下调关键基因如cox1,cox2而且Nad1可能是Al抑制非SL接种幼苗生长的关键因素。因此,在铝胁迫下激活这些基因的策略马尾松应该进一步调查。我们还鉴定了几个候选基因,包括一些未注释的基因,这些基因可能在铝胁迫耐受性中发挥重要作用。这些基因资源的功能表征将为工程研究提供必要的工具松果体对外生菌根真菌依赖性较小的植物。
方法
植物材料、外生菌根真菌及胁迫处理
马尾松羊肉。本研究以植物为材料。种子于2018年11月从种植在中国贵州省都匀市的一棵优质种源树(20年)上收集。外生菌根真菌种类Suillus危害(SL),被认为是一种侵略性的殖民者马尾松[56],用于植物接种。真菌的出果部分从马尾松中国贵州省贵阳市龙里县龙里林场(N26°28′01″,E107°00′37″)纯人工林。植物材料和真菌的正式鉴定由本文通讯作者丁桂杰教授负责。植物材料可在国家基地马尾松(N26°169′~ 26°170′,E107°623′~ 107°624′),中国贵阳贵州植物园保存有凭证标本,登记号:xgnk-2003-a12。收集这些样品不需要许可。接种体制备和植物接种详见Yu等人的著作[6].2019年2月至7月育苗,6月龄苗接种美国的危害以未接种的6个月龄苗为对照。
实验在光强为600 ~ 800 μmol m的温室中进行−2年代−1,相对湿度55%,光周期16h,光照25°C,黑暗18°C。将石英砂漂洗后,在高压釜(压力0.14 MPa, 121℃)中灭菌2 h,然后装入塑料罐(21 cm × 15 cm × 18.5 cm)。选择均匀的幼苗移栽到花盆中。在正常生长条件下,经常注入1/2霍格兰营养液,培养2周。然后,压力治疗开始了。设4个处理,分别为2个SL0 (0 mmol L−1艾尔3 +), SL04 (0.4 mmol L .−1艾尔3 +)和2个非接种处理CK0 (0 mmol L .−1艾尔3 +), CK04 (0.4 mmol L .−1艾尔3 +)以下对刘及刘的描述[47].对于铝(Al)胁迫,以无水AlCl的形式加入到总Hoagland营养液中3.pH值调整为4.1±0.1 [47]用0.1 M稀释的HCl或NaOH来维持酸性条件。为了维持Al活性,0.5 mmol L−1CaCl2同时加入营养液中,避免Al离子与溶液离子相互作用。治疗液每周倒一次。每个处理重复5次,每个处理15盆,每盆3株。在Al胁迫诱导后第60天采集植株,测定4组植株的生长和生理参数。此外,我们在每个处理的不同重复中随机选择3株植物,收集针状样本进行转录组分析。样品在液氮中冷冻,并保存在−80°C下供进一步使用。
形态参数测量
每个处理从5个重复中选择10株(每个重复2株),轻轻摇动去除根表面的石英砂,并用自来水仔细清洗。根数量性状通过桌面扫描仪(EPSON perfect V800 Photo, CA, USA)使用WinRHIZO Pro软件(Regent Instruments Inc., Quebec, Canada)的扫描图像进行测量。用游标卡尺测量苗高;用电天平分别记录根、梢鲜重(型号:ML 204;梅特勒托莱多公司,Greifensee,瑞士;测量精度0.0001 g)。样品在80°C干燥至恒重,记录干重。
SOD、POD、可溶性糖和MDA的测定
根据试剂盒(COMIN,克明生物技术有限公司,中国苏州)提供的说明,分别在5个重复中测定了4个处理针叶样品中的丙二醛(MDA)含量以及超氧化物歧化酶(SOD)和过氧化物酶(POD)活性。MDA含量以μmol g表示−1弗兰克-威廉姆斯。SOD和POD活性以每克鲜重(U g−1弗兰克-威廉姆斯)。一个单位(U)的SOD活性定义为黄嘌呤氧化酶偶联反应体系抑制50%时的SOD活性,一个单位(U)的POD活性定义为A470 / mL反应体系中0.01的变化。
统计分析
所有数据采用Minitab18软件进行统计分析(P< 0。05).采用基于方差分析(ANOVA)的Tukey检验对数据进行分析。
RNA提取、cDNA文库构建及转录组测序
实验遵循上海应用蛋白质技术有限公司(APT,中国上海)的标准程序进行。简单地说,用RNAprep Pure Plant Kit (TIANGEN, Beijing, China)从12个针样中提取总rna。样品浓度由NanoDrop 2000C分光光度计(赛默飞世尔科学公司)定量。为了获得高质量的RNA,样品用1%琼脂糖凝胶电泳检测RNA和DNA污染的完整性。为了准确检测RNA完整性,使用Agilent 2100 Bioanalyzer。RNA定量使用Qubit RNA检测试剂盒在Qubit 2.0荧光仪(Life Technologies, Carlsbad, CA, USA)中进行。接下来,使用安捷伦生物分析仪2100系统(安捷伦科技,圣克拉拉,加州,美国)的RNA纳米6000检测试剂盒检查RNA完整性。为了合成cDNA,每个样本用DNase I处理1 μg RNA,去除基因组DNA,然后作为反转录模板(quantitative reverse transcription Kit, Qiagen, China)。
我们以短段RNA为模板,加入片段缓冲液,将其裂解成短段。测序文库使用NEB Next Ultra RNA文库准备试剂盒按照制造商的说明创建。索引代码被添加到每个样本中。简单地说,用聚t寡聚磁珠从3个重复的3 μg总RNA中纯化mRNA,然后分解成短片段合成第一链cDNA。随后用DNA聚合酶I和RNase h合成第二链cDNA,用Phusion高保真DNA聚合酶进行PCR,使用通用PCR引物和指数(×)引物。最终构建了12个插入大小为300 bp的成对端cDNA文库进行转录组测序,并在上海应用蛋白质技术有限公司(APT,上海,中国)的Illumina HiSeq 4000平台(Illumina Inc., San Diego, USA)上进行测序。
从头组装,功能注释,表达式分析
使用FastQC工具,在修剪接头序列,去除低质量(含有> 50%碱基,Phred质量评分< 20)和未知核苷酸(超过1%的不明确残基N)的reads (http://www.bioinformatics.babraham.ac.uk/projects/fastqc/).对GC含量分布进行分析。转录组组装使用Trinity r20140717 [80],并采用成对端法。对于分层聚类,使用Corset (https://code.google.com/p/corset-project/).以Corset层次结构为unigene进行聚类,得到最长的聚类序列用于后续分析。在KEGG等数据库中使用KAAS (E-value < 1.0 × 10−10), GO使用Blast2GOv2.5 (e值< 1.0 × 10−6), PFAM采用HMMER3.0 (E-value < 0.01), Swissprot采用BLAST 2.6.0+ (E-value < 1.0 × 10−5), NR采用BLAST 2.6.0+ (e值< 1.0 × 10−5).
测序结果与unigene文库使用Bowtie2进行比较[81],结合RSEM估计表达水平[82].根据外显子每百万片段映射(FPKM)法测定基因表达水平。主成分分析在R v2.3.0中进行。读取计数归一化,EdgeR Bioconductor包[83],以|log2倍变化|≥2,错误发现率(FDR)校正设置为时,测定组间差异表达基因(DEGs)P< 0.05 [54].采用基于wallenius非中心超几何分布的topGO方法进行氧化石墨烯富集分析P< 0.05 [84].利用KOBAS2.0对DEGs进行KEGG通路富集分析[85].采用了FDR修正(P< 0.05)以减少富集GO项和KEGG通路的假阳性预测。
基因表达定量PCR分析
为了确认RNA-seq获得的基因表达水平,如前所述,对从针样中提取的RNA进行qRT-PCR分析[86].qRT-PCR在Roche Lightcyler®480仪器上进行,使用SYBR Green Master Mix (Vazyme, Vazyme生物技术有限公司,中国南京),遵循制造商的协议。的基因肌动蛋白2作为内部控制。所选基因的特异性引物序列用PrimerPremier 5设计,见表S1.
数据和材料的可用性
支持本文结论的数据集可在NCBI生物项目存储库中获得,登录号:PRJNA636599。这些数据将在这篇手稿发表时公布。
缩写
- 艾尔:
-
铝
- SL:
-
Suillus危害
- ROS:
-
活性氧
- MDA:
-
丙二醛
- SOD:
-
超氧化物歧化酶
- 圆荚体:
-
过氧化物酶
- FPKM:
-
每千碱基的片段数,每百万片段数
- 主成分分析:
-
主成分分析
- 度:
-
差异表达基因
- 罗斯福:
-
错误发现率
参考文献
- 1.
罗永华,孙德杰,林建勇,郭文峰,卢丽华,温永刚。近自然管理对马尾松人工林自然更新和物种多样性的影响。生态学报,2013;33(19):6154-62。
- 2.
窦欣,邓强,李敏,王伟,张强,程霞马尾松改变了华南侵蚀土壤有机碳氮动态。生态学报,2013;
- 3.
王勇,丁刚。菌根的生理反应马尾松幼苗对干旱胁迫及抗旱性评价。应用生态学报,2013;24:639-45。
- 4.
张涛,文霞,丁国强,马尾松外生菌根通过表达磷转运体基因增强对低磷的耐受性(马尾松).物理植物学报,101(2017)。https://doi.org/10.1007/s11738-017-2392-y.
- 5.
王霞,陆琳,邢辉,曾杰,谢颖,蔡东,刘霞,张霞马尾松不同林分发育阶段的人工林。热带生态学报,2018;11:1-16。
- 6.
余鹏,孙勇,黄志,朱峰,孙勇,姜丽。外生菌根真菌对重金属在土壤中转运的影响马尾松矿山尾矿区根际土壤细菌群落。J危险物质。2020;381:121203。
- 7.
蒋震,张世银。2003。中国人工林的可持续木材供应和发展。http://www.fao.org/3/XII/0955-B4.htm,于2020年5月21日访问。
- 8.
杨华,王松,张军,范斌,张伟马尾松中国南方种植园:不同管理实践的模拟。食品农业环境学报,2011;9:689-93。
- 9.
邓霞,张磊,雷鹏,向伟,闫伟。华南马尾松树干轴向木材基本密度随树龄和社会等级的变化。森林科学学报,2014;21(4):516 - 516。https://doi.org/10.1007/s13595-013-0356-y.hal-01101774施普林格Verlag/EDP Sciences。
- 10.
张鹏,何勇,冯勇,De La Torre R.,贾宏,唐军,Cubbage F.华南地区人工林潜在投资收益分析。50岁的新人,943 - 968(2019)。https://doi.org/10.1007/s11056-019-09708-x.
- 11.
崔勇,谢辉,王杰马尾松树皮中提取。Phytother Res. 2005; 19:34-8。https://doi.org/10.1002/ptr.1619.
- 12.
马红,赖峰,谢辉,王娟,王慧。马尾松树皮提取物Bcl-2家族成员参与诱导HeLa细胞凋亡。植物科学,2008;22:1472-6。
- 13.
JA公爵,Ayensu ES。中国药用植物。1985;2(705 S):1300。Strichzeichnungen:参考出版物。公司。Algonac。密歇根。ISBN 0量917266 20量4。
- 14.
吴东,李松,杨东,崔勇马尾松树皮提取物对HeLa细胞粘附和迁移能力的影响。Fitoterapia。2011;82:1202-5。
- 15.
Rincón, A., Álvarez, I. & Pera, J.植物外生菌根真菌松果体pineaL.在西班牙东北部。菌根8,271 - 276(1999)。https://doi.org/10.1007/s005720050245.
- 16.
Rincón A, Alvarez IF, Pera J.容器接种松果体pineaL具有七种外生菌根真菌的幼苗。菌根。2001;11:265 - 71。
- 17.
Parladé J,佩拉J,阿尔瓦雷斯IF。用5种外生菌根真菌的孢子接种袋装孟子杉和松幼苗。菌根。1996;6:237-45。
- 18.
Duñabeitia MK, Hormilla S, Garcia-Plazaola JI, Txarterina K, Arteche U, Becerril JM。三种真菌对环境因子的差异响应及其在红松菌根化中的作用菌根。2004;14:11-8。
- 19.
鲁楠,于敏,崔敏,罗震,冯勇,曹松,孙勇,李勇。不同外生菌根真菌接种对黄曲霉生长的影响油松温室条件下的幼苗。森林。2016;7:316。
- 20.
外生菌根共生在森林抗水分胁迫中的作用。农业科学,2000;29:63-9。
- 21.
Kohler J, Hernández JA, Caravaca F, Roldán a .诱导抗氧化酶参与PGPR对AM真菌在提高生菜对严重盐胁迫的耐受性方面的更大有效性。环境科学学报。2009;26(2):344 - 344。
- 22.
Lehto T, Zwiazek JJ。树木外生菌根与水分关系研究进展。菌根。2011;21:71 - 90。
- 23.
罗喆,杨z D,蒋旭,Göbel C, Wildhagen H, Tan Y, Rennenberg H, Feussner I, Polle A.外生菌根对胁迫耐受性的影响:从代谢和转录谱分析到胁迫预发的重编程。植物科学进展。2009;https://doi.org/10.1104/pp.109.143735.
- 24.
郝志强,谢伟,陈斌(2019)。丛枝菌根共生影响植物对病毒感染和积累的免疫。病毒,11(6),534。https://doi.org/https://doi.org/10.3390/v11060534.
- 25.
朱军,李芳,徐明,康宏,吴霞。外生菌根真菌在缓解中国北方半干旱沙地松树退化中的作用:试验方法。Ann For Sci 65,304(2008)。https://doi.org/10.1051/forest:2008007.
- 26.
王杰,黄燕,蒋晓霞。外生菌根真菌对植物必需元素吸收和平衡的影响油松盐渍土壤中的幼苗。土壤圈。2011;21(3):400 - 6。
- 27.
刘志刚,王志刚,王志刚,王志刚(2012)干旱胁迫对植物生长的响应抗旱性单种和多种接种外生菌根真菌的幼苗。PLoS One 7(4): e35275。https://doi.org/10.1371/journal.pone.0035275.
- 28.
尹东,孙海富,宋锐,祁军,邓晓霞,登俊。一种外生菌根真菌对黄曲霉生长和生理的影响抗旱性盐碱胁迫下无功沙栎幼苗的研究J For Res 2020,31,781 - 788。https://doi.org/10.1007/s11676-019-01007-7.
- 29.
Ulrich B(1989)。酸性降水对欧洲森林生态系统的影响。见:阿德里亚诺等人(编)。酸性降水,生物和生态效应。纽约:施普林格,189-272。
- 30.
张健,吕震,邵生,李峰,杨松,宋伟,李伟,李松。酸沉积诱导铝毒性对贵州龙里松林生态系统的影响。地理科学,2016;26:495-507。https://doi.org/10.1007/s11769-015-0763-0.
- 31.
欧阳明。酸性降水对欧洲森林生态系统的影响。进:阿德里亚诺DC,约翰逊AH,编辑。《酸性沉淀》第2卷。柏林:Spring-Verlay;1989.p . 189 - 272。
- 32.
土壤酸度手册。纽约:Marcel Dekker Inc;2003.p。496。
- 33.
李伟,Johnson CE。美国东北部酸性森林土壤中pH值、铝溶解度和铝络合与有机质的关系。Geoderma。2016;271:234-42。
- 34.
冯uexkuell HR, Mutert E.酸性土壤的全球范围、发展和经济影响。植物土壤。1995;171:1-15。
- 35.
Ryan PR, DiTomaso JM, Kochian LV。根的铝毒性:根冠的空间敏感性和作用的研究。中国生物医学工程学报,1993;44:437-46。https://doi.org/10.1093/jxb/44.2.437.
- 36.
Kochian LV, Pineros MA, Hoekenga OA。植物抗铝和铝毒性的生理学、遗传学和分子生物学。植物学报,2005;
- 37.
Yamamoto Y, Kobayashi Y, Matsumoto H.脂质过氧化是铝引发豌豆根伸长抑制的早期症状,但不是主要原因。植物科学进展。2001;
- 38.
Kochian LV, Hoekenga OA, Piñeros MA。农作物如何耐受酸性土壤?耐铝和磷效率的机理。植物生物学,2004;55:459-93。
- 39.
摩根富林明。高等植物铝毒性综合征与耐铝多样性。中国生物医学工程学报,2007;26(2):344 - 344。
- 40.
Brunner, I., & Sperisen, C.(2013)。木本植物的铝排斥性和耐铝性。前沿植物科学,4,172。https://doi.org/10.3389/fpls.2013.00172.
- 41.
佐佐木T,山本Y, Ezaki B, Katsuhara M, Ahn SJ, Ryan PR,等。一种小麦基因编码铝活化苹果酸盐转运体。植物学报2004;37:645-53。https://doi.org/10.1111/j.1365-313X.2003.01991.x.
- 42.
Hoekenga OA, Maron LG, Piñeros MA, Cançado GM, Shaff J, Kobayashi Y,等。AtALMT1该基因编码一种苹果酸转运蛋白,被鉴定为对铝耐受性至关重要的几个基因之一拟南芥.美国国家科学研究院。2006; 103:9738-43。https://doi.org/10.1073/pnas.0602868103.
- 43.
古川J,山治N,王华,三谷N,村田Y,佐藤K,等。大麦中铝活化的柠檬酸盐转运体。植物物理学报。2007;48:1081-91。https://doi.org/10.1093/pcp/pcm091.
- 44.
Magalhaes JV,刘娟,Guimarães CT, Lana UGP, Alves VMC,王玉华,等。多药毒性复合挤压(MATE)家族中的一个基因赋予高粱耐铝性。Nat Genet, 2007; 39:1156-61。https://doi.org/10.1038/ng2074.
- 45.
边敏,周敏,孙东,李成。植物耐酸性土壤机理的分子生物学研究。2013; 1:91-104。
- 46.
schedle M, Thornton FC, Raynal DJ, Tepper HB。树木幼苗对铝的反应。树木物理。1989;5:337-56。
- 47.
刘荣,刘华。酸性和铝对植物生长的影响马尾松幼苗。机械学报,1995;37(2):154-8。
- 48.
Grisel, N., Zoller, S., Künzli-Gontarczyk, M., Lampart, T., Münsterkötter, M., Brunner, I., Bovet, L., Métraux, j.p ., & Sperisen, C.(2010)。白杨根系对铝胁迫的转录组响应(杨树tremula).BMC植物生物学,10,185。https://doi.org/10.1186/1471-2229-10-185.
- 49.
Göransson A, Eldhuset TD。铝对大豆根系生长和养分吸收的影响桦木属翻车机幼苗。物理学报。1987;69:193-9。
- 50.
张志刚,王志刚,王志刚,等。铝对体外培养的影响松果体caribaea菌根。植物学报。1990;24(3):344 - 344。https://doi.org/10.1007/BF00010933.
- 51.
Ahonen-Jonnarth, U. Göransson, A. Finlay, R. D.(2003)。高铝处理自然基质中外生菌根樟子松幼苗的生长和养分吸收树物理学报,23(3),157-167。https://doi.org/10.1093/treephys/23.3.157.
- 52.
Sheoran S, Thakur V, Narwal S, Turan R, Mamrutha HM, Singh V, Tiwari V, Sharma I.小麦抗氧化酶活性和表达谱及其生理变化(小麦L.)干旱。中国生物医学工程学报。2015;29(6):344 - 344。
- 53.
Foyer CH, Noctor G.氧化还原稳态和抗氧化信号:应激感知和生理反应之间的代谢界面。植物学报。2005;17(7):1866-75。
- 54.
陈红,吕超,姜红,彭娟。铝积累种的耐铝途径绣球花macrophylla以及标记识别。科学通报。2015;10(12):e0144927。https://doi.org/10.1371/journal.pone.0144927.
- 55.
郭俊,David Vogt R,张旭,张勇,Seip HM,肖军,唐慧。雷公山地区酸性森林土壤铝的动员作用:室内与野外研究。环境污染。2006;51:21 1 - 8。
- 56.
奈良,黄,J。K。,丽安,C,宗庆后,K,彭,K,天雪,年代,&沈z(2012)。与马尾松有关的外生菌根真菌群落(马尾松在中国南部的铅锌矿遗址。菌根杂志22(8),589-602。https://doi.org/10.1007/s00572-012-0436-0.
- 57.
海沃德,J.,霍顿,T. R.,保查德,A., & Nuñnez, m.a.(2015)。一个单一的外生菌根真菌物种可以使松树入侵。生态学报,39(5),457 - 457。https://doi.org/10.1890/14-1100.1.
- 58.
Colpaert, j.v., Vandenkoornhuyse, P., Adriaensen, K.和Vangronsveld, J.(2000),外生菌根担子菌的遗传变异和重金属耐受性Suillus危害.New Phytol 147: 367-379。https://doi.org/10.1046/j.1469-8137.2000.00694.x.
- 59.
黄娟,韩强,李娟(2018)。锰矿荒地马尾松外生菌根真菌的土壤繁殖库。科学通报,28 (6),e0198628。https://doi.org/https://doi.org/10.1371/journal.pone.0198628.
- 60.
汤普森GW,梅德韦RJ。铝和锰对外生菌根真菌生长的影响。应用环境微生物学。1984年9月48(3):556-60。
- 61.
黄海燕,李志强,李志强,等。黄海燕的种内铝反应。,一种苏格兰松树的外生菌根共生体。环境科学学报,1995;43(4):344 - 344。https://doi.org/10.5586/asbp.1995.014.
- 62.
李华,黄建国,袁磊。铝和锰对外生菌根真菌生长、养分吸收和外排的影响。环境科学,2013;34(1):315-20。
- 63.
王明明,袁林,黄建刚,周泽峰。四种外生菌根真菌对Al3+的吸收和同化。环境科学,2015;36(9):3479-85。https://doi.org/10.13227/j.hjkx.2015.09.045.
- 64.
D L。王,李,张,Y。,高,Y。,,,,X。,&张X(2016)。耐涝和敏感芝麻基因型揭示了涝渍胁迫响应模式。科学通报,11(3),e0149912。https://doi.org/10.1371/journal.pone.0149912.
- 65.
Dossa、K。李,D, L,郑,X。,,,,,,X。,,R, Fonceka, D,迪乌夫,D,廖,B。,西塞,N, &张X(2017)。转录组、生化和生理解剖研究揭示了两种不同芝麻基因型对干旱胁迫的反应。科学代表,7(1),8755。https://doi.org/10.1038/s41598-017-09397-6.
- 66.
Bojórquez-Quintal, E, Escalante-Magaña, C., Echevarría-Machado, I., & Martínez-Estévez, M.(2017)。铝,酸性土壤中高等植物的朋友或敌人。前沿植物科学,8,1767。https://doi.org/10.3389/fpls.2017.01767.
- 67.
郭鹏,齐亚平,黄伟林,等。两种耐铝柑桔叶片中铝反应基因的RNA-Seq分析及相关生理反应。生态毒理学杂志2018;158:213-22。https://doi.org/10.1016/j.ecoenv.2018.04.038.
- 68.
郭鹏,齐亚平,蔡宜涛,杨泰,杨丽林,黄志荣,陈立林。铝对两种不同铝耐受性柑橘光合作用、活性氧和甲基乙二醛解毒的影响。树物理学报,2018;38(10):1548-65。https://doi.org/10.1093/treephys/tpy035.
- 69.
郭萍,齐玉萍,杨丽婷,赖乃文,叶霞,杨颖,陈丽生。通过RNA-Seq分析揭示了两种不同耐铝柑橘品种根系对铝处理的适应性反应。植物科学学报,2017;8:433。https://doi.org/10.3389/fpls.2017.00330.
- 70.
郑世杰,马建峰,松本宏。荞麦的高铝抗性。一、al诱导草酸从根尖特异性分泌。植物科学学报,1998;17(2):344 - 344。
- 71.
杨晓明,杨晓明,杨晓明,杨晓明。转磷酸烯醇丙酮酸羧化酶水稻耐铝性的研究。植物营养学报,2009;32(1):84-96。https://doi.org/10.1080/01904160802531035.
- 72.
徐丽敏,刘超,崔保民,王楠,赵忠,周丽妮,黄克峰,丁建忠,杜海明,姜伟,张淑珍。玉米对铝胁迫的转录组反应。综合农业学报,2018;17(9):1946-58。
- 73.
李国强,李国强。果胶甲基酯酶调节玉米和茄对铝的敏感性。植物学报。2000;109:419-27。
- 74.
曼西拉,N.,拉卡,S.,格拉,D. E.,冈萨雷斯,D. H., &韦尔琛,E.(2018)。线粒体复合体IV的复杂性:植物细胞色素c氧化酶生物发生的更新。中华分子生物学杂志,19(3),662。https://doi.org/10.3390/ijms19030662.
- 75.
弗洛姆,S.,森克勒,J.,尤贝尔,H., Peterhänsel, C., &布劳恩,H. P.(2016)。没有复合体I的生命:缺乏线粒体NADH脱氢酶复合体的拟南芥突变体的蛋白质组分析。中国机械工程,29(4),489 - 497。https://doi.org/10.1093/jxb/erw165.
- 76.
Yamamoto Y, Kobayashi Y, Devi SR, Rikiishi S, Matsumoto H.铝毒性与植物细胞线粒体功能障碍和活性氧的产生有关。植物科学进展。2002;28(1):63-72。
- 77.
罗志斌,吴春春,张超,李华,李卡乌,波乐a。外生菌根在寄主植物耐重金属胁迫中的作用。环境科学学报。2014;38(4):344 - 344。
- 78.
王晓明,王志强,王晓明,等。铝胁迫对水稻根系转录组的影响拟南芥.Mol Gen Genomics, 2008; 279:339-57。
- 79.
刘志刚,刘志刚,王志刚,王志刚。酸性土壤对玉米根系生长的影响。BMC植物生物学。2010;10:196。
- 80.
Grabherr MG, Haas BJ, Yassour M, Levin JZ, Thompson DA, Amit I, Adiconis X, Fan L, Raychowdhury R,曾强,等。来自RNA-Seq数据的全长转录组组装,没有参考基因组。中国生物工程学报,2011;29(4):644 - 52。https://doi.org/10.1038/nbt.1883.
- 81.
朗米德,B.萨尔茨伯格,S.快速间隙阅读对齐领结2。Nat方法9,357 - 359(2012)。https://doi.org/10.1038/nmeth.1923.
- 82.
李B,杜威CN。RSEM:从RNA-Seq数据中精确的转录物定量,有或没有参考基因组。生物信息学。2011;12:323。https://doi.org/10.1007/978-1-4939-0512-63.
- 83.
罗宾逊,m.d.,麦卡锡,d.j., &史密斯,g.k.(2010)。edgeR:用于数字基因表达数据差异表达分析的生物导体包。生物信息学,26(1),139-140。https://doi.org/10.1093/bioinformatics/btp616.
- 84.
Young MD, Wakefield MJ, Smyth GK, Oshlack A. RNA-seq的基因本体分析:考虑选择偏差。中国生物工程学报。2010;11:R14。
- 85.
谢超,毛晓霞,黄娟,丁勇,吴娟,董松,孔林,高刚,李春英,魏林。KOBAS 2.0:一种丰富途径和疾病注释与识别的web服务器。核酸研究,2011;39:W316-22。https://doi.org/10.1093/nar/gkr483.
- 86.
杜莎·K,马马迪,周瑞,张涛,苏瑞,张勇,王玲,尤建,张旭。芝麻多重非生物胁迫响应的核心转录组调控(芝麻)。Int.分子生物学杂志,2019;20:2-22。https://doi.org/10.3390/ijms20163930.
确认
不适用。
资金
国家重点研发计划项目(No. 2017YFD06003002)和贵州省科学技术基金项目([2016]1144)资助。资助者在研究的设计和实施中没有任何作用;数据的收集、管理、分析和解释;手稿的准备、审查或批准;并决定将手稿提交出版。
作者信息
从属关系
贡献
HL:实验搭建,RNA-seq数据分析及稿件撰写;HC和KL:生理生化指标分析;GD: qRT-PCR验证,RNA-seq数据分析稿件撰写;研究构想、经费获取、监督、稿件修改。所有作者均已阅读并批准稿件。
相应的作者
道德声明
伦理批准并同意参与
不适用。
发表同意书
不适用。
相互竞争的利益
作者宣称他们之间没有利益冲突。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
附加文件1:表S1。
本研究用于qRT-PCR的引物序列。
附加文件2:图S1。
氧化石墨烯富集分析。SL0, CK0, CK04代表Suillus危害(SL)接种不施铝胁迫的植株,SL接种0.4 mmol L的植株−1施铝胁迫、不施铝胁迫和0.4 mmol L不施铝胁迫−1分别施加Al应力。图S2。KEGG富集分析。SL0, CK0, CK04代表Suillus危害(SL)分别接种不施铝胁迫、不施铝胁迫和0.4 mmol L不接种−1分别施加Al应力。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
刘浩,陈浩,丁,郭。et al。水稻耐铝胁迫候选基因的鉴定马尾松用外生菌根真菌接种的BMC植物生物学20.521(2020)。https://doi.org/10.1186/s12870-020-02719-3
收到了:
接受:
发表:
关键字
- 铝的毒性
- 植树造林
- 基因表达
- 真菌菌
- 马尾松