摘要
背景
血清素最初鉴定为哺乳动物中的神经递质,用作抗氧化剂,以清除植物中的细胞ROS。在水稻中,通过SL(Sekiguchi病变),Cytochrome P450单氧化酶系列的成员催化Tryptamine对血清素的转化。这sl来自水稻品种Sekiguchi-asahi的突变体表现出自发病变,而其对病原体的免疫应答尚未明确表征。
结果
在这里,我们确定了三个等位基因突变体sl在一个印度米饭恢复线明辉86(MH86),名为SL-MH-1那- 2和- 3.,所有这些都在正常生长条件下呈现典型的病变。与MH86中的血清素含量相比SL-MH-1显著降低,而色胺和l -色氨酸水平则显著增加。这SL-MH-1突变体积累高H2O.2对外源性H更为敏感2O.2治疗比野生型。当用还原剂维生素C(VC)处理时,物病变形成SL-MH-1叶可以有效地抑制。此外,SL-MH-1对稻瘟病菌和枯萎病菌表现出更强的抗性,Pyricularia oryzae(P. Oryzae.,远程照片:magnaporthe oryzae.) 和Xanthomonas oryzae.PV。oryzae.(XOO),分别。病原菌相关分子模式(PAMPs)触发免疫(PTI)反应,如活性氧(ROS)爆发和胼胝质的沉积,增强SL-MH-1.此外,SL功能的丧失导致了防御激素、水杨酸和茉莉酸的静息水平升高。rna序列分析表明P. Oryzae.感染,参与还原 - 氧化调控的基因的转录是最显着的变化SL-MH-1,与MH86相比。
结论
我们的结果表明,涉及血清素生物合成的最终步骤的SL,通过损害PTI应答和防御激素积累来负调节对(Hemi)生物养殖病原体的水稻抗性。
背景
本质上,植物不断暴露于各种致病微生物,因此他们开发了一种复杂的先天免疫系统,以保护自己免受感染[1].通过植物细胞膜局部化的模式识别受体识别保守病原体相关分子模式(PAMP)的保守病原体相关分子模式(PAMP)激活,可以快速引出植物防御反应,包括钙离子流入,反应性氧(ROS)一代,调用沉积和气孔闭合等[2].植物免疫的另一个分支是效应触发的免疫(ETI),其通过植物抗性(R)蛋白直接或间接感知,其通常与过敏反应(HR)相关,并且呈现出孤立特异性的抗性[3.].作为人力资源的典型特征,伴随着生产ROS和Phytoalexins的编程细胞死亡(PCD),用于有效地停止初始渗透位点内病原体的传播[4.].另一方面,植物免疫应答的激活取决于细胞还原 - 氧化(氧化还原)状态的显着变化,导致转录组的重编程以及本地和全身辩护的建立[5.].当被感染时,植物细胞中升高的氧化应激对于HR的形成和发育是必不可少的[6.].
血清素(5-羟基 - 羟基胺)最初被称为神经递质控制基本生理过程,如情绪,睡眠和焦虑,在哺乳动物中[7.].自首次识别以来黎豆属pruriens血清素广泛分布于植物界,参与多种生理过程的调控[8.那9.].植物中的血清素生物合成,因为色氨酸脱羧酶转化为色氨酸,如色氨酸脱氨酸甲酯催化到阅览室阅读全文5-羟化酶[10.]. 血清素很容易被氧化,作为一种抗氧化剂清除细胞内的活性氧[11.]. 据报道,血清素的抗氧化活性远远超过色氨酸、色胺及其衍生物[9.].因此,可以想到,血清素通过调节细胞氧化还原状态在植物先天免疫中起作用。此外,血清素也可以掺入植物细胞壁中,以加强对病原体的机械屏障[12.].
米饭(栽培稻)是世界上一半以上人口的主食。稻瘟病和细菌性白叶枯病,由半生物营养真菌病原体引起Pyricularia oryzae(P. Oryzae.)和生物养殖细菌病原体Xanthomonas oryzae.PV。oryzae.(XOO)分别是最毁灭性的水稻疾病[13.].越来越多的报告表明,水稻中的5 -羟色胺途径与抗病有关,而大多数研究都基于对病变模拟突变体的特征描述,sekiguchi病变(sl),起源于水稻品种旭化成。这个sl基因,由Fujiwara克隆等。AL.2010年,编码CYP71P1,属于细胞色素P450单氧基酶系列[14.].SL具有Tryptamine 5-羟化酶酶活性,可以催化Tryptamine在水稻中转化为血清素。原因,血清素的积累后Bipolaris oryzae.(b . oryzae(一种坏死性病原体)的感染被消灭sl突变体,sl表现出对b . oryzae[12.].但是,回答sl突变对生物养殖病原体感染和涉及植物免疫的SL机制仍然含糊不清。
在这项研究中,我们确定了slMH86背景中的突变体(sl MH公司)并且发现病变的病变SL-MH-1是由ROS过度积累引起的,这可以通过还原剂治疗抑制。没有SL导致增强的PTI响应和高休息水平的防御激素,从而产生广泛的耐频率P. Oryzae.和XOO.
结果
鉴定slMH86背景中的突变体
我们已经确定了一种稻米失控 - 细胞死亡突变体,rcd1-1,在A.印度稻米恢复线明辉86(MH86)。当在田间或温室生长时,该突变体自发地在其叶子上呈现橙色病变(图。S1).通过基于地图的克隆,在1205个核苷酸中发现了G至T突变slORF,导致370 Arg突变为Leu [15.].两个等位基因的突变体,rcd1-2和rcd1-3,获得了60.γ射线辐射,其中携带C85和A1420缺失sl分别编码区域(图。S2).这两个rcd1-2和rcd1-3自发地存在Sekiguchi病变,类似于rcd1-1(图。S1).因此,我们从此命名rcd1-1那rcd1-2和rcd1-3突变体SL-MH-1那SL-MH-2和SL-MH-3, 分别。
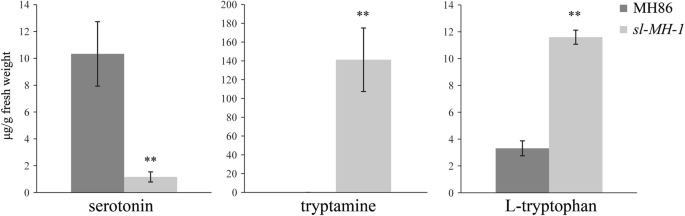
调查血清素生物合成途径中代谢物水平的差异SL-MH-1测量突变体和MH86,测量了在具有自然光的温室中生长的8周龄植物的叶片的血清素,Tryptamine和L- Trytophan的含量。数据表明,血清素水平显着下降SL-MH-1与MH86相比,血清素生物合成的上游代谢产物色胺和l -色氨酸积累显著高于MH86SL-MH-1(图。1),证明SL在催化Tryptamine转化为血清素的功能。此外,我们发现L-谷氨酰胺的含量SL-MH-1显着高于MH86(图。S3).总的来说,我们的结果表明slMH86背景也会导致典型的关口病损和血清素生物合成受损。
内源性氧化应激导致病变形成SL-MH-1树叶
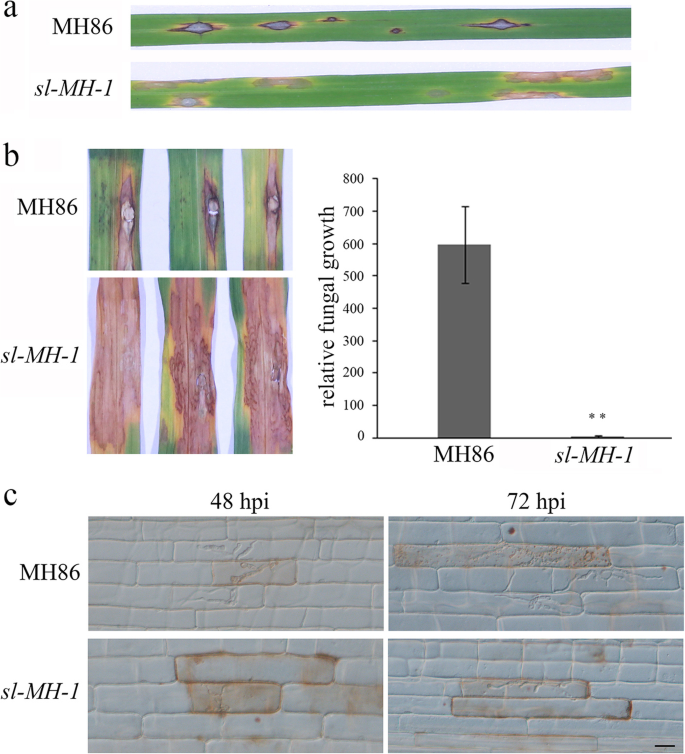
在没有SL的情况下确定细胞死亡与ROS积累之间的关系,我们染色了8周岁的叶子SL-MH-1和锥虫蓝和3,3-二氨基苯并丁二氯化物(DAB)的MH86以检测细胞死亡和H.2O.2分别积累。如图1所示。2A,与MH86相比,病变部位SL-MH-1叶(显示为深台扁蓝染色)显示较多H2O.2DAB染色(深棕色)所示的积累。评估缺陷SL-MH-1响应外源ROS应激,SL-MH-1MH86种子在含或不含H的MS培养基上萌发2O.2.在28°C的生长室内保持12小时1周后,我们发现在没有显着差异SL-MH-1和MH86幼苗在MS培养基上不含H2O.2(图。2b)。H.2O.2施用可延缓二者的生长SL-MH-1和MH86幼苗,然而SL-MH-1与野生型相比,幼苗对H的胁迫程度更大(叶片变黄)2O.2治疗(图。2b) 是的。因此,sl突变导致高内源性ROS积累并增加对外源性ROS胁迫的敏感性。
以便进一步确定是否损伤SL-MH-1我们用抗氧化剂维生素C (VC,抗坏血酸)处理突变体,这是植物细胞中主要的氧化还原缓冲液之一,并作为抗氧化剂进行ROS解毒[16.].据报道,VC的外源性应用可以缓解非生物胁迫诱导的水稻中的氧化应激[17.].质询SL-MH-1在绿色房子中生长的幼苗,其叶子未表现出可见的病变,通过喷涂10天用0.1%VC或水(作为对照)治疗。然后计算顶部第二和第三叶上的病变数。如图1所示。2C和表格1,Lesion号码SL-MH-1VC处理显著降低了叶片的抗氧化能力,说明外源抗氧化处理可以抑制叶片的抗氧化能力SL-MH-1病变的形成。综上所述,我们的数据表明,缺乏SL的细胞死亡是由高内源性ROS积累引起的。
SL-MH-1突变体显示增强的抵抗力P. Oryzae.和XOO
由于ROS生产是植物对病原体入侵的重要防御反应,我们想知道SL-MH-1突变体更耐水稻病原体。首先,我们挑战3周龄SL-MH-1与瘟真菌分离物FJ-1分生孢子的MH86幼苗进行喷施。如图1所示。3.a,接种FJ-1在MH86叶片上引起典型的病害症状SL-MH-1突变体在FJ-1感染部位显示Sekiguchi病变。量化阻力SL-MH-1对于爆炸真菌,我们进行了冲击接种SL-MH-1和MH86叶片并研究了感染区域内的相对真菌生物量,表明了SL-MH-1突变体支持显着较少的爆炸真菌生长而不是MH86(图。3.b)。为了进一步监测这个过程m . oryzae入侵SL-MH-1和MH86,进行水稻叶鞘接种试验。结果发现,MH86的侵入菌丝(IH)在接种后48 h (hpi)可向第一个被感染细胞的邻近细胞延伸,在72 h (hpi)时进一步向邻近细胞延伸。3.C)。然而,在48和72 HPI中,IH仍然在第一个受感染的细胞中被限制SL-MH-1(图。3.c) 是的。虽然IH可以从48 hpi延长到72 hpiSL-MH-1结果表明,稻瘟病菌的感染率明显低于MH86。综上所述,这些结果表明sl提高水稻对稻瘟病菌的抗性。
SL-MH-1突变体显示增加抵抗P. Oryzae..一种质询MH86和SL-MH-1幼苗被接种P. Oryzae.分生孢子喷洒。在接种后7天(dpi),对患病叶片进行成像。B.穿孔接种与P. Oryzae.在4周龄MH86和4周的叶子上进行了分类SL-MH-1植物。感染的叶子在9 dpi(左)拍摄;同时测量真菌生物量以量化相对P. Oryzae.MH86的增长和SL-MH-1叶子(右)。条形图表示三个生物重复的平均值±标准差。**表示统计学上的显着差异(P.< 0.01,学生的T.以及)。C.MH86和SL-MH-1注射P. Oryzae.分生孢子监测感染过程。在48和72hpi条件下,用显微镜在光场下对感染细胞进行成像。酒吧 = 20 微米
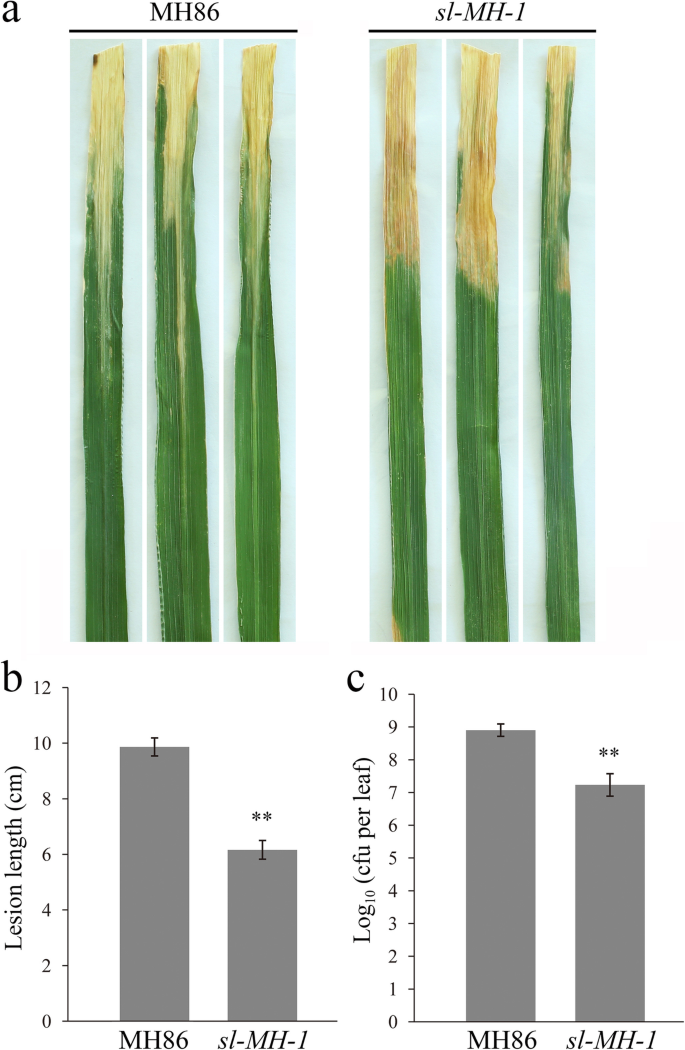
确定是否SL-MH-1突变株对病原菌的抗性增强,我们进一步接种SL-MH-1和MH86的植物XOO.如图1所示。4.,通过对接种后14天的枯萎病变长度和细菌种群进行比较,发现它SL-MH-1确实表现出增强的抗枯萎细菌。此外,支持抗性表型SL-MH-1导致SL的损耗功能,另一种等位基因突变体,SL-MH-3,进行上述接种测定。结果表明类似的结果SL-MH-1那SL-MH-3表现出更强的抵抗力P. Oryzae.和XOO(图。S4广告)。因此,SL负面调节水稻广谱耐受(Hemi)生物养殖病原体。
sl突变导致PTI反应增强
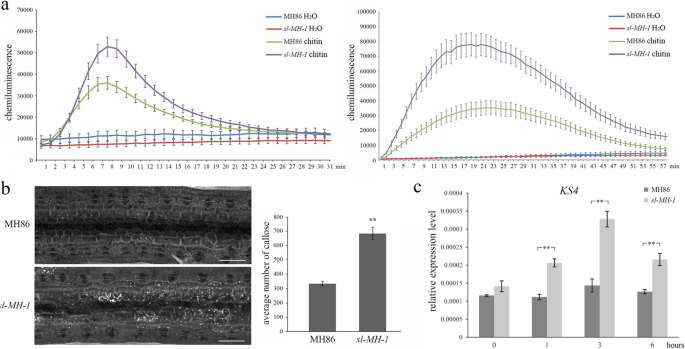
为了破译SL缺失的增强抗性机制,PTI响应SL-MH-1和MH86分析。我们首先测量了ROS爆裂的水平SL-MH-1和MH86在FLG22和甲壳素治疗中。发现ROS突发都可以在两者中刺激SL-MH-1和MH86由PAMPS治疗留下,而ROS产量的水平明显高于SL-MH-1比指示时间点的MH86(图。5.a).此外,胼胝质沉积在SL-MH-1研究了几丁质治疗后的MH86叶。如图1所示。5.b,与MH86相比,胼胝质的沉积明显增多SL-MH-1树叶。并且类似地观察到增强的胼舌沉积SL-MH-3叶子(图。S4e).进一步研究pti相关防御基因的转录谱KS4被调查了SL-MH-1丁蛋白治疗前后MH86。KS4是涉及在白夹层生物合成的二萜环酶[18.那19.].我们发现在甲壳素治疗后的所有指示时间点,转录水平KS4在SL-MH-1显著高于MH86(图5)。5.c).综上所述,我们的数据表明,SL的损失功能增强了水稻的PTI反应。
PTI反应增强SL-MH-1突变体。一种ROS爆发了MH86和SL-MH-1在指示的时间点检测用400nm壳酸或500nm flg22处理的叶片。误差栏代表se(N= 8)。这些数据来自三个独立实验中的一个,实验结果相似。B MH86和MH86上胼胝质沉积SL-MH-1在紫外光下用显微镜对几丁质处理后的叶片进行成像(左)。用图J(右)分析每张图胼胝质的沉积数量。条表示平均值±SE (N= 5)。**表示统计学上的显着差异(P.< 0.01,学生的T.以及)。该试验在三个独立的重复中进行,结果相似。C相对转录水平KS4在3周龄MH86和SL-MH-1用400nm甲壳素治疗后,在指定的时间点叶。水稻泛素编码基因(UBQ公司)被用作内部控制。条表示平均值±SD(N= 3)。**表示统计学上的显着差异(P.< 0.01,学生的T.以及)。该测定在两个与类似结果的独立重复中进行
sl MH公司突变体积累了更高水平的防御激素
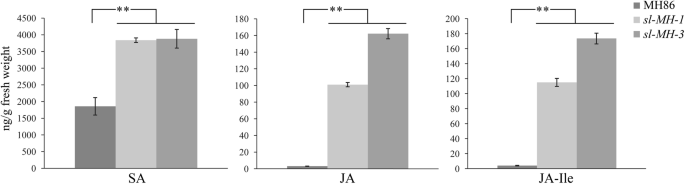
水杨酸(Sa)和茉莉酸(Ja)是对抗病原体外防的主要植物激素。评估是否sl检测6周大鼠血清中SA、JA和JA-异亮氨酸(JA- ile, JA的活性形式)的含量SL-MH-1和MH86植物,当损伤完全出现时SL-MH-1树叶。如图1所示。6.,免费SA级别SL-MH-1大约是MH86航班的两倍;JA和JA- ile的内容SL-MH-1比MH86高大约30倍。同时测定SA、JA、JA- ile水平SL-MH-3要确认防御激素的高积累是由此产生的sl突变。人们发现SL-MH-3累积类似水平的免费SASL-MH-1甚至更高的JA和JA-ILE水平比那些人更高SL-MH-1(图。6.).此外,研究人员还测量了3周大的孩子的防御激素水平SL-MH-1和MH86植物,当未观察到病变时SL-MH-1树叶。如图1所示。S53周大的血清游离SA水平SL-MH-1幼苗类似地比MH86高的两倍高;ja-ile内容SL-MH-1与MH86相比,3周龄SL-MH-1和mh86。这些结果表明sl突变导致SA产量不断增加,随着病变出现,JA和JA- ile含量显著增加。
sl突变主要改变在爆炸真菌感染时减少氧化途径中基因的转录
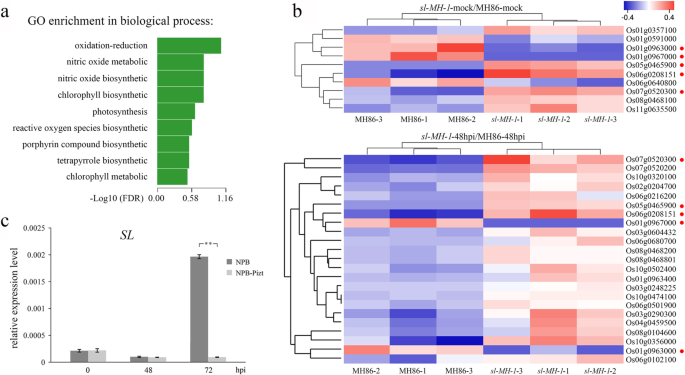
目的:探讨基因转录的差异sl突变型和野生型对病原菌感染的反应,我们进行了转录组分析SL-MH-1和MH86的植物P. Oryzae.接种。叶组织SL-MH-1在48 hpi时用FJ-1采集MH86进行rna测序分析,水处理作为对照(模拟)。显著差异表达位点(SDEL)的数量SL-MH-1-mock与MH86 mock的比较(SL-MH-1-模拟/MH86模拟)和SL-MH-1-48hpi与MH86-48hpi (SL-MH-1-48HPI / MH86-48HPI)分别折叠≥2或≤0.5分别为95和149(补充表S1和表格S2).我们使用基因本体学富集分析来研究各种生物过程中的转录物概况SL-MH-1和MH86后患有爆炸真菌感染。结果表明,与MH86相比,最明显影响的生物过程SL-MH-1是氧化还原途径(图。7.一种)。与氧化还原术语有关的重要差异表达基因(DEG)为10和23SL-MH-1-mock / mh86-mock和SL-MH-1-48HPI / MH86-48HPI分别显示其转录水平作为图1所示的热量。7.湾有五种氧化还原相关基因在两者中具有类似的转录变化趋势SL-MH-1-mock / mh86-mock和SL-MH-1-48HPI / MH86-48HPI(图。7.B由红色点表示),表明其缺陷SL引起的转录变化不受Blass Fungus感染的影响。其中,OS07G0520300编码了细胞色素P450家族的植物激素相关蛋白,其转录水平显着增加SL-MH-1;OS01G0963000和OS01G0967000是唯一的两个下调氧化还原基因SL-MH-1接种后,它们分别编码阳离子过氧化物酶SPC4和含蛋白质的LSM结构域。SPC4可能涉及RIS中的ROS [20.].
MH86基因的转录组分析SL-MH-1植物有和没有爆炸真菌接种。一种基因本体论富集分析显示了不同生物过程中基因转录谱的变化SL-MH-1,与MH86相比,之后P. Oryzae.接种。B.氧化还原途径中的显着差异表达基因(DEGS)的热图SL-MH-1- 与MH86-MOCK相比,和SL-MH-1-48HPI与MH86-48HPI相比。红点表示具有类似转录变化趋势的基因SL-MH-1-mock / mh86-mock和SL-MH-1-48hpi/MH86-48hpi。C相对转录水平sl在接种之前和之后的NPB和NPB-PIZT植物中P. Oryzae.隔离KJ201。UBQ公司用作内部控制。条表示平均值±SD(N= 3)。**表示统计学上的显着差异(P.< 0.01,学生的T.以及)。数据来自三种独立实验中的一个,具有类似的结果
在其他十八次氧化还原相关的egg中sl-48hpi / mh86-48hpi,所有这些都上调SL-MH-1突变体,五个基因,OS06G0102100,OS02G0204700,OS06G0680700,OS10G0320100和OS06G0501900编码细胞色素P450家族蛋白;OS10G0356000和OS10G0502400主要在光合体系中表达,后来通过不同光线条件下的Phytochromes和CryptoComes调节[21.那22.];OS08G0104600编码了位于位于叶绿体的Ferridoxin,涉及从照照I转移电子I至NADP+和代谢过程的各种受体系统[23.];os06g0290300及Os06g0216200 (Osop2.)分别编码ω-3脂肪酸去饱和酶和OPR同工酶,其涉及JA Biosynest [24.那25.那26.]; Os04g0459500编码一种甘油醛-3-磷酸脱氢酶(GAPDH),在细胞凋亡过程中转移到细胞核中并影响细胞毒性[27.]. 为了证实上述RNA序列的结果,我们对MH86和MH86中氧化还原途径的关键基因Os01g0963000、Os08g0104600和Os03g0290300进行了定量实时PCR(qRT PCR)分析SL-MH-3之前和48小时后P. Oryzae.接种。如图1所示。S6,这些基因的转录变化SL-MH-3与那些相似SL-MH-1transcritome数据。
此外,我们调查了sl转录的japonica.水稻品种Nipponbare (NPB)和Piz-t公司与爆炸真菌分离kj201接种之前和之后的转发NPB(NPB-PIZT)植物,这是无毒的Piz-t公司[19.那28.].如图1所示。7.C,没有显着差异sl在接种后在48小时之前或在48小时之前检测NPB和NPB-PIZT的转录水平。随着疾病发展,sl在72hpi时,NPB中的转录显著上调,而在NPB-Pizt中没有明显改变(图。7.c).这些结果表明成功P. Oryzae.感染可能上调sl在米饭中的表达。
讨论
Sekiguchi病变是内源性ROS高积累的结果
主要探讨了水稻中血清素的生物学功能,通过表征表型来探讨sekiguchi病变突变体,如SL是将色胺转化为血清素所必需的。在本研究中,我们鉴定了sl基因在MH86背景中,在正常生长条件下也表现出Sekiguchi病变,并且显着降低了血清素含量。SL-MH-1突变体积聚高水平的h2O.2在其病变部位,对外源性更敏感2O.2治疗。此外,VC治疗可以抑制病变形成SL-MH-1叶子,并且已经描述了类似的结果sl突变体(29.].这些结果表明,当SL有缺陷时,高内源性氧化水平导致细胞死亡发生,这与血清素作为有效内部ROS清除剂的作用一致[30.].同时,当sl突变,h2O.2通过单胺氧化酶从过量的色氨酸氧化产生的产生也可能有助于病变形成[29.].过量的ROS生产可以通过快速氧化和破坏细胞组分,包括蛋白质,核酸和脂质来贡献或执行PCD。ROS诱导的PCD被描述为光合作用期间植物中的光氧化损伤的机制[31.].据报道,诱导典型Sekiguchi病变的最有效波长为400-700nm;虽然在黑暗中,只形成了棕色斑点和坏死的点病变sl叶子(32.].此外,光合抑制剂可以显着抑制Sekiguchi病变[33.].因此,我们推测,在正常生长条件下,血清素是清除光合作用过程中产生的内源性氧自由基,从而保护水稻免受氧化损伤的必要物质。
SL负调控水稻对生物营养病原菌的抗性
在这项研究中,我们发现了sl MH公司突变体显示出增强的抗真菌和枯萎细菌的抗性。SL-MH-1形成了围绕感染部位的典型病变,其可以有效地抑制病原体延伸。而且,转录水平sl在NPB中令人抑制,但在72个HPI中没有NPB-PIZT,用爆炸真菌孤立无毒Piz-t公司,表明水稻和P. Oryzae.可以诱发sl表达式。据推测,72 hpi是P. Oryzae.在其疾病循环期间从生物营养到病重营养期的过度[34.].因此,上调sl可能需要在这种时间点的表达来缓解由宿主细胞塌陷引起的高氧化胁迫在进入病症期后。类似地,表明血清素有效地在受人类人力资源造成的氧化损伤中保护未感染的组织[35.].
我们的数据也显示了这一点SL-MH-1突变体表现出更强的PTI反应,包括pamps诱导的ROS爆发和胼胝质的沉积。植物细胞的高氧化水平在介导免疫应答的建立中起着多方面的信号传导作用[36.].例如,ROS可以刺激快速CA2+埃米特涌入[37.].所有植物质膜局部呼吸爆发氧化酶同源物(Rbohs),它们对胞外ROS的产生至关重要[38.],包含Ca2+−结合EF手基在其N端,意味着ROS的产生和Ca2+流入相互调节[39.].除此之外,ROS直接调解植物细胞壁部件的交联,以强化对抗病原体的结构障碍[40].此外,ROS还可以通过诱导基因表达的变化来促进植物免疫应答的激活[41.]. 因此,我们假设sl MH公司突变体也可能是其高内源性ROS积累的影响。
与其增强的抵抗力相反P. Oryzae.和XOO,sl据报道,突变体更易受病毒感染b . oryzae[12.].发散的致病表型sl突变体可以由这些病原体的不同营养类型产生。b . oryzae是一种病重养殖病原体,从死宿主细胞中营养。在这种情况下,自发细胞死亡sl突变体可能是一个有利的术语b . oryzae增长。然而,P. Oryzae.和XOO是半营养型和生物营养型病原体,分别向谁定植、损害sl突变体可以设定限制。
SL功能抑制防御激素的积累
SA和JA是触发和调解一系列防御反应的重要植物激素。在拟南芥中,JA参与抗病性病原体和食草昆虫的抗性[42.],虽然SA有助于对生物营养病原体的防御反应[43.].而SA和ja介导的免疫通路在拟南芥中始终是相互拮抗的。虽然水杨酸在水稻中的防御作用被保留了下来,但是水杨酸的含量对于水稻抗性的诱导并不那么重要,因为水稻植株在正常生长过程中通常会积累大量的水杨酸[44.那45.].有趣的是,SA也有助于水稻对褐飞虱的防御[46.].此外,与拟南芥的发现相反,水稻中的JA正向调节对(半)生物营养病原体的免疫反应[47.那48.].
我们的结果表明,SA不断积累在SL-MH-1突变到野生类型的大约两倍的水平,并且Ja和Ja-ile的内容急剧增加SL-MH-1当病变出现时。考虑到水稻中的SA对调节氧化还原平衡和清除内源性ROS至关重要[49.[我们推测了高速累积SL-MH-1可以使用来缓解其内部氧化应激。Ja是一种脂质衍生的激素,其叶状塑料中间体,CIS-(1)-12-氧代苯甲酸(OPDA)衍生自氧化改性的多不饱和脂肪酸[50.].因此,JA和JA-ILE内容增加SL-MH-1也可能是由氧化水平升高引起的,因为在拟南芥中,由于叶绿体中主要的铁氧还蛋白Fd2缺失,积累了更多的ROS,从而导致了较高的JA及其衍生物水平[23.].另一方面,编码参与合成用作JA前体的不饱和脂肪酸的ω-3脂肪酸去饱和酶的OS03G0290300显着上调sl MH公司突变体也可以促进JA和JA-ILE的产生。
结论
在这项研究中,我们确定slMH86背景中的突变体(sl MH公司),揭示了SL在水稻先天免疫中的作用。我们的研究结果得出了以下结论:(i)sl MH公司突变体对外源性ROS胁迫更敏感,其病变形成主要是由于内部ROS的过度积累;(ii)通过损害PTI响应并抑制防御激素积累,SL负调节防毒菌和枯萎细菌的水稻防御;(III)SL的损失功能显着改变了接种后氧化还原途径所涉及的基因的转录P. Oryzae.;(iv)成功P. Oryzae.感染up-cnathtate的转录水平sl在米饭中。我们的研究破译了SL在水稻防治中的负面作用对抗(Hemi)生物养殖病原体。
方法
植物材料和爆炸分离物
这印度米饭恢复线明辉86最初在中国农业科学院大米研究所,中国福州。这SL-MH-1如前所述,从组织培养诱导的MH86突变产生突变体[15.].这SL-MH-2和SL-MH-3本研究中的突变体是从60.美国MH86的CO〜γ射线辐射。水稻品种Nipponbare,其转基因线携带Piz-t公司(npb-pizt)和P. Oryzae.孤立的KJ201最初是从郭梁王博士的实验室(俄亥俄州州立大学植物病理学系)获得。这P. Oryzae.Dewei Yang(福建省农业科学院,中国福建省农业科学院)提供了孤立的FJ-1(毒禽86)。这XOO菌株6由唐定忠博士(福建农林大学植物免疫中心,中国福州)提供。对H2O.2治疗,P. Oryzae.接种,PTI响应检测和防御激素测量测定,植物在12-H光下在28℃下在生长室中发芽并生长(600-800μmol/ m2。)/ 12-H黑暗循环。用于代谢物测量,病变染色,VC处理和XOO接种试验表明,在夏季自然条件下,这些植物生长在湿度控制的温室中。
爆炸真菌和枯萎细菌接种
P. Oryzae.和XOO接种分别在生长室和温室中进行。P. Oryzae.将分离物FJ-1在CMII培养基上培养2周,以进行孢子率。然后是3×10的分枝悬架5.在3周龄米叶上喷洒孢子/ ml。接种后,将幼苗在黑暗中以高湿度在28℃下保持24小时,然后转移到生长室中5〜7天进行评估疾病症状。如前所述,使用了四周的稻米植物进行冲击接种[19.]和10μl体积的孢子悬架(2×105.施用孢子/ mL)。作为预先描述的方法进行了对感染稻叶组织的真菌生物量的研究[51.].从一个单一植物中收集两个穿孔的叶子作为统计分析的一种生物复制。对于叶片鞘接种,将共分享悬浮液注入到21天老植物的独立式鞘掌上。然后,将接种的护套保持在培养箱中,该培养箱具有80%湿度的表示时间。在显微镜观察之前,将内护套的表面电池剥离并制成载玻片样品。接种XOO在叶片剪切方法期间进行在耕作阶段进行[52.].细菌悬浮液,光学密度为600nm(OD600) = 用0.5接种水稻叶片:用剪刀蘸菌悬液,剪叶。接种后的植株在温室中保存14天 疾病症状分析前天。如前所述,对侵染叶片中的枯萎病病斑长度和细菌数量进行了评估[53.].
VC治疗
vc(用蒸馏水稀释0.1%)喷洒到3周龄米幼苗上,每天三次(9:00,12:00和15:00)持续10天。喷水用作对照。
代谢物含量分析
分别将1000 μl预冷提取液(乙腈:甲醇:水,2:2:1)加入到MH86和sl-MH-1样品中,每50 mg。代谢物提取如前所述[54.]小调如下。在匀浆后圆圈和离心后,将100μl上清液转移并在氮气流下干燥,然后使用100μl10%甲醇重构残余物。离心后,将80μl上清液转移到用于UHPLC-MS / MS分析的自动取样器小瓶中。如前所述进行制备标准溶液和UHPLC分离54.]. 以L-2-氯苯丙氨酸为内标,浓度为200 纳摩尔/升。流动相A为0.1%醋酸水溶液,流动相B为甲醇。UHPLC分离和代谢物含量定量分析的洗脱时间和梯度如表所示S3.每个实验采用5个生物重复来评估重复性。
SA和JA目录测量
用于测量防御激素内容物,叶子来自三个6周龄MH86,SL-MH-1或者SL-MH-3收获植物作为一种生物重复;八个3周龄MH86或SL-MH-1植物作为一个生物复制体被收获。测量方法如前所述[55.].
DAB和台盼蓝染色
8周龄的MH86和MH86叶片样品SL-MH-1将植物浸泡在2mg / ml 3,3'-二氨基苯胺(DAB)中(2mg / ml DAB,0.05%Tween 20,10mM Na2HPO.4.)4〜5小时然后转移到脱离溶液(乙醇:乳酸:甘油= 3:1)。在加热至90-95℃下15分钟后,将叶片转移到新鲜剥离溶液中并轻轻致亮过夜。如前所述进行台盼蓝染色[56.].
胼胝质沉积
为了观察到胼舌,7天幼苗的米饭用几丁质(六乙酰苯乙酸己糖)对待。如前所述进行测定[57.].最后,在紫外光下观察到叶子(340至380nm; Zeiss Lsm880)。
幼苗用h治疗2O.2
将Dehusking稻种子与75%乙醇灭菌2分钟,3%次氯酸钠30分钟,然后在1/2 ms培养基上发芽,或没有0.02%h2O.2.将板放入28℃的生长室中,12小时光/ 12-H暗循环7天。然后拍摄幼苗以分析对H的敏感性2O.2治疗。
ROS破裂检测
将来自7天大米幼苗的叶片漂浮在灭菌水中过夜,然后用500nm flg22或400nm chitin含有100μl反应溶液(20μm腔和2.5μg/ ml过氧化物酶),立即测试ROS爆裂。通过Berthold Mithras发光计每1-2分钟测量发光1小时。每个数据点表示八个复制。
RNA-SEQ测序和QRT-PCR分析
来自MH86的总RNA和SL-MH-1根据制造商的说明,使用RNAEasy试剂盒(Qiagen,Germany)提取出来的喷雾真菌喷雾接种之前和之后的叶片在洗脱菌喷射接种并用RNA酶DNase Set(Qiagen,德国)进行处理。使用2100生物分析仪系统(Agilent,USA)测定RNA质量,图书馆构建和尺寸。使用Truseq RNA样品制备v2套件(Illumina,USA)合成了文库。合并来自每种处理的总RNA,然后构建两种文库并用于测序。在Novaseq系统中运行样品,获得配对150bp的原始序列。
下面的分析是在Majorbio (https://www.i-sanger.com.).原始读取使用fastx_toolkit_0.0.14进行计算。清洁数据采用SeqPrep和Sickle软件。TopHat2被用来分别绘制MH86或MH86中每个生物复制的读取SL-MH-1反对O. Sativa japonica品种Nipponbare序列根据MSU 7.0。用袖扣组装成抄本,并附有参考注释以指导组装[58.].所有程序均按确定的参数完成。显著差异表达位点(SDEL)SL-MH-1在应用多重校正(FDR校正)后,与MH86相比的突变体被识别出来P.≤0.05)。具有折叠变化≥2或≤0.5的SDEL用于进一步分析。在SDEL中进行功能性富集分析(FEA)SL-MH-1与MH86相比。在与氧化还原生物学过程相关的基因集上进行功能注释和表达相关分析。使用聚类分析产生热图。
可用性数据和材料
所有数据维持本研究中的结果都包含在本手稿或其补充信息文件中。在当前研究期间分析的数据集可以从相应的作者获得合理的请求。本文报告的原始测序数据已存放在NCBI SRA数据库中,该数据库在登录号PRJNA634690中,可公开访问http://www.ncbi.nlm.nih.gov/bioproject/634690.
缩写
- PCD:
-
编程细胞死亡
- 风险资本:
-
维生素C
- PAMPS:
-
病原体相关分子模式
- PTI:
-
PAMPs触发免疫
- ROS:
-
反应性氧气
- P. Oryzae.:
-
Pyricularia oryzae
- XOO:
-
Xanthomonas oryzae.PV。oryzae.
- B.:
-
oryzae.:Bipolaris oryzae.
- 氧化还原:
-
减少氧化
- eti:
-
Effector-triggered免疫力
- 人力资源:
-
过敏反应
- sl:
-
sekiguchi病变
- 轻拍:
-
3,3-二氨基苯并丁二烷二氯化硅烷
- 小姐:
-
Murashige和斯库
- 南非:
-
水杨酸
- JA:
-
茉莉酸
- JA-Ile:
-
JA-异氨酸
- hpi公司:
-
接种后的小时
- SDEL:
-
重要的差异表达的基因座
- 度:
-
差异表达基因
- RNA序列:
-
RNA测序
- QRT-PCR:
-
定量实时聚合酶链反应
参考文献
- 1。
Jones JDG,Dangl JL。植物免疫系统。自然。2006; 444(7117):323-9。
- 2。
唐丹,王刚,周建民。植物-病原体相互作用中的受体激酶:不仅仅是模式识别。植物细胞。2017;29:618-37。
- 3.
PENG Y,WERSCH RV,Zhang Y.在PAMP触发的免疫和效应引发的免疫力下的收敛和发出信号。Mol植物微生物相互作用。2017; 31(4):403-9。
- 4.
Hofius D,Tsitsigiannis di,Jones JDG,Mundy J.植物免疫诱导细胞死亡。Semin癌症Biol。2007; 17(2):166-87。
- 5。
spoel sh,loake gj。基于氧化还原的蛋白质修饰:植物免疫信号中缺失的联系。CurrOp植物BIOL。2011; 14(4):358-64。
- 6。
NS上校,Epple P, Dangl JL。植物免疫系统中的程序性细胞死亡。细胞死亡的不同。2011;18(8):1247-56。
- 7。
Veenstra-Vanderweele J,Anderson Gm,Cook EH。药物发生和血清素系统:初步研究和未来方向。EUR J Pharmacol。2000; 410(2):165-81。
- 8.
Bowden K,Brown Bg,Batty Je。5-羟基 - 羟基胺:其在牛群(Mucuna Pruriens)的发生。自然。1954年; 174:925-6。
- 9
罗摩克里希纳A, Giridhar P, Ravishankar GA。Phytoserotonin:审查。植物信号处理研究进展。2011;6(6):800-9。
- 10。
Schröderp,abele c,gohr p,stuhlfauth-roisch u,Grosse W.最新关于核桃种子中血清素生物合成的酶学。Adv Exp Med Biol。1999; 467:637-44。
- 11.
Huether G,Fettkötteri,keilhoff g,狼G. serotonin用作自由基清除剂,并且在活性微胶质细胞的呼吸爆发期间氧化成二聚体。J neurochem。2010; 69(5):2096-101。
- 12.
研究表明,色氨酸途径通过血清素的产生,参与了水稻对病原感染的防御反应。植物j . 2008; 54(3): 481 - 95。
- 13。
刘W,刘J,Triplett L,Leach JE,Wang GL。水稻对细菌和真菌病原体的天然免疫的新见解。植物病理学年鉴。2014;52(1):213–41.
- 14。
富士瓦拉T,Maisonneuve S,Isshiki M,Mizutani M,Chen L,Wong HL,Kawasaki T,Shimamoto K.Sekiguchi病变基因编码细胞色素P450单氧基酶,其催化Tryptamine在水稻中转化为羟色胺。J Biol Chem。2010; 285(15):11308-13。
- 15.
高X,Chen Z,Song Y,Chen Z,Tian D,林Y,杨S,陈S,王F. runaway细胞死亡突变体RCD1在水稻中的鉴定与基因映射。莫尔植物品种。2015; 13:1433-40。
- 16。
Pavet V、Olmos E、Kiddle G、Mowla S、Kumar S、Antoniw J。Alvarez MaE,foyer CH:拟南芥中抗坏血酸缺乏激活细胞死亡和抗病反应。植物生理学。2005;139(3):1291–303.
- 17。
王R,刘S,Zhou S,丁C.外源性抗坏血酸和谷胱甘肽缓解Oryza Sativa L. Z Naturforsch C.2014的叶绿素中盐胁迫诱导的氧化应激; 69:226-36。
- 18。
Hasegawa M,Mitsuhara I,Seo S,Imai T,Koga J,Okada K,Yamane H,ohashi Y.植物alexin在水稻和喷丸间相互作用中的积累。Mol植物微生物相互作用。2010; 23(8):1000-11。
- 19
Park Ch,Shirsekar G,Bellizzi M,Chen S,Songkumarn P,Xie X,Shi X,Ning Y,Zhou B,Suttiviya P等。E3连接酶Apip10将效应子AVRPIZ-T连接到水稻中的NLR受体Piz-T。PLOS POAROG。2016; 12(3):E1005529。
- 20。
刘X,威廉姆斯CE,Nemacheck Ja,Wang H,Subramanyam S,Zheng C,Chen M-S。反应性氧物种涉及植物防御静物。植物理性。2010; 152(2):985-99。
- 21。
Mccormac AC, Fischer A, Kumar AM, Söll D, Terry MJ。拟南芥去黄化过程中光敏色素和质体信号调控HEMA1的表达植物j . 2001; 25(5): 549 - 61。
- 22。
叶绿素循环调控光捕获复合物的构建和破坏。生物化学与生物物理学报(BBA)/生物能量学。2011, 1807(8): 968 - 76。
- 23。
王M,瑞兰,闫H,施立,赵开,林继,张克,布朗德JJ,Mackey D,Tang D等人。主要叶片Ferredoxin FD2调节拟南芥的植物先天免疫力。莫尔植物途径。2018; 19(6):1377-90。
- 24。
Sobajima H,Takeda M,Sugimori M,Kobashi N,Kiribuchi K,Cho E-M,Akimoto C,Yamaguchi T,Minami E,Shibuya N等人。在悬浮培养的水稻细胞中编码12-氧代苯甲酸还原酶的茉莉酸响应基因的克隆与表征。Planta。2003; 216(4):692-8。
- 25。
Taki N、Sasaki Sekimoto Y、Obayashi T、Kikuta A、Kobayashi K、Ainai T、Yagi K、Sakurai N、Suzuki H、Masuda T等。12-氧代植物二烯酸触发一组不同基因的表达,并在拟南芥的创伤诱导基因表达中发挥作用。植物生理学。2005;139(3):1268–83.
- 26。
Goepfert S,Poirier Y.脂肪酸降解和超越β-氧化。CurrOp植物BIOL。2007; 10(3):245-51。
- 27。
Hara Mr,Agrawal N,Kim SF,Cascio MB,Cascio MB,Fujimuro M,Ozeki Y,Takahashi M,Cheah Jh,Tankou Sk,Hester Ld等。S-亚硝基聚糖的GAPDH通过SiaH1结合后核易位引发凋亡细胞死亡。NAT细胞BIOL。2005; 7(7):665-74。
- 28。
周B,ZH Qu S,Liu G,Dolan M,Sakai H,Lu G,Bellizzi M,Wang GL。在PI2和Piz-T抗性蛋白之间的三个富含亮氨酸的重复中的八个氨基酸差异决定了Magnaporthe Grisea的抗性特异性。Mol植物微生物相互作用。2006; 19(11):1216-28。
- 29。
上野M, Shibata H, Kihara J, Honda Y, Arase S.增加色氨酸脱羧酶和单胺氧化酶活性诱导稻瘟病菌感染水稻Sekiguchi病斑的形成。植物j . 2003; 36(2): 215 - 28。
- 30.
Huether G, Fettkötter I, Keilhoff G, Wolf G血清素作为一种自由基清除剂,在激活的小胶质细胞呼吸爆发期间被氧化成二聚体。J Neurochem。2002;69(5):2096 - 101。
- 31。
Tiantaphylides C,Krischke M,Hoeberichts Fa,KSAS B,Gresser G,Havaux M,Van Breusegem F,Mueller MJ。单线氧氧是植物的光氧化损伤的主要反应性氧。植物理性。2008; 148(2):960-8。
- 32。
Arase S,Fukuyama R,本田Y. Bipolaris Oryzae在水稻CV中的Sekiguchi病变形成的轻依赖性诱导。Sekiguchi-ashi。J植物疗法。2000; 148(4):193-6。
- 33。
IEDOME M,Arase S,Honda Y,Nozu M.在水稻CV中的Magnaporthe Grisea Toxin的轻依赖性坏死形成。Sekiguchi-ashi。J植物疗法。2008; 143:325-8。
- 34。
Mathioni Sm,BelóA,Rizzo CJ,Dean Ra,Donofrio NM。稻瘟病真菌在侵入性植物感染和体外胁迫下的转录组谱分析。BMC基因组学。2011; 12:49。
- 35。
Hayashi K,Fujita Y,Ashizawa T,Suzuki F,Nagamura Y,Hayano-Saito Y.Serotonin衰减生物应激并导致由对大米的Magnaporthe Oryzae渗透的过敏反应引起的病变褐变。植物J细胞摩尔Biol。2016; 85(1):46-56。
- 36。
Lehmann S、Serrano M、L'Haridon F、Tjamos SE、Metraux J-P。活性氧与植物对病原真菌的抗性。植物化学。2014;112:54–62.
- 37。
Levine A,Pennell Ri,Alvarez Me,Palmer R,Lamb C.钙介导的凋亡在植物过敏性疾病抗性反应中。Curr Biol。1996年; 6(4):427-37。
- 38。
托雷斯马,詹姆斯·吉尔,琼斯JDG。Arabidopsis GP91phox同源物ATRBOHD和ATRBOHF是在植物防御反应中积累反应性氧中间体的累积。PROC NATL ACAD SCI。2002; 99(1):517-22。
- 39。
Torres MA, Dangl JL。呼吸爆发氧化酶在生物相互作用、非生物胁迫和发育中的作用。植物生物学杂志。2005;8(4):397-403。
- 40。
Almagro L, Gomez Ros LV, Belchi-Navarro S, Bru R, Ros Barcelo A, Pedreno MA。植物防御反应中的III类过氧化物酶。实验机器人。2009;60(2):377-90。
- 41。
kotchoni所以,gachomo ew。反应性氧物种网络途径:感知病原体发作的必要前提条件和植物中获得的抗病性。j biosci。2006; 31(3):389-404。
- 42。
对生物营养和坏死营养病原体防御机制的对比。Annu Rev Phytopathol. 2005; 43:05 - 27。
- 43。
Vlot AC,Dempsey DMA,Klessig DF。水杨酸,一种对抗疾病的多方素激素。Annu Rev phytopathol。2009; 47:177-206。
- 44。
杨D-L,杨Y,He Z.植物激素的角色及其在水稻免疫中的相互作用。莫尔植物。2013; 6:675-85。
- 45。
Silverman P,Seskar M,Kanter D,Schweizer P,MétrauxJ-P,Raskin I.水稻水杨酸:生物合成,共轭和可能的作用。植物理性。1995年; 108:633-9。
- 46。
陆海平,罗T,傅华,王丽,谭Y-Y,黄杰z,王Q,叶G-Y,Gatehouse A,娄Y-G,等.5-羟色胺生物合成抑制介导的水稻抗虫性研究。天然植物。2018;4(6):338–44.
- 47。
Yamada S,Kano A,Tamaoki D,Miyamoto A,Shishido H,Miyoshi S,Taniguchi S,Akimitsu K,Gomi K.涉及奥斯·纳西族诱导的水稻细菌枯萎病的抗性。植物细胞生理。2012; 53(12):2060-72。
- 48。
Mei C,齐米,盛G,杨Y.诱导型稻氧化物合成酶基因的诱导过度表达增加了内源性茉莉酸水平,PR基因表达和宿主对真菌感染的抵抗力。Mol植物微生物相互作用。2006; 19:1127-37。
- 49。
关键词:水稻,内源水杨酸,氧化损伤,生物胁迫,非生物胁迫植物j . 2004; 40(6): 909 - 19所示。
- 50.
Wasternack C,遗址B. jasmonals:生物合成,感知,信号转导和植物应激反应,生长和发育的作用。Ann Bot。2013; 111:1021-58。
- 51.
Park C-H, Chen S, Shirsekar G, Zhou B, Khang CH, Songkumarn P, Afzal AJ, Ning Y, Wang R, Bellizzi M,等。水稻Magnaporthe oryzae效应因子avrpizt靶向RING E3泛素连接酶APIP6,抑制水稻病原体相关的分子模式触发免疫。植物细胞,2012;24(11):4748 - 62。
- 52.
Kauffman He,Reddy APK,Hsieh Spy,Merca SD。一种改进的Xanthomonas oryzae PV耐水稻品种抗性技术。oryzae。植物DIS批准。1973; 57:537-41。
- 53.
Chern M,Canlas Pe,Fitzgerald HA,Ronald PC。米NRR,抗病症负调节剂,与拟南芥NPR1和水稻NH1相互作用。工厂J. 2005; 43:623-35。
- 54。
欧J,Peng Y,Yang W,Zhang Y,Hao J,Li F,Chen Y,Zhao Y,Xie X,Wu S等人。ABHD5通过促进自噬尿嘧啶产率刺激与氟尿嘧啶的敏感性。NAT Communce。2019; 10(1):1078。
- 55。
关键词:植物激素,超高效液相色谱-串联质谱(UPLC-MS),分离纯化,同位素稀释肛门Sci。2012;28(11):1081 - 7。
- 56。
Akhter D,Qin R,UK,Alamin M,Jin X,Shi C.棕色中叶(BML)突变稻米(栽培稻l .)导致叶片过早衰老和诱导防御反应。基因。2018;9(4):203。
- 57。
关键词:水稻,几丁质,Magnaporthe, MoChia1,水稻,四肽重复蛋白植物细胞,2019,31(1):172 - 88。
- 58。
Trapnell C,Williams Ba,Pertea G,Mortazavi A,Kwan G. Baren MJV,Salzberg SL,Wold BJ,Pachter L:转录程序组装和RNA-SEQ的定量揭示了细胞分化期间的未经曲目的转录物和同种型切换。NAT BIOTECHNOL。2010; 28(5):511-5。
致谢
我们感谢宋波彪·陈博士,在中国闽江大学海洋学院,福州,福州分享SL-MH-1种子。中国福州福建农林大学植物免疫中心唐定忠博士提供了XOO福建省农业科学院大米研究所德威杨举行赛赛举行6号,提供了P. Oryzae.中国科学院遗传与发育生物学研究所的孤立FJ-1,北京,中国北京,帮助我们衡量和分析防御激素的内容。
资金
福建省自然科学基金项目(no . 2014 J01102);国家自然科学基金青年项目(no . 31301654);中国博士后科学基金项目(no . 2019 M662919);2017年zx08001 - 001)。
作者信息
隶属关系
贡献
MW和DT构思和设计了该项目。FY,YN和DT进行了实验。DT,FY,YN,YL,ZC和GL分析了数据。MW,DT,QL和FW编写并编辑了稿件。所有作者都读过了最后的手稿。
相应的作者
伦理宣言
伦理批准和同意参与
不适用。
同意出版物
不适用。
相互竞争的利益
作者声明没有利益冲突。
附加信息
出版商的注意
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
补充信息
附加文件1:图S1。
等位基因的病变表型sl MH公司突变体MH86的叶子,SL-MH-1那SL-MH-2和SL-MH-3在温室生长后拍摄了6周。
附加文件2:图S2。
的示意图表示sl基因结构和突变位点。黑匣子和线条分别表示外显子和内含子,并且在灰色框中显示了未翻译的区域。箭头表示等位基因的突变位点sl MH公司突变体。
附加文件3:图S3。
MH86中L-谷氨酰胺的含量和SL-MH-1.L-谷氨酰胺的水平在8周龄MH86和SL-MH-1通过UPLC测量植物。棒代表五个生物重复的平均值±SD。**表示统计学上的显着差异(P.< 0.01,学生的T.以及)。
附加文件4:图S4。
电阻的SL-MH-3至P. Oryzae.和XOO.a. 3周前坠毁的MH86和SL-MH-3幼苗被接种P. Oryzae.通过喷涂和患病的叶片在7 dpi成像分枝叶。湾穿孔接种与P. Oryzae.在4周龄MH86和4周的叶子上进行了分类SL-MH-3植物。患病的叶片在9 dpi(左)处拍摄,测量真菌生物质(右)。条形图表示三个生物重复的平均值±标准差。**表示统计学上的显着差异(P.< 0.01,学生的T.以及)。C。MH86和SL-MH-3植物被接种XOO.被感染的叶子来自三个独立的MH86或SL-MH-3植物以14 dpi成像。d.枯萎病斑长度SL-MH-3测量MH86叶(左),条表示平均值±SD(N= 6,来自三个独立的植物;*意味着P. < 0.05 by Student’sT.以及)。用代表三个独立MH86或MH86的平均值±SD的条形图来计数白叶枯病菌种群数量为14 dpiSL-MH-3植物(右),**意味着P. < 0.01 by Student’sT.-测试。e。在MH86和MH86上沉积SL-MH-3在紫外光下用显微镜对几丁质处理后的叶片进行成像(左)。计算每个视图的调用沉积的数量(右)。条表示平均值和SD(N= 5)。**表示统计学上的显着差异(P.< 0.01,学生的T.以及)。
附加文件5:图S5。
3周龄MH86和SL-MH-1植物。3周龄MH86和6周龄MH86的SA、JA和JA-Ile的静息水平SL-MH-1叶子通过UPLC测量。条形图表示三个生物重复的平均值±标准差。**表示统计学上的显着差异(P.< 0.01,学生的T.以及)。
附加文件6:图S6。
MH86中氧化还原途径代表基因的QRT-PCR分析SL-MH-3.OS01G0963000,OS08G0104600和OS03G0290300的转录水平在MH86和MH86中确定SL-MH-3在48 HPIP. Oryzae.(喷水为嘲弄治疗)。UBQ公司用作内部控制。条表示平均值±SD(N= 3)。**表示统计学上的显着差异(P.< 0.01,学生的T.以及)。
附加文件7:表S1。
显着的差异表达基因SL-MH-1-mock / mh86-mock。
附加文件8:表S2。
显着的差异表达基因SL-MH-1-48hpi/MH86-48hpi。
附加文件9:表S3。
UHPLC-MS的血清素,Tryptamine,L- Trytophan和L-谷氨酰胺的定量。
附加文件10:表S4。
本研究的qRT-PCR引物序列。
权利和权限
开放访问本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料包括在文章的创作共用许可中,除非在材料的信用线中另有说明。如果材料没有包含在文章的创作共用许可证中,而您的预期使用不被法律法规允许或超过允许的使用,您将需要直接获得版权持有人的许可。如欲浏览本许可证的副本,请浏览http://creativecommons.org/licenses/by/4.0/.Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信用额度中另有说明。
关于这篇文章
引用这篇文章
田东,杨峰,牛勇。et al。明恢86的关口病损功能丧失导致对(半)生物营养病原菌的抗性增强。BMC植物BIOL.20,507 (2020). https://doi.org/10.1186/s12870-020-02724-6
已收到:
公认:
发表:
关键字
- 大米
- 血清仁
- 反应性氧气
- PAMP触发免疫
- 防御激素
- Pyricularia oryzae