- 研究文章
- 开放获取
- 发表:
MfbHLH38,Myrothamnus flabellifoliabHLH转录因子,赋予植物对干旱和盐胁迫的耐受性拟南芥
BMC植物生物学体积20.,文章号:542(2020)
摘要
背景
基本螺旋-环-螺旋(bHLH)蛋白是一个大型转录因子家族,参与植物的生长发育和对各种环境胁迫的防御反应。复活植物Myrothamnus flabellifolia植物以其极强的耐旱性而闻名,但近年来研究发现参与非生物胁迫响应的bHLHs很少m . flabellifolia.
结果
在本研究中,我们克隆并鉴定了一个脱水诱导基因,MfbHLH38,从m . flabellifolia.MfbHLH38蛋白定位于细胞核,在那里它可以作为转录因子。异源表达MfbHLH38在拟南芥通过叶绿素、丙二醛(MDA)、脯氨酸(Pro)、可溶性蛋白、可溶性糖含量、离体叶片失水速率、活性氧(ROS)积累和抗氧化酶活性等生理指标的研究,表明叶片对干旱和盐度胁迫的耐受性有所提高。除此之外,MfbHLH38过表达增加了甘露醇和脱落酸(ABA)对气孔关闭的敏感性,提高了干旱胁迫下的ABA水平,增加了ABA生物合成和ABA响应相关基因的表达,如NCED3,P5CS,RD29A.
结论
我们的研究结果证明MfbHLH38增强了植物对干旱和盐胁迫的耐受性拟南芥通过增加保水能力、调节渗透平衡、降低胁迫诱导的氧化损伤,可能参与了aba依赖的胁迫响应通路。
背景
植物作为固结物种,易受环境条件变化的影响,干旱和盐度胁迫的增加通常通过干扰离子稳态、减少养分吸收和加剧氧化胁迫来限制植物的发育和生长[1].为了适应这些不利的环境胁迫条件,植物在进化过程中形成了各种复杂的应对机制。植物在应对不同胁迫时,信号转导和转录调控在复杂的生物化学和分子调控网络中起着重要作用。脱落酸(ABA)作为一种普遍存在的植物激素,参与了植物对环境刺激的应激信号网络,在植物在生物和非生物胁迫条件下的各种生物过程中起着不可替代的作用[2,3.].ABA水平升高可激活某些转录因子(tf),从而调控下游多种基因的表达[4].迄今为止,已经报道了不同植物抗非生物胁迫耐受的一系列胁迫响应tf [5,6].
在植物界,基本的螺旋-环-螺旋(bHLH)转录因子属于一个大的超家族。可细分为26个子节,参与多种转录调控途径[7].第一个bHLH转录因子,调控基因R分别从玉米中分离出167和177个成员拟南芥和大米,分别[8,9,10].bHLH转录因子具有高度保守的bHLH结构域,包括位于其n端的基本区域和紧随其后的HLH区域。这两个区域分别起到DNA结合和促进蛋白质-蛋白质相互作用的作用[11,12].bHLH蛋白识别的靶基因的核心DNA序列元件是一个称为E-box (5 ' -CANNTG-3 ')的一致基序,其中回文G-box (5 ' -CACGTG-3 ')是最常见的形式之一[13,14].
近年来,越来越多的证据表明bHLHs通过ABA信号转导途径参与植物的多种非生物胁迫响应。AtbHLH92[15],AtbHLH17(AtAIB) [16,17),而AtbHLH122[16通过aba依赖的途径调节对干旱、盐度、渗透、氧化或冷胁迫的反应。葡萄VvbHLH1赋予转基因拟南芥通过ABA信号网络提高对盐度和干旱的耐受性[18].菊花CmbHLH1可以通过上调缺铁反应基因的表达促进铁的吸收,ABA可能在其中发挥关键作用[19].
众所周知,Ib组bHLH蛋白bHLH38、bHLH39、bHLH100和bHLH101通过与fe - deficient INDUCED TRANSCRIPTION FACTOR (FIT) (bHLH29)相互作用参与铁稳态调控,其表达受铁饥饿的强烈诱导[20.].他们可以被AtMYC2[20.],在干旱胁迫下aba诱导的基因表达中起转录激活作用拟南芥[21].ABRE元件(脱落酸反应元件)通常存在于aba诱导基因的启动子区,在共表达基因的启动子中检测到AtbHLH039而且AtbHLH101[22].Kurt和Filiz还在bHLH38/39/100/101基因的启动子区发现了ABRE元件拟南芥、大米、大豆、西红柿和玉米[23].这些结果表明这些Ib组bHLH蛋白可能参与了aba反应通路。然而,目前尚不清楚它们是否参与了对其他非生物胁迫的反应,如干旱和盐度。
木本复活植物Myrothamnus flabellifoliaWelw。是世界上独一无二的矮灌木,生长在恶劣的岩石条件下[24,25].长期的进化,以及对极端干旱环境的强大适应能力,使得m . flabellifolia制定强有力的生存策略,包括发育良好的根系和从脱水中恢复的能力[26,27,28].根据之前的研究,有多种转录因子在脱水过程中参与转录调控网络m . flabellifolia,其中MfbHLH38在脱水处理初期明显上调[29].复活植物强大的抗逆性机制与其多种逆境基因是分不开的。在这项研究中,MfbHLH38克隆自m . flabellifolia.进行了序列分析和功能表征。确定了其增强抗旱性和耐盐性的作用,并初步探讨了其作用机制。
结果
克隆及序列分析MfbHLH38
采用PCR扩增法,得到了MfbHLH38是从m . flabellifolia.得到的序列长720 bp,编码239个氨基酸的蛋白质。的理论等电点MfbHLH38为8.84,预测分子质量为27.15 kDa。在硅预测中检测到一个典型的bHLH结构域和推定的“KKLNHNASERDRRKKIN”的二部核定位信号(NLS)。1a).对MfbHLH38和几种高度同源的bHLH蛋白的氨基酸进行多次比对,显示出一个保守的碱基区和一个HLH结构域(图2)。1a).我们进一步进行了系统发育分析,发现MfbHLH38与来自的VvORG2、PtORG2、HbORG2-like、JcORG2 (ORG2也称为bHLH38)、AtbHLH38同源性最强葡萄,杨树trichocarpa,橡胶树取代巴西橡胶树,麻风树,拟南芥,分别。(无花果。1b)。
多序列比对(一个)和系统发育分析(bMfbHLH38和几种高度同源的bHLH蛋白。黑色和灰色阴影分别表示相同和相似的氨基酸。虚线标记的氨基酸为推导出的NLS。基本区域由白色方框标记,曲线连接的黑色方框表示保守的HLH域。利用邻居连接方法进行系统发育重建。所使用序列的登录号如下:AtbHLH38 (AT3G56970.1)来自拟南芥;VvORG2 (RVW89141.1)从葡萄;PdbHLH (BBH07182.1)从李属dulcis;PpORG2 (XP_020423445.1)从碧桃;PyORG2-like (PQM37255.1)裸李;PaORG2-like (XP_021822000.1)李属鸟结核;TobHLH (PON88894.1)从东方Trema;PbbHLH (AMX27896.1)从Pyrus betulifolia;PcbHLH (AMX27897.1)从Pyrus calleryana;ZjORG2-like (XP_024922954.1)Ziziphus jujuba;HbORG2-like (XP_021669234.1)橡胶树取代巴西橡胶树;RcORG2-like (XP_024162921.1)罗莎对;PabHLH (PON38640.1)从Parasponia andersonii;ZjORG3-like (XP_015900576.1)Ziziphus jujuba;PtORG2 (XP_002307969.3)杨树trichocarpa;JcORG2 (XP_012072671.1)从麻风树;和PdORG2 (BBH07187.1)李属dulcis
MfbHLH38定位于细胞核
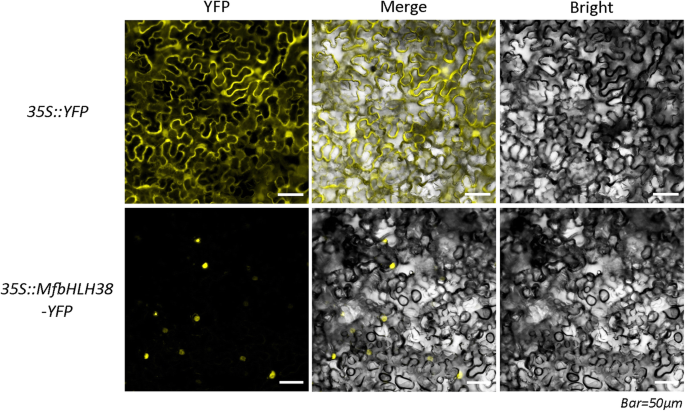
MfbHLH38预测的NLS(图2)。1A)暗示它可能在细胞核中起作用。为了证实这一推测,我们在烟草叶表皮细胞中进行了35S::MfbHLH38-YFP的瞬时表达。共聚焦显微镜观察表明,35S::YFP在整个细胞内均能检测到荧光,而35S:: MfbHLH38-YFP转化细胞的细胞核内特异性地出现了强烈的黄色荧光。这些结果证明MfbHLH38位于细胞核中(图2)。2).
OverexpressingMfbHLH38增加耐旱和耐盐性
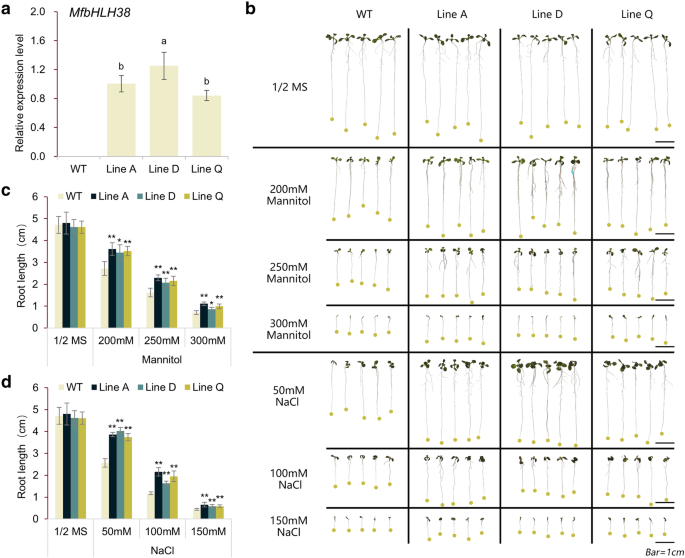
为了分析其在非生物胁迫下的潜在作用MfbHLH38被引入拟南芥由35S启动子驱动。T1转基因拟南芥过度表达的行MfbHLH38经卡那霉素耐药筛选获得3个纯合子T3.随机选择转基因株系用于进一步分析。qRT-PCR分析表明,该基因的表达水平MfbHLH38在3个转基因株系中均能检测到,其中系D的表达量显著高于其他2个株系(图2)。3.一个)。
以便验证是否MfbHLH38与耐干旱和耐盐胁迫有关,WT和转基因株系在苗期和成虫期均进行了胁迫处理。在苗期,正常条件下野生型和转基因植株之间没有显著差异(图2)。3.B).在甘露醇和盐处理下,转基因株系的根系显著延长。当使用中等浓度的甘露醇(250 mM)和NaCl (100 mM)时,这种差异更为明显。3.B, C和D)。与野生型相比,转基因株系的叶面积同样更大(图2)。3.B)。
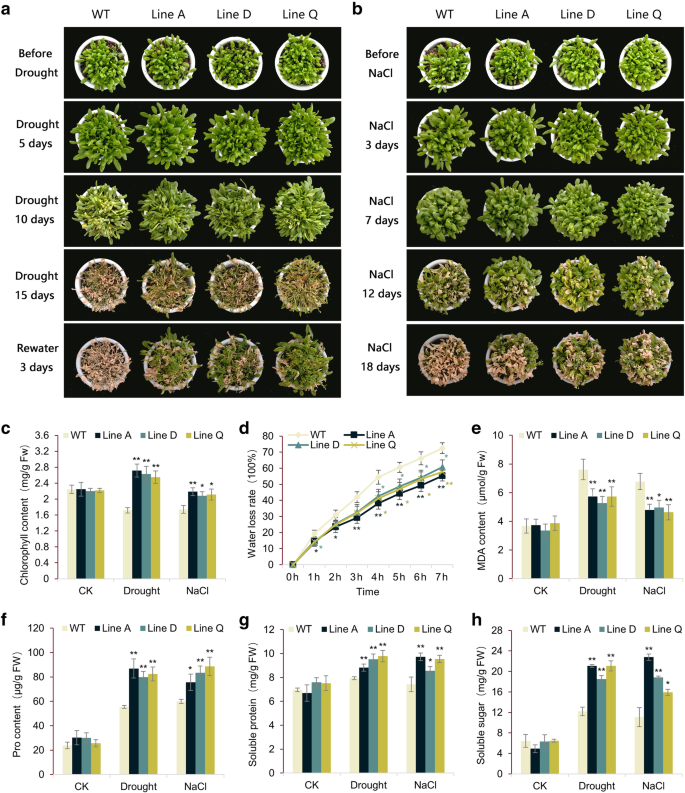
在成体阶段,对生长在土壤中的4周龄转基因和野生型植株进行自然干旱和300 mM NaCl处理。在两种处理前和处理初期,转基因和野生型植株的形态差异不显著(图2)。4).拒水10 d后,WT叶片的萎蔫程度显著高于转基因株系,叶片叶绿素含量是前者的1.48 ~ 1.58倍(图2)。4a, c).在15 DAW时,野生型植株叶片基本枯萎,而转基因植株有相当数量的叶片保持浅绿色(图。4a).重新浇水3天后,转基因植株部分恢复,但WT植株几乎全部死亡(图2)。4一个)。
盐胁迫对植物生长有负面影响,在盐处理7天左右可见(图2)。4B),叶片叶绿素含量MfbHLH38转基因株系比野生型株系高1.20 ~ 1.26倍(图;4c).盐度胁迫后12天,WT植株比转基因植株出现更多枯萎叶片。18天后,大约1/3以上的转基因植株保持绿色并开花,而WT的几乎所有叶片都枯萎了(图2)。4b)。
测定了离体叶片脱水过程中的动态失水速率。如图所示。4d时,除0 h外,转基因植株的WLR均显著低于WT,说明转基因植株的WLR过表达MfbHLH38减缓了水分流失。丙二醛(Malondialdehyde, MDA)对植物细胞膜具有严重的损伤作用,其积累程度通常被认为是膜脂过氧化的一个指标。在我们的实验中,虽然干旱和盐处理都提高了野生型和转基因植株的MDA含量,但与野生型相比,MDA含量明显降低(图2)。4e)。
比较了转基因和野生型植株处理前后脯氨酸、可溶性蛋白和可溶性糖等几种渗透调节物质的含量。结果显示,干旱胁迫和盐胁迫均能促进野生型和转基因株系的渗透液积累,但干旱胁迫和盐胁迫后的渗透液积累明显高于前者(图2)。4f-h)。
的影响MfbHLH38抗氧化代谢的过表达
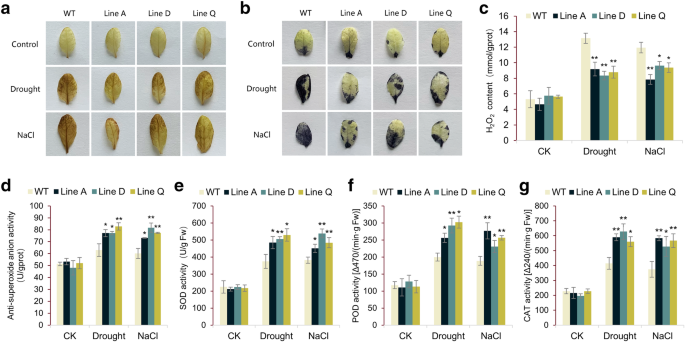
众所周知,植物在遭受非生物胁迫时,脂质过氧化物的升高会加剧细胞氧化损伤。这是由于ROS(活性氧化物质)的过度积累,如过氧化氢(H2O2)和超氧阴离子自由基(O2−).我们用3,3 ' -二氨基联苯胺(DAB)和硝基蓝四唑(NBT)进行组织化学染色,评估干旱和盐处理后细胞ROS含量。与转基因植株相比,WT叶片染色颜色更深,面积更大(图2)。5A和b),表明转基因株系发生了轻微的细胞氧化损伤。一致地,H更少2O2在3个转基因株系中检测到较高的抗超氧阴离子活性。5C和d)。
此外,我们还测定了参与ROS清除的关键酶——超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)的活性。随着ROS水平的升高,干旱和盐处理均显著提高了野生型和转基因植株的SOD、POD和CAT活性。然而,转基因植物的酶活性明显高于WT(图2)。6E-g),表示的过度表达MfbHLH38可以通过增加ROS清除能力来减少应激条件下的细胞氧化损伤。
MfbHLH38促进气孔关闭和内源ABA的生物合成
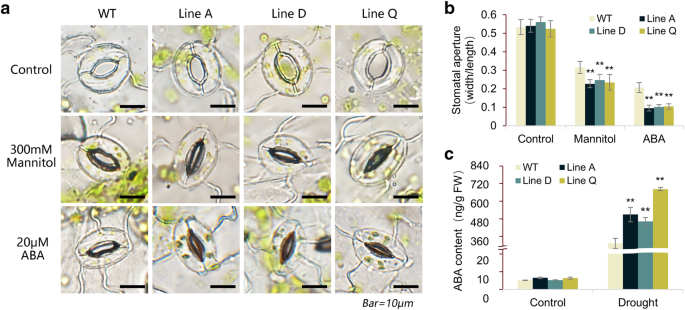
aba介导的气孔运动在水分胁迫下的蒸腾作用中起着核心作用。在300 mM甘露醇和20 μM ABA处理下,研究了气孔闭合情况。在正常条件下,野生型和转基因株系的大部分气孔都是开放的(图2)。6a),转基因植株与野生型植株气孔孔径(宽长比)差异显著(图;6b).甘露醇和ABA处理使3个转基因株系的气孔孔径分别降低至0.23 ~ 0.25和0.09 ~ 0.10,显著低于野生型株系(0.32和0.21)(图2)。6b).这些结果表明MfbHLH38促进了甘露醇和ABA对气孔关闭的响应。我们还测定了干旱胁迫下ABA的含量。干旱处理后,野生型和转基因株系ABA的积累显著增加,但3个转基因株系的ABA含量是野生型的1.48 ~ 2.18倍(图2)。6c).该结果表明MfbHLH38促进干旱条件下ABA的合成。
过度的MfbHLH38aba反应基因表达水平上调
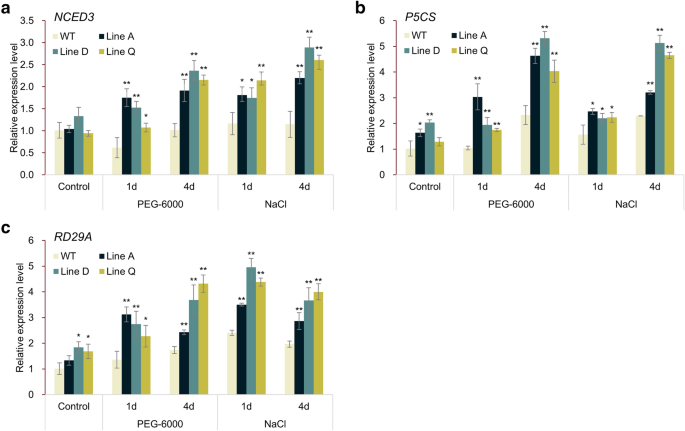
目的:探讨植物抗旱耐盐能力增强的分子机制MfbHLH38在人工模拟干旱处理(10% PEG-6000)和盐处理(300 mM NaCl)下,分别测定了胁迫诱导和aba反应基因的表达量。如图所示。7A,相似的表达水平NCED3在处理前WT和转基因株系中均发现了。处理后,3个转基因株系的表达量均比野生型提高更快、更高P5CS而且RD29A在处理前,转基因株系的表达水平略高(图;7b和c)。在干旱处理下,P5CS而且RD29A在MfbHLH38-过表达株系显著增加,且显著高于WT株系。在盐度胁迫下,表达水平P5CS而且RD29A显示了类似的趋势NCED3.所有这些结果都表明MfbHLH38正调节aba反应基因的表达拟南芥直接或间接地。
讨论
植物的抗逆性依赖于逆境基因,这些基因的过表达可以提高植物对各种环境胁迫的适应能力[30.].的功能bHLH38应力耐受性尚未被开发,尽管它在维持细胞铁稳态中的作用已被广泛研究。在本研究中,我们进行了分离和鉴定MfbHLH38从m . flabellifolia。它包含高度保守的bHLH结构域(图。1a),与VvORG2同源性高(葡萄), PtORG2 (杨树trichocarpa), HbORG2-like (橡胶树取代巴西橡胶树)和JcORG2 (麻风树)(图。1b)。
进一步的调查表明,过度表达MfbHLH38在拟南芥使其具有较好的耐旱耐盐性,表现为生长势较好MfbHLH38-在胁迫处理和苗期或成虫期过度表达的植物(图2)。3.b,4a)和b).转基因植物对干旱和盐度胁迫的适应性增强与外部形态和生化水平同时发生的适应性变化密不可分。
植物可以通过发育良好的根系从深层土壤中汲取水分,从而提高干旱条件下有限用水的效率[31].在幼苗胁迫测定中,MfbHLH38转基因株系表现出较强的生长和较长的主根(图2)。3.c和d).此外,植物可以通过促进气孔关闭来减少干旱条件下的水分损失,aba调节的气孔运动使植物能够提高保水能力。年气孔孔径明显减小PebHLH35-overexpressing拟南芥随着干旱程度的增加,表明PebHLH35过表达转基因植物对干旱胁迫具有良好的耐受性[32].在本研究中,气孔运动MfbHLH38过表达系对甘露醇处理和外源ABA更敏感。6a, b),且失水速率显著降低(图。4d).这些结果表明MfbHLH38能增强水分的吸收和保留,从而在胁迫处理下提供更好的水分利用条件。
植物在胁迫下可以产生渗透调节物质,包括脯氨酸、可溶性蛋白质和可溶性糖。这些渗透调节剂的积累可以通过维持渗透平衡来帮助植物抵抗环境胁迫[33,34].Yang等发现,在干旱和盐度胁迫处理后,叶片脯氨酸和可溶性糖含量显著降低TabHLH1转基因拟南芥增加,且显著高于WT植物[35].我们的数据表明,在干旱和盐度胁迫下,这三种渗透调节物质的含量明显增加。4f-h)。这一结果也得到了较高表达水平的P5CS与野生型植物相比,三个转基因株系在胁迫下因此,MfbHLH38可能直接或间接参与渗透调节。
MDA含量是通过反映植物膜脂过氧化水平来衡量氧化应激程度的指标[36].在本研究中,检测到较少的MDA积累MfbHLH38转基因株系(图;4E),暗示过度表达MfbHLH38在干旱和盐度条件下能维持膜脂结构的稳定。ROS在植物细胞中的积累,如过氧化氢(H2O2)和超氧阴离子(O2−),在干旱和盐胁迫的推动下,会对植物造成不可逆转的损害[37,38].DAB和NBT组织化学染色结果及H2O2含量及抗超氧阴离子活性MfbHLH38在干旱和盐度胁迫下,转基因株系的ROS积累增加较少。5模拟)。抗氧化酶在减轻干旱和盐胁迫对植物的氧化损伤方面具有重要作用[39].与低ROS积累一致,过表达MfbHLH38在应激条件下,显著提高了抗氧化酶,SOD, CAT和POD的活性(图。5E-g),表示MfbHLH38能增强ROS清除系统,减轻应激下的氧化损伤。
ABA作为一种重要的植物激素,参与植物的多种发育过程和胁迫信号转导机制[40].据报道,几种bHLH转录因子可诱导ABA生物合成,并参与胁迫耐受。例如,葡萄VvbHLH1对转基因具有很强的耐受性拟南芥增加ABA水平对干旱胁迫的影响[18].在本研究中,在干旱处理下,三个转基因株系的ABA含量明显高于WT(图2)。6c).这是明显的过度表达MfbHLH38促进ABA生物合成,这解释了胁迫处理促进气孔关闭以及ABA生物合成基因表达水平升高NCED3ABA和应激反应基因P5CS而且RD29A(无花果。7).这些结果表明MfbHLH38可能通过aba依赖通路在植物防御中起积极作用。
bHLH38在缺铁中起正向调节作用[41].在本研究中,我们证明了MfbHLH38也正调控干旱和盐胁迫反应。这一结果表明MfbHLH38可能介导铁缺乏调节和其他非生物应激反应之间的串扰[42].由于铁作用于某些抗氧化酶的特定活性位点,如SOD、POD和CAT [43), overexpressingMfbHLH38可能有助于通过促进铁的吸收来保持或增加抗氧化酶的活性。此外,铁(Fe)在叶绿素生物合成和光合作用中起着重要作用。然而,水分缺乏影响养分向根系的运输和养分利用率,如微量元素Fe [44,45].高浓度的钠还会干扰铁和其他矿物元素的吸收和转运[46,47].而胁迫引发的缺铁会进一步对叶绿素造成破坏,从而严重干扰其所参与的光合作用过程[48].Babaeian等在干旱条件下对向日葵花期和灌浆期叶片施用铁肥,检测到比对照植物更高的叶绿素荧光(FV/FM)和叶绿素含量,证明在干旱胁迫下Fe有助于改善光合作用[49].因此,有可能过度表达MfbHLH38MfbHLH38可以促进胁迫条件下Fe的吸收,减缓叶绿素的损伤及其生物合成,从而保证植物比WT更好的生长。但MfbHLH38在非生物胁迫响应调控中的确切机制有待进一步研究。
结论
本研究报告的特征MfbHLH38编码一种与AtbHLH38同源的bHLH转录因子。我们证明了MfbHLH38在拟南芥通过增强其保水能力、调节渗透平衡、强化胁迫诱导的氧化清除系统等途径增强其抗旱性和耐盐性,并可能参与了aba依赖的胁迫响应通路。这是bHLH38参与干旱和盐胁迫调节的首次报道。MfbHLH38在提高植物抗旱耐盐性方面具有潜在的应用价值。这将有助于进一步探索动物生存的分子机制m . flabellifoli来自干燥环境。
方法
植物材料和生长条件
的m . flabellifolia最初由Matthew Opel博士(University
康涅狄格)。m . flabellifolia最早由Welwitsch记录并命名[50].本种的一个代金券标本可以在国家自然历史博物馆(美国华盛顿特区西北第10街和宪法大道)的植物学收藏(美国目录编号:: 2921412条形码:00072109)。本研究中使用的植物是在22°C/18°C、60%相对空气湿度和充足光照的条件下,在12小时光照/12小时黑暗的塑料盆中种植的。
的种子拟南芥生态型哥伦比亚(野生型,WT)和过表达系用稀释漂白剂消毒5min,用消毒去离子水冲洗3次。将灭菌后的种子置于含有0.7% (w/v)琼脂和2% (w/v)蔗糖的1/2倍Murashige和Skoog (MS)培养基上,调整pH为5.8 ~ 6.0。在4°C下春化2天后,将培养基板置于光照培养箱中约10天。将幼苗移栽到生长室中以土壤和蛭石(1:1)为栽培基质的花盆中,在长昼(光照16 h /暗8 h, 24°C/22°C)和75%左右相对湿度条件下生长4周后进行胁迫处理。
克隆及序列分析MfbHLH38
用植物总RNA分离试剂盒(TINAGENE Co., Beijing, China)从新鲜叶片中提取总RNA。根据试剂盒提供的方案,使用逆转录酶M-MLV (RNaseH-) (Takara Bio, Dalian, China)进行第一链cDNA合成。的编码序列(CDS)MfbHLH38采用Phanta Max超保真DNA聚合酶(Vazyme Biotech Co.,南京,中国)PCR扩增,引物为5 ' -TCCCCCGGG atgctagctcttatctccttt -3 ' (SmaІ网站有下划线)和5 ' -GACTAGTTCATACGATGATGGTACGTA-3 ' (SpeI网站有下划线)。目标扩增片段从凝胶中回收,并连接到pasy - t1简单载体上(TransGen Biotech,北京,中国)。得到的结构体pasy - t1 - mfbhlh38被转化为大肠杆菌菌株DH5α和推测的阳性克隆经Sanger测序(青岛生物科技有限公司,北京,中国)确认。
开放阅读框(ORF)由NCBI的ORFfinder检测(https://www.ncbi.nlm.nih.gov/orffinder/).等电点(pI)和分子量用ExPASy (https://web.expasy.org/compute_pi/).聪明的(http://smart.embl-heidelberg.de/)用于分析推导出的蛋白序列中潜在的保守结构域。利用BLASTP (https://blast.ncbi.nlm.nih.gov/Blast.cgi)。使用MEGA 7.0进行多个比对和后续的系统发育分析[51]采用近邻连接法,并进行1000个重复的自举试验。用Jpred 4 (http://www.compbio.dundee.ac.uk/jpred/index.html).
MfbHLH38的亚细胞定位
没有终止密码子的完整ORFMfbHLH38引物包含连接位点侧面5 ' -ACCAGTCTCTCTCTCaagcttatgtagctctactatctccttt−3 ' (后ІІІ站点下划线)和反向,5 ' -GCTCACCATACTAGTGgatcctacgatgatgatggtacgta−3 ' (BamHІ站点下划线)。放大的片段被双消化BamHІ和后ІІІ,插入pHB-YFP载体中形成表达构建物MfbHLH38-YFP,与CaMV(花椰菜花叶病毒)35S启动子驱动的编码黄色荧光蛋白(YFP)基因融合。35S::MfbHLH38-YFP和35S::YFP均转化为根癌土壤杆菌应变GV3101分别采用冻融法。四周生的叶子(烟草benthamiana)野生型烟草注射农。所有转化后的烟草植株在22°C的黑暗环境中生长16小时,然后移至正常条件下生长2天,然后用激光共聚焦扫描显微镜观察YFP (Nikon, Tokyo, Japan)。
拟南芥质粒构建转化
的完整编码区域MfbHLH38是否使用基因特异性引物进行扩增SmaІ或Spe我限制网站。将扩增子双酶切后连接到相应位点pGSA-1403,构建物35S::pGSA1403-MfbHLH38农菌株LBA4404,再转化为拟南芥利用花浸变换方法[52].T0种子在加卡那霉素(50 μg/ml)的1/2 MS培养基上筛选。将耐卡那霉素的幼苗移栽到有土壤的花盆中,通过PCR进一步验证转基因阳性植株。3个纯合子阳性系(T3.)进行进一步实验。
表达分析MfbHLH38和aba反应基因
4周龄的幼苗分别在正常条件下,模拟干旱(10% PEG-6000)和盐处理(300 mM NaCl) 1天和4天。以处理1天和4天植株相同位置的叶片为样本,进行表达水平分析。按照上述步骤提取总RNA和合成第一链cDNA。2 × Taq SYBR Green qPCR Mix 12.5 μl,每个引物0.5 μl (10 μM),稀释的cDNA 4 μl, Nuclease-free H 7.5 μl组成25 μl反应液(Innovagene Biotech)2O. PCR采用CFX Connect荧光定量PCR仪(Bio-Rad, Hercules, CA, USA),扩增条件为:94°C for 5 min, 42个循环,94°C for 8 s, 60°C for 60s。的AtActin2作为内参,用2−ΔΔCT方法。每个qRT-PCR实验至少进行三次技术和生物学重复。所用引物MfbHLH38, 5 ' - TCGGAGAGAGGAAAACAAGC−3 '(正向)和5 ' - TTTTCCTTCACCCCAGACAC−3 '(反向);NCED3, 5 ' - CGAGCCGTGGCCTAAAGTCT−3 '(正向)和5 ' - GCTCCGATGAATGTACCGTGAA−3 '(反向);P5CS, 5 ' - GGTGGACCAAGGGCAAGTAAGATA−3 '(正向)和5 ' - TCGGAAACCATCTGAGAATCTTGT−3 '(反向);RD29A, 5 ' - GATAACGTTGGAGGAAGAGTCGG−3 '(正向)和5 ' - TCCTGATTCACCTGGAAATTTCG−3 '(反向);而且AtActin2, 5 ' - GGAAGGATCTGTACGGTAAC−3 '(正向)和5 ' - TGTGAACGATTCCTGGACCT−3 '(反向)。
抗旱耐盐性分析
在苗期胁迫试验中,无菌种子置于1/2 MS的甘露醇(0-300 mM)和NaCl (0-150 mM)浓度不同的固体培养基上。培养皿垂直沉淀,并在光(24°C)/暗(22°C)的16小时/8小时的循环中孵育。9天后,测量每个样品的主根长度(每个培养皿每系15苗)。每个试验分为3个重复。
为探索成熟植株的耐旱性和耐盐性,将充分浸水后的培养基质平均分成每盆。在常规栽培条件下,将每系经春化(4°C, 2天)的种子大约50粒播种到盆中。对4周龄植株进行干旱和盐胁迫处理。对于干旱处理,每盆先充分灌溉,以保证饱和含水量。对于干旱处理,立即停止浇水,持续15天,然后再浇水。在盐处理中,用300 mM的NaCl溶液灌溉植物,间隔3天两次。每两到三天对所有植物进行一次拍照。生理指标测定样品分别通过干燥处理(不浇水)10天和盐处理(300 mM NaCl) 7天获得。
估计失水率
用四周生的植株来估算水分失失率。在室温(~ 25°C)和60%相对湿度的实验台上,从5株以上相同状态的植株中切除约0.5 g叶片,放在滤纸上。在设计的时间点对叶片进行加权。然后计算失水率,每条水系重复3次。
测量与耐受力有关的生理指标
叶绿素根据前面描述的程序提取[53].采用改进的酸性茚三酮法测定脯氨酸含量[54].可溶性蛋白和可溶性糖含量分别采用TP定量检测试剂盒(南京建成)和植物可溶性糖含量检测试剂盒(南京建成)测定。用3,3 ' -二氨基联苯胺(DAB)和硝基蓝四唑(NBT)染色观察累积的过氧化氢(H2O2)和超氧阴离子自由基(O2−),在胁迫处理后的叶片中分别增加[50].H2O2采用过氧化氢测定试剂盒(南京建成)和抑制及产生超氧阴离子测定试剂盒(南京建成)分别测定其含量和抗超氧阴离子活性。超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)活性及丙二醛(MDA)含量评价如前所述[55,56].试验均设3个重复。
气孔孔径与内源ABA含量分析
为了测量甘露醇和ABA对叶片气孔运动的影响,将4周龄WT和转基因株系的莲叶漂浮在50mm KCl和0.1 mM CaCl溶液上2, 10 mM MES, pH 6.15)光照2.5 h诱导气孔张开。然后,将这些叶片分别转移到不含300 mM甘露醇或20 μM ABA的开放溶液中,并在生长培养箱中进一步处理2 h [57,58,59].立即用光学显微镜观察并拍摄了叶片下表皮层的气孔(DP80, Olympus, Japan)。对每一株系60个以上气孔的宽度、长度及其比值(气孔孔径)进行了测定和计算。所有实验均重复3次。
内源性ABA含量用MetWare (http://www.metware.cn/AB Sciex QTRAP 6500 LC-MS/MS平台。简单地说,用1 ml甲酸/水/甲醇(0.5:2:7 5,V/V/V)提取4周龄WT和转基因植株叶片50 mg。提取液在氮气中蒸发干燥,用0.1 ml 80%甲醇(V/V)重组,过滤检测。进行3次生物重复。
统计分析
本研究产生的数据采用SPSS 23.0独立样本t检验进行分析,以三个重复的均数±标准差(SD)表示,差异显著性用* (P< 0.05)和** (P< 0.01)。
数据和材料的可用性
的序列MfbLHL38已存入NCBI GenBank,登录号为。MT383747 (https://www.ncbi.nlm.nih.gov/nuccore/MT383747.1/).在这项研究中产生或分析的所有其他数据都包含在这篇发表的文章中。
缩写
- TFs:
-
转录因子
- 阿坝:
-
脱落酸
- YFP:
-
黄色荧光蛋白
- 存在:
-
实时定量PCR
- WT:
-
野生型
- MDA:
-
丙二醛
- ROS:
-
活性氧
- H2O2:
-
过氧化氢
- O2−:
-
超氧阴离子自由基
- SOD:
-
超氧化物歧化酶
- 圆荚体:
-
过氧化物酶
- 猫:
-
过氧化氢酶
参考文献
- 1.
杨晓明,李志强,李志强,等。工程植物抗非生物胁迫的研究进展。生物技术。2005;16:123-32。
- 2.
李文杰,李文杰,李文杰,李文杰。ABA感知与信号传递。植物科学进展,2010;15:395-401。
- 3.
李文杰,李志强,李志强,等。MAPK模块和ABA在非生物胁迫信号通路中的作用。植物科学进展(英文版);2016;
- 4.
Mehrotra R, Bhalothia P, Bansal P, Basantani MK, Bharti V, Mehrotra S.脱落酸和非生物胁迫耐受性-不同的调节层。中国生物医学工程学报,2014;
- 5.
植物转录因子与ABA依赖和独立的非生物胁迫信号传递。生物植物。2010;54:201-12。
- 6.
杨晓明,杨晓明,杨晓明,等。赤霉素和脱落酸对种子萌发和非生物胁迫的调控。9.前沿植物科学,2018;https://doi.org/10.3389/fpls.2018.00838.
- 7.
王志刚,王志刚。植物基-螺旋-环-螺旋蛋白的来源和多样性。分子生物学杂志,2010;27:862-74。
- 8.
Ludwig SR, Habera LF, Dellaporta SL, Wessler SR. Lc是玉米R基因家族的成员,负责组织特异性花青素的生产,编码一种类似于转录激活剂的蛋白质,并包含myc同源区。《美国国家科学院学报》上。1989; 86:7092-6。
- 9.
贝利PC,马丁C,托莱多-奥尔蒂斯G, Quail PH,胡克E,海姆MA,等。拟南芥基本螺旋-环-螺旋转录因子基因家族的研究进展。《植物科学》2003;15:497 - 502。
- 10.
卡雷特罗-保莱特L,加尔斯特安A,罗伊-维拉诺瓦I, Martínez-García JF,毕尔巴鄂-卡斯特罗JR,罗伯逊DL。拟南芥、杨树、水稻、苔藓和藻类植物bHLH家族转录因子的全基因组分类和进化分析[W]。植物科学进展。2010;
- 11.
Atchley WR, Terhalle W, Dress A. bHLH蛋白结构域的位置依赖、派系和预测基基。中华药理学杂志,1999;26(3):344 - 344。
- 12.
Nesi N, Debeaujon I, Jond C, Pelletier G, Caboche M, Lepiniec L. TT8基因编码了拟南芥DFR和BAN基因表达所需的基本螺旋-环-螺旋结构域蛋白。《植物细胞》2000;12:1863-78。
- 13.
tolido - ortiz G, Huq E, Quail PH.拟南芥基本/螺旋-环-螺旋转录因子家族。《植物科学》2003;15:1749-70。
- 14.
高超,孙杰,王超,董勇,肖松,王旭,等。花生基本/螺旋-环-螺旋基因家族的全基因组分析及其在荚果发育中的作用评价12.公共科学图书馆,2017;https://doi.org/10.1371/journal.pone.0181843.
- 15.
蒋艳,杨波,戴宏明。拟南芥bHLH92转录因子在非生物胁迫下的功能表征。基因工程学报。2009;282:503-16
- 16.
刘伟,邰华,李松,高伟,赵敏,谢超,等。bHLH122在拟南芥抗旱、抗渗透胁迫及ABA分解代谢抑制中起重要作用。新植物,2014;201:1192-204。
- 17.
abitha KC, Ramu SV, Pruthvi V, Mahesh P, Nataraja KN, Udayakumar M.拟南芥AtbHLH17和WRKY28的共表达对非生物胁迫的抗性转基因res 2013; 22:327-41。
- 18.
王峰,朱华,陈东,李忠,彭荣,姚强。葡萄bHLH转录因子基因VvbHLH1在转基因拟南芥中增加黄酮类化合物的积累,增强耐盐和耐旱性。植物细胞组织器官,2016;125:387-98。
- 19.
赵敏,宋安,李萍,陈松,姜娟,陈峰。一种bHLH转录因子对菊花缺铁条件下铁摄入量的调控。科学通报2014;4:6694。
- 20.
崔勇,陈昌林,崔明,周文杰,吴海林,凌海强。四种IVa bHLH转录因子是拟南芥FIT和JA抑制铁吸收的新相互作用因子。植物学报。2018;11:11 - 83。
- 21.
Abe H, Urao T, Ito T, Seki M, Shinozaki K, Yamaguchi-Shinozaki K.拟南芥AtMYC2 (bHLH)和AtMYB2 (MYB)作为脱落酸信号的转录激活因子。《植物科学》2003;15:63-78。
- 22.
李华,王林,杨志明。共表达分析揭示了一组可能参与调节植物对缺铁反应的基因。基因。2015;554:16-24。
- 23.
Kurt F, Filiz E.拟南芥、番茄、水稻、大豆和玉米中bHLH38、bHLH39、bHLH100和bHLH101基因的全基因组和比较分析:铁(Fe)稳态的洞见。Biometals。2018;31:489 - 504。
- 24.
Moore JP, Farrant JM, Lindsey GG, Brandt WF。复活植物Myrothamnus flabellifolius的南非和纳米比亚种群在基因上是不同的,并在其加洛酰奎尼酸组成中显示变异。化学工程学报,2005;31(2):323 - 334。
- 25.
Moore JP, Lindsey GG, Farrant JM, Brandt WF。耐干燥复活植物白桃的生物学研究综述。杨晓明。2007;29(1):1 - 7。
- 26.
他们JM。三种被子植物复活植物抗旱机制的比较。植物生态学报2000;151:29-39。
- 27.
Moore JP, Nguema-Ona E, Chevalier L, Lindsey GG, Brandt WF, Lerouge P,等。复活植物厚叶细胞壁对干燥的响应。植物物理学报。2006;41:651 - 62。
- 28.
杨晓明,李志强,李志强,等。耐干燥被子植物白杨叶的边缘和层状水鞘结构。植物区系、分布、功能与生态学报。2009;
- 29.
马超,王华,Macnish AJ, Estrada-Melo AC,林杰,常勇,等。转录组分析显示,复活植物白骨木(Myrothamnus flabellifolia)中有多种不同的蛋白激酶和转录因子参与抗旱性。Hortic Res. 2015; 2:1-12。
- 30.
张磊,程杰,孙鑫,赵涛,李敏,王强,等。过表达VaWRKY14通过调节胁迫相关基因的表达提高拟南芥的耐旱性。植物细胞报告2018;37:1159-72。
- 31.
马丽丽,马丽丽,马丽丽,等。在荒漠耕作条件下,通过根系选择了一种抗旱促进微生物群。7.公共科学图书馆,2012;https://doi.org/10.1371/journal.pone.0048479.
- 32.
董勇,王超,韩旭,唐松,刘松,夏霞,等。来自胡杨(Populus euphratica)的一种新的bHLH转录因子PebHLH35通过调控气孔发育、光合作用和拟南芥的生长而赋予其耐旱性。生物化学与生物物理学报。2014;450:453-8。
- 33.
王永强,王永强,王永强。非生物胁迫诱导光抑制过程中光合作用的调节。植物学报。2015;8:1304-20。
- 34.
李志强,李志强,李志强,等。甜菜碱和脯氨酸在提高植物非生物抗逆性中的作用。环境实验机器人,2007;59:206-16。
- 35.
杨涛,姚树山,郝玲,赵艳,陆伟,肖凯。小麦bhlh型转录因子基因TabHLH1通过调节aba相关通路介导渗透胁迫耐受性。植物细胞代表2016;35:2309-23。
- 36.
杨晓明,李志强,张晓明,等。植物组织中丙二醛含量的测定方法。《肛肠生物化学》,2006;347:201-7。
- 37.
克拉森斯基,乔克。干旱、盐和温度胁迫诱导的代谢重排和调节网络。中国科学(d辑),2012;
- 38.
杨晓明,张志刚,张晓明,等。盐生植物抗盐胁迫下ROS稳态的研究进展。中国科学(d辑),2014;
- 39.
Chawla S, Jain S, Jain V.盐诱导耐盐和盐敏水稻品种的氧化应激和抗氧化系统。植物生物化学学报。2013;22:27-34。
- 40.
Cutler SR, Rodriguez PL, Finkelstein RR, Abrams SR.脱落酸:核心信号网络的出现。植物学报,2010;
- 41.
王海燕,Klatte M, Jakoby M, Bäumlein H, Weisshaar B, Bauer P.拟南芥4个Ib亚群BHLH基因缺铁介导的胁迫调控。足底。2007;226:897 - 908。
- 42.
Tripathi DK, Singh S, Gaur S, Singh S, Yadav V, Liu S,等。高等植物铁的获取和稳态及其在非生物胁迫耐受中的可能作用。4 .环境科学学报,2018;https://doi.org/10.3389/fenvs.2017.00086.
- 43.
Scandalios詹。植物抗氧化防御基因对环境胁迫的响应进:斯坎达里奥斯JG,编辑。遗传学进展:学术出版社;1990.1-41页。https://doi.org/10.1016/s0065 - 2660 (08) 60522 - 2.
- 44.
古内斯A,奇切克N,伊纳尔A,阿尔帕斯兰M,埃拉斯兰F,古内利E,等。鹰嘴豆的基因型反应(中投arietinumL.)品种在花前和花后对干旱胁迫的响应及其与养分吸收和效率的关系。植物土壤环境。2011;52(8):368-76。
- 45.
沙玛拉,马伦,夏安齐奥。干旱胁迫下大豆种子大小分布及矿质养分的响应。植物营养学报。2004;27:15 - 35。
- 46.
朱镕基j - k。植物耐盐性。植物科学进展2001;6:66-71。
- 47.
徐文峰,史文敏。通过实时RT-PCR分析幼年番茄(Solanum lycopersicum)根系14-3-3基因家族对盐胁迫和钾铁缺乏的响应。Ann Bot. 2006; 98:965-74。
- 48.
普什尼克,米勒GW,曼韦林JH。铁在高等植物叶绿素生物合成、维持和叶绿体生物发生中的作用。植物学报,1984;7:733-58。
- 49.
Babaeian M, Piri I, Tavassoli A, Esmaeilian Y, Gholami H.水分胁迫和微量元素(Fe、Zn、Mn)对锡斯坦地区向日葵叶绿素荧光、叶绿素含量和养分吸收的影响Afr J agricultural Res. 2011; 6:3526-31。
- 50.
傅瑞杰,王志强,王志强。植物叶片光氧化胁迫的研究进展。中国科学(d辑),2002;
- 51.
Kumar S, Stecher G, Tamura K. MEGA7:更大数据集的分子进化遗传学分析版本7.0。Mol Biol Evol 2016; 33:19 70 - 4。
- 52.
刘志刚,张志刚,张志刚。拟南芥农杆菌介导转化的一种简化方法。植物学报(英文版);1998;
- 53.
Palta JP。叶片叶绿素含量。遥感Rev. 1990; 5:207-13。
- 54.
Bates LS, Waldren RP, Teare ID。水分胁迫研究中游离脯氨酸的快速测定。植物土壤。1973;39:205-7。
- 55.
郑欣,田松,孟x,李波。室温贮藏过程中草酸处理对桃果生理生化的响应。食品化学。2007;104:156-62。
- 56.
张元,王志刚。改良硫代巴比妥酸法测定富糖植物组织提取物中的脂质氧化。农业化学学报,1992;40:1566-70。
- 57.
赵颖,刘敏,何玲,李霞,王峰,闫波,等。玉米细胞质NAD+依赖的GPDH (ZmGPDH1)参与耐盐和耐渗透胁迫。BMC植物生物学2019;19:16。
- 58.
林川川,朴c,金金华,朱华,洪E,李sc .辣椒泛素E3连接酶CaREL1通过aba信号通路调控抗旱性。科学通报2017;7:477。
- 59.
蒋淑春,梅超,梁松,余玉涛,卢凯,吴震,等。拟南芥五肽重复蛋白SOAR1在干旱、盐和冷胁迫响应中的关键作用植物分子生物学杂志,2015;
致谢
不适用。
资金
本研究由四川省科技厅国际合作项目(2018HH0078)和四川农业大学双智计划资助。资助者在研究设计、数据收集、分析和解释中没有任何作用,也没有参与报告的撰写或文章发表的决定。
作者信息
从属关系
贡献
实验概念和设计,ZH和CZJ;融资收购,ZH;调查,JRQ, ZH, XYX, WXX, JTW, JC, YX, LS, SZC, LXS;数据分析:JRQ、ZH、XL、JM资源、CZJ;ZH项目管理与监理;文稿起草,JRQ;手稿修订:JRQ, ZH, CZJ。所有作者都同意了最终的手稿。
相应的作者
道德声明
伦理批准并同意参与
不适用。
发表同意书
不适用。
相互竞争的利益
作者宣称他们之间没有利益冲突。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
邱小,黄中,向,XY。et al。MfbHLH38,Myrothamnus flabellifoliabHLH转录因子,赋予植物对干旱和盐胁迫的耐受性拟南芥.BMC植物生物学20.542(2020)。https://doi.org/10.1186/s12870-020-02732-6
收到了:
接受:
发表:
关键字
- bHLH转录因子
- 非生物耐受力
- 脱落酸
- Myrothamnus flabellifolia