- 研究文章gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
通过对形态生理反应、体内平衡和转录组分析的综合分析,揭示了异体四倍体油菜籽对盐度的系统性抗性gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba20.gydF4y2Ba文章编号:gydF4y2Ba534gydF4y2Ba(gydF4y2Ba2020gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
在世界范围内,盐度严重抑制作物生长、产量和质量。异源四倍体油菜籽(gydF4y2Ba芸苔属植物显著gydF4y2BaL.)是一种主要的糖类油料作物,易受盐度影响。了解油菜籽抗盐的生理和分子策略,是开发高抗盐品种的有效策略。gydF4y2Ba
结果gydF4y2Ba
首先,在高盐度条件下发现了油菜叶片的早期衰老和根系生长受到抑制。电镜分析表明,在200mm NaCl处理下,叶片毛状体和气孔减少,胞浆裂解和叶绿体降解减少。初级和次级代谢产物分析表明,盐胁迫导致花青素、渗透调节物质、脱落酸、茉莉酸、果胶、纤维素、活性氧和抗氧化活性明显增加,光合色素、吲哚乙酸、细胞分裂素、赤霉素和木质素显著降低。ICP-MS辅助离子组学结果表明,盐度显著抑制了氮、磷、钾、钙、镁、铁、锰、铜、锌、硼等必需元素的吸收,并诱发了钠钾比的升高。全基因组转录组分析表明,差异表达基因主要参与光合作用、刺激反应、激素信号的生物合成/转导和盐胁迫下营养物质的转运。gydF4y2Ba
结论gydF4y2Ba
高分辨率的盐反应基因表达谱有助于高效地鉴定调控植物耐盐性的中心成员。这些研究结果可提高对盐胁迫的形态生理和分子响应的综合综合认识,为耐盐作物品种的遗传改造提供优良的遗传资源。gydF4y2Ba
背景gydF4y2Ba
土壤盐渍化是世界范围内农业作物高产优质的严重限制因素[gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba].据认为,约50%的耕地受到盐度的不利影响,而且由于全球极端气候的出现和过度使用高盐灌溉水,这一比例估计将继续增加[gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4gydF4y2Ba,gydF4y2Ba5gydF4y2Ba].土壤盐分通过两阶段生理功能障碍抑制作物生长和发育,进而降低产量:(i)渗透胁迫降低水势(ii)离子毒性扰乱离子稳态[gydF4y2Ba6gydF4y2Ba].这些应激与多种生物过程的紊乱有关,包括细胞内稳态失衡、氧化应激、必需营养功能障碍、蛋白质合成中断、器官生长迟缓,甚至植物死亡[gydF4y2Ba7gydF4y2Ba].gydF4y2Ba
在高等植物中,保持低钠gydF4y2Ba+gydF4y2Ba水平和K的合适范围gydF4y2Ba+gydF4y2Ba/ NagydF4y2Ba+gydF4y2Ba细胞内的比例是提高植物抗盐能力所必需的[gydF4y2Ba6gydF4y2Ba,gydF4y2Ba8gydF4y2Ba].钠过量积累gydF4y2Ba+gydF4y2Ba在植物中,主要有以下三种方法:(i)抑制NagydF4y2Ba+gydF4y2Ba(2)钠含量升高gydF4y2Ba+gydF4y2Ba(iii)强化NagydF4y2Ba+gydF4y2Ba细胞内部位流出[gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10gydF4y2Ba].在盐度胁迫下,部分非选择性阳离子通道(NSCCs)、KgydF4y2Ba+gydF4y2Bapermeasure和其他类型的转运体允许NagydF4y2Ba+gydF4y2Ba进入植物细胞[gydF4y2Ba11gydF4y2Ba].因此,维持适当的离子稳态是植物抗盐的重要策略。gydF4y2Ba盐过度敏感gydF4y2Ba(gydF4y2Ba紧急求救信号gydF4y2Ba)信号通路及gydF4y2Ba非选择性阳离子通道gydF4y2Ba(gydF4y2BaNSCCsgydF4y2Ba)是调节根Na的关键gydF4y2Ba+gydF4y2Ba流入及流出量[gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba].NagydF4y2Ba+gydF4y2Ba/小时gydF4y2Ba+gydF4y2Ba反转运体(NHXs)介导Na的转运gydF4y2Ba+gydF4y2Ba进入液泡,并对液泡钠有贡献gydF4y2Ba+gydF4y2Ba这是植物SSR的关键。此外,增强亲和性渗透物、抗氧化剂和多胺的生物合成,维持活性氧(ROS)和植物激素的内稳态也是植物抗盐胁迫的关键策略[gydF4y2Ba14gydF4y2Ba].gydF4y2Ba
异源四倍体油菜籽(gydF4y2Ba芸苔属植物显著gydF4y2BaL.)广泛用于生产食用植物油、牲畜蛋白粉和工业生物柴油[gydF4y2Ba15gydF4y2Ba].异源四倍体油菜(AgydF4y2BangydF4y2Ba一个gydF4y2BangydF4y2BaCgydF4y2BangydF4y2BaCgydF4y2BangydF4y2Ba, ~ 1345 Mb, 2gydF4y2BangydF4y2Ba= 4gydF4y2BaxgydF4y2Ba= 38)来源于它的二倍体祖先gydF4y2Bab·拉伯gydF4y2Ba(一个gydF4y2BargydF4y2Ba一个gydF4y2BargydF4y2Ba, ~ 485 Mb, 2gydF4y2BangydF4y2Ba= 2gydF4y2BaxgydF4y2Ba= 20) [gydF4y2Ba16gydF4y2Ba),gydF4y2Bab . oleraceagydF4y2Ba(CgydF4y2BaogydF4y2BaCgydF4y2BaogydF4y2Ba, ~ 630 Mb, 2gydF4y2BangydF4y2Ba= 2gydF4y2BaxgydF4y2Ba= 18) [gydF4y2Ba17gydF4y2Ba,gydF4y2Ba18gydF4y2Ba,gydF4y2Ba19gydF4y2Ba])。油菜基因组包含大量的重复染色体段和同源基因组区,进一步导致多基因家族的形成[gydF4y2Ba18gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba].gydF4y2Ba
盐度极大地阻碍油菜籽生物量和种子产量[gydF4y2Ba20.gydF4y2Ba].尽管有各种关于提高油菜籽耐盐性的出版物,但在这方面取得的进展有限[gydF4y2Ba21gydF4y2Ba,gydF4y2Ba22gydF4y2Ba,gydF4y2Ba23gydF4y2Ba].全面了解耐盐的形态生理和分子机制,有助于提高作物在盐胁迫下的生产性能。选育性能优良的耐盐油菜籽基因型是在盐胁迫下保持最佳产量的合理解决方案[gydF4y2Ba24gydF4y2Ba].研究了油菜籽植株对盐度的形态生理响应,并研究了油菜籽幼苗对盐度响应的全基因组转录谱。本研究可丰富油菜抗盐的形态生理策略,盐响应差异表达核心基因的鉴定可为油菜耐盐种质分子育种提供优质遗传资源。gydF4y2Ba
结果gydF4y2Ba
油菜对盐度的形态响应gydF4y2Ba
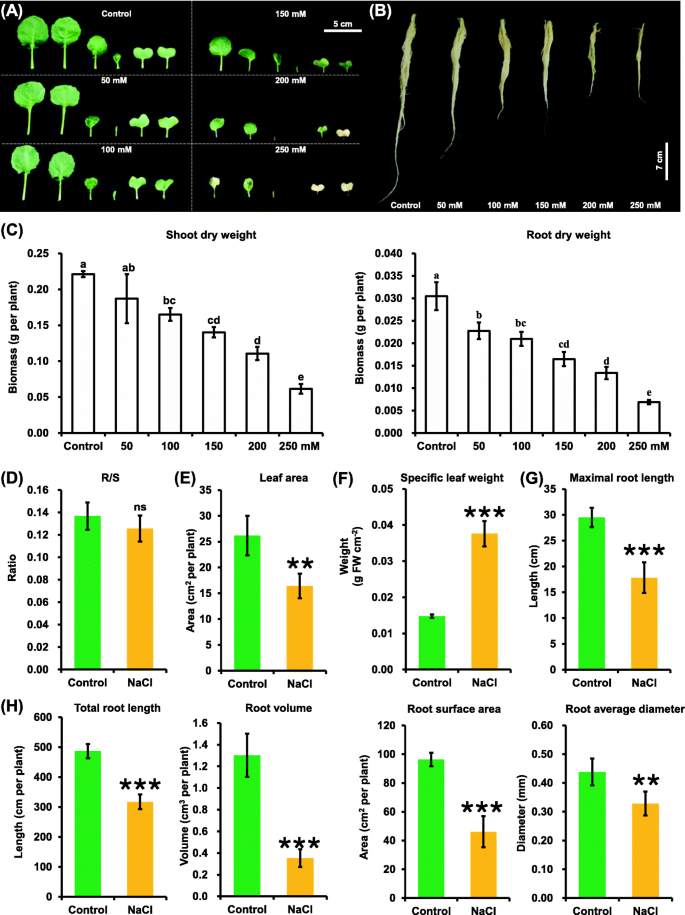
在0(对照)、50 mM、100 mM、150 mM、200 mM和250 mM NaCl条件下,选择最适宜的NaCl浓度进行油菜耐盐性研究。与对照相比,当NaCl浓度高于100 mM时,油菜植株开始出现明显的生长迟缓,包括叶片坏死和根系抑制(图1)。gydF4y2Ba1gydF4y2Baa, b).盐诱导的生长抑制还表现为茎和根生物量的显著减少(图2)。gydF4y2Ba1gydF4y2Bac).在200 mM NaCl处理下,茎干重和根干重降低达50%。gydF4y2Ba1gydF4y2BaC),在随后的盐度实验中使用,在之前的研究中也被广泛应用[gydF4y2Ba25gydF4y2Ba].gydF4y2Ba
对照和盐度条件下油菜植株生长性能的研究。(A-B)嫩枝生长性能(gydF4y2Ba一个gydF4y2Ba)和根(gydF4y2BabgydF4y2Ba)在不同盐剂量条件下的油菜植株中。gydF4y2BacgydF4y2Ba不同NaCl浓度下油菜植株的茎干重和根干重。种子萌发7 d后均匀的油菜籽植株在无NaCl(对照)条件下生长10 d,然后更换到含0 ~ 250 mM NaCl的溶液中生长5 d。不同的小写表示在的显著差异gydF4y2BaPgydF4y2Ba< 0.05。(D-H)根/梢(R/S)比(gydF4y2BadgydF4y2Ba),叶面积(gydF4y2BaegydF4y2Ba)、比叶重(gydF4y2BafgydF4y2Ba),最大根长(gydF4y2BaggydF4y2Ba)和根系体系结构(gydF4y2BahgydF4y2Ba)在对照和200 mM NaCl条件下。为gydF4y2BadgydF4y2Ba-gydF4y2BahgydF4y2Ba将种子萌发7 d后生长均匀的油菜籽在无NaCl(对照)条件下生长10 d,然后转移到含200 mM NaCl的溶液中生长5 d。数据为平均值(±SD),gydF4y2BangydF4y2Ba= 5。ns,不重要;*,gydF4y2BaPgydF4y2Ba< 0.05;**gydF4y2BaPgydF4y2Ba< 0.01;* * *,gydF4y2BaPgydF4y2Ba< 0.001gydF4y2Ba
在本研究中,在200 mM NaCl处理下,没有观察到根/冠比的显著变化(图1)。gydF4y2Ba1gydF4y2Bad).随后,确定盐度对嫩枝和根系生长的具体影响(图5)。gydF4y2Ba1gydF4y2Ba情况)。盐度使总叶面积减少了40%(图4)。gydF4y2Ba1gydF4y2Bae).然而,在盐度条件下,比叶重增加了一倍(图5)。gydF4y2Ba1gydF4y2BaF),表明叶厚显著增加。相反,盐度导致根系结构相关参数的显著减少,包括最大长度(图1)。gydF4y2Ba1gydF4y2Bag),总长度,体积,表面积,平均直径(图。gydF4y2Ba1gydF4y2Bah)。gydF4y2Ba
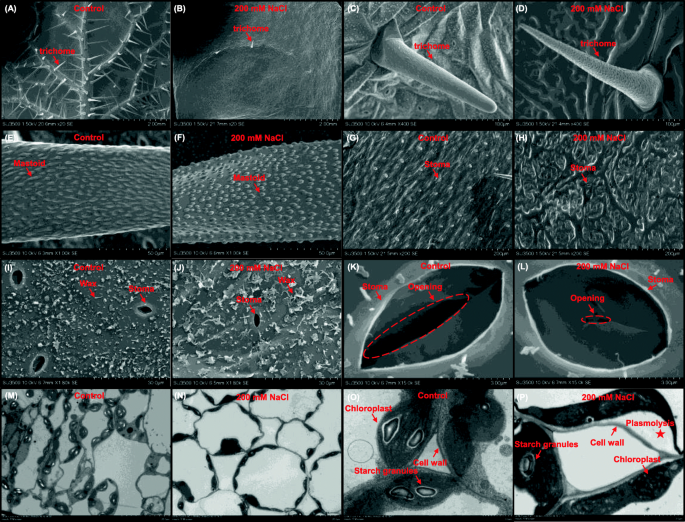
利用扫描电镜观察幼叶表皮的毛状体和气孔形态,利用透射电镜观察细胞器损伤情况,从而观察在对照和盐胁迫条件下形成形态差异的细胞内超微结构(图1)。gydF4y2Ba2gydF4y2Ba).与对照相比,盐度处理显著减少了叶片毛状体的数量(图1)。gydF4y2Ba2gydF4y2Baa, b)。然而,在对照和盐度条件下,叶片毛状体的整体形态和表面乳突没有明显改变(图1)。gydF4y2Ba2gydF4y2Bac, f)。与对照相比,盐度条件下气孔数明显减少(图1)。gydF4y2Ba2gydF4y2Bag和h)。此外,在盐度条件下,叶片表面的蜡皮比对照条件下要大(图2)。gydF4y2Ba2gydF4y2Bai, j)。此外,盐度条件下气孔的闭合程度高于对照条件(图1)。gydF4y2Ba2gydF4y2Bak, l)。盐胁迫下叶绿体中淀粉粒数量明显减少,导致细胞分离,质膜萎缩,即质浆溶解(图1)。gydF4y2Ba2gydF4y2Bam p)。gydF4y2Ba
对照和盐胁迫下油菜叶片超微结构的显微特征。gydF4y2Ba一个gydF4y2Ba-gydF4y2BadgydF4y2Ba低放大率视图(gydF4y2Ba一个gydF4y2Ba,gydF4y2BabgydF4y2Ba)及特写图片(gydF4y2BacgydF4y2Ba,gydF4y2BadgydF4y2Ba)叶毛状体。(gydF4y2BaegydF4y2Ba-gydF4y2BafgydF4y2Ba毛状体表面的乳突形态。gydF4y2BaggydF4y2Ba-gydF4y2BajgydF4y2Ba低放大率视图(gydF4y2BaggydF4y2Ba,gydF4y2BahgydF4y2Ba)和叶片表面蜡层的形态(gydF4y2Ba我gydF4y2Ba,gydF4y2BajgydF4y2Ba).gydF4y2BakgydF4y2Ba-gydF4y2BalgydF4y2Ba气孔的特写图像。gydF4y2Ba米gydF4y2Ba-gydF4y2BapgydF4y2Ba低放大率(gydF4y2Ba米gydF4y2Ba,gydF4y2BangydF4y2Ba)及特写镜头(gydF4y2BaogydF4y2Ba,gydF4y2BapgydF4y2Ba)叶绿体沿质膜和细胞形态的观点。种子萌发7 d后均匀的油菜籽植株在无NaCl(对照)条件下培养10 d,然后转移到含200 mM NaCl的溶液中培养5 d。毛状体、乳突、气孔、细胞壁、叶绿体和淀粉粒用箭头表示,质分裂用星号表示。气孔的开口用虚线圈表示gydF4y2Ba
油菜籽植物对盐度的生理响应gydF4y2Ba
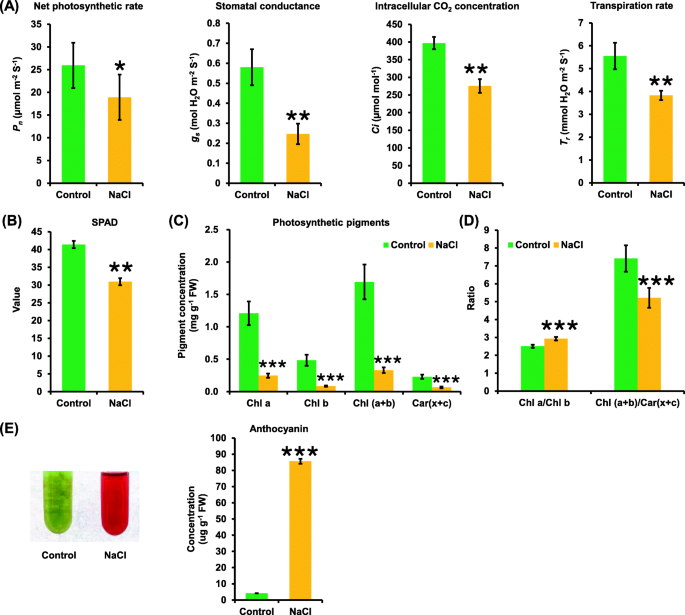
在对照和盐胁迫条件下的差异形态分析的基础上,进一步探讨了盐胁迫下油菜植株的生理变化。结果表明,盐度对净光合速率有负面影响,使净光合速率降低了20%以上(图5)。gydF4y2Ba3.gydF4y2Baa).除了在盐度条件下扫描显微镜发现气孔数和电导减少外(图5)。gydF4y2Ba2gydF4y2Baa, d),气孔导度降低了一半以上(图。gydF4y2Ba3.gydF4y2Baa).气孔导度的降低与细胞内CO的减少有关gydF4y2Ba2gydF4y2Ba浓度,大约减少了四分之一(图。gydF4y2Ba3.gydF4y2Baa).此外,盐度条件下油菜植株的蒸腾速率明显低于对照条件(图1)。gydF4y2Ba3.gydF4y2Ba一个)。gydF4y2Ba
对照和盐胁迫下油菜光合特性及花青素含量gydF4y2Ba一个gydF4y2Ba盐度对净光合速率的影响(gydF4y2BaPgydF4y2BangydF4y2Baμ摩尔米gydF4y2Ba−2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba)、气孔导度(gydF4y2BaggydF4y2Ba年代gydF4y2Ba摩尔HgydF4y2Ba2gydF4y2BaO mgydF4y2Ba−2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba),细胞间有限公司gydF4y2Ba2gydF4y2Ba浓度(gydF4y2BaCgydF4y2Ba我gydF4y2Baμ摩尔,摩尔gydF4y2Ba−1gydF4y2Ba)、蒸腾速率(gydF4y2BaTgydF4y2BargydF4y2Ba,更易与HgydF4y2Ba2gydF4y2BaO mgydF4y2Ba−2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba)对照和200 mM NaCl条件下的油菜植株。gydF4y2BabgydF4y2Ba-gydF4y2BadgydF4y2BaSPAD值(gydF4y2BabgydF4y2Ba)、光合色素浓度(gydF4y2BacgydF4y2Ba,gydF4y2BadgydF4y2Ba)和花青素浓度(gydF4y2BaegydF4y2Ba)在对照和200 mM NaCl条件下的油菜植株中。种子萌发7 d后均匀的油菜籽在无NaCl(对照)条件下水培10 d,然后转移到含200 mM NaCl的溶液中培养5 d。数据为平均值(±SD), n = 5。使用Student 's来确定显著差异gydF4y2BatgydF4y2Ba-test: ns,不重要;*,gydF4y2BaPgydF4y2Ba< 0.05;**gydF4y2BaPgydF4y2Ba< 0.01;* * *,gydF4y2BaPgydF4y2Ba< 0.001gydF4y2Ba
SPAD值(代表叶片叶绿素含量)的测定也表明,盐度抑制了油菜籽植物的光合作用。gydF4y2Ba3.gydF4y2Bab).进一步研究了盐度对光合色素的影响。无一例外,总叶绿素(包括叶绿素a和叶绿素b)和类胡萝卜素(包括叶黄素和胡萝卜素)的浓度均显著降低(图1)。gydF4y2Ba3.gydF4y2Bac).叶绿素浓度比gydF4y2Ba一个gydF4y2Ba对叶绿素gydF4y2BabgydF4y2Ba在盐度条件下明显高于对照(图5)。gydF4y2Ba3.gydF4y2Bad).此外,盐度降低了叶绿素总浓度与类胡萝卜素浓度的比值(图5)。gydF4y2Ba3.gydF4y2Bad).花青素的过量积累也被观察到,这从其浓度在盐度下显著增加得到了验证(图5)。gydF4y2Ba3.gydF4y2Bae)。gydF4y2Ba
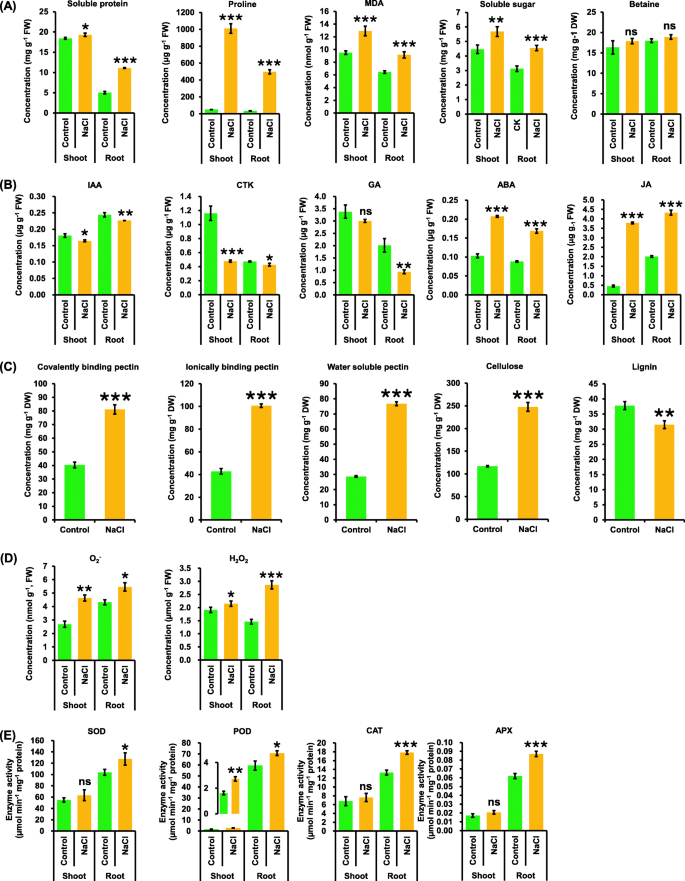
为了进一步了解油菜籽植物对盐度的生理响应,对可能参与SSR调控的一些关键代谢物进行了检测。盐胁迫后油菜嫩枝和根部可溶性蛋白、脯氨酸、丙二醛(MDA)和可溶性糖的浓度均显著升高(图5)。gydF4y2Ba4gydF4y2Baa).在本研究中,与对照条件相比,在盐度条件下,油菜植株茎部和根部的甜菜碱浓度均未发生显著变化(图1)。gydF4y2Ba4gydF4y2Baa).随后,研究了油菜籽植物在盐胁迫下的激素响应。总体而言,在盐度条件下,油菜植株中吲哚乙酸(IAA)、细胞分裂素(CTK)和赤霉素(GA)的浓度显著低于对照条件(图4)。gydF4y2Ba4gydF4y2Bab).然而,在对照和盐度条件下,嫩枝中的GA浓度没有显著差异(图5)。gydF4y2Ba4gydF4y2Bab).相反,盐胁迫下嫩枝和根中脱落酸(ABA)和茉莉酸(JA)的浓度显著高于对照(图4)。gydF4y2Ba4gydF4y2Bab)。gydF4y2Ba
对照和盐胁迫下油菜植株的一些关键代谢产物图谱。gydF4y2Ba一个gydF4y2Ba-gydF4y2BaegydF4y2Ba某些渗透调节物质(A,包括可溶性蛋白质、脯氨酸、丙二醛、可溶性糖和甜菜碱)、植物激素(gydF4y2BaBgydF4y2Ba,包括IAA, CTK, GA, ABA, JA),细胞壁成分(gydF4y2BacgydF4y2Ba,包括共价/离子结合和水溶性果胶、纤维素和木质素)、活性氧(gydF4y2BadgydF4y2Ba,包括阿gydF4y2Ba2gydF4y2Ba−gydF4y2Ba和HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba)和抗氧化酶的活性(gydF4y2BaegydF4y2Ba对照和200 mM NaCl条件下油菜苗和根中SOD、POD、CAT、APX含量的变化。种子萌发7 d后均匀的油菜籽在无NaCl(对照)条件下水培10 d,然后转移到含200 mM NaCl的溶液中培养5 d。数据为平均值(±SD),gydF4y2BangydF4y2Ba= 3。ns,不重要;*,gydF4y2BaPgydF4y2Ba< 0.05;**gydF4y2BaPgydF4y2Ba< 0.01;* * *,gydF4y2BaPgydF4y2Ba< 0.001gydF4y2Ba
在盐度条件下,观察到了油菜籽叶片的卷曲度和细胞壁超微结构的变化,测定了细胞壁成分。共价/离子结合和水溶性果胶、纤维素和木质素对盐度的响应如图所示。gydF4y2Ba4gydF4y2Bac.与对照相比,嫩枝中共价/离子结合剂和水溶性果胶、纤维素浓度约为对照的2倍(图1)。gydF4y2Ba4gydF4y2Bac).但在盐度条件下,木质素浓度显著降低(图1)。gydF4y2Ba4gydF4y2Bac).细胞壁结构紊乱常引起电解质渗漏,渗漏常伴有ROS积累[gydF4y2Ba26gydF4y2Ba].超氧阴离子(OgydF4y2Ba2gydF4y2Ba−gydF4y2Ba过氧化氢(HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba盐胁迫下嫩枝和根系的浓度均显著高于对照(图1)。gydF4y2Ba4gydF4y2Bad). ROS内稳态受ROS产生和清除的复杂调控。结果表明,与对照条件相比,盐度条件下积累了更多的ROS(图1)。gydF4y2Ba4gydF4y2Bad).植物根系中超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)和抗坏血酸过氧化物酶(APX)活性对盐度的响应显著升高。然而,除POD活性明显升高外,幼苗中SOD、CAT和APX活性无明显变化(图1)。gydF4y2Ba4gydF4y2Bae)。gydF4y2Ba
油菜籽植物对盐度的组学响应gydF4y2Ba
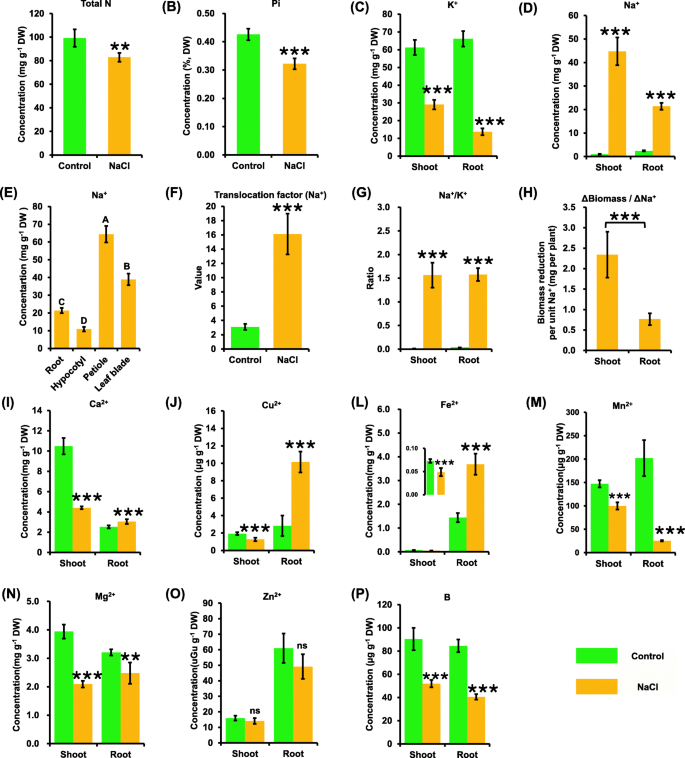
随后,利用ICP-MS分析对照和盐度条件之间的组学剖面。结果表明,与对照相比,盐胁迫下嫩枝和根中大部分矿质元素(包括N、P、K、Ca、Mg)和微量元素(Fe、Cu、Mn、Zn、B)的含量明显下降(图4)。gydF4y2Ba5gydF4y2Bap)。ICP-MS定量分析表明NagydF4y2Ba+gydF4y2Ba盐胁迫下嫩枝和根的浓度均显著增加(图2)。gydF4y2Ba5gydF4y2Bad).此外,NagydF4y2Ba+gydF4y2Ba在嫩枝中的浓度高于根中的浓度(图。gydF4y2Ba5gydF4y2Bad)。NagydF4y2Ba+gydF4y2Ba本研究测定了根、下胚轴、叶柄和叶片中钠的浓度,以进一步表征钠的分布gydF4y2Ba+gydF4y2Ba到工厂。分析表明,NagydF4y2Ba+gydF4y2Ba浓度在叶柄中最高,叶片和根中次之,下胚轴中最低(图4)。gydF4y2Ba5gydF4y2Bae). Na的易位因子gydF4y2Ba+gydF4y2Ba与对照相比,盐度条件下显著增加(图5)。gydF4y2Ba5gydF4y2Baf).盐度下,NagydF4y2Ba+gydF4y2Ba/ KgydF4y2Ba+gydF4y2Ba嫩枝和根的比例均显著增加(图5)。gydF4y2Ba5gydF4y2Bag).生物量对比分析表明,NagydF4y2Ba+gydF4y2Ba导致嫩枝生物量的下降幅度大于根的下降幅度(图5)。gydF4y2Ba5gydF4y2Bah)。gydF4y2Ba
对照和盐胁迫下油菜植株的组学分析。种子萌发7 d后均匀的油菜籽在无NaCl(对照)条件下水培10 d,然后转移到含200 mM NaCl的溶液中培养5 d。N,氮;π,磷酸;钾、钾;钠,钠;钙、钙;镁、镁;铁、铁;锰、锰; Cu, copper; Zn, zinc; B, boron. ns, not significant. Translocation factor (Na+gydF4y2Ba) = (NagydF4y2Ba+gydF4y2Ba内容)gydF4y2Ba拍摄gydF4y2Ba/ (NagydF4y2Ba+gydF4y2Ba内容)gydF4y2Ba根gydF4y2Ba.数据为平均值(±SD),gydF4y2BangydF4y2Ba= 3。ns,不重要;*,gydF4y2BaPgydF4y2Ba< 0.05;**gydF4y2BaPgydF4y2Ba< 0.01;* * *,gydF4y2BaPgydF4y2Ba< 0.001gydF4y2Ba
随后,一些其他金属阳离子的浓度,包括CagydF4y2Ba2 +gydF4y2Ba、铁gydF4y2Ba2 +gydF4y2Ba、铜gydF4y2Ba2 +gydF4y2Ba、镁gydF4y2Ba2 +gydF4y2Ba、锰gydF4y2Ba2 +gydF4y2Ba,锌gydF4y2Ba2 +gydF4y2Ba,并检测了一种类金属营养素,即B(图。gydF4y2Ba5gydF4y2Bai p)。一般来说,CagydF4y2Ba2 +gydF4y2Ba、铁gydF4y2Ba2 +gydF4y2Ba,铜gydF4y2Ba2 +gydF4y2Ba在盐度下表现出类似的响应模式。具体来说,CagydF4y2Ba2 +gydF4y2Ba、铁gydF4y2Ba2 +gydF4y2Ba,铜gydF4y2Ba2 +gydF4y2Ba在嫩枝中显著减少;相反,它们在根部的浓度明显增加(图5)。gydF4y2Ba5gydF4y2Ba我)。MggydF4y2Ba2 +gydF4y2Ba和锰gydF4y2Ba2 +gydF4y2Ba盐胁迫下嫩枝和根部的浓度均显著降低(图5)。gydF4y2Ba5gydF4y2Ba与上述阳离子不同的是,ZngydF4y2Ba2 +gydF4y2Ba与对照相比,盐胁迫下嫩枝和根部的浓度变化不明显(图1)。gydF4y2Ba5gydF4y2Bao)。同时,盐胁迫下嫩枝和根系中B的浓度均显著低于对照(图1)。gydF4y2Ba5gydF4y2Bap)。gydF4y2Ba
油菜植物对盐度的全基因组转录响应gydF4y2Ba
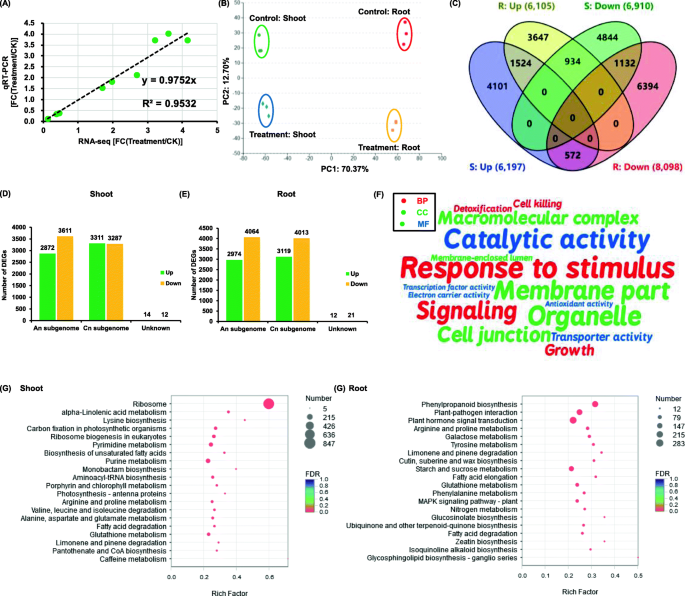
在去除适配器序列和低质量读取后,大约5.4 × 10gydF4y2Ba7gydF4y2Ba获得每个样品的清洁读数。12个样品的清洁读数总长度约为6.5 × 10gydF4y2Ba8gydF4y2Bant和问gydF4y2Ba20.gydF4y2Ba> 98%和QgydF4y2Ba30.gydF4y2Ba> 95%(补充表S .gydF4y2Ba1gydF4y2Ba).大部分的gydF4y2Ba皮尔森gydF4y2Ba在相同处理下,每对生物重复之间的相关系数均大于0.90(补充图SgydF4y2Ba1gydF4y2Ba),表明转录组数据是高度可信的。gydF4y2Ba
随后,在200 mM NaCl条件下与无盐条件下检测油菜整体差异基因表达。首先,选择10个DEGs比较RT-qPCR结果与转录组测序结果的表达一致性。结果表明,大部分基因表达高度相关(gydF4y2BargydF4y2Ba> 0.95)。gydF4y2Ba6gydF4y2Baa).主成分分析显示,不同处理和不同油菜组织之间的表达模式存在显著差异(图1)。gydF4y2Ba6gydF4y2Bab).在盐胁迫下,在嫩枝和根中分别有13,107和14,203个基因差异表达(图1)。gydF4y2Ba6gydF4y2Bac).在嫩枝和根中,下调的DEGs数量都大于上调的DEGs数量(图1)。gydF4y2Ba6gydF4y2Bac).进一步研究了盐度对同种异体四倍体油菜An和Cn亚基因组同源基因表达偏倚的影响(图5)。gydF4y2Ba6gydF4y2Bad, e)。总的来说,在茎和根中,Cn亚基因组上的DEGs比An亚基因组上的DEGs更丰富(图1)。gydF4y2Ba6gydF4y2Bad, e)。gydF4y2Ba
对照和盐胁迫下油菜植株转录组测序数据综述。gydF4y2Ba一个gydF4y2BaRT-qPCR与RNA-seq结果的相关性分析。gydF4y2BabgydF4y2Ba,gydF4y2BacgydF4y2Ba主成分分析(B)及维恩图分析(gydF4y2BacgydF4y2Ba的差异表达基因(DEGs)在对照和盐(处理)条件下的嫩枝(S)和根(R)中的表达。学位证书编号列在括号内。gydF4y2BadgydF4y2Ba-gydF4y2BaegydF4y2Ba火山图显示对照和盐(处理)条件下嫩枝(gydF4y2BadgydF4y2Ba)和根(gydF4y2BaegydF4y2Ba)., upregulation;以上。差别,对这些gydF4y2BafgydF4y2Ba-gydF4y2BaggydF4y2Ba(gydF4y2BafgydF4y2Ba)和KEGG通路(gydF4y2BaggydF4y2Ba)对照与盐(处理)条件下嫩枝和根部整体DEGs富集分析。为gydF4y2BafgydF4y2Ba, BP,生物过程;CC,蜂窝组件;MF、分子功能。过度呈现的GO项目是由WordArt程序描绘的。字体越大,对应的GO类别越多。为gydF4y2BaggydF4y2Ba,圆的大小表示DEGs的数量,丰富因子表示涉及DEGs的KEGG通路的富集程度。为了进行转录组测序,将种子萌发7 d后的均匀油菜籽植株在无NaCl(对照)条件下培养10 d,然后更换到含200 mM NaCl的溶液中培养12 hgydF4y2Ba
在深入研究DEGs的特异性反应之前,我们先研究了表达量在盐度下变化最大的DEGs的分子函数(MF)。如表所示gydF4y2Ba1gydF4y2Ba在盐度条件下,胚胎发生晚期丰富蛋白(LEA)、脱氢蛋白、糖和N转运蛋白、防御素等胁迫相关蛋白的DEGs表达量发生了非常高的变化。进一步,通过对氧化石墨烯(MF)、细胞组分(CC)和生物过程(BP)的富集分析,表征了盐胁迫下DEGs的主要生物作用。尽管在盐度下的芽或根,BP中最富集的氧化石墨烯项是对刺激的响应、信号、生长和细胞杀伤(图1)。gydF4y2Ba6gydF4y2Baf).然而,在CC类中,膜部分、细胞器和细胞连接是最丰富的三个项目(图。gydF4y2Ba6gydF4y2Baf).在MF注释中,催化活性和转运蛋白活性是最丰富的两个项目(图。gydF4y2Ba6gydF4y2Baf).利用KEGG数据库进一步确定涉及的响应的活性途径gydF4y2Ba显著gydF4y2Ba盐度。在嫩枝中,光合生物的嘧啶和嘌呤代谢、卟啉和叶绿素代谢以及碳固定通路高度富集(图。gydF4y2Ba6gydF4y2Bag)。在根系中,很大比例的DEGs主要参与苯丙类生物合成、植物激素信号转导、蜡质生物合成以及碳(含淀粉和糖)-氮代谢(图1)。gydF4y2Ba6gydF4y2Bag)。gydF4y2Ba
光合作用和花青素生物合成相关基因对盐度的转录响应gydF4y2Ba
数字gydF4y2Ba3.gydF4y2BaA-c表明在盐胁迫下油菜植株叶绿素降解严重,光合作用受到抑制。在转录组学分析中,我们发现叶绿素生物合成相关基因,gydF4y2Ba毫克gydF4y2Ba2 +gydF4y2BachelatasegydF4y2Ba,gydF4y2Basenescence-associated基因(凹陷)gydF4y2Ba,编码光合作用II反应蛋白和RuBisCo亚基结合蛋白的基因在盐度下显著下调(图1)。gydF4y2Ba7gydF4y2Ba一个)。gydF4y2Ba
光合作用和花青素生物合成基因在对照和盐条件下的差异表达谱。gydF4y2Ba一个gydF4y2Ba参与光合作用基因的差异表达谱。gydF4y2BabgydF4y2Ba植物花青素生物合成途径及参与花青素生物合成基因的差异表达谱。答,花青素合成酶;C4H:肉桂酸4-羟化酶;气,chalcone-flavanone异构酶;CHS、查耳酮合酶;4 cl, coumaroyl-CoA合酶;DRF, dihydroflavonol 4-reductase;F3H,黄烷酮3-hydroxylase;F3'H,黄烷酮3 -羟化酶;GT,糖基转移酶; PAL, phenylalanine ammonia lyase.cgydF4y2Ba一般表达式分析和差异表达的数量gydF4y2BaMYBgydF4y2Ba转录因子基因。gydF4y2BadgydF4y2Ba的微分表达式分析gydF4y2BaPAP1gydF4y2Ba(gydF4y2BaMYB75gydF4y2Ba),gydF4y2BaPAP2gydF4y2Ba(gydF4y2BaMYB90gydF4y2Ba).PAP,生产花青素色素。gydF4y2BaegydF4y2Ba一般表达式分析和差异表达的数量gydF4y2BabHLHgydF4y2Ba转录因子基因。gydF4y2BafgydF4y2Ba的微分表达式分析gydF4y2BabHLH122gydF4y2Ba家族的基因。gydF4y2BaggydF4y2Ba的微分表达式分析gydF4y2BaWD40gydF4y2Ba家族的基因。为了进行转录组测序,将种子萌发7天后的均匀油菜籽植株在无NaCl(对照)条件下水培10天,然后转移到含200 mM NaCl的溶液中12 h。, upregulation;,监管。热图显示由FPKM值指示的基因表达水平。在对照(Ctrl)和盐(200 mM NaCl)条件下表达量较高的差异表达基因用星号表示gydF4y2Ba
花青素,作为一种抗应激的非酶抗氧化剂,主要产生于苯丙醇依赖的方式。在花青素生物合成过程中,苯丙氨酸被苯丙氨酸解氨酶(PAL)转化为肉桂酸,并在香马罗酰基辅酶a处分解成多条途径。随后,查尔酮合成酶(CHS)催化香豆油酰辅酶a衍生类黄酮形成,进而引发黄酮醇、花青素和花青素的生物合成(图。gydF4y2Ba7gydF4y2Bab)。在无花果。gydF4y2Ba3.gydF4y2BaE、油菜籽叶片在盐胁迫下花青素过度积累。此外,研究了在盐度条件下参与花青素生物合成的基因的转录谱。结果表明,约95%的DEGs在盐度下显著上调(图5)。gydF4y2Ba7gydF4y2Bab). MYB-bHLH-WDR (MBW)络合物对花青素的生物合成至关重要[gydF4y2Ba27gydF4y2Ba].在全基因组deg中占很大比例(75%)gydF4y2BaBnaMYBsgydF4y2Ba是由盐度引起的(图。gydF4y2Ba7gydF4y2Bac).的转录水平gydF4y2BaBnaA7。PAP1gydF4y2Ba而且gydF4y2BaBnaA7。PAP2gydF4y2Ba在盐度条件下显著高于对照条件(图5)。gydF4y2Ba7gydF4y2Bad).基因组deg的一半(50%)gydF4y2BaBnabHLHsgydF4y2Ba被发现是由盐度引起的(图。gydF4y2Ba7gydF4y2Bae)。这两个概念gydF4y2BabHLH122gydF4y2Ba同源染色体(gydF4y2BaBnaA6.bHLH122gydF4y2Ba而且gydF4y2BaBnaC6.bHLH122gydF4y2Ba),显著受盐度诱导,表达丰度最高(图。gydF4y2Ba7gydF4y2Bae, f),只有的微分表达式gydF4y2BaBnaA7。WD40gydF4y2Ba而且gydF4y2BaBnaC7。WD40gydF4y2Ba被发现(图gydF4y2Ba7gydF4y2BaG)在全基因组范围内gydF4y2BaWD40gydF4y2Ba基因。gydF4y2Ba
参与脯氨酸和细胞壁生物合成、活性氧产生和清除盐的基因的转录响应gydF4y2Ba
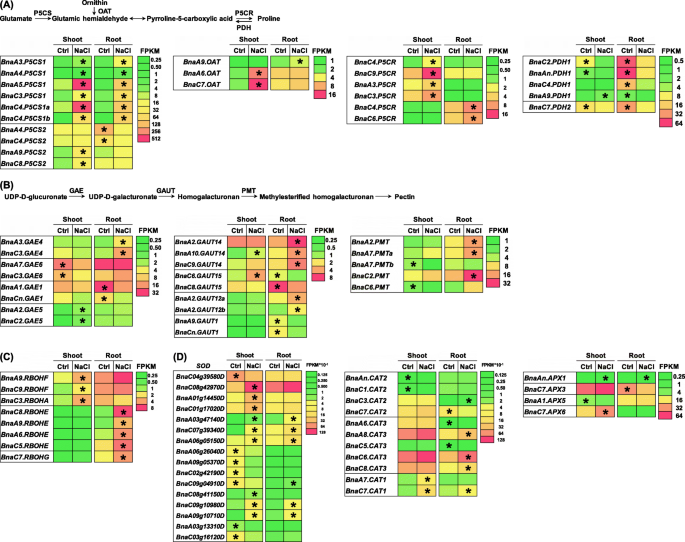
脯氨酸是在环境胁迫下维持细胞内稳态的主要渗透调节物质[gydF4y2Ba28gydF4y2Ba].脯氨酸生物合成开始于谷氨酸被吡咯啉-5-羧酸合成酶(P5CS)转化为谷氨酸半醛或鸟氨酸氨基转移酶(OAT)将鸟氨酸转化为谷氨酸半醛,然后转化为吡咯啉-5-羧酸还原酶(P5CR),最后在OAT的催化下转化为脯氨酸(图5)。gydF4y2Ba8gydF4y2Baa).盐度条件下脯氨酸过度积累;的表达gydF4y2BaP5CSgydF4y2Ba,gydF4y2Ba燕麦gydF4y2Ba,gydF4y2BaP5CRgydF4y2Ba在嫩枝和根中均显著上调(图。gydF4y2Ba8gydF4y2Baa).相反,的表达gydF4y2BaBnaPDHsgydF4y2Ba显著降低(图。gydF4y2Ba8gydF4y2Baa).在参与脯氨酸生物合成的deg中,gydF4y2BaBnaA5。P5CS1gydF4y2Ba,gydF4y2BaBnaC4。P5CS1agydF4y2Ba,gydF4y2BaBnaC7。燕麦gydF4y2Ba,gydF4y2BaBnaC9。P5CRgydF4y2Ba,gydF4y2BaBnaAn。PDH1gydF4y2Ba,表达水平较高,褶皱变化较大(图。gydF4y2Ba8gydF4y2BaA),可能是盐诱导脯氨酸生产的主要原因。gydF4y2Ba
油菜籽中脯氨酸和果胶生物合成、活性氧(ROS)产生和清除基因在对照(Ctrl)和盐度条件下的差异表达谱。gydF4y2Ba一个gydF4y2Ba脯氨酸生物合成途径及相关基因的差异表达谱分析。燕麦,鸟氨酸转氨酶;P5CR pyrroline-5-carboxylate还原酶;P5CS pyrroline-5-carboxylate合成酶;PDH、脯氨酸脱氢酶。gydF4y2BabgydF4y2Ba果胶生物合成途径及相关基因的差异表达谱分析。GAE, UDP-glucuronate 4-epimerase;GAUT galacturonosyl转移酶;PMT,果胶甲基转移酶。gydF4y2BacgydF4y2BaROS产生相关基因的差异表达谱。RBOH,呼吸爆裂氧化酶同源物。gydF4y2BadgydF4y2Ba差异表达抗氧化酶基因的一般表达谱。APX型抗坏血酸盐过氧化物酶;猫,过氧化氢酶;超氧化物歧化酶SOD。为了进行转录组测序,种子萌发7天后均匀的油菜籽植株在无NaCl(对照)条件下培养10天,然后转移到含200 mM NaCl的溶液中培养12 h,直到取样。热图显示由fpkm值指示的基因表达水平。在对照(Ctrl)和盐(200 mM NaCl)条件下表达量较高的差异表达基因用星号表示gydF4y2Ba
在形态生理分析中,发现细胞壁超微结构和成分发生了显著变化(图5。gydF4y2Ba2gydF4y2Ba,gydF4y2Ba4gydF4y2Bac).本研究的重点是细胞壁成分中的果胶。果胶的生物合成始于udp -葡糖醛酸盐,然后被udp -葡糖醛酸盐4-表烯酶、半乳糖醛酸转移酶和果胶甲基转移酶(PMT)清除,最终转化为果胶(图)。gydF4y2Ba8gydF4y2Bab). RNA-seq结果表明,在嫩枝或根中,盐度诱导的果胶生物合成相关基因比例较大(图1)。gydF4y2Ba8gydF4y2Bab).在这些上调基因中,gydF4y2BaBnaA2。GAUT14gydF4y2Ba而且gydF4y2BaBnaC2。PMTgydF4y2Ba,表达水平较高,褶皱变化较大(图。gydF4y2Ba8gydF4y2BaB),可能在盐胁迫下果胶生物合成中起核心作用。gydF4y2Ba
RgydF4y2Ba呼吸爆裂氧化酶同系物gydF4y2Ba(gydF4y2BaRBOHgydF4y2Ba)编码NADPH氧化酶的基因是产生ROS的关键[gydF4y2Ba29gydF4y2Ba].所有的八个gydF4y2BaRBOHgydF4y2Ba盐胁迫下,嫩枝或根中DEGs显著上调(图1)。gydF4y2Ba8gydF4y2Bac).对盐度的响应,在嫩枝或根中,编码SOD、CAT和APX的基因有较大比例上调(图1)。gydF4y2Ba8gydF4y2Bad).在抗氧化酶基因中,gydF4y2BaBnaC8。草皮gydF4y2Ba,gydF4y2BaBnaC6。CAT3gydF4y2Ba,gydF4y2BaBnaC7。APX6gydF4y2Ba,表达水平较高,褶皱变化较大(图。gydF4y2Ba8gydF4y2Bad),可能是在盐度条件下清除ROS所必需的。gydF4y2Ba
植物激素生物合成相关基因对盐度的转录响应gydF4y2Ba
盐度条件下IAA、CTK和GA浓度显著降低,ABA和JA浓度显著升高(图4)。gydF4y2Ba4gydF4y2Bab).因此,本研究研究了油菜籽中植物激素代谢相关基因对盐度的转录响应。gydF4y2Ba
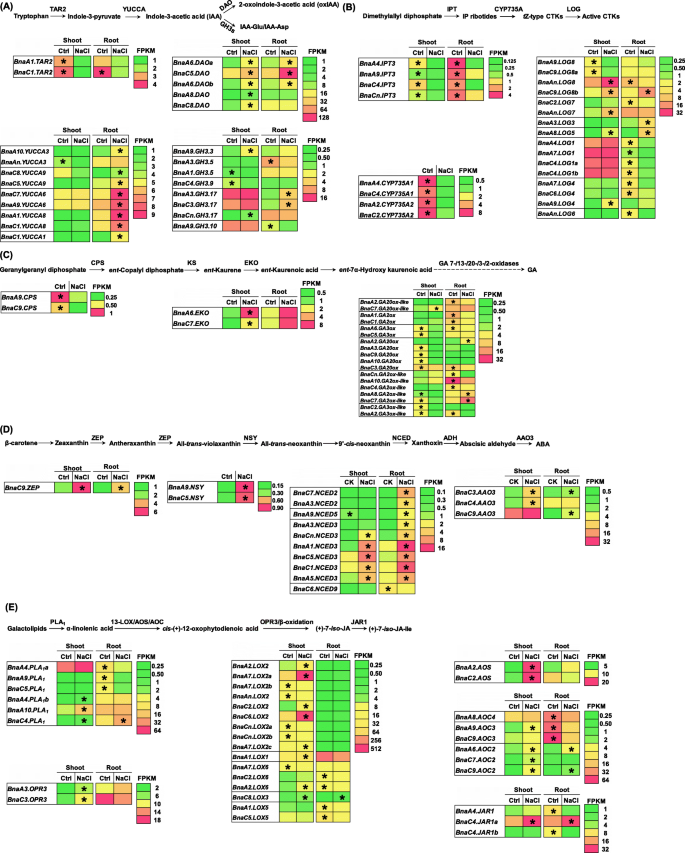
生长素的生物合成从色氨酸转化为吲哚-3-丙酮酸开始,最后转化为IAAgydF4y2BaTAR2gydF4y2Ba而且gydF4y2Ba丝兰gydF4y2Ba(无花果。gydF4y2Ba9gydF4y2Baa).生长素降解的主要途径gydF4y2Ba拟南芥gydF4y2Ba包括氧化的gydF4y2Ba生长素氧化的双加氧酶gydF4y2Ba并结合gydF4y2Ba格雷琴·哈根gydF4y2Ba[gydF4y2Ba30.gydF4y2Ba].一般来说,的表达式gydF4y2BaBnaTAR2gydF4y2Ba在盐度下表达明显下调,而gydF4y2BaBnaYUCCAgydF4y2Ba在嫩枝和根中显著上调(图。gydF4y2Ba9gydF4y2Baa).在盐度下,大部分的gydF4y2BaBnaDAOgydF4y2Ba而且gydF4y2BaBnaGH3gydF4y2Ba在嫩枝和根中,DEGs显著上调(图。gydF4y2Ba9gydF4y2Baa). CTK的生物合成始于二甲基烯丙基二磷酸,最终被IPT、CYP735A和LOG转化为活性CTK。在盐度下,所有的表达水平gydF4y2BaBnaIPT3gydF4y2Ba而且gydF4y2BaBnaCYP735A1sgydF4y2Ba和最gydF4y2BaBnaLOGgydF4y2BaDEGs明显下调(图。gydF4y2Ba9gydF4y2Bab).甘草酸生物合成从香叶酰香叶酰二磷酸开始,香叶酰香叶酰二磷酸经CPS、KS、EKO和GA 7−/13−/20−/3−/2氧化酶转化为甘草酸。在盐度下,表达水平gydF4y2BaBnaCPSsgydF4y2Ba显著下降,而gydF4y2BaBnaEKOgydF4y2Bas显著上调(图。gydF4y2Ba9gydF4y2Bac)。gydF4y2Ba
油菜籽植物激素生物合成基因在对照和盐胁迫下的差异表达谱。gydF4y2Ba一个gydF4y2Ba-gydF4y2BaegydF4y2Ba生长素相关基因的生物合成途径和差异表达谱(IAA,gydF4y2Ba一个gydF4y2Ba)、细胞分裂素(CTK,gydF4y2BabgydF4y2Ba)、赤霉素(GA),gydF4y2BacgydF4y2Ba脱落酸(ABA,gydF4y2BadgydF4y2Ba)和茉莉酸(JA, E). AAO,脱落醛氧化酶;抗利尿激素、酒精脱氢酶;AOC:烯氧化物环化酶;AOS,异丙烯氧化物合成酶;CPS,gydF4y2BaentgydF4y2Ba-copalyl二磷酸合成酶;DAO,生长素氧化双加氧酶;EKO贸易,gydF4y2BaentgydF4y2Ba-kaurene 19-oxidase;GAox GA氧化酶;GH3s, Gretchen Hagen 3s;KS,gydF4y2BaentgydF4y2Ba-kaurene合酶;液态氧,脂氧合酶;数控,9 -gydF4y2Ba独联体gydF4y2Ba-epoxycarotenoid加双氧酶;12-氧-植物二烯酸还原酶;中国人民解放军gydF4y2Ba1gydF4y2Ba,磷脂酶gydF4y2Ba1gydF4y2Ba;齐柏林飞艇,玉米黄质环氧酶;ZSY neoxanthin合成酶。为了进行转录组测序,将种子萌发7天后的均匀油菜籽植株在无NaCl(对照)条件下培养10天,然后转移到含200 mM NaCl的溶液中培养12 h。热图显示由FPKM值指示的基因表达水平。在对照和200 mM NaCl条件下表达量较高的差异表达基因用星号表示gydF4y2Ba
ABA的生物合成始于一系列酶,如ZEPs、NSYs、NCEDs和AAOs,将β-胡萝卜素转化为ABA。gydF4y2Ba9gydF4y2Bad).在盐度下,gydF4y2BaBnaZEPsgydF4y2Ba,gydF4y2BaBnaNSYsgydF4y2Ba,gydF4y2BaBnaNCED2sgydF4y2Ba,gydF4y2BaBnaAAO3sgydF4y2Ba显著上调(图。gydF4y2Ba9gydF4y2Bad)。gydF4y2BaBnaC9。齐柏林飞艇gydF4y2Ba,gydF4y2BaBnaA9。NSYgydF4y2Ba,gydF4y2BaBnaA1。NCED3gydF4y2Ba,表达水平较高,褶皱变化较大(图。gydF4y2Ba9gydF4y2Bad),可能在ABA生物合成中起主导作用。JA的生物合成始于包括聚乳酸在内的一系列酶基因将半乳糖转化为JAgydF4y2Ba1gydF4y2Ba, LOX, AOS, AOC, OPR, JAR1(图。gydF4y2Ba9gydF4y2Bae). JA生物合成相关基因对盐度表现出明显的转录响应。两者的deggydF4y2BaBnaOPR3sgydF4y2Ba而且gydF4y2BaBnaAOSsgydF4y2Ba在油菜籽植株中显著上调。gydF4y2Ba9gydF4y2Bae).然而,其他JA生物合成相关基因DEGs对盐度的响应并不一致(图1)。gydF4y2Ba9gydF4y2Bae),说明在盐度条件下JA生物合成存在复杂的调控网络。度,gydF4y2BaBnaA7。LOX2agydF4y2Ba,gydF4y2BaBnaC6。LOX2gydF4y2Ba,gydF4y2BaBnaA2。先进的gydF4y2Ba,gydF4y2BaBnaC2。先进的gydF4y2Ba,gydF4y2BaBnaC4。JAR1agydF4y2Ba表达水平增强,褶皱改变(图。gydF4y2Ba9gydF4y2Bae),可能在JA生物合成中起主导作用。gydF4y2Ba
Na的转录反应gydF4y2Ba+gydF4y2Ba/ KgydF4y2Ba+gydF4y2Ba盐的转运基因gydF4y2Ba
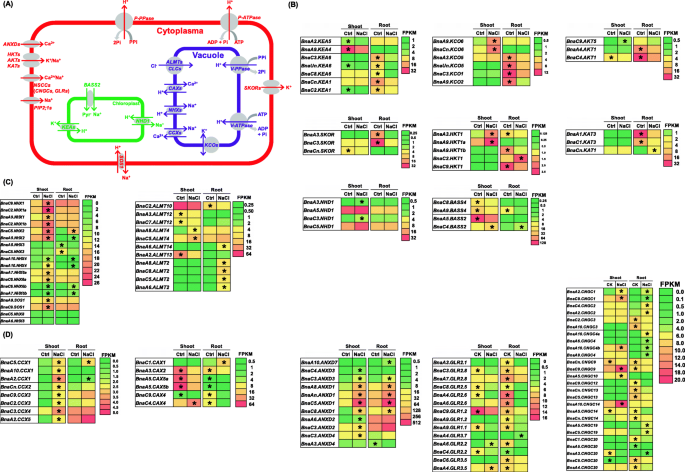
在众多的DEGs中,涉及营养离子稳态的基因受到了广泛的关注,这对油菜籽植株的耐盐性起着至关重要的作用。一个分子模型显示了负责钠的运输的基因gydF4y2Ba+gydF4y2BaKgydF4y2Ba+gydF4y2Ba,其他阳离子在图中标出。gydF4y2Ba10gydF4y2Baa.转录组学结果显示KgydF4y2Ba+gydF4y2Ba转运蛋白基因,包括叶绿体定位的KgydF4y2Ba+gydF4y2Ba射流输送基因gydF4y2Ba食肉鹦鹉gydF4y2Ba(gydF4y2BaKgydF4y2Ba+gydF4y2Ba射流逆向转运gydF4y2Ba),液泡KgydF4y2Ba+gydF4y2Ba流入输送基因gydF4y2BaKCOgydF4y2Ba(gydF4y2Ba二端口KgydF4y2Ba+gydF4y2Ba通道gydF4y2Ba),质膜定位KgydF4y2Ba+gydF4y2Ba涌入转运体基因gydF4y2Ba一种蛋白激酶/ KATgydF4y2Ba(gydF4y2Ba拟南芥KgydF4y2Ba+gydF4y2Ba转运体gydF4y2Ba),gydF4y2BaHKTgydF4y2Ba(gydF4y2Ba高亲和性KgydF4y2Ba+gydF4y2Ba运输类型gydF4y2Ba)和KgydF4y2Ba+gydF4y2Ba流出的基因gydF4y2BaSKORgydF4y2Ba(gydF4y2Bastelar KgydF4y2Ba+gydF4y2Ba外在的整流器gydF4y2Ba),在盐度下表达下调(图。gydF4y2Ba10gydF4y2Bab)。gydF4y2BaNagydF4y2Ba+gydF4y2Ba/小时gydF4y2Ba+gydF4y2Ba逆向转运gydF4y2Ba(gydF4y2BaNHXgydF4y2Ba)基因,特别是液泡体定位gydF4y2BaNHX1gydF4y2Ba而且gydF4y2BaNHX2gydF4y2Ba负责液泡钠gydF4y2Ba+gydF4y2Ba区隔和质膜定位gydF4y2BaSOS1gydF4y2Ba/gydF4y2BaNHX7gydF4y2Ba调节细胞钠gydF4y2Ba+gydF4y2Ba挤压,被上调(图。gydF4y2Ba10gydF4y2Bac).叶绿体局部下调gydF4y2Ba胆汁酸钠转运体gydF4y2Ba(gydF4y2Ba低音gydF4y2Ba)调节钠gydF4y2Ba+gydF4y2Ba涌入,特别是gydF4y2BaBnaA5。BASS2gydF4y2Ba,和上调gydF4y2Ba区域gydF4y2Ba基因调节钠gydF4y2Ba+gydF4y2Ba流出,特别是gydF4y2BaBnaC3。NHD1gydF4y2Ba(无花果。gydF4y2Ba10gydF4y2Bac)可能有助于减轻过量Na对叶绿体的损伤gydF4y2Ba+gydF4y2Ba.此外,过量的NaCl还诱导了大部分的表达gydF4y2BaALMTgydF4y2Ba(gydF4y2Baaluminum-activated苹果酸转运蛋白gydF4y2Ba)参与液泡氯化(ClgydF4y2Ba−gydF4y2Ba)封存(无花果。gydF4y2Ba10gydF4y2Bac)。gydF4y2Ba
钠(Na)转运相关基因的差异表达谱gydF4y2Ba+gydF4y2Ba),氯离子(ClgydF4y2Ba−gydF4y2Ba),钾(KgydF4y2Ba+gydF4y2Ba)和钙(钙gydF4y2Ba2 +gydF4y2Ba)离子在对照(Ctrl)和盐处理之间的差异。gydF4y2Ba一个gydF4y2Ba这是一个分子模型,显示了参与Na转运的基因gydF4y2Ba+gydF4y2BaKgydF4y2Ba+gydF4y2Ba, CagydF4y2Ba2 +gydF4y2Ba在植物。gydF4y2Ba罪犯gydF4y2Ba钾转运相关基因的差异表达谱分析gydF4y2Ba+gydF4y2Ba(gydF4y2BabgydF4y2Ba),钠gydF4y2Ba+gydF4y2Ba/ ClgydF4y2Ba−gydF4y2Ba(gydF4y2BacgydF4y2Ba), CagydF4y2Ba2 +gydF4y2Ba(gydF4y2BadgydF4y2Ba)在对照和200 mM NaCl条件下的油菜植株中。铝活化苹果酸转运蛋白;一种蛋白激酶/ KAT,拟南芥KgydF4y2Ba+gydF4y2Ba转运体;ANXD膜联蛋白D;BASS:胆汁酸钠转运体;CAX,阳离子交换剂;CCX,阳离子钙交换器;CNGC,环核苷酸门控通道;GLR glutamate-like受体;高亲和性K HKT,gydF4y2Ba+gydF4y2Ba运输机类型;KEA KgydF4y2Ba+gydF4y2Ba射流逆向转运;KCO,二端口KgydF4y2Ba+gydF4y2Ba通道;NHX /区域,NagydF4y2Ba+gydF4y2Ba/小时gydF4y2Ba+gydF4y2Ba逆向转运;SKOR stelar KgydF4y2Ba+gydF4y2Ba向外整流器;SOS,盐过度敏感。为了进行转录组测序,将种子萌发7 d后均匀的油菜籽植株在无NaCl(对照)条件下水培10 d,然后转移到含200 mM NaCl的溶液中12 h。热图显示由FPKM值指示的基因表达水平。在对照和200 mM NaCl条件下表达量较高的差异表达基因用星号表示gydF4y2Ba
随后,一些其他阳离子转运基因的表达,包括gydF4y2Ba钙阳离子交换器gydF4y2Ba(gydF4y2Ba芝加哥气候交易所gydF4y2Ba),gydF4y2Ba阳离子交换器gydF4y2Ba(gydF4y2BaCAXgydF4y2Ba),gydF4y2Ba膜联蛋白DgydF4y2Ba(gydF4y2BaANXDgydF4y2Ba),gydF4y2Baglutamate-like受体gydF4y2Ba(gydF4y2BaGLRgydF4y2Ba),gydF4y2Ba循环nucleotide-gated通道gydF4y2Ba(gydF4y2Ba中国兵器gydF4y2Ba)被调查,这可能与Na有关gydF4y2Ba+gydF4y2Ba内稳态下盐度。在盐度下,表达增加gydF4y2BaBnaCCXsgydF4y2Ba的约化表达式gydF4y2BaBnaCAXsgydF4y2Ba的增强表达gydF4y2BaBnaANXDsgydF4y2Ba可能有助于减少胞质钠gydF4y2Ba+gydF4y2Ba增强胞质钙gydF4y2Ba2 +gydF4y2Ba浓度(无花果。gydF4y2Ba10gydF4y2Bad).大部分表达局限于质膜gydF4y2Ba非选择性阳离子通道gydF4y2Ba(gydF4y2BaNSCCsgydF4y2Ba),包括gydF4y2BaGLRsgydF4y2Ba而且gydF4y2Ba中国兵器gydF4y2Ba,表达下调(图。gydF4y2Ba10gydF4y2Bad),这可能会防止钠过量gydF4y2Ba+gydF4y2Ba从进入细胞质。gydF4y2Ba
其他转运体基因对盐度的转录应答gydF4y2Ba
盐胁迫下,植物氮代谢发生显著变化[gydF4y2Ba31gydF4y2Ba].分子模型显示了参与植物氮代谢的基因。gydF4y2Ba11gydF4y2Baa).在盐度条件下,负责氮吸收的硝酸盐转运基因,包括gydF4y2BaNRT1.1gydF4y2Ba,gydF4y2BaNRT2.1gydF4y2Ba,gydF4y2BaNAR2.1gydF4y2Ba,显著下调(图。gydF4y2Ba11gydF4y2Baa).大部分空泡硝酸盐内流转运蛋白基因,gydF4y2Ba氯离子通道gydF4y2Ba(gydF4y2BaclcgydF4y2Ba),在盐度条件下表达量也较对照降低。根系木质部的硝酸盐装载基因,gydF4y2BaBnaNRT1.5年代gydF4y2Ba和根硝酸盐木质部卸载基因,gydF4y2BaBnaNRT1.8年代gydF4y2Ba,在盐度下分别上调和下调,有助于提高硝酸盐在根系中对盐度的保留。负责氮从衰老叶片循环到新器官的硝酸盐转运基因,gydF4y2BaNRT1.7gydF4y2Ba而且gydF4y2BaNRT1.9gydF4y2Ba,在盐度条件下表达较对照增强。此外,铵转运蛋白基因,gydF4y2Ba数量gydF4y2Ba,被盐度抑制。的gydF4y2Ba硝酸还原酶gydF4y2Ba(gydF4y2BaNIA1gydF4y2Ba而且gydF4y2BaNIA2gydF4y2Ba),gydF4y2Ba亚硝酸盐还原酶gydF4y2Ba(gydF4y2Ba近红外光谱gydF4y2Ba)基因下调,而谷氨酰胺合成酶(GS)和gydF4y2Baglutamine-2-oxoglutarate转氨酶gydF4y2Ba(gydF4y2BaGOGATgydF4y2Ba)基因被盐度诱导。gydF4y2Ba
油菜中氮(N)、磷(P)、硼(B)、铁(Fe)、铜(Cu)、镁(Mg)转运基因和水通道蛋白基因在对照(Ctrl)和盐胁迫下的差异表达谱氮(N)转运相关基因的差异表达谱gydF4y2Ba一个gydF4y2Ba)、P (gydF4y2BabgydF4y2Ba)、B (gydF4y2BacgydF4y2Ba)、铁(gydF4y2BadgydF4y2Ba)、铜(gydF4y2BaegydF4y2Ba), Mg (gydF4y2BafgydF4y2Ba)和水通道蛋白基因(gydF4y2BaggydF4y2Ba)在对照和200 mM NaCl条件下的油菜植株中。AMT,铵转运蛋白;CLC,氯通道;科普特人、铜转运体;GS,谷氨酰胺合成酶;GOGAT glutamine-2-oxoglutarate转氨酶;红外热成像、铁转运体;NIA,硝酸还原酶;近红外光谱,亚硝酸还原酶;结节蛋白26样内在蛋白NIP; NRT, nitrate transporter; MGT, magnesium transporter; PHT, phosphate transporter; PIP, plasma membrane intrinsic protein; TIP, tonoplast intrinsic protein. For the transcriptome sequencing, uniform rapeseed plants after 7-day seed germination were cultivated under NaCl-free (control) for 10 days, and then they were changed to the solution containing 200 mM NaCl for 12 h. The heatmaps show gene expression levels as indicated by the FPKM (values. The differentially expressed genes presenting higher expression levels between the control and 200 mM NaCl conditions are denoted by asterisks
盐胁迫下,大部分磷(Pi)转运基因显著下调gydF4y2BaBnaC9.PHT1; 3 cgydF4y2Ba(无花果。gydF4y2Ba11gydF4y2Bab).盐度明显抑制b吸收通道基因的表达,gydF4y2BaBnaNIP5; 1gydF4y2Ba和B转运蛋白基因,gydF4y2BaBnaBOR1sgydF4y2Ba并诱发的表达gydF4y2BaNIP6; 1gydF4y2Ba,硼优先运输到生长芽组织的硼酸通道(图。gydF4y2Ba11gydF4y2Bac).转运蛋白基因(包括gydF4y2BaIRT1sgydF4y2Ba,gydF4y2Ba科普特人gydF4y2Ba,gydF4y2Ba本gydF4y2Ba)参与铁的吸收和运输gydF4y2Ba2 +gydF4y2Ba、铜gydF4y2Ba2 +gydF4y2Ba,毫克gydF4y2Ba2 +gydF4y2Ba在盐度的作用下,根系有明显的下调(图5)。gydF4y2Ba11gydF4y2Bad-f)。在盐度下,大部分的水通道蛋白基因尤其明显gydF4y2BaBnaC4.PIP2; 2 bgydF4y2Ba而且gydF4y2BaBnaC2.TIP2; 2gydF4y2Ba,在嫩枝和根中均显著下调(图5)。gydF4y2Ba11gydF4y2Baf)。gydF4y2Ba
讨论gydF4y2Ba
在世界范围内,盐碱条件严重抑制植物生长、产量和作物质量。异源四倍体油菜籽(gydF4y2BangydF4y2Ba一个gydF4y2BangydF4y2BaCgydF4y2BangydF4y2BaCgydF4y2BangydF4y2Ba, 2gydF4y2BangydF4y2Ba= 4gydF4y2BaxgydF4y2Ba= 38)是一种主要的糖植油料作物,对盐度非常敏感。了解油菜籽耐盐的生理和分子机制,是开发高耐盐油菜籽品种的有效途径。gydF4y2Ba
转录组学辅助解剖油菜植物对盐度的形态生理响应gydF4y2Ba
不同的作物适应不同的盐浓度范围,不同的NaCl浓度对植物的影响不同[gydF4y2Ba32gydF4y2Ba,gydF4y2Ba33gydF4y2Ba,gydF4y2Ba34gydF4y2Ba,gydF4y2Ba35gydF4y2Ba].本研究采用0 mM、50 mM、100 mM、150 mM、200 mM、250 mM NaCl浓度对油菜植株进行处理,筛选出适合油菜SSR研究的NaCl浓度。在50 mM、100 mM和150 mM NaCl浓度下,油菜植株生长没有明显的抑制作用(图1)。gydF4y2Ba1gydF4y2Baa, b)。然而,在250 mM NaCl下,油菜幼苗表现出过量盐诱导的植株损伤,包括叶片早衰老,抑制根系,最终导致植株死亡(图1)。gydF4y2Ba1gydF4y2Baa, b),不适合作物SSR研究。最后确定了适合研究油菜籽盐度的NaCl浓度为200 mM,该浓度在其他研究中也得到了广泛应用[gydF4y2Ba35gydF4y2Ba,gydF4y2Ba36gydF4y2Ba,gydF4y2Ba37gydF4y2Ba,gydF4y2Ba38gydF4y2Ba,gydF4y2Ba39gydF4y2Ba].因此,200 mM NaCl可以作为作物水培SSR研究的通用条件。gydF4y2Ba
气孔是受环境刺激影响的叶片胞内组织与外界环境间气体交换的重要调节机制。此前有研究表明,气孔阀也与净光合速率相关[gydF4y2Ba40gydF4y2Ba].在本研究中,盐度降低了气孔数量和气孔导度,也导致叶绿体分离和叶绿素降解(图1)。gydF4y2Ba2gydF4y2Ba),所有这些都可能进一步导致光合作用的抑制(图5。gydF4y2Ba3.gydF4y2Ba模拟)。转录组数据也显示,与光合作用相关的KEGG通路高度积累(图1)。gydF4y2Ba6gydF4y2Bag),在盐度条件下,叶绿素生物合成通路相关基因明显下调(图5)。gydF4y2Ba7gydF4y2Baa).作为光合色素和光适应的功能指标[gydF4y2Ba41gydF4y2Ba],为叶绿素浓度比gydF4y2Ba一个gydF4y2Ba对叶绿素gydF4y2BabgydF4y2Ba在盐度条件下明显高于对照条件(图5)。gydF4y2Ba3.gydF4y2BaD),说明盐度对叶绿素的抑制作用更为明显gydF4y2BabgydF4y2Ba比叶绿素gydF4y2Ba一个gydF4y2Ba.此外,总叶绿素与类胡萝卜素的浓度比提示了衰老、胁迫或光合作用损伤的发生[gydF4y2Ba41gydF4y2Ba],而盐度降低了总叶绿素与类胡萝卜素的浓度比(图。gydF4y2Ba3.gydF4y2BaD),说明叶绿素对盐致损害更为敏感。gydF4y2Ba
花青素是植物中重要的次生代谢产物和非酶促抗氧化剂[gydF4y2Ba27gydF4y2Ba].生理和转录组数据都证实了在盐度条件下花青素的过度积累。gydF4y2Ba3.gydF4y2BaE和b-g),可以保护油菜籽叶片免受盐胁迫下的过度光致损伤。此外,通过转录组学分析,发现了一些可能参与盐诱导花青素生物合成的中心基因的显著上调,如gydF4y2BaBnaCn。PAP1gydF4y2Ba,gydF4y2BaBnaC3。PAP2gydF4y2Ba,gydF4y2BaBnaA6.bHLH122gydF4y2Ba,gydF4y2BaBnaC7。WD40gydF4y2Ba(无花果。gydF4y2Ba7gydF4y2Bac g)。先前的研究表明,在盐度条件下,渗透调节剂水平发生显著变化[gydF4y2Ba31gydF4y2Ba].在盐度下,可溶性蛋白、脯氨酸、丙二醛和可溶性糖浓度显著增加(图1)。gydF4y2Ba4gydF4y2Baa).然而,本研究中没有发现甜菜碱在盐度下的显著变化,这与以往的研究结果不同([gydF4y2Ba31gydF4y2Ba,gydF4y2Ba42gydF4y2Ba].这表明甜菜碱可能不参与油菜SSR的渗透调节。gydF4y2Ba
转录组学辅助解剖油菜植物对盐度的组学反应gydF4y2Ba
减少钠gydF4y2Ba+gydF4y2Ba含量和增加KgydF4y2Ba+gydF4y2Ba含量是提高植物抗盐性的关键。在盐度下,NagydF4y2Ba+gydF4y2Ba/ KgydF4y2Ba+gydF4y2Ba比值显著增加,影响植物的多种代谢反应[gydF4y2Ba43gydF4y2Ba].在这项研究中,NagydF4y2Ba+gydF4y2Ba在盐度条件下,嫩枝中的浓度高于根部(图5)。gydF4y2Ba5gydF4y2Bad),这可能进一步导致嫩枝生物量减少的程度更高(图。gydF4y2Ba5gydF4y2Bah).根系先受盐度处理,盐度对嫩枝的抑制作用强于对根系的抑制作用。转录组学结果显示,在茎和根中分别鉴定出13107和14203个DEGs(图1)。gydF4y2Ba6gydF4y2Bac, d)。根中deg的数量明显多于嫩枝,这可能与根先受盐度影响有关。gydF4y2Ba
盐度条件除了降低阳离子浓度外,还使B浓度明显降低(图5)。gydF4y2Ba5gydF4y2Ba),这与b摄取通道基因的下调一致gydF4y2BaBnaNIP5; 1gydF4y2Ba(无花果。gydF4y2Ba11gydF4y2Bac).在盐度条件下,油菜籽叶片变得更厚、更弯曲、更脆弱(图5)。gydF4y2Ba1gydF4y2Baa),这与油菜籽植物缺乏B所引起的症状相似[gydF4y2Ba44gydF4y2Ba].盐度对细胞壁超微结构和成分(主要是果胶)也有显著影响(图1)。gydF4y2Ba4gydF4y2BaC),相对含水量[gydF4y2Ba45gydF4y2Ba和水通道蛋白活性(图。gydF4y2Ba11gydF4y2Ba),受B族营养状况的调节[gydF4y2Ba44gydF4y2Ba].在油菜籽中,缺B会加重盐胁迫对植株生长的抑制作用[gydF4y2Ba46gydF4y2Ba].由此可见,B与盐度之间可能存在着密切的串扰,适当施用外源B可以减轻植物的盐害。gydF4y2Ba
转录组学辅助鉴定油菜籽盐反应基因家族核心成员gydF4y2Ba
本研究在盐度条件下对油菜籽植株的形态和生理变化进行了研究。gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4gydF4y2Ba而且gydF4y2Ba5gydF4y2Ba).此外,通过高分辨率转录组学分析,发现了参与渗透调节物质、细胞壁成分、抗氧化酶、植物激素和矿质营养物质运输的中心盐碱化响应基因(图5)。gydF4y2Ba7gydF4y2Ba,gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10gydF4y2Ba而且gydF4y2Ba11gydF4y2Ba).脯氨酸是植物抗盐性的关键渗透调节物质,可能参与短期盐胁迫下植物激素代谢的调节[gydF4y2Ba47gydF4y2Ba].在盐度条件下,鉴定了与脯氨酸生物合成有关的核心基因,包括gydF4y2BaBnaA5。P5CS1gydF4y2Ba,gydF4y2BaBnaA7。燕麦gydF4y2Ba,gydF4y2BaBnaC9。P5CRgydF4y2Ba,gydF4y2BaBnaAn。PDH1gydF4y2Ba(无花果。gydF4y2Ba8gydF4y2BaA)将为油菜耐盐性的分子调控提供关键基因。在盐冲击下,三个基因(gydF4y2BaBnaC08g42970DgydF4y2Ba,gydF4y2BaBnaC6。CAT3gydF4y2Ba,gydF4y2BaBnaC7。APX6gydF4y2Ba)编码SOD、CAT和APX。gydF4y2Ba8gydF4y2Bac),分别在盐诱导的ROS清除中发挥核心作用,有助于缓解细胞损伤。植物激素,调节植物发育和调节非生物胁迫抗性[gydF4y2Ba48gydF4y2Ba],在本研究盐度条件下发生显著变化(图。gydF4y2Ba9gydF4y2Ba).NCED是ABA生物合成的速率限制酶gydF4y2BaOsNCED5gydF4y2Ba过表达,增加ABA水平,增强水稻耐盐性[gydF4y2Ba48gydF4y2Ba].此外,JA还能增强马铃薯植株对盐胁迫的体外抗性[gydF4y2Ba49gydF4y2Ba].在本研究中,有几个关键gydF4y2BaNCED3gydF4y2Ba而且gydF4y2BaJARgydF4y2Ba同系物,如gydF4y2BaBnaA1。NCED3gydF4y2Ba而且gydF4y2BaBnaC4。JAR1agydF4y2Ba,分别被鉴定为调节ABA和JA生物合成的核心基因(图。gydF4y2Ba9gydF4y2Ba),这将为在盐度条件下调节植物激素稳态提供关键基因。NagydF4y2Ba+gydF4y2Ba/ KgydF4y2Ba+gydF4y2Ba体内平衡是适应盐胁迫的必要条件。nhx介导的钠分隔gydF4y2Ba+gydF4y2Ba进入液泡是植物抗盐胁迫的关键[gydF4y2Ba50gydF4y2Ba].在这项研究中,gydF4y2BaBnaC2。NHX1agydF4y2Ba而且gydF4y2BaBnaC9。SOS1gydF4y2Ba,被鉴定为调节液泡Na的核心基因gydF4y2Ba+gydF4y2Ba封存和NagydF4y2Ba+gydF4y2Ba流出(图gydF4y2Ba10gydF4y2Ba),被认为是维持Na的优良基因资源gydF4y2Ba+gydF4y2Ba体内平衡。通过转录组学辅助对盐胁迫响应基因家族核心成员的鉴定和鉴定,为油菜抗盐胁迫基因改造提供了优秀的基因资源。gydF4y2Ba
结论gydF4y2Ba
在盐度下,植物已经进化出多方面的适应策略来应对有害的损害[gydF4y2Ba51gydF4y2Ba].本研究一方面揭示了盐胁迫下油菜籽根系和嫩枝的形态生理和组学变化。另一方面,本研究通过高分辨率表达谱分析,确定了多拷贝家族成员中编码抗氧化酶、植物激素、营养转运蛋白等胁迫响应蛋白的核心基因,为油菜耐盐种质分子育种提供了精英和明确的基因资源。gydF4y2Ba
方法gydF4y2Ba
生长条件和盐处理gydF4y2Ba
考虑到中双11号(冬季油菜品种)基因组序列信息众所周知,是油质高、产籽量大、抗逆性强的优良基因型[gydF4y2Ba19gydF4y2Ba],以中双11号为油菜籽品系进行后续试验。油菜籽苗,最初由黄金勇教授(gydF4y2Bajinyhuang@zzu.edu.cngydF4y2Ba,郑州大学,郑州,450,001,中国河南),用霍格兰营养液在光照生长室内水培生长[gydF4y2Ba52gydF4y2Ba].根据Hua等人的报告设置栽培条件。[gydF4y2Ba52gydF4y2Ba].gydF4y2Ba
为了测定形态生理参数,将种子萌发7 d后的均匀油菜籽植株在无nacl(对照)条件下生长10 d。之后,将植株置于含0-250 mM NaCl的溶液中处理5天,直至植株取样。为了进行转录组测序,种子萌发7天后均匀的油菜籽植株在无NaCl条件下生长10 d,然后更换到含200 mM NaCl的溶液中培养12 h,直到取样。gydF4y2Ba
叶和根系体系结构分析gydF4y2Ba
采用LI-COR LI-3100C叶面积仪测定油菜籽植株总叶面积。比叶重用于评价叶片厚度,其计算公式为:比叶重(g FW cmgydF4y2Ba−2gydF4y2Ba=叶FW (g) /叶面积(cm .gydF4y2Ba2gydF4y2Ba) [gydF4y2Ba53gydF4y2Ba].gydF4y2Ba
对油菜籽幼苗的根系进行图像扫描,然后使用WinRHIZO Pro (Regent Instruments, QC, Canada)分析根系总长度、根系体积、根系表面积和根系平均直径。gydF4y2Ba
Photosynthesis-related参数分析gydF4y2Ba
采用Li-Cor 6400光合系统测定以下净光合速率(gydF4y2BaPgydF4y2BangydF4y2Baμ摩尔米gydF4y2Ba−2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba)、气孔导度(gydF4y2BaggydF4y2Ba年代gydF4y2Ba摩尔HgydF4y2Ba2gydF4y2BaO mgydF4y2Ba−2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba),细胞间有限公司gydF4y2Ba2gydF4y2Ba浓度(gydF4y2BaCgydF4y2Ba我gydF4y2Baμ摩尔,摩尔gydF4y2Ba−1gydF4y2Ba)、蒸腾速率(gydF4y2BaTgydF4y2BargydF4y2Ba,更易与HgydF4y2Ba2gydF4y2BaO mgydF4y2Ba−2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba).的gydF4y2BaPngydF4y2BaggydF4y2Ba年代gydF4y2Ba,gydF4y2BaCgydF4y2Ba我gydF4y2Ba,gydF4y2BaTgydF4y2BargydF4y2Ba在光子强度为1300 μmol mgydF4y2Ba−2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba叶温28.0±1.0℃,相对湿度50.0%±1%,大气COgydF4y2Ba2gydF4y2Ba浓度400±5.0 mmol molgydF4y2Ba−1gydF4y2Ba.gydF4y2Ba
用SPAD-502叶绿素仪(Konica Minolta, Tokyo, Japan)测定油菜籽叶片的SPAD值。用80%异丙醇(v/v)在黑暗中提取叶绿素和类胡萝卜素色素24小时,然后用UV-1800分光光度计(MAPADA, Shanghai, China)在663.2、646.8和470 nm处测定纯化提取物的浓度。用分离缓冲液(CHgydF4y2Ba3.gydF4y2Ba哦:HgydF4y2Ba2gydF4y2BaO: HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba= 60:13:2,gydF4y2BavgydF4y2Ba/gydF4y2BavgydF4y2Ba/gydF4y2BavgydF4y2Ba).随后,用紫外-1800分光光度计在530和657 nm下测定提取物的浓度。gydF4y2Ba
显微镜分析gydF4y2Ba
油菜籽叶片约1毫米gydF4y2Ba2gydF4y2Ba用透射电子显微镜(H-7650;日立,日本东京)[gydF4y2Ba54gydF4y2Ba].使用扫描电子显微镜(JSM-6390/LV, JEOL,东京,日本)测定采样叶片的气孔密度、形态和蜡皮[gydF4y2Ba55gydF4y2Ba].具有至少三个独立生物重复的叶片样品被用于电子显微镜分析。gydF4y2Ba
Ionomic分析gydF4y2Ba
将过干的茎和根组织加入HNO中gydF4y2Ba3.gydF4y2Ba/ HClOgydF4y2Ba4gydF4y2Ba混合(4:1,v/v)在200°C直到消化完成。用电感耦合等离子体质谱(ICP-MS;NexIONTM 350 x, PerkinElmer)。gydF4y2Ba
渗透调节物质的测定gydF4y2Ba
用硫代巴比妥酸提取丙二醛(MDA),在450 nm、532 nm和600 nm波长下分光光度法测定其浓度[gydF4y2Ba50gydF4y2Ba].用紫外分光光度计(UV-160,岛津,日本东京)测定脯氨酸浓度,采用茚三酮测定法[gydF4y2Ba56gydF4y2Ba].gydF4y2Ba
用Bradford试剂测定可溶性蛋白浓度,在595 nm处测定样品提取物的吸光度[gydF4y2Ba57gydF4y2Ba].用蒽酮法测定油菜籽植物乙醇提取物中可溶性糖的含量[gydF4y2Ba58gydF4y2Ba].采用0.375% (w/v) Reinecke盐提取甜菜碱,采用[gydF4y2Ba59gydF4y2Ba],在525 nm处读取吸光度[gydF4y2Ba60gydF4y2Ba].gydF4y2Ba
植物激素测定gydF4y2Ba
制备新鲜油菜籽样品,以获得植物激素提取物[gydF4y2Ba61gydF4y2Ba].标准生长素(吲哚-3-乙酸,IAA),细胞分裂素(CTK),赤霉素(GA),脱落酸(ABA),茉莉酸(JA)和ABA从Sigma-Aldrich (St. Louis, MO, USA)或OlChemIm (OlChemIm, Olomouc,捷克共和国)购买。采用超快速液相色谱-电喷雾电离串联质谱法(UFLC-ESI-MS)测定植物激素浓度[gydF4y2Ba62gydF4y2Ba].gydF4y2Ba
活性氧测定及酶活性测定gydF4y2Ba
新鲜的叶子和根被采集并立即冷冻。用磷酸钾缓冲液(pH 7.8)和0.1% (w/v)三氯乙酸制备OgydF4y2Ba2gydF4y2Ba−gydF4y2Ba和HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba分别提取。用分光光度法分别在530 nm和390 nm波长处测定上述提取液的吸光度[gydF4y2Ba63gydF4y2Ba].gydF4y2Ba
采用硝基蓝四唑法在560 nm下分光光度法测定SOD活性[gydF4y2Ba64gydF4y2Ba].通过在470 nm处监测愈创木酚的形成,分光光度法测定POD活性[gydF4y2Ba65gydF4y2Ba].CAT活性计算依据Aebi的研究[gydF4y2Ba66gydF4y2Ba].用抗坏血酸盐在290 nm氧化法测定APX活性[gydF4y2Ba67gydF4y2Ba].gydF4y2Ba
高通量转录组测序gydF4y2Ba
种子萌发7天后的油菜籽幼苗在无NaCl条件下生长10天,然后转移到添加200 mM NaCl的营养液中培养12 h,直至取样。gydF4y2Ba
采集上述油菜籽植株的嫩枝和根,每个处理使用三个独立的生物重复。使用预冷冻的Trizol (Takara Bio Inc., Kusatsu, Shiga, Japan)分离总RNA,然后评估RNA完整性数(RIN)。共获得12份RIN值为> 8.0的RNA样本,构建链特异性cDNA文库,并在Illumina Hiseq 4000平台上进行双端测序(读取长度为150 bp)。将FPKM值归一化以量化基因表达丰度,FDR和gydF4y2BaPgydF4y2Ba< 0.05值用于差异表达基因(DEGs)的鉴定[gydF4y2Ba23gydF4y2Ba].豹(gydF4y2Bahttp://www.pantherdb.org/data/gydF4y2Ba) [gydF4y2Ba68gydF4y2Ba]及KEGG (gydF4y2Bahttp://www.kegg.jp/gydF4y2Ba) [gydF4y2Ba69gydF4y2Ba]分别用于对DEGs进行GO和途径富集分析。显示差异基因表达的热图使用多重实验观察器(gydF4y2Bahttp://www.tm4.org/mev.htmlgydF4y2Ba) [gydF4y2Ba70gydF4y2Ba].gydF4y2Ba
逆转录定量聚合酶链反应分析gydF4y2Ba
根据制造商的建议,使用预冷冻TRIzol试剂(Invitrogen, Carlsbad, CA, USA)提取每个样本的总RNA。用无rnase - DNase I处理RNA样本后,将总RNA作为模板,使用带有gDNA Eraser的PrimeScript™逆转录(RT)试剂Kit进行cDNA合成(Perfect Real Time;豆类、志贺、日本)。为了检测目标基因的相对表达,rt -定量聚合酶链式反应(RT-qPCR)检测在应用生物系统StepOne™Plus系统(赛默飞世尔科学公司,Waltham, MA, USA)下进行。RT-qPCR程序按如下热循环设置:95°C 3 min, 95°C 10 s, 60°C 30 s循环40次。用两个公共管家基因将目标基因的表达水平归一化,gydF4y2BaBnaEF1 -αgydF4y2Ba[gydF4y2Ba71gydF4y2Ba),gydF4y2BaBnaGDI1gydF4y2Ba[gydF4y2Ba72gydF4y2Ba,基于2gydF4y2Ba——ΔΔCgydF4y2BaTgydF4y2Ba方法(gydF4y2Ba73gydF4y2Ba].本研究使用的RT-qPCR引物见补充表SgydF4y2Ba1gydF4y2Ba.gydF4y2Ba
统计分析gydF4y2Ba
使用统计产品和服务解决方案17.0 (SPSS, Chicago, IL, USA)进行统计测试。单向方差分析,然后是Tukey的诚实显著差异(gydF4y2BaPgydF4y2Ba< 0.05,gydF4y2BaPgydF4y2Ba< 0.01,gydF4y2BaPgydF4y2Ba< 0.001)采用多重比较检验来确定显著性差异。gydF4y2Ba
数据和材料的可用性gydF4y2Ba
如欲复制研究结果所需的资料及资料,请联络通讯作者华英鹏博士(gydF4y2Bayingpenghua@zzu.edu.cngydF4y2Ba).转录组测序的原始数据已提交美国国家生物技术信息中心(NCBI) (gydF4y2Bahttp://www.ncbi.nlm.nih.gov/gydF4y2Ba)与PRJNA340053的生物项目。gydF4y2Ba
缩写gydF4y2Ba
- 阿坝:gydF4y2Ba
-
脱落酸gydF4y2Ba
- 一种蛋白激酶:gydF4y2Ba
-
拟南芥KgydF4y2Ba+gydF4y2Ba交通系统gydF4y2Ba
- AtKC1:gydF4y2Ba
-
拟南芥gydF4y2BaKgydF4y2Ba+gydF4y2Ba通道gydF4y2Ba
- APX型:gydF4y2Ba
-
抗坏血酸盐过氧化物酶gydF4y2Ba
- 贝斯:gydF4y2Ba
-
胆汁酸:NagydF4y2Ba+gydF4y2Ba同向转运蛋白家族gydF4y2Ba
- 猫:gydF4y2Ba
-
过氧化氢酶gydF4y2Ba
- CHX:gydF4y2Ba
-
阳离子/小时gydF4y2Ba+gydF4y2Ba换热器gydF4y2Ba
- CNBD:gydF4y2Ba
-
环核苷酸结合域gydF4y2Ba
- 注册会计师:gydF4y2Ba
-
阳离子/小时gydF4y2Ba+gydF4y2Ba逆向转运gydF4y2Ba
- 与原:gydF4y2Ba
-
细胞分裂素gydF4y2Ba
- 度:gydF4y2Ba
-
差异表达基因gydF4y2Ba
- 遗传算法:gydF4y2Ba
-
赤霉酸gydF4y2Ba
- 植物人:gydF4y2Ba
-
封闭的外向整流钾gydF4y2Ba+gydF4y2Ba通道gydF4y2Ba
- GS / GOGAT:gydF4y2Ba
-
谷氨酰胺合成酶/谷氨酰胺氧戊二酸转氨酶gydF4y2Ba
- 在野阵营:gydF4y2Ba
-
高亲和性KgydF4y2Ba+gydF4y2Ba转运体gydF4y2Ba
- 国际宇航科学院:gydF4y2Ba
-
吲哚乙酸gydF4y2Ba
- 是:gydF4y2Ba
-
茉莉酸gydF4y2Ba
- 凯特:gydF4y2Ba
-
KgydF4y2Ba+gydF4y2Ba频道gydF4y2Ba拟南芥gydF4y2Ba
- 山:gydF4y2Ba
-
KgydF4y2Ba+gydF4y2Ba射流逆向转运gydF4y2Ba
- KT:gydF4y2Ba
-
KgydF4y2Ba+gydF4y2Ba转运体gydF4y2Ba
- KUP:gydF4y2Ba
-
KgydF4y2Ba+gydF4y2Ba吸收转运体gydF4y2Ba
- MDA:gydF4y2Ba
-
丙二醛gydF4y2Ba
- NHX:gydF4y2Ba
-
NagydF4y2Ba+gydF4y2Ba/小时gydF4y2Ba+gydF4y2Ba换热器gydF4y2Ba
- 圆荚体:gydF4y2Ba
-
过氧化物酶gydF4y2Ba
- RT-qPCR:gydF4y2Ba
-
逆转录定量聚合酶链反应gydF4y2Ba
- SKOR:gydF4y2Ba
-
恒星KgydF4y2Ba+gydF4y2Ba外在的整流器gydF4y2Ba
- SOD:gydF4y2Ba
-
超氧化物歧化酶gydF4y2Ba
- 紧急求救信号:gydF4y2Ba
-
盐过度敏感gydF4y2Ba
参考文献gydF4y2Ba
作物的耐盐性——代价是什么?新植醇。2015;208:668 - 73。gydF4y2Ba
杨永强,郭燕。植物盐胁迫反应的分子机制研究。新植醇。2018;217:523-39。gydF4y2Ba
Smith P, House JI, Bustamante M,等。土地使用和管理带来的全球变化对土壤的压力。中国生物医学杂志2016;22:1008-28。gydF4y2Ba
向盐生植物学习:提高作物非生物胁迫耐受性的生理基础和策略。安机器人。2016;112:1209-21。gydF4y2Ba
Suzuki K, Yamaji N, Costa A,等。OsHKT1;4介导的Na(+)在茎中的转运是盐胁迫下水稻生殖生长期叶片Na(+)排异的主要原因。BMC Plant Biol. 2016;16:22。gydF4y2Ba
杨志强,杨文华,杨文华,等。植物耐盐机理。植物学报2008;59:651-81。gydF4y2Ba
Raddatz N, Morales de Los Ríos L, Lindahl M, Quintero FJ, Pardo JM。硝酸盐,钾和钠的协调运输。植物科学进展2020;11:247。gydF4y2Ba
张敏,曹勇,王铮,王志强,石晶,梁旭,宋伟,陈强,赖军,蒋聪。一个HKT1家族钠转运蛋白的逆转录转座子引起叶钠的变异gydF4y2Ba+gydF4y2Ba玉米的排斥性和耐盐性。新植醇。2018;217:1161 - 76。gydF4y2Ba
陈小刚,陆晓坤,舒宁,王德龙,王松,王俊杰,郭丽霞,郭晓宁,范文力,林志祥,叶雯雯。GhSOS1是一种质膜钠gydF4y2Ba+gydF4y2Ba从陆地棉中提取/H+反转运蛋白基因,增强转基因棉花的耐盐性gydF4y2Ba拟南芥gydF4y2Ba.《公共科学图书馆•综合》。2017;12:e0181450。gydF4y2Ba
吴海红,Shabala L,周敏,苏宁,吴强,Ul-Haq T,朱杰,Mancuso S, Azzarello E, Shabala SgydF4y2Ba+gydF4y2Ba贮藏而非排除吸收与大麦的耐盐性有关。植物j . 2019; 100:55 - 67。gydF4y2Ba
Ward PR, Fillery IRP, Maharaj EA, Dunin FX。原生班克西亚林地和邻近林地的水分收支和养分gydF4y2Ba紫花苜蓿gydF4y2Ba牧场。土壤植物。2003;257:305-19。gydF4y2Ba
朱镕基JK。植物耐盐。植物学报2001;6:66-71。gydF4y2Ba
测试员M,达文波特R. NagydF4y2Ba+gydF4y2Ba宽容和NagydF4y2Ba+gydF4y2Ba高等植物的运输。安机器人。2003;91:503-27。gydF4y2Ba
Wani SH, Kumar V, Khare T,等。植物工程耐盐性研究进展与展望。足底。2020;251:76。gydF4y2Ba
Blackshaw R, Johnson E, Gan YT, May W, McAndrew D, Barthet V, McDonald T, Wispinski D.加拿大大草原上生物柴油原料的替代油籽作物。植物生态学报,2011;32(2):389 - 396。gydF4y2Ba
王新伟,王喆,王杰,等。中多倍体作物物种的基因组gydF4y2Ba芸苔属植物拉伯gydF4y2Ba.Nat麝猫。2011;43:1035-9。gydF4y2Ba
拜耳PE, Hurgobin B, Golicz AA,等。组装与比较两者密切相关gydF4y2Ba芸苔属植物显著gydF4y2Ba基因组。植物工程学报,2017;15:1602-10。gydF4y2Ba
Chalhoub B, deneud F, Liu S,等。植物遗传学。后新石器时代早期异源多倍体进化gydF4y2Ba芸苔属植物显著gydF4y2Ba油料基因组。科学。2014;345:950-3。gydF4y2Ba
孙福,范刚,胡强,等。高质量的基因组gydF4y2Ba芸苔属植物显著gydF4y2Ba品种“ZS11”在半冬季型中表现出渗透历史。植物j . 2017; 92:452 - 68。gydF4y2Ba
方勇军,李军,蒋建军,耿永林,王建林,王毅平。生理和表观遗传学分析gydF4y2Ba芸苔属植物显著gydF4y2Ba种子萌发对盐胁迫的响应。植物学报,2017;39:128。gydF4y2Ba
盐胁迫对水稻根系形态和根毛性状的影响gydF4y2Ba芸苔属植物显著gydF4y2Ba.植物(巴塞尔)。2019; 8:192。gydF4y2Ba
Mohamed IAA, Shalby N, Bai C,等。气孔性状和光合性状与研究植物对氯化钠的耐受性有关gydF4y2Ba芸苔属植物显著gydF4y2Bal .品种。植物(巴塞尔)。2020; 9:62。gydF4y2Ba
万和平,陈丽丽,郭建彪,李强,文杰,易斌,马长忠,涂建新,付道堂,沈建新。全基因组关联研究揭示油菜耐盐相关性状的遗传结构(gydF4y2Ba芸苔属植物显著gydF4y2Bal .)。植物科学进展2017;8:593。gydF4y2Ba
shokrii - gharelo R, Noparvar PM。油菜对盐胁迫的分子响应:耐盐机制的探讨。同行j . 2018; 6: e4822。gydF4y2Ba
熊建林,王慧萍,谭晓燕,张丽玲,Naeem MS. 5-氨基乙酰丙酸通过调节四吡咯和脯氨酸代谢提高植物耐盐性gydF4y2Ba芸苔属植物显著gydF4y2BaNaCl胁迫下的L.幼苗。植物物理与生物化学,2018;124:88-99。gydF4y2Ba
Demidchik V, Straltsova D, Medvedev SS, Pozhvanov GA, Sokolik A, Yurin V.应力诱导电解质泄漏:K+渗透通道的作用及其在程序性细胞死亡和代谢调节中的参与。J Exp Bot 2004; 65:1259-70。gydF4y2Ba
Chaves-Silva S, Santos ALD, Chalfun-Júnior A,赵杰,Peres LEP, Benedito VA.了解植物花青素生物合成的遗传调控——培育紫色果蔬品种的工具。植物化学。2018;153:11-27。gydF4y2Ba
梁晓伟,张磊,Natarajan SK, Becker DF。2013.胁迫生存的脯氨酸机制。Antioxid。氧化还原信号。2013;19:998 - 1011。gydF4y2Ba
田文华,武田美,小林美,等。活性氧产生酶活性的比较分析gydF4y2Ba拟南芥gydF4y2BaNADPH氧化酶类。植物j . 2019; 98:291 - 300。gydF4y2Ba
梅勒N, Band LR, Pěnčík A,等。生长素氧化酶和结合酶AtDAO1和GH3的动态调控可调节生长素的内稳态。中国生物医学工程学报2016;113:11022-7。gydF4y2Ba
刘亮,王斌,刘东,邹春玲,吴培瑞,王振英,王亚波,李春芳。甜菜根系碳氮代谢改变对盐胁迫的适应机制的转录组学和代谢组学分析。BMC Plant Biol. 2020;20:138。gydF4y2Ba
Krishnamurthy P, Vishal B, Khoo K, Rajappa S, Loh CS, Kumar PP. AoNHX1的表达提高了水稻和拟南芥的耐盐性,bHLH转录因子调控了拟南芥中的AtNHX1和AtNHX6。植物细胞学报2019;38:1299-315。gydF4y2Ba
高丽敏,刘敏,王敏,沈睿睿,郭sw。在硝酸盐营养条件下,盐耐受性增强与胞外钠有关gydF4y2Ba+gydF4y2Ba菜籽菜的含量(gydF4y2Ba芸苔属植物显著gydF4y2BaL.)和大米(gydF4y2Ba栽培稻gydF4y2Bal .)植物。植物细胞物理学报2016;57:23 - 33。gydF4y2Ba
金涛,孙云云,赵瑞仁,单铮,盖建勇,李颖。过氧化物酶基因GsPRX9的过表达使大豆具有耐盐性。国际分子科学2019;20:3745。gydF4y2Ba
卞晓红,李伟,牛长青,等。在大豆驯化过程中选择的B类热冲击因子通过促进类黄酮的生物合成有助于大豆的耐盐性。新植醇。2020;225:268 - 83。gydF4y2Ba
转基因耐盐番茄植株在叶子中积累盐,但在果实中不积累盐。生物科技Nat》。2001;19:765-8。gydF4y2Ba
王敏,袁俊杰,秦林明,史文敏,夏刚,刘士伟。TaCYP81D5是小麦细胞色素P450基因簇中的一个成员,通过活性氧清除使其具有耐盐性。植物工程学报,2020;18:791-804。gydF4y2Ba
Devkar V, Thirumalaikumar VP, Xue GP, Vallarino JG, Turečková V, Strnad M, Fernie AR, Hoefgen R, muller - roeber B, Balazadeh s番茄SlTAF1在盐胁迫响应中的多方面调控功能。新植醇。2020;225:1681 - 98。gydF4y2Ba
Park YC, Lim SD, Moon JC, Jang CS。一个非常有趣的水稻新基因H2-type E3连接酶OsSIRH2-14通过泛素/26S蛋白酶体介导的盐相关蛋白降解增强耐盐性。植物细胞环境学报2019;42:3061-76。gydF4y2Ba
耿刚,吕超,steanato P,李瑞仁,刘红,于丽华,王一刚。对甜菜盐敏感和耐盐基因型的转录组分析揭示了甜菜耐盐代谢途径。国际分子科学2019;25:20。gydF4y2Ba
安曼R, Carle R, Conrad J, Beifuss U, Schieber A.高速逆流色谱法从植物材料和膳食补充剂中分离类胡萝卜素。中华化学杂志。2005;1074:99-105。gydF4y2Ba
Soliman M, Elkelish A, Souad T, Alhaithloul H, Farooq M.油菜素内酯种子施氮提高大豆的耐盐性。植物学报,2020;26:501-11。gydF4y2Ba
Almeida DM, Oliveira MM, Saibo NJM。Na的监管gydF4y2Ba+gydF4y2Ba和KgydF4y2Ba+gydF4y2Ba植物内稳态:向提高作物耐盐性的方向发展。journal of Genet Mol Biol. 2017; 40:326-45。gydF4y2Ba
引用本文华耀平,周涛,丁德光,杨启勇,石林,徐福生。油菜基因型对缺硼反应的生理、基因组和转录多样性。J Exp Bot. 2016; 67:5769-84。gydF4y2Ba
García-Sánchez F, Simón-Grao S, Martínez-Nicolás JJ, Alfosea-Simón M,刘刚,Chatzissavvidis C, Perez-Perez JG, Cámara-Zapata JM。植物硼中毒和缺硼引起多重胁迫。J危险物质。2020;397:122713。gydF4y2Ba
油菜籽植物生长阶段反应的模拟(gydF4y2Ba芸苔属植物显著gydF4y2BaL.)对盐度和硼的综合应力。国际植物学报2009;3:91-104。gydF4y2Ba
朱颖,蒋旭,张娟,何颖,朱旭,周旭,龚红,尹杰,刘颖。硅通过调节脯氨酸和细胞分裂素使黄瓜抗盐胁迫。植物物理与生物化学,2020;156:209-20。gydF4y2Ba
黄燕,焦燕,谢楠,郭燕,张芳,向志,王锐,王芳,高强,田亮,李丹,陈丽,梁明。gydF4y2BaOsNCED5gydF4y2Ba, 9 -gydF4y2Ba独联体gydF4y2Ba-环氧类胡萝卜素双加氧酶基因调控水稻耐盐、耐水胁迫和叶片衰老。植物科学。2019;287:110188。gydF4y2Ba
艾菲莫娃MV,穆哈马蒂诺娃EA,科夫通IS,卡比勒FF,梅德韦杰娃YV,库兹涅佐夫VV。茉莉酸增强了马铃薯植株对盐胁迫的抗性gydF4y2Ba在体外gydF4y2Ba.生物科学2019;488:149-52。gydF4y2Ba
Kotula L, Garcia Caparros P, Zörb C, Colmer TD, Flowers TJ。利用转基因技术提高作物的耐盐性:最新进展和生理分析。植物细胞环境,2020。gydF4y2Bahttps://doi.org/10.1111/pce.13865gydF4y2Ba.gydF4y2Ba
韩宁,Ebel C, Ngom M, laplase L, Masmoudi K.植物耐盐机制的新认识及其在育种中的应用。植物科学进展2016;7:1787。gydF4y2Ba
华耀平,冯燕,周涛,徐福生。用基因组尺度的mRNA转录组学研究油菜的反应(gydF4y2Ba芸苔属植物显著gydF4y2BaL.)与不同的硼可用性。土壤植物。2017;416:205-25。gydF4y2Ba
韩松,陈少林,蒋海霞,史密斯布瑞,杨立龙,谢春春。缺硼降低柑橘幼苗生长和光合作用,增加叶片淀粉和己糖含量。植物生理学报2008;165:1331-41。gydF4y2Ba
Ribeiro PG, Martins GC, Moreira CG, de Oliveira C, Andrade MLC, Sales TS, Chagas WFT, Labory CRG, de Carvalho TS, Guilherme LRG。高耐锌乡土植物镉与锌的相互作用gydF4y2BaAndropogon gayanusgydF4y2Ba水培栽培:生长终点,金属生物积累,和超微结构分析。2020年国际环境科学与污染研究。gydF4y2Bahttps://doi.org/10.1007/s11356-020-10183-7gydF4y2Ba.gydF4y2Ba
Vandegeer RK, Zhao C, Cibils-Stewart X, Wuhrer R, Hall CR, Hartley SE, Tissue DT, Johnson SN。硅沉积在保卫细胞上增加了由K介导的气孔敏感性gydF4y2Ba+gydF4y2Ba外流,从而减少气孔导度。杂志。2020。gydF4y2Bahttps://doi.org/10.1111/ppl.13202gydF4y2Ba.gydF4y2Ba
邓松,孙杰,赵锐,等。gydF4y2Ba胡杨gydF4y2BaAPYRASE2通过调节囊泡运输和细胞外ATP增强耐冷性gydF4y2Ba拟南芥gydF4y2Ba植物。植物杂志。2015;169:530-48。gydF4y2Ba
贝茨LS,沃尔德伦RP,蒂尔ID。水胁迫研究中游离脯氨酸的快速测定。土壤植物。1973;39:205-7。gydF4y2Ba
利用蛋白质与染料结合的原理,对蛋白质的微克量进行定量的一种快速而灵敏的方法。学生物化学肛门。1976;38:248-52。gydF4y2Ba
BC, Dang TT, Berrin JG, Haltrich D, To KA, Sigoillot JC, Yamabhai M.克隆,表达在gydF4y2Ba毕赤酵母属pastorisgydF4y2Ba和耐热GH5甘露聚糖内参-1,4- β -甘露糖苷酶的表征gydF4y2Ba黑曲霉gydF4y2BaBK01。微生物细胞工厂。2009;8:59。gydF4y2Ba
水溶性季铵盐化合物的快速测定方法。土壤植物。1983;70:303-7。gydF4y2Ba
于俊杰,金旭,孙晓明,高天祥,陈晓明,佘艳梅,蒋涛,陈世祥,戴世杰。杨树叶片过氧化氢反应(gydF4y2Ba杨树simoniigydF4y2Ba×gydF4y2Ba杨树黑质gydF4y2Ba)从生理学和蛋白质组学分析中发现。国际分子科学杂志2017;18:208。gydF4y2Ba
刘海红,李晓红,肖建华,王sp .一种简便的同时定量检测多种植物激素及其代谢物的方法:在水稻-细菌相互作用研究中的应用。工厂方法。2012;宣告。gydF4y2Ba
周涛,华勇,黄毅平,丁大刚,石磊,徐福生。生理和转录分析揭示了植物激素对缺硼的不同反应gydF4y2Ba芸苔属植物显著gydF4y2Ba基因型。植物科学,2016;7:221。gydF4y2Ba
褚晓涛,付俊杰,孙艳芳,徐艳梅,苗艳君,徐艳芳,胡tm。接种丛枝菌根真菌对冷胁迫诱导的黄瓜叶片氧化损伤的影响gydF4y2Ba大高寒草场gydF4y2BaGriseb。科学通报。2016;104:21-9。gydF4y2Ba
傅媛媛,李富芳,徐涛,蔡世杰,褚文英,邱红,沙山,程光勇,徐启勤。生物积累、亚细胞和分子定位及对生理和超微结构的损伤gydF4y2BaNymphoides peltatagydF4y2Ba(Gmel)。O.昆策暴露于钇。环境科学与污染,2014;214:2935-42。gydF4y2Ba
过氧化氢酶的体外培养,vol. 105。纽约:学术;1984.gydF4y2Ba
菠菜叶绿体中过氧化氢被抗坏血酸特异性过氧化物酶清除。植物细胞物理。1981;22:867-80。gydF4y2Ba
Mi H, Lazareva-Ulitsky B, Loo R,等。PANTHER蛋白质族、亚族、功能和途径数据库。《核酸学报》2005;33:D284-8。gydF4y2Ba
金ehisa M,荒木M,后藤S,服部M,平川M,伊藤M,等。KEGG将基因组与生命和环境联系起来。核酸学报2008;36:D480-4。gydF4y2Ba
Eisen MB, Spellman PT, Brown PO, Botstein D.全基因组表达模式的聚类分析和显示。美国国家科学院。1998; 95:14863-8。gydF4y2Ba
美拉德A,艾蒂安P, Diquélou S, Trouverie J, Billard V, Yvin JC, Ourry AgydF4y2Ba芸苔属植物显著gydF4y2Ba改变植物组织的组学组成:关注钼与其他营养物质的相互作用。J Exp Bot. 2016; 67:5631-41。gydF4y2Ba
杨海林,刘娟,黄明明,郭婷婷,邓伯伦,华伟。基于基因组和转录组数据的qRT-PCR新内参基因的筛选与评价gydF4y2Ba芸苔属植物显著gydF4y2Bal基因。2014;538:113-22。gydF4y2Ba
Livak KJ, Schmittgen TD。相关基因表达数据的实时定量PCR分析和2gydF4y2Ba——ΔΔCgydF4y2BaTgydF4y2Ba方法。方法。2001;25:402-8。gydF4y2Ba
确认gydF4y2Ba
不适用。gydF4y2Ba
资金gydF4y2Ba
本研究获得国家自然科学基金项目(31801923、U2004149)、郑州市重大协同创新项目(郑州大学重点学科建设项目)(NO.;郑州大学青年创新工程重点学科资助项目(xkzdjc201905);XKZDQN202002)。gydF4y2Ba
作者信息gydF4y2Ba
从属关系gydF4y2Ba
贡献gydF4y2Ba
HYP、ZT和HJY参与了数据解释。CJQ和LY对油菜籽植株进行栽培,并进行试验。hy和HYP设计了这项研究,HYP和FYN撰写了手稿。所有的作者都阅读并认可了手稿的最终版本。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
伦理批准和同意参与gydF4y2Ba
在本研究中,所有油菜籽植物的种子都来自我们的课题组,课题组由黄金勇教授(gydF4y2Bajinyhuang@zzu.edu.cngydF4y2Ba郑州大学化学系,河南郑州450001)。gydF4y2Ba
同意出版gydF4y2Ba
不适用。gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者声明他们没有竞争利益。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba
施普林格自然对出版的地图和机构附属的管辖权要求保持中立。gydF4y2Ba
补充信息gydF4y2Ba
额外的文件2:gydF4y2Ba
补充图S1。gydF4y2Ba皮尔森gydF4y2Ba每对生物重复RNA-seq数据的相关系数。注意:C,控制;T,处理(200 mM NaCl);年代,拍摄;R,根。gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循创作共用署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),该协议允许在任何媒体或格式中使用、分享、改编、分发和复制,只要您给予原作者和来源适当的署名,提供创作共用许可协议的链接,并说明是否有更改。本文中的图片或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果材料不包含在文章的创作共用许可中,并且您的预期用途不被法律法规允许或超出了允许的用途,您将需要直接从版权所有者那里获得许可。欲查看此许可证的副本,请访问gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.创作共用公共领域奉献放弃书(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)适用于本文提供的数据,除非在数据的信用额度中另有说明。gydF4y2Ba
关于这篇文章gydF4y2Ba
引用这篇文章gydF4y2Ba
冯,Yn。、铜我,Jq., Zhou, T.et al。gydF4y2Ba通过对形态生理反应、体内平衡和转录组分析的综合分析,揭示了异体四倍体油菜籽对盐度的系统性抗性。gydF4y2BaBMC植物杂志gydF4y2Ba20.gydF4y2Ba534(2020)。https://doi.org/10.1186/s12870-020-02734-4gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12870-020-02734-4gydF4y2Ba
关键字gydF4y2Ba
- 异源四倍体油菜籽gydF4y2Ba
- 差异基因表达gydF4y2Ba
- 离子体内平衡gydF4y2Ba
- Morpho-physiologic响应gydF4y2Ba
- 盐度的阻力gydF4y2Ba