抽象的
背景
低温是一种重大的非生物应激,严重限制了红树林生产力和分布。倒卵形秋茄是红树林植物中最耐寒的品种,但其耐寒的分子机制却鲜为人知。渗透素是植物中与非生物和生物胁迫反应相关的关键蛋白,但目前尚无关于该基因的相关信息K倒卵形据报道。
结果
在本研究中,编码渗透蛋白的cDNA序列,KoOsmotin(GenBank登录号。KP267758)被红树林植物克隆K倒卵形. KoOsmotin蛋白由221个氨基酸组成,分子量为24.11 kDa与p我4.92。KoOsmotin包含16个半胱氨酸残基和一个n端信号肽,是大多数桂花素和发病相关5蛋白的共同信号。KoOsmotin的三维(3D)模型,包含一个α.螺旋和11个β-strands由三个特征域形成。Koosmotin的数据库比较显示了渗透素34的最接近的身份(55.75%)Theobroma Cacao..系统发育树还显示Kooosmotin在Osmotin / OLP的分支中聚集(卵黄素样蛋白)。证明了Koosmotin蛋白通过亚细胞定位分析局部地定位于血浆膜和细胞质。基因表达表明KoOsmotin主要是在K倒卵形,但在茎和根中少丰富。过表达的KoOsmotin赋予植物耐寒性大肠杆菌细胞。
结论
正如我们所知,这是第一个探索渗透素K倒卵形.我们的研究为进一步探索的功能提供了有价值的线索KoOsmotin反应压力。
背景
红树林作为一种重要的海洋湿地生态系统,主要分布在热带和亚热带河口,在其生长发育过程中往往会经历多变而复杂的非生物胁迫[1.,2.]。倒卵形秋茄是红树植物中最耐寒的品种。研究表明K倒卵形利用多种生理和结构机制,以快速响应多重应力,如冷,盐度,干旱和水井测井[3.,4.]。作为一种多功能蛋白,渗透素在应对非生物胁迫中起着关键的调节作用[5.,6.]。因此,在我们以前的研究中的冷应激 - 反应基因中[7.], 这osmotin基因可能是最有效的改善候选人之一K倒卵形工作压力。然而,关于渗透素或渗透素样蛋白(OLP)的研究文献较少K倒卵形到目前为止,其他红树林植物。
渗透素是PR-5蛋白家族的成员之一。PR-5通常包括与thaumatin, zeamatin和osmotin相关的蛋白,被认为具有抗真菌活性[8.]。渗透素最初是从烟草细胞培养物中分离出来的[9[然后克隆编码渗透素的基因[10.]。作为预蛋白质,认为卵黄素在液泡内合成,分子量为26.4kDa,而成熟形式为24kDa [11.]。渗透蛋白通常含有十六个保守的半胱氨酸残基,其分布在整个蛋白质中并形成八个二硫化物桥梁[12.]。这些保守的半胱氨酸残基可以有助于稳定分子,精确折叠和防止蛋白酶降解[13.]。Osmotin由三个图案(结构域I-III)组成,其在其他PR-5蛋白如甲磺汀和Zeamatin中显示出类似的折叠[12.]。渗透素是一种不包含内含子、dna结合基序和糖基化位置的分泌蛋白[14.然而,它通常包含一个c端多肽延伸,这是液泡定位所必需的[15.]。
虽然密集的研究已经进行了渗透氨酸的防御功能,但复杂的相互作用osmotin在基因调节中尚不清楚。主要是,许多研究假设这一点osmotin可能是调节基因响应非生物和生物应激的关键基因的转录因子[16.,17.]。然而,后来的证据排除了这一假设,因为渗透素不包含任何dna结合基序[14.]。此外,还显示出血清蛋白,激活丝裂原激活的蛋白激酶(MAPK),这对大多数信号传导和监管过程是基础的[18.]。因此,研究人员最近提出,渗透素是调节植物对各种应激反应的关键调控因子[19.]。此外,Osmotin在保护天然蛋白质结构和修复变性蛋白质中发挥了基本作用[20.]。在盐度和干旱胁迫下,渗透蛋白显示通过溶质的舱室化或结构和代谢变化保持细胞渗透性的能力[21.]。在矮牵牛织布达,渗透素是由几个明显不相关的环境信号诱导的,这说明了基因表达的本质复杂性[22.]。桂花素是由生物和非生物胁迫诱导而来的[22.,23.,24.]。表达的osmotin转基因植物的基因可以增强对寒冷、干旱、高盐及其某些组合的耐受性[19.,25.,26.,27.]。在橄榄植物中,Osmotin的过度表达对CA显示了多种影响2+信号转导、细胞骨架动力学和程序化细胞死亡[28.]。此外,组合过度表达osmotin和逐胰酶基因在转基因水稻中具有增强的抗真菌活性[29.]。研究也支持渗透素与植物中其他与寒冷相关的基因协同活动[25.,30.]。
一种局部核苷酸序列(KO3113)显示高同源性osmotin从cDNA文库中孤立K倒卵形在我们之前的研究中[7.]。在这里,我们进一步克隆并表征了该基因的全长,并命名为它Koosmotin。研究了冷胁迫下该基因在植物系统(根、茎、叶)中的表达模式。通过表达绿色荧光蛋白(GFP)标记,确定KoOsmotin的亚细胞定位KoOsmotin在转基因烟草植物中.此外,通过过表达进行耐寒性的功能分析KoOsmotin在大肠杆菌细胞。本研究将为研究提供良好的开端KoOsmotin应激防御中K倒卵形,并有助于改善红树林植物中应力抗性的机制。
结果
隔离与结构分析KoOsmotin从K.obovata
来自的渗透蛋白cDNA序列K.obovata,指定为KoOsmotin(加入基因库。KP267758),通过SMART™RACE cDNA扩增分离。的核苷酸序列KoOsmotin是1126 BP,其含有666bp开放阅读框(ORF)编码推导的蛋白质长度为221个氨基酸。ORF在ATG启动密码子处在位置196处开始,并在标签终止子密码子处终止于位置861.计算的分子量和p我推定的Koosmotin蛋白分别为24.11kDa和4.92。氨基酸组成分析表明,Koosmotin含有高含量的Gly(8.6%),Ser(8.6%),Cys(7.7%),Ala(6.3%),Thr(6.3%),Asn(6.3%)和val(5.9%),而该TRP占用了最低(1.4%)部分。二次结构分析表明,曲素蛋白包括9.05%α.-Helix,延长股28.96%,4.07%β-turg和57.92%的随机线圈(分布式细节如图2所示。1.).Koosmotin包括19带负电荷的残基(ASP和Glu)和13个带正电荷的残基(Arg和Lys),其在大多数kooosmotin表面上具有负电荷(图。2.b)。此外,预计Kooosmotin的患者水碎率(肉汁)的盛大平均值为-0.158。由于负肉汁值始终显示蛋白质的亲水性,因此表明Koosmotin是一种亲水性PRTOEIN。TMPRED预测分析表明,Koosmotin具有跨膜螺旋(残留物17-33)。Koosmotin还含有两个保守的残基(Asp121和Asp202),其将形成结构中的酸性裂缝区域(图。2.b)。在Addtion中,Kooosmotin具有渗透蛋白的保守特征,例如没有透明的糖基化位置,没有内含子,没有DNA结合的基序和没有过敏丝基序。结果一致与上一份关于Osmotin的报告[14.]。
Koosmotin和其他良好的植物PR-5蛋白的序列对准。只使用完整的已发表的序列。PR-5蛋白中的相同和相似的氨基酸分别是暗和浅灰色的。Koosmotin中的裂解位点由N-末端的红色箭头表示。预料到的α.螺旋和β- 分别在暗盒和白色宽箭头中向上表明序列上方。包含中央裂缝的五个氨基酸的保守位置被红色三角形标记。通过黄色阴影突出显示了十六个保守的半胱氨酸残基,可能参与PR-5蛋白中二硫化物桥的形成。预测为负责细胞外分泌和真空位置的信号肽的N-和C末端伸长率分别用蓝线表示。在红色虚线中盒装的序列显示了Thaumatin Motif G-X-G / F-X-C-X-T / S-G / A-D-C-X-G / Q-X-X-X-X-X-X-X-X-X-X-X-X-C,其是PR-5蛋白的家庭签名。3D结构中的域II和域III分别由序列下的绿色和橙色盒子表示
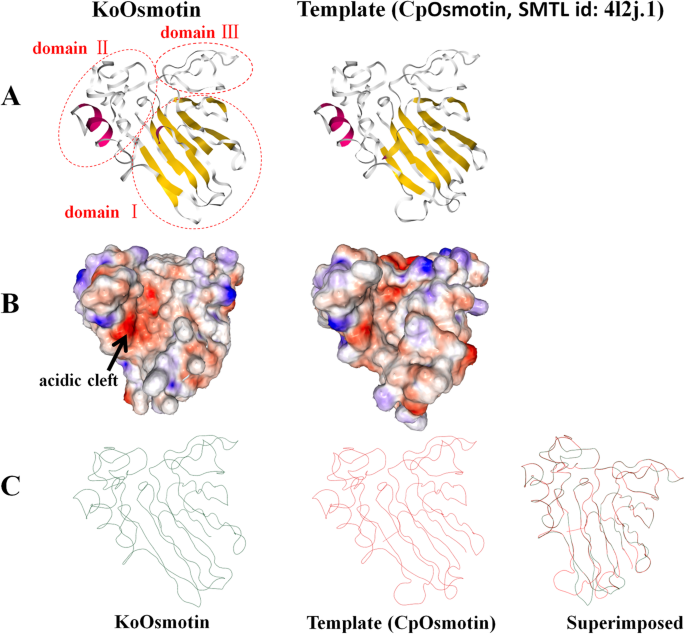
Koosmotin的3D结构预测与其模板Cposmotin的比较。Koosmotin及其模板(CPOSMOTIN,SMTL ID:4L2J.1)的3D模型由同源建模瑞士模型生产。A..图片是预测Koosmotin及其模板的带状结构α.螺旋(红色)β-strand(黄色),随机线圈(白色)。红外椭圆(结构域I,氨基酸1-68,102-142,207-221,氨基酸143-206。结构域III,氨基酸69-101)。三个域在3D拓扑中与其他PR-5蛋白相似。B.图左为KoOsmotin的表面拓扑,右为其模板,显示静电势的分布。根据带正电荷的区域(蓝色),带负电荷的区域(红色)和带中性电荷的区域(白色),蛋白质表面被着色。酸性裂口用一个黑色的箭头表示。C.图中预测了KoOsmotin和CpOsmotin的微量结构及其叠加
NCBI数据库上的BLASTX搜索表明,KOOSMOTIN从Theobroma Cacao.[31.], 100%覆盖率,氨基酸鉴定率为55.75%。BLAST搜索结果显示,KoOsmotin的氨基酸序列与部分PR-5蛋白如thaumatin和thaumatin-like protein (TLP)具有较高的相似性。因此,我们对氨基酸序列进行了多序列比对,以比较KoOsmotin和其他研究得很透彻的PR-5蛋白,包括osmotin [22.,31.]、类渗透蛋白(OLP) [32.,33.], zeamatin [34.]、玉米素样蛋白(ZLP) [35.],thaumatin [36.]及张力腿平台[37.]。虽然KoOsmotin与这8个特征良好的PR-5蛋白的相似性高达52.9%,但KoOsmotin包含了渗透蛋白或PR-5蛋白的特征序列(图1)。1.).基序扫描分析表明,KoOsmotin含有一个非常保守的典型基序(残基27-221),属于thaumatin家族。在KoOsmotin中发现了一种特殊的指纹图谱G-x-G/F-x-C-x-T/S-G/A- d -c -x- g /Q-x-x-x-C,即thaumatin motif(图77-92)。1.). 这种thaumatin基序在渗透蛋白和其他PR-5蛋白中高度保守[38.,39.]。KoOsmotin含有16个半胱氨酸残基,并形成8个二硫键桥。二硫键被认为有助于蛋白质分子的稳定并允许精确折叠[12.]。KoOsmotin中的16个半胱氨酸残基在渗透蛋白和其他PR-5蛋白中高度保守(图1)。1.). 与这些蛋白质类似,库斯莫汀在N末端(残基1-20)附近含有一个分泌信号肽和一个裂解位点(图。1.).虽然C末端域始终存在于Osmotin和Pr-5蛋白中[40], KoOsmotin缺失c -末端多肽,而一些渗透素和其他PR-5蛋白也缺失c -末端多肽(图5)。1.).根据这些结果,KoOsmotin被鉴定为渗透素的一个成员,属于PR-5蛋白家族,参与植物对病原体的防御[41.]。
三维模型KoOsmotin
用同源建模瑞士模型预测KoOsmotin的三级结构[42.]。KoOsmotin与模板(Osmotin: anti真菌乳汁管蛋白,SMTL id: 4l2j.1.A) CpOsmotin的模型同源性最高(58.08%)Calotropis procera[43.]和其他TLP(数据未显示)。由于3D模型的形成需要比较原理氨基酸序列之间的50%相似性[44.]表示Koosmotin的3D模型是合理且应收的。同源造型显示,Koosmotin的结构由三个结构域组成,其在PR-5蛋白中常见。Koosmotin的3D模型包含一个α.- Helix,11β-strands和一些随机线圈,进一步形成了三个特征域:“域I”(残留物1-68,102-142,207-221)包括11个β- 以压实的三明治形式,“域II”(残留物143-206)包含一个α.- elix和“域III”(残留物69-101)包括两个单环(图。2.一种)。结构域I和II在KOOSMOTIN中形成酸性裂缝(图。2.b)。研究报告说,在渗透蛋白中的结构域-II中呈现了许多变化[8.]。然而,KoOsmotin与其模板CpOsmotin之间的显著差异是结构域I。骨架差异表现出可变性,并表现为结构域I的环方向(残基109-112,132-137)的改变(图1)。2.C). KoOsmotin作为一种酸性PR-5蛋白,具有广泛的负区,特别是KoOsmotin分子表面几乎带负电荷。KoOsmotin的静电势分布明显不同于其模板CpOsmotin。(无花果。2.b)。这些骨骼基础和表面静电电位的这些差异可能与PR-5蛋白之间的特异性相互作用和活性作用具有决定性。
系统发育关系KoOsmotin
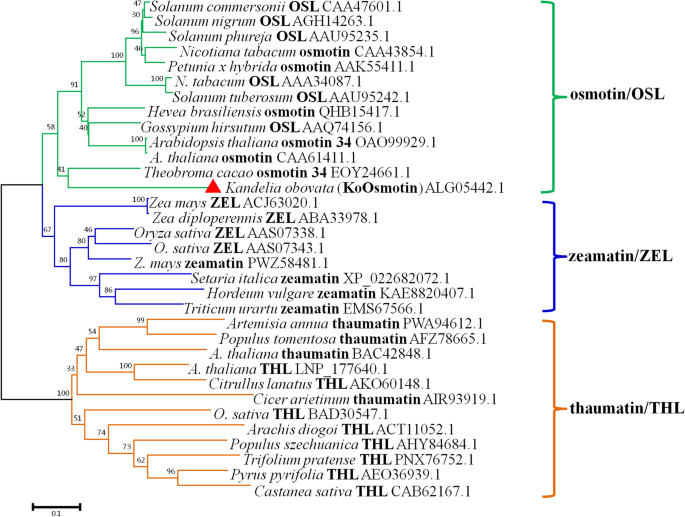
许多植物中都含有桂花素。因此,NCBI数据库中有许多渗透素的部分和完整序列。NCBI数据库显示KoOsmotin与osmotin和其他PR-5蛋白如thaumatin和TLP具有同源性。为了明确KoOsmotin与其他PR-5蛋白的进化关系,构建了系统发育树。33个来自不同植物的PR-5蛋白同源物作为该树的基础。系统发育树由osmotin/OLP、zeamatin/ ZLP、thaumatin/TLP 3个主要聚类组成,每个聚类都包含较高的同源性蛋白。集群组通常受到引导值的良好支持。系统进化树分析表明,KoOsmotin与osmotin/OLP的支持分支亲缘关系较近,与osmotin 34亲缘关系最密切t .可可(无花果。3.),进一步证明了KoOsmotin是一种渗透素。系统发育分析还表明,来自同一种的PR-5蛋白有相当大的变异,如拟南芥和奥雅萨苜蓿. 进化分析表明PR-5蛋白家族具有高度的差异性,证实了PR-5蛋白家族的多样性PR-5.基因家族是一个古代多尾家庭在植物中保守[45.]。
亚细胞本地化KoOsmotin在烟草表皮细胞中
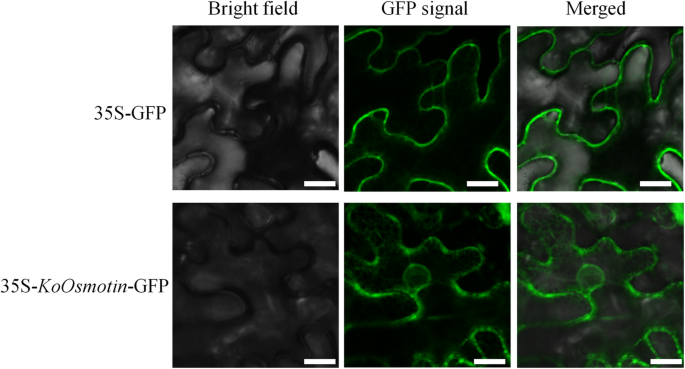
利用在线预测工具Cell-Ploc 2.0和Softberry预测KoOsmotin分别定位于细胞质和液泡中。为了进一步验证KoOsmotin在植物中的亚细胞定位,采用荧光标记35S-KoOsmotin-GFP生成并转化为N. Benthamiana.表皮细胞。如图1所示。4., 35S-KoOsmotin-GFP荧光信号在宿主植物细胞边缘大量聚集,呈斑点分布,在细胞质中扩散较弱。KoOsmotin作为一种成熟的分泌蛋白,存在于细胞质中,可能是由液泡分泌的。然而,在N. Benthamiana.表皮细胞,而仅表达空载体,荧光仅在具有线性分布的血浆膜上观察到,并且它们均未定位于细胞质(图。4.).这些结果表明,Koosmotin将其局部化为血浆膜和细胞质,它们可能满足不同的功能。还证实渗透蛋白在先前研究中将其定位于血浆膜[19.]。
基因表达的KoOsmotin在K倒卵形冷应激诱导
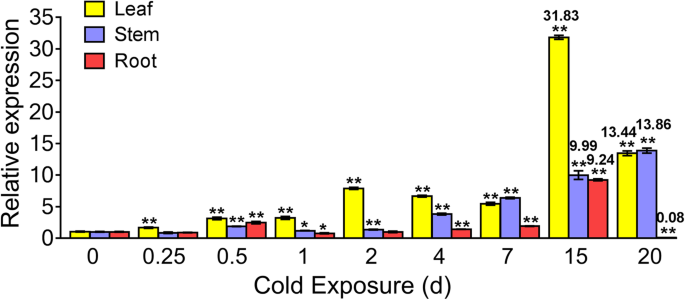
确定表达式模式KoOsmotin冷应激在整个植物中引起的,水平KoOsmotin检查叶片,茎和根部的转录物。从各种组织中分离出总RNAK倒卵形冷刺激后的幼苗。实时定量PCR(RT-QPCR)结果显示基因表达KoOsmotin在冷应激下的叶子中高度诱导,但在茎和根中较低(图。5.).虽然KoOsmotin基因在某些时间点有积极或消极的反应,表达模式KoOsmotin在叶子和根中显示出类似的表达倾向。在叶子中,表达式KoOsmotin在引发冷刺激后诱导并刺激到15d的顶部(31.83倍),但在20 d急剧下降。在根中存在类似的趋势。最高表达水平(9.24倍)KoOsmotin在15 d时也被观察到,20 d时在根中快速诱导。结果表明,20 d时叶片的表达量仍高于对照(0 d)(13.44倍),而根的表达量则低于对照(0.08倍)。有趣的是,在茎中,数量KoOsmotin冷刺激后的延伸时间逐渐增加,并达到20天的峰(13.86倍)。明显,数量KoOsmotin叶片、茎和根的表达量在第7 d时均有少量的诱导,但在第15 d时则急剧增加,达到大量积累。这些结果表明KoOsmotin不同组织,尤其是光合作用发生的叶片,对低温胁迫的后期反应积极。这意味着KoOsmotin基因可能是信令网络的重要组成部分K倒卵形应对寒冷的压力。
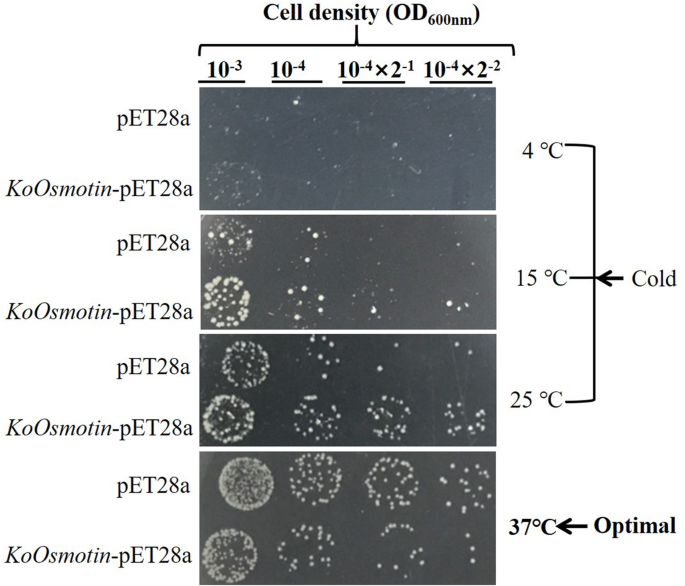
过度的KoOsmotin增强了转化的耐寒性大肠杆菌
目的:探讨…的功能作用KoOsmotin在耐寒性方面,抗寒性强KoOsmotin被克隆和过度表达大肠杆菌.转变大肠杆菌细胞与KoOsmotin生成-pET28a来测试KoOsmotin.在最佳条件下(37°C)大肠杆菌细胞转化为KoOsmotin-Pet28a显示出比对照略微较弱(图。6.).但是,在所有不同的冷处理中(5℃,15℃,25℃),大肠杆菌细胞转化为KoOsmotin-Pet28a与对照相比,在与对照相比时显着提高了增强(图。6.).这些结果表明过表达KoOsmotin能赋予抗寒性吗大肠杆菌并有助于增加增长大肠杆菌冷应激。之前的研究已经证明了这种过度表达osmotin基因可以有助于提高转基因植物的耐寒性[19.,27.]。因此,我们可以推断过度表达KoOsmotin可能在转基因植物中赋予耐寒性。使用大肠杆菌或者其他微生物分析植物基因的功能已在先前的研究中适应[46.,47.,48.,49.]。在这项研究中,功能分析KoOsmotin使用大肠杆菌可用于预测其在转基因植物中的耐受性。这只是函数的开始KoOsmotin在耐寒性中,需要进行进一步的研究。
讨论
在这项研究中,一种冷诱导的osmotin编码酸性PR-5蛋白的基因,指定为KoOsmotin,是由K倒卵形.我们在结构和转录水平上描述了该基因,以及它的亚细胞定位。此外,我们验证了抗寒性KoOsmotin在大肠杆菌细胞。通常,Osmotin的三级结构对山甘油,Zeamatin和TLP同源际[45.]。符合此,Kooosmotin与渗透蛋白显示出最高的相似性,然后根据NCBI数据库和瑞士模型搜索,与Thaumatin或TLP一起进行。通常,基于它们的结构,分子量及其保守的二硫键相互彼此相互作用。此外,Osmotin由三个域组成,所述三个域显示出与Thaumatin和Zeamatin类似的折叠[12.]。本研究的系统发育树结果进一步证实了这三个蛋白之间的密切关系。然而,thaumatin蛋白尝起来是甜的,而osmotin却没有甜的味道[8.]。
在本研究中,KoOsmotin的预测分子量为24.11 kDa,这与宝贵的研究结果一致[11.]表明Koosmotin是一种成熟的蛋白质。C-末端结构域始终存在于Osmotin和Pr-5蛋白中存在[40]。然而,Koosmotin的序列缺乏C末端多肽,其在一些其他渗透蛋白中也不存在,最初纯化为来自健康叶子的成熟蛋白质[31.]。在Zeamatin也发现了一些类似于无C末端伸长的PR-5蛋白[34.],ZLP公司[35.,50.,51.],TLP [38.,52.]及OLP [33.]。据报道,植物渗透素在不同的细胞室内定位,包括血浆膜,液泡,叶绿体和内质网[19.]。生物信息工具预测,Koosmotin局部化为细胞质或液泡或细胞外。通过共聚焦显微镜分析进行的进一步证据显示,Koosmotin主要是局部化的血浆膜,其与Osmotin,TLOSM一致Tripogon loliiformis.[19.].然而,TLOSM具有C末端伸长率,总是认为真空靶向所必需的[40]。此外,许多缺乏C末端伸长率但仅用N-末端信号肽的许多PR-5蛋白通常认为被认为分泌到细胞外基质中[33.,50.],并局部化在植物的痉挛性空间中[38.]. 事实上,共焦显微镜对亚细胞定位的研究显示了不同的现象。因此,渗透素可同时定位于多个细胞室。TMpred分析预测KoOsmotin中有一个跨膜片段,提示这个区域是KoOsmotin质膜定位的原因。通常认为,质膜中含有的蛋白质是应激信号感知和信号转导到下游基因的基础。以前的研究表明osmotin基因可能是上游基因,并参与压力信号转导[14.,22.,30.,40,53.]。这表明Kooosmotin可以用作血浆膜上的应激反应器,并在压力下调节下游基因的关键作用。
KoOsmotin模型在域I和域II之间包含一个酸性裂口。这种酸性裂蛋白被认为是为了确定pr蛋白对其目标受体或配体的特异性,从而具有抗真菌活性,而抗真菌药索马atin没有碱性裂蛋白[12.,45.]。KoOsmotin的酸性裂区是拮抗真菌活性所必需的五个氨基酸残基(Arg64.,gln.104.,Gly.116., Asp121.和Asp202)(图。1.).假设这些氨基残留物负责裂缝周围的拓扑和表面静电电位。在Koosmotin,五种酸性残留物中的三种(arg64., Asp121.和Asp202)在其他PR-5蛋白中保守。另外两个中性和亲水残基(Gln104.和糖果116.)Kooosmotin分别被Glu和Asp取代,所述Glu和Asp在大多数PR-5蛋白中存在。两种酸性残基(Glu和Asp)也被少量PR-5蛋白更换[13.]。在K倒卵形,两个氨基酸(gln104.和糖果116.)与大多数植物的PR-5蛋白不同,这可能表明植物对潮汐环境的特殊胁迫适应K.obovata成长的过程。作为一种分泌蛋白,KoOsmotin可能具有特殊的抗真菌活性K.obovata植物生长在恶劣的自然栖息地。
RT-QPCR结果显示基因表达KoOsmotin在叶子中高度诱导,但在茎和根中较低。此外,表达模式KoOsmotin在根和茎中没有同步。很明显表达了KoOsmotin表现出组织特异性表达,也观察到其他osmotin / OLP基因。在矮牵牛织布达, 这osmotin根中积累量较高,茎叶中积累量较小[22.]. 烟草osmotin伤后主要在花中诱导,而不是在芽中诱导[54.]。在大豆的情况下,GmOLPb基因在叶子中高度诱导,但在己酸酯刺激的茎中较低[38.]。以前的研究表明,Osmotin具有保护叶绿素和光合作机的能力,防止反应性氧物种积聚并刺激更多的脯氨酸积累[5.,16.,55.]。金额KoOsmotin在前7d中表达在很小程度上诱导,叶片的表达水平高于茎和根。因此,可以得出结论,Kooosmotin将被释放到细胞外空间中,然后在防御系统中释放以保护K倒卵形冷应激早期阶段的细胞(主要是叶片)。冷应激通常伴有脱水和渗透失衡随着时间的推移而伴随。研究证明,Osmotin在压力下的Osmoreculation中具有功能,并且适应了低渗透潜在环境[14.,24.,56.]。表达水平KoOsmotin在叶子,茎和根部的冷应激之后增加至大量积累。因此,它来推断出来KoOsmotin可能对低温治疗后期大量积累起到保护作用K倒卵形反对不平衡和赋予冷压力的耐受性。
此外,值得一提的是表达式KoOsmotin冷胁迫15 d时,叶片和根均显著增加。但在20 d时,两者的表达量均迅速下降,与对照相比下降了0.08倍。的变化KoOsmotin表达与形态变化基本一致。冷处理(5°C) 15 d的幼苗在恢复温度(25°C)下培养20 d,所有幼苗均存活。然而,在相同恢复条件下,冷处理(5℃)20 d的幼苗,这些幼苗的叶片全部枯萎凋谢(这里没有数据)。这可能意味着KoOsmotin和那个K.obovata生存并在保护方面发挥了关键作用K倒卵形冷应激。根据之间的高度一致性KoOsmotin在分子水平上表达,在形态水平上恢复存活,可以推断15-20天的时间范围可能是有限的K倒卵形冷处理幼苗(5 摄氏度)。这将为北方引进新技术提供参考K倒卵形.
已经鉴定并表征了许多卵黄素,并具有通过转基因植物中过表达增强耐寒性的能力[19.,27.,28.]。烟草渗透素基因在橄榄植株上的过表达表明,烟草渗透素基因在橄榄植株上具有显著的活性osmotin基因可以防止冷诱导的钙信号传导,调节细胞骨架的动态和冷与冷有程序的细胞死亡[57.]。而且,过表达的osmotin在低温条件下,烟草中的脯氨酸基因能够刺激下游脯氨酸合成相关基因的表达[16.]。我们的研究还通过过表达表达了增强的耐寒性KoOsmotin基因改造大肠杆菌细胞。使用原核生物来分析植物基因的功能在许多研究中适应了[46.,47.,48.,49.]。虽然还需要进一步的调查,但我们可以推断KoOsmotin在转基因植物中也可能具有抗寒性。此外,许多科学家已经成功转型osmotin在转基因植物中诱导盐,干旱和渗透胁迫性的基因[16.,19.,26.,55.,57.,58.],以及抗真菌活动[40,59.,60.]。这些文献导致我们得出结论,渗透蛋白是一个重要的PR蛋白,预计将在未来成功地用于开发植物防御机制。因此,在生物和非生物胁迫条件下,进一步探讨这一重要蛋白质Koosmotin的功能是很好的。
结论
这是第一个探索渗透素的研究K倒卵形.它还提供了有价值的线索,以进一步探索功能KoOsmotin反应压力。在这项研究中,KoOsmotin克隆和特征来自K倒卵形.此外,过表达KoOsmotin增强耐寒性并增加了增长大肠杆菌。进一步的研究,包括使用转基因植物和重组蛋白的功能分析,将揭示确切的角色和功能KoOsmotin参与生物和非生物胁迫耐受性。
方法
植物材料和处理
缺点K倒卵形购自广东红树林生态科技有限公司(中国)。次髓基质在干净的沙滩中发芽,并用1/2的Hoagland溶液浇水。在四叶阶段,将幼苗转移到生长室(25℃,75%湿度,14小时光/ 10小时暗循环)中。在冷应力(5℃)下培养幼苗,分别为0,0.25,0.5,1,2,4,7,15和20d(日)。所有治疗含有至少三种幼苗。将样品(叶,茎和根)用超纯水洗涤,并在收集之前用清洁纸巾干燥。在0d处收集的样品用作对照。将所有收获的样品在液氮中立即冷冻,并在使用前储存在-80℃。
RNA分离和cDNA合成
按照制造商的方案,使用植物总RNA提取试剂盒(BioTeke Corporation,中国)提取总RNA。RNA颗粒溶解在无RNA酶的水中。RNA用Nanodrop 1000分光光度计(Thermo Scientific,Wilmington,DE,USA)定量,并用琼脂糖凝胶电泳(1%)检查。按照制造商的说明,用无核糖核酸酶DNaseI(Promega,USA)去除总RNA样本中的基因组DNA。利用SMART技术合成了第一链cDNA™ 逆转录试剂盒(Clontech),按照制造商的说明。蛋白质的3′端和5′端序列KoOsmotin通过Smart™种族cDNA扩增套件(Clontech,USA)指的是克隆的克隆。
大肠杆菌全长cDNA的克隆KoOsmotin基因
部分核苷酸序列(GenBank登录号:Ko3113)KoOsmotin基因用作用于设计基因引物的参考序列。3'-和5'-末端序列KoOsmotin采用SMART™RACE cDNA扩增试剂盒(Clontech, USA)按照说明书克隆。合成基因特异性引物(GSPs或NGSPs)进行3 ' -和5 ' - race。以GSP1 (5 ' - TTGTTGCTTCACTGGCAGCTGTGGGCCT-3 ')和GSP2 (5 ' - GAACACAACCGCATAATTAGACCCGGCAG−3 ')作为初级PCR扩增,获得5 '和3 '端序列KoOsmotin基因。采用NGSP1 (5 ' - ctggcagctgtgggcctactgtttacc -3 ')和NGSP2 (5 ' - AACCGCATAATTAGACCCGGCAGGACAAG-3 ')进行巢式PCR。3’-和5’- RACE产物经琼脂糖凝胶纯化,并与pMD T19载体(Takara, Japan)转化大肠杆菌DH5型α.有态度的细胞。选择阳性克隆并通过核苷酸测序确认。获得的3'-和5'-核苷酸序列被组装,重叠为全长KoOsmotinDNAMAN软件。用组装后的序列设计引物克隆全长Koosmotin。新的序列KoOsmotin被送到核苷酸测序。因此,完整的全长cDNA序列KoOsmotin确认并提交于加入号码KP267758下的Genbank。
生物信息学分析
可能的orfKoOsmotin由ORF Finder (http://www.ncbi.nlm.nih.gov/gorf/gorf.html.).Expasy ProtParam工具(https://web.expasy.org/protparam/)用以预测分子量,理论p我和疏水性。TMPRED预测跨膜结构域(http://www.ch.embnet.org/software/tmpred_form.html.).使用MOTIF扫描来检测主题序列(http://myhits.isb-sib.ch/cgi-bin/motif_scan.).二次结构由SOPMA工具描述(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html).signalp-5.0服务器(http://www.cbs.dtu.dk/services/signalp//)用于预测潜在信号肽切割位点。Cell-Ploc 2.0(http://www.csbio.sjtu.edu.cn/bioinf/cell-ploc-2/)和骨折(http://linux1.softberry.com/)组合以预测亚细胞定位。具有已知序列的序列比较由NCBI数据库进行(https://www.ncbi.nlm.nih.gov/).由Mega 5.0软件进行系统发育分析。自动化3D结构建筑是通过瑞士模型工具完成的(https://swissmodel.expasy.org/interactive).
亚细胞定位分析
确认Koosmotin的亚细胞定位,整个ORFKoOsmotin使用Hieff Clone®Plus One Step Cloning Kit (Yeasen Biotech,中国),按照生产厂家的说明,在载体pFGC5941-35S-GFP中克隆无终止密码子。重组质粒35S-KoOsmotin-GFP测序并分析以确认成功融合。将证实的重组质粒引入中根癌土壤杆菌菌株EHA105并在28℃下补充有Kanamycin(50μg/ ml)的Luria-Bertani(LB)培养基中过夜。农悬浮液铺有35s-KoOsmotin-GFP质粒瞬时转化烟草benthamiana叶子,只有PFGC5941-35S-GFP矢量作为控制。叶片表皮细胞中的GFP荧光信号N. Benthamiana.由蔡司LSM710激光扫描共聚焦显微镜成像。用于共聚焦成像的×63油浸没物镜。为了激发荧光蛋白,使用来自氩离子激光的488nm线捕获荧光。用于GFP信号检测的激发和发射波长为489nm和510nm。
RT-QPCR的表达分析
研究转录水平KoOsmotin采用RT-qPCR方法测定冷胁迫下黄瓜叶、茎和根的表达水平K.obovata.RT-qPCR反应采用iCycler iQ5实时PCR检测系统(Bio-Rad, CA,美国),使用SYBR Premix Ex TaqTM II试剂(Takara,日本),按照制造商协议进行。特定的引物KoOsmotin(正向引物,CTGTGGGCCTACTGTT,反向引物,TTTGTGGCATCGTCTTT)设计。这个18s rrna.的K倒卵形作为内参基因。PCR方法为:95°C for 30 s, 95°C for 5 s, 55°C for 30 s, 72°C for 30 s。每个RT-qPCR反应3个重复。基因的转录表达KoOsmotin用2-△△计算机断层扫描方法(61.,62.]. 数据以平均值表示 ± 标准偏差(x ± SD)。使用GraphPad Prism 5.0版(GraphPad软件,加利福尼亚州圣地亚哥)进行学生t检验,进行所有统计分析。
耐寒性分析科克汀在大肠杆菌细胞
为了验证功能KoOsmotin冷应激反应基因KoOsmotin没有止挡密码子被引入载体pET28a-t7-his以产生重组质粒KoOsmotin-pet28a。这个大肠杆菌BL21(DE3)细胞窝藏KoOsmotin培养,用于确定耐寒耐力的培养物28aKoOsmotin.由于温度37°C是增长的最佳条件大肠杆菌细胞,转化的大肠杆菌将细胞在37℃下以1b培养基培养12-16小时。然后将其在接种体积的1%重新培养2-3小时,直到OD600约0.6。添加IPTG(0.1毫米)并继续培养6-8小时,直到OD600是0.8。离心并悬浮大肠杆菌细胞在1ml灭菌的0.9%盐水溶液中。用灭菌的0.9%盐水溶液稀释溶液,以不同的浓度梯度,例如10- 3.10.- 4.10.- 4. × 2- 110.- 4. × 2- 2.这些不同浓度的细菌溶液用于分析过度表达的耐寒性KoOsmotin基因大肠杆菌细胞。耐寒性分析,转化大肠杆菌分别于5°C、15°C、25°C和37°C培养。大肠杆菌只包含空载体的单元格用作对照。
可用性数据和材料
这个KoOsmotin序列数据可从“下载”KP267758下的NCBI数据库(https://www.ncbi.nlm.nih.gov/nuccore/KP267758.1/).本研究期间生成或分析的所有数据都包含在本公布的文章中。在当前研究期间生成或分析的数据可从相应的作者获得合理的请求。
缩写
- PR-5:
-
Pathogenesis-related 5
- olp:
-
渗透蛋白样蛋白
- TLP:
-
泰国汀式的proiein
- ZLP:
-
鲜类样蛋白
- GFP:
-
绿色荧光蛋白
- RT-QPCR:
-
实时定量PCR
参考文献
- 1。
连续dm。红树林森林:弹性,保护海啸,以及对全球气候变化的回应。estuar海岸架子sci。2008; 76:1-13。
- 2。
MAFI-GOTAMI D,JAAFARI A,Zenner Ek,Kamari An,Bui Dt。红树林生态系统暴露于多种环境危害的空间建模。SCI总环境。2020; 740:140167。
- 3.
陈LZ,王卫,张耶,黄l,赵克,杨sc,杨zw,陈义,徐HL,zhong cr,苏b,方博,陈妮,zeng cz,林gh。2008年初在中国南部的极端寒冷的红树林损害。Acta phytoecologica sinica。2010; 34:186-94。
- 4.
彭一林,王一燕,费杰,孙继红。两种新型C-重复序列结合因子的分离及表达分析(CBF.在红树林中涉及植物生长和非生物应激反应的基因倒卵形秋茄.生态毒理学。2020;29:718-25。
- 5。
Kumar SA,Kumari PH,Kumar GS,Mohanalatha C,Kishor PBK。Osmotin:一种植物哨兵和哺乳动物脂联素可能的激动剂。前植物SCI。2015; 6:163。
- 6。
Pluskota我们,Pupel P,Glowacka K,Okorska SB,Jerzmanowski A,Nonogaki H,Gorecki RJ。茉莉酸和乙烯参与渗透番茄种子中渗透蛋白的积累。J植物理性。2019; 232:74-81。
- 7。
Fei J,Wang Ys,Jiangzy,Cheng H,张JD。红树林叶片耐寒性基因的鉴定倒卵形秋茄抑制消减杂交。生态毒理学。2015;24:1686–96.
- 8。
Hakim UA,Hussain A,Shaban M,Khan Ah,Alariqi M,GUL S,Jun Z,Lin S,Li Jy,Jin SX,MFH M. Osmotin:一种抗生物和非生物胁迫的植物防御工具。植物理性生物生物。2018; 123:149-59。
- 9。
Singh Nk,Handa Ak,Hasegawa PM,Bressan Ra。与培养的烟草细胞的适应相关的蛋白质与NaCl相关。植物理性。1985; 79:126-37。
- 10。
Singh NK,Nelson de,Kuhn D,Hasegawa PM,Bressan Ra。作者:张莹莹,王莹,王莹,王莹,王莹,王莹,王莹,王莹,王莹,王莹,王莹植物理性。1989; 90:1096-101。
- 11.
Noori SAS,Sokhansanj A.含有Osmotin基因的小麦植物显示出在高NaCl浓度下产生根的增强能力。Russ J植物理体。2008; 55:256-8。
- 12.
Min K,Ha Sc,Hasegawa PM,Bressan Ra,Yun DJ,Kim Kk。渗透蛋白的晶体结构,植物抗真菌蛋白。Proteins struct funct生物蛋白。2004; 54:170-3。
- 13。
刘俊杰,Zamani A, Ekramoddoullah AK。西方白松复杂索马汀样蛋白家族的表达谱分析。足底。2010;231:637-51。
- 14。
植物渗透调节蛋白(PR)的研究进展。信息学手段。2011;5:336-40。
- 15.
Viktorova J,Klcova B,Rehorova K,Vlcko T,Stankova L,Jelenova N,Cejnar P,Kundu JK,Ohnoutkova L,Macek T.在大麦中渗透蛋白蛋白蛋白的重组表达提高了不良病症期间的胁迫性和食品安全。Plos一个。2019; 14:E0212718。
- 16。
Barthakur S,Babu V,Bansal KC。Osmotin的过表达诱导脯氨酸积聚,并赋予转基因烟草中渗透胁迫的耐受性。J工厂Biochem Biotechnol。2001; 10:31-7。
- 17。
Husaini AM, Abdin MZ。转基因草莓的研制(Fragaria.×ananassa.Duch。)植物耐盐胁迫。植物SCI。2008; 174:446-55。
- 18。
Yun DJ, Ibeas JI, Lee H, Coca MA, Narasimhan ML, Uesono Y, Hasegawa PM, Pardo JM, Bressan RA。渗透素是一种植物抗真菌蛋白,它可以通过破坏信号转导来增强真菌细胞的敏感性。摩尔细胞。1998;1:807-17。
- 19。
lettt, Williams B, Mundree SG。来自复活植物的渗透素Tripogon loliiformis.(TlOsm)赋予转基因水稻中的多种非生物胁迫的耐受性。physiol platararum。2018; 162:13-34。
- 20.
Patade Vy,Khatri D,Kumari M,Grover A,Gupta Sm,Ahmed Z.在Osmotin转基因番茄中的耐冷耐寒性(茄属植物lycopersicumL.)与应激响应基因的转录性丰度的调制相关。Springer Plus。2013; 2:117。
- 21.
Chowdhury S,Basu A,Kundu S.过表达新的卵黄素样蛋白基因(SindOLP)对生物和非生物胁迫具有耐受性。植物科学与技术,2017;
- 22.
植物渗透蛋白基因的克隆与表达矮牵牛织布达.植物SCI。2002; 162:745-52。
- 23.
Bashir Ma,Silvestri C,Ahmad T,Hafiz Ia,Abbasi Na,Manzoor A,Cristofori V,Rugini E. Osmotin:阳离子蛋白质导致改善植物中的生物和非生物胁迫耐受性。植物 - 巴塞尔。2020; 9:992。
- 24.
童卓,孙勇,王丹,王玲,李玲,孟x,冯伟,Wurtele ES,王旭Hbosmotin.从橡胶树取代巴西橡胶树.植物生理学杂志。2016;109:171-80。
- 25.
D'Angeli S、Matteucci M、Fattorini L、Gismondi A、Ludovici M、Canini A、Altamura MM。OEFAD8.,oelip.和OeOSM冷驯化中的表达与活动齐墩果欧洲公司,一个没有冬季休眠的多年生单点。Planta。2016; 243:1279-96。
- 26.
kaur a,reddy ms,pati pk,kumar a。过度表达Osmotin(osmws.)基因的有antia somnifera.马铃薯品种‘Kufri Chipsona 1号’表现出对马铃薯的抗性alertaria solani..植物细胞组织org。2020; 142:131-42。
- 27.
Patade Vy,Meena H,Grover A,Gupta SM,Nasim M.遏制评估,耐寒耐受和毒性分析osmotin转基因番茄(茄属植物lycopersicumL简历。普萨红宝石)。3生物技术。2018;8:410.
- 28.
D'Angeli S,Altamura M. Osmotin通过影响编程的细胞死亡和细胞骨架组织来诱导橄榄树的冷保护。Planta。2007; 225:1147-63。
- 29。
Sripriya R,Parameswari C,Veluthambi K.通过组合表达烟草Osmotin的表达增强转基因水稻的鞘枯耐耐受性(ap24)和水稻几丁质酶(池11)基因。体外细胞驱动生物植物。2017; 53:12-21。
- 30.
Narasimhan ML、Coca MA、Jin JB、Yamauchi T、Ito Y、Kadovaki T、Kim KK、Pardo JM、Damsz B、Hasegawa PM、Yun DJ、Bressan RA。渗透素是哺乳动物脂联素的同系物,通过哺乳动物脂联素受体的同系物控制酵母细胞凋亡。摩尔细胞。2005;17:171–80.
- 31.
Motamayor JC,Mockaitis K,Schmutz J,Haiminen N,III DL,Cornejo O,Findley SD,郑P,Utro F,Royaert S,Saski C,Jenkins J,Podicheti R,Zhao M,Scheffler,Stack JC,Feltus Fa,Mustiga gm,amores f,Phillips W,Marelli JP,May Gd,Shapiro H,MA J,Bustamante CD,Schnell RJ,Main D,Gilbert D,Parida L,Kuhn DN。最广泛栽培的可可类型的基因组序列及其用于识别调节荚颜色的候选基因。基因组Biol。2013; 14:R53。
- 32.
Castillo Ruiz Ra,Herrera C,Geislain M,Gebhardt C.苯丙氨酸氨酶(PAL),酸性PR-5和Osmotin样(OSM)防御 - 反应基因系列在马铃薯基因组中。Mol Gen Genomics。2005; 274:168-79。
- 33。
Onishi M,Tachi H,Kojima T,Shiraiwa M,Takahara H.在大豆中编码PR-5蛋白酸性同种型的新型盐诱导基因的分子克隆与表征。植物理性生物化学。2006; 44:574-80。
- 34。
Sun S,周Y,陈继,施J,赵H,赵H,歌,张M,崔Y,Dong X,Liu H,Ma X,Jiao Y,Wang B,Wei X,Stein JC,Glaubitz JC,Lu F, Yu G, Liang C, Fengler K, Li B, Rafalski A, Schnable PS, Ware DH, Buckler ES, Lai J. Extensive intraspecific gene order and gene structural variations between Mo17 and other maize genomes. Nat Genet. 2018;50:1289–95.
- 35。
关键词:玉米,免疫基因,遗传多样性,进化历史生物学报,2005,22:2480 - 90。
- 36。
杜强,龚超,潘伟,张丹微卫星在中国白杨木材性状候选基因中的开发与应用(英文)Populus tomentosacarr。)。DNA Res。2013; 20:31-44。
- 37。
红三叶草基因的分类与分子标记挖掘(三叶草pratense)繁殖。植物科学与技术,2017;
- 38。
Tachi H,Fukuda-Yamada K,Kojima T,Shiraiwa M,Takahara H.一种新型大豆基因的分子表征编码高盐胁迫诱导的中性PR-5蛋白。植物理性生物生物。2009; 47:73-9。
- 39。
关键词:水稻,全基因组,基因鉴定,表达分析TLP.甜瓜的基因家庭(Cucumis Melo.l .)。基因组学。2020;112:2499 - 509。
- 40。
Viktorova J,Krasny L,Kamlar M,Novakova M,Mackova M,Macek T. Osmotin,一种与病因相关的蛋白质。Curr蛋白Pept SCI。2012; 13:672-81。
- 41。
vigers aj,robertswk,selitrennikoff cp。一系列新的植物抗真菌蛋白。Mol植物微生物相互作用。1991; 4:315-23。
- 42。
Schwede T,Kopp J,Guex N,Peitsch MC。瑞士型号:自动蛋白质同源性建模服务器。核酸RES。2003; 31:3381-5。
- 43.
Bruno-Moreno F,De Oliveira Rsb,Moreira Rd,Lobo MDP,De Freitas Cdt,Ramos MV,Grangeiro TB,Monteiro-Moreira Aco。抗真菌型蛋白质的结晶和X射线衍射分析。Acta Crystallogr F. 2013; 69:646-9。
- 44.
Dobson cm,Sali A,Karplus M.蛋白质折叠:从理论和实验的视角。Angew Chem Int编辑。1998年; 37:868-93。
- 45.
刘jj,sturrock r,ekramoddoullah akm。甲磺汀样蛋白质的超家族:其起源,演化和对生物功能的表达。植物细胞代表2010; 29:419-36。
- 46.
关键词:红树,氧化丙烯环化酶,耐盐性大肠杆菌,酵母和烟草细胞。植物细胞生理学。2002;43:903-10。
- 47.
刘H,邢米,杨,亩x,王x,鲁f,王y,张l。全基因组鉴定和功能见解进入后期胚胎发生的丰富(lea)面包小麦基因家族(Triticum Aestivum.).Sci众议员2019;9:13375。
- 48.
曾X,Ling H,Yang J,Li Y,Guo S. Lea蛋白来自胃脂榆树增强低温应力的耐受性大肠杆菌.基因。2018; 646:136-42。
- 49.
张恩,赵立,施,吴y,江j。I类SLHSP17.7基因负责番茄冷应力耐受性的功能性。植物SCI。2020; 298:110568。
- 50。
Malehorn D,Borgmeyer Jr,Smith Ce,Shah DM。抗真菌素样蛋白的表征和表达(ZLP.)基因玉米.植物理性。1994年; 106:1471-81。
- 51.
张建平,张建平,等。基于Pasternak S, Liang C, Zhang J, Fulton L, Graves TA, Minx P, Reily AD, Courtney L, Kruchowski SS, Tomlinson C, et al. .玉米B73基因组:复杂性、多样性和动态性。科学。2009;326:1112-5。
- 52.
Singh NK,Kumar Kr,Kumar D,Shukla P,Kirti PB。病原体诱导的血小素样蛋白基因ADTLP的表征落花生diogoi一种野生花生。《公共科学图书馆•综合》。2013;8:e83963。
- 53.
艾哈迈德A,阿里T,金M W,汗A,乔M H。Rehman S,Khan MS,bin AN,Khan M,UllahR,Jo MG,Kim MO.脂联素同源物新型渗透素通过上调Ob/Ob和db/db转基因小鼠模型中的脂联素/PPARα信号来保护肥胖/糖尿病诱导的NAFLD。代谢临床实验2019;90:31–43.
- 54.
Neale Ad,Wahleithner Ja,Lund M,Bonnett HT,Kelly A,Meeks-Wagner Dr,孔雀WJ,Dennis Es。花氨酰酶,β-1,3-葡聚糖酶,Osmotin和延伸素在花形成期间在烟草外植物中表达。植物细胞。1990; 2:673-84。
- 55.
Silvestri C、Celletti S、Cristofori V、Astolfi S、Ruggiero B、Rugini E. Olive (齐墩果欧洲公司L.)用于烟草Osmotin基因的植物转基因对体外诱导的干旱胁迫敏感。Acta physiol植物。2017; 39:229。
- 56.
关键词:渗透势,渗透势,草莓abstract: the development associated potential decline in the fruit成熟期草莓属ananassa).前植物SCI。2020; 11:1035。
- 57。
Parkhi V,Kumar V,Sunilkumar G,Campbell LM,Singh NK,Rathore Ks。在棉赋予耐旱性耐旱性的间成型分泌的烟草卵黄素的表达。mol品种。2009; 23:625-39。
- 58。
Weber RLM, Wiebke-Strohm B, Bredemeier C, margi - pinheiro M, de Brito GG, Rechenmacher C, Bertagnolli PF, de Sa MEL, Campos MDA, de RMS A, Beneventi MA, margi R, grosi -de-Sa MF。一种渗透蛋白样蛋白的表达Solanum nigrum.在转基因大豆中赋予耐旱耐受性。BMC植物BIOL。2014; 14:343。
- 59。
Silvaa RJS,Alves RM,Gramacho KP,Marcellino LH,Micheli F.在结构上不同的Cupuassu几章酶和Osmotin参与植物抗真菌的抗性Moniliophthora孢.植物生理学学报,2000,20(1):1 - 5。
- 60。
赵Q,邱B,李S,张Y,崔X,刘D.Spanax Notoginseng的奥斯米蛋白样蛋白基因由茉莉酸和防御反应涉及茄镰刀菌.植物病理学。2020;110:1419-27。
- 61。
Bustin SA, Benes V, Garson JA, Hellemans J, Huggett J, kubissta M, Mueller R, Nolan T, Pfaffl MW, Shipley GL, Vandesompele J, Wittwer CT。MIQE指南:实时荧光定量PCR实验发布的最低信息。中国化学2009;55:611-22。
- 62。
Livak KJ,Schmittgen TD。实时定量PCR的相对基因表达数据分析及2( - Delta Delta C)方法。方法。2001; 25:402-8。
确认
我们非常感谢我们所有同事在我们实验室提供有用的技术援助。
资金
中国国家自然科学基金(美国国家科学院国际伙伴关系(No.41430966和No.41430966和41876126号)支持这项工作(美国专利No.11676086,No.41430966和41876126),国家主要研发计划(2017年FY100700)与中国科学院战略优先研究计划(No.XDA23050200,No.XDA13010500和No.XDA13020503)。引进南方海洋科学与工程人才队的主要专项项目广东实验室(广州)(GML2019ZD0305)。资金机构没有参与数据的设计和收集,分析和对数据的解释以及写作稿件。
作者信息
从属关系
贡献
JF构思、设计并承担了实验并撰写了手稿。YSW设计、构思和监督了手稿。HC构思并指导了这项研究,修改和发展了这篇手稿。YBS参与了基因表达分析和功能分析实验,并修改了手稿。YJZ进行了亚细胞定位实验,为改进这篇手稿做出了贡献。LZ参与了亚细胞定位的制备和分析。所有作者都已阅读并批准了手稿。
相应的作者
伦理宣言
伦理批准和同意参与
不适用。
同意出版物
不适用。
利益争夺
提交人声明他们没有竞争利益。
附加信息
出版商的注意
斯普林格自然保持中立,就管辖权的要求,在出版的地图和机构的联系。
权利和权限
开放访问本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用这篇文章
Fei,J.,Wang,Ys。,程,H.等等。克隆和表征KoOsmotin来自红树林植物倒卵形秋茄冷应激。BMC植物BIOL.21日,10(2021)。https://doi.org/10.1186/s12870-020-02746-0
收到了:
认可的:
发表:
关键词
- Osmotin
- 红树植物
- 倒卵形秋茄
- 3D模型
- 基因表达
- 冷抵抗