抽象的
背景
褪黑激素(MT)对于植物生长和发展是重要的;但是,尚不清楚MT是否涉及Apple不定根(AR)开发。在这项研究中,我们对待Malus prunifolia(MP)在AR开发的四个不同阶段,分析了内源激素MT,生长素(IAA),ZEEN-核糖苷(ZR),脱落酸(ABA)和赤霉素的水平(GA1 + 3.),在所有四个治疗组和未经治疗的对照组。RT-qPCR检测MT、IAA生物合成、转运和信号转导、细胞周期、根系发育相关基因的表达。的功能mdwox11.在转基因苹果植物中分析。
结果
MT的AR开发促进依赖于苹果砧木中0到2天的AR诱导的阶段。MT治疗在AR形成期间增加了MT和IAA之间存在的IAA和串扰的水平。表达mdwox11.正调控苹果AR的形成。此外,过度表达的转基因株系mdwox11.线条产生更多的ARS而不是'GL3'。表型分析表明mdwox11.过度表达线对外源MT处理更敏感,而不是'GL3',表明mdwox11.根据苹果砧木的MT调节AR形成.
结论
MT通过诱导IAA水平和上调的AR诱导阶段促进AR形成mdwox11..
背景
苹果 (马吕斯有明显)是全球种植的主要商业果树,苹果果实具有很高的营养价值和经济价值。Malus prunifolia(MP)被广泛称为最容易生根的苹果砧木。它提供了良好的移植性兼容性,耐寒性,盐和碱耐药性等优点,以及疾病和抗虫性。茎基组织的不定根(ARS)诱导是苹果砧木营养传播的主要步骤。ARS是从非根机出现的胚胎根系,并且AR原序从邻近韧皮细胞的杂交挂钩细胞产生[1,2].在不同的植物中研究了AR形成所需的方法,包括稻米[3.],拟南芥[4,5]和poplar [6];然而,尚未研究改善苹果中AR形成的方法。
褪黑激素(MT; N-乙酰基-5-甲氧基氨基胺)是动物中众所周知的激素,并在1995年通过两组工人在植物中发现[7,8].以前的研究表明,MT作为植物中的调节信号9],对根,芽,外植体的生长至关重要[10.,11.,12.,13.,14.,15.].在草本植物中主要研究了MT和AR组之间的关系;例如,MT的外源性促进番茄和稻米的偶然生根[16.,17.]但是机制MT如何调节AR形成仍有待阐明的木质植物,如苹果。AR形成可以作为四阶段过程进行分类[18.,19.,20.,21.]而且MT对AR开发很重要的阶段仍然是未知的。在这项研究中,我们观察到MT在AR诱导和开始的早期阶段促进了AR形成。以前的研究表明,MT和其他植物激素如植物蛋白(IAA),细胞蛋白(CK),嗜酸性纤维素(GA),脱落酸(ABA)之间的关系22.]: MT处理使植物在非生物胁迫下CK水平升高[23.[MT还有助于提高诸如GA的活性气体的含量3.和遗传算法4[24.[和外源MT应用导致ABA含量的降低[23.].然而,在不定根生根期间MT与这些激素之间的关系仍有待确定。潜在地,通过增加IAA,IAA合成和极性IAA运输的水平,MT作为增长促进化合物[25.,26.,27.].大多数研究分析了MT以类似IAA的方式刺激根和茎生长的能力[28.].然而,MT对根生长和分化的影响被认为是独立于IAA [29.].在这项研究中,我们建立了MT-IAA Crosstalk在AR诱导中发挥着重要作用。尽管如此,苹果砧木在AR形成期间的植物激素相互作用和相关信号网络的作用是不完全理解的。
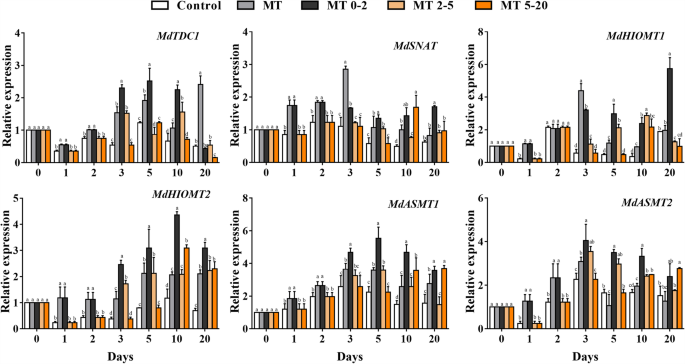
参与MT生物合成的基因,例如TDC.,鼻,hiomt.和asmt.,由mt引起的[30.,31.,32.,33.,34.],mzsnat5.调节苹果线粒体中的MT合成[33.]和过度表达asmt.增加MT生产拟南芥蒂利亚纳[34.].在本研究中,MT和生长素相关基因的表达,如一种营养响应因素(ARFS.) 和挡(别针)基因在苹果中分析。此外,Wuschel相关的Homeobox基因11(WOX11.)在皇冠根出现和发展中的功能[35.和拟南芥AR的发展[36.,但在木本植物中,调节WOX11.在AR开发期间明白很差。此外,它未知是否在转基因苹果植物中形成过表达的mdwox11.由外源mt调节。
目前,在苹果砧木中,MT调控AR形成的机制尚不清楚。在本研究中,我们发现外源MT通过增加IAA的合成、转运和信号相关基因的表达,在AR诱导和起始的早期阶段诱导了AR的形成。苹果组培苗经MT处理后,根系发育相关基因的表达量增加,从而增加了ARs的数量。此外,我们证明了过度表达mdwox11.促进ARS的出现和发展,并在过度表达的转基因苹果中产生外源性MT诱导的AR发育mdwox11..本研究的结果为MT如何调节苹果砧木的机制提供了见解。
结果
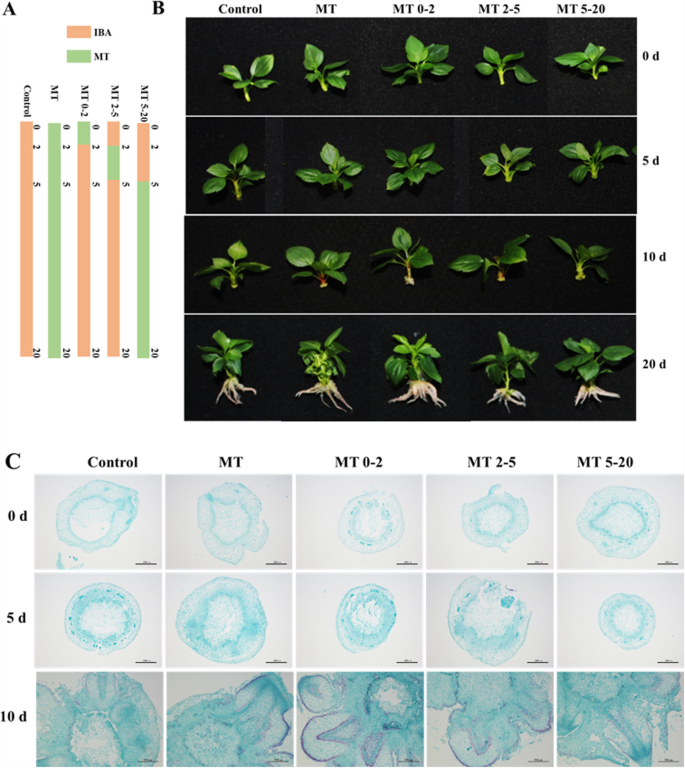
本研究的目的是鉴定MT促进MP苹果砧木组织培养植物中的AR形成的精确时间。在该研究中,0-2d表示AR诱导的阶段,2-5d代表AR开始,5-20d覆盖Ar原始形成和麦克风中的Ar出苗。该研究由五种不同的治疗组组成:MT,MT0-2,MT2-5,MT5-20和一个对照组(图。1a).各组在5 d前均无明显形态学改变;然而,在第10 d时,ARs从基部茎部出现(图2)。1b)。在20d处,在MT0-2组中观察到最多的ARs,MT2-5和MT5-20组在20d中产生比对照和MT组更多的ARs,在ARS的数量中没有观察到显着差异这些组(图。1b)。为了观察在Ar形成的不同阶段的茎的解剖学,部分由石蜡包埋的样品制成,并使用光学显微镜观察。在0天,样品的横截面显示出态度细胞的存在。仍然,在5 d处观察到有丝分裂爪细胞分裂,在紧凑地布置的电池中可见细胞分割。在培养基中培养10天的茎碱的部分出现(图。1c).生长素抑制剂n -1-萘基酞酸(NPA)或三碘苯酸(TIBA)处理MP 20 d后未观察到AR形成,但MT处理后观察到AR形成。图S1总结了所有表型。
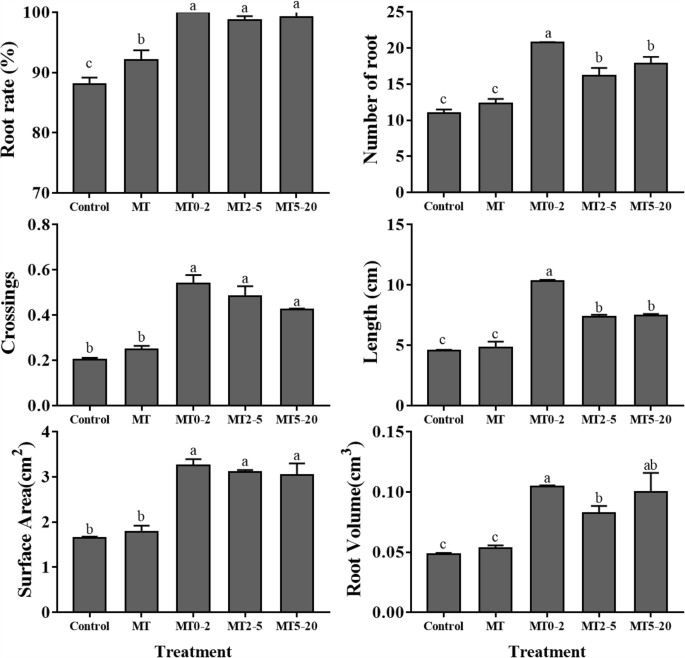
我们还测量了所有5个处理组的生根率、AR数量、交叉、根长、根体积和根表面积,数据与AR形成的表型一致。MT0-2组测得的所有参数均高于其他组,且对照组的ARs数和其他根参数值最小(图2)。2).结果表明,在AR诱导阶段,MT主要促进0-2d的AR形成。
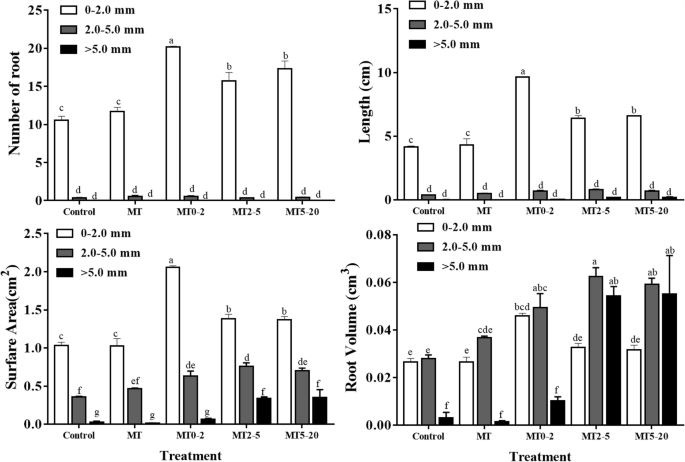
按直径分为0-2.0 mm、2.0-5.0 mm和> - 5.0 mm 3组。从AR数、长度和表面积来看,0-2.0 mm类别所占比例最大;根体积以2.0 ~ 5.0 mm组最大(图2)。3.).MT0-2组包含在0-2.0 mm类中的最大数量的ARS,这是对照组中的两倍(图。3.).我们得出结论,大多数AR是细根(0-2.0毫米)。
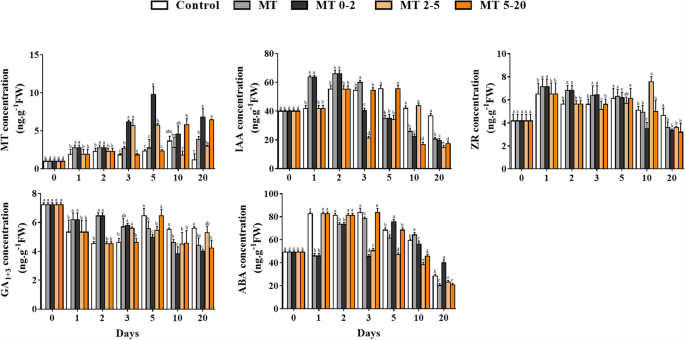
荷尔蒙MT,IAA,ZR,GA的水平1 + 3.MT0-2组的MT含量在AR发育早期高于其他处理组,并在5 d时达到峰值。在MT和MT0-2处理中,IAA、ZR和GA水平显著升高1 + 3.在1d和2d的AR诱导期间高于对照组中的那些,但在10 d时,MT0-2组的水平低于其他基团。ABA的水平与IAA,ZR和GA相反1 + 3.在治疗中(图。4).
此外,在AR形成期间分析了MT合成相关基因的表达水平。除了0和20 d,表达水平MdTDC1,mdhiomt2.,mdasmt1和mdasmt2.在MT0-2组中,参与MT合成的基因的表达量高于其他组,在MT0-2组中,参与MT合成的基因的表达量高于其他组mdsnat.和MdHIOMT1MT0-2比在1d,5 d和20 d处的其他组的2级更高。这些结果表明MT治疗诱导MT合成相关基因的表达(图。5).
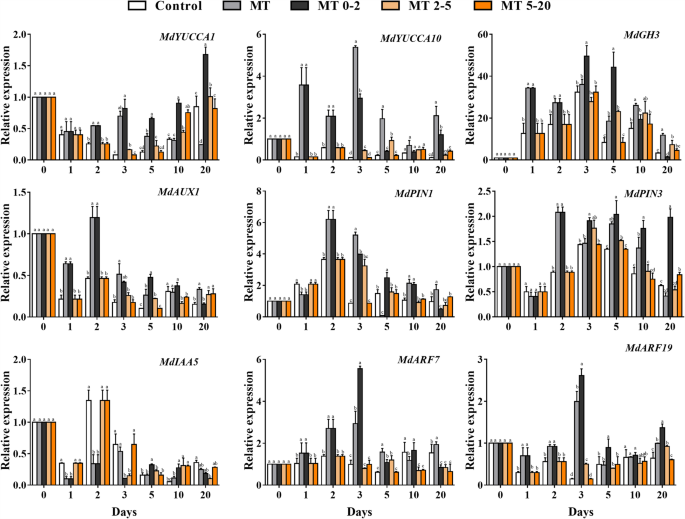
为了确定是否存在MT和IAA之间的互动效果,我们测量了与IAA生物合成和信号转导相关的基因的表达。表达mdyucca1.,MdYUCCA10,MDARF7., 和MdARF19MT0-2治疗组在1d,2 d和3d中的其他基团中较高。IAA传输相关基因的表达水平mdaux1.,mdpin1., 和mdpin3.MT0-2的MT0-2也比在2 D的其他组中更高;但是,IAA信号转导基因的表达MdIAA5在AR诱导阶段期间除了在其他处理中的MT0-2处理后较低(图。6).
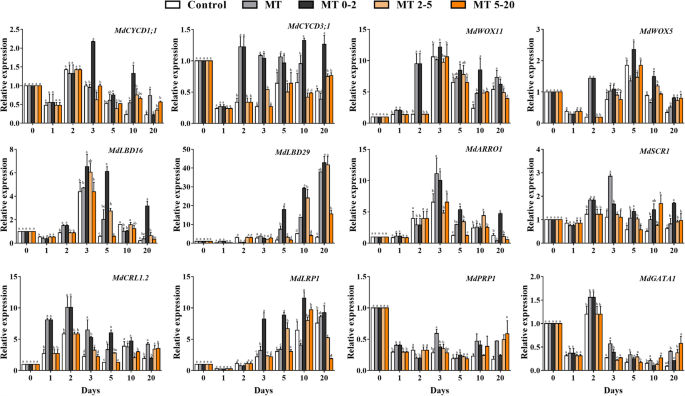
为了研究MT是否影响细胞分裂,表达细胞周期相关基因mdcycd1; 1和MdCYCD3; 1进行了分析,这些基因高表达MT0-2 10 3 d和d。因此,我们认为太提升基于“增大化现实”技术的应用形成苹果、和RT-qPCR分析表明,高根发展基因的表达是最多采样时间点太治疗的反应。我们观察到,在所有根系发育相关基因中,mdwox11.在MT处理后的表达比在2d下的对照植物中的表达高5.6倍(图。7).这表明了mdwox11.可能在AR诱导中对MT治疗起到重要作用。
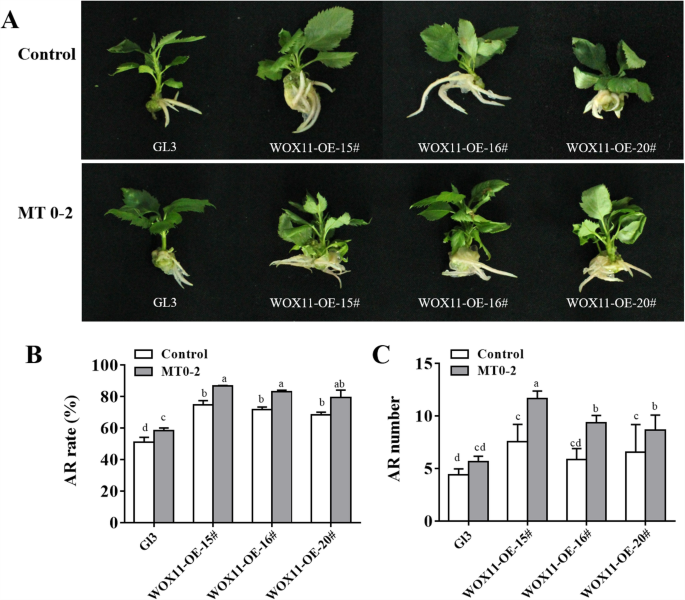
表达mdwox11.被IBA治疗诱导(图。7).我们产生过表达(OE)转基因素mdwox11-oe15#,16#和20#在'gl3'中,确认过表达水平mdwox11.转基因系(图S2)。确认是否mdwox11.转基因系表现出对Mt信号传导的增强响应,在组织培养中生长的野生型和转基因苹果植株,用3.45μm的IBA作为对照或MT进行0-2d(MT0-2)。在MT0-2组中观察到更多AR,而不是对照组,过表达mdwox11.转基因株系和' GL3 'mdwox11.过表达系比‘GL3’产生更多的ARs(图。8一种)。过度表达mdwox11.还导致ARS率的增加(图。8b)。此外,mdwox11.过表达植物对外源MT处理比野生型更敏感(图。8a-c),表明这一点mdwox11.诱导响应MT治疗的AR形成。
讨论
ar形成是营养繁殖的关键,之前的研究已经将AR形成从组织培养植物中分为四个阶段:诱导,开始,原始形成和出现[18.,19.,20.,21.].在该研究中,0-2d表示AR诱导的阶段,2-5d代表AR开始,5-20d覆盖Ar原始形成和麦克风中的Ar出苗。MT影响许多生物过程,包括植物生长,开花和应力反应,虽然MT促进番茄中的ar发育[16.,并没有对木本植物进行过研究。因此,为了确定MT何时以及如何促进AR的形成,我们在不同时间对MP植物进行了MT处理。5个处理组的表型显示,MT2-5和MT5-20处理组的植株之间无差异,但MT0-2处理组产生的ARs比其他处理组更多(图5)。1,2和3.),表明MT主要在0-2d的AR诱导阶段促进AR形成。
在根部发展期间Mt和Iaa之间相互作用的影响尚不清楚。一些研究表明,低浓度的外源MT可以引起植物内源性IAA水平的增加,并且据信MT对生长的促进作用可能是由于IAA含量的增加引起的[25.].然而,其他研究表明,由MT的根生长和分化的调节均独立于IAA [29.].为了分析MT治疗是否可以提高IAA含量并增强IAA信号,我们测量了五个MT治疗中植物中的IAA含量。在MT施用后AR诱导过程中,IAA含量主要增加,但在AR启动和妊娠阶段期间减少(图。4).这可能反映了IAA在根系发育的早期阶段起着重要的作用[37.,38.,39.].在AR形成期间,用IAA抑制剂和MT处理MP Plantlet(图S1)。NPA和TIBA治疗抑制AR形成,NPA和TIBA具有抑制IAA极性运输的功能。我们得出结论,外源MT处理促进了AR形成以影响AR区的IAA分布。此外,它表明IAA可能在MT的下游以诱导AR形成。然而,RT-QPCR数据表明MT参与IAA信号通路,并且MT治疗可以诱导IAA生物合成,传输和信号转导相关基因的表达(图。6).因此,MT可能通过增加IAA水平和IAA信号传导来促进AR诱导。以前的研究表明,MT处理的植物在非生物应激期间增加了CK水平[23.[MT还增加了诸如GA的活性气体的含量3.和遗传算法4[24.].在MT治疗之后的Ga和Zr水平的观察到的增加还表明MT和Zr或Ga之间存在联系1 + 3..
WOX11.通过IAA调节拟南芥AR的形成[36.[一些研究表明WOX11.由IAA诱导,积极诱导表达侧琴边界Domain16(LBD16) 和LBD29在AR发展的早期阶段[40].但是,很少有关于的功能mdwox11.在苹果这样的木本植物中,包括在AR形成期间响应于MT的转基因苹果植物中发生的形态变化。在这项研究中,我们产生了表达的转基因苹果植物35s :: wox11-oe.他们的表型证明了这一点mdwox11.是AR激活的阳性调节因子,并对此的MT治疗mdwox11.过表达植物增加了AR发育(图。8).因此,诱导mdwox11.其相关基因可能代表MT促进AR地层的可能机制。这是第一次使用的研究mdwox11.研究转基因株系的作用mdwox11.响应AR诱导过程中的MT。集体,数据表明mdwox11.促进AR形成响应于MT,并向MT诱导ARS的分子机制提供见解。
结论
褪黑激素主要通过增加IAA水平并激活诱导的AR诱导阶段的不定根形成mdwox11..结果代表了改善AR形成以加速难以根的苹果砧木的性繁殖的可能性。
方法
外植体生长条件和MT治疗
MP苹果砧木的组织培养植物在杨平(108°04'e,34°16'N),中国的组织培养中生长,并用作AR形成的植物。MP的Plantlet从日本的异常进口,并通过无性繁殖传播。将MP的组织培养植物分成五组,并且同时处理所有基团的植物20d。在含有补充有3.45μM吲哚-3-丁酸(IBA)的半强度MS的根诱导培养基上培养对照植物,以促进根部形成。将第二组植物培养在培养基中,其半强度MS补充有1.29μmmt和3.45μm的IBA,并指定为Mt处理组。在培养Mt培养基中,将第三组转移到根诱导的培养基中2d,称为MT 0-2。将第四组(MT 2-5)转移到MT培养基中,在根诱导培养基上培养2d,然后在MT培养基上以3d培养后转移到根诱导培养基。在培养根诱导培养基5d后,将第五组转移到MT培养基中,称为MT5-20。用于该研究的不同介质的组成列于补充表S1中。在0d,1d,2d,3d,5 d,10 d和20d的所有五组中收获样品(即使在mt-处理之前收集一些样品)。 In total, 3150 cuttings, consisting of 630 cuttings from each of the five groups were harvested, which in turn, consisted of 90 cuttings sampled at each sampling point. Samples were collected from the basal part of the stems, including the AR formation zone (approximately 0.5 cm). The plants in the NPA treatment group were continuously cultivated in 10 μM NPA and 1.29 μM MT for 20 d, and the TIBA-treated plants were continuously cultivated in 10 μM TIBA and 1.29 μM MT for 20 d, the control was the same as above. Overexpression ofmdwox11.转基因苹果35 s:: MdWOX11-OE)和'GL3'分为两组:一组在根诱导培养基上连续培养,其用作对照,在培养MT培养基中,将其它基团转移到根引发培养基中。
解剖观察和形态测量
解剖观察是根据先前描述的协议进行的[1,41.,42.].测量的形态参数包括:每次切割的AR率、AR长度和平均AR数[43.].此外,使用EPSON表达式10000xl扫描仪(加拿大LA L600扫描仪)来分析其他根相关指标。总共分析了90个切屑,每组在每个采样点收集的每组90个切屑。将收获的样品立即在液氮中冷冻并储存在-80℃以进行激素和表达分析。
激素水平的测量
所有5个处理组在不同时间点采集用于激素提取的样品。根据前面描述的步骤纯化和提取激素[44.].分析了每个采样点的每组的三个生物学重复。酶联免疫吸附试验(ELISA)技术用于检测和分析激素水平[44.].
RNA提取和cDNA的合成
基于CTAB的提取方法用于分离总RNA [45.]并且通过2%琼脂糖凝胶上的样品的电泳测试总RNA完整性。使用GDNA橡皮擦(Takara Bio,Shiga,日本)的素剧性RT试剂盒用于合成cDNA。
RT-QPCR分析
MT,IAA合成,传输和信号转导,细胞周期和根部发育相关基因表达式通过RT-QPCR量化。在补充表S2中列出了基因全名和苹果中的MDP注释,以及苹果中蛋白质鉴定的同源蛋白质和物种,在补充表S2中列出。底漆设计基于先前的研究[43.[分析基因的所有基因特异性引物列于补充表S3中。
RT-QPCR根据已发表的方法进行[46.].苹果EF-α.基因用于标准化表达。每个样本包含三种生物重复和三种技术复制。分析的基因相对表达通过2计算−ΔΔCt方法 [47.].
统计分析
SPSS11.5软件(SPSS,Chicago,IL,USA)用于分析显着的差异,使用(ANOVA)确定每个采样时间点和治疗之间的显着性差异。Sigmaplot12.0(Systat Software,Inc。)用于生成数字。
可用性数据和材料
本研究过程中产生或分析的所有数据均包含在本发表的文章及其补充信息文件中。
缩写
- 公吨:
-
褪黑激素
- ar:
-
不定根
- MP:
-
Malus prunifolia
- IAA:
-
养阴
- CK:
-
cytokinin
- GA:
-
赤霉素
- 阿巴:
-
脱盐酸
- ELISA:
-
酶联免疫吸附试验
- WOX11:
-
Wuschel相关的Homeobox基因11
- IBA:
-
吲哚-3-丁酸
- LBD16:
-
侧琴边界Domain16
参考文献
- 1。
Naija S, Elloumi N, Jbir N, Ammar S, Kevers C.苹果砧木mm106不定根培养过程中的解剖和生化变化体外.C r Biol。2008; 331(7):518-25。
- 2。
杰西J,Klerk GJD。苹果干切片中不定根形成的解剖学与超微结构检查。BIOL植物。1997年; 39(1):79-90。
- 3.
姜伟,周胜,张强,宋华,周德兴,赵颖。WOX11转录调控网络参与水稻冠根发育、细胞分裂素信号和氧化还原的调控。J Exp Bot. 2017;68(11): 2787-98。
- 4.
生长素通过调控茉莉酸稳态来调控拟南芥不定根的起始。植物细胞,2012;24(6):2515 - 27所示。
- 5。
WOX11/12转录因子直接激活WOX5/7促进根原基起始和器官发生。植物杂志。2016;172:2363 - 73。
- 6。
Rigal A, Yordanov YS, Perrone I, Karlberg A, Tisserant E, Bellini C, Busov VB, Martin F, Kohler A, Bhalerao R. AINTEGUMENTA LIKE1同源性转录因子PtAIL1控制杨树不定根原基的形成。植物杂志。2012;160(4):1996 - 2006。
- 7。
Dubbels R,Reiter RJ,Klenke E,Goebel A,Schnakenberg E,Ehlers C,Schiwara HW,Schloot W.通过放射免疫测定和高效液相色谱 - 质谱法鉴定的可食用植物中的褪黑素。j pineal res。1995年; 18(1):28-31。
- 8。
Hattori A,Migitaka H,Iigo M,Itoh M,Yamamoto K,Ohtanikaneko R,Hara M,Suzuki T,Reiter RJ。植物中褪黑素的鉴定及其对脊椎动物中褪黑素受体的血浆褪黑素水平的影响及其对褪黑素受体的影响。Biochem mol biol int。1995年; 35(3):627-34。
- 9。
公园WJ。褪黑激素作为内源性植物调节信号:辩论和观点。J植物BIOL。2011; 54(3):143-9。
- 10.
褪黑素促进樱桃砧木PHL-C (Prunus avium x Prunus cerasus)根系再生、光合色素、生物量、总碳水化合物和脯氨酸含量。植物生理与生物化学。2012;61:162-8。
- 11.
Li C,梁B,常C,魏Z,周S,MA F.外源褪黑素在不同胁迫条件下改善了Malus的钾含量。j pineal res。2016; 61(2):218-29。
- 12.
arnao mb,Hernández-ruizj.褪黑激素促进过硫酸盐缺口中的不定程度和横向根部再生Lupinus Albus L..j pineal res。2007; 42(2):147。
- 13。
Byeon Y, Back K.转基因水稻中褪黑激素的增加会导致多效表型,包括促进幼苗生长、延迟开花和低产量。J Pineal Res. 2014; 56:408-14。
- 14。
MałgorzataM,Posmyk,Krystyna M,Janas。植物中的褪黑激素。acta physiol植物。2009; 31:1-11。
- 15.
Park S. Back K. Melatonin促进萌发后转基因水稻的精根伸长和根生长。j pineal res。2012; 53:385-9。
- 16。
温和,龚B,Sun S,Liu S,王X,魏米,杨F,李义,施Q.促进褪黑素在不定根发展中的作用Solanum Lycopersicum L.通过调节养蛋白和一氧化氮信号。前植物SCI。2016; 7:718。
- 17。
梁C,李安,余H,Li W,梁C,郭S,张R,暗思,褪黑素通过调节水稻中的毒素反应来调节根系结构。前植物SCI。2017; 8:134。
- 18。
Atkinson Ja,Rasmussen A,Traini R,Voss U,Sturrock C,Mooney SJ,Wells DM,Bennett MJ。在根中分支:揭示形式,功能和规定。植物理性。2014; 166(2):538-50。
- 19。
Klerk GJD,Arnholdt-Schmitt B,莱比雷·克,Neumann Kh。根部,芽和胚胎的再生:生理,生化和分子方面。BIOL植物。1997年; 39(1):53-66。
- 20.
Legue V, Rigal A, Bhalerao RP。树种不定根的形成:转录因子的参与。杂志。2014;151(2):192 - 8。
- 21.
德克勒克颁奖G-J。microcuttings加油。理论和实践。中国生物医学工程学报。2002;38(5):415-22。
- 22.
Arnao MB,Hernandez-Ruiz J. Melatonin及其与植物激素的关系。Ann Bot。2018; 121(2):195-07。
- 23。
晶Z,易思,张X,杜H,徐B,黄B.热诱导叶片褪黑素的褪黑素抑制涉及孤立酸和细胞蛋白生物合成和多年生黑麦草中的信号通路的变化(多年生黑麦草L.)。Environ Exp Bot。2017; 138:36-45。
- 24。
海军Z,Na Z,Rong-Chao Y,Li W,Qian-Qian S,Dian-Bo L,Yun-yun C,Sarah W,Bing Z,Shuxin R. Melatonin通过调节抗氧化剂来促进高盐度下的种子萌发系统,ABA和GA?黄瓜的相互作用(Cucumis sativus L.)。j pineal res。2015; 57(3):269-79。
- 25。
陈Q,齐WB,罗布尔·魏W,王民地。外源应用褪黑激素刺激根系生长,并在含有金属幼苗的根部中提高内源性吲哚乙酸Brassica Juncea..J植物理性。2009; 166(3):324-8。
- 26。
王强,安斌,魏勇,史华,罗华,何志强。褪黑素通过抑制生长素的合成和极性运输调控根分生组织拟南芥.前植物SCI。2016; 7:1882。
- 27。
黄志刚,刘志刚,刘志刚,等。褪黑激素对植物生长的影响。植物生理学报。2017;39(6):1-7。
- 28。
Marino B.Arnao,Hernández-ruiz J.植物中褪黑素的生理功能。植物信号表现。2006; 1(3):89-95。
- 29。
Ramo´n Pelagio-Flores, Edith Mun ~ oz-Parra, Randy Ortiz-Castro, pez-Bucio。杰。褪黑激素调节拟南芥的根系结构,可能独立于生长素信号。J Pineal Res. 2012; 53:279-88。
- 30.
马Q,张T,张P,王Z-y。褪黑激素衰减木薯储存根的采后生理恶化。j pineal res。2016; 60:424-34。
- 31。
Sangkyu P,Da-Eun L,Hyungi J,Yeong B,Yeonk B,Kyoungwhan B.富含褪黑素的转基因水稻植物表现出对除草剂诱导的氧化应激的抵抗力。j pineal res。2013; 54(3):258-63。
- 32.
Yeong B,Hyoung Yool L,OK Jin H,Hye-Jung L,Kyungjin L,Kyoungwhan B.反应镉治疗米叶片中褪黑素合成和降解基因的协调调节。j pineal res。2015; 58(4):470-8。
- 33.
王磊,冯超,郑旭,郭勇,周飞,单东,刘旭,孔建军。植物线粒体合成褪黑激素和增强植物对干旱胁迫的耐受性。acta botanica yunnanica(云南植物研究)2017;63(3):e12429。
- 34.
左波,郑旭,何平,林伟,雷强,冯超,周杰,李强,韩铮,孔杰mzasmt.改善褪黑激素的产生,增强转基因的耐旱性拟南芥蒂利亚纳植物。j pineal res。2014; 57:408-17。
- 35。
赵y,胡y,戴米,黄l,周dx。Wuschel相关的Homeobox基因WOX11是在水稻中激活射击冠的根部发育。植物细胞。2009; 21(3):736-48。
- 36。
Liu J, Sheng L, Xu Y, Li J, Yang Z, Huang H, Xu L. WOX11和wox12参与了根器官发生的第一步细胞命运转变拟南芥.植物细胞。2014;26(3):1081 - 93。
- 37。
Laskowski M.横根启动是一种概率事件,其频率是通过波动响应的波动水平设定的概率事件。J Exp Bot。2013; 64(9):2609-17。
- 38。
毛建平,张东,张旭,李凯,刘铮,孟Y,雷超,韩明义。外源吲哚-3-丁酸(indole-3- butano酸,IBA)的应用对水稻侧根发育形态、激素状态和基因表达的影响Malus hupehensis..SCI Hortic。2018; 232:112-20。
- 39。
生长素介导的早期侧根起始的细胞周期激活。植物细胞。2002;14(10):2339 - 51。
- 40。
刘波,王丽,张静,李军,郑华,陈静,陆明。毛白杨(Populus tomentosa) wuschele相关同源盒基因在不定根形成中的表达模式和功能相似性。BMC基因组学。2014;15:296。https://doi.org/10.1186/1471-2164-15-296.
- 41。
齐云旭,柴F,新城AN,韩S.侵袭性物种石蜡段的生产方法烟.植物分类害虫。2012; 2:46-8。
- 42。
杨JP。对传统石蜡切片制备方法的改进。J杂志。2006;01:47-8。
- 43。
毛军,张丹,孟Y,李凯,王华,韩明。细胞分裂素对苹果砧木不定根发育的抑制作用基于其抑制不定根原基的形成。杂志。2018;166:663 - 76。
- 44.
DOBREV PI,KamínekM.使用混合模式固相萃取的助长和脱落酸的快速有效地分离细胞蛋白和纯化。J色谱A. 2002; 950(1-2):21-9。
- 45.
Gambino G,Perrone I,Gribaudo I.一种快速有效的葡萄树和其他木质植物组织的RNA提取方法。Phytochem肛门。2008; 19(6):520-5。
- 46.
李G,MA J,TAN M,MAO J,N,SHA G,张D,ZHAO C,HAN M.转录组分析揭示了糖代谢和生长素和细胞素信号传导途径对嫁接苹果生长发育的影响。BMC基因组学。2016; 17:150。
- 47。
Livak KJ, Schmittgen TD。利用实时荧光定量PCR技术分析相关基因表达数据−ΔΔCt) 方法。方法。2001; 25(4):402-8。
致谢
作者感谢Zhhong Zhang(沉阳农业大学,辽宁沉阳)提供组织培养的“GL-3”植物。
资金
本工作是由国家重点研发项目(2018YFD10001,2019YFD1001803),中国陕西省重点研发项目(2017ZDXM-NY-019,2019TSLNY02-04),唐奖学金的主要研发项目支持和西北农业和林业大学,中国苹果研究体系(Cars-27)。该资助者是设计研究研究的文章的相应作者。
作者信息
从属关系
贡献
J.M.,D.Z.和M.H.设计了研究研究。J.M.,C.N.,K.L.和S.C。进行了研究。准:C.N.和M.M.分析了数据。j.m.和d.z.写了这篇论文。所有作者均批准了稿件。
相应的作者
伦理宣言
伦理批准和同意参与
不适用。
同意出版
不适用。
相互竞争的利益
所有作者宣布他们没有竞争利益。
附加信息
出版商的注意事项
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
补充信息
额外的文件1:
图S1。组织培养植物中AR形成的形态学观察Malus prunifolia在20天。IBA组在3.45μmIBA和1.29μmmt中持续培养,NPA组在10μmnPa和1.29μmmt中连续培养,TIBA组在10μmtiba和1.29μmmt中连续培养。图S2。鉴定过表达的DNA水平mdwox11.转基因素,标记为2000磅,野生型被命名为WT,过表达有三条线mdwox11.转基因素,它们是mdwox11o-15#,mdwox11o-16#,mdwox11o-20#, H2o被设置为负控制。表S1.培养基的组成。表S2.基因名称(缩写和全名)和Apple MDP编号,以及苹果蛋白基于的同源物的物种和蛋白质。表S3.用于表达分析的引物序列,用于前引物的前引物的F,用于后引物的R,MDP基因数和引物的长度。
权利和权限
开放访问本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信贷额度中另有说明。
关于这篇文章
引用这篇文章
毛,J.,Niu,C.,Li,K。等等。通过促进功能,褪黑激素促进Apple中的不定根形成mdwox11..BMC植物BIOL.20.536(2020)。https://doi.org/10.1186/s12870-020-02747-z.
已收到:
接受:
发表:
关键词
- 激活不定根
- 不定的根源
- 苹果的小苗
- mdwox11.
- 褪黑激素
- 转基因Plantlets.